Method Article
מתח ומות תא מפעיל באמצעות מיקרוסקופ Confocal הקונבנציונלי UV הליזר
In This Article
Summary
Targeted manipulations to cause directed stress or death in individual cells have been relatively difficult to accomplish. Here, a single-cell-resolution ablation approach to selectively stress and kill individual cells in cell culture and living animals is described based on a standard confocal UV laser.
Abstract
Using a standard confocal setup, a UV ablation method can be utilized to selectively induce cellular injury and to visualize single-cell responses and cell-cell interactions in the CNS in real-time. Previously, studying these cell-specific responses after injury often required complicated setups or the transfer of cells or animals into different, non-physiological environments, confounding immediate and short-term analysis. For example, drug-mediated ablation approaches often lack the specificity that is required to study single-cell responses and immediate cell-cell interactions. Similarly, while high-power pulsed laser ablation approaches provide very good control and tissue penetration, they require specialized equipment that can complicate real-time visualization of cellular responses. The refined UV laser ablation approach described here allows researchers to stress or kill an individual cell in a dose- and time-dependent manner using a conventional confocal microscope equipped with a 405-nm laser. The method was applied to selectively ablate a single neuron within a dense network of surrounding cells in the zebrafish spinal cord. This approach revealed a dose-dependent response of the ablated neurons, causing the fragmentation of cellular bodies and anterograde degeneration along the axon within minutes to hours. This method allows researchers to study the fate of an individual dying cell and, importantly, the instant response of cells-such as microglia and astrocytes-surrounding the ablation site.
Introduction
מיקרוסקופ פלואורסצנטי כבר זמן רב בשימוש כדי לחקור את ההשפעות של transgenes במערכת העצבים המרכזית דג הזברה, במיוחד והשפעתם על פיתוח 1. מיקרוסקופיה ברזולוציה גבוהה אפשרה מיפוי מפורט של התהליכים התאיים מעורבים בהתפתחות מוח, דור שריר, ואירועים התפתחותיות אחרים רבים 2. לימוד מותו של תא יחיד כבר יותר מאתגר, בעיקר בשל הקשיים הטכניים של גרימת מוות של תאים סלקטיבי במהלך הליכי הדמיה סטנדרטיים. עם זאת, שילוב של הדמיה ברזולוצית תא בודד וטכניקות אבלציה ממוקדות במיוחד מאפשר חקירת תגובות הסלולר מיידיות מתח פציעה, כמו גם של אינטראקציות תאי תאים הסוגרות. הבנת התהליכים הללו הוא קריטי, במיוחד עבור מחלות ניווניות כגון מחלת הנוירון המוטורי (MND), שבו אינטראקציות גליה נוירון הוכחו לתרום להתקדמותשל המחלה 3.
MND, או טרשת לרוחב amyotrophic (ALS), היא מחלה ניוונית של מערכת העצבים הרסנית המשפיעה הנוירונים המוטוריים בגזע המוח, הקורטקס המוטורי, וחוט השדרה. אובדן הנוירונים האלה מוביל לאובדן שריר, וחולה למות תוך 3 - 5 שנים של אבחון 4. הנוירונים המוטוריים בקישור חוט השדרה אל סיבי השריר ויש להם תפקיד חיוני בהנחיית התכווצות שרירים. ניתק בתקשורת זו או מוות של נוירונים אלה בהדרגה מחליש את השרירים ומשפיע על היכולת של החולה לבלוע, ללכת, לדבר, לנשום. לדמיין את מותו של הנוירון מוטורי ואת ההשלכות לטווח קצר חי מספק הזדמנות מצוינת להבין טוב יותר את התהליכים הדינמיים מעורבים הומאוסטזיס ומחלות תא נורמלי.
דג זברה צמחה כמערכת מודל אטרקטיבית כדי לחקור מחלות ניווניות 1. זֶהבשל היתרונות המוצעים על ידי אורגניזם מודל זה, כגון הפריה חוץ, זמן התפתחות קצר, גישה אופטית למערכת העצבים, וקלות transgenesis. בנוסף, את היכולת ליצור מהונדס דג זברת תרכובת בקלות מאפשרת אסטרטגיות תיוג מרובות של תאים מסוגים שונים. אבלציה גנטי מתקרב להרוג סוגי תאים מסוימים לאפשר הפרעה רחבה למדי, אך היא לא יכולה בקרה טובה של מיקוד תאים בודדים 5. טכניקות בסיוע לייזר, מצד שני, לספק שליטה של זמן ומרחב משובח שימשו במשך במודלים של בעלי חיים שונים. בעוד שרוב הגישות להשתמש בציוד מיוחד, כגון לייזרים פעמו 6, 7, 8, 9, 10, 11, 12 או שני פוטונים בחרו קופץ 13, אחרקבוצות מחקר ניצלו לאחרונה של לייזר UV במיקרוסקופים confocal קונבנציונאלי 14.
הטכניקה המתוארת כאן משלב מיקרוסקופיה confocal ברזולוציה גבוהה עם גישה לייזר בתיווך UV לגרום הסלולר מתח או מוות בצורה תלוית-מינון הנוירונים המוטוריים שנבחרו. היא מסתמכת על שימוש ליזר 405 ננומטר מותקן בדרך כלל, כבר נוסה בהצלחה על תרבית תאים ובחיות חיים, מאפשרת אפיון המפורט של אינטראקציות הסלולר, כגון שחרור microglial לאחר מותו העצבי.
Protocol
הערה: עיצוב, התנהגות, ודיווח על ניסויים בבעלי חיים חייב לקחת בחשבון את ההנחיות הנוכחיות 15. עבודה כזו חייבת להיות מאושרת מראש על ידי רשות רווחת בעלי החיים המקומית (במקרה שלנו, ועדת האתיקה בעלי החיים של Macquarie University).
1. מכינים את דג הזברה עבור התקנה אבלציה תא UV
- צור דג הזברה (Danio rerio) להביע חלבוני ניאון.
- כדי להביע את חלבוני ניאון של עניין דג זברה, לבצע זריקות פלסמיד לשלב חד-תאים של ביצת דג הזברה (כמתואר במקום אחר 16) או להשתמש קווי מהונדס ניאון. כדי לתייג סוגי תאים מרובים, ליצור קווי דג זברה מתחמים מהונדסים ידי חציית קווים מהונדסים הוקמו רלוונטיים לשאלה של עניין. מניח זכר אחד ו דג זברה אחד נקבה בכל צד של טנק הזדווגות זוג שווא תחתון בערב ולהסיר את המחיצה עם תחילתה של אורלמחרת בבוקר (כמפורט במקומות אחרים 17). שמור על דג הזברה ב 28 ° C ולטפל בהן בהתאם לפרוטוקולים הוקמה 17, 18.
- אסוף את העוברים לאחר השרצה מוצלחת ידי מאמץ את המים במכל המכילים את העוברים דרך מסננת תה פלסטיק. יש לשטוף את הביצים במי מערכת ולהעביר אותם לתוך מי ביצה בצלחת פטרי.
- לבחון אותם תחת מיקרוסקופ אור כדי לקבוע הפריה. חנות מופרית ביצים בצלחת פטרי ומניחים אותם באינקובטור ב 28 ° C 18.
- אופציונלי: בצע microinjection לתייג אוכלוסיות תאים ספציפיים.
הערה: זוהי שיטה חלופית המאפשרת הביטוי להדמיה של חלבונים, ללא הצורך להעלות קווים מהונדסים יציבים. שיטה זו היא גם יתרון כאשר החלבון של עניין הוא רעיל ואוסר הדור של טרנס יציבהקווי genic.- להזריק את בונת פלסמיד לשלב חד-תאים של עוברי דג זברה, כמתואר במקום אחר 19, 20, 21.
הערה: שיטה זו תוצאה של ביטוי הפסיפס של החלבון של עניין. החלבון של עניין הוא מונע מן אמרגן של בחירה (למשל, islet1 22, -3mnx1 23, 24, נפגש 25, או MPEG1 26) מוקף Tol2 הפוך חוזר 20.
- להזריק את בונת פלסמיד לשלב חד-תאים של עוברי דג זברה, כמתואר במקום אחר 19, 20, 21.
- גיל הדגים לגודל הרצוי.
- הרם את דג 3 - 5 ימים לאחר ההפריה (DPF) ומניח אותם תחת מיקרוסקופ מתחם ניאון. מסך החיות לביטוי fluorophore המתאים ובחר את הדגים שכותרתו במאור פנים. הפרד את הזחלים המתאימים לתוך צלחת נוספת עם מי ביצה להטבעה מאוחרr על (חנות בתוך חממה 28 ° C).
ניתן למקם עוברים לתוך פתרון 0.2 מ"מ 1-פניל-2-thioures (PTU) אצבעות ב 24 שעות שלאחר ההפריה (hpf) כדי לדכא את היווצרות פיגמנטציה: אופציונלי. יש להקפיד עם PTU, כפי שהוא רעיל ויכול להיות פיסיולוגי לוואי, גנטי, או תופעות מורפולוגיים. - עבור מחקרים בשלב התפתחותי מוקדם (<2 DPF), dechorionate את העוברים באמצעות מלקחיים חדים באופן ידני. Dechorionate מספר גדול של עוברים enzymatically ידי הוספת pronase (2 מ"ג / מ"ל) אל המים ביצה דוגרים אותם במשך 10 דקות ב 28 מעלות צלזיוס.
- להעביר את העוברים מעת לעת באמצעות פיפטה פסטר מפלסטיק להקל dechorionation. לסיים את התהליך כאשר רוב עובר צמחו מתוך chorions שלהם על ידי שטיפה אותם מספר פעמים עם מי ביצה.
- הרם את דג 3 - 5 ימים לאחר ההפריה (DPF) ומניח אותם תחת מיקרוסקופ מתחם ניאון. מסך החיות לביטוי fluorophore המתאים ובחר את הדגים שכותרתו במאור פנים. הפרד את הזחלים המתאימים לתוך צלחת נוספת עם מי ביצה להטבעה מאוחרr על (חנות בתוך חממה 28 ° C).
- הכינו פתרונות להטבעת דג הזברה ב agarose.
- כן פתרון הרדמה על ידי הוספת 4 g / L MS222 (פתרון מניות tricaine, pH 7.0)dropwise כדי בצלחת פטרי המכילה מי ביצה. מינון של 50 מ"ג / L הוא נקודת התחלה מומלצת (איור 1 א).
- הכינו מלאי של agarose התכה נמוכה (0.8 - 1.5%) במים ביצה ו aliquot אותו לתוך צינורות microcentrifuge 1.5 מ"ל. הוסף aliquot לתוך גוש חום מחומם מראש (38 - 40 ° C) ולתת לו לאזן את טמפרטורת הסט (~ 30 דקות; איור 1B).
- אופציונלי: עבור הדמיה לטווח ארוך (> 4 שעות), להכין מעגל agarose קטן בתוך זכוכית התחתונה צלחת פטרי 35 מ"מ ולאפשר לו להגדיר (משלים איור 1).
הערה: צעד נוסף זה היה יעיל הימנעות כל תנועה של ירידת agarose השלמה עם דג הזברה על מסגרות זמן ארוכות יותר.- לשם כך, במקום ~ 300 μL של agarose לאורך המעגל הפנימי של המנה זכוכית התחתונה להכין מעגל בצורת סופגנייה עם פתח קטן באמצע שבו למקם את הדג (שלב 1.5.3; משלים איור 1) .
- הר דג הזברה agarose עבור במיקרוסקופ.
- בחר 1 - 3 של הדג מראש לגילוי אבלציה להרדים הזחלים באמצעות העברתם (בעזרת פיפטה העברה) לתוך צלחת עם פתרון הרדמה (שלב 1.4.1; איור 1 ג; כ 5 דקות).
הערה: הדג מורדם כאשר הם מראים תנועת opercular רדודה קצב לב ירד וכבר לא להציג תגובת בריחה עוררת מגע (TEER; אי לשחות משם לאחר נגיעת הזנב שלהם בעדינות עם מברשת). ודא הרדמה מתאימה לטיפול האתי של הדגים כדי למנוע עוויתות עם העברה לתוך agarose או חשיפה לאור הניאון. - לאחר ההרדמה הוא אשר, להתחנף זחל באמצעות פיפטה מתכווננת (עם קצה חתוך 200 μL המוגדר ~ 30 μL) ולתת לו לשקוע לקרקעית של הקצה. מעבירים את הזחל לתוך agarose שחומם מראש (שלב 1.4.2) על ידי שחרור טיפת הנוזל עםזחל לתוך agarose (מנסה למזער את כמות מי ביצה הולכים לתוך agarose; איור 1D).
- תמצוץ את הדג המוקף agarose. ומוציאים אותו במהירות לתוך צלחת בגודל 35 מ"מ זכוכית התחתונה הכין בעבר.
- שימוש במיקרוסקופ לנתיחת מברשת צבע סטנדרטית (אונייה ארוכה, גודל 1) כדי למקם את החיה בתוך agarose בצד (ראשו שמאלה), כך הגוף והזנב הם שטוחים (איור 1E). אם עובדים עם דגים מרובים, ליישר את כל הדגים בצלחת, כך שהם ממוקמים בקלות באמצעות מיקרוסקופ confocal בהמשך.
הערה: במהירות לבצע הליך זה של מיצוב יישור (זה עלול לדרוש קצת אימון, כמו agarose מתחיל להגדיר מייד לאחר חשיפה לטמפרטורות קרות). - השאירו את הדגים agarose מוטבע במשך 10 - 15 דקות עד agarose מוגדר היטב. בזהירות הדף את צלחת פטרי 35 מ"מ עם ~ 2 מ"ל של ביצה מים המכיל tricaine (איור 1F).
- בחר 1 - 3 של הדג מראש לגילוי אבלציה להרדים הזחלים באמצעות העברתם (בעזרת פיפטה העברה) לתוך צלחת עם פתרון הרדמה (שלב 1.4.1; איור 1 ג; כ 5 דקות).
2. הגדרת Confocal מיקרוסקופ ופרמטרים הדמיה
- מניח את צלחת פטרי עם הזחל מוטבע על במת מיקרוסקופ confocal ולהתמקד בצד הגבי של חוט השדרה אצל בעלי החיים (באמצעות שדה בהיר). בדוק את החיה תחת הגדלה המתאימה (40X) והגדרת פלורסנט ולדמיין את המבנה של עניין (למשל, עוצמת קרינה של נוירונים שכותרתו או תנועת microglial) כדי לאשר את כל פרמטרי ההדמיה הם לפי צורך עבור אבלציה עוקבת (איור 2). אנו משתמשים באופן שגרתי מטרת 40X לבצע מחקרים לשגות זמננו.
- אופציונאלי: כדי לבצע מחקר הזמן לשגות במשך כמה שעות, רצוי לרשום יחיד או כמה זמן נקודות לפני אבלציה להקים התגובה הפיזיולוגית השאננה של התא וסביבתו (כגון תנועת microglial להקים מהירויות בסיס ותנועתיות).
- קבע את העובי של structיור ריבית בגין אבלציה לייזר UV.
- באמצעות כונן z, לאמת את החלק העליון והתחתון של המבנה של עניין (למשל, סומה תא) על ידי התמקדות מעלה ומטה באופן ידני. רשום את z-המטוס יהיה ablated (למשל, במרכז התא).
הערה: מניסיון, שיטה זו היתה יעילה ביותר על ידי מיקוד נוירונים בחוט השדרה תויגו במאור פנים (יחס אות לרעש גבוה המאפשר הדמיה זמן לשגות קל לאחר אבלציה, לדוגמה, איור 4) ועל ידי ablating באמצע סומה תא. קרינת גרעין תא יכולה להיות יתרון מבטיחה מיקוד נכון ויעילות אבלציה גבוהה.
- באמצעות כונן z, לאמת את החלק העליון והתחתון של המבנה של עניין (למשל, סומה תא) על ידי התמקדות מעלה ומטה באופן ידני. רשום את z-המטוס יהיה ablated (למשל, במרכז התא).
.3 בצע לייזר ממוקד אבלציה של תאים בודדים בחוט השדרה דג הזברה
הערה: לקבלת גישה אבלציה להדמיה זו, מיקרוסקופ confocal (Leica SP5) היה בשימוש. הליך אבלציה באמצעות דיודה 405 ננומטר עבור dest תא ספציפימְהוּמָה מפורט בהתאם לתוכנה (חבילת היישומים לייקה, v2.7.3.9723). עם זאת, כל מיקרוסקופ confocal קונבנציונאלי כי הוא מצויד לייזר 405 ננומטר ו FRAP (התאוששות הקרינה לאחר photobleaching) או מודול אקונומיקה יאפשר את הביצועים של אותו מניפולציות התא, אך עם פוטנציאל עם הגדרות שונות במקצת, פרמטרים, ושמות.
- הפעל את אשף FRAP על ידי לחיצה על התפריט הנפתח בחלק העליון של תפריט התוכנה (איור 3 א, 1 ו -2). שים חלון חדש עם שלבים שונים המאפשר להגדיר של הפרמטרים הספציפיים עבור אבלציה הליזר (איור 3 ב, 3).
- קבע את הפרמטרים תמונה עבור הגישה אבלציה ידי בחירת הפורמט, מהירות סריקה (איור 3B, 4), והעמיד ממוצע (איור 3 ב, 5). פורמט תמונה של 1,024 x 1,024 ב ומהירות סריקה של 400 הרץ ו קוהממוצע של 4 היה מתאים ביותר.
הערה: בדרך כלל אין צורך לשנות את זיהוי ספקטרלי (כגון פרמטרי העירור או פליטה), כפי שהם נקבעו ברכישה הקודמת.- אם מדד כשל מטוס אבלציה לא כבר נבחר (כפי שמתואר בשלב 2.4.), ולחץ על הכפתור "החי" ולהתמקד דרך הדגימה עד מבנה הניאון או z-המטוס הרצוי כי הוא הולך להיות ablated הוא בפוקוס.
- לאחר הפרמטרים התמונה הכללית מוגדרים, לגשת צעד "אקונומיקה" (איור 3 ג, 6) לשלוט רכיבים אבלציה ספציפיים.
הערה: שילוב של עוצמת הלייזר (איור 3 ג, 8), מהירות סריקה, ואת המיצוע כי הוגדרה בשלב 3.2 (איור 3B, 4 ו -5), כמו גם את מספר החזרות כי ייקבע 3.5 צעד (איור 3E,12), יקבע את זמן להתעכב הכוללת של לייזר UV ב ההחזר על ההשקעה, ועל כן, את היעילות הלבנה.- להעסיק את ליזר 405 ננומטר על ידי הפעלת אותו ההליך הלבן (איור 3 ג, 8).
הערה: הצלחה רוב עם ההגדרות הנ"ל הושג עם עוצמות לייזר 405 ננומטר בין 60 - 80% ב הגדרת הניסוי שלנו. עליך להיות מודע לכך פלט כוח לייזר זה הוא מכשיר ספציפי יהיה שונה עבור כל התקנה confocal. - השתמש "זום" אפשרות (איור 3 ג, 7) על מנת למקסם את עוצמת הלבנה בבית ROI שנבחרו על ידי צמצום שדה סריקה, ולכן למקסם את הזמן להתעכב. לחלופין, השתמש באפשרות "נקודת אקונומיקה" של תוכנת הבחירה עבור תהליך זה.
- להעסיק את ליזר 405 ננומטר על ידי הפעלת אותו ההליך הלבן (איור 3 ג, 8).
- בחר ROIs אחד או מרובה (3D איור, 10) עבור אבלציה באמצעות כל כלי הציור ברוח רכישת תמונהow (איור 3D, 9). מקד את תלולית האקסון, למשל, עם כלי ציור מעגלי של כ 4 - 8 מיקרומטר.
הערה: אזור אבלציה הוא מתכוונן מ פיקסל בודד שטח נרחב יותר, בהתאם ליישום. - לאחר הקמת ROI, בחר בלחצן "מהלך הזמן" (3E איור, 11) ולאשר את מספר מחזורי את ROIs ייסרקו / ablated (3E איור, 12). בחר את מסגרות "Pre-אקונומיקה" ו "פוסט-אקונומיקה" כרצונך כדי לאפשר סקירה של התמונה כולה רק לפני ומיד לאחר תהליך הלבנה.
- לאחר הקמת כל הפרמטרים אבלציה הצורך, לחץ על "הפעל ניסוי" (3E איור, 13) ולנטר את היעילות של אבלציה.
הערה: ב התקנת FRAP שלנו, תמונה אחת תילקח לפני ואחרי מחזור FRAP עם דואר הליזר המתאיםxcitation (למשל, 488 ננומטר עירור עבור תאים המבטאים-EGFP). תמונות לפני ואחרי אבלציה אלה מאפשרים שיפוט מהיר של איך בצורה משביעת רצון את ההחזר על ההשקעה, שהייתה לבנים עד כמה יעיל פרמטרי אבלציה שנבחרו היו. - חזרו על התהליך על ידי התאמת עוצמת הליזר (איור 3 ג, 8), מהירות סריקת מיצוע (איור 3B, 4 ו -5), וחזרות (איור 3E, 12) במקרה ההחזר על ההשקעה הנבחרת עדיין מציגים עוצמת קרינה גבוהה לאחר השלמתי מחזור FRAP.
4. בצע את הליך המעקב, כולל דגים "הצלה" או סילוק
- אם הניסוי הוא מסוף, להרדימו עם מנת יתר של tricaine. הסר את המים ביצה ולהחליפו פתרון מניות הרדמה במשך 10 דקות. כדי להבטיח המתת חסד, לבדוק תחת מיקרוסקופ על הפסקת פעימות הלב.
- אופציונאלי:אם הניסוי הוא לא סופני, להסיר את הדג בזהירות מן agarose עם מלקחיים בסדר ומברשת. מניחים את הדגים במים ביצה טרייה ולאפשר לו להתאושש תחת השגחה במשך 15 דקות. אם התנהגות שחייה רגילה חוזרת, להחזיר את הדגים אל האינקובטור.
- השלך חיות טרנסגניות פי זרם פסולת GMO המאושר של המוסד.
תוצאות
השיטה המתוארת כאן מאפשרת אבלציה של הנוירונים מוטוריים בחוט שדרת דג הזברה באמצעות מודול FRAP של מיקרוסקופ confocal מסחרי. קווי דג זברה מהונדסים המבטאים חלבון פלואורסצנטי ירוק בנוירונים בשליטת יזמים ספציפיים, כגון - 3mnx1, islet1, או נפגשו, היו בשימוש. הביטוי של ה- GFP מונע על ידי אמרגן הנוירון המוטורי (כגון -3mnx1 או נפגש) מאפשר הדמיה ברזולוציה גבוהה של גופי התא, אקסונים הראשי, ואת הענפים ההיקפיים הארכת השרירים (איור 4 וידאו 1).
נוירונים בחוט השדרה של 3 עד 5 דגים יום בן כבר ablated בהצלחה, עם זמן להתעכב הכולל של 60 - 80 s בהספק לייזר של ~ 70% ואת ההגדרות הכלליות כמתואר בשלב 3. אבלציה מוצלחת היא מושגת כאשר הקרינה נמוג מיד לאחר אבלציהולעולם לא יתחדש (איור 5, C ו- D). ניסיונות אבלציה עם קווי לייזר אחרים (כגון קו לייזר 488 ננומטר) לא לגרום דהייה קבע, הקרינה שוקם בתוך מסגרות זמן קצר. חשוב לציין, טכניקה זו הפגינה תכונות אופייניות של מוות של תאי אפופטוטיים נוירונים-ablated UV, כגון נוכחות של Annexin V, שינויים מורפולוגיים עקביים של ניוון somal, ו blebbing axonal של נוירון ablated 27.
הספציפיות של גישה זו הוא אישר בניסויים באמצעות fluorophore photoconvertible קאאד (שעוברת פליטתו מירוק לאדום לאחר חשיפה לאור UV), שבו נוירון ממוקד אחד הוסב (איור 5, A ו- B) ללא סימני הסלולר הרס על פני כמה שעות. השימוש של כוח לייזר גבוה במקום מוביל to הכחדה של הנוירון הממוקד (לא photoconversion או מחודש של קרינה) ו photoconversion (ללא מוות) של התאים בסמיכות (~ 20 מיקרומטר) לאתר אבלציה (איור 5, C ו- D).
יתרון חשוב אחד טכניקת אבלציה ליזר מושרה זהו התלות במינון של הגישה. כדי למקד תאים עם עוצמות שונות, מספר שכבות של כיוונון עדין זמינות ידי התאמת כוח הליזר (איור 3 ג, 8), מיצוע מהירות קו הסריקה (איור 3B, 4 ו -5), בגודל של ROI להיות ablated (איור 3D, 10), ואת החזרות (3E האיור, 12). יש לציין, גישה זו יכולה גם להיות מנוצלת כדי ליישם מתח הסלולר לתאים בודדים במקום גרימת מוות של תאים. לדוגמה, כיוונון עדין כבריקר למדי להעריך תהליכים תאיים במהלך המוות של תא עצב. הנוירונים המוטוריים עם תחזיות axonal ארוכים שהיו ablated עם עוצמות לייזר UV נמוכה חשף "blebbing" מאפיין (היווצרות ופיצול של שלפוחית הסלולר), שהחלה ב סומה ממוקד והמשיך לאורך האקסון לאורך זמן (40 - 90 דק '; איור 4 ; שניתן 3D סרט של אבלציה זה וידאו 1). כתוצאה מכך, ויסות פרמטרי אבלציה ליזר שונה ועל כן רמת מתח הסלולר מושרה ואת מהלך הזמן של מוות מאפשרת לחוקרים רמה גבוהה של גמישות ניסיון.
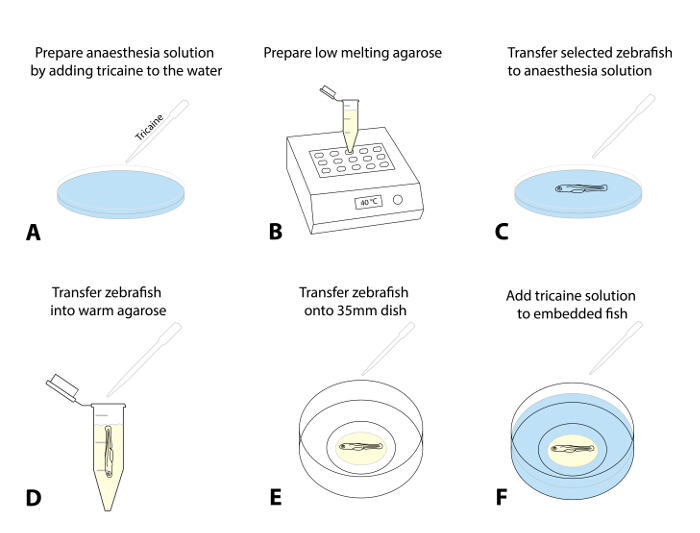
איור 1: הטמעה של דג הזברה הדמיה לחיות. (AF) Embedding נוהל הדמיה חיה: (א) Tricaine מתווסף מי ביצה כדי לטשטש א דג הזברה שיעור התחלה במינון ta של 50 מ"ג / ליטר. (ב) agarose התכה נמוכה (0.8 - 1.5%) מוכן וחמם עד 38 - 40 ° C. (C) בעזרת פיפטה העברה, דג הזברה ושנבחר מועבר לתוך צלחת עם פתרון tricaine. לאחר סדציה מוצלח (תנועת opercular רדודה, ירד קצב לב, העדר תגובה עורר מגע), דג מועבר לתוך agarose שחומם מראש (D). תקטין את כמות מי ביצה מועברת לתוך agarose כדי למנוע דילול שלאחר מכן. (E) עבר טיפת agarose (~ 30 - 50 μL) המכילה את דג הזברה על צלחת בגודל 35 מ"מ זכוכית תחתונה. בצע זה תחת מיקרוסקופ לנתיחה להשתמש במברשת כדי ליישר את דג הזברה בעדינות האוריינטציה המועדפת שלה. המתן 10 - 15 דקות, עד agarose מוגדר, ולהוסיף ~ 2 מ"ל של תמיסת tricaine כדי בצלחת (F). ה' "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
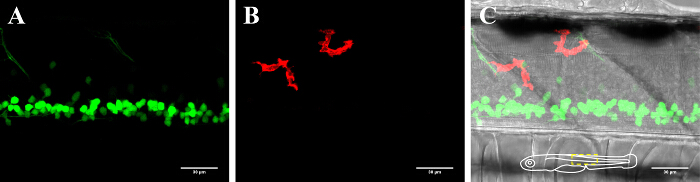
איור 2: ויזואליזציה של נוירונים microglia בחוט השדרה של דג הזברה 3-DPF. ויזואליזציה של המיקרוגליה נוירונים בחוט השדרה של דג הזברה מהונדס בן 3 ימים לבטא (א) נוירונים GFP חיובי (islet1: GFP) ו- (ב) mCherry חיובי microglia (MPEG1: GAL4, כטב"מ: mCherry). (C) תמונה מורכבת של ערוץ נוירון ו microglia יחד עם תמונת השדה הבהיר. את כנס סכמטית (C) מתאר את הכיוון של הדגים ומתווה באזור שהוצג. בר סולם = 30 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
דק-page = "1"> 
איור 3: צעדים בתהליך של אבלציה לייזר UV (כפי שמתואר בפרוטוקול, שלב 3). צעדים לשלוט מודול תוכנת FRAP בתוכנת confocal (חבילת יישומים ליקה). (א) החל את מודול FRAP ככלי לבצע אבלציה לייזר UV. (ב) הקמת מטוס- z עבור הגדרות FRAP אבלציה אחרים כמו פורמט, מהירות, והעמיד ממוצע, אשר יקבע את זמן להתעכב של הלייזר. (ג) בקרה של עוצמת הלייזר ואת "זום" אפשרות מנת למקסם את יעילות הלבנה. (ד) בחירה של אזור אחד או מספר של (ROI) הריבית תהיה ablated. (ה) הגדירה את מהלך הזמן של הלבנה קובעת את מחזורי האקונומיקה להתעכב זמן ליזר על ROIs. אנא לחץ אותה דואר כדי לצפות בגרסה גדולה יותר של דמות זו.
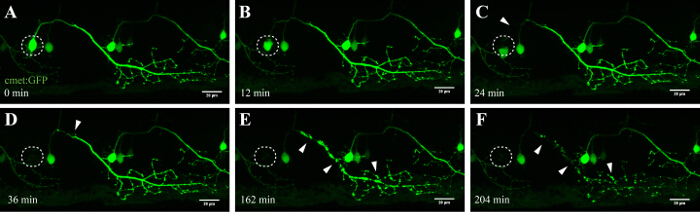
איור 4: ניוון האנטרוגרד של נוירון-ablated UV. זמן לשגות הדמיה של הניוון המוחיה של נוירון שדרת ablated-UV. (AF) UV-הקרנה של נוירון השדרה יחיד (במצטבר: GAL4, כטב"מ: EGFP; A; מעגל) הביא סומה של נוירון מתכווץ וריכוז לאורך זמן (AC), ואחריו הפיצול אקסונלית (CF; ראשי חץ) . התנוונות אקסונלית התחילה ב סומה (האתר של אבלציה) והתקדמה האנטרוגרד לכיוון הקצה הדיסטלי של האקסון עד שלבסוף, הקרינה ב סומה נעלמה ואת האקסון כולו הראה "blebbing" (DF). ברי סולם = 20 מיקרומטר. סרט 3D שניתן זמן לשגות של אבלציה זה מוצג וידאו 1.es / ftp_upload / 54,983 / 54983fig4large.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
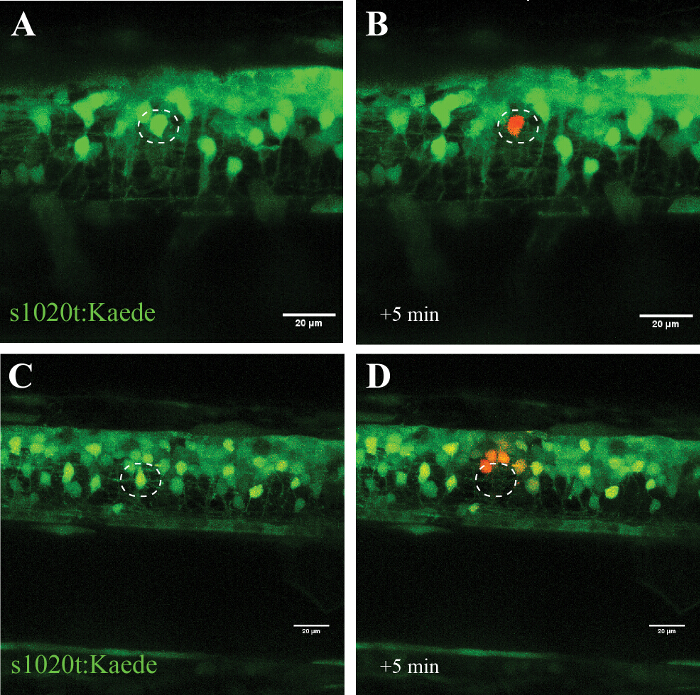
איור 5: אישור של השפעת קרינת UV תא בודד באמצעות fluorophore photoconvertible (קאאד) בתוך הנוירון מוטורי. אימות של קרינת UV תא בודד דרך ההפעלה של קאאד fluorophore photoconvertible נוירון. (AD) קרינת UV של נוירונים שכותרתו עם קאאד. (א) photoconversion של נוירון בודד (עיגול) עם כוח לייזר של 30% עבור 10 s הובילה photoconversion של קאאד (מירוק לאדום) ב נוירון יחיד ממוקד בלבד (B). ראוי לציין, כי תא המרה שרד במשך כמה שעות, לא הראה שום סימנים חזותיים של הידרדרות, כגון blebbing או עיגול כלפי מעלה. אבלציה של נוירון בודד (C ; המעגל) עם כוח ליזר גבוה יותר (95% במשך 10 שניות) הביא היעלמות לאלתר כי נוירון (ד) ו photoconversion הבאה של קאאד במספר קטן של נוירונים שמסביב ברדיוס של כ 20 מיקרומטר. ברי סולם = 20 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
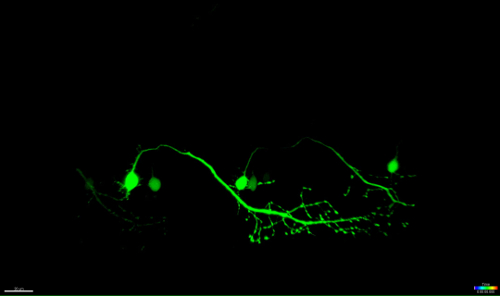
וידאו 1: טיוח משטח 3D (Imaris) של הנוירון ablated UV באיור 4.
הוידאו זמן לשגות של הנוירון מתואר באיור 4 הוא משטח שניתנו באמצעות תוכנת ויזואליזציה (Imaris, Bitplane). זה מדגיש את תהליך ההתכווצות של סומה ablated, ואחריו פיצול אקסונלית anterogradely לקראת סוף דיסטלי של התא."Target =" euron_ablation-3D_rendered.mov _ blank "> אנא לחץ כאן כדי להוריד את הקובץ.
איור 1 משלים: יצוק agarose אופציונלי הדמיה זמן ארוך.
כדי למנוע תנועה של הדג ואת agarose במהלך הרכישה לטווח ארוך להכין סופגנייה מעגל בצורת של agarose בשולי באמצע המנה 35 מ"מ זכוכית התחתונה (א). תן סט agarose עבור ~ 10 דקות והועבר דגים לתוך המעגל הפנימי עם ירידה של agarose (B). נסו לצמצם את כמות agarose עבור הטבעה (לצחצח agarose עודף אל מחוץ לאחר orientating הדג). אנא לחץ כאן כדי להוריד את הקובץ.
Discussion
גישות אבלציה לייזר
ליזר בסיוע טכניקות אבלציה לאפשר המיקוד המדויק של קבוצות בודדות או קטנות של תאים. שילוב טכניקה זו עם מיקרוסקופ ברזולוציה גבוהה מניפולציות גנטיות במודלים של בעלי חיים כגון דג זברה מאפשר לחוקרים לבחון את גורלו של תא יחיד שיטתיים ואת האינטראקציות לאחר פציעה.
ה- UV (405 ננומטר) פרוטוקול אבלציה לייזר המתואר כאן מתאר כיצד תאים בודדים ניתן הדגיש או נהרג סלקטיבי (באופן תלוי מינון), בעוד השכנה נוירונים, גליה, ואת האקסונים נותרים ללא פגע. יש לנו מנוצל בהצלחה גישה זו בניסויים בתרביות תאים ולתאר כאן הגישה מפורטת חוט השדרה דג הזברה. אנו מראים יישום של גישה זו בחוט השדרה דג הזברה על ידי הדגשת נוירון יחיד סלקטיבי בתוך רשת של תאים אחרים (איור 5, A ו- B), או על ידי הריגת נוירון בודד מיד וללא התאוששות (איור 5, C ו- D).
בעבר, מערכות לייזר מתמחה, כגון לייזר פעמו-חנקן או מערכות לייזר שני הפוטונים, נדרשו כדי לגרום נזק לרקמות עצב מוטוריים transections 10, 11, 12, 13. מערכות לייזר אלה נוצלו בהצלחה לגרום נזק לתאים, כגון פקקת עורקים וורידים 6, פציעה 7 כליות חריפה, הלב פציעה 8, וכדי ללמוד גלי סידן ותגובה microglial לאחר פגיעה מוחית 9. יתר על כן, סוסטל ועמיתיו השתמשו ההתקנה confocal קונבנציונאלי (351 ננומטר ו 364 ננומטר לייזרים UV) כדי לגרום נזק אפיתל ותאי גלייה ב תסיסנית 14 </ Sup>.
רלוונטי של מודלי דג זברה עבור הבנת ALS (ומחלות אדם אחרות)
דג הזברה הם אורגניזם מודל בשימוש נרחב, במיוחד ללימודי התפתחותי 28, 29, 30. אמנם יש להם מגבלות מסוימות, את הפוטנציאל שלהם לבנות מודל מחל אנושיות ולתת הבנה של מנגנונים מולקולריים פתוגניים הוא עצום. מודלי דג זברה הוקמו היטב לחקר MND ו הובילו לתובנות מולקולריים חשובים 31, 32, 33, 34. קווי דג הזברה מהונדס יכול להיווצר במהירות (4 - 5 חודשים) ולאפשר מעקב סלקטיבית של תאים מסוג מסוים, תכונות ההופכות אותם תוספת רבת ערך במודלים של בעלי חיים הנוכחי של ALS. עוברי דג זברה / זחלים הם אופטיים שקופים להציע התנסות ייחודיתיתרונות נפשיים המאפשרים הדמיה חי לטווח ארוך ברמה מהתא הבודד במוח או בחוט השדרה, אשר לא ניתן להשיג בקלות במודלים של מכרסמים (או בבני אדם). בשילוב עם שיטות מולקולריות, כגון אבלציה תא בודד, זה מספק פלטפורמת ניסיוני ייחודית לחקר מנגנונים מולקולריים מדויקים in vivo.
הנוירונים המוטוריים ניתן לכוון באופן סלקטיבי באמצעות UV לייזר אבלציה
הנוירונים שדרת דג הזברה מתחילים להתפתח בתוך 10 שעות לאחר הלידה, שהוקמו לאחר כ 48 שעות 35, 36. זו התפתחות מהירה מאפשרת ההדמיה של נוירונים אלה במסגרות זמן קצרות ועם קצב העברת נתונים גבוהים. הנוירונים מוטוריים לספק את הקשר ההכרחי בין המוח ושרירים, ב ALS, מושפעות הקורטקס המוטורי (נוירונים מוטורי עליון), גזע המוח, ואת חוט השדרה (הנוירונים מוטוריים נמוכים). אובדן הנוירונים האלה מוביל בהכרח muניוון וחולשה scle. הנוירונים מוטוריים בחוט של דג זברת השדרה ניתן לזהות על ידי התחזיות המובהקות שלהם ועל ידי השימוש של יזמים ספציפיים הנוירון מוטורי כמו -3MNX1. מיקוד סומה תא של נוירונים מקרין כזה חשף את ניוון האנטרוגרד לאורך הקרנת axonal לאורך זמן (איור 4 ווידאו 1). הדמיה ברזולוציה מתחיל מתא בודד הנוירונים המוטוריים השדרה בנוסף אישר טרנסלוקציה phosphatidylserine ו Annexin V-תיוג הסוגר לאחר אבלציה לייזר (ראה איור 4 משלים וידאו 3 הפניה 27). למרות אנו מדווחים על ההפעלה של Annexin V בלמות נוירונים לאחר גישה אבלציה לייזר UV שלנו, אנחנו לא יכולים להיות בטוחים כי מפל המוות כי היא מופעלת במהלך תהליך מואץ זה תואם בדיוק את ומוות עצבי המתרחשת במהלך ניווניות של מערכת העצבים או הומאוסטזיס תא נורמלי.
בעוד גישה זו אבלציה היא מאוד לשחזורוספציפיות, אסטרטגיות הטבעה שונות עשויות גם להשפיע על היעילות של אבלציה UV. מניסיוננו, זה היה מוצלח ביותר כדי למזער את שכבת agarose אנו מוטבעים הדגים שלנו. שכבות דקיקות של הטבעה בינונית עם שכבה נוספת של מי ביצה עשוי להפחית את כוח UV קבל בסופו של דבר על ידי התא בשל הנחתה ואפקטי פיזור המתרחשים לאורך נתיב קרן.
בעתיד, חציית קווי דג מהונדסים שונים תאפשר ההדמיה של לטווח קצר מיידית (עד 12 שעות) תגובות של תאים נגועים אחרים, כגון גליה, להרס תאים שנגרם ע"י הליזר. לדוגמא, astrocyte ורעילה אוטונומיים בלתי תא בהפרעות ניווניות כגון ALS כבר באור זרקורי המחקר מעורב בכבדות פתוגניות של ALS ספורדי והמשפחתי 37, 38. עם זאת, המנגנונים רעילים גליה סלקטיביותכלפי מנוע נוירונים עדיין אינם ברורים. אנחנו ואחרים נצלו לאחרונה של גישה זו ללמוד לבליעה למות נוירונים ידי המיקרוגליה דמיינו סליקת שרידים עצביים 27, 39, 40.
שילוב הטכניקה אבלציה עם מיקרוסקופיה וסמנים ברזולוציה גבוהה neuroinflammation יאפשר לחוקרים בעתיד להרחיב את ההבנה של תפקוד תא בודד ומערכות תאים מחוברות. אפיון התהליכים האלה בסביבת in vivo הוא קריטי לא רק במסגרות התפתחותיות אלא גם במודלים של מחלות ניווניות, כולל MND, שבו אינטראקציות הסלולר עלולות להיפגע 3, 41.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This work was supported by the MND Research Institute of Australia and the Cure for MND Foundation [GIA 1638], the Snow Foundation, and Macquarie University [MQRDG 9201401462]. Imaging was carried out at the Microscopy Facility in the Department of Biomedical Sciences, Macquarie University. Other members of the MND research center are thanked for their contributions to the development of these methods and fish lines.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose low melting | Fisher-Scientific | Dissolve in egg water with tricaine (0.02%) at 0.8 - 1.5% | |
| Tricaine | Argent Labs | MS-222 | 0.02% |
| Harvard standard wall Borosilicate with filament Capillary Glass | World Precision Instruments, Inc. | GC100F-10 (short) GC100F-15 (long) | Pull to a resistance of 2 - 7 MΩ |
| Egg water | 0.6 g Instant Ocean sea salt, 4 mL of 1 mg/mL methylene blue in 10 L deionized water | ||
| 1-phenyl-2-thiourea (PTU) | Sigma | P7629 | |
| Pronase | Sigma | 10165921001 | |
| Heat block | Select BioProducts | Digital block heater (SBD110_) | |
| Microinjection apparatus | World Precision Instruments, Inc. | Microinjection was performed by hand under a steromicroscope (Leica) with a loaded glass needle and a Picospritzer II (General Valve corporation) | |
| Stereoscope | Leica | Bright field illumination microscopy was performed on a Leica M165FC stereo dissection microscope (Leica) | |
| Microscope | Leica | SP5 | |
| 35 mm glass bottom dish | MatTek Corporation | P35G-0-20-C |
References
- Becker, T. S., Rinkwitz, S. Zebrafish as a genomics model for human neurological and polygenic disorders. Dev Neurobiol. 72 (3), 415-428 (2012).
- Wilt, B. A., et al. Advances in light microscopy for neuroscience. Annu Rev Neurosci. 32, 435-506 (2009).
- Philips, T., Robberecht, W. Neuroinflammation in amyotrophic lateral sclerosis: role of glial activation in motor neuron disease. Lancet Neurol. 10 (3), 253-263 (2011).
- Robberecht, W., Philips, T. The changing scene of amyotrophic lateral sclerosis. Nat Rev Neurosci. 14 (4), 248-264 (2013).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62 (3), 232-240 (2013).
- Jagadeeswaran, P., Paris, R., Rao, P. Laser-induced thrombosis in zebrafish larvae: a novel genetic screening method for thrombosis. Methods Mol Med. 129, 187-195 (2006).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845(2011).
- Matrone, G., et al. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
- Sieger, D., Moritz, C., Ziegenhals, T., Prykhozhij, S., Peri, F. Long-range Ca2+ waves transmit brain-damage signals to microglia. Dev Cell. 22 (6), 1138-1148 (2012).
- Lewis, G. M., Kucenas, S. Motor nerve transection and time-lapse imaging of glial cell behaviors in live zebrafish. J Vis Exp. (76), (2013).
- Rosenberg, A. F., Wolman, M. A., Franzini-Armstrong, C., Granato, M. In vivo nerve-macrophage interactions following peripheral nerve injury. J Neurosci. 32 (11), 3898-3909 (2012).
- Villegas, R., et al. Dynamics of degeneration and regeneration in developing zebrafish peripheral axons reveals a requirement for extrinsic cell types. Neural Dev. 7, 19(2012).
- O'Brien, G. S., et al. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. (24), (2009).
- Soustelle, L., Aigouy, B., Asensio, M. L., Giangrande, A. UV laser mediated cell selective destruction by confocal microscopy. Neural Dev. 3, 11(2008).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), 1000412(2010).
- Essentials of Biology 2. JoVE. , JoVE Science Education Database. Mouse, Zebrafish, and Chick. Zebrafish Microinjection Techniques (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196(2012).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio).Vol.4th ed. , Univ. of Oregon Press. Eugene. (2000).
- Clark, K. J., Urban, M. D., Skuster, K. J., Ekker, S. C. Transgenic zebrafish using transposable elements. Methods Cell Biol. 104, 137-149 (2011).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), (2009).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20 (1), 206-218 (2000).
- Arkhipova, V., et al. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365 (1), 290-302 (2012).
- Flanagan-Steet, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132 (20), 4471-4481 (2005).
- Hall, T. E., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin alpha2-deficient congenital muscular dystrophy. Proc Natl Acad Sci U S A. 104 (17), 7092-7097 (2007).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Morsch, M., et al. In vivo characterization of microglial engulfment of dying neurons in the zebrafish spinal cord. Front. Cell. Neurosci. , (2015).
- Grunwald, D. J., Eisen, J. S. Headwaters of the zebrafish -- emergence of a new model vertebrate. Nat Rev Genet. 3 (9), 717-724 (2002).
- Lele, Z., Krone, P. H. The zebrafish as a model system in developmental, toxicological and transgenic research. Biotechnol Adv. 14 (1), 57-72 (1996).
- Veldman, M. B., Lin, S. Zebrafish as a developmental model organism for pediatric research. Pediatr Res. 64 (5), 470-476 (2008).
- Kabashi, E., et al. Gain and loss of function of ALS-related mutations of TARDBP (TDP-43) cause motor deficits in vivo. Hum Mol Genet. 19 (4), 671-683 (2010).
- Laird, A. S., et al. Progranulin is neurotrophic in vivo and protects against a mutant TDP-43 induced axonopathy. PLoS One. 5 (10), 13368(2010).
- Lemmens, R., et al. Overexpression of mutant superoxide dismutase 1 causes a motor axonopathy in the zebrafish. Hum Mol Genet. 16 (19), 2359-2365 (2007).
- Ramesh, T., et al. A genetic model of amyotrophic lateral sclerosis in zebrafish displays phenotypic hallmarks of motoneuron disease. Dis Model Mech. 3 (9-10), 652-662 (2010).
- Hanneman, E., Trevarrow, B., Metcalfe, W. K., Kimmel, C. B., Westerfield, M. Segmental pattern of development of the hindbrain and spinal cord of the zebrafish embryo. Development. 103 (1), 49-58 (1988).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Prog Neurobiol. 69 (6), 419-449 (2003).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Philips, T., Rothstein, J. D. Glial cells in amyotrophic lateral sclerosis. Exp Neurol. 262, Pt B 111-120 (2014).
- Mazaheri, F., et al. Distinct roles for BAI1 and TIM-4 in the engulfment of dying neurons by microglia. Nat Commun. 5, 4046(2014).
- van Ham, T. J., Kokel, D., Peterson, R. T. Apoptotic cells are cleared by directional migration and elmo1- dependent macrophage engulfment. Curr Biol. 22 (9), 830-836 (2012).
- Radford, R. A., et al. The established and emerging roles of astrocytes and microglia in amyotrophic lateral sclerosis and frontotemporal dementia. Front Cell Neurosci. 9, 414(2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved