Method Article
في المختبر تمايز الناضجة Myofibers للتصوير لايف
In This Article
Summary
Muscle cells are among the most complex eukaryotic cells. We present a protocol for the in vitro differentiation of highly mature myofibers that allows for genetic manipulation and clear imaging during all developmental stages.
Abstract
وتتكون العضلات والهيكل العظمي من myofibers، أكبر الخلايا في جسم الثدييات واحدة من عدد قليل من syncytia. كيف يتم تجميع الهياكل المعقدة والحفظ تطويريا التي يتكون منها لا يزال قيد التحقيق. حجمها والفسيولوجية ملامح غالبا ما تقيد التلاعب والتصوير التطبيقات. ويستخدم على نطاق واسع الثقافة من خطوط الخلايا خلده، ولكن يمكن تكرار سوى الخطوات الأولى من التمايز.
هنا، نحن تصف البروتوكول الذي يتيح التلاعب الجيني سهولة myofibers القادمة من myoblasts الماوس الأولية. بعد أسبوع واحد من التمايز، وmyofibers عرض انقباض، محاذاة ساركومير والثلاثيات، وكذلك نوى الطرفية. يمكن أن يتبع عملية التمايز بأكملها من خلال التصوير الحي أو المناعي. هذا النظام يجمع بين مزايا الموجودة خارج الحي وفي بروتوكولات المختبر. إمكانية ترنسفكأيشن سهلة وفعالة وكذلكسهولة الوصول إلى جميع مراحل التمايز يوسع التطبيقات المحتملة. Myofibers بالتالي، يمكن استخدامها ليس فقط لمعالجة مسائل البيولوجيا التطورية والخلية ذات الصلة، ولكن أيضا لإعادة إنتاج الظواهر مرض في العضلات لالتطبيقات السريرية.
Introduction
الهيكل العظمي والعضلات يؤلف ما يصل إلى 40٪ من وزن جسم الإنسان 1. وتمثل الاضطرابات المرتبطة عضلة الصحية الهائلة والعبء الاقتصادي 2. كيف يتكون هذا النسيج المعقد للغاية والمنظمة، حافظ، ومجدد يشكل حقل بحث واسعة وراسخة. تبعا لأهمية علمية محددة، يمكن أن النهج الأكثر ملاءمة تتراوح بين الثقافات myotube مركزيا بسيطة لمجمع في النماذج الحية 3-6.
والهدف من هذا البروتوكول هو توفير نظام في المختبر التي تسمح لرصد تكون العضل من خلال التصوير الحي والمناعي. بالمقارنة مع الأساليب التقليدية، وهذا النظام يوفر نظرة كاملة جدا وحيوية في عملية عضلي الماوس. يمكن اتباعها الخلايا من مرحلة بالخلايا العضلية الجذعية إلى ناضجة، ليف عضلي متعددة النوى عرض الثلاثيات متقاطع ونوى الطرفية 7. هذا المستوى النضج يمكنيمكن تحقيقه باستخدام معدات زراعة الخلايا العادية، دون الحاجة إلى أجهزة تنشيطية أو الميكانيكية المعقدة. وعلى الرغم من بعض النجاح في أنظمة المختبر تم الإبلاغ 8،9، على حد علمنا، هذا هو البروتوكول الوحيد توليد myofibers الماوس ناضجة مع تي الأنابيب يقترن عرضيا مع العضلية شبكية (SR). وبالتالي، فإن هذا النظام في المختبر يمكن أن تستخدم لدراسة الآليات الجزيئية لتشكيل الثالوث، التي لا تزال غير مفهومة 10.
وثمة ميزة أخرى لاستخدام هذا النظام هو توافر الموارد المستهدفة الماوس التحقق من صحتها، مثل الأجسام المضادة، والأدوية، والأدوات رني. لا يتطلب بروتوكول بسيط نسبيا خطوات شاقة، والتلاعب من ذوي المهارات العالية، أو معدات باهظة الثمن ومخصصة. تبدأ myofibers نضجت تظهر بعد 5 د للثقافة التمايز 7، وعرض انقباض جانب الشرر الكالسيوم (بيانات غير منشورة). في أسبوع واحد، وتطوير مختلفآل مراحل إحدى الخلايا الأكثر تعقيدا في جسم الثدييات يمكن دراستها بالاشتراك مع مجموعة متنوعة من فحوصات في المختبر.
Protocol
ملاحظة: واحد عوائد الماوس myoblasts كافية لما يقرب من 35 أطباق مم أو طبقين الحية التصوير، لذلك mattings الخطة، تشريح، وطلاء (الخطوة 2.6) وفقا لذلك. منذ يتم عزل myoblasts من خلال centrifugations متسلسل وpreplating، وينبغي أن يتم ذلك البروتوكول ودفعات من 5-10 الحيوانات.
وقد وافق جميع الإجراءات التي تجرى على الحيوانات من قبل لجنة الأخلاقيات الحيوانية في معهد لطب الجزيئي وجامعة بيير وماري كوري
1. تشريح الفئران حديثي الولادة عضلات هند الأطراف الاصطناعية
- إعداد جميع الحلول مقدما (مواد الجدول) وتعقيم عن طريق الترشيح (0.22 ميكرون فلتر). تأكد من أن جميع وسائل الإعلام هي عند 37 درجة مئوية قبل إضافة إلى الخلايا، فيما عدا المستحضرات التي تحتوي على قبو غشاء المصفوفة (على سبيل المثال، Matrigel).
- تعقيم المواد تشريح (واحد لكل من: مقص منحني، مقص مستقيم، ملقط العادية،وملقط غرامة طرف) ومقاعد البدلاء العمل بمسحها مع 70٪ من الإيثانول.
- إعداد طبق بتري 100 ملم مع 5 مل من Dulbecco والفوسفات مخزنة المالحة (DPBS) لجمع العضلات والحفاظ على الجليد حتى الخطوة تنميق.
- قطع رأس P6 - P8 الفئران مع المقص مباشرة وتعقيم الجلد مع الايثانول 70٪.
- إجراء شق في الجلد مرة أخرى وسحب بلطف نحو أطرافه الخلفية حتى تتم إزالته، وفضح تماما العضلات الخلفية الأطراف الاصطناعية.
- استخدام الملقط لإزالة الأنسجة الدهنية دون الإضرار العضلات.
- لإزالة العضلات الظهرية هند الأطراف الاصطناعية، والحفاظ على أطرافهم امتدت وثني مخلب لفضح الأوتار كعب. استخدام مقص منحني إلى العضلات منفصلة من العظام، بدءا من الأوتار، عن طريق تحريك بلطف وقطع صعودا. استئصال العضلات ووضعها في DPBS مثلج.
- عزل عضلات الفخذ عن طريق معسر العضلات مع ملقط غرامة طرف وقطع حوله دون الإضرار عظم الفخذ أو مفصل الركبة.
- بعد تشريح جميع الحيوانات، والمضي قدما إلى معقم غطاء تدفق الصفحي ثقافة الخلية، حيث يجب أن يتم تنفيذ كافة الخطوات التالية.
2. بالخلايا العضلية الجذعية عزل
- إزالة الفائض من DPBS. اللحم المفروم مع النسيج المقص منحنية تعقيمها من أجل الحصول على كتلة موحدة.
- جمع الأنسجة المفروم في أنبوب الطرد المركزي 50 مل المخروطية باستخدام 5 مل من مزيج الهضم واحتضان مع الانفعالات عند 37 درجة مئوية لمدة 90 دقيقة.
- وقف عملية الهضم عن طريق إضافة 6 مل من تشريح المتوسطة وأجهزة الطرد المركزي تعليق لمدة 5 دقائق في 75 x ج لتكوير الأنسجة المتبقية.
- بعناية جمع طاف. تأكد من عدم جمع الحطام الأنسجة. أجهزة الطرد المركزي لذلك في 350 x ج لمدة 5 دقائق. و resuspend في 5 مل من المتوسط تشريح.
- تصفية تعليق الخلية من خلال مصفاة الخلية 40 ميكرون. إضافة 25 مل من المتوسط تشريح وpreplate في صحن 150 ملم لمدة 4 ساعات في حاضنة الثقافة الخلية (37 درجة مئوية و 5٪ CO 2 </ دون>) للسماح للالليفية على الانضمام.
- في حين preplating، أطباق معطف مع 500 ميكرولتر من بدروم غشاء مصفوفة المخفف 1: 100 في IMDM البارد لمدة 1 ساعة على RT. يغسل مرة واحدة مع DPBS ولوحة الخلايا على الفور (خطوة 2.8) أو ترك مع متوسط النمو حتى الطلاء.
- بعد preplating، وجمع طاف وأجهزة الطرد المركزي لذلك في 350 x ج لمدة 10 دقيقة.
- و resuspend في وسط النمو والاعتماد على الخلايا على عدادة الكريات. ضبط مستوى الصوت بحيث يتم مطلي بين 150،000 و 250،000 الخلايا في الغشاء القاعدي طبق المغلفة المصفوفة. إبقاء الخلايا في حاضنة الثقافة الخلية.
3. ليف عضلي التمايز
ملاحظة: بعد 3 د، يجب أن الخلايا تبدأ في الصمامات وشكل myotubes في حوالي 70٪ confluency (الشكل 1B).
- عند هذه النقطة، transfect الخلايا، إذا رغبت في ذلك، مع سيرنا أو الحمض النووي من الفائدة. إذا لا ينبغي transfected الخلايا، وتغيير مباشرة إلى التمايز المتوسطة والتزلج على الجليدp لخطوة 3.4.
- Transfect مع الكواشف ترنسفكأيشن باتباع إرشادات الشركة المصنعة. احتضان الخلايا لمدة 5 ساعات مع المجمعات سيرنا الدهون (20 نانومتر + 1 ميكرولتر من كاشف) أو المجمعات الحمض النووي الدهون (1 ميكروغرام + 1 ميكرولتر من كاشف). تحسين تركيز سيرنا والحمض النووي إذا لزم الأمر.
- غسلها مرة واحدة مع متوسط التمايز ومن ثم التبديل إلى متوسطة التمايز الجديد.
- في اليوم التالي، وتمييع الطابق السفلي غشاء المصفوفة 1: 2 في الجليد الباردة التمايز المتوسطة. إزالة المتوسطة القائمة وإضافة 200 ميكرولتر من المصفوفة الجليد الباردة إلى كل طبق.
- احتضان لمدة 30 دقيقة في حاضنة الثقافة الخلية.
- تكملة متوسطة التمايز مع أجرين AGRIN (100 نانوغرام / مل) وإضافة بعناية 2 مل إلى الخلايا.
- بعناية تغيير نصف المتوسط كل د 2، المكمل دائما مع أجرين AGRIN إلى تركيز النهائي من 100 نانوغرام / ميكرولتر.
- مراقبة تمايز الخلايا وقدرتها على البقاء. اعتمادا على مجموعة متنوعة من العوامل (مثل FBS وجhicken أصول استخراج الجنين)، والخلايا قد يستغرق ما بين 5-10 التمايز د للوصول إلى النضج الكامل (الشكل 2).
4. المناعية في أطباق الزجاج السفلي
- لالمناعية، في أي وقت نقطة من الفائدة، وغسل خلايا مرة واحدة مع DPBS واصلاحها مع PFA 4٪ في RT لمدة 10 دقيقة.
- غسلها مرتين مع DPBS. في هذه المرحلة، والخلايا ويمكن تخزينها في 4 درجة مئوية.
- Permeabilize لهم مع 0.5٪ تريتون X-100 لمدة 5 دقائق على RT.
- غسلها مرتين مع برنامج تلفزيوني ومنع مع عرقلة الحل لمدة 30 دقيقة في RT.
- احتضان لهم مع الأجسام المضادة الأولية مخففة في عرقلة الحل O / N عند 4 درجات مئوية.
- غسل 3X مع DPBS لمدة 5 دقائق على RT.
- احتضان لهم مع الأجسام المضادة الثانوية و 0.2 ميكروغرام / مل من دابي لمدة 1 ساعة على RT.
- غسل 3X مع DPBS لمدة 5 دقائق على RT.
- إضافة 200 ميكرولتر من المتوسطة المتزايدة، والشروع في التصوير.
النتائج
يتم تحديد مدى التطور ليف عضلي في الغالب من قبل نقاء وبقاء myoblasts معزولة. يمكن استخدام التصاق، والانتشار، والقدرة على الاندماج للوصول تجريبيا تلك المعلمات (الشكل 1 أ، ب). في انتشار D2، يجب myoblasts انضمت ويجب عرض شكل مغزلي نموذجي. ومن المتوقع أن يحدث على نطاق واسع في هذه المرحلة، مما يؤدي إلى تشكيل myotube مركزيا عفوية في اليوم التالي (الشكل 1B) انتشار الأسلحة النووية.
confluency خلية قد تحتاج تعديلات طفيفة. ينبغي زيادة إذا myoblasts تأخذ أكثر من 3 d لتتكاثر والصمامات. يجب أن انخفض ذلك إذا لم يتم السماح myofibers على النمو واستطال مباشرة نسبيا نظرا لكثافتها. Confluency يقلل عادة من المركز إلى المحيط الخارجي للصحن، لذلك يجب أن يتم العثور على أفضل myofibers نحو المناطق الخارجية.
سوف Myotubes استطال بسرعة وعرض متعددة النوى الانحياز مركزيا (الشكل 1C). بواسطة D5، بعض الخلايا تبدأ الحصول على التصدعات ونقل النواة إلى المحيط. فإن عدد myofibers مع خصائص ناضجة زيادة مع مرور الوقت وكذلك مع سمك الخلية (1D الشكل).
درجة التمايز يمكن زيادة احظ المناعي. Myofibers الثابتة في التمايز D8 الثلاثيات الحالي مستعرضة. ويمكن التأكد من ذلك عن طريق تصوير مكونات T-الأنابيب (DPHR) وريال (triadin)، التي من المتوقع أن colocalize في الثلاثيات (الشكل 2).
وظائف myofibers يمكن معالجتها عن طريق التصوير الحي. من التمايز D3 فصاعدا، وتعرض الخلايا الوخز عفوية. قبل transfecting جهاز استشعار الكالسيوم (على سبيل المثال.، GCaMP6f 11)، فمن الممكن أن نلاحظ أن الانقباضات تقترن مع قمم الكالسيوم (الشكل 3).
باستخدام هذا النظام، تمكنا من تحديد المسار الجزيئي الرواية التي تتعطل في اعتلال العضلات centronuclear وضمور العضلي، والتي يمكن بالتالي أن يكون الهدف رواية عن العلاجات الجزيئية مبتكرة 7. تكيفنا أيضا هذا الأسلوب لدراسة تطوير الوصل العصبي العضلي (NMJ) 12. من خلال coculture مع الفئران Explants النخاع الشوكي، التي وصفناها دور للداينين في تشكيل NMJ 13.

الشكل 1: مراحل تطور ثقافة بالخلايا العضلية الجذعية. أ) في انتشار D2، انضمت myoblasts وبدأت تنتشر. ب) في prolifووصل إلى 80٪، وmyoblasts بدء دمج عفويا - eration D3، وconfluency 60. C) في D3 التمايز، myotubes تحتوي على نوى موقعا مركزيا والسائد. D) من التمايز D5 فصاعدا (على سبيل المثال، يوم 8)، myofibers تبدأ العارضة التصدعات ونوى المحيطية وتبدأ في رشاقته. شريط الحجم: 50 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
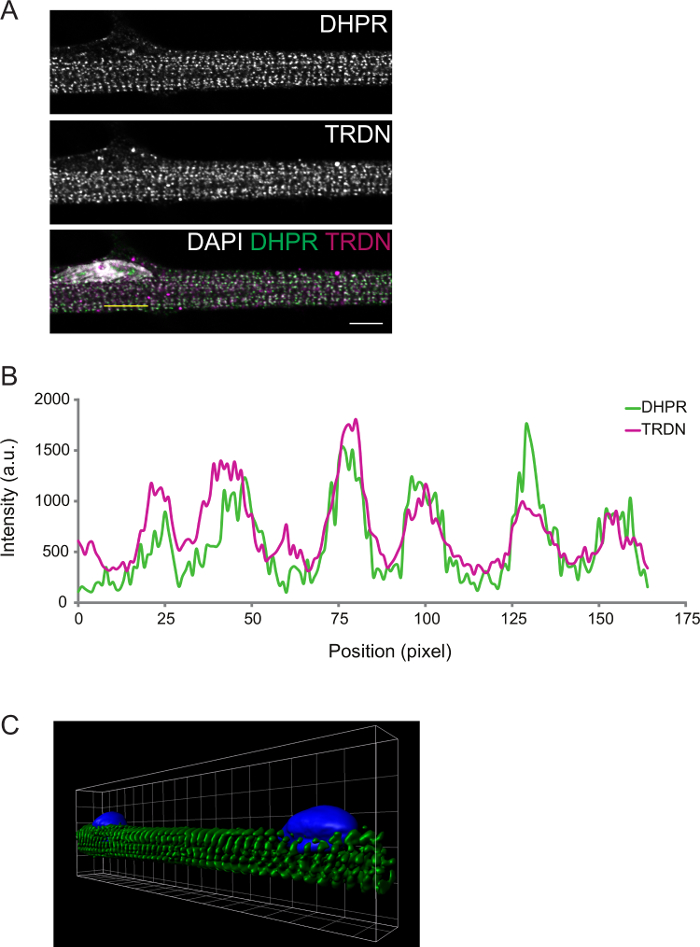
الشكل 2: الممثل متحد البؤر صورة من D8 ليف عضلي Immunostain. أ) المناعية للديهيدروبيريدين مستقبلات (DHPR، أعلى لوحة) وtriadin (TRDN، وسط لوحة). تراكب القنوات DHPR، TRDN، ودابي يظهر colocalization من مكونات الثالوث. B) ملف تعريف كثافة من الخط الأصفر تعادل في A. C) صورة 3D من حجم جعل من myofibers الملون لα-actinin (الخضراء) ودابي (الأزرق). نطاق شريط وشبكة العرض: 5 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
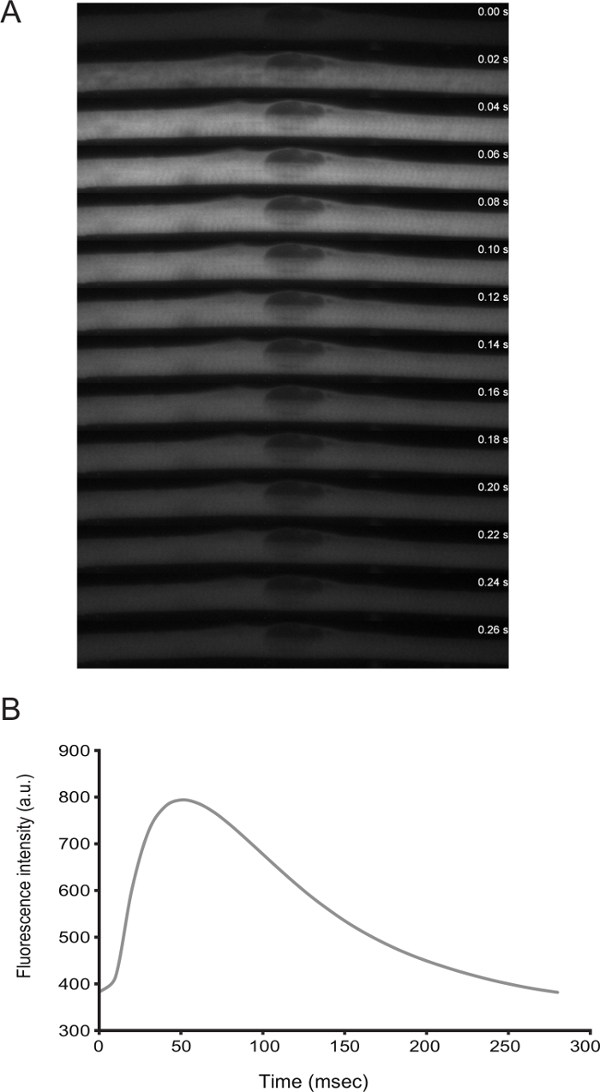
الرقم 3: تصوير لايف مستويات الكالسيوم في Myofibers مع عفوية الوخز. أ) عالية السرعة الوقت الفاصل بين (20 مللي إطارات) المجهري شرارة الكالسيوم في ليف عضلي الوخز. تم الكشف عن الكالسيوم من خلال التعبير عن GCaMP6f (Addgene البلازميد # 40755). B) الكمي لكثافة مضان مع مرور الوقت لاستشعار الكالسيوم في لوحة A._blank "> اضغط هنا لمشاهدة نسخة أكبر من هذا الرقم.
Discussion
استخدام هذا البروتوكول لزراعة myoblasts الأولية يثير مكانة خاصة التي تغذي بشكل كبير في تطوير myofibers. ومن المقرر جزئيا إلى أنواع أخرى من الخلايا التي هي أيضا موجودة بأعداد قليلة جدا هذا. يجب تحقيق التوازن بين تركيز بالخلايا العضلية الجذعية ونقاء الثقافة. يعتمد ثقافة خلية جيدة أيضا على نوعية المنتجات المستخدمة لصياغة المتوسطة. جميع المنتجات المشتقة من مصادر حيوانية يجب اختبارها بدقة. في تجربتنا، وينبغي أيضا أن تراقب الأوضاع الهضم.
كالعادة للثقافات الأولية، يمكن أن تقلب التجريبية تكون أعلى مما كانت عليه في الدراسات مع الألياف معزولة أو myoblasts خلد. هذا التغير يمكن أن تقلص من توحيد مكونات المتوسطة والهضم، والفئران العمر والحجم، والنقاط الزمنية للتلاعب الثقافة وجمع النتائج. ومع ذلك، والاستفادة من التدقيق في الوقت الحقيقي آليات معقدةاللازمة لنمو ليف عضلي يفوق كثيرا من العيب التباين.
هذا البروتوكول يمنح مزايا في المختبر النهج دون المساس تمايز الخلايا. تنضج Myofibers حتى تتشكل الثلاثيات وتقترن تقلصات إلى الشرر الكالسيوم. هذه المخرجات الوظيفية يمكن الوصول إليها في ظروف تجريبية مختلفة. وعلاوة على ذلك، يمكن أن يكون هناك العديد من الاختلافات التقنية التي أدخلت على البروتوكول. Myoblasts يمكن أن تحصد من الفئران حديثي الولادة مع الطفرات المصالح المتعلقة تنمية العضلات. الخلايا يمكن هي lysed لتحليل الكيمياء الحيوية في مختلف نقاط وقت التمايز. يمكن إضافة المؤشرات الكالسيوم للثقافة لمتابعة دينامياتها. بنيات علم البصريات الوراثي يمكن استخدامها لتنفيذ بعض مسارات الإشارات أو للحث على الاستجابات المحلية المحددة. وأخيرا، فإن myofibers يمكن cocultured مع أنواع الخلايا الأخرى لدراسة تفاعلاتها.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
This work was supported by the European Research Council (ERG) and EMBO installation (ERG) and by a PhD fellowship from the Fundação para a Ciência e Tecnologia (MP).
Materials
| Name | Company | Catalog Number | Comments |
| Dispase II | Gibco | 17105041 | |
| Collagenase type V | Sigma-Aldrich-Aldrich | C9263 | |
| IMDM, Glutamax supplemented | Gibco | 31980022 | |
| Matrigel Growth reduced factor | Corning | 354230 | protein concentration of the lot should be around 10 mg/mL and endotoxin result should be <1.5 |
| Chicken Embryo Extract | MP biomedical | 2850145 | it is also possible to prepare in the lab (Danoviz ME, Yablonka-Reuveni Z. Methods Mol Biol (2012)) |
| Recombinant rat agrin | R&D systems | 550-AG-100 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Horse Serum | GE Healthcare | 11581831 | |
| Lipofectamine RNAiMAX | Invitrogen | 13778-150 | used to transfect siRNA |
| Lipofectamine LTX | Invitrogen | 15338-100 | used to transfect DNA |
| Lipofectamine 2000 | Invitrogen | 11668030 | used to transfect siRNA plus DNA |
| DPBS | Gibco | 14190094 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF0001 | |
| Cell strainer | Corning | 21008-949 | |
| Fluorodishes | World precision instruments | FD35-100 | dishes used to cultivate cells for live imaging |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| 16% PFA (Paraformaldehyde) | Science Services GmbH | E15710 | |
| Goat Serum | Sigma-Aldrich | G9023 | |
| BSA (Bovine Serum Albumine) | Sigma-Aldrich | A7906 | |
| Saponine | Sigma-Aldrich | 47036 | |
| DAPI | Sigma-Aldrich | D9542 | use at 200 ng/µL |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| Name | Company | Catalog Number | Comments |
| Solutions and Media | |||
| Digestion Mix | in DPBS 5 mg/mL collagenase 3.5 mg/mL dispase sterile filtered, can be stored in working aliquotes for 2 weeks at -20 °C | ||
| Dissection Medium | in IMDM Glutamax supplemented 10% FBS 1% Penicillin/Streptomycin sterile filtered | ||
| Growth Medium | in IMDM Glutamax supplemented 20% FBS 1% Chicken Embryo Extract 1% Penicillin-Streptomycin sterile filtered | ||
| Differentiation Medium | in IMDM Glutamax supplemented 2% Horse Serum 1% Penicillin-Streptomycin sterile filtered | ||
| Blocking Solution | in DPBS 10% Goat Serum 5% BSA add 0.1% saponine when incubating with primary and secondary antibodies |
References
- Janssen, I., Heymsfield, S. B., Wang, Z., Ross, R. Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol. 89 (1), 81-88 (2000).
- Manring, H., Abreu, E., Brotto, L., Weisleder, N., Brotto, M. Novel excitation-contraction coupling related genes reveal aspects of muscle weakness beyond atrophy-new hopes for treatment of musculoskeletal diseases. Front Physiol. 5, 37 (2014).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270 (5639), 725-727 (1977).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. J Vis Exp. (73), (2013).
- Meng, H., Janssen, P. M. L., et al. Tissue Triage and Freezing for Models of Skeletal Muscle Disease. J Vis Exp. (89), (2014).
- Demonbreun, A. R., McNally, E. M. DNA Electroporation, Isolation and Imaging of Myofibers. J Vis Exp. (106), (2015).
- Falcone, S., Roman, W., et al. N-WASP is required for Amphiphysin-2/BIN1-dependent nuclear positioning and triad organization in skeletal muscle and is involved in the pathophysiology of centronuclear myopathy. EMBO Mol Med. 6 (11), 1455-1475 (2014).
- Flucher, B. E., Phillips, J. L., Powell, J. A. Dihydropyridine receptor alpha subunits in normal and dysgenic muscle in vitro: expression of alpha 1 is required for proper targeting and distribution of alpha 2. J Cell Biol. 115 (5), 1345-1356 (1991).
- Cooper, S. T., Maxwell, A. L., et al. C2C12 co-culture on a fibroblast substratum enables sustained survival of contractile, highly differentiated myotubes with peripheral nuclei and adult fast myosin expression. Cell Motil Cytoskeleton. 58 (3), 200-211 (2004).
- Al-Qusairi, L., Laporte, J. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skelet Muscle. 1, 26 (2011).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system to study mechanisms of neuromuscular junction development and maintenance. Development. , (2016).
- Vilmont, V., Cadot, B., Vezin, E., Le Grand, F., Gomes, E. R. Dynein disruption perturbs post-synaptic components and contributes to impaired MuSK clustering at the NMJ: implication in ALS. Sci Rep. 6, 27804 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved