Method Article
In vitro Differenzierung von Mature Muskelfasern für Live - Imaging
In diesem Artikel
Zusammenfassung
Muscle cells are among the most complex eukaryotic cells. We present a protocol for the in vitro differentiation of highly mature myofibers that allows for genetic manipulation and clear imaging during all developmental stages.
Zusammenfassung
Skelettmuskeln bestehen aus Muskelfasern zusammengesetzt, die größten Zellen im Körper von Säugetieren und einer der wenigen Syncytien. Wie die komplexen und evolutionär konservierte Strukturen, die sie zusammensetzen zusammengebaut wird weiter untersucht. Ihre Größe und physiologischen Funktionen beschränken oft Manipulation und Imaging-Anwendungen. Die Kultur von immortalisierten Zelllinien, ist weit verbreitet, aber es kann nur die frühen Schritte der Differenzierung replizieren.
Hier beschreiben wir ein Protokoll, das einfache genetische Manipulation von Muskelfasern mit Ursprung aus primären Maus-Myoblasten ermöglicht. Nach einer Woche der Differenzierung zeigen die Muskelfasern Kontraktilität, ausgerichtet und Sarkomeren Triaden sowie peripheren Kerne. Die gesamte Differenzierungsprozess kann durch die Live-Darstellung oder Immunofluoreszenz folgen. Dieses System kombiniert die Vorteile der bestehenden ex vivo und in vitro - Protokolle. Die Möglichkeit der einfachen und effizienten Transfektion sowiedie Leichtigkeit der Zugriff auf alle Differenzierungsstufen erweitert die Anwendungsmöglichkeiten. Muskelfasern kann anschließend verwendet werden, nicht nur relevante Entwicklungs- und Zellbiologie Fragen zu beantworten, aber auch Muskelerkrankung Phänotypen für die klinische Anwendung zu reproduzieren.
Einleitung
Skelettmuskel komponiert 1 bis 40% des menschlichen Körpergewichts. Muscle-assoziierten Erkrankungen stellen eine immense gesundheitliche und wirtschaftliche Belastung 2. Wie diese hochkomplexen und organisierte Gewebe gebildet wird, gehalten und regeneriert stellt ein umfangreiches und gut etabliertes Forschungsfeld. 6 - Abhängig von der spezifischen wissenschaftlichen Interesse, die am besten geeignete Ansatz kann von einfachen Myotubenkulturen bis hin zu komplexen in vivo - Modellen 3 reichen.
Das Ziel des Protokolls ist es, ein in vitro - System zu schaffen , das für die Überwachung der Myogenese durch Echtzeit- Bildgebung und Immunofluoreszenz ermöglicht. Im Vergleich zu herkömmlichen Ansätzen bietet dieses System eine sehr komplette und dynamischen Einblick in die myogenen Prozess Maus. Die Zellen können aus der Myoblasten - Stufe zu der reifen, mehrkernige myofiber Anzeige transversal Triaden und peripheren Kerne 7 folgen. Diese Reifung Ebene kannmit regulären Zellkulturausrüstung, ohne die Notwendigkeit komplexer stimulierenden oder mechanische Vorrichtungen erreicht werden. Obwohl einige erfolgreich in vitro - Systemen haben 8,9, zu unserem Wissen berichtet wurde, ist dies das einzige Protokoll reifen Maus Muskelfasern mit T-Tubuli Erzeugung quer gepaart mit Retikulum (SR). Somit ist dieser in vitro - System kann die molekularen Mechanismen der Triade Bildung zu studieren verwendet werden, die immer noch schlecht 10 verstanden werden.
Ein weiterer Vorteil dieses Systems zu verwenden, ist die Verfügbarkeit von validierten Maus-bezogene Ressourcen, wie beispielsweise Antikörper, Medikamente und RNAi-Tools. Die relativ einfaches Protokoll erfordert keine mühsamen Schritte, hoch qualifizierte Manipulation oder teure und spezielle Geräte. Gereift Muskelfasern beginnen nach 5 d der Kultur Differenzierung erscheinen 7, Kontraktilität Anzeige in Verbindung mit Calcium - Funken (nicht veröffentlichte Daten). In einer Woche, die unterschiedliche Entwicklungal Stufen eines der komplexesten Zellen in dem Säugetierkörper kann mit einer Vielzahl von in vitro - Assays in Kombination untersucht werden.
Protokoll
HINWEIS: Eine Maus Erträge ausreichend Myoblasten für etwa zwei 35-mm-Schalen oder zwei Live-Imaging-Gerichte, so Plan Mattierungen, Dissektion und Beschichtung (Schritt 2.6) entsprechend. 10 Tiere - Da Myoblasten durch sequentielle Zentrifugationen und Vorabscheidungs isoliert werden, sollte das Protokoll in Chargen von 5 erfolgen.
Alle Verfahren unter Verwendung tierischer Probanden wurden von der Tierethikkommission im Instituto de Medicina Molecular und Universität Pierre et Marie Curie genehmigt
1. Dissection von neugeborenen Mäusen Hind Gliedmaßen Muskeln
- Bereiten Sie alle Lösungen im Voraus (Werkstoff - Tabelle) und sterilisieren durch Filtration (0,22 & mgr; m - Filter). Sicherstellen , dass alle Medien , auf 37 ° C werden vor der Zugabe zu den Zellen, mit Ausnahme der Formulierungen Basalmembran - Matrix , die (beispielsweise Matrigel).
- Sterilisieren Sie die Dissektion Material (je eine aus: gebogene Schere, gerade Schere, regelmäßige Zange,und Feinspitze Zange) und die Werkbank, indem sie mit 70% Ethanol abwischen.
- Bereiten Sie eine 100 mm Petrischale mit 5 ml Dulbecco-Phosphat-gepufferte Saline (DPBS) für das Muskel Sammlung und halten Sie sie auf Eis, bis die Zerkleinerungs- Schritt.
- Enthaupten P6 - P8 Mäuse mit geraden Schere und sterilisieren Sie die Haut mit 70% Ethanol.
- Einen Einschnitt in der Rückseite der Haut und ziehen Sie sie vorsichtig auf die Hinterbeine, bis sie entfernt wird, vollständig die Hinterschenkel-Muskulatur auszusetzen.
- Verwenden Sie die Zange Fettgewebe zu entfernen, ohne die Muskeln zu beschädigen.
- Um die Rückenhinterbeinmuskeln zu entfernen, halten Sie das Bein gestreckt und biegen Sie die Pfote an der Ferse Sehnen aus. Verwenden Sie die gebogene Schere zum Trennen von Muskel von Knochen, von den Sehnen beginnen, durch sanftes Gleiten und Schneiden nach oben. Excise die Muskeln und sie in gefrorener DPBS.
- Isolieren Sie die Quadrizeps durch den Muskel mit Feinspitze Zange kneifen und schneiden um es ohne den Oberschenkelknochen oder das Kniegelenk zu beschädigen.
- Nachdem alle Tiere seziert, gehen Sie sollten in einen sterilen Laminar-Flow-Zellkultur-Haube, wenn alle folgenden Schritte durchgeführt werden.
2. Myoblasten Isolation
- Entfernen Sie den Überschuss an DPBS. Mince das Gewebe mit sterilisiertem gebogene Schere, um eine einheitliche Masse zu erhalten.
- Sammeln das zerkleinerte Gewebe in einer 50 ml konischen Zentrifugenröhrchen unter Verwendung von 5 ml Verdauungsmischung und Inkubieren sie unter Rühren bei 37 ° C für 90 min.
- Stoppen Sie die Verdauung durch Zugabe von 6 ml Dissektion Medium und Zentrifugieren Sie die Suspension für 5 min bei 75 xg das verbleibende Gewebe zu pelletieren.
- sammeln vorsichtig den Überstand. Achten Sie darauf, nicht Gewebedebris sammeln. Zentrifugieren es bei 350 xg für 5 min; Resuspendieren in 5 ml Dissektion Medium.
- Filtern Sie die Zellsuspension durch ein 40 & mgr; m Zelle Sieb. 25 ml Dissektion Medium und Vorbeschichtungszyklus sie in einem 150 - mm - Schale für 4 h in einem Zellkulturbrutschrank (37 ° C und 5% CO 2 </ Sub>) die Fibroblasten zu ermöglichen, zu haften.
- Während Vorplattieren mantel Gerichte mit 500 & mgr; l Basalmembranmatrix 1: 100 verdünnt in kaltem IMDM für 1 h bei RT. Waschen Sie einmal mit DPBS und die Zellen Platte sofort (Schritt 2.8) oder verlassen mit Wachstumsmedium bis Plattierung.
- Nach Vorplattieren, sammeln Sie den Überstand und Zentrifuge für 10 min bei 350 x g.
- Resuspendieren sie in einem Wachstumsmedium und zählen Sie die Zellen auf einem Hämozytometer. Stellen Sie die Lautstärke so, dass zwischen 150.000 und 250.000 Zellen pro Basalmembranmatrix beschichtete Schale ausgestrichen werden. Halten Sie die Zellen in einer Zellkultur-Inkubator.
3. myofiber Differenzierung
HINWEIS: Nach 3 d, sollten die Zellen zu Sicherung und Form Myotuben bei etwa 70% Konfluenz (Abbildung 1B) beginnen.
- An diesem Punkt, um die Zellen zu transfizieren, falls gewünscht, mit einer siRNA oder DNA von Interesse. Wenn die Zellen nicht transfiziert werden, ändern Sie direkt an Differenzierungsmedium und Skip zu Schritt 3.4.
- Transfizieren mit Transfektionsreagenzien den Anweisungen des Herstellers folgen. Inkubiere die Zellen für 5 h mit siRNA-Lipid-Komplexe (20 nM + 1 & mgr; l Reagenz) oder DNA-Lipid-Komplexe (1 & mgr; g + 1 & mgr; l Reagenz). Optimieren Sie die siRNA und DNA-Konzentrationen, wenn nötig.
- Waschen Sie sie einmal mit Differenzierungsmedium und wechseln Sie dann auf neue Differenzierungsmedium.
- Am folgenden Tag, verdünnen Sie die Basalmembranmatrix 1: 2 in eiskaltem Differenzierungsmedium. Entfernen Sie das vorhandene Medium und mit 200 & mgr; l eiskaltem Matrix zu jedem Gericht.
- Inkubieren für 30 min in einem Zellkulturbrutschrank.
- Ergänzen Sie die Differenzierungsmedium mit Agrin (100 ng / ml) und vorsichtig 2 ml zu den Zellen.
- ändern Sie vorsichtig die Hälfte des Mediums alle 2 d, Ergänzung stets mit Agrin bis zu einer endgültigen Konzentration von 100 ng / ul.
- Überwachen Sie die Zelldifferenzierung und Lebensfähigkeit. In Abhängigkeit von einer Vielzahl von Faktoren ab (wie FBS und chicken Embryo Extrakt Ursprung), könnte nehmen die Zellen zwischen 5-10 Differenzierung d vollständige Reifung (Abbildung 2) zu erreichen.
4. Immunostaining in Glasboden Geschirr
- Für die Immunfärbung, zu jeder Zeit-Punkt von Interesse, waschen Sie die einmal Zellen mit DPBS und fixieren Sie diese mit 4% PFA bei RT für 10 min.
- Waschen Sie sie zweimal mit DPBS. An diesem Punkt können die Zellen bei 4 ° C gelagert werden.
- Permeabilisieren sie mit 0,5% Triton X-100 für 5 min bei RT.
- Waschen Sie sie zweimal mit PBS und Block mit 30 min bei RT-blockierende Lösung.
- Inkubieren sie mit dem primären Antikörper verdünnt in Blockierungslösung O / N bei 4 ° C.
- Wasch 3x mit DPBS für 5 min bei RT.
- Inkubieren sie mit dem sekundären Antikörper, und 0,2 & mgr; g / ml DAPI für 1 h bei RT.
- Wasch 3x mit DPBS für 5 min bei RT.
- In 200 ul Eindeckmediums und fahren Sie mit Bildgebung.
Ergebnisse
Das Ausmaß der myofiber Entwicklung wird vor allem durch die Reinheit und Lebensfähigkeit der isolierten Myoblasten bestimmt. Die Adhäsion, Proliferation und Fusionskapazität kann empirisch verwendet werden , um diese Parameter zuzugreifen (Figur 1 A, B). Bei Proliferation D2 sollte Myoblasten haben eingehalten und sollte die typische fusiform Form anzuzeigen. Proliferation wird erwartet , umfassend in dieser Phase geschehen, was zu spontaner Bildung Myotube Am folgenden Tag (1B).
Zellkonfluenz konnten geringfügige Anpassungen benötigen. Es sollte erhöht werden, wenn die Myoblasten mehr als 3 d nehmen sich zu vermehren und die Sicherung. Es sollte verringert werden, wenn Muskelfasern nicht erlaubt, zu wachsen und relativ gerade aufgrund ihrer Dichte zu verlängern. Konfluenz nimmt typischerweise von der Mitte zu dem Umfang der Schale, so dass die besten Muskelfasern sollten in Richtung der äußeren Bereiche gefunden werden.
Myotuben wird schnell verlängern und die Anzeige mehrere zentral ausgerichteten Kerne (1C). Durch D5, beginnen einige Zellen Riefen und bewegen ihre Kerne an die Peripherie zu erwerben. Die Anzahl der Muskelfasern mit ausgereiften Eigenschaften werden mit der Zeit zunehmen sowie mit Zelldicke (1D).
Der Grad der Differenzierung kann durch Immunofluoreszenz beobachtet werden. Muskelfasern an Differenzierung D8 Triaden vorhanden transversal fixiert. Dies kann durch Abbilden Komponenten der T-Tubuli (DPHR) und SR (Triadin) bestätigt werden, die erwartet werden , an den Triaden (Abbildung 2) zu co - lokalisieren.
Die Funktionalität von Muskelfasern durch die Live-Darstellung angesprochen werden. Von Differenzierung D3 ab, zeigen die Zellen spontan Zucken. Durch Transfizieren eines Calciumsensor (zB., GCaMP6f 11) ist es möglich , zu beobachten , dass die Kontraktionen mit Calcium Spitzen gekoppelt (Abbildung 3).
Mit diesem System konnten wir einen neuartigen molekularen Signalweg zu identifizieren , die in zentronukleäre Myopathien und myotonic dystrophies gestört wird, die somit 7 ein neues Ziel für innovative molekulare Therapien sein kann. Wir haben auch dieses Verfahren geeignet ist, die Entwicklung der neuromuskulären Synapse (NMJ) 12 zu studieren. Durch die Kokultur mit Rattenrückenmark Explantate haben wir eine Rolle für Dynein in NMJ Bildung 13 beschrieben.

Abbildung 1: Entwicklungsstadien der Myoblastenkultur. A) Auf Proliferation D2, Myoblasten haben geklebt und begann wuchernden. B) Bei prolifration D3, eine Konfluenz von 60 bis 80% erreicht ist, und Myoblasten spontan verschmelzen beginnen. C) Bei Differenzierung D3, Myotuben zentral gelegenen Kerne enthalten , sind vorherrschend. D) von Differenzierung D5 ab (zB Tag 8), starten Muskelfasern Riefen und peripheren Kerne aufweisen und beginnen zu verdicken. Maßstabsbalken: 50 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
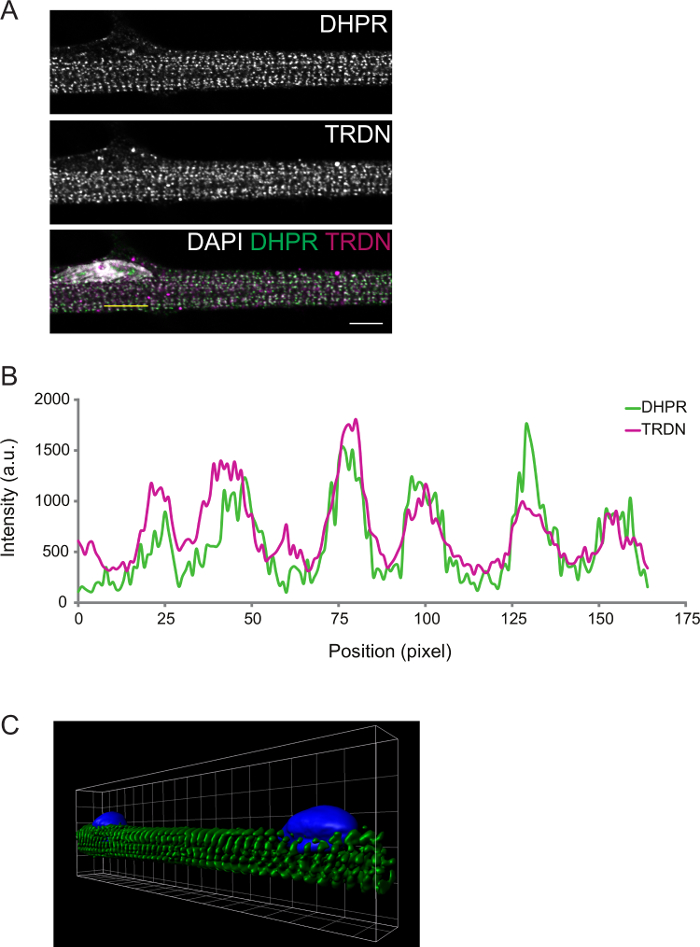
Abbildung 2: Repräsentative konfokale Bild eines D8 myofiber immunostain. A) Immunostaining für Dihydropyridin Rezeptor (DHPR, oberes Feld) und Triadin (TRDN, Mitte). Eine Überlagerung der DHPR, TRDN und DAPI Kanäle zeigt Kolokalisation der Triade-Komponenten. B) Ein Intensitätsprofil des in A. C gezogen gelbe Linie) ein 3D - Bild von Volumenrendering von Muskelfasern für α-Actinin (grün) und DAPI (blau gefärbt). Maßstabsbalken und Rasterweite: 5 um. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
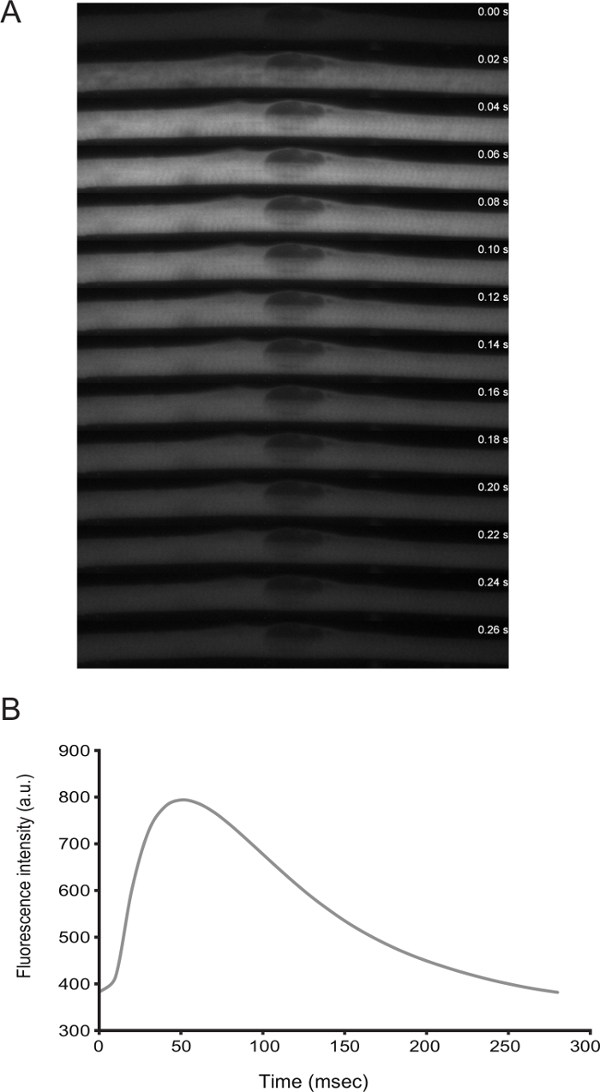
Abbildung 3: Live - Imaging von Kalziumspiegel in Muskelfasern mit Spontane Zucken. A) High-Speed - Zeitraffer (20 - ms - Rahmen) Mikroskopie eines Calcium - Funken in einem Zucken myofiber. Calcium wurde durch die Expression GCaMP6f (Addgene Plasmids # 40755) nachgewiesen. B) Quantifizierung der Fluoreszenzintensität über der Zeit für das Calciumsensor in Tafel A._blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
Diskussion
Die Verwendung dieses Protokolls für die Kultivierung von primären Myoblasten entsteht eine besondere Nische, die die Entwicklung von Muskelfasern stark fördert. Dies ist teilweise auf andere Zelltypen, die in sehr geringen Stückzahlen auch vorhanden sind. Ein Gleichgewicht zwischen Myoblasten Konzentration und Reinheit der Kultur erreicht werden muss. Eine gute Zellkultur hängt auch von der Qualität der Produkte für das Medium Formulierung verwendet. Alle Produkte aus tierischen Quellen stammen sollten gründlich geprüft werden. Nach unserer Erfahrung sollten die Aufschlussbedingungen überwacht werden.
Wie üblich für Primärkulturen können experimentelle Variabilität höher sein als in den Studien mit isolierten Fasern oder unsterblich gemacht Myoblasten. Diese Variabilität kann durch die Standardisierung von mittleren und Verdauung Komponenten, Mäuse Alter und Größe, und die Zeitpunkte für die Manipulation der Kultur und Ergebnisse Sammlung vermindert werden. Dennoch ist der Vorteil der komplizierten Mechanismen in Echtzeit prüfendennotwendig für myofiber Entwicklung übertrifft deutlich die Variabilität Nachteil.
Dieses Protokoll verleiht die Vorteile der in - vitro - Ansätze ohne Zelldifferenzierung zu beeinträchtigen. Reifen Muskelfasern bis Triaden gebildet werden und Kontraktionen Calcium Funken gekoppelt sind. Diese funktionellen Ausgänge können in verschiedenen experimentellen Bedingungen erreicht werden. Darüber hinaus kann es viele technische Variationen des Protokolls. Myoblasten können von neugeborenen Mäusen mit Mutationen von Interesse im Bereich der Muskelentwicklung geerntet werden. Die Zellen können für die biochemische Analyse an verschiedenen Differenzierungszeitpunkten aufgelöst werden. Calcium-Indikatoren können zu der Kultur hinzugefügt werden, um die Dynamik zu folgen. Optogenetische Konstrukte können verwendet werden, um bestimmte Signalwege zu erzwingen oder spezifische lokale Antworten zu induzieren. Schließlich können die Muskelfasern mit anderen Zellen kokultiviert werden Typen ihre Interaktionen zu studieren.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
This work was supported by the European Research Council (ERG) and EMBO installation (ERG) and by a PhD fellowship from the Fundação para a Ciência e Tecnologia (MP).
Materialien
| Name | Company | Catalog Number | Comments |
| Dispase II | Gibco | 17105041 | |
| Collagenase type V | Sigma-Aldrich-Aldrich | C9263 | |
| IMDM, Glutamax supplemented | Gibco | 31980022 | |
| Matrigel Growth reduced factor | Corning | 354230 | protein concentration of the lot should be around 10 mg/mL and endotoxin result should be <1.5 |
| Chicken Embryo Extract | MP biomedical | 2850145 | it is also possible to prepare in the lab (Danoviz ME, Yablonka-Reuveni Z. Methods Mol Biol (2012)) |
| Recombinant rat agrin | R&D systems | 550-AG-100 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Horse Serum | GE Healthcare | 11581831 | |
| Lipofectamine RNAiMAX | Invitrogen | 13778-150 | used to transfect siRNA |
| Lipofectamine LTX | Invitrogen | 15338-100 | used to transfect DNA |
| Lipofectamine 2000 | Invitrogen | 11668030 | used to transfect siRNA plus DNA |
| DPBS | Gibco | 14190094 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF0001 | |
| Cell strainer | Corning | 21008-949 | |
| Fluorodishes | World precision instruments | FD35-100 | dishes used to cultivate cells for live imaging |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| 16% PFA (Paraformaldehyde) | Science Services GmbH | E15710 | |
| Goat Serum | Sigma-Aldrich | G9023 | |
| BSA (Bovine Serum Albumine) | Sigma-Aldrich | A7906 | |
| Saponine | Sigma-Aldrich | 47036 | |
| DAPI | Sigma-Aldrich | D9542 | use at 200 ng/µL |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| Name | Company | Catalog Number | Comments |
| Solutions and Media | |||
| Digestion Mix | in DPBS 5 mg/mL collagenase 3.5 mg/mL dispase sterile filtered, can be stored in working aliquotes for 2 weeks at -20 °C | ||
| Dissection Medium | in IMDM Glutamax supplemented 10% FBS 1% Penicillin/Streptomycin sterile filtered | ||
| Growth Medium | in IMDM Glutamax supplemented 20% FBS 1% Chicken Embryo Extract 1% Penicillin-Streptomycin sterile filtered | ||
| Differentiation Medium | in IMDM Glutamax supplemented 2% Horse Serum 1% Penicillin-Streptomycin sterile filtered | ||
| Blocking Solution | in DPBS 10% Goat Serum 5% BSA add 0.1% saponine when incubating with primary and secondary antibodies |
Referenzen
- Janssen, I., Heymsfield, S. B., Wang, Z., Ross, R. Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol. 89 (1), 81-88 (2000).
- Manring, H., Abreu, E., Brotto, L., Weisleder, N., Brotto, M. Novel excitation-contraction coupling related genes reveal aspects of muscle weakness beyond atrophy-new hopes for treatment of musculoskeletal diseases. Front Physiol. 5, 37 (2014).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270 (5639), 725-727 (1977).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. J Vis Exp. (73), (2013).
- Meng, H., Janssen, P. M. L., et al. Tissue Triage and Freezing for Models of Skeletal Muscle Disease. J Vis Exp. (89), (2014).
- Demonbreun, A. R., McNally, E. M. DNA Electroporation, Isolation and Imaging of Myofibers. J Vis Exp. (106), (2015).
- Falcone, S., Roman, W., et al. N-WASP is required for Amphiphysin-2/BIN1-dependent nuclear positioning and triad organization in skeletal muscle and is involved in the pathophysiology of centronuclear myopathy. EMBO Mol Med. 6 (11), 1455-1475 (2014).
- Flucher, B. E., Phillips, J. L., Powell, J. A. Dihydropyridine receptor alpha subunits in normal and dysgenic muscle in vitro: expression of alpha 1 is required for proper targeting and distribution of alpha 2. J Cell Biol. 115 (5), 1345-1356 (1991).
- Cooper, S. T., Maxwell, A. L., et al. C2C12 co-culture on a fibroblast substratum enables sustained survival of contractile, highly differentiated myotubes with peripheral nuclei and adult fast myosin expression. Cell Motil Cytoskeleton. 58 (3), 200-211 (2004).
- Al-Qusairi, L., Laporte, J. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skelet Muscle. 1, 26 (2011).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system to study mechanisms of neuromuscular junction development and maintenance. Development. , (2016).
- Vilmont, V., Cadot, B., Vezin, E., Le Grand, F., Gomes, E. R. Dynein disruption perturbs post-synaptic components and contributes to impaired MuSK clustering at the NMJ: implication in ALS. Sci Rep. 6, 27804 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten