Method Article
Diferenciación in vitro de las fibras maduras de imágenes en vivo
En este artículo
Resumen
Muscle cells are among the most complex eukaryotic cells. We present a protocol for the in vitro differentiation of highly mature myofibers that allows for genetic manipulation and clear imaging during all developmental stages.
Resumen
Los músculos esqueléticos están formados por fibras musculares, las grandes células en el cuerpo de los mamíferos y uno de los pocos sincitios. ¿Cómo las estructuras complejas y conservadas evolutivamente que lo componen se ensamblan sigue bajo investigación. Sus características de tamaño y fisiológicos a menudo limitan las aplicaciones de manipulación y de imagen. El cultivo de líneas celulares inmortalizadas es ampliamente utilizado, pero sólo puede reproducir los primeros pasos de la diferenciación.
A continuación, se describe un protocolo que permite la fácil manipulación genética de las fibras musculares procedentes de mioblastos primarios de ratón. Después de una semana de la diferenciación, las miofibras muestran la contractilidad, alineado sarcómeros y tríadas, así como núcleos periféricos. Todo el proceso de diferenciación puede ser seguido por formación de imágenes en vivo o inmunofluorescencia. Este sistema combina las ventajas de la existente ex vivo y en los protocolos in vitro. La posibilidad de transfección fácil y eficiente así comola facilidad de acceso a todas las etapas de diferenciación amplía las aplicaciones potenciales. Miofibras posteriormente se puede utilizar no sólo para abordar cuestiones de biología del desarrollo y celular pertinentes, sino también para reproducir fenotipos de la enfermedad muscular para aplicaciones clínicas.
Introducción
El músculo esquelético se compone de hasta 40% del peso del cuerpo humano 1. Trastornos músculo-asociado representan una inmensa carga sanitaria y económica 2. ¿Cómo se forma este tejido altamente complejo y organizado, mantenido y regenerado constituye un campo de investigación extensa y bien establecida. Dependiendo del interés científico concreto, el enfoque más adecuado puede variar a partir de cultivos de miotubos simples hasta las más complejas en modelos in vivo 3 - 6.
El objetivo de este protocolo es proporcionar un sistema in vitro que permite el seguimiento de la miogénesis a través de imágenes en vivo e inmunofluorescencia. En comparación con los métodos tradicionales, este sistema ofrece una visión muy completa y dinámica en el proceso de miogénica ratón. Las células pueden ser seguidas desde la etapa de mioblastos a la miofibras maduras, multinucleadas se presentan tríadas transversales y núcleos periféricos 7. Este nivel de maduración puedeconseguirse utilizando equipo de cultivo celular regular, sin necesidad de aparatos estimuladores o mecánicos complejos. Aunque algunos exitosos en sistemas in vitro se han reportado 8,9, a nuestro conocimiento, este es el único protocolo de generación de las fibras maduras de ratón con los túbulos T transversalmente emparejado con retículo sarcoplásmico (SR). Por lo tanto, este sistema in vitro se puede utilizar para estudiar los mecanismos moleculares de la formación de tríada, que son aún poco conocidos 10.
Una ventaja adicional del uso de este sistema es la disponibilidad de los recursos de ratón orientada validadas, tales como anticuerpos, fármacos, y herramientas de ARNi. El protocolo relativamente simple no requiere pasos laboriosos, manipulación altamente calificado, o un equipo costoso y dedicado. Miofibras maduras comienzan a aparecer después de 5 días de la diferenciación de la cultura 7, mostrando la contractilidad junto con chispas de calcio (datos no publicados). En una semana, el diferente desarrolloetapas Al de una de las células más complejas en el cuerpo de un mamífero pueden estudiarse en combinación con una variedad de ensayos in vitro.
Protocolo
NOTA: uno se rinde ratón mioblastos suficientes para aproximadamente dos placas de 35 mm o dos platos de generación de imágenes en vivo, por lo mattings plan, la disección, y recubrimiento (paso 2.6) en consecuencia. Desde mioblastos se aíslan mediante centrifugaciones secuenciales y preplating, el protocolo debe hacerse en lotes de 5 - 10 animales.
Todos los procedimientos que involucran sujetos animales fueron aprobados por el Comité de Ética Animal de la Instituto de Medicina Molecular y la Universidad Pierre et Marie Curie
1. La disección de los ratones recién nacidos Los músculos de las extremidades posteriores
- Preparar todas las soluciones de antemano (Tabla de Materiales) y esterilizar por filtración (0,22 micras filtro). Asegúrese de que todos los medios de comunicación son a 37 ° C antes de la adición a las células, con excepción de las formulaciones que contienen la matriz de la membrana basal (por ejemplo, Matrigel).
- Esterilizar el material de disección (uno por cada uno de: tijeras curvas rectas, tijeras, pinzas regulares,y unas pinzas de punta fina) y el banco de trabajo, limpiándolos con un 70% de etanol.
- Preparar un plato de 100 mm de Petri con 5 ml de Dulbecco tamponada con fosfato salino (DPBS) para la recogida de los músculos y mantener en hielo hasta que el paso de picar carne.
- Decapitar a P6 - P8 ratones con tijeras rectas y esterilizar la piel con etanol al 70%.
- Hacer una incisión en la piel de la espalda y tire de ella suavemente hacia las extremidades posteriores hasta que se retira, dejando al descubierto por completo la musculatura de las extremidades posteriores.
- Utilice las pinzas para quitar el tejido graso sin dañar los músculos.
- Para eliminar los músculos de las extremidades posteriores dorsales, mantener la extremidad estirado y doblar la pata para exponer los tendones del talón. Usar las tijeras curvadas para músculo separado del hueso, a partir de los tendones, deslizando y de corte hacia arriba con suavidad. Extirpar los músculos y colocarlos en DPBS helado.
- Aislar el cuádriceps pellizcando el músculo con unas pinzas de punta fina y cortar alrededor de ella sin dañar el fémur o la articulación de la rodilla.
- Después de la disección de todos los animales, proceder a una campana de cultivo de células de flujo laminar estéril, donde se deben realizar todos los pasos siguientes.
2. Aislamiento de mioblastos
- Retire el exceso de DPBS. Picar el tejido con tijeras curvas esterilizados a fin de obtener una masa uniforme.
- Recoger el tejido picado en un tubo de centrífuga de 50 ml cónico utilizando 5 ml de la mezcla de digestión y se incuba con agitación a 37 ° C durante 90 min.
- Detener la digestión mediante la adición de 6 ml de medio de disección y se centrifuga la suspensión durante 5 min a 75 xg para sedimentar el tejido restante.
- Recoger cuidadosamente el sobrenadante. Asegúrese de no recoger los desechos de los tejidos. Centrifugar al 350 xg durante 5 min; volver a suspender en 5 ml de medio de disección.
- Se filtra la suspensión celular a través de un filtro de células de 40 micras. Añadir 25 ml de medio de disección y la presiembra en un plato 150 mm durante 4 h en un incubador de cultivo de células (37 ° C y 5% de CO 2 </ Sub>) para permitir que los fibroblastos se adhieren.
- Mientras preplating, platos capa con 500 l de matriz de membrana basal diluyeron 1: 100 en IMDM frío durante 1 h a TA. Lavar una vez con DPBS y la placa de las células inmediatamente (paso 2.8) o salir con medio de crecimiento hasta el chapado.
- Después de preplating, recoger el sobrenadante y centrifugar al 350 xg durante 10 min.
- Volver a suspender en medio de crecimiento y contar las células en un hemocitómetro. Ajustar el volumen para que entre 150.000 y 250.000 células se colocan por membrana basal plato de matriz-revestido. Mantener las células en una incubadora de cultivo celular.
3. Diferenciación miofibrilar
NOTA: Después de 3 d, las células deben comenzar a fundirse y formar miotubos en torno al 70% de confluencia (Figura 1B).
- En este punto, transfectar las células, si se desea, con un siRNA o ADN de interés. Si no se pueden transfectar a las células, cambiar directamente al medio de diferenciación y de esquíp al paso 3.4.
- Transfectar con reactivos de transfección siguientes instrucciones del fabricante. Se incuban las células durante 5 h con complejos siRNA-lípido (20 nM + 1 l de reactivo) o complejos de ADN-lípido (1 g + 1 l de reactivo). Optimizar las concentraciones de siRNA y de ADN, si es necesario.
- Lavarlos una vez con medio de diferenciación y luego cambiar a un nuevo medio de diferenciación.
- El día siguiente, se diluye la matriz de la membrana basal 1: 2 en medio de diferenciación enfriado con hielo. Retire el medio existente y añadir 200 l de matriz helada para cada plato.
- Incubar durante 30 min en un incubador de cultivo celular.
- Suplemento el medio de diferenciación con la agrina (100 ng / ml) y añadir con cuidado 2 ml a las células.
- cambiar cuidadosamente la mitad del medio cada 2 d, siempre que complementa con la agrina a una concentración final de 100 ng / l.
- Monitor de la diferenciación celular y la viabilidad. Dependiendo de una variedad de factores (tales como FBS y chicken orígenes extracto de embrión), las células podría tomar entre de 5 - 10 d diferenciación para llegar a la maduración completa (Figura 2).
4. La inmunotinción en platos con fondo de cristal
- Para la inmunotinción, en cualquier momento, lugar de interés, se lavan las células una vez con DPBS y fijarlas con PFA al 4% a temperatura ambiente durante 10 min.
- Lavar dos veces con DPBS. En este punto, las células se pueden almacenar a 4 ° C.
- Permeabilizar con 0,5% Triton X-100 durante 5 min a RT.
- Lavar dos veces con PBS y bloquear con solución de bloqueo durante 30 min a RT.
- Incubar con el anticuerpo primario diluido en solución de bloqueo O / N a 4 ° C.
- Lavar 3 veces con DPBS durante 5 min a RT.
- Incubar con el anticuerpo secundario y 0,2 g / ml de DAPI durante 1 h a TA.
- Lavar 3 veces con DPBS durante 5 min a RT.
- Añadir 200 l de medio de montaje y proceder a la formación de imágenes.
Resultados
El grado de desarrollo de las miofibrillas se determina principalmente por la pureza y la viabilidad de los mioblastos aislados. La adhesión, la proliferación y la capacidad de fusión se pueden usar para acceder empíricamente los parámetros (Figura 1 A, B). En proliferación D2, mioblastos deberían haber adherido y deben mostrar la típica forma fusiforme. Se espera proliferación a pasar ampliamente en esta etapa, lo que lleva a la formación espontánea myotube el día siguiente (Figura 1B).
confluencia celular podría necesitar pequeños ajustes. Debe aumentarse si mioblastos toman más de 3 d a proliferar y el fusible. Se debe disminuirse si miofibras no se les permite crecer y alargar relativamente sencillo debido a su densidad. Confluencia disminuye típicamente desde el centro a la periferia del plato, por lo que los mejores miofibras deben encontrarse hacia las regiones exteriores.
Miotubos tendrán una elongación rápida y múltiples núcleos alineados centralmente pantalla (Figura 1C). Por D5, algunas células comienzan a adquirir estrías y moviendo sus núcleos a la periferia. El número de miofibras maduras con características aumentará con el tiempo, así como con el espesor celular (Figura 1D).
El grado de diferenciación se puede observar además por inmunofluorescencia. Miofibras fijos en la diferenciación D8 tríadas presente transversales. Esto puede ser confirmado por componentes de imagen de los túbulos T (RPCP-PD) y el SR (triadin), que se espera que colocalize en las tríadas (Figura 2).
La funcionalidad de miofibras se puede abordar mediante formación de imágenes en vivo. De diferenciación D3 en adelante, las células muestran contracciones espontáneas. Por la transfección de un sensor de calcio (por ejemplo,., GCaMP6f 11), es posible observar que las contracciones se acoplan con picos de calcio (Figura 3).
Usando este sistema, hemos sido capaces de identificar una nueva vía molecular que se interrumpe en las miopatías y distrofias Centronuclear miotónica, por lo tanto, que puede ser un objetivo novedoso para terapias moleculares innovadoras 7. También hemos adaptado este método para estudiar el desarrollo de la unión neuromuscular (UNM) 12. A través de la co-cultivo con la rata explantes de médula espinal, hemos descrito un papel de dineína en la formación NMJ 13.

Figura 1: Etapas del desarrollo de la cultura de mioblastos. A) En proliferación D2, mioblastos se han adherido y comenzó la proliferación. B) En proliferación D3, una confluencia del 60-80% se alcanza, y mioblastos se inicia la fusión de forma espontánea. C) En D3 diferenciación, miotubos que contienen núcleos céntricos son predominantes. D) A partir de la diferenciación D5 en adelante (por ejemplo, el día 8), las miofibrillas se inicia exhibiendo estrías y núcleos periféricos y comience a espesar. Barra de escala: 50 micras. Haga clic aquí para ver una versión más grande de esta figura.
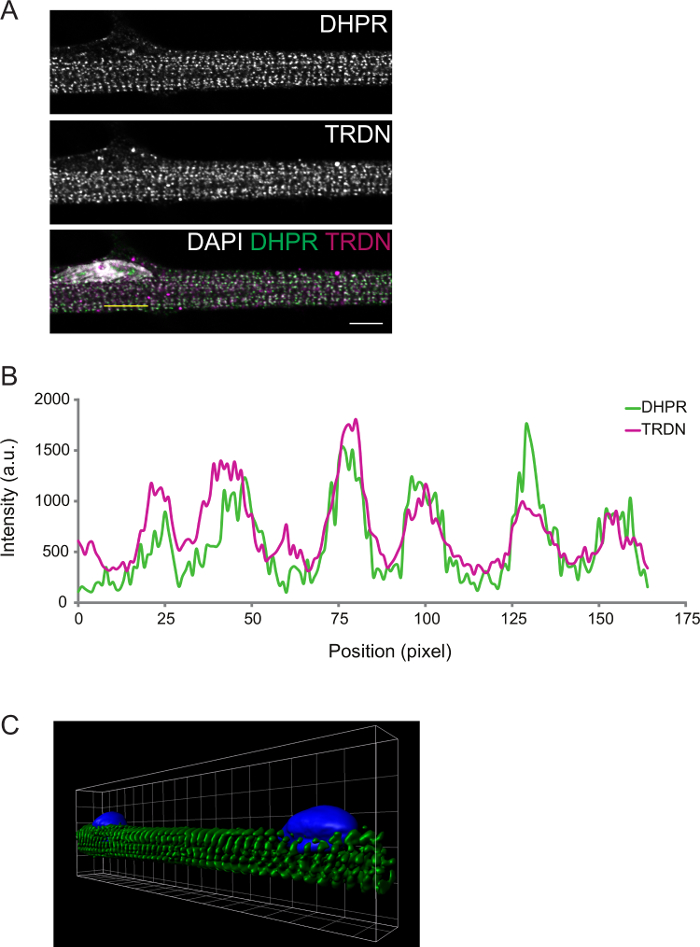
Figura 2: Representante confocal Imagen de un D8 miofibrilar Inmunotinción. A) La inmunotinción para el receptor de dihidropiridina (DHPR, panel superior) y triadin (TRDN, panel central). Una superposición de los canales DHPR, TRDN, y DAPI muestra la colocalización de los componentes de la tríada. B) Un perfil de intensidad de la línea amarilla dibujada en A. C) Una imagen en 3D de representación de volumen de fibras musculares teñidas para la α-actinina (verde) y DAPI (azul). Barra de nivel y ancho de rejilla: 5 micras. Haga clic aquí para ver una versión más grande de esta figura.
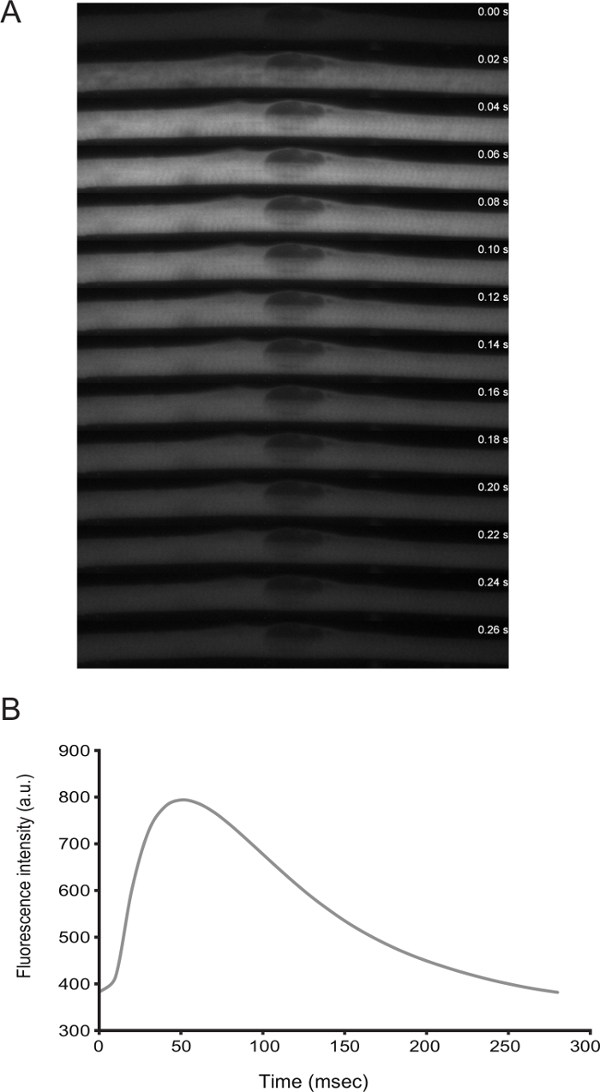
Figura 3: imágenes en vivo de niveles de calcio dentro de las miofibrillas con Contracciones espontánea. A) de alta velocidad de lapso de tiempo (tramas de 20 ms) microscopia de un destello de calcio en un miofibrilar espasmos. El calcio se detectó mediante la expresión de GCaMP6f (Addgene plásmido # 40755). B) Cuantificación de la intensidad de fluorescencia con el tiempo para el sensor de calcio en el panel A._blank "> Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El uso de este protocolo para el cultivo de mioblastos primarios da lugar a un nicho especial que nutre en gran medida el desarrollo de las miofibrillas. Esto se debe en parte a otros tipos de células que también están presentes en números muy pequeños. Debe lograrse un equilibrio entre la concentración de mioblastos y la pureza del cultivo. Un buen cultivo celular también depende de la calidad de los productos utilizados para la formulación del medio. Todos los productos derivados de fuentes animales deben ser probados a fondo. En nuestra experiencia, las condiciones de digestión también debe ser monitoreada.
Como es habitual en cultivos primarios, la variabilidad experimental puede ser mayor que en los estudios con fibras aisladas o mioblastos inmortalizados. Esta variabilidad puede ser disminuida por la estandarización de los componentes del medio y la digestión, la edad y el tamaño de los ratones, y los puntos de tiempo para la manipulación de cultivo y la recogida de resultados. Sin embargo, la ventaja de examinar en tiempo real los mecanismos intrincadosnecesaria para el desarrollo de miofibras supera en gran medida el inconveniente variabilidad.
Este protocolo confiere las ventajas de los enfoques in vitro sin comprometer la diferenciación celular. Las fibras maduras hasta que se forman tríadas y las contracciones se acoplan a las chispas de calcio. Estas salidas funcionales se puede acceder en diferentes condiciones experimentales. Además, puede haber muchas variaciones técnicas efectuadas en el protocolo. Los mioblastos se pueden cosechar a partir de ratones recién nacidos con mutaciones de interés relacionados con el desarrollo muscular. Las células pueden ser lisadas para el análisis bioquímico en diferentes puntos temporales diferenciación. indicadores de calcio se pueden añadir al cultivo para seguir su dinámica. construcciones Optogenética pueden ser utilizados para hacer cumplir ciertas vías de señalización o para inducir respuestas locales específicas. Por último, las miofibras se pueden cocultivaron con otros tipos de células para estudiar sus interacciones.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
This work was supported by the European Research Council (ERG) and EMBO installation (ERG) and by a PhD fellowship from the Fundação para a Ciência e Tecnologia (MP).
Materiales
| Name | Company | Catalog Number | Comments |
| Dispase II | Gibco | 17105041 | |
| Collagenase type V | Sigma-Aldrich-Aldrich | C9263 | |
| IMDM, Glutamax supplemented | Gibco | 31980022 | |
| Matrigel Growth reduced factor | Corning | 354230 | protein concentration of the lot should be around 10 mg/mL and endotoxin result should be <1.5 |
| Chicken Embryo Extract | MP biomedical | 2850145 | it is also possible to prepare in the lab (Danoviz ME, Yablonka-Reuveni Z. Methods Mol Biol (2012)) |
| Recombinant rat agrin | R&D systems | 550-AG-100 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Horse Serum | GE Healthcare | 11581831 | |
| Lipofectamine RNAiMAX | Invitrogen | 13778-150 | used to transfect siRNA |
| Lipofectamine LTX | Invitrogen | 15338-100 | used to transfect DNA |
| Lipofectamine 2000 | Invitrogen | 11668030 | used to transfect siRNA plus DNA |
| DPBS | Gibco | 14190094 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF0001 | |
| Cell strainer | Corning | 21008-949 | |
| Fluorodishes | World precision instruments | FD35-100 | dishes used to cultivate cells for live imaging |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| 16% PFA (Paraformaldehyde) | Science Services GmbH | E15710 | |
| Goat Serum | Sigma-Aldrich | G9023 | |
| BSA (Bovine Serum Albumine) | Sigma-Aldrich | A7906 | |
| Saponine | Sigma-Aldrich | 47036 | |
| DAPI | Sigma-Aldrich | D9542 | use at 200 ng/µL |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| Name | Company | Catalog Number | Comments |
| Solutions and Media | |||
| Digestion Mix | in DPBS 5 mg/mL collagenase 3.5 mg/mL dispase sterile filtered, can be stored in working aliquotes for 2 weeks at -20 °C | ||
| Dissection Medium | in IMDM Glutamax supplemented 10% FBS 1% Penicillin/Streptomycin sterile filtered | ||
| Growth Medium | in IMDM Glutamax supplemented 20% FBS 1% Chicken Embryo Extract 1% Penicillin-Streptomycin sterile filtered | ||
| Differentiation Medium | in IMDM Glutamax supplemented 2% Horse Serum 1% Penicillin-Streptomycin sterile filtered | ||
| Blocking Solution | in DPBS 10% Goat Serum 5% BSA add 0.1% saponine when incubating with primary and secondary antibodies |
Referencias
- Janssen, I., Heymsfield, S. B., Wang, Z., Ross, R. Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol. 89 (1), 81-88 (2000).
- Manring, H., Abreu, E., Brotto, L., Weisleder, N., Brotto, M. Novel excitation-contraction coupling related genes reveal aspects of muscle weakness beyond atrophy-new hopes for treatment of musculoskeletal diseases. Front Physiol. 5, 37 (2014).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270 (5639), 725-727 (1977).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. J Vis Exp. (73), (2013).
- Meng, H., Janssen, P. M. L., et al. Tissue Triage and Freezing for Models of Skeletal Muscle Disease. J Vis Exp. (89), (2014).
- Demonbreun, A. R., McNally, E. M. DNA Electroporation, Isolation and Imaging of Myofibers. J Vis Exp. (106), (2015).
- Falcone, S., Roman, W., et al. N-WASP is required for Amphiphysin-2/BIN1-dependent nuclear positioning and triad organization in skeletal muscle and is involved in the pathophysiology of centronuclear myopathy. EMBO Mol Med. 6 (11), 1455-1475 (2014).
- Flucher, B. E., Phillips, J. L., Powell, J. A. Dihydropyridine receptor alpha subunits in normal and dysgenic muscle in vitro: expression of alpha 1 is required for proper targeting and distribution of alpha 2. J Cell Biol. 115 (5), 1345-1356 (1991).
- Cooper, S. T., Maxwell, A. L., et al. C2C12 co-culture on a fibroblast substratum enables sustained survival of contractile, highly differentiated myotubes with peripheral nuclei and adult fast myosin expression. Cell Motil Cytoskeleton. 58 (3), 200-211 (2004).
- Al-Qusairi, L., Laporte, J. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skelet Muscle. 1, 26 (2011).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system to study mechanisms of neuromuscular junction development and maintenance. Development. , (2016).
- Vilmont, V., Cadot, B., Vezin, E., Le Grand, F., Gomes, E. R. Dynein disruption perturbs post-synaptic components and contributes to impaired MuSK clustering at the NMJ: implication in ALS. Sci Rep. 6, 27804 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados