Method Article
La differenziazione in vitro di miofibre mature per Live Imaging
In questo articolo
Riepilogo
Muscle cells are among the most complex eukaryotic cells. We present a protocol for the in vitro differentiation of highly mature myofibers that allows for genetic manipulation and clear imaging during all developmental stages.
Abstract
I muscoli scheletrici sono composte da fibre muscolari, i più grandi cellule nel corpo dei mammiferi e uno dei pochi sincizi. Come le strutture complesse e evolutivamente conservati che lo compongono sono assemblati resta sotto osservazione. Le loro dimensioni e caratteristiche fisiologiche spesso limitano le applicazioni di manipolazione e di imaging. La cultura di linee cellulari immortalizzate è ampiamente utilizzato, ma può replicare solo le prime fasi di differenziazione.
Qui, descriviamo un protocollo che consente una facile manipolazione genetica delle fibre muscolari provenienti da mioblasti di topo primari. Dopo una settimana di differenziazione, le miofibre mostrano contrattilità, allineati sarcomeri e triadi, così come nuclei periferici. L'intero processo di differenziazione può essere seguita da imaging dal vivo o immunofluorescenza. Questo sistema combina i vantaggi della esistente ex vivo e in vitro protocolli. La possibilità di facile ed efficiente trasfezione nonchéla facilità di accesso a tutti gli stadi di differenziazione amplia le potenziali applicazioni. Miofibre può successivamente essere utilizzato non solo per affrontare importanti questioni di biologia dello sviluppo e delle cellule, ma anche di riprodurre fenotipi malattia muscolare per le applicazioni cliniche.
Introduzione
Il muscolo scheletrico compone fino al 40% del peso del corpo umano 1. Disturbi muscolari associate rappresentano un immenso salute e l'onere economico 2. Come questo tessuto altamente complessa e organizzata si forma, la manutenzione e rigenerato costituisce un campo di ricerca estesa e consolidata. A seconda del particolare interesse scientifico, l'approccio più adatto può variare da semplici culture myotube a complessi modelli in vivo 3 - 6.
L'obiettivo di questo protocollo è quello di fornire un sistema in vitro che consente il monitoraggio della miogenesi mediante imaging vivo e immunofluorescenza. Rispetto ai metodi tradizionali, questo sistema offre una visione molto completa e dinamica nel processo miogenico mouse. Le cellule possono essere seguiti dalla fase mioblasti al maturo, myofiber multinucleate visualizzazione triadi trasversali e dei nuclei periferici 7. Questo livello di maturazione puòrealizzabile con attrezzature regolare coltura cellulare, senza bisogno di apparati stimolatorie o meccanici complessi. Anche se alcuni di successo nei sistemi in vitro sono stati segnalati 8,9, a nostra conoscenza, questo è l'unico protocollo che genera miofibre mature del mouse con T-tubuli trasversalmente in coppia con reticolo sarcoplasmatico (SR). Così, questo sistema in vitro può essere utilizzato per studiare i meccanismi molecolari di formazione triade, che sono ancora poco conosciuti 10.
Un ulteriore vantaggio di questo sistema è la disponibilità di risorse topo targeting convalidati, come gli anticorpi, farmaci e strumenti RNAi. Il protocollo relativamente semplice non richiede operazioni laboriose, manipolazione altamente qualificato, o attrezzature costose e dedicato. Miofibre maturate iniziano ad apparire dopo 5 d della cultura differenziazione 7, la visualizzazione di contrattilità accoppiato con scintille di calcio (dati non pubblicati). In una settimana, il diverso sviluppoAl fasi di una delle celle più complesse nel corpo dei mammiferi possono essere studiati in combinazione con una varietà di saggi in vitro.
Protocollo
NOTA: Un rendimenti del mouse mioblasti sufficiente per circa due piatti 35 mm o due piatti live-imaging, così stuoie piano, dissezione, e rivestimento (passo 2,6) di conseguenza. Dal momento che i mioblasti vengono isolati tramite centrifugazioni sequenziali e preplating, il protocollo dovrebbe essere fatto in lotti di 5 - 10 animali.
Tutte le procedure che coinvolgono soggetti animali sono stati approvati dal comitato etico degli animali a Instituto de Medicina Molecolare e Università Pierre et Marie Curie
1. La dissezione dei neonatale Mice muscoli posteriori degli arti
- Preparare tutte le soluzioni in anticipo (Materials Table) e sterilizzare per filtrazione (0,22 micron filtro). Assicurarsi che tutti i mezzi sono a 37 ° C prima dell'aggiunta alle celle, tranne le formulazioni contenenti matrice membrana basale (ad esempio, Matrigel).
- Sterilizzare il materiale dissezione (uno ciascuno di: forbici curve, forbici, pinze diritte regolari,e pinze fine-tip) e il banco di lavoro pulendo con il 70% di etanolo.
- Preparare da 100 mm capsula di Petri con 5 ml di Dulbecco tampone fosfato (DPBS) per la raccolta dei muscoli e tenerlo in ghiaccio fino al passo macinazione.
- Decapitare P6 - P8 topi con le forbici diritte e sterilizzare la pelle con il 70% di etanolo.
- Fare un'incisione nella pelle indietro e tirare delicatamente verso gli arti posteriori fino a quando non viene rimosso, esponendo completamente la muscolatura degli arti posteriori.
- Utilizzare le pinze per rimuovere il tessuto grasso senza danneggiare i muscoli.
- Per rimuovere le dorsali muscoli posteriori degli arti, tenere l'arto allungato e piegare la zampa per esporre i tendini del tallone. Utilizzare le forbici curve al muscolo separata dall'osso, partendo dai tendini, facendo scorrere verso l'alto e tagliando delicatamente. Accise L'muscoli e metterli in DPBS ghiacciate.
- Isolare il quadricipite pizzicando il muscolo con una pinza fine-tip e il taglio intorno ad esso senza danneggiare il femore o del ginocchio.
- Dopo la dissezione tutti gli animali, procedere ad una cappa di coltura cellulare a flusso laminare sterile, dove devono essere eseguiti i seguenti passaggi.
Isolamento 2. Myoblast
- Rimuovere l'eccesso di DPBS. Macinare il tessuto con forbici curve sterilizzati in modo da ottenere una massa uniforme.
- Raccogliere il tessuto macinate in una provetta da centrifuga da 50 ml conica con 5 ml di miscela di digestione e incubare con agitazione a 37 ° C per 90 min.
- Arrestare la digestione aggiungendo 6 mL di media dissezione e centrifugare la sospensione per 5 min a 75 xg per sedimentare il tessuto rimanente.
- Raccogliere accuratamente il surnatante. Assicurarsi di non raccogliere i detriti dei tessuti. Centrifugare a 350 xg per 5 min; risospendere in 5 mL di media dissezione.
- Filtrare la sospensione cellulare attraverso un filtro cella 40 micron. Aggiungere 25 ml di mezzo dissezione e preplate in un piatto di 150 mm per 4 h in un incubatore di coltura cellulare (37 ° C e 5% CO 2 </ Sub>) per consentire ai fibroblasti di aderire.
- Mentre preplating, piatti cappotto con 500 ml di matrice membrana basale diluito 1: 100 in IMDM fredda per 1 ora a RT. Lavare una volta con DPBS e piastra immediatamente le cellule (passo 2.8) o lasciare con terreno di coltura fino placcatura.
- Dopo preplating, raccogliere il surnatante e centrifugare a 350 xg per 10 min.
- Risospendere in mezzo di crescita e contare le cellule su un emocitometro. Regolare il volume in modo che tra 150.000 e 250.000 cellule sono placcati per membrana basale piatto matrice rivestite. Mantenere le cellule in un incubatore di coltura cellulare.
3. Differenziazione myofiber
NOTA: Dopo 3 d, le cellule devono iniziare a fondere e formare miotubi intorno al 70% di confluenza (Figura 1B).
- A questo punto, trasfezione delle cellule, se desiderato, con un siRNA o DNA di interesse. Se le cellule non devono essere transfettate, modificare direttamente al terreno di differenziamento e scip al passo 3.4.
- Trasfezione con i reagenti di trasfezione seguito le istruzioni del produttore. Incubare le cellule per 5 h con complessi siRNA-lipidi (20 Nm + 1 ml di reattivo) o complessi DNA-lipidi (1 mg + 1 ml di reagente). Ottimizzare le concentrazioni di siRNA e di DNA, se necessario.
- Lavare una volta con mezzo di differenziazione e quindi passare al nuovo mezzo di differenziazione.
- Il giorno seguente, diluire la matrice membrana basale 1: 2 in terreno di differenziamento ghiacciata. Rimuovere il supporto esistente e aggiungere 200 ml di matrice ghiacciata per ogni piatto.
- Incubare per 30 minuti in un incubatore di coltura cellulare.
- Supplemento del mezzo di differenziazione con agrina (100 ng / mL) e aggiungere con cautela 2 ml per le cellule.
- Cambiare con cura la metà del mezzo ogni 2 d, sempre che completa con agrina ad una concentrazione finale di 100 ng / ml.
- Monitorare la differenziazione cellulare e la vitalità. A seconda di una varietà di fattori (come FBS ecHicken embrione origini estratto), le cellule potrebbe richiedere tra i 5 - 10 differenziazione d per raggiungere la piena maturazione (Figura 2).
4. Immunocolorazione in piatti con fondo di vetro
- Per immunostaining, in qualsiasi momento, di interesse, lavare le cellule una volta con DPBS e fissarle con 4% PFA a temperatura ambiente per 10 min.
- Lavare due volte con DPBS. A questo punto, le cellule possono essere conservati a 4 ° C.
- li permeabilize con 0,5% Triton X-100 per 5 minuti a temperatura ambiente.
- Lavare due volte con PBS e bloccare con soluzione bloccante per 30 minuti a RT.
- incubare con l'anticorpo primario diluito in soluzione bloccante O / N a 4 ° C.
- Lavare 3x con DPBS per 5 minuti a temperatura ambiente.
- li Incubare con l'anticorpo secondario e 0,2 mg / ml di DAPI per 1 ora a RT.
- Lavare 3x con DPBS per 5 minuti a temperatura ambiente.
- Aggiungere 200 ml di mezzo di montaggio e procedere a delle immagini.
Risultati
Il grado di sviluppo myofiber è in gran parte determinato dalla purezza e vitalità dei mioblasti isolati. L'adesione, proliferazione, e la capacità di fusione possono essere utilizzati per accedere empiricamente quei parametri (Figura 1 A, B). A proliferazione D2, mioblasti dovrebbero hanno aderito e dovrebbe visualizzare la tipica forma fusiforme. Proliferazione dovrebbe accadere estesamente in questa fase, che porta alla formazione myotube spontanea il giorno successivo (Figura 1B).
Cellulare confluenza potrebbe aver bisogno di piccoli aggiustamenti. Dovrebbe essere aumentato se mioblasti prendere più di 3 d di proliferare e fusibile. Dovrebbe essere diminuita se miofibre non possono crescere e allungare relativamente semplice a causa della loro densità. Confluenza tipicamente diminuisce dal centro alla periferia del piatto, in modo che i migliori miofibre dovrebbero trovare verso le regioni esterne.
Miotubi si allungano in modo rapido e visualizzare più nuclei allineati in posizione centrale (Figura 1C). Con D5, alcune cellule iniziano l'acquisizione di striature e trasferire i loro nuclei verso la periferia. Il numero di miofibre con caratteristiche maturi aumenta con il tempo e con spessore di cellule (Figura 1D).
Il grado di differenziazione può essere ulteriormente osservato mediante immunofluorescenza. Miofibre fissati differenziazione D8 triadi presenti trasversali. Questo può essere confermato da componenti di imaging del T-tubuli (DPHR) e SR (triadina), che dovrebbero colocalize le triadi (Figura 2).
La funzionalità di miofibre può essere affrontato da immagini dal vivo. Da differenziazione D3 in poi, le cellule mostrano contrazioni spontanee. Trasfettando un sensore di calcio (ad esempio., GCaMP6f 11), è possibile osservare che le contrazioni sono accoppiati con picchi di calcio (Figura 3).
Utilizzando questo sistema, siamo stati in grado di identificare un percorso molecolare romanzo che viene interrotto in miopatie centronucleare e distrofie miotoniche, che possono quindi essere un obiettivo nuovo per terapie molecolari innovative 7. Abbiamo anche adattato questo metodo per studiare lo sviluppo della giunzione neuromuscolare (NMJ) 12. Attraverso la co-coltura con il ratto espianti midollo spinale, abbiamo descritto un ruolo per dynein nella formazione NMJ 13.

Figura 1: fasi di sviluppo della cultura mioblasti. A) A proliferazione D2, mioblasti hanno aderito e iniziato a proliferare. B) A prolifperazione D3, una confluenza di 60 - 80% è raggiunto, e mioblasti avviare fusione spontaneamente. C) A differenziazione D3, miotubi contenenti nuclei centrali sono predominanti. D) Da differenziazione D5 in poi (ad esempio, il giorno 8), miofibre iniziare esibendo striature e nuclei periferici e cominciano ad addensarsi. barra della scala: 50 micron. Clicca qui per vedere una versione più grande di questa figura.
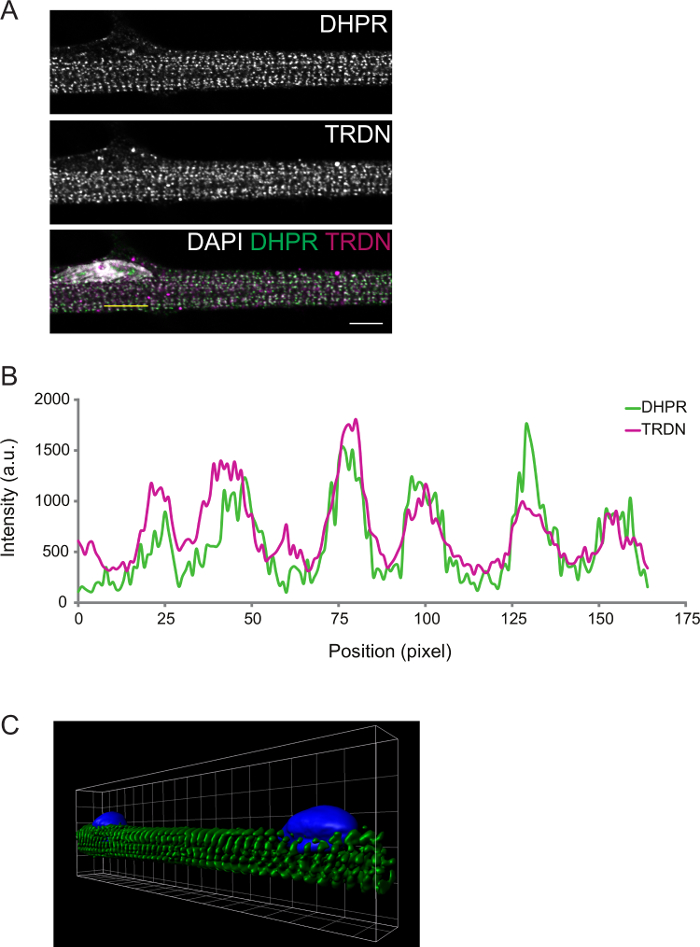
Figura 2: Rappresentante confocale immagine di una D8 myofiber Immunostain. A) immunocolorazione per il recettore diidropiridina (DHPR, pannello superiore) e triadina (TRDN, pannello centrale). Una sovrapposizione dei canali DHPR, TRDN, e DAPI mostra colocalization dei componenti della triade. B) Un profilo di intensità della linea gialla disegnato in A. C) Una immagine 3D di rendering volumetrico di miofibre colorate per α-actinina (verde) e DAPI (blu). Scala bar e griglia di larghezza: 5 micron. Clicca qui per vedere una versione più grande di questa figura.
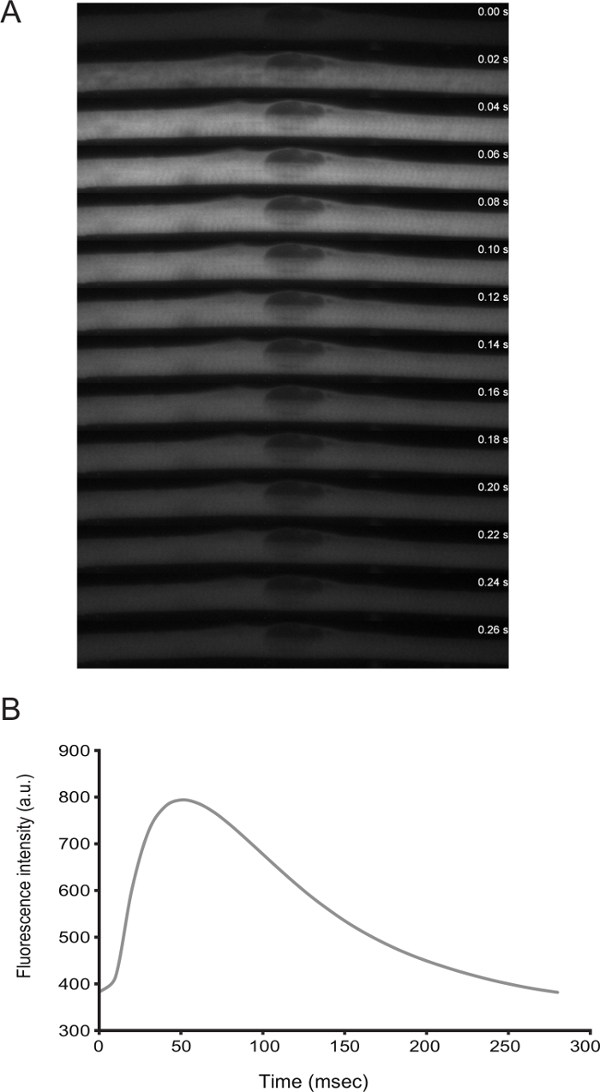
Figura 3: immagini dal vivo dei livelli di calcio in miofibre con spontanea spasmi. A) time-lapse ad alta velocità (20 ms fotogrammi) microscopia di una scintilla di calcio in un myofiber spasmi. Il calcio è stato rilevato attraverso l'espressione di GCaMP6f (Addgene plasmide # 40755). B) Quantificazione dell'intensità di fluorescenza nel tempo per il sensore calcio nel pannello A._blank "> Clicca qui per vedere una versione più grande di questa figura.
Discussione
L'uso di questo protocollo per la coltivazione di mioblasti primari dà luogo ad una nicchia speciale che alimenta notevolmente lo sviluppo delle miofibre. Questo è parzialmente dovuto ad altri tipi di cellule che sono presenti in numero limitato anche. Un equilibrio tra la concentrazione dei mioblasti e cultura purezza deve essere raggiunto. Una cultura buona cellulare dipende anche dalla qualità dei prodotti utilizzati per la formulazione di media. Tutti i prodotti derivati da fonti animali devono essere accuratamente testati. Nella nostra esperienza, le condizioni di digestione devono essere monitorati.
Come di consueto per colture primarie, la variabilità sperimentale può essere superiore negli studi con fibre isolate o mioblasti immortalati. Questa variabilità può essere ridotta dalla standardizzazione dei media e di digestione componenti, topi età e dimensioni, ed i punti di tempo per la manipolazione della cultura e la raccolta dei risultati. Tuttavia, il vantaggio di scrutare in tempo reale complessi meccanisminecessario per lo sviluppo myofiber supera notevolmente l'inconveniente variabilità.
Questo protocollo conferisce i vantaggi di vitro approcci senza compromettere la differenziazione cellulare. Miofibre maturano fino triadi sono formate e contrazioni sono accoppiati a scintille calcio. Queste uscite funzionali sono accessibili in diverse condizioni sperimentali. Inoltre, ci possono essere molte varianti tecniche apportate al protocollo. Mioblasti possono essere raccolte da topi neonati con mutazioni di interesse relative allo sviluppo muscolare. Le celle possono essere lisate per l'analisi biochimica in diversi momenti differenziazione. indicatori di calcio possono essere aggiunti alla coltura di seguire le dinamiche. costrutti optogenetic possono essere utilizzati per far rispettare determinate vie di segnalazione o per indurre specifiche risposte locali. Infine, le fibre muscolari possono essere messi in coltura con i tipi di altre cellule per studiare le loro interazioni.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
This work was supported by the European Research Council (ERG) and EMBO installation (ERG) and by a PhD fellowship from the Fundação para a Ciência e Tecnologia (MP).
Materiali
| Name | Company | Catalog Number | Comments |
| Dispase II | Gibco | 17105041 | |
| Collagenase type V | Sigma-Aldrich-Aldrich | C9263 | |
| IMDM, Glutamax supplemented | Gibco | 31980022 | |
| Matrigel Growth reduced factor | Corning | 354230 | protein concentration of the lot should be around 10 mg/mL and endotoxin result should be <1.5 |
| Chicken Embryo Extract | MP biomedical | 2850145 | it is also possible to prepare in the lab (Danoviz ME, Yablonka-Reuveni Z. Methods Mol Biol (2012)) |
| Recombinant rat agrin | R&D systems | 550-AG-100 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Horse Serum | GE Healthcare | 11581831 | |
| Lipofectamine RNAiMAX | Invitrogen | 13778-150 | used to transfect siRNA |
| Lipofectamine LTX | Invitrogen | 15338-100 | used to transfect DNA |
| Lipofectamine 2000 | Invitrogen | 11668030 | used to transfect siRNA plus DNA |
| DPBS | Gibco | 14190094 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF0001 | |
| Cell strainer | Corning | 21008-949 | |
| Fluorodishes | World precision instruments | FD35-100 | dishes used to cultivate cells for live imaging |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| 16% PFA (Paraformaldehyde) | Science Services GmbH | E15710 | |
| Goat Serum | Sigma-Aldrich | G9023 | |
| BSA (Bovine Serum Albumine) | Sigma-Aldrich | A7906 | |
| Saponine | Sigma-Aldrich | 47036 | |
| DAPI | Sigma-Aldrich | D9542 | use at 200 ng/µL |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| Name | Company | Catalog Number | Comments |
| Solutions and Media | |||
| Digestion Mix | in DPBS 5 mg/mL collagenase 3.5 mg/mL dispase sterile filtered, can be stored in working aliquotes for 2 weeks at -20 °C | ||
| Dissection Medium | in IMDM Glutamax supplemented 10% FBS 1% Penicillin/Streptomycin sterile filtered | ||
| Growth Medium | in IMDM Glutamax supplemented 20% FBS 1% Chicken Embryo Extract 1% Penicillin-Streptomycin sterile filtered | ||
| Differentiation Medium | in IMDM Glutamax supplemented 2% Horse Serum 1% Penicillin-Streptomycin sterile filtered | ||
| Blocking Solution | in DPBS 10% Goat Serum 5% BSA add 0.1% saponine when incubating with primary and secondary antibodies |
Riferimenti
- Janssen, I., Heymsfield, S. B., Wang, Z., Ross, R. Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol. 89 (1), 81-88 (2000).
- Manring, H., Abreu, E., Brotto, L., Weisleder, N., Brotto, M. Novel excitation-contraction coupling related genes reveal aspects of muscle weakness beyond atrophy-new hopes for treatment of musculoskeletal diseases. Front Physiol. 5, 37 (2014).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270 (5639), 725-727 (1977).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. J Vis Exp. (73), (2013).
- Meng, H., Janssen, P. M. L., et al. Tissue Triage and Freezing for Models of Skeletal Muscle Disease. J Vis Exp. (89), (2014).
- Demonbreun, A. R., McNally, E. M. DNA Electroporation, Isolation and Imaging of Myofibers. J Vis Exp. (106), (2015).
- Falcone, S., Roman, W., et al. N-WASP is required for Amphiphysin-2/BIN1-dependent nuclear positioning and triad organization in skeletal muscle and is involved in the pathophysiology of centronuclear myopathy. EMBO Mol Med. 6 (11), 1455-1475 (2014).
- Flucher, B. E., Phillips, J. L., Powell, J. A. Dihydropyridine receptor alpha subunits in normal and dysgenic muscle in vitro: expression of alpha 1 is required for proper targeting and distribution of alpha 2. J Cell Biol. 115 (5), 1345-1356 (1991).
- Cooper, S. T., Maxwell, A. L., et al. C2C12 co-culture on a fibroblast substratum enables sustained survival of contractile, highly differentiated myotubes with peripheral nuclei and adult fast myosin expression. Cell Motil Cytoskeleton. 58 (3), 200-211 (2004).
- Al-Qusairi, L., Laporte, J. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skelet Muscle. 1, 26 (2011).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system to study mechanisms of neuromuscular junction development and maintenance. Development. , (2016).
- Vilmont, V., Cadot, B., Vezin, E., Le Grand, F., Gomes, E. R. Dynein disruption perturbs post-synaptic components and contributes to impaired MuSK clustering at the NMJ: implication in ALS. Sci Rep. 6, 27804 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon