Method Article
Na diferenciação in vitro de miofibras maduras for Imaging ao vivo
Neste Artigo
Resumo
Muscle cells are among the most complex eukaryotic cells. We present a protocol for the in vitro differentiation of highly mature myofibers that allows for genetic manipulation and clear imaging during all developmental stages.
Resumo
Os músculos esqueléticos são compostos de miofibras, as maiores células no corpo de um mamífero e um dos poucos sincicios. Como as estruturas complexas e evolutivamente conservadas que o compõem são montados permanece sob investigação. Suas características de tamanho e fisiológicas, muitas vezes restringir aplicativos de manipulação e de imagem. A cultura das linhas celulares imortalizadas é amplamente usada, mas ela só pode replicar os primeiros passos de diferenciação.
Aqui, descrevemos um protocolo que permite a manipulação genética fácil de miofibras provenientes de mioblastos principal do mouse. Após uma semana de diferenciação, as miofibras exibir contractilidade, alinhados sarcómeros e tríades, bem como núcleos periféricos. Todo o processo de diferenciação pode ser seguido por meio de imagens ao vivo ou imunofluorescência. Este sistema combina as vantagens de a existente ex vivo e em protocolos in vitro. A possibilidade de fácil e eficiente, assim como a transfecçãoa facilidade de acesso a todos os estágios de diferenciação amplia as aplicações potenciais. Miofibras podem subsequentemente ser utilizados não só para responder a questões de desenvolvimento e biologia celular relevantes, mas também para reproduzir fenótipos da doença muscular para aplicações clínicas.
Introdução
O músculo esquelético compõe-se de 40% do peso do corpo humano 1. Distúrbios associados com musculares representam uma imensa de saúde e dos custos económicos 2. Como este tecido altamente complexo e organizado é formado, mantidos e regenerado constitui um campo de pesquisa extensa e bem estabelecida. Dependendo do interesse científico específico, a abordagem mais adequada pode variar entre culturas miotubos simples aos mais complexos modelos in vivo 3 - 6.
O objetivo deste protocolo é o de proporcionar um sistema in vitro que permite a monitorização de miogênese através de imagens ao vivo e imunofluorescência. Em comparação com as abordagens tradicionais, este sistema oferece uma visão muito completa e dinâmica no processo miogênica mouse. As células podem ser seguidas a partir da fase de mioblastos ao myofiber madura, multinucleadas exibindo tríades transversais e núcleos periféricos 7. Este nível de maturação podeser obtida utilizando equipamento de cultura celular normal, sem a necessidade de aparelhos estimuladores ou mecânicos complexos. Embora algumas bem sucedidas em sistemas in vitro têm sido relatados 8,9, a nosso conhecimento, este é o único protocolo de gerar fibras musculares maduras rato com a T-túbulos transversalmente emparelhado com Sarcoplasmic Reticulum (SR). Assim, este sistema in vitro pode ser utilizada para estudar os mecanismos moleculares da formação tríade, que são ainda pouco compreendidos 10.
Uma outra vantagem da utilização deste sistema é a disponibilidade de recursos destinados-rato validadas, tais como anticorpos, drogas e instrumentos de ARNi. O protocolo relativamente simples não requer etapas trabalhosas, manipulação altamente qualificados, ou equipamentos caros e dedicado. Myofibers amadureceu começam a aparecer após 5 d de diferenciação de cultura 7, exibindo contratilidade juntamente com faíscas de cálcio (dados não publicados). Em uma semana, o desenvolvimento diferenteal fases de uma das células mais complexas no corpo de um mamífero pode ser estudada em combinação com uma variedade de ensaios in vitro.
Protocolo
NOTA: Um rato produz mioblastos suficientes para cerca de dois pratos de 35 mm ou dois pratos de geração de imagens ao vivo, então mattings plano, dissecção, e revestimento (passo 2.6) em conformidade. Desde mioblastos são isolados a partir de centrifugações sequenciais e preplating, o protocolo deve ser feito em lotes de 5 - 10 animais.
Todos os procedimentos que envolvem indivíduos animais foram aprovados pelo Comitê de Ética Animal do Instituto de Medicina Molecular e da Universidade Pierre et Marie Curie
1. Dissecção do Ratos Neonatal Músculos Hind-membros
- Preparar todas as soluções previamente (Tabela Materiais) e esterilizar por filtração (filtro de 0,22 nm). Certifique-se de todos os meios de comunicação estão a 37 ° C antes da adição às células, com excepção das formulações contendo matriz de membrana basal (por exemplo, Matrigel).
- Esterilizar o material de dissecção (um de cada: tesoura curva, tesoura reta, pinças regulares,e uma pinça de ponta fina) e bancada de trabalho, limpando-os com etanol 70%.
- Preparar um prato de 100 milímetros de Petri com 5 mL de fosfato de Dulbecco tamponado com solução salina (DPBS) para a recolha de músculo e mantê-lo em gelo até que o passo de trituração.
- Decapitar P6 - ratos P8 com tesoura reta e esterilizar a pele com etanol 70%.
- Faça uma incisão na pele para trás e puxe-o suavemente para os membros posteriores até que seja removido, expondo completamente a musculatura posterior-membro.
- Utilizar as pinças para remover o tecido de gordura, sem danificar os músculos.
- Para remover os músculos posteriores-membros dorsais, manter o membro alongado e dobrar a pata para expor os tendões do salto. Use as tesouras curvadas para músculo separado do osso, a partir dos tendões, deslizando suavemente e de corte para cima. Extirpar os músculos e colocá-los em DPBS gelado.
- Isolar os quadríceps, apertando o músculo com uma pinça de ponta fina e corte em torno dele sem danificar o fêmur ou a articulação do joelho.
- Após dissecação todos os animais, a uma capa de cultura de célula de fluxo laminar estéril, em que todos os passos que se seguem devem ser realizados.
Isolamento 2. mioblasto
- Remover o excesso de DPBS. Picar o tecido com tesoura curva esterilizadas de modo a obter uma massa uniforme.
- Recolhe-se o tecido moído num tubo de centrífuga cónico de 50 ml com 5 ml de mistura de digestão e incubar-a com agitação a 37 ° C durante 90 min.
- Parar a digestão através da adição de 6 ml de meio de dissecção e centrifugar a suspensão durante 5 minutos a 75 xg para sedimentar as restante tecido.
- Recolher cuidadosamente o sobrenadante. Certifique-se de não recolher os restos de tecido. Centrifugar-lo a 350 xg durante 5 min; ressuspender-o em 5 mL de meio de dissecção.
- Filtra-se a suspensão de células através de um coador de células de 40 ^ m. Adicionar 25 mL de meio de dissecção e preplate-lo em um prato de 150 mm para os 4 h numa incubadora de cultura de células (37 ° C e 5% de CO 2 </ Sub>) para permitir que os fibroblastos para aderir.
- Enquanto preplating, pratos de revestimento com 500 mL de matriz de membrana basal diluído 1: 100 em IMDM a frio durante 1 h, à RT. Lavar uma vez com DPBS e placa as células imediatamente (passo 2.8) ou deixar com meio de crescimento até o chapeamento.
- Após preplating, recolher o sobrenadante e centrifuga-se que a 350 xg durante 10 min.
- Ressuspender-lo no meio de crescimento e contar as células em um hemocitómetro. Ajustar o volume para que entre 150.000 e 250.000 células são banhados por membrana basal prato revestido de matriz. Manter as células numa incubadora de cultura de células.
3. Diferenciação de miofibras
NOTA: Depois de 3 d, as células devem começar a fundir e formar miotubos em cerca de 70% de confluência (Figura 1B).
- Neste ponto, transfectar as células, se desejado, com um siRNA ou de ADN de interesse. Se as células não estão a ser transfectada, mudar directamente para meio de diferenciação e de esquip para o passo 3.4.
- Transfectar com reagentes de transfecção seguindo as instruções do fabricante. Incubam-se as células durante 5 h com complexos de siRNA-lípido (20 nM + 1 ul de reagente) ou complexos ADN-lípido (1 ug + 1 uL de reagente). Otimizar as concentrações de siRNA e de DNA, se necessário.
- Lavá-los uma vez com meio de diferenciação e, em seguida, mudar para o novo meio de diferenciação.
- No dia seguinte, dilui-se a matriz de membrana basal 1: 2 em meio de diferenciação gelada. Remover o meio e adicionar 200 existente ul de matriz arrefecido com gelo para cada prato.
- Incubar durante 30 min numa incubadora de cultura de células.
- Suplementar o meio de diferenciação com agrina (100 ng / mL) e adicionar cuidadosamente 2 mL para as células.
- Cuidadosamente mudar metade do meio a cada 2 d, sempre que completa com agrina a uma concentração final de 100 ng / mL.
- Monitorar diferenciação celular e viabilidade. Dependendo de uma variedade de factores tais como (FBS e Chicken extracto de embrião origens), as células podem ter entre 5-10 diferenciação d para atingir plena maturação (Figura 2).
4. A imunocoloração em pratos de vidro de fundo
- Para a imunocoloração, em qualquer ponto de tempo de interesse, lavagem das células uma vez com DPBS e corrigi-los com PFA a 4%, à TA, durante 10 min.
- Lave-os duas vezes com DPBS. Neste ponto, as células podem ser armazenadas a 4 ° C.
- Permeabilizar-os com 0,5% de Triton X-100 durante 5 min à TA.
- Lavar duas vezes com PBS e bloquear com solução de bloqueio durante 30 minutos à TA.
- Incubar os com anticorpo primário diluído em solução bloqueadora O / N a 4 ° C.
- Lavar 3x com DPBS durante 5 min à TA.
- Incubar-los com o anticorpo secundário e 0,2 ug / ml de DAPI, durante 1 h, à RT.
- Lavar 3x com DPBS durante 5 min à TA.
- Adicionar 200 mL de meio de montagem e proceder à imagem.
Resultados
A extensão do desenvolvimento da fibra muscular é em grande parte determinado pela pureza e viabilidade dos mioblastos isolados. A adesão, proliferação, e a capacidade de fusão pode ser utilizado para aceder empiricamente os parâmetros (Figura 1 A, B). No proliferação D2, mioblastos deveria ter respeitado e deve apresentar a forma típica fusiforme. Proliferação se espera que aconteça extensivamente nesta fase, que conduz à formação de miotubos espontânea no dia seguinte (Figura 1B).
confluência celular pode precisar de pequenos ajustes. Deve ser aumentada se mioblastos tomar mais do que 3 d para proliferar e se fundem. Deve ser diminuída se miofibras não são deixadas a crescer e alongada relativamente simples devido à sua densidade. Confluência tipicamente diminui a partir do centro para a periferia do prato, de modo a melhor miofibras devem ser encontrados para as regiões exteriores.
Miotubos rapidamente alongado e vários monitores núcleos alinhadas centralmente (Figura 1C). Por D5, algumas células começam a adquirir estrias e movendo-se os seus núcleos para a periferia. O número de miofibras maduras com características irá aumentar com o tempo, bem como com a espessura das células (Figura 1D).
O grau de diferenciação pode ser mais observada por imunofluorescência. Miofibras fixos na diferenciação D8 tríades presentes transversais. Isto pode ser confirmado por componentes de imagem dos túbulos T (DPHR) e o SR (triadin), que se prevê venham a colocalize em tríades (Figura 2).
A funcionalidade de miofibras podem ser tratadas por meio de imagens ao vivo. De diferenciação D3 em diante, as células apresentam espasmos espontâneos. Por transfecção de um sensor de cálcio (por exemplo,., GCaMP6f 11), é possível observar que as contracções são acoplados com picos de cálcio (Figura 3).
Usando este sistema, fomos capazes de identificar um caminho molecular romance que é interrompido nas miopatias centronuclear e distrofias miotônica, que pode, portanto, ser um novo alvo para terapias moleculares inovadoras 7. Também se adaptaram este método para estudar o desenvolvimento da junção neuromuscular (JNM) 12. Através da co-cultura com ratos explantes da medula espinhal, descrevemos um papel para dineína no MNJ formação 13.

Figura 1: estágios de desenvolvimento da cultura mioblasto. A) A proliferação D2, mioblastos aderiram e começaram a proliferar. B) No prolifração D3, uma confluência de 60-80% é alcançado, e mioblastos começar a fundir espontaneamente. C) Em D3 diferenciação, miotubos contendo núcleos localizados centralmente são predominantes. D) A partir de diferenciação D5 em diante (por exemplo, dia 8), myofibers começar exibindo estrias e núcleos periféricos e começar a engrossar. Barra de escala: 50 ^ m. Por favor clique aqui para ver uma versão maior desta figura.
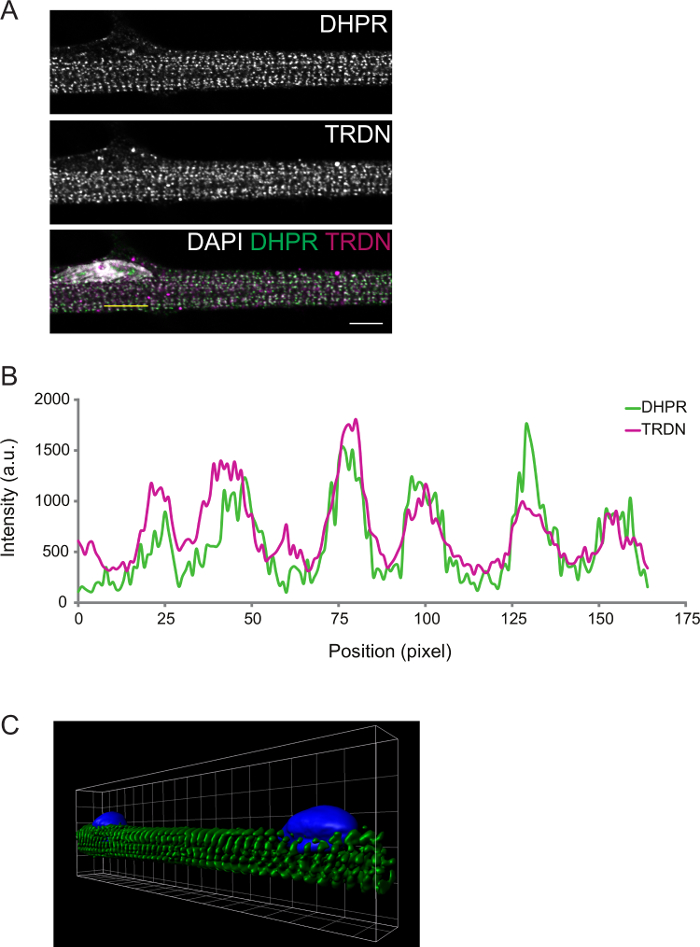
Figura 2: Representante confocal Imagem de um D8 miofibras imunocoloração. A) A imunocoloração para o receptor dihidropiridina (DHPR, painel superior) e triadin (TRDN, painel do meio). Uma sobreposição dos canais DHPR, TRDN e DAPI mostra co-localização dos componentes da tríade. B) Um perfil de intensidade da linha amarela desenhado em A. C) Uma imagem 3D de renderização de volume de miofibras coradas para α-actinina (verde) e DAPI (azul). Escala de barra e grade width: 5 mm. Por favor clique aqui para ver uma versão maior desta figura.
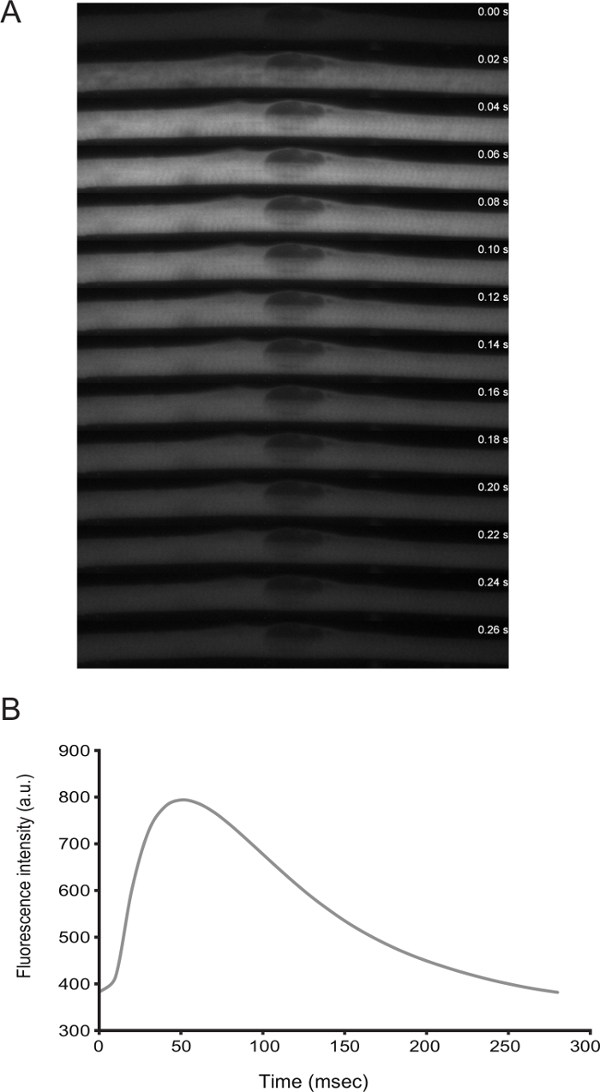
Figura 3: Imagens ao vivo dos níveis de cálcio em miofibras com Spontaneous Twitching. A) de alta velocidade de lapso de tempo (20 ms quadros) microscopia de uma faísca de cálcio em um myofiber espasmos. Cálcio foi detectado através da expressão de GCaMP6f (Addgene plasmídeo # 40755). B) Quantificação da intensidade de fluorescência ao longo do tempo para o sensor de cálcio no painel A._blank "> Por favor clique aqui para ver uma versão maior desta figura.
Discussão
A utilização deste protocolo para a cultura de mioblastos primários dá origem a um nicho especial que alimenta grandemente o desenvolvimento de miofibras. Isto é parcialmente devido a outros tipos de células que estão também presentes em números muito pequenos. Um equilíbrio entre a concentração de mioblastos e pureza da cultura deve ser alcançado. Uma cultura de células boa também depende da qualidade dos produtos utilizados para a formulação de meio. Todos os produtos derivados de origem animal deve ser cuidadosamente testado. Em nossa experiência, as condições de digestão também devem ser monitorados.
Como é habitual para culturas primárias, variabilidade experimental pode ser maior do que em estudos com fibras isoladas imortalizadas ou mioblastos. Esta variabilidade pode ser diminuída pela normalização dos componentes do meio e da digestão, ratos idade e o tamanho, e os pontos de tempo para a manipulação de cultura e recolha de resultados. No entanto, a vantagem de analise em tempo real, os mecanismos complicadosnecessárias para o desenvolvimento de células musculares ultrapassa grandemente a desvantagem da variabilidade.
Este protocolo confere as vantagens de abordagens in vitro sem comprometer a diferenciação celular. Miofibras maduras até tríades são formados e as contracções são acoplados a faíscas de cálcio. Estas saídas funcionais podem ser acessados em diferentes condições experimentais. Além disso, pode haver muitas variações técnicas introduzidas no protocolo. Os mioblastos podem ser colhidas a partir de ratos neonatais com mutações de interesse relativamente ao desenvolvimento muscular. As células podem ser lisadas para análise bioquímica em diferentes pontos no tempo de diferenciação. indicadores de cálcio pode ser adicionado à cultura de seguir a sua dinâmica. construções optogenética pode ser usada para impor certas vias de sinalização ou para induzir respostas locais específicos. Finalmente, as miofibras podem ser co-cultivadas com outros tipos de células para estudar as suas interacções.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
This work was supported by the European Research Council (ERG) and EMBO installation (ERG) and by a PhD fellowship from the Fundação para a Ciência e Tecnologia (MP).
Materiais
| Name | Company | Catalog Number | Comments |
| Dispase II | Gibco | 17105041 | |
| Collagenase type V | Sigma-Aldrich-Aldrich | C9263 | |
| IMDM, Glutamax supplemented | Gibco | 31980022 | |
| Matrigel Growth reduced factor | Corning | 354230 | protein concentration of the lot should be around 10 mg/mL and endotoxin result should be <1.5 |
| Chicken Embryo Extract | MP biomedical | 2850145 | it is also possible to prepare in the lab (Danoviz ME, Yablonka-Reuveni Z. Methods Mol Biol (2012)) |
| Recombinant rat agrin | R&D systems | 550-AG-100 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Horse Serum | GE Healthcare | 11581831 | |
| Lipofectamine RNAiMAX | Invitrogen | 13778-150 | used to transfect siRNA |
| Lipofectamine LTX | Invitrogen | 15338-100 | used to transfect DNA |
| Lipofectamine 2000 | Invitrogen | 11668030 | used to transfect siRNA plus DNA |
| DPBS | Gibco | 14190094 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF0001 | |
| Cell strainer | Corning | 21008-949 | |
| Fluorodishes | World precision instruments | FD35-100 | dishes used to cultivate cells for live imaging |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| 16% PFA (Paraformaldehyde) | Science Services GmbH | E15710 | |
| Goat Serum | Sigma-Aldrich | G9023 | |
| BSA (Bovine Serum Albumine) | Sigma-Aldrich | A7906 | |
| Saponine | Sigma-Aldrich | 47036 | |
| DAPI | Sigma-Aldrich | D9542 | use at 200 ng/µL |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| Name | Company | Catalog Number | Comments |
| Solutions and Media | |||
| Digestion Mix | in DPBS 5 mg/mL collagenase 3.5 mg/mL dispase sterile filtered, can be stored in working aliquotes for 2 weeks at -20 °C | ||
| Dissection Medium | in IMDM Glutamax supplemented 10% FBS 1% Penicillin/Streptomycin sterile filtered | ||
| Growth Medium | in IMDM Glutamax supplemented 20% FBS 1% Chicken Embryo Extract 1% Penicillin-Streptomycin sterile filtered | ||
| Differentiation Medium | in IMDM Glutamax supplemented 2% Horse Serum 1% Penicillin-Streptomycin sterile filtered | ||
| Blocking Solution | in DPBS 10% Goat Serum 5% BSA add 0.1% saponine when incubating with primary and secondary antibodies |
Referências
- Janssen, I., Heymsfield, S. B., Wang, Z., Ross, R. Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol. 89 (1), 81-88 (2000).
- Manring, H., Abreu, E., Brotto, L., Weisleder, N., Brotto, M. Novel excitation-contraction coupling related genes reveal aspects of muscle weakness beyond atrophy-new hopes for treatment of musculoskeletal diseases. Front Physiol. 5, 37 (2014).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270 (5639), 725-727 (1977).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. J Vis Exp. (73), (2013).
- Meng, H., Janssen, P. M. L., et al. Tissue Triage and Freezing for Models of Skeletal Muscle Disease. J Vis Exp. (89), (2014).
- Demonbreun, A. R., McNally, E. M. DNA Electroporation, Isolation and Imaging of Myofibers. J Vis Exp. (106), (2015).
- Falcone, S., Roman, W., et al. N-WASP is required for Amphiphysin-2/BIN1-dependent nuclear positioning and triad organization in skeletal muscle and is involved in the pathophysiology of centronuclear myopathy. EMBO Mol Med. 6 (11), 1455-1475 (2014).
- Flucher, B. E., Phillips, J. L., Powell, J. A. Dihydropyridine receptor alpha subunits in normal and dysgenic muscle in vitro: expression of alpha 1 is required for proper targeting and distribution of alpha 2. J Cell Biol. 115 (5), 1345-1356 (1991).
- Cooper, S. T., Maxwell, A. L., et al. C2C12 co-culture on a fibroblast substratum enables sustained survival of contractile, highly differentiated myotubes with peripheral nuclei and adult fast myosin expression. Cell Motil Cytoskeleton. 58 (3), 200-211 (2004).
- Al-Qusairi, L., Laporte, J. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skelet Muscle. 1, 26 (2011).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system to study mechanisms of neuromuscular junction development and maintenance. Development. , (2016).
- Vilmont, V., Cadot, B., Vezin, E., Le Grand, F., Gomes, E. R. Dynein disruption perturbs post-synaptic components and contributes to impaired MuSK clustering at the NMJ: implication in ALS. Sci Rep. 6, 27804 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados