Method Article
استخدام نموذج خنزير صغير لدراسة التسمم العصبي التنموي الناجم عن التخدير (إيدن): نهج علم الأعصاب الانتقالي
In This Article
Summary
وقد ركزت البحوث العصبية التنموية التي يسببها التخدير (إيدن) على القوارض، والتي لا تنطبق بشكل واسع على البشر. نماذج الرئيسيات غير البشرية هي أكثر ملاءمة، ولكن هي باهظة التكلفة وصعبة للاستخدام للتجريب. الخنزير الصغير، في المقابل، هو ذات الصلة سريريا، نموذج حيواني عملي مثالية لدراسة العصبية التخدير.
Abstract
لا يمكن تجنب التخدير في كثير من الحالات عندما تكون هناك حاجة لعملية جراحية، وخاصة في الأطفال. وقد أثارت التحقيقات الأخيرة في الحيوانات المخاوف من أن التعرض التخدير قد يؤدي إلى موت الخلايا المبرمج العصبي، والمعروفة باسم التسمم العصبي الناجم عن التخدير (إيدن). وعلاوة على ذلك، قد أشارت بعض الدراسات السريرية في الأطفال أن التعرض التخدير قد يؤدي إلى العجز العصبي التنموي في وقت لاحق من الحياة. ومع ذلك، لم يتم بعد تطوير نموذج حيواني مثالي للدراسة قبل السريرية. يمثل خنزير صغير الولادة نموذجا قيما للدراسة قبل السريرية، لأنها تشترك في عدد مذهل من أوجه التشابه التنموية مع البشر.
وعلم التشريح وعلم وظائف الأعضاء من الخنازير تسمح لتنفيذ الظروف البشرية المحيطة بالجراحة صارمة في كل من البقاء على قيد الحياة وعدم البقاء على قيد الحياة الإجراءات. القثطرة الشريان الفخذي يسمح للرصد عن كثب، مما يتيح تصحيح فوري من أي انحراف من علامات الحيوية والكحوليات الخنزير الصغير. أنابالإضافة إلى ذلك، هناك أوجه تشابه تنموية متعددة بين الخنازير وحديثي الولادة. التقنيات المطلوبة لاستخدام الخنازير للتجريب تتطلب خبرة لإتقان. طبيب تخدير الأطفال هو عضو بالغ الأهمية في فريق التحقيق. نحن تصف، بمعنى عام، الاستخدام المناسب لنموذج خنزير صغير لدراسة النمو العصبي.
Introduction
في كل عام، الملايين من الأطفال في الولايات المتحدة الأمريكية تلقي التخدير العام، وكثير منهم دون 4 سنوات من العمر 1 . السمية العصبية التنموية التي يسببها التخدير (إيدن) أصبحت محور أبحاث تخدير الأطفال كما أصبح من الضروري الحصول على فهم آثار التخدير على العقول غير ناضجة. وقد أظهرت الأبحاث السابقة أن التخدير شائعة الاستخدام، مثل إيسوفلوران، يمكن أن يسبب زيادة موت الخلايا المبرمج العصبي في أدمغة الحيوانات الصغيرة. وقد أسفرت الدراسات في الأطفال عن نتائج غامضة 2 . فهم التسبب في إيدن، وتحديد الأهداف العلاجية المحتملة للوقاية منه أو تحسينها، ووصف أنظمة التخدير الأكثر أمانا المتاحة أصبحت أهدافا ملحة للمجتمع تخدير الأطفال. وكان الهدف الأساسي من هذه الدراسة هو تطوير نموذج الحيوان الأمثل وطريقة لقياس آثار التخدير على الدماغ النامية، وتحفيز بعناية تصميم التحقيق في سلامة التخدير المستخدمة على نطاق واسع حاليا.
في مراجعة منهجية حديثة من الجسم الحالي من الأدب قبل السريرية على إيدن، لاحظ الباحثون عدم التجانس المنهجية كبيرة في أكثر من 900 دراسة 3 . واعتبر الكثيرون ذلك دعوة إلى نموذج سريري ذي تصميم سريري ذي صلة سريريا، وهو ما لا يوجد حتى الآن على الرغم من عدة سنوات من البحث حول هذا الموضوع. معظم النماذج القوارض، من الضرورة، استخدام النهج الذي لا يسمح الرصد الفسيولوجي الدقيق، وأخذ عينات الدم، أو التهوية الميكانيكية. منذ الدماغ هو حساس بشكل رائع ل ديرانجيمنتس الفسيولوجية، فإنه من الصعب الاعتماد على نتائج من هذه النماذج. وكان الهدف الأساسي لتطوير هذا النموذج هو تصميمه بطريقة يتم فيها رصد جميع المتغيرات الفسيولوجية مثل معلمات غازات الدم ودرجة حرارة الجسم ومعلمات الجهاز التنفسي وغيرها وتصحيحها عند الضرورة.
سس = "jove_content"> بالإضافة إلى ذلك، لأن السمية العصبية للتخدير يعتمد على التقدم التنموي للدماغ في وقت التعرض، وينبغي اختيار نموذج حيواني التي يمكن أن تحاكي أفضل تطور وهيكل الدماغ البشري حديثي الولادة، لتعظيم أهمية متعدية للنتائج 4 . يوفر نموذج خنزير صغير متعدية مستوى الأهمية السريرية سعى بعد في هذه الاستعراضات والافتتاحيات، كما أنها مصممة لمعالجة هذه الحاجة إلى البيانات قبل السريرية ذات الصلة التي يمكن أن تسترشد الدراسات السريرية في المستقبل.
إيسوفلوران، وهو غابا من نوع A (غابا A ) مستقبلات ناهض ومضاد مستقبلات نمدا ضعيفة، هو مخدر استنشاق شائعة الاستخدام في الممارسة السريرية في جميع أنحاء العالم. وقد اعتبر التخدير مثل إيسوفلوران آمنة طالما أنها لا تسبب انخفاض ضغط الدم أو نقص الأكسجة. ومع ذلك، قد تحدث آثار أكثر دقة. عندما يتعرض الدماغ إلى التخدير العام، والتوازن من غابا أغونيسم و نمدا العداء تعطلت، مما أدى إلى تغييرات في الهندسة الخلوية، والاتصال، والوظيفة. وبالإضافة إلى ذلك، في حين أن غابا عموما الناقل العصبي المثبطة، ومن المعروف أن يكون مثيرا في العقول غير ناضجة 5 . على وجه التحديد عندما الانتقال غابا من الإثارة إلى مثبط يحدث ليس مفهوما جيدا، ومن المرجح أن تعتمد على الأنواع.
عندما يحدث خلل بين المدخلات المثبطة والمثبطة في الدماغ خلال ما يسمى ب "طفرة نمو الدماغ"، قد يؤدي عدم التسمم الناتج عن التمزق في المسارات الجزيئية الحرجة إلى نمو عصبي غير طبيعي، مثل تنكس عصبي موت الخلايا المبرمج (أبوبتوتيك نيورودجينيراتيون). بالإضافة إلى زيادة موت الخلايا المبرمج، يمكن أيضا أن يسببها الإجهاد التأكسدي والالتهاب، في حين أن تكاثر الخلايا العصبية، هجرة الخلايا العصبية، والمحور أربوريزاتيون تصبح قمعها أو ديسريغولاتد 6 . والنتيجة الصافية هي الاضطرابات العصبية المعرفية التي قد تستمر في الغش2 .
لقياس مباشرة التأثيرات السمية العصبية لل إيسوفلوران على الثدييات الصغيرة، وتستخدم الخنازير الوليدية. الخنازير تشترك المزيد من التشابهات نس مع البشر من أي حيوان ثديي آخر، وعلى هذا النحو، تشابهها العصبي العصبي و نيورواناتوميكال جعلها حيوان مثالي لنموذج الثدييات ذات الصلة سريريا من إيدن. كل من البشر والخنازير تمتلك العقول الدماغية، وتقاسم التشابه في الطابع والتوزيع من جيري الدماغ، المادة الرمادية، والمواد البيضاء. و الحصين خنزير صغير، العقد القاعدية، و الدماغ هي أيضا مماثلة طبوغرافيا مماثلة لتلك التي من البشر 7 . من الناحية التنموية، الخنازير هي واحدة من عدد قليل من الثدييات غير البشرية التي تخضع لنمو الدماغ في الفترة المحيطة بالولادة والميلين 8 . في الرحم، كل من العقول البشرية والخنازير تخضع لنمو كبير خلال أواخر الحمل الأشهر الثلاثة. في الارتباط، عند الولادة، والعقول البشرية والخنازير هي 27٪ و 25٪ من العقول الكبار، على التوالي. وقد كشف التصوير بالرنين المغناطيسي أن الدماغ خنزير صغير القديم أسبوع واحد ما يعادل تقريبا إلى الدماغ البشري القديم شهر واحد من حيث نضوج الخلايا العصبية والشجرة التغصنية 9 . بالإضافة إلى ذلك، خنزير صغير والدماغ البشري تشترك في العديد من أوجه التشابه فيما يتعلق أنماط النمو العصبي. على سبيل المثال، فإن التعبير وتسلسل مرنا من ريلين 10 ، والتوزيع الطبوغرافي للخلايا العصبية 5-هت 11 ، وإغلاق الأنبوب العصبي 12 كلها موازية لتلك التي ينظر إليها في البشر. وعلاوة على ذلك، هناك التماثل واسعة بين جينومات الخنازير والبشر 13 .
يجب فهم أهمية نموذج حيواني في سياق علم الأمراض البشرية، ولا سيما فيما يتعلق نضج الدماغ وعلم الأحياء المرضية للرضيع البشري. معظم الدراسات السمية التخدير القائمة تستخدم نموذج القوارض، مع عدد قليل من استخدام غير البشريةنماذج الرئيسيات. ومع ذلك، القوارض والرئيسات قد لا تكون الحيوانات مثالية للتحقيق إيدن.
على الرغم من استخدامها على نطاق واسع، والأدمغة القوارض مختلفة جدا عن تلك البشرية في جميع مراحل التنمية. الأهم من ذلك، القوارض تمتلك الدماغ الدماغية (أو السلس). إن قوارض القوارض تفتقر إلى الغيري والتصلب الذي يتميز به كائنات أكثر تعقيدا عصبيا. يختبر الدماغ القوارض أيضا طفرة نمو الدماغ بعد الولادة 14 ، تختلف عن البشر والخنازير. وقد لوحظ أن هناك اختلافات في ضعف مناطق الدماغ المختلفة لاستنشاق مخدر 15 . لذلك، ينبغي أن يكون من المهم أن نموذج الحيوان لدراسة إيدن تمتلك الدماغ الذي عصبيا و نيورواناتوميكالي مماثلة لتلك التي من الإنسان، وذلك لأفضل نموذج التخدير الناجم عن التغييرات في الدماغ التي من المرجح أن ينظر إليها في المرضى الأطفال. كما هو موضح سابقا، الخنازير تمتلك الدماغ الذي طأفضل بكثير لهذا الدور. وعلاوة على ذلك، فإن الأشكال الشائعة من القوارض اختبار المعرفي العصبي، مثل التعلم المكاني والذاكرة تقييمها في متاهة المياه موريس، ليست ذات صلة مباشرة أو قابلة للمقارنة للتقييمات المعرفية العصبية لدى الأطفال الصغار 16 . واحدة من مزايا استخدام الخنازير لعلم الأعصاب التنموي هو أنها قابلة للغاية للاختبار العصبية المعرفية، حتى في سن مبكرة. وقد استخدمت بنجاح العديد من الاختبارات المعرفية العصبية التي تعتبر مفيدة لأنواع الثدييات الأخرى والتحقق من صحتها في الخنازير. في حين لا يزال حقل متطور، والتقييم المعرفي العصبي في الخنازير يتضمن اختبارات أكثر تعقيدا أن يحاكي بشكل أفضل العجز البشري، مثل اختبار محرك شعاع يميل 17 ، 18 والمرآة اختبار الوعي المكاني 19 . اختبار المحرك مع شعاع يميل، كجزء من دراسة إصابات الدماغ الصدمة في الخنازير، ويظهر موثوقية عالية في التقييممن وظيفة المحرك. اختبار المرآة يدل على الذاكرة من البيئة المحيطة بالإضافة إلى الاعتراف والاستفادة من صورة المنعكسة للحصول على مكافأة الغذاء.
من ناحية أخرى، قد تكون الرئيسيات غير البشرية نموذجا أكثر ملاءمة لدراسات تخدير الأطفال، ولكن هناك عدد من العوامل الباهظة، بما في ذلك التكلفة وصعوبة الاستخدام. بالإضافة إلى ذلك، فهي حساسة للغاية لظروف تربية في وقت مبكر، وخاصة الإجهاد وفصل الأمهات 20 . العوامل الهامة لدراسة إيدن، مثل المحاكات ألوستيريك، ارتباطات مستقبلات يجند، التعديلات بعد متعدية، تركيبات فرعية مستقبلات، والمتغيرات البديلة الربط، غير معروفة في حالة الرئيسيات. وذلك لأن الجينات ذات الصلة بهذه المفاهيم لم تستنسخ. في المقابل، تم استنساخها في الخنازير. على هذا النحو، لم يتم سوى عمل محدود في الرئيسيات غير البشرية 21 ، 22 .
نموذج خنزير صغير يستفيد من مزايا النماذج القوارض وغير البشرية الرئيسيات: أنها فعالة من حيث التكلفة، وسهلة الاستخدام بالنسبة لدراسات الرئيسيات غير البشرية، و نيوراناتوميكالي والعصبية مشابهة للدماغ البشري للأطفال. وقد نمت استخدام خنزير صغير في أبحاث علم الأعصاب في السنوات الأخيرة، بما في ذلك عدد من الدراسات التي فحصت الظروف نيوروينفلاماتوري الأطفال. آثار العدوى الفيروسية في الجهاز التنفسي على الحصين والتعلم المكاني 23 ، والحد من موت الخلايا الدماغية بعد السكتة الدماغية 24 ، تكوين الخلايا العصبية التالية إصابات في الدماغ 25 ، والنشاط الإنزيم أثناء المضبوطات 26 هي بعض الدراسات التي استخدمت الخنازير الوليدية. هذه المجموعة الكبيرة والمتنامية من الأدب يضفي قوة لمدى ملاءمة واستدامة نموذج خنزير صغير ذات الصلة سريريا وقابلة للتكرار للغاية لدراسة أنسثالعصبية التي يسببها سيا.
Protocol
يتم الحصول على الخنازير المنزلية صحية (سوز سكروفا ) من مزرعة وافقت عليها جامعة ولاية أوهايو المؤسسية رعاية الحيوان واستخدام اللجنة (إاكوك). يتم تنفيذ جميع التجارب على الحيوانات وفقا لسياسة إاكوك جامعة ولاية أوهايو، بعد موافقة البروتوكول.
1. الحيوانات ومعالجة الحيوانات
- استخدام الخنازير الذكور في هذه التجربة للقضاء على الآثار الخلط المحتملة للجنس. ملاحظة: إذا كانت الأهداف التجريبية تشمل تقييم آثار التجربة على الحيوانات بينما في فترة نمو الدماغ القصوى، لا تستخدم الخنازير الأكبر سنا من 14 يوما.
- جدولة الخنازير للوصول في فيفاريوم 24 ساعة على الأقل قبل التجريب للسماح للتأقلم مع البيئة.
ملاحظة: فنيين بيطريين مدربين يشرف عليهم الأطباء البيطريون المرخصون يقدمون رعاية حيوانية روتينية.- الحفاظ على الخنازير في أقفاص التحكم في درجة الحرارة الفردية وإعطاء نوتريتيونالي كاملة، حليب خنزير صغير التجارية ليبيتوم الإعلانية . توريد الحيوانات مع بطانية ولعبة. مراقبة باستمرار درجة الحرارة في حاويات الحيوان.
- ولإجراء دراسة الجدوى الأولية هذه، استخدم 18 خنزير صغير لذراع الأيزوفلوران و 22 خنزير صغير لذراع التحكم. إجراء حسابات حجم العينة بناء على تصميم الدراسة عندما يكون ذلك ممكنا. عشوائيا الخنازير المتاحة إما السيطرة أو مجموعة التعرض لطول مناسب من التعرض. من الخبرة، حتى مع العديد من المحققين، ونتوقع أن تكون قادرة على أداء ما لا يزيد عن 2 التجارب يوميا (مجموع 2 الحيوانات).
2. الحيوانات السيطرة
- لا تقم بإجراء التدخل التجريبي على الحيوانات السيطرة.
- استخلاص التخدير العام العميق عن طريق قناع مخروط الوجه لإجراء نضح وجمع الأنسجة. على وجه التحديد، بعد فترة التأقلم 24 ساعة، تخدير الخنازير مع 5٪ إيسوفلوران أو 8٪ سيفوفلوران في الأكسجين 100٪ <إم> عبر قناع مخروط الوجه. لا تستخدم ديسفلوران للتحريض.
ملاحظة: يجب أن يكون الوقت بين تحريض التخدير ومؤسسة نضح بس الباردة قصيرة قدر الإمكان. يمكن الفنيين ذوي الخبرة إكمال هذه العملية في أقل من 5 دقائق.- تأكيد عمق كاف من التخدير بسبب عدم وجود منعكس ديوكلاو قرصة باستخدام المشبك الجراحي.
- لتجنب الإهانات نقص الأكسجة / الدماغية إلى الدماغ، ورصد الخنزير باستخدام مقياس التأكسج النبض لضمان الحفاظ على الأوكسجين كافية، والتهوية، والانتاج القلبي حتى نضح من الفوسفات البارد مخزنة المالحة (بس) يبدأ.
ملاحظة: لتوفير حماية إضافية ضد تلف الأنسجة، حزمة الحيوان (بما في ذلك الرأس) في الجليد بعد تحريض التخدير.
- إجراء نضح ترانسكاردياك.
ملاحظة: لأن بارافورمالدهيد يستخدم، وينبغي إجراء إجراء نضح تحت غطاء الدخان أو على جدول دوندرافت.- جعل كرانيوكودال طنسيسيون على طول طول القص باستخدام مشرط. وينبغي أن يكون عمق شق كافية لفضح القص.
- بعناية، إجراء القص خط الوسط مع زوج من مقص الثقيلة حاد، وتجنب الأضرار التي لحقت القلب والرئتين، أو الحجاب الحاجز. إذا لزم الأمر، ضع إصبع وضعت بين الجانب الخلفي من القص والمحتويات داخل الصدر لتجنب الإصابات. مناورة إصبع في المنصف من خلال جعل صغيرة (حجم الإصبع) شق في الحجاب الحاجز.
- بعد دخول تجويف الصدري، والحفاظ على القفص الصدري فتح باستخدام ريكتراكتور الاحتفاظ الذاتي.
- شق التامور باستخدام ملقط وزوج من مقص، وفضح القلب الضرب. توخ الحذر لتجنب إصابة القلب.
- تحديد البطين الأيسر ووضع بعناية قنية (مثل أنجيوكاثيتر 14 G) من خلال قمة البطين. إزالة الإبرة، وترك القسطرة في مكانها.
ملاحظة: توخ الحذر لعدم ثقب الجدار الخلفي للبطين.عودة الدم النابض من القسطرة تشير إلى أنه يتم وضعها بشكل صحيح. يمكن بسهولة أخذ عينات من الدم من الحيوان في هذه المرحلة. - بعد تحديد الأذين الأيمن، وإجراء بضع الشريان عن طريق إجراء شق كبير في الأذين مع مقص للسماح لل إكسانغينييناتيون والهروب من بيرفوسيت.
ملاحظة: يجب أن تستمر إيسوفلوران عن طريق استنشاق حتى يتم تأكيد وفاة القلب. يتم تأكيد الموت القلبي من قبل نقص ملحوظ لوحظ من الناتج القلبي.
- يروي خنزير صغير باستخدام بيرفوسيت تتكون من البرد (4 ° C) الفوسفات مخزنة المالحة (بس) التي تحتوي على الهيبارين بتركيز 5 وحدات لكل مل. يروي في 300 مل لكل دقيقة لمدة 5 دقائق أو حتى يتم تشغيل الحل واضح.
- توخ الحذر من أن قنية نضح لا تصبح طرد أثناء نضح. استخدام مضخة تحوي المتاحة تجاريا لهذا وجميع بيرفوسيونس الأخرى.
- إجراء استئصال هيمكرانيكتومي لإعادةنقل نصف الكرة الأرضية من الدماغ لتحليل الأنسجة الطازجة.
ملاحظة: هذا البروتوكول يسمح لاسترجاع نصف الكرة واحدة من أنسجة المخ الطازجة. نصف الكرة الآخر ثابت. إذا لم يكن هناك حاجة الأنسجة الطازجة، انتقل إلى الخطوة 2.6.- خلال هذا الإجراء، والاستمرار في تعميم برنامج تلفزيوني الجليد الباردة بمعدل 50 مل في الساعة للتأكد من أن الدماغ لا يزال باردا.
- إجراء شق طولي في فروة الرأس على طول طول خياطة السهمي حتى الثقبة ماغنوم باستخدام مشرط. خلال هذه العملية، استخدم ضغط الشركة لخلق النتيجة في الجمجمة. تعكس فروة الرأس لفضح الجمجمة بأكملها.
- باستخدام رونجورس وبداية في ماغنوم الثقبة، وإزالة الجمجمة على جانب واحد عن طريق إدراج رونجورس بين الجمجمة والأم الجافية، وذلك بحذر لعدم إصابة أنسجة المخ الكامنة. إزالة العظام في القطع، وذلك باستخدام رونجورس لابعاد بعيدا عن حمة الدماغ.
- مرة واحدة وقد تم إزالة الجمجمة، شق وإزالة دواستخدام مقط باستخدام مقص ومقص، مرة أخرى باستخدام الحذر بعدم إصابة أنسجة المخ الكامنة.
- وضع شفرة مشرط بين نصفي الكرة الأرضية لتقسيم بعناية الجسم الثفني.
- باستخدام أداة مسطحة مثل نهاية مقبض واسع من ملقط، التراجع بلطف الفص الجبهي، وقطع تدريجيا الأعصاب القحفية، والعمل الأمامي إلى الخلفي. في الجانب الخلفي أكثر من نصف الكرة الأرضية، واستخدام مشرط لقطع الحبل الشوكي. إزالة كتلة نصف الكرة الأرضية .
ملاحظة: الأنسجة الدماغ غير مثبت هشة. توخي الحذر عند إزالة نصف الكرة الأرضية لمنع انقطاع إمدادات الدم في نصف الكرة الأرضية المتبقية. - قسم نصف الكرة إزالة. إذا أشار، على الفور فلاش تجميد في 2-ميثيلبوتان تبريد إلى -160 درجة مئوية في حمام النيتروجين السائل لتجنب انهيار الأنسجة، وتخزينها على الفور في -80 درجة مئوية لتحليلها لاحقا.
ملاحظة: نوصي باجتزاء الدماغ كورونالي في الزيادات 2 ملم باستخدام مصفوفة، ولكن ديتاي محددةلس من سيكتيونينغ تعتمد على أهداف تجريبية محددة.
- تغيير بيرفوسات إلى بارافورمالدهيد 4٪ (بفا). مواصلة نضح بفا في 300 مل في الدقيقة الواحدة لا يقل عن 5 دقائق.
الحذر! بفا هو سامة، وتجنب الاتصال مع الجلد والعينين، أو الأغشية المخاطية. لا يستنشق أبخرة بفا. - نتوقع الجسم خنزير صغير لتصلب بسبب تشكيل ألدهيد عبر الروابط التي يتم إنشاؤها في العضلات. بعد نضح بفا كاملة، وإزالة نصف الكرة الأرضية المتبقية بطريقة مماثلة لتلك المذكورة في الخطوة 2.5.5.
ملاحظة: سوف بيرفوسد الدماغ بشكل صحيح يكون شاحب تماما إكسانغيناتد.- وضع نصف الكرة الأرضية المتبقية في وعاء صغير مع الطازجة بفا 4٪ في 4 درجات مئوية. الحفاظ على نصف الكرة في بفا لمدة 24-48 ساعة لاستكمال عملية التثبيت.
- بعد 24-48 ساعة، نقل الدماغ ثابتة إلى حل من برنامج تلفزيوني يحتوي على 0.1٪ أزيد الصوديوم، كما أنه من الضروري لمنع الإفراط في التثبيت. الإفراط في التثبيت يمكن أن يؤدي إلى ماسملك حاتمة أو قوية غير محددة تلطيخ الخلفية. إضافة أزيد الصوديوم يمنع نمو البكتيريا.
ملاحظة: يمكن تخزين الأنسجة لمدة تصل إلى شهر واحد في 4 درجات مئوية.
3. إيسوفلوران (التجريبية) الحيوانات
ملاحظة: يمكن استخدام أي مخدر أو تدخل، ولكن نحن لا ننصح ديسفلوران لاستنشاق الاستقراء.
- تحريض وصيانة التخدير:
- إجراء التخدير باستخدام محطة عمل التخدير السريري مجهزة أجهزة التنفس الصناعي للأطفال وأجهزة الرصد.
- بعد فترة التأقلم 24 ساعة، تخدير الخنازير مع سيفوفلوران 8٪ في 100٪ O 2 عبر قناع مخروط الوجه.
- مراقبة مستمرة قياس النبض، ضغط الدم غير الغازية، تخطيط القلب، ودرجة الحرارة خلال فترة الاستقراء وفي جميع الأوقات أثناء إجراء الدراسة.
- بعد الاستقراء، معايرة سيفوفلوران أو إيسوفلوركض إلى التركيز الذي يسمح لعمق كاف من التخدير مع ضمان التنفس التلقائي المستمر (عادة بتركيز 3-4٪).
- وضع 24 غرام الطرفية القسطرة في الوريد في الوريد الأذن الهامشية ( الشكل 1 ).
- وضع خنزير صغير في موقف راقد ظهري للتنبيب الرغامي ( الشكل 2 ، لوحة A). استخدام ميلر # 1 أو شفرة 1.5 لتسهيل الأجهزة من البلعوم السفلي والتنبيب من القصبة الهوائية. ملاحظة: هناك حاجة إلى مشغل ومساعد من ذوي الخبرة أثناء تنظير الحنجرة.
- يكون مساعد تهجير لسان الحيوان باستخدام الشاش الجاف لتسهيل التعرض للحنجرة والتصور من الحبال الصوتية ( الشكل 2 ب ).
ملاحظة: الخنازير خنزير صغير مماثلة شكليا لتلك التي من البشر ( الشكل 2 C ). ال التعريف، خنزير صغير، صخبا، كوردس يمكن أن يكون من الصعب تصور لأنها عدة مليمترات عميقة داخل مدخل الحنجرة ( الشكل 2 D ). - تهجير النهايات: ضع غيض من شفرة منظار الحنجرة تحت المزمار ورفع الشفرة صعودا لفضح الحنجرة.
- قبل وضع الأنبوب في القصبة الهوائية، رذاذ الحبال الصوتية مع 0.5 مل من 2٪ ليدوكائين لمنع تشنج الحنجرة خلال مرور الأنبوب الرغامي، كما الخنازير عرضة بشكل خاص لتشنج الحنجرة.
- يكون مساعد تهجير لسان الحيوان باستخدام الشاش الجاف لتسهيل التعرض للحنجرة والتصور من الحبال الصوتية ( الشكل 2 ب ).
- وضع وتأمين أنبوب القصبة الهوائية 3.0 مم مكبل.
- ضمان أصوات التنفس الثنائية وثابتة ثاني أكسيد الكربون المد والجزر باستخدام تسمع الصدر مع سماعة الطبيب و إتكو 2 الرصد.
- تضخيم الرئتين خنزير صغير لضغط مجرى الهواء المستمر من 20 سم H 2 O. ثم، تضخيم صفعة من أنبوب الرغامي إلى الحد الأدنى من الضغط المطلوب لمنع تسرب الهواء عند ضغط 20 سم H 2 O، والاستماع عبر القصبة الهوائية لتحديد تسرب الهواء إذا كان موجودا.
ملاحظة: هذا مهم لمنع نقص تروية المخاطية خلال متقطعة التهوية الضغط الإيجابي. - يتم الحفاظ على نورموكسيا و نورموكاربيا خلال التخدير.
- بدء إدارة 2٪ إيسوفلوران في 50٪ الأكسجين / 50٪ الهواء. معايرة الأكسجين للحفاظ على باو 2 من 90 - 100 مم زئبق. استمر لمدة 3 ساعات (أو المدة التجريبية المطلوبة).
- تطبيق مرهم العيون على العينين لمنع جفاف لمدة التخدير.
- تبدأ قسطرة الشريان الفخذي بعد بدء 2٪ إيسوفلوران.
- إدارة المضادات الحيوية واسعة الطيف قبل شق (سيفازولين، 25 ملغ / كلغ) عن طريق خط الوريد المحيطي لمنع العدوى الموقع الجراحي.
- تعقيم كل من الفخذ باستخدام كلورهكسيدين ملون لضمان الحقل العقيمة المناسب، ووضع ثنى العقيمة المناسب ( الشكل 3 B ). كحد أدنى، يجب على الموظفين المشاركين في جراحة البقاء على قيد الحياة ارتداء غطاء الجراحية، قناع، قفازات معقمة، وحماية العين.
- جس النبض الفخذي في تجعد الأربية باستخدام مؤشر والأصابع الوسطى.
- جعل سطحية، 1.5 سم، شق كرانيوكودال باستخدام مشرط ( الشكل 3 C ).
- تشريح بين اثنين من رؤساء العضلات غراسيليس باستخدام أداة حادة، مثل مرقئ الجراحية أو مقص حادة يميل ( الشكل 3 D ).
ملاحظة: يتم العثور على حزمة وعائية عصبية الفخذ عادة بين وعمق فقط لهذه العضلات اثنين. ( الشكل 4 ألف ). - باستخدام حلقات الأوعية الدموية أو العلاقات الحريرية، وعزل الشريان في نهاية القريبة والقاصي. استخدام حلقة لسحب الشريان تصل إلى مستوى الجلد عن بعد ( الشكل 4 B ).
- في حينووضع الجر على التعادل القريبة كافية لوقف تدفق الدم، وجعل بضع الشريان الصغيرة مع زوج من مقص بضع بضع.
- توخ الحذر لعدم انتقال الشريان. وهناك بضع الشريان الصغيرة كافية. بدلا من ذلك، استخدم نهج إبرة والأسلاك للوصول إلى الشريان ( الشكل 4 C ).
- سوف الجر لطيف على التعادل القريبة منع فقدان الدم المفرط في أي لحظة خلال هذا الجزء من الإجراء. إذا باستخدام نهج الإبرة والأسلاك، وتمرير سلك التوجيه (المرفقة مع عدة أو الحصول على حدة) من خلال الإبرة وفي الشريان تصل إلى 5 سم.
- توخي الحذر لعدم دفع السلك أبعد لأنها يمكن أن تسبب إكتوبي البطين. سحب السلك فورا 1-2 سم إذا حدث هذا.
- إزالة الإبرة من السفينة، مع الحرص على ترك سلك دليل في السفينة. تمر بلطف القسطرة على السلك وفي السفينة ( الشكل 4 D).
- استخدام 3-الفرنسية، 8 سنتيمتر القسطرة لقسطرة الشريان الفخذي. نتوقع مقاومة خفيفة عندما يدخل طرف القسطرة أولا الجدار السطحي للسفينة.
- إذا كنت تستخدم نهج بضع الشريان، تقدم القسطرة أو أنابيب البولي ايثيلين مباشرة في الوعاء. وينبغي ملاحظة عودة الدم فورا.
- على الفور إرفاق القسطرة تعلق على محول الضغط. تدفق القسطرة مع المياه المالحة العادية للحفاظ على المباحرة القسطرة.
- وضع الغرز لتأمين القسطرة في المكان. تغطية شق مع الشاش معقم لمنع التلوث. استخدام نهج عن طريق الجلد لقسطرة الشريان الفخذي.
ملاحظة: تأكد من أن الموجات فوق الصوتية يتم تنفيذها من قبل فني من ذوي الخبرة.
- وضع الغرز لتأمين القسطرة في المكان. تغطية شق مع الشاش معقم لمنع التلوث. استخدام نهج عن طريق الجلد لقسطرة الشريان الفخذي.
- الظروف داخل المنطوق والرصد:
- نشط الحارة خنزير صغير مع جهاز الاحترار القسري ورصد باستمراردرجة حرارة المستقيم ( الشكل 3 A ).
- يحتوي على سكر العنب، سائل متساوي التوتر (5٪ سكر العنب في اللاكتات رينغر أو المالحة العادية) في معدل الصيانة (4 أضعاف وزن خنزير صغير في كيلوغرام، مل / ساعة).
- مراقبة العلامات الحيوية للاضطرابات (انخفاض ضغط الدم، عدم انتظام ضربات القلب، نقص / ارتفاع الحرارة، نقص الأكسجة)
ملاحظة: نطاقات علامة الحيوية العادية والإدارة المقترحة المقابلة في حالة تشوهات تلخص في الجدول 1 . - باستخدام نظام تحليل الدم المتاحة تجاريا، وقياس غازات الدم الشريانية (الرقم الهيدروجيني الشرياني، 2 ، بو 2 )، الشوارد (بيكربونات، قاعدة الزائدة / العجز، الصوديوم والبوتاسيوم والكالسيوم المؤين)، الهيموغلوبين، والجلوكوز على الأقل كل ساعة خلال التجربة فترة. رسم عينة الدم الشرياني من القسطرة الشريان الفخذي.
ملاحظة: عادي حمض قاعدة والقيم المنحل بالكهرباء جنبا إلى جنب مع توصيات لتصحيح إذا شوهدت تشوهات أويرد موجز لها في الجدول 1 .
- بعد 3 ساعات من التعرض إيسوفلوران، وإزالة القسطرة الشريان الفخذي.
- ربط بعناية أسفل الحرير الأوعية الدموية القريبة إلى انسداد دائم الشريان الفخذي لمنع النزيف. بدلا من ذلك، استخدم مقطع الأوعية الدموية.
- ضمان الارقاء الكامل قبل إغلاق شق. ري شق مع 10-20 مل من محلول ملحي معقم للمساعدة في منع العدوى.
- في ختام التجربة، وإغلاق شق الجلد مع بسيطة، والخيوط توقف باستخدام 3-0 غير قابلة للامتصاص خياطة المواد.
- التسلل الجرح باستخدام 0.5-1 مل / كغ من بوبيفاكين 0.25٪ مع 1: 200،000 ادرينالين للسيطرة على الألم. معطف شق مع معقمة، لاصقة الجلد الجراحية.
ملاحظة: لا يلزم ارتداء الملابس.
- التسلل الجرح باستخدام 0.5-1 مل / كغ من بوبيفاكين 0.25٪ مع 1: 200،000 ادرينالين للسيطرة على الألم. معطف شق مع معقمة، لاصقة الجلد الجراحية.
- التوقف عن مخدر والسماح للخنزير الصغير أن يوقظ.
- إزالة الأنبوب الرغامي على علامات أوا(فتح العينين، ومحاولات الوقوف، والركل، وفتح وإغلاق الفم)، مع علامات ديناميكا الدم مستقرة، الأوكسجين كافية، والتهوية الكافية.
- بعد الانقلاب، توريد الأكسجين التكميلي عن طريق مخروط الوجه حتى يتم ضمان كفاية الأوكسجين والتهوية.
- إدارة البوبرينورفين 0.05 ملغ / كغ تحت الجلد لمراقبة إضافية الألم. بدلا من ذلك، يمكن استخدام الفنتانيل عبر الجلد.
- عند الاقتضاء، قم بإرجاع الخنزير الصغير إلى قفصه في المنزل. لا تترك خنزير صغير غير المراقب حتى استعاد وعيه كافية للحفاظ على الاستلقاء القصية. لا تعود الحيوان إلى قفص مع الحيوانات الأخرى حتى تعافى تماما من التخدير.
- بنشاط دافئ قفص المنزل الخاص مع ضوء الاحترار.
- مراقبة عن كثب الحيوان بعد التخدير من قبل الموظفين البيطريين أو البحوث المدربين. توفير استبدال حليب خنزير صغير.
- السماح للخنازير لاستردادلمدة 48-72 ساعة، اعتمادا على الأهداف التجريبية.
- حقن خنازير مع البوبرينورفين تحت الجلد في جرعة مناسبة، كل ثلاث ساعات حسب الحاجة لضمان السيطرة على الألم، وفقا لتقدير موظفي رعاية الحيوان من ذوي الخبرة للسيطرة على الانزعاج بعد الجراحة في الحيوانات.
- مراقبة الخنازير كل ساعة لأول 6 ساعات بعد الجراحة وكل 4 ساعات بعد ذلك. أداء التضحية الحيوانية وشراء الأنسجة بطريقة مماثلة للسيطرة على الحيوانات، وصفها أعلاه.
النتائج
تم دراسة 40 خنزير صغير (18 إيسوفلوران، 22 سيطرة). كانت إجراءات الدراسة جيدة التحمل من قبل جميع الحيوانات. وكانت جميع الخنازير درس الذكور. لم يكن هناك فرق كبير بين المجموعات فيما يتعلق بالعمر أو الوزن ( الجدول 2، الشكل 5 ). ويرد في الجدول 3 متوسط قيم المختبر أثناء التجريب في مجموعة الأيزوفلورين. هذه القيم تثبت أن البروتوكول التجريبي يمتلك الاتساق الداخلي واستنساخ، كما كان لدينا الفنيين متعددة أداء الجراحة على مدى عامين. غير المدفوعة من قبل هذه الأرقام هي العديد من التعديلات والتصحيحات كان علينا أن تؤدي خلال العمليات الجراحية للحفاظ على الارقاء الفسيولوجية. كو 2 الاحتفاظ، وانخفاض درجة حرارة الجسم الأساسية، ونقص السكر في الدم هي بعض من الخلط العديد من أننا تجنبها من خلال الرصد الشامل والتكيف حسب الضرورة.
t "فو: كيب-together.within-بادج =" 1 ">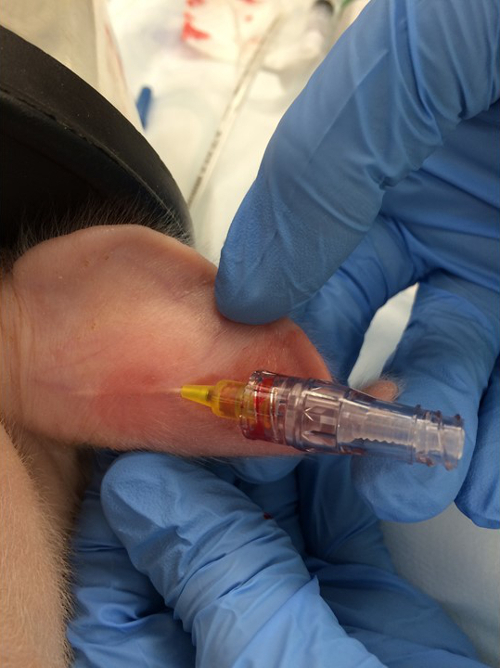
شكل 1:. وضع الخط الوريدي المحيطي. يتم وضع قسطرة الوريد 24 G في الوريد الأذن الهامشية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
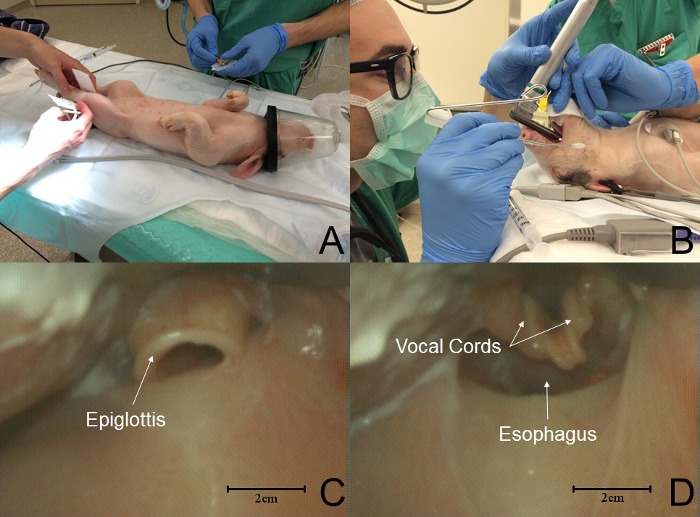
الشكل 2: تسلسل الأحداث في التنبيب الخنزير الصغير. ( أ ) يتم وضع الخنازير في موقف راقد الجانبية للتنبيب. يتم وضع شاشات قياسية. ( ب ) مساعد نازح اللسان من تجويف الفم في حين أن تنظير الحنجرة يؤدي تنظير الحنجرة. ( C ) و ساق المزمار مماثلة شكليا لتلك التي من الإنسان. في هذا الرسم، غيض من الe شفرة في فالكولا. ( د ) تشريح الحنجرة الخنازير يختلف بشكل واضح عن ذلك من البشر. الحبال الصوتية هي عدة مليمترات عميقة إلى مدخل الحنجرة. في هذا الرسم، غيض طرف النصل من المزمار، وتعريض الحنجرة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
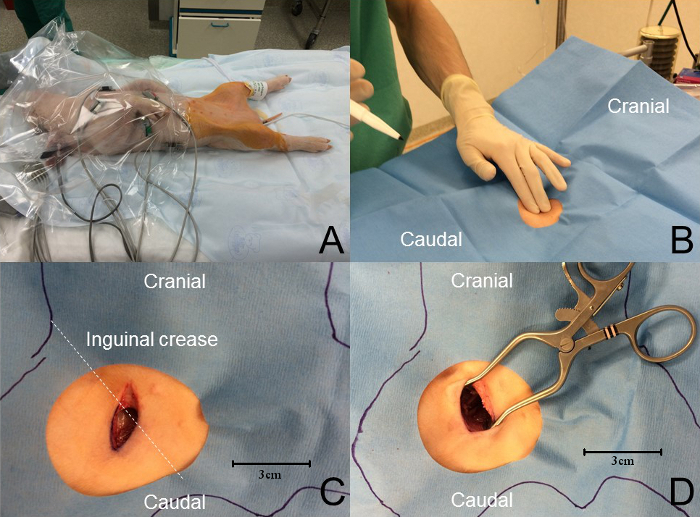
الشكل 3: نهج الشريان الفخذي. ( A ) يتم الحفاظ على درجة حرارة الحيوان باستخدام جهاز الاحترار القسري. ويستخدم الرصد طوال العملية. يتم إعداد حقل معقم واسعة مع الكلورهيكسيدين ملون والحيوان مغطاة ثنى معقمة فينستراتد. ( ب ) الجس في تجعد الأربية يكشف نبض الفخذ. ( C ) A كرشق الجلد أنيوكودال، عمودي تقريبا على تجعد الأربية وحوالي 1.5 سم في الطول، ويتم تنفيذ المغطي نبض الفخذ. ( D ) ويتحقق تشريح حادة لفضح حزمة وعائية عصبية الفخذ. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
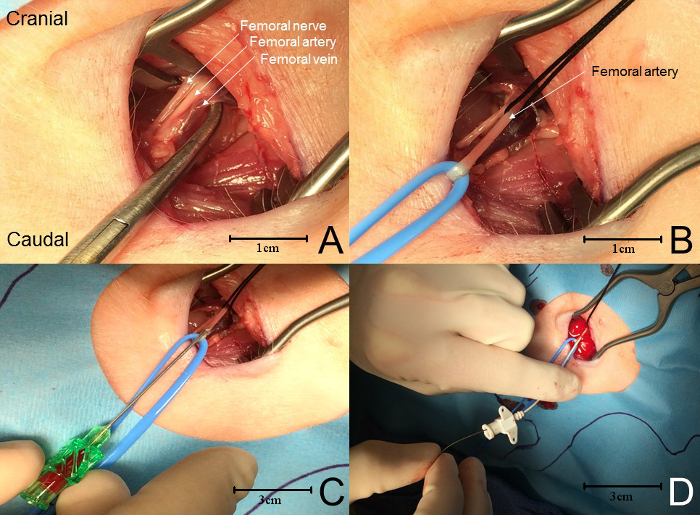
الشكل 4: قنية الشريان الفخذي. ( A ) من الوحشي إلى الإنسي، حزمة عصبية وعائية تحتوي على العصب الفخذي، والشريان، والوريد. ( ب ) يتم عزل الشريان الفخذي باستخدام حلقات السفينة و / أو خياطة. استمرار التوتر على التعادل القريبة يمنع فقدان الدم المفرط في حين ثقب الشريان (انظر تبييض السفينة). ( C ) يتم استخدام إبرة لثقب الفخذ أريتري، تجنب ثقب الجدار الخلفي للشريان. عندما يعود الدم، يتم توجيه سلك التوجيه في الشريان من خلال الإبرة. ( D ) تتم إزالة الإبرة والقسطرة متقدمة على سلك التوجيه في الشريان الفخذي. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
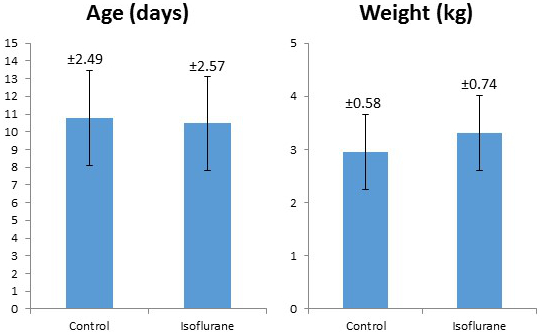
الشكل 5: مقارنة متوسط وزن وعمر السيطرة والخنازير المعالجة إيسوفلوران. تمثل أشرطة الخطأ الانحراف المعياري +/- 1، مع الإشارة إلى قيمة الانحراف المعياري فوق كل شريط خطأ.
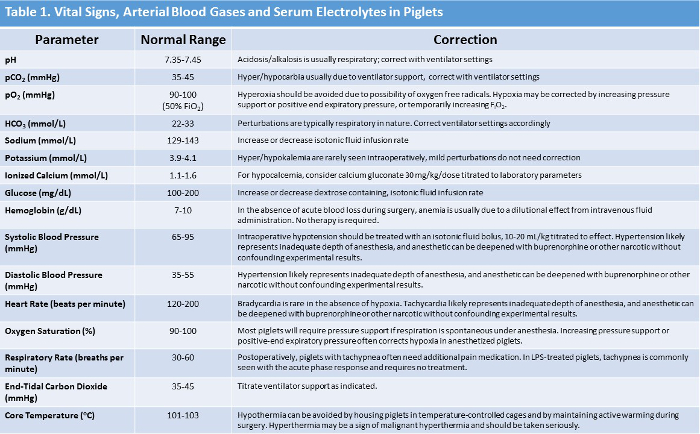
الجدول 1: ملخص علامات الحيوية خنزير صغير، أرتيريآل غاز الدم، والقيم المنحل بالكهرباء مع طرق التصحيح المقترحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الجدول.
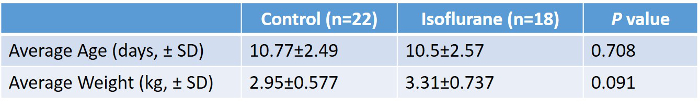
الجدول 2: ملخص متوسط وزن وعمر السيطرة مقابل الخنازير المعالجة إيسوفلوران. تم إجراء اختبار T تيليد غير مثبت، ولم يظهر أي فرق كبير بين المجموعتين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الجدول.
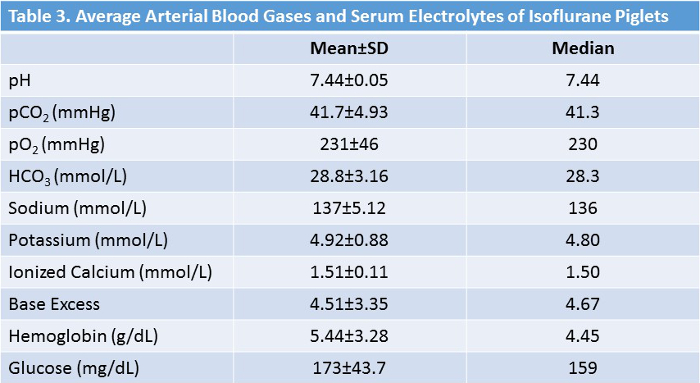
الجدول 3: متوسط العلامات الحيوية والقيم المختبرية للحيوانات المعالجة إيسوفلوران. خلال الدورةوالجراحات الإلكترونية، والانحرافات من العلامات الحيوية والقيم المختبرية من النطاقات العادية يتم تصحيحها على وجه السرعة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الجدول.
Discussion
خطوات البروتوكول الحرجة / تحري الخلل وإصلاحه
ومع بدء التجربة، يجب أن تبدأ مراقبة العلامات الحيوية غير الغازية بالحث. ضغط الدم، ومعدل ضربات القلب، وتشبع الأكسجين، ودرجة الحرارة المستقيم يمكن الحصول عليها بسهولة ورصدها. يجب أن يكون خنزير صغير تحت جهاز تدفئة الهواء للحفاظ على درجة حرارة الجسم الأساسية الكافية، وهذه الحيوانات يمكن أن تصبح انخفاض حرارة الجسم بسرعة تحت التخدير العام. وضع الفوري للقسطرة الوريدية الطرفية يسمح لعلاج حالات الطوارئ إذا ظهرت خلال الحث. من المهم أن نراقب باستمرار خنزير صغير، نونينفاسيفيلي أو إنفاسيفيلي، في جميع أنحاء كل من الإجراء إيسوفلوران وإجراء التضحية. يمكن للخنزير تجربة الشرايين تشبع الأكسجين بسرعة كبيرة خلال خطوات متعددة في جميع أنحاء البروتوكول، وخصوصا أثناء إدارة مجرى الهواء والتنبيب. نحن نستخدم 8٪ سيفوفلوران للحث على التخدير من أجل تكرار ممارسة طب الأطفال البشري و سبيd التعريفي. ومع ذلك، تم استخدام 5٪ إيسوفلوران بنجاح ومناسبة. وبالنظر إلى الاختلافات في التشريح وإمكانية تشنج الحنجرة، يمكن أن يكون من الصعب أن خنزير صغير. إذا بدأ خنزير صغير في تشبع أثناء إدارة الحث و / أو مجرى الهواء، وينبغي أن تدار على الفور 100٪ الأكسجين وسيفوفلوران عن طريق مخروط الوجه من أجل إعادة تأمين مستوى تشبع الأكسجين آمنة وعمق كاف من التخدير. نضع في اعتبارنا أنه في حين أن الطائرة من التخدير يجب أن تكون عميقة بما فيه الكفاية للسماح التنبيب، والتخدير المفرط قد يؤدي إلى انقطاع النفس. مطلوب اليقظة المستمرة فيما يتعلق بالتهوية الحيوانية والأكسجين، مع المعايرة من مخدر استنشاق وفقا لذلك. وبعد ذلك يمكن إعادة التنبيب بعد استعادة الأوكسجين وتم تحقيق التخدير الكافي. قد يتم محاولة التهوية الضغط الإيجابي عبر مخروط الوجه، ولكن عادة ما تكون غير ناجحة. إذا يحدث تشنج الحنجرة، وتطبيق محلول يدوكائين مباشرة إلى فوكيشار إلى الحبال للسماح التنبيب الرغامي.
يجب أن تكون الأدوية في حالات الطوارئ متاحة دائما، وينبغي أن تدار حسب الحاجة خلال الأجزاء الحرجة من البروتوكول لتصحيح الاضطرابات الفسيولوجية. في حين أن مناقشة مستفيضة عن استخدام المخدرات التخدير والطوارئ في الخنازير هو خارج نطاق هذه المخطوطة، سويندل "الخنازير في المختبر: الجراحة والتخدير والتصوير، والتقنيات التجريبية" هو مورد ممتاز. 27
وبالمثل، قد يبدأ خنزير صغير في تشبع بسرعة خلال التضحية، بعد فتح تجويف الصدر خلال القص الأوسط خط الوسط. المشغل يجب أن تعمل بسرعة ولكن بأمان لفضح القلب وإدراج أنجيوكاثيتر لبدء برنامج تلفزيوني الباردة. وهناك حاجة إلى نضح الباردة الباردة بس (والتثبيت السريع مع بفا، إذا أشار) لمنع الضرر الدماغية في الدماغ.
مرة واحدة وقد تم تنبيب خنزير صغير، ريسييبدأ المعدل التنفسي وتتبع ثاني أكسيد الكربون في نهاية المد والجزر ( الجدول 1 ). استقرار الأكسجين في المد والجزر نهاية المد والجزر من خلال المعايرة دعم التنفس الصناعي مع الحفاظ على التخدير المناسب. نحن نستخدم التهوية الميكانيكية لتقليد ما يستخدم في البشر قدر الإمكان. يجب تجنب فرط التأكسج لتقليل فرصة الإجهاد التأكسدي.
خنازير الأيزوفلورين الخضوع لعملية قنية الشريان الفخذي لسببين: لمراقبة ضغط الدم الشرياني بشكل مستمر. ولعينة الدم الشرياني لتقييم حالة الحمضي القاعدي، غازات الدم، والشوارد في جميع أنحاء الإجراء. القنية من الشريان الفخذي يمكن أن يكون تحديا. يرجى الاطلاع على الفيديو للحصول على تفاصيل كاملة. لتجارب البقاء على قيد الحياة، وينبغي أن يتم هذا الإجراء في بيئة عمل معقمة في ظل ظروف معقمة. بعد قنية من الشريان الفخذي، تبدأ مراقبة كل ساعة من غاز الدم الشرياني والشوارد في الدم، وتصحيح حسب الضرورة لالحفاظ على التوازن ( الجدول 1 ). يجب أن يتلقى الخنزير الصغير سائل متوازن متساوي التوتر يحتوي على سكر العنب للحفاظ على نسبة كافية من الجلوكوز في الدم. خلال التجربة، يجب مراقبة الحيوان بشكل مستمر من أجل الحرارة المعيارية، وينبغي توفير الاحترار بالهواء القسري حسب الحاجة. من المهم أيضا تجنب انخفاض حرارة الجسم وارتفاع الحرارة.
في حين يوفر هذا البروتوكول نصف الكرة واحدة من الدماغ "جديدة" ونصف الكرة الأرضية واحدة من الأنسجة العصبية الثابتة، وهذا يمكن تكييفها بسهولة لاستيعاب تصاميم الدراسة البديلة. ويمكن جمع عينات إضافية من خنزير صغير أيضا. يمكن الحصول على كسف بعد تخدير خنزير صغير، مع أو بدون توجيه التنظير. ويمكن أيضا أن يتم جمع الدم من خنزير صغير في مراحل مختلفة من البروتوكول، بما في ذلك من القسطرة الشريان الفخذي، وكذلك مباشرة من البطين الأيسر عن طريق أنجيوكاثيتر مباشرة قبل نضح. ويمكن أيضا إطالة فترة النقاهة أو ش أورتيند، لفحص الاستجابة المزمنة أو الحادة، على التوالي.
قيود التقنية
هذا البروتوكول ونموذج تحديا من الناحية الفنية. مطلوب المحقق الماهر وجناح التشغيل الموردة بالكامل، لا سيما من أجل تجارب البقاء على قيد الحياة. المحقق (ومساعد، لبعض أجزاء من البروتوكول) يجب أن تكون مريحة مع كل من المكونات الجراحية والتخدير من هذا البروتوكول، والتي قد تتطلب التدريب والخبرة لإتقان. وتشمل القيود الأخرى على حساب الخنازير بالنسبة لنماذج القوارض، على الرغم من أن نموذج خنزير صغير أقل بكثير من التكلفة من الرئيسيات غير البشرية. في حين أن تكلفة الخنازير تختلف تبعا للمنطقة والمزرعة التي يتم الحصول عليها من الحيوانات، يمكن للمرء أن يتوقع أن تكون تكلفة كل حيوان أقل من 500 دولار، في حين أن الرئيسيات غير البشرية يمكن أن تكون الآلاف من الدولارات لكل حيوان. في تجربتنا، متوسط تكلفة للحيوان هو عادة حوالي 200 دولار.
jove_content "> وأخيرا، وبما أن الغرض من نموذج خنزير صغير لتقليد الدماغ البشري النامية، ينبغي استخدام الخنازير الوليد فقط.الجهاز العصبي المركزي هو الأكثر عرضة للخطر خلال فترة النمو السريع، وفي الخنازير، وتمتد هذه الفترة من قبل ستة أسابيع من الولادة إلى خمسة أسابيع بعد الولادة 8. استخدام الخنازير القديمة أكثر بعدا عن تاريخها البعيدة تحمل خطر إضعاف الصلة السريرية للنموذج خنزير صغير.في حين أن هناك جدل كبير فيما يتعلق "معادلة" من تطوير الدماغ الخنزير الصغير إلى أن من الوليد الإنسان، وهناك تشابه مذهل عندما يتم مقارنة وقت مبكر نمو الدماغ بعد الولادة بين البشر والخنازير.في الولادة، وأدمغة البشر والخنازير هي 27٪ و 25٪ من وزن الكبار، على التوالي 14 بناء على عمل جونسون وزملاؤنا، يمكننا أن نستنتج أن أسبوع خنزير صغير يعادل تقريبا شهر بشري واحد .9 هذه النتائج، على أساس و أولي الدماغ حجم البيانات، تم التحقق من صحة من قبل عمل وركمان والزملاء. 28 اخترنا 7-14 يوم الخنازير القديمة من أجل تقريب الإنسان من 1-2 أشهر من العمر. ومع ذلك، قد يكون من الحكمة استخدام الحيوانات الأصغر سنا (1-5 أيام من العمر) إذا كان الهدف التجريبي هو محاكاة ذروة نمو طفرة الدماغ خنزير صغير. هذا ممكن، حيث يمكن أن يكون الفطام عند الفطام عند الولادة. سيكون لدينا استخدام نموذج خنزير صغير التكيف مع البيانات الجديدة تصبح متاحة فيما يتعلق أوجه التشابه بين نمو الدماغ البشري والخنازير بعد الولادة.أهمية التقنية فيما يتعلق بالطرق البديلة / القائمة
خنزير صغير يمتلك تشابهات لافتة لحديثي الولادة الإنسان، بما في ذلك التشابهات الحرجة في نمو الدماغ والاستجابات الفيزيولوجية المرضية. ولذلك فهو نموذج الثدييات ذات الصلة سريريا والدليل على مفهوم دراسة تشير إلى أن خنزير صغير هو نموذج مناسب لدراسة السمية العصبية مخدرريف "> 29 ، 30. ويمكن أيضا أن تتكيف بسهولة مع أنواع أخرى من البحوث علم الأعصاب التنموي.وقد تم تصميم النموذج للتحقيق، مع السلطة العلمية، ومدى وآلية إيدن التقليل من المخاوف التي الخلط، مثل نقص الأكسجة أو هيبيركاربيا، هي مما تسبب في تلف عصبي يمكن أن يساء تفسيره على أنه التخدير الناجم.لتحقيق ذلك، يتم التعامل مع خنزير صغير مع نفس الجراحة المحيطة بالجراحة ومخدر الظروف والرصد من ذوي الخبرة من قبل المرضى الأطفال.
الاتجاهات المستقبلية والتطبيقات بعد إتقان التقنية
المضي قدما، الخنازير هي أيضا قابلة جدا للاختبار المعرفي العصبي 17 . وهذه السمة تسمح للتقييم الشامل والشامل للنتائج المعرفي العصبي بعد التعرض للتخدير في التجارب المستقبلية. وينبغي أيضا التأكيد على أنه في الإعداد السريري، والأطفال في كثير من الأحيان الخضوع التخدير فورا إجراء فسيولوجي إجهاد (جراحة). التفاعلات بين التخدير والتهاب ما بعد الجراحة وكذلك إصابة العصبية الناتجة و / أو السمية (كما رأينا في القوارض والرئيسيات) تستحق المزيد من الاستكشاف واعتبار كبير. يوفر خنزير صغير حديثي الولادة فريدة من نوعها، نموذج أساسي سريريا ذات الصلة لتأثيرات التخدير على الدماغ النامية دون تأثير مربكة لعملية جراحية (محاكاة السيناريوهات السريرية الشائعة في الأطفال). تأثير أنواع مختلفة من الجراحة أو غيرها من المربكة (نقص التروية، إصابات الدماغ، والاستعداد الوراثي، وما إلى ذلك ) يمكن الآن اختبار موثوق بها باستخدام هذا النموذج.
في المختبر، ونحن نخطط لاستخدام طرق الكهربية والكهروكيميائية متعددة لمزيد من التحقيق آليات التخدير و إيدن في الدوائر العصبية سليمة. وتشمل هذه التقنيات في الجسم الحي قياس النشاط العصبي، خلية كاملة التصحيح المشبك التسجيلات، التصوير العصبي، والتحقيقات العصبية في شرائح الدماغ. فيما يتعلق بعلم الأعصاب في الدماغ غير الناضج، الخنازير هي أكثر أهمية للبشر من نماذج الفئران مع عدد قليل جدا من العيوب الموجودة مع الرئيسيات غير البشرية. مع مزيد من التطوير، قد تكون الخنازير النموذج المثالي للبحوث علم الأعصاب التنمية البشرية.
Disclosures
الكتاب تعلن أنه ليس لديهم المصالح المتنافسة.
Acknowledgements
ويود المؤلفون أن يعترفوا بمساهمات مركز الموارد الحيوانية لمختبر جامعة ولاية أوهايو (أولار).
Materials
| Name | Company | Catalog Number | Comments |
| Liqui-Wean | Milk Specialities | 454836 | |
| Piglet Anesthesia Face-Cone Mask | VetEquip | 921428 | |
| Masterflex L/S Peristaltic Pump | Cole-Parmer | EW-77916-20 | Alternative peristaltic pumps can be used, as long as a constant and sufficient perfusion rate can be achieved |
| Masterflex L/S Pump Tubing, 25 ft | Cole-Parmer | EW-96410-24 | |
| 14 G angiocatheter | Becton-Dickson | 381164 | |
| 10x PBS | Thermo-Fisher Scientific | ||
| Paraformaldehyde powder | Sigma-Aldrich | P6148-5KG | Our lab makes this reagent from the powder as it is much more cost-effective. Prepared paraformaldehyde can also be purchased. |
| 2-methylbutane | Sigma-Aldrich | M32631-4L | |
| Needle holder | Teleflex | 152720 | |
| Right angle clamp | Teleflex | 496217 | |
| Rongeurs | Teleflex | 028120 | |
| Tenotomy scissors | Teleflex | 423480 | |
| Stitch scissors | Teleflex | 423440 | |
| McPherson Tying Forceps | Teleflex | 425200 | |
| Adson Tissue Forceps | Teleflex | 181223 | |
| 3-0 nylon suture | Medline | ETH627H | |
| Integra SL Anesthesia Workstation | DRE Veterinary | 2350 | This anesthesia workstation is chosen to best mimic the clinical monitoring experienced by pediatric patients in the operating room. Any anesthesia machine can be used as long as it allows for sufficient physiologic monitoring and intervention. |
| Laryngoscope handle | Teleflex | 8710000 | |
| Miller 1 Laryngoscope blade | Teleflex | 2216100 | |
| Bair Hugger | 3M | 750 | |
| Bair Hugger Torso Blanket | 3M | 540 | |
| iStat Handheld | Abbott Point of Care | 300 | Alternative point of care arterial blood gas analysis devices may be used |
| iStat Cartridges | Abbott Point of Care | CG8+ | |
| Dermabond Advanced Topic Skin Adhesive | Ethicon | DNX6 | |
| LMA Laryngotracheal Atomization Device | Teleflex | MAD720 | A cotton-tipped applicator soaked in local anesthetic can also be used |
| Sheridan CF 3.0 Cuffed Endotracheal Tube | Teleflex | 5-10106 | This model ETT was selected because it has a Murphy's eye, which is important to prevent ETT occlusion during the experiment |
| Pediatric Intubation Stylet | Smiths Medical | 100/120/100 | |
| 24 G angiocatheter | Becton-Dickson | 381112 | |
| #10 Disposable Scalpel | Ted Pella, Inc | 549-9-10 | |
| Arterial Pressure Monitoring Kit (3 French, 8 cm catheter) | Cook Medical | C-PMSY-300-FA | Simple polyethylene tubing with a luer-lock adapter can also be used |
| Intramedic PE90 Polyethylene tubing | Fisher Scientific | 14-170-12D | |
| Monoject Blunt Cannula | VWR International | 15141-144 |
References
- Buie, V. C., Owings, M. F., DeFrances, C. J., Golosinskiy, A. National hospital discharge survey: 2006 annual summary. Vital Health Stat 13. (168), 1-79 (2010).
- Hays, S. R., Deshpande, J. K. Newly postulated neurodevelopmental risks of pediatric anesthesia. Curr Neurol Neurosci Rep. 11, 205-210 (2011).
- Disma, N., Mondardini, M. C., Terrando, N., Absalom, A. R., Bilotta, F. A systematic review of methodology applied during preclinical anesthetic neurotoxicity studies: important issues and lessons relevant to the design of future clinical research. Paediatr Anaesth. 26, 6-36 (2016).
- Loepke, A. W., Vutskits, L. What lessons for clinical practice can be learned from systematic reviews of animal studies? The case of anesthetic neurotoxicity. Paediatr Anaesth. 26, 4-5 (2016).
- Cherubini, E., Rovira, C., Gaiarsa, J. L., Corradetti, R., Ben Ari, Y. GABA mediated excitation in immature rat CA3 hippocampal neurons. International journal of developmental neuroscience. 8, 481-490 (1990).
- Kaindl, A. M., et al. Brief alteration of NMDA or GABAA receptor-mediated neurotransmission has long term effects on the developing cerebral cortex. Mol Cell Proteomics. 7, 2293-2310 (2008).
- Glauser, E. M. Advantages of piglets as experimental animals in pediatric research. Exp Med Surg. 24, 181-190 (1966).
- Dickerson, J., Dobbing, J. Prenatal and postnatal growth and development of the central nervous system of the pig. Proceedings of the Royal Society of London B: Biological Sciences. 166 (1005), 384-395 (1967).
- Conrad, M. S., Johnson, R. W. The domestic piglet: an important model for investigating the neurodevelopmental consequences of early life insults. Annu Rev Anim Biosci. 3, 245-264 (2015).
- Nielsen, K. B., et al. Reelin expression during embryonic development of the pig brain. BMC Neuroscience. 11, 75 (2010).
- Niblock, M. M., et al. Comparative anatomical assessment of the piglet as a model for the devleoping human medullary serotonergic system. Brain Res Brain Res Rev. 50 (1), 169-183 (2005).
- van Straaten, H. W., Peeters, M. C., Hekking, J. W., van der Lende, T. Neurulation in the pig embryo. Anat Embryol (Berl). 202 (2), 75-84 (2000).
- Goureau, A., et al. Conserved synteny and gene order difference between human chromosome 12 and pig chromosome 5. Cytogenetics and cell genetics. 94 (1-2), 49-54 (2001).
- Dobbing, J., Sands, J. Comparative aspects of the brain growth spurt. Early Human Development. 3 (1), 79-83 (1979).
- Istaphanous, G. K., et al. Characterization and quantification of isoflurane-induced developmental apoptotic cell death in mouse cerebral cortex. Anesth Analg. 116 (4), 845-854 (2013).
- Loepke, A. W., et al. The effects of neonatal isoflurane exposure in mice on brain cell viability, adult behavior, learning, and memory. Anesth Analg. 108 (1), 90-104 (2009).
- Sullivan, S., et al. Improved behavior, motor, and cognition assessment in neonatal piglets. J Neurotrauma. 30 (20), 1770-1779 (2013).
- Gieling, E. T., Nordquist, R. E., van der Staay, F. J. Assessing learning and memory in pigs. Anim Cogn. 14 (12), 151-173 (2011).
- Broom, D. M., Sena, H., Moynihan, K. L. Pigs learn what a mirror image represents and use it to obtain information. Animal Behaviour. 78 (5), 1037-1041 (2009).
- Martin, L. J., Spicer, D. M., Lewis, M. H., Gluck, J. P., Cork, L. C. Social deprivation of infant rhesus monkeys alters the chemoarchitecture of the brain: I. Subcortical regions. The Journal of neuroscience. 11 (11), 3344-3358 (1991).
- Rizzi, S., Ori, C., Jevtovic-Todorovic, V. Timing versus duration: determinants of anesthesia-induced developmental apoptosis in the young mammalian brain. Annals of the New York Academy of Sciences. 1199, 43-51 (2010).
- Brambrink, A. M., et al. Isoflurane-induced neuroapoptosis in the neonatal rhesus macaque brain. Anesthesiology. 112 (4), 834-841 (2010).
- Elmore, M. R., et al. Respiratory viral infection in neonatal piglets causes marked microglia activation in the hippocampus and deficits in spatial learning. J Neurosci. 34 (6), 2120-2129 (2014).
- Alonso-Alconada, D., et al. Brain cell death is reduced with cooling by 3.5 degrees C to 5 degrees C but increased with cooling by 8.5 degrees C in a piglet asphyxia model. Stroke. 46 (1), 275-278 (2015).
- Costine, B. A., et al. The subventricular zone in the immature piglet brain: anatomy and exodus of neuroblasts into white matter after traumatic brain injury. Developmental neuroscience. 37 (2), 115-130 (2015).
- Holtzman, D., et al. In vivo phosphocreatine and ATP in piglet cerebral gray and white matter during seizures. Brain research. 783 (1), 19-27 (1998).
- Swindle, M. M. . Swine in the Laboratory. , (2007).
- Workman, A. D., Charvet, C. J., Clancy, B., Darlington, R. B., Finlay, B. L. Modeling transformations of neurodevelopmental sequences across mammalian species. J Neurosci. 33 (17), 7368-7383 (2013).
- Lunney, J. K. Advances in swine biomedical model genomics. International journal of biological sciences. 3 (3), 179-184 (2007).
- Nemzek, J. A., Hugunin, K. M., Opp, M. R. Modeling sepsis in the laboratory: merging sound science with animal well-being. Comparative medicine. 58 (2), 120-128 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved