Method Article
Verwendung eines Ferkelmodells für die Untersuchung der anästhetisch-induzierten Entwicklungsneurotoxizität (AIDN): Ein Translational Neuroscience Approach
In diesem Artikel
Zusammenfassung
Anästhesie-induzierte Entwicklung Neurotoxizität (AIDN) Forschung konzentriert sich auf Nagetiere, die nicht breit auf den Menschen anwendbar sind. Nicht-menschliche Primatenmodelle sind relevanter, aber kostenaufwendig und schwer zu experimentieren. Das Ferkel dagegen ist ein klinisch relevantes, praktisches Tiermodell, ideal für das Studium der anästhetischen Neurotoxizität.
Zusammenfassung
Anästhesie kann in vielen Fällen nicht vermieden werden, wenn eine Operation erforderlich ist, besonders bei Kindern. Neuere Untersuchungen an Tieren haben Bedenken geäußert, dass die Anästhesieexposition zu einer neuronalen Apoptose führen kann, die als Anästhesie-induzierte Entwicklungsneurotoxizität (AIDN) bekannt ist. Darüber hinaus haben einige klinische Studien bei Kindern vorgeschlagen, dass Anästhesieexposition zu neurodevelopmentalen Defiziten später im Leben führen kann. Dennoch ist noch ein ideales Tiermodell für präklinische Studien zu entwickeln. Das neonatale Ferkel stellt ein wertvolles Modell für die präklinische Studie dar, da sie eine auffällige Anzahl von Entwicklungsähnlichkeiten mit dem Menschen teilen.
Die Anatomie und Physiologie der Ferkel ermöglichen die Umsetzung von rigorosen menschlichen perioperativen Bedingungen sowohl im Überlebens- als auch im Nicht-Überlebensverfahren. Die femorale Arterienkatheterisierung ermöglicht eine genaue Überwachung und ermöglicht so eine sofortige Korrektur einer Abweichung der Vitalzeichen und Chemikalien des Ferkels. ichZusätzlich gibt es mehrere Entwicklungsähnlichkeiten zwischen Ferkeln und menschlichen Neugeborenen. Die Techniken, die erforderlich sind, um Ferkel für das Experimentieren zu verwenden, erfordern Erfahrung, um zu meistern. Ein pädiatrischer Anästhesist ist ein kritisches Mitglied des Ermittlungsteams. Wir beschreiben im allgemeinen Sinn die entsprechende Verwendung eines Ferkelmodells für die neurodevelopmentale Studie.
Einleitung
Jedes Jahr erhalten Millionen von Kindern in den USA eine allgemeine Anästhesie, viele von ihnen unter 4 Jahren 1 . Anästhesie-induzierte Entwicklungsneurotoxizität (AIDN) ist ein Schwerpunkt der pädiatrischen Anästhesieforschung geworden, da es zwingend notwendig geworden ist, die Auswirkungen der Anästhesie auf unreife Gehirne zu verstehen. Bisherige Untersuchungen haben gezeigt, dass häufig verwendete Anästhetika wie Isofluran eine erhöhte neuronale Apoptose im Gehirn von Jungtieren verursachen können. Studien bei Kindern haben zweideutige Ergebnisse ergeben 2 . Das Verständnis der Pathogenese von AIDN, die Identifizierung potenzieller therapeutischer Ziele für seine Prävention oder Verbesserung und die Beschreibung der sicherste anästhetischen Regimen sind zu dringenden Zielen der pädiatrischen Anästhesie Gemeinschaft geworden. Das primäre Ziel dieser Studie war es, ein optimales Tiermodell und eine Methode zur Quantifizierung der Auswirkungen von Anästhetika auf das sich entwickelnde Gehirn zu entwickeln und sorgfältig zu stimulierenEntworfene Untersuchung der Sicherheit der derzeit weit verbreiteten Anästhetika.
In einer neueren systematischen Überprüfung der aktuellen körperlichen Präklinik-Literatur über AIDN, die Autoren festgestellt, signifikante methodische Heterogenität in über 900 Studien 3 . Viele betrachteten dies als einen Aufruf für ein klinisch relevantes, gut entworfenes präklinisches Modell, das es noch nicht gibt, trotz mehrjähriger Forschung zu diesem Thema. Die meisten Nagetiermodelle verwenden aus der Notwendigkeit einen Ansatz, der keine strenge physiologische Überwachung, Blutentnahme oder mechanische Beatmung erlaubt. Da das Gehirn für physiologische Störungen exquisit empfindlich ist, ist es schwierig, sich auf die Ergebnisse dieser Modelle zu verlassen. Ein primäres Ziel für die Entwicklung dieses Modells war es, das so zu gestalten, dass alle physiologischen Variablen wie Blutgasparameter, Körpertemperatur, Atemparameter etc. bei Bedarf überwacht und korrigiert werden.
Darüber hinaus, weil die Neurotoxizität der Anästhesie wahrscheinlich von dem Entwicklungsfortschritt des Gehirns zum Zeitpunkt der Exposition abhängt, sollte ein Tiermodell gewählt werden, das die Entwicklung und Struktur des neonatalen menschlichen Gehirns am besten nachahmen kann, um zu maximieren Die translationalen Relevanz der Ergebnisse 4 . Das translatorische Ferkelmodell liefert die klinische Relevanz, die in diesen Rezensionen und Editorials angestrebt wird, da es darauf abzielt, diese Notwendigkeit für relevante präklinische Daten zu adressieren, die zukünftige klinische Studien informieren können.
Isofluran, ein GABA-Typ A (GABA A ) Rezeptor-Agonist und schwacher NMDA-Rezeptor-Antagonist, ist das häufig verwendete Inhalationsanästhetikum in der klinischen Praxis weltweit. Anästhetika wie Isofluran wurden als sicher betrachtet, solange sie keine Hypotonie oder Hypoxie induzieren; Dennoch können subtilere Effekte auftreten. Wenn das Gehirn einer allgemeinen Anästhesie ausgesetzt ist, ist das Gleichgewicht von GABA aGonismus und NMDA-Antagonismus ist gestört, was zu Veränderungen in der zellularen Architektur, Konnektivität und Funktion führt. Zusätzlich, während GABA im Allgemeinen ein inhibitorischer Neurotransmitter ist, ist es bekannt, in den unreifen Gehirnen exzitatorisch zu sein. Gerade wenn der Übergang von GABA vom Erreger zur Hemmung nicht gut verstanden wird und wahrscheinlich speziesabhängig ist.
Wenn ein Ungleichgewicht zwischen exzitatorischen und hemmenden Inputs im Gehirn während des sogenannten "Hirnwachstumsspurtes" auftritt, kann die daraus resultierende exzitotoxische Dysregulation kritischer molekularer Wege zu einer abnormen Neuroentwicklung führen, wie z. B. apoptotische Neurodegeneration. Zusätzlich zu einer erhöhten Apoptose können auch oxidativer Stress und Entzündungen induziert werden, während die neuronale Zellproliferation, die neuronale Migration und die axonale Verwüstung unterdrückt oder dysreguliert werden 6 . Das Nettoergebnis sind neurokognitive Störungen, die in adul bleiben könnenThood 2
Zur direkten Messung der neurotoxischen Effekte von Isofluran auf junge Säugetiere werden neonatale Ferkel verwendet. Ferkel teilen mehr ZNS-Ähnlichkeiten mit Menschen als jeder andere Säugetier, und als solche machen ihre neurodevelopmentalen und neuroanatomischen Ähnlichkeiten sie zu einem idealen Tier für ein klinisch relevantes Säugetiermodell von AIDN. Sowohl Menschen als auch Ferkel besitzen gyrencephalische Gehirne, teilen Gemeinsamkeiten im Charakter und Verteilung von Gehirn gyri, graue Substanz und weiße Substanz. Der Ferkel-Hippocampus, die Basalganglien und der Hirnstamm sind auch topographisch ähnlich denen des Menschen 7 . Entwickelt sind Ferkel einer der wenigen nichtmenschlichen Säugetiere, die perinatalen Hirnwachstum und Myelinisierung unterziehen 8 . In utero, sowohl menschliche und Ferkel Gehirne unterziehen sich signifikantes Wachstum während der späten Trimester Schwangerschaft. In der Korrelation, bei der Geburt, menschlichen und Ferkel Gehirne sind 27% und 25% der erwachsenen Gehirne, respectively. Die Magnetresonanztomographie hat ergeben, dass ein einwöchiges Ferkelhirn etwa ein einmonatiges menschliches Gehirn in Bezug auf neuronale Reifung und dendritische Wölbung entspricht. Darüber hinaus haben das Ferkel und das menschliche Gehirn zahlreiche Ähnlichkeiten in Bezug auf Muster der Neuroentwicklung. Beispielsweise sind die Expressions- und mRNA-Sequenz von reelin 10 , die topographische Verteilung der 5-HT-Neuronen 11 und der Neuralrohrverschluss 12 alle parallel zu dem, was beim Menschen zu sehen ist. Darüber hinaus gibt es eine weitgehende Homologie zwischen den Genomen von Ferkeln und Menschen 13 .
Die Relevanz eines Tiermodells muss im Kontext der menschlichen Pathologie verstanden werden, insbesondere in Bezug auf die Hirnreife und die Pathobiologie des menschlichen Kindes. Die meisten der vorhandenen Anästhesie-Toxizitätsstudien verwenden ein Nagetiermodell, mit einigen wenigen, die nicht-menschlichen verwendenPrimatenmodelle Allerdings können Nagetiere und Primaten nicht die idealen Tiere für die Untersuchung von AIDN sein.
Obwohl weit verbreitet, Nagetier Gehirne sind sehr verschieden von denen der Menschen während der Entwicklung. Vor allem Nagetiere besitzen lissencephalen (oder glatten) Gehirnen. Das Nagetier-Gehirn fehlt dem Gyri und Sulci, die für mehr neurologisch komplexe Organismen charakteristisch sind. Das Nagetier-Gehirn unterliegt auch einem postnatalen Hirnwachstum Spurt 14 , unähnlich für Menschen und Ferkel. Es wurde beobachtet, dass es Variationen in der Anfälligkeit der verschiedenen Hirnregionen zu inhaliertem Anästhetikum gibt 15 . Daher sollte es wichtig sein, dass das Tiermodell für das Studium von AIDN ein Gehirn besitzt, das neurodevelopmental und neuroanatomisch ähnlich dem eines Menschen ist, um die anästhesieinduzierten Hirnveränderungen am besten zu modellieren, die bei pädiatrischen Patienten wahrscheinlich zu beobachten sind. Wie bereits erwähnt, besitzen Ferkel ein Gehirn, das ich habeViel besser für diese Rolle geeignet. Darüber hinaus sind die gemeinsamen Formen der Nagetierneurokognitiven Tests, wie z. B. räumliches Lernen und Gedächtnis, die im Morris-Wasserlabyrinth ausgewertet werden, nicht direkt relevant oder vergleichbar mit den neurokognitiven Bewertungen bei kleinen Kindern 16 . Einer der Vorteile der Verwendung von Ferkeln für die Entwicklungsneurowissenschaften ist, dass sie auch in einem frühen Alter extrem neurokognitiv sind. Zahlreiche neurokognitive Tests, die für andere Säugetierarten als nützlich erachtet werden, wurden erfolgreich bei Schweinen eingesetzt und validiert. Während es sich immer noch um ein sich entwickelndes Feld handelt, enthält die neurokognitive Beurteilung bei Ferkeln komplexere Tests, die menschliche Defizite besser nachahmen, wie z. B. ein Schrägstrahl-Motor-Test 17 , 18 und spiegelnder räumlicher Bewusstseinstest 19 . Motor-Tests mit dem geneigten Strahl, als Teil der traumatischen Hirnverletzung Studie in Ferkel, zeigt eine hohe Zuverlässigkeit in der BeurteilungDer motorischen Funktion. Der Spiegeltest zeigt die Erinnerung an die Umgebung und die Anerkennung und Ausnutzung eines reflektierten Bildes, um die Nahrungsmittelbelohnung zu suchen.
Auf der anderen Seite können nicht-menschliche Primaten ein geeignetes Modell für pädiatrische Anästhesie-Studien sein, aber es gibt eine Reihe von prohibitiven Faktoren, einschließlich Kosten und Schwierigkeiten der Nutzung. Darüber hinaus sind sie äußerst empfindlich auf frühe Aufzuchtbedingungen, insbesondere Stress und mütterliche Trennung 20 . Faktoren, die für die Untersuchung von AIDN wichtig sind, wie etwa allosterische Modulatoren, Rezeptor-Ligand-Affinitäten, posttranslationale Modifikationen, Rezeptor-Untereinheitszusammensetzungen und alternative Spleißvarianten, sind bei Primaten nicht bekannt. Dies ist, weil Gene, die für solche Konzepte relevant sind, nicht geklont worden sind. Im Gegensatz dazu wurden sie bei Schweinen geklont. Als solches wurden nur begrenzte Arbeiten in nichtmenschlichen Primaten 21 , 22 durchgeführt .
Das Ferkelmodell nutzt die Vorteile der Nagetier- und Nichtmenschen-Primatenmodelle: Es ist kostengünstig, einfach in Bezug auf nichtmenschliche Primatenstudien zu verwenden und ist neuroanatomisch und neurophysiologisch ähnlich dem pädiatrischen menschlichen Gehirn. Die Verwendung von Ferkel in der neurowissenschaftlichen Forschung ist in den letzten Jahren gewachsen, darunter eine Reihe von Studien, die pädiatrische neuroinflammatorische Bedingungen untersucht haben. Effekte der respiratorischen Virusinfektion auf Hippocampus und räumliches Lernen 23 , Verringerung des Hirnzelltods nach Schlaganfall 24 , Neurogenese nach traumatischer Hirnverletzung 25 und Enzymaktivität während der Anfälle 26 sind einige der Studien, die neonatale Ferkel verwendet haben. Diese umfangreiche und wachsende Anzahl von Literatur verleiht der Eignung und Nachhaltigkeit des klinisch relevanten und hochreproduzierbaren Ferkelmodells die Möglichkeit,Sia-induzierte Neurotoxizität.
Protokoll
Gesunde, häusliche Ferkel ( Sus scrofa) werden von einer Farm erhalten, die vom Ohio State University Institutional Animal Care and Use Committee (IACUC) genehmigt wurde. Alle Tierversuche werden in Übereinstimmung mit der Ohio State University IACUC Politik durchgeführt, nach Protokoll Genehmigung.
1. Tier- und Tierhandling
- Verwenden Sie männliche Ferkel in diesem Experiment, um die potenziellen verstörenden Auswirkungen des Geschlechts zu beseitigen. HINWEIS: Wenn experimentelle Ziele die Bewertung der Wirkungen des Experiments an Tieren einschließen, während in der Zeit des maximalen Hirnwachstums keine Ferkel älter als 14 Tage verwenden.
- Planen Sie die Ferkel, um im Vivarium mindestens 24 Stunden vor dem Experimentieren anzukommen, um eine Akklimatisierung der Umwelt zu ermöglichen.
ANMERKUNG: Ausgebildete Veterinärtechniker, die von lizenzierten Tierärzten betreut werden, stellen eine routinemäßige Tierpflege zur Verfügung.- Halten Sie die Ferkel in einzelnen temperaturgesteuerten Käfigen und geben Sie ein NutritioNally komplette, kommerzielle Ferkelmilchersatz ad libitum. Versorgen Sie die Tiere mit einer Decke und einem Spielzeug. Kontinuierliche Überwachung der Temperatur in den Tiergehegen.
- Für diese vorläufige Machbarkeitsstudie wurden 18 Ferkel für den Isofluranarm und 22 Ferkel für den Kontrollarm verwendet. Führen Sie Stichprobengrößenberechnungen auf der Grundlage des Studienentwurfs, wenn möglich. Randomisieren Sie die verfügbaren Ferkel entweder kontrollieren oder Exposition Gruppe für die entsprechende Länge der Exposition. Aus Erfahrung, auch mit mehreren Ermittlern, erwarten, dass sie nicht mehr als 2 Experimente pro Tag (2 Tiere insgesamt) durchführen können.
2. Tiere kontrollieren
- Führen Sie keine experimentellen Eingriffe bei Kontrolltieren durch.
- Erzwingen Sie eine tiefe Vollnarkose über eine Gesichtskegelmaske für die Perfusions- und Gewebsansammlung. Speziell, nach der 24-h-Akklimatisierungsperiode, betäubt man die Ferkel mit 5% Isofluran oder 8% Sevofluran in 100% Sauerstoff <Em> über Gesichtskegelmaske Verwenden Sie Desfluran nicht zur Induktion.
ANMERKUNG: Die Zeit zwischen der Induktion der Anästhesie und der Anstalt der kalten PBS-Perfusion sollte so kurz wie möglich sein. Erfahrene Techniker können diesen Prozess in weniger als 5 min abschließen.- Bestätigen Sie eine ausreichende Tiefe der Anästhesie durch Mangel an Dewclaw-Pinch Reflex mit einer chirurgischen Klemme.
- Um hypoxisch / ischämische Beleidigungen für das Gehirn zu vermeiden, überwachen Sie das Ferkel mit einem Pulsoximeter, um die Aufrechterhaltung einer ausreichenden Oxygenierung, Belüftung und Herzzeitmessung zu gewährleisten, bis die Perfusion von kaltphosphatgepufferter Kochsalzlösung (PBS) beginnt.
HINWEIS: Um einen zusätzlichen Schutz gegen Gewebeschäden zu bieten, packen Sie das Tier (einschließlich des Kopfes) in Eis nach Induktion der Anästhesie.
- Führen Sie eine transkardiale Perfusion durch.
HINWEIS: Da Paraformaldehyd verwendet wird, sollte das Perfusionsverfahren unter einer Dunstabzugshaube oder auf einem Downdraft-Tisch durchgeführt werden.- Machen Sie eine craniocaudal iNcision entlang der Länge des Sternums mit einem Skalpell. Die Tiefe des Einschnitts sollte ausreichen, um das Sternum auszusetzen.
- Sorgfältig, führen Sie eine Mittellinie Sternotomie mit einem Paar scharfe schwere Schere, Vermeidung von Schäden an Herz, Lunge oder Zwerchfell. Wenn nötig, platziere einen Finger zwischen den hinteren Aspekt des Sternums und den intrathorakalen Inhalt, um Verletzungen zu vermeiden. Manövrieren Sie einen Finger in das Mediastinum, indem Sie einen kleinen (fingergroßen) Einschnitt im Zwerchfell machen.
- Nach dem Eintritt in die Thoraxhöhle den Rippenkäfig mit einem selbsthaltenden Retraktor öffnen.
- Schneiden Sie das Perikard mit Pinzette und eine Schere, die das Herz schlagen. Sei vorsicht, das Herz nicht zu verletzen.
- Den linken Ventrikel identifizieren und vorsichtig eine Kanüle (wie einen 14 G Angiokatheter) durch den Scheitel des Ventrikels platzieren. Entfernen Sie die Nadel, so dass der Katheter an Ort und Stelle bleibt.
HINWEIS: Sei vorsicht, die hintere Wand des Ventrikels nicht zu durchstechen.Pulsatile Blutrückkehr aus dem Katheter zeigt an, dass es richtig platziert ist. Blut kann leicht von dem Tier an diesem Punkt entnommen werden. - Nach der Identifizierung des rechten Vorhofs, führen Sie eine Atriotomie durch eine große Inzision im Atrium mit Schere, um Exsanguination und die Flucht von Perfusat zu ermöglichen.
ANMERKUNG: Isofluran über Inhalation sollte fortgesetzt werden, bis Herztod bestätigt ist. Der Herztod wird durch den direkten beobachteten Mangel an Herzleistung bestätigt.
- Setzen Sie das Ferkel mit einem Perfusat aus Kälte (4 ° C) phosphatgepufferte Kochsalzlösung (PBS), die Heparin in einer Konzentration von 5 Einheiten pro ml enthält. Perfund bei 300 mL pro min für 5 min oder bis die Lösung klar läuft.
- Seien Sie vorsichtig, dass die Perfusionskanüle während der Perfusion nicht verschoben wird. Verwenden Sie hierfür eine handelsübliche Peristaltikpumpe und alle anderen Perfusionen.
- Führen Sie eine hemicraniektomie zu reVerschiebe eine Hemisphäre des Gehirns für eine frische Gewebeanalyse.
HINWEIS: Dieses Protokoll erlaubt das Abrufen einer Hemisphäre von frischem Hirngewebe. Die andere Halbkugel ist fixiert. Wenn kein frisches Gewebe erforderlich ist, fahren Sie mit Schritt 2.6 fort.- Während dieses Vorgangs die Zirkulation von eiskaltem PBS mit einer Geschwindigkeit von 50 ml pro Stunde fortsetzen, um sicherzustellen, dass das Gehirn kalt bleibt.
- Machen Sie einen Längsschnitt in der Kopfhaut entlang der Länge der sagittalen Naht bis das Foramen magnum mit einem Skalpell. Während des Prozesses, verwenden Sie festen Druck, um eine Punktzahl im Schädel zu schaffen. Reflektieren Sie die Kopfhaut, um den gesamten Schädel auszusetzen.
- Mit Rongeurs und beginnend am Foramen magnum, entfernen Sie den Schädel auf einer Seite, indem Sie die Rongeurs zwischen den Schädel und die Dura mater, mit Vorsicht nicht zu verletzen das zugrunde liegende Hirngewebe. Knochen in Stücke entfernen, mit den Rongeurs, um es vom Gehirnparenchym zu entfernen.
- Sobald der Schädel entfernt worden ist,Ra mater mit Pinzette und Schere, wieder mit Vorsicht nicht zu verletzen das zugrunde liegende Hirngewebe.
- Lege eine Skalpellklinge zwischen die beiden Hemisphären, um das Corpus callosum sorgfältig zu teilen.
- Mit einem flachen Werkzeug wie dem breiten Griff Ende der Pinzette, sanft zurückziehen die frontale Lappen, allmählich trennt die Hirnnerven, arbeiten anterior bis posterior. Im hintersten Aspekt der Hemisphäre, verwenden Sie ein Skalpell, um das Rückenmark zu schneiden. Die hemisphäre en bloc entfernen
HINWEIS: Unfixiertes Hirngewebe ist zerbrechlich. Seien Sie vorsichtig, wenn Sie die Hemisphäre entfernen, um eine Störung der Blutspülung der verbleibenden Hemisphäre zu verhindern. - Abschnitt die entfernte Hemisphäre. Wenn angegeben, sofort in 2-Methylbutan einfrieren, das auf -160 ° C in einem flüssigen Stickstoffbad gekühlt wird, um einen Gewebeabbau zu vermeiden und sofort bei -80 ° C für eine spätere Analyse gelagert zu werden.
HINWEIS: Wir empfehlen, das Gehirn koronal in 2-mm-Schritten mit einer Matrix, aber spezifisch detaiDie Abschnitte hängen von bestimmten experimentellen Zielen ab.
- Ändern Sie das Perfusat auf 4% Paraformaldehyd (PFA). Fortsetzen Sie die PFA-Perfusion bei 300 ml pro Minute für mindestens 5 min.
VORSICHT! PFA ist giftig, Kontakt mit Haut, Augen oder Schleimhäuten vermeiden. PFA-Dämpfe nicht einatmen. - Erwarten Sie, dass der Ferkelkörper durch die Bildung von Aldehyd-Vernetzungen, die im Muskel entstehen, versteift wird. Nachdem die Perfusion von PFA abgeschlossen ist, entfernen Sie die verbleibende Hemisphäre in identischer Weise wie in Schritt 2.5.5 beschrieben.
HINWEIS: Richtig perfundiertes Gehirn wird blass und völlig exsanguiniert.- Lege die restliche Halbkugel in einen kleinen Behälter mit frischem 4% PFA bei 4 ° C. Halten Sie die Hemisphäre in PFA für 24-48 h, um den Fixierungsprozess abzuschließen.
- Nach 24-48 h bewegen Sie das feste Gehirn zu einer Lösung von PBS, die 0,1% Natriumazid enthält, da es notwendig ist, eine Überfixierung zu verhindern. Überfixierung könnte zu mas führenKönig des Epitops oder starke unspezifische Hintergrundfärbung. Die Zugabe von Natriumazid verhindert bakterielles Wachstum.
HINWEIS: Das Gewebe kann bis zu einem Monat bei 4 ° C gelagert werden.
3. Isofluran (experimentelle) Tiere
HINWEIS: Jede Anästhesie oder Intervention kann verwendet werden, aber wir empfehlen kein Desfluran für Inhalationsinduktion.
- Induktion und Instandhaltung der Anästhesie:
- Führen Sie die Anästhesie mit einem klinischen Anästhesie Workstation mit einem pädiatrischen Ventilator und Überwachungsgeräte ausgestattet.
- Nach der 24-Stunden-Akklimatisierungsperiode die Ferkel mit 8% Sevofluran in 100% O 2 über Gesichtskegelmaske betäubt.
- Kontinuierlich überwachen Pulsoximetrie, nicht-invasiven Blutdruck, Elektrokardiographie und Temperatur während der Induktion Zeitraum und zu jeder Zeit während des Studiums.
- Nach der Induktion titrieren Sevofluran oder IsofluZu einer Konzentration führen, die eine ausreichende Tiefe der Anästhesie ermöglicht und gleichzeitig eine nachhaltige spontane Atmung (typischerweise bei einer Konzentration von 3-4%) gewährleistet.
- Legen Sie einen 24 g peripheren intravenösen Katheter in die Randohrvene (Abbildung 1 ).
- Lege das Ferkel in die dorsale Liegeposition für die Trachealintubation ( Abb. 2 , Tafel A). Verwenden Sie ein Miller # 1 oder # 1.5 Klinge, um die Instrumentierung des Hypopharynx und die Intubation der Trachea zu erleichtern. ANMERKUNG: Ein erfahrener Betreiber und Assistent werden bei der Laryngoskopie benötigt.
- Lassen Sie einen Assistenten die Zunge des Tieres mit einer trockenen Gaze verschieben, um die Belichtung des Kehlkopfes und die Visualisierung der Stimmbänder zu erleichtern (Abbildung 2 B ).
ANMERKUNG: Die Ferkel-Epiglottis ist morphologisch ähnlich der des Menschen (Abbildung 2 C ). Die Ferkel Vocal CorDs kann schwer zu visualisieren, da sie mehrere Millimeter tief im Kehlkopfeinlass sind (Abbildung 2 D ). - Verschieben Sie die Epiglottis: Legen Sie die Spitze des Laryngoskopblattes unter die Epiglottis und heben Sie die Klinge nach oben, um den Kehlkopf auszusetzen.
- Vor der Platzierung des Röhrchens in die Trachea, sprühen Sie die Stimmbänder mit 0,5 ml 2% Lidocain, um Laryngospasmus während des Durchgangs des Endotrachealtubus zu verhindern, da Ferkel besonders anfällig für Laryngospasmus sind.
- Lassen Sie einen Assistenten die Zunge des Tieres mit einer trockenen Gaze verschieben, um die Belichtung des Kehlkopfes und die Visualisierung der Stimmbänder zu erleichtern (Abbildung 2 B ).
- Platzieren und sichern Sie ein 3,0 mm Manschetten-Trachealtubus.
- Sicherstellen von bilateralen Atemgeräuschen und nachhaltigem Kohlendioxid-Kohlendioxid unter Verwendung von Brustauskultation mit Stethoskop und EtCO 2- Monitoring.
- Die Lippen des Ferkels auf einen kontinuierlichen Atemwegsdruck von 20 cm H 2 O aufblasen. Anschließend die Manschette des Endotrachealtubus auf den Mindestdruck aufpumpen, der erforderlich ist, um ein Luftleck bei einem Druck von 20 cm H zu verhindern 2 O, über die Trachea zu hören, um Luftleck zu identifizieren, falls vorhanden.
HINWEIS: Dies ist wichtig, um Schleimhaut Ischämie bei intermittierenden positiven Druckbelüftung zu verhindern. - Normoxia und Normocarbia werden während der Anästhesie aufrechterhalten.
- Beginn der Verabreichung von 2% Isofluran in 50% Sauerstoff / 50% Luft. Titration von Sauerstoff zur Aufrechterhaltung von PaO 2 von 90 - 100 mmHg. Weiter für 3 h (oder gewünschte experimentelle Dauer).
- Die ophthalmische Salbe auf die Augen auftragen, um die Trockenheit für die Dauer der Anästhesie zu verhindern.
- Beginne die Femoralarterie-Katheterisierung nach Beginn von 2% Isofluran.
- Verabreichung von Breitband-Antibiotika-Prä-Inzision (Cefazolin, 25 mg / kg) über die periphere intravenöse Linie, um eine chirurgische Infektion zu verhindern.
- Sterilisieren Sie beide Leisten mit getöntem Chlorhexidin, um ein ordnungsgemäßes steriles Feld zu gewährleisten, und legen Sie eine geeignete sterile Abdeckung (Abbildung 3 B ). Zumindest sollten die Mitarbeiter, die an der Überlebenschirurgie teilnehmen, eine chirurgische Kappe, Maske, sterile Handschuhe und Augenschutz tragen.
- Palpate den femoralen Puls an der Leistenfalte mit Index und Mittelfinger.
- Machen Sie eine oberflächliche, 1,5 cm, craniokaudale Inzision mit einem Skalpell (Abbildung 3 C ).
- Dissektion zwischen den beiden Köpfen des Gracilis-Muskels mit einem stumpfen Instrument, wie z. B. chirurgischer Hämostat oder Stumpfschere ( Bild 3 D ).
ANMERKUNG: Das femorale neurovaskuläre Bündel ist typischerweise zwischen und nur tief zu diesen beiden Muskeln gefunden. ( Fig. 4A ). - Verwenden Sie Gefäßschleifen oder Seidenbindungen, isolieren Sie die Arterie am proximalen und distalen Ende. Benutze die Schleife, um die Arterie bis zum Niveau der Haut distal zu ziehen ( Abbildung 4 B ).
- WährendPlatzierung Traktion auf die proximale Krawatte ausreichend, um den Blutfluss zu unterbrechen, machen eine kleine Arteriotomie mit einem Paar von Tenotomie Schere.
- Sei vorsicht, die Arterie nicht zu transektieren. Eine kleine Arteriotomie genügt. Alternativ verwenden Sie einen Nadel-und-Draht-Ansatz, um auf die Arterie zuzugreifen (Abbildung 4 C ).
- Eine sanfte Traktion auf der proximalen Bindung verhindert einen übermäßigen Blutverlust an irgendeinem Punkt während dieses Teils des Verfahrens. Bei Verwendung des Nadel- und Drahtansatzes den Führungsdraht (geliefert mit dem Bausatz oder separat erhältlich) durch die Nadel und in die Arterie bis zu 5 cm führen.
- Sei vorsichtig, den Draht nicht weiter vorzudrücken, da er eine ventrikuläre Ektopie verursachen kann. Ziehen Sie den Draht sofort 1-2 cm, wenn dies geschieht.
- Entfernen Sie die Nadel aus dem Gefäß und achten Sie darauf, den Führungsdraht im Gefäß zu lassen. Den Katheter vorsichtig über den Draht und in das Gefäß führen ( Abb. 4 D).
- Verwenden Sie einen 3-französischen, 8 Zentimeter Katheter für die femorale Arterie Katheterisierung. Erwarten Sie milden Widerstand, wenn die Spitze des Katheters zuerst in die oberflächliche Wand des Gefäßes eintritt.
- Bei Verwendung des Arteriotomie-Ansatzes den Katheter- oder Polyethylen-Schlauch direkt in das Gefäß geben. Blutrückführung sollte sofort beobachtet werden.
- Den Katheter sofort an einen Druckwandler anschließen. Spülen Sie den Katheter mit normaler Kochsalzlösung, um die Durchgängigkeit des Katheters aufrechtzuerhalten.
- Legen Sie Nähte, um den Katheter zu sichern. Den Einschnitt mit steriler Gaze abdecken, um eine Kontamination zu vermeiden. Verwenden Sie einen perkutanen Ansatz zur femoralen Arterienkatheterisierung.
HINWEIS: Sicherstellen, dass der Ultraschall von einem erfahrenen Techniker durchgeführt wird.
- Legen Sie Nähte, um den Katheter zu sichern. Den Einschnitt mit steriler Gaze abdecken, um eine Kontamination zu vermeiden. Verwenden Sie einen perkutanen Ansatz zur femoralen Arterienkatheterisierung.
- Intraoperative Bedingungen und Überwachung:
- Aktivieren Sie das Ferkel mit einem Zwangsluft-Warmhaltegerät und überwachen Sie kontinuierlichRektale Temperatur (Abbildung 3 A ).
- Infusions-Dextrose-haltige isotonische Flüssigkeit (5% Dextrose im Ringer-Laktat oder normale Kochsalzlösung) bei Erhaltungsrate (4-faches Ferkelgewicht in Kilogramm, ml / h).
- Beobachten Sie wichtige Anzeichen für Störungen (Hypotonie, Arrhythmie, Hypo / Hyperthermie, Hypoxie)
HINWEIS: Normale Vitalzeichen und entsprechende vorgeschlagene Management bei Anomalien sind in Tabelle 1 zusammengefasst. - Bei Verwendung eines handelsüblichen Blutanalysesystems werden arterielle Blutgase (arterieller pH-Wert, pCO 2 , pO 2 ), Elektrolyte (Bicarbonat, Basenüberschuss / Defizit, Natrium, Kalium, ionisiertes Calcium), Hämoglobin und Glukose mindestens stündlich während des Versuchs gemessen Periode. Zeichnen Sie arterielle Blutprobe aus dem femoralen Arterienkatheter.
HINWEIS: Normale Säure-Base und Elektrolyt-Werte zusammen mit Empfehlungen für die Korrektur, wenn Anomalien gesehen werden aIn Tabelle 1 zusammengefasst.
- Nach 3 h Isofluran-Exposition den Femoralarterienkatheter entfernen.
- Die proximale Gefäßseide sorgfältig binden, um die Oberschenkelarterie dauerhaft zu verschließen, um Blutungen zu vermeiden. Alternativ verwenden Sie einen Gefäßclip.
- Sorgen Sie für eine vollständige Hämostase, bevor Sie den Einschnitt schließen. Bewässern Sie den Schnitt mit 10-20 ml steriler Kochsalzlösung, um eine Infektion zu verhindern.
- Am Ende des Experiments schließen Sie den Hautschnitt mit einfachen, unterbrochenen Nähten mit einem 3-0 nicht resorbierbaren Nahtmaterial.
- Infiltrieren Sie die Wunde mit 0,5-1 ml / kg 0,25% Bupivacain mit 1: 200.000 Epinephrin zur Schmerzkontrolle. Den Schnitt mit einem sterilen, chirurgischen Hautkleber beschichten.
HINWEIS: Kein Dressing ist erforderlich.
- Infiltrieren Sie die Wunde mit 0,5-1 ml / kg 0,25% Bupivacain mit 1: 200.000 Epinephrin zur Schmerzkontrolle. Den Schnitt mit einem sterilen, chirurgischen Hautkleber beschichten.
- Beenden Sie das Anästhetikum und lassen Sie das Ferkel erwachen.
- Entfernen Sie das Endotrachealtubus auf Anzeichen von awaKening (Öffnung der Augen, Versuche zu stehen, Treten und Öffnen und Schließen des Mundes), mit Anzeichen einer stabilen Hämodynamik, ausreichende Oxygenierung und ausreichende Belüftung.
- Nach der Extubation versorgen Sie den Zusatzsauerstoff über den Gesichtskegel, bis die Angemessenheit der Oxygenierung und der Belüftung gewährleistet ist.
- Verabreichung von Buprenorphin 0,05 mg / kg subkutan zur zusätzlichen Schmerzkontrolle. Alternativ kann auch transdermales Fentanyl verwendet werden.
- Gegebenenfalls das Ferkel in den Hauskäfig zurückbringen. Verlasse das Ferkel nicht unbeaufsichtigt, bis es ein ausreichendes Bewußtsein wiedererlangt hat, um die äußere Wiederholung zu bewahren. Gib kein Tier zu einem Käfig mit anderen Tieren zurück, bis es sich vollständig von der Anästhesie erholt hat.
- Aktivieren Sie den privaten Hauskäfig mit einem wärmenden Licht.
- Das Tier nach der Anästhesie von geschultem Veterinär- oder Forschungspersonal genau überwachen. Geben Sie den Ferkelmilchersatz an.
- Lassen Sie die Ferkel sich erholenFür 48-72 h, je nach experimentellen zielen.
- Infektion von Ferkeln mit Buprenorphin subkutan in einer geeigneten Dosis, alle drei Stunden, um die Schmerzkontrolle zu gewährleisten, im Ermessen von Tierpflegespezialisten, die nach der chirurgischen Beschwerden bei Tieren kontrolliert wurden.
- Überwachen Sie die Ferkel jede Stunde für die ersten 6 Stunden nach der Operation und alle 4 Stunden danach. Führen Sie Tieropfer und Gewebebeschaffung in identischer Weise, um Tiere zu kontrollieren, wie oben beschrieben.
Ergebnisse
Vierzig Ferkel wurden untersucht (18 Isofluran, 22 Kontrolle). Studienverfahren wurden von allen Tieren gut vertragen. Alle Ferkel, die studiert wurden, waren männlich. Es gab keinen signifikanten Unterschied zwischen den Gruppen in Bezug auf Alter oder Gewicht ( Tabelle 2, Abbildung 5 ). Durchschnittliche Laborwerte während des Experimentierens in der Isoflurangruppe sind in Tabelle 3 angegeben. Diese Werte zeigen, dass das experimentelle Protokoll interne Konsistenz und Reproduzierbarkeit besitzt, da wir im Laufe von zwei Jahren mehrere Techniker durchführen mussten. Nichts von diesen Zahlen sind die vielen Anpassungen und Korrekturen, die wir während der Operationen durchführen mussten, um die physiologische Hämostase aufrechtzuerhalten. CO 2 Retention, niedrige Kernkörpertemperatur und Hypoglykämie sind einige der vielen Confounder, die wir durch eine umfassende Überwachung und Anpassung wie nötig abgewendet haben.
T "fo: keep-together.within-page =" 1 ">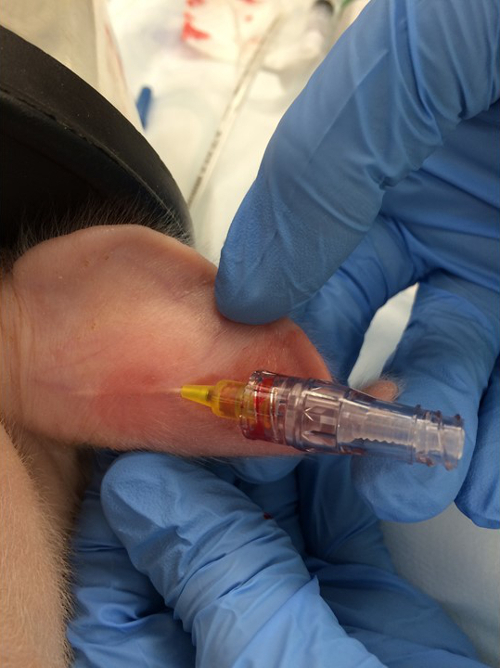
Abbildung 1:. Platzierung der peripheren intravenösen Linie. Ein 24 G intravenöser Katheter wird in die Randohrvene gelegt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
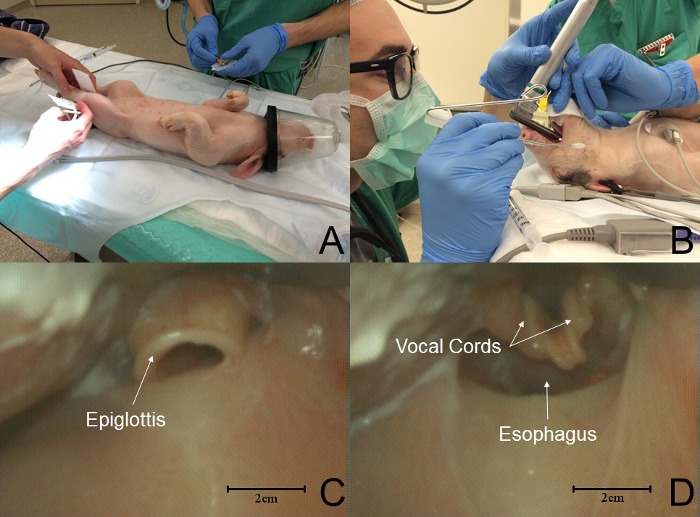
Abbildung 2: Reihenfolge der Ereignisse in der Ferkel-Intubation. ( A ) Ferkel werden in die seitliche Liegeposition zur Intubation gebracht. Standardmonitore werden platziert. ( B ) Ein Assistent vertrieb die Zunge aus der Mundhöhle, während der Laryngoskop die Laryngoskopie durchführt. ( C ) Die Epiglottis ist morphologisch ähnlich der eines Menschen. In dieser grafik ist die spitze von thE Klinge ist im Tschiff. ( D ) Die Schweinekehlkopfanatomie unterscheidet sich deutlich von der des Menschen; Die Stimmbänder sind einige Millimeter tief zum Kehlkopfeinlass. In dieser Grafik hat die Spitze der Klinge die Epiglottis verdrängt und den Kehlkopf ausgesetzt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
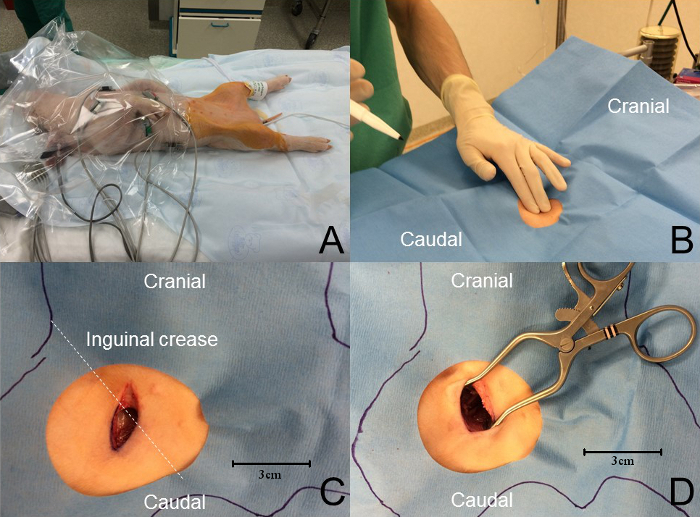
Abbildung 3: Femoralarterienansatz. ( A ) Die Tiertemperatur wird unter Verwendung einer Zwangsluft-Erwärmungsvorrichtung aufrechterhalten. Die Überwachung wird während des gesamten Verfahrens durchgeführt. Ein breites steriles Feld wird mit getöntem Chlorhexidin hergestellt und das Tier ist mit einem fenestrierten sterilen Tuch bedeckt. ( B ) Palpation an der Leistenfalte zeigt den Oberschenkelpuls. ( C ) Eine KrAniokaudal-Hautschnitt, etwa senkrecht zur Leistenfalte und etwa 1,5 cm Länge, wird über dem Femoralpuls durchgeführt. ( D ) Eine stumpfe Dissektion wird erreicht, um das femorale neurovaskuläre Bündel freizulegen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
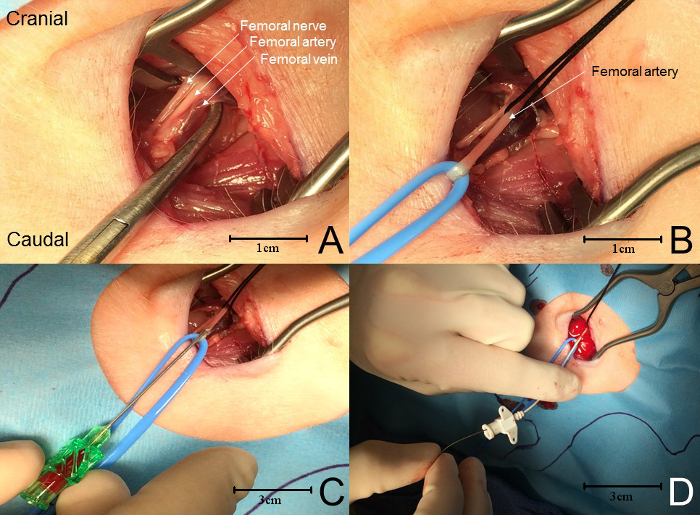
Abbildung 4: Femoralarterie-Kanüle ( A ) Von der lateralen zur medialen enthält das neurovaskuläre Bündel den N. femoralis, die Arterie und die Vene. ( B ) Die Femoralarterie wird mit Gefäßschleifen und / oder Naht isoliert. Eine anhaltende Spannung an der proximalen Bindung verhindert einen übermäßigen Blutverlust, während die Arterie durchbohrt ist (siehe Aufhellung des Gefäßes). ( C ) Eine Nadel wird verwendet, um die Oberschenkel zu punktierenRtery, Vermeidung von Perforation der hinteren Wand der Arterie. Wenn das Blut zurückkehrt, wird ein Führungsdraht durch die Nadel in die Arterie hineingezogen. ( D ) Die Nadel wird entfernt und der Katheter wird über den Führungsdraht in die Femoralarterie. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
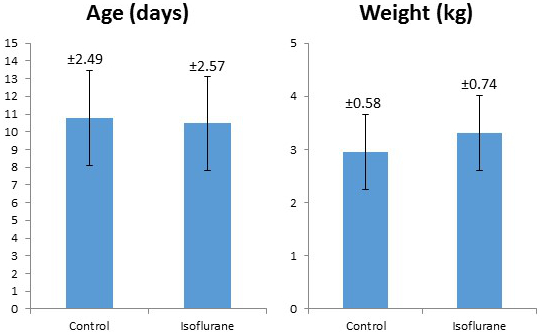
Abbildung 5: Vergleich des durchschnittlichen Gewichts und des Alters der Kontrolle und Isofluran-behandelten Ferkel. Die Fehlerbalken stellen eine +/- 1 Standardabweichung dar, wobei der Standardabweichungswert über jeder Fehlerleiste angegeben ist.
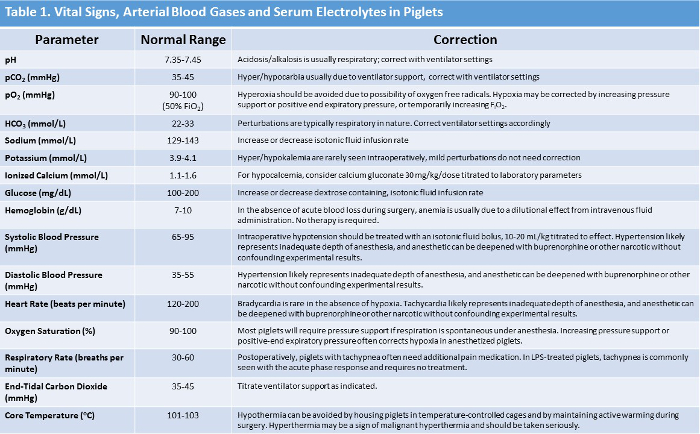
Tabelle 1: Zusammenfassung der normalen Ferkel-Vitalzeichen, ArteriAl Blutgas und Serum-Elektrolyt-Werte mit Vorgeschlagenen Korrekturmethoden. Bitte klicken Sie hier, um eine größere Version dieser Tabelle zu sehen.
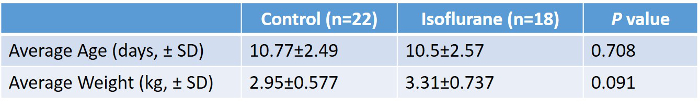
Tabelle 2: Zusammenfassung des durchschnittlichen Gewichts und des Alters der Kontrolle gegenüber Isofluran-behandelten Ferkeln. Es wurde ein ungepaartes Zwei-Tailed-T-Test durchgeführt, das keinen signifikanten Unterschied zwischen den beiden Gruppen zeigte. Bitte klicken Sie hier, um eine größere Version dieser Tabelle anzuzeigen.
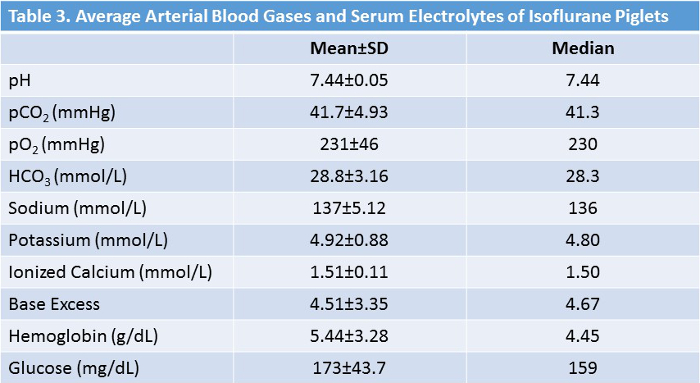
Tabelle 3: Durchschnittliche Vitalzeichen und Laborwerte von Isofluran-behandelten Tieren. Im Laufe desE Chirurgie, Abweichungen der Vitalzeichen und Laborwerte aus den normalen Bereichen werden umgehend korrigiert. Bitte klicken Sie hier, um eine größere Version dieser Tabelle anzuzeigen.
Diskussion
Critical Protocol Steps / Fehlersuche
Wenn das Experiment beginnt, sollte die Überwachung nicht-invasiver Vitalzeichen mit der Induktion beginnen. Blutdruck, Herzfrequenz, Sauerstoffsättigung und rektale Temperatur können leicht erhalten und überwacht werden. Das Ferkel sollte unter einer Luft-wärmenden Vorrichtung sein, um eine ausreichende Kernkörpertemperatur aufrechtzuerhalten, da diese Tiere unter der Allgemeinanästhesie schnell hypothermisch werden können. Die sofortige Platzierung eines peripheren intravenösen Katheters ermöglicht die Behandlung von Notfällen, wenn sie während der Induktion auftreten. Es ist wichtig, das Ferkel, nichtinvasiv oder invasiv, während des Isofluran-Verfahrens und des Opferverfahrens kontinuierlich zu überwachen. Das Ferkel kann die arterielle Sauerstoff-Desaturierung sehr schnell während mehrerer Schritte während des gesamten Protokolls, vor allem während der Atemwege-Management und Intubation. Wir verwenden 8% Sevofluran, um Anästhesie zu induzieren, um die menschliche pädiatrische Praxis zu replizieren und zu speeD Induktion. Allerdings wurde 5% Isofluran erfolgreich eingesetzt und ist angemessen. Angesichts der Unterschiede in der Anatomie und einer Prädisposition für Laryngospasmus, kann das Ferkel schwer zu intubieren. Wenn das Ferkel während des Induktions- und / oder Atemwegmanagements zu entsättigen beginnt, sollten 100% Sauerstoff und Sevofluran sofort über Gesichtskegel verabreicht werden, um einen sicheren Sauerstoffsättigungsgrad und eine ausreichende Tiefe der Anästhesie wiederherzustellen. Denken Sie daran, dass, während die Ebene der Anästhesie muss tief genug, um Intubation zu ermöglichen, kann übermäßige Anästhesie zu Apnoe führen. Eine kontinuierliche Vigilanz in Bezug auf die Belüftung und Oxygenierung des Tieres ist erforderlich, wobei die Titration des inhalierten Anästhetikums entsprechend erfolgt. Die Intubation kann dann wiederhergestellt werden, sobald die Oxygenierung wiederhergestellt ist und eine ausreichende Anästhesie erreicht ist. Eine positive Druckbelüftung über den Gesichtskegel kann versucht werden, ist aber meist nicht erfolgreich. Wenn Laryngospasmus auftritt, Anwendung von Lidocain-Lösung direkt auf die vocEs wird angedeutet, dass die Trachealintubation möglich ist.
Notfallmedikamente sollten immer verfügbar sein und sollten nach Bedarf während der kritischen Teile des Protokolls verabreicht werden, um physiologische Störungen zu korrigieren. Während eine gründliche Diskussion über Anästhesie- und Notfallmedizin in Ferkeln außerhalb des Umfangs dieses Manuskripts liegt, ist Swindles "Schwein im Labor: Chirurgie, Anästhesie, Imaging und Experimentelle Techniken" eine hervorragende Ressource. 27
Ähnlich kann das Ferkel beginnen, während des Opfers schnell zu entsättigen, nach dem Öffnen der Brusthöhle während der Mittellinien-Sternotomie. Der Bediener sollte schnell arbeiten, aber sicher, um das Herz auszusetzen und den Angiokatheter einzusetzen, um das kalte PBS zu starten. Eine gründliche kalte PBS-Perfusion (und schnelle Fixierung mit PFA, falls angegeben) ist erforderlich, um ischämische Schäden am Gehirn zu verhindern.
Sobald das Ferkel intubiert wurde, respiRational Rate und End-Tidal-Kohlendioxid-Tracking beginnt ( Tabelle 1 ). Stabilisieren Sie die Entziehung und Belüftung des Ferkels durch Titration der Beatmungsunterstützung unter Beibehaltung einer ausreichenden Anästhesie. Wir verwenden mechanische Belüftung, um zu verstehen, was bei Menschen so eng wie möglich verwendet wird. Hyperoxie sollte vermieden werden, um die Chance auf oxidativen Stress zu minimieren.
Die Isofluran-Ferkel werden aus 2 Gründen einer Femoralarterien-Kanüle unterzogen: um den arteriellen Blutdruck kontinuierlich zu überwachen; Und arterielles Blut zur Beurteilung des Säure-Basen-Status, Blutgase und Elektrolyte während des gesamten Verfahrens zu untersuchen. Die Kanülen der Oberschenkelarterie können herausfordernd sein. Bitte sehen Sie das Video für alle Details. Für Überlebensexperimente sollte dieses Verfahren in einer sterilen Betriebsumgebung unter sterilen Bedingungen durchgeführt werden. Nach der Kanülierung der Oberschenkelarterie beginnen die stündliche Überwachung des arteriellen Blutgases und der Serumelektrolyte, sobald es notwendig ist, zu korrigierenHalten Sie die Homöostase ( Tabelle 1 ). Das Ferkel sollte kontinuierliche dextrosehaltige isotonische Flüssigkeit erhalten, um ausreichende Blutglukose aufrechtzuerhalten. Während des gesamten Experiments sollte das Tier kontinuierlich auf Normothermie überwacht werden, und die Zwangswärme sollte nach Bedarf bereitgestellt werden. Es ist ebenso wichtig, Hypothermie und Hyperthermie zu vermeiden.
Während dieses Protokoll eine Hemisphäre von "frischem" Gehirn und einer Hemisphäre von festem neuralen Gewebe bereitstellt, kann dies leicht angepasst werden, um alternativen Studienentwürfen Rechnung zu tragen. Zusätzliche Proben können auch aus dem Ferkel gesammelt werden. CSF kann nach der Betäubung des Ferkels mit oder ohne Fluoroskopie-Anleitung gewonnen werden. Blut kann auch aus dem Ferkel in verschiedenen Stadien des Protokolls, einschließlich der aus dem femoralen Arterienkatheter, sowie direkt aus dem linken Ventrikel über den Angiokatheter unmittelbar vor der Perfusion gesammelt werden. Die Rekonvaleszenzperiode kann auch verlängert werden oder sh Ortened, zur Untersuchung der chronischen oder akuten Antwort.
Einschränkungen der Technik
Dieses Protokoll und Modell sind technisch anspruchsvoll. Ein qualifizierter Ermittler und eine vollständig gelieferte Betriebssuite sind erforderlich, insbesondere für Überlebensexperimente. Der Ermittler (und Assistent, für bestimmte Teile des Protokolls) muss mit den chirurgischen und anästhetischen Komponenten dieses Protokolls bequem sein, die Schulung und Erfahrung erfordern können, um zu meistern. Andere Einschränkungen beinhalten die Kosten der Ferkel im Vergleich zu Nagetiermodellen, obwohl das Ferkelmodell weit weniger kostenintensiv ist als nichtmenschliche Primaten. Während die Kosten für Ferkel auf der Grundlage der Region und der Farm variieren, von denen Tiere erhalten werden, kann man erwarten, dass die Kosten pro Tier weniger als $ 500 betragen, während nicht-menschliche Primaten Tausende von Dollar pro Tier sein können. In unserer Erfahrung sind die durchschnittlichen Kosten pro Tier typischerweise etwa 200 Dollar.
Jove_content "> Schließlich, da es der Zweck des Ferkelmodells ist, das sich entwickelnde menschliche Gehirn nachzuahmen, sollten nur neugeborene Ferkel verwendet werden. Das zentrale Nervensystem ist in der Zeit des schnellen Wachstums am meisten anfällig, und bei Ferkeln reicht diese Periode von Sechs Wochen vor der Geburt bis fünf Wochen nach der Geburt 8. Mit älteren Ferkeln, die weit entfernt von ihrem abwurfenden Datum liegen, besteht das Risiko, die klinische Relevanz des Ferkelmodells zu schwächen, während in Bezug auf die "Äquivalenz" der Ferkelhirnentwicklung eine erhebliche Kontroverse besteht Die eines menschlichen Neugeborenen, gibt es auffallende Ähnlichkeiten, wenn die frühe postnatale Hirnentwicklung zwischen Menschen und Schweinen verglichen wird. Bei der Geburt sind die Gehirne von Menschen und Schweinen 27% bzw. 25% des erwachsenen Gewichts. 14 Basierend auf der Arbeit von Johnson Und Kollegen, können wir schließen, dass eine Ferkelwoche ungefähr einem menschlichen Monat entspricht. 9 Diese Ergebnisse, basierend auf wh Ole-Brain-Volumendaten, wurden durch die Arbeit von Arbeiter und Kollegen validiert. 28 Wir haben 7-14 Tage alte Ferkel ausgewählt, um einen Menschen von 1-2 Monaten zu approximieren. Allerdings kann es vorsichtig sein, jüngere Tiere (1-5 Tage alt) zu benutzen, wenn das experimentelle Ziel ist, den Zenit des Ferkelhirnwachstums zu verfolgen. Dies ist machbar, da Ferkel bei der Geburt entwöhnt werden können. Unsere Verwendung des Ferkelmodells wird sich anpassen, wenn neue Daten in Bezug auf die Parallelen zwischen der menschlichen und schweren postnatalen Gehirnentwicklung zur Verfügung stehen.Bedeutung der Technik im Hinblick auf alternative / bestehende Methoden
Das Ferkel besitzt auffallende Ähnlichkeiten mit menschlichen Neugeborenen, einschließlich kritischer Parallelen in der Entwicklung des Gehirns und pathophysiologischen Reaktionen. Es handelt sich also um ein klinisch relevantes Säugetiermodell, und die Proof-of-Concept-Studie zeigt, dass das Ferkel ein geeignetes Modell für die Untersuchung der anästhetischen Neurotoxizität istRef "> 29 , 30. Es kann auch leicht an andere Arten der Entwicklung der neurowissenschaftlichen Forschung angepasst werden.Das Modell ist entworfen, um mit wissenschaftlicher Autorität, das Ausmaß und den Mechanismus der AIDN zu minimieren Bedenken, dass Confounder, wie Hypoxie oder Hypercarbien, zu untersuchen Wodurch neurologische Schäden verursacht werden, die als anästhesieinduziert fehlinterpretiert werden könnten. Um dies zu erreichen, wird das Ferkel mit den gleichen perioperativen chirurgischen und anästhetischen Zuständen behandelt und beobachtet von pädiatrischen Patienten.
Zukünftige Richtungen und Anwendungen nach dem Mastering der Technik
Vorwärts gehen, Ferkel sind auch sehr neurokognitiven Tests zugänglich 17 . Dieses Attribut wird eine komplexe, umfassende Bewertung des neurokognitiven Ergebnisses nach der anästhetischen Exposition in zukünftigen Experimenten ermöglichen. Es sollte auch betont werden, dass in der klinischen Umgebung die Kinder am häufigsten einer Anästhesie ausgesetzt sindRa physiologisch stressiges Verfahren (Chirurgie). Die Wechselwirkungen zwischen Anästhesie und postoperativer Entzündung sowie die daraus resultierende neuronale Verletzung und / oder Toxizität (wie bei Nagetieren und Primaten gesehen) verdienen eine weitere Erforschung und eine beträchtliche Berücksichtigung. Das neonatale Ferkel bietet ein einzigartiges, klinisch relevantes Basismodell für die Auswirkungen von Anästhetika auf das sich entwickelnde Gehirn ohne den verstörenden Einfluss der Operation (Nachahmung gemeinsamer klinischer Szenarien bei Kindern). Die Auswirkungen von verschiedenen Arten von Chirurgie oder anderen Confoundern (Ischämie, Hirnverletzung, genetische Prädisposition, etc. ) können nun mit diesem Modell zuverlässig getestet werden.
Im Labor wollen wir mehrere elektrophysiologische und elektrochemische Methoden einsetzen, um Mechanismen der Anästhesie und AIDN in intakten neuronalen Schaltkreisen weiter zu untersuchen. Diese Techniken umfassen in vivo Messung der Neurotransmitter-Aktivität, Ganzzell-Patch-Clamp-Aufnahmen, Neuroimaging undNeurophysiologische Untersuchungen in Hirnschnitten. In Bezug auf die Neurowissenschaften im unreifen Gehirn sind Ferkel für Menschen besser als murine Modelle mit sehr wenigen der Nachteile, die bei nichtmenschlichen Primaten vorhanden sind. Mit der Weiterentwicklung können Ferkel das ideale Modell für die Forschung in der Neurowissenschaften sein.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden Interessen haben.
Danksagungen
Die Autoren möchten die Beiträge des Ohio State University Laboratory Animal Resource Centers (ULAR) anerkennen.
Materialien
| Name | Company | Catalog Number | Comments |
| Liqui-Wean | Milk Specialities | 454836 | |
| Piglet Anesthesia Face-Cone Mask | VetEquip | 921428 | |
| Masterflex L/S Peristaltic Pump | Cole-Parmer | EW-77916-20 | Alternative peristaltic pumps can be used, as long as a constant and sufficient perfusion rate can be achieved |
| Masterflex L/S Pump Tubing, 25 ft | Cole-Parmer | EW-96410-24 | |
| 14 G angiocatheter | Becton-Dickson | 381164 | |
| 10x PBS | Thermo-Fisher Scientific | ||
| Paraformaldehyde powder | Sigma-Aldrich | P6148-5KG | Our lab makes this reagent from the powder as it is much more cost-effective. Prepared paraformaldehyde can also be purchased. |
| 2-methylbutane | Sigma-Aldrich | M32631-4L | |
| Needle holder | Teleflex | 152720 | |
| Right angle clamp | Teleflex | 496217 | |
| Rongeurs | Teleflex | 028120 | |
| Tenotomy scissors | Teleflex | 423480 | |
| Stitch scissors | Teleflex | 423440 | |
| McPherson Tying Forceps | Teleflex | 425200 | |
| Adson Tissue Forceps | Teleflex | 181223 | |
| 3-0 nylon suture | Medline | ETH627H | |
| Integra SL Anesthesia Workstation | DRE Veterinary | 2350 | This anesthesia workstation is chosen to best mimic the clinical monitoring experienced by pediatric patients in the operating room. Any anesthesia machine can be used as long as it allows for sufficient physiologic monitoring and intervention. |
| Laryngoscope handle | Teleflex | 8710000 | |
| Miller 1 Laryngoscope blade | Teleflex | 2216100 | |
| Bair Hugger | 3M | 750 | |
| Bair Hugger Torso Blanket | 3M | 540 | |
| iStat Handheld | Abbott Point of Care | 300 | Alternative point of care arterial blood gas analysis devices may be used |
| iStat Cartridges | Abbott Point of Care | CG8+ | |
| Dermabond Advanced Topic Skin Adhesive | Ethicon | DNX6 | |
| LMA Laryngotracheal Atomization Device | Teleflex | MAD720 | A cotton-tipped applicator soaked in local anesthetic can also be used |
| Sheridan CF 3.0 Cuffed Endotracheal Tube | Teleflex | 5-10106 | This model ETT was selected because it has a Murphy's eye, which is important to prevent ETT occlusion during the experiment |
| Pediatric Intubation Stylet | Smiths Medical | 100/120/100 | |
| 24 G angiocatheter | Becton-Dickson | 381112 | |
| #10 Disposable Scalpel | Ted Pella, Inc | 549-9-10 | |
| Arterial Pressure Monitoring Kit (3 French, 8 cm catheter) | Cook Medical | C-PMSY-300-FA | Simple polyethylene tubing with a luer-lock adapter can also be used |
| Intramedic PE90 Polyethylene tubing | Fisher Scientific | 14-170-12D | |
| Monoject Blunt Cannula | VWR International | 15141-144 |
Referenzen
- Buie, V. C., Owings, M. F., DeFrances, C. J., Golosinskiy, A. National hospital discharge survey: 2006 annual summary. Vital Health Stat 13. (168), 1-79 (2010).
- Hays, S. R., Deshpande, J. K. Newly postulated neurodevelopmental risks of pediatric anesthesia. Curr Neurol Neurosci Rep. 11, 205-210 (2011).
- Disma, N., Mondardini, M. C., Terrando, N., Absalom, A. R., Bilotta, F. A systematic review of methodology applied during preclinical anesthetic neurotoxicity studies: important issues and lessons relevant to the design of future clinical research. Paediatr Anaesth. 26, 6-36 (2016).
- Loepke, A. W., Vutskits, L. What lessons for clinical practice can be learned from systematic reviews of animal studies? The case of anesthetic neurotoxicity. Paediatr Anaesth. 26, 4-5 (2016).
- Cherubini, E., Rovira, C., Gaiarsa, J. L., Corradetti, R., Ben Ari, Y. GABA mediated excitation in immature rat CA3 hippocampal neurons. International journal of developmental neuroscience. 8, 481-490 (1990).
- Kaindl, A. M., et al. Brief alteration of NMDA or GABAA receptor-mediated neurotransmission has long term effects on the developing cerebral cortex. Mol Cell Proteomics. 7, 2293-2310 (2008).
- Glauser, E. M. Advantages of piglets as experimental animals in pediatric research. Exp Med Surg. 24, 181-190 (1966).
- Dickerson, J., Dobbing, J. Prenatal and postnatal growth and development of the central nervous system of the pig. Proceedings of the Royal Society of London B: Biological Sciences. 166 (1005), 384-395 (1967).
- Conrad, M. S., Johnson, R. W. The domestic piglet: an important model for investigating the neurodevelopmental consequences of early life insults. Annu Rev Anim Biosci. 3, 245-264 (2015).
- Nielsen, K. B., et al. Reelin expression during embryonic development of the pig brain. BMC Neuroscience. 11, 75 (2010).
- Niblock, M. M., et al. Comparative anatomical assessment of the piglet as a model for the devleoping human medullary serotonergic system. Brain Res Brain Res Rev. 50 (1), 169-183 (2005).
- van Straaten, H. W., Peeters, M. C., Hekking, J. W., van der Lende, T. Neurulation in the pig embryo. Anat Embryol (Berl). 202 (2), 75-84 (2000).
- Goureau, A., et al. Conserved synteny and gene order difference between human chromosome 12 and pig chromosome 5. Cytogenetics and cell genetics. 94 (1-2), 49-54 (2001).
- Dobbing, J., Sands, J. Comparative aspects of the brain growth spurt. Early Human Development. 3 (1), 79-83 (1979).
- Istaphanous, G. K., et al. Characterization and quantification of isoflurane-induced developmental apoptotic cell death in mouse cerebral cortex. Anesth Analg. 116 (4), 845-854 (2013).
- Loepke, A. W., et al. The effects of neonatal isoflurane exposure in mice on brain cell viability, adult behavior, learning, and memory. Anesth Analg. 108 (1), 90-104 (2009).
- Sullivan, S., et al. Improved behavior, motor, and cognition assessment in neonatal piglets. J Neurotrauma. 30 (20), 1770-1779 (2013).
- Gieling, E. T., Nordquist, R. E., van der Staay, F. J. Assessing learning and memory in pigs. Anim Cogn. 14 (12), 151-173 (2011).
- Broom, D. M., Sena, H., Moynihan, K. L. Pigs learn what a mirror image represents and use it to obtain information. Animal Behaviour. 78 (5), 1037-1041 (2009).
- Martin, L. J., Spicer, D. M., Lewis, M. H., Gluck, J. P., Cork, L. C. Social deprivation of infant rhesus monkeys alters the chemoarchitecture of the brain: I. Subcortical regions. The Journal of neuroscience. 11 (11), 3344-3358 (1991).
- Rizzi, S., Ori, C., Jevtovic-Todorovic, V. Timing versus duration: determinants of anesthesia-induced developmental apoptosis in the young mammalian brain. Annals of the New York Academy of Sciences. 1199, 43-51 (2010).
- Brambrink, A. M., et al. Isoflurane-induced neuroapoptosis in the neonatal rhesus macaque brain. Anesthesiology. 112 (4), 834-841 (2010).
- Elmore, M. R., et al. Respiratory viral infection in neonatal piglets causes marked microglia activation in the hippocampus and deficits in spatial learning. J Neurosci. 34 (6), 2120-2129 (2014).
- Alonso-Alconada, D., et al. Brain cell death is reduced with cooling by 3.5 degrees C to 5 degrees C but increased with cooling by 8.5 degrees C in a piglet asphyxia model. Stroke. 46 (1), 275-278 (2015).
- Costine, B. A., et al. The subventricular zone in the immature piglet brain: anatomy and exodus of neuroblasts into white matter after traumatic brain injury. Developmental neuroscience. 37 (2), 115-130 (2015).
- Holtzman, D., et al. In vivo phosphocreatine and ATP in piglet cerebral gray and white matter during seizures. Brain research. 783 (1), 19-27 (1998).
- Swindle, M. M. . Swine in the Laboratory. , (2007).
- Workman, A. D., Charvet, C. J., Clancy, B., Darlington, R. B., Finlay, B. L. Modeling transformations of neurodevelopmental sequences across mammalian species. J Neurosci. 33 (17), 7368-7383 (2013).
- Lunney, J. K. Advances in swine biomedical model genomics. International journal of biological sciences. 3 (3), 179-184 (2007).
- Nemzek, J. A., Hugunin, K. M., Opp, M. R. Modeling sepsis in the laboratory: merging sound science with animal well-being. Comparative medicine. 58 (2), 120-128 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten