Method Article
麻酔誘発性発達神経毒(AIDN)研究のための子豚モデルの使用:翻訳神経科学的アプローチ
要約
麻酔誘発性発達神経毒性(AIDN)研究は、ヒトに広く適用されないげっ歯類に焦点を当てている。非ヒト霊長類モデルはより関連性が高いが、費用がかかり、実験に使用することは困難である。対照的に、仔ブタは、麻酔性神経毒性の研究に理想的な、臨床的に関連性のある実用的な動物モデルである。
要約
手術が必要な多くの場合、特に小児で麻酔を避けることはできません。最近の動物実験では、麻酔暴露が麻酔誘発性発達神経毒性(AIDN)として知られているニューロンのアポトーシスにつながる可能性が懸念されています。さらに、小児におけるいくつかの臨床研究では、麻酔曝露が後の人生で神経発達障害を引き起こす可能性があることが示唆されている。それにもかかわらず、前臨床研究のための理想的な動物モデルはまだ開発されていない。新生児の子豚は、ヒトと著しい数の発達上の類似点を共有しているため、前臨床試験の貴重なモデルです。
子豚の解剖学および生理学は、生存および非生存処置の両方において、厳密なヒト周術期状態の実施を可能にする。大腿動脈カテーテル法は、密接なモニタリングを可能にし、したがって、子ブタの生命徴候および化学物質の偏差の迅速な補正を可能にする。私さらに、子豚とヒト新生児との間には複数の発生上の類似点がある。実験のために子豚を使用するのに必要な技術は、経験する必要があります。小児麻酔医は調査チームの重要なメンバーです。我々は、一般的な意味で、神経発達研究のための子豚モデルの適切な使用を記述する。
概要
毎年、米国の何百万人もの子どもが全身麻酔を受け、その多くは4歳未満の子供の1人です。麻酔によって誘発された発達神経毒性(AIDN)は、未熟児に対する麻酔の効果を理解することが不可欠になっているため、小児麻酔研究の焦点となっている。以前の研究では、イソフルランなどの一般的に使用される麻酔薬は、若い動物の脳の神経細胞のアポトーシスを増加させることが示されています。子どもの研究は、不確かな結果をもたらしている2 。 AIDNの病因を理解し、その予防または改善のための潜在的な治療標的を特定し、入手可能な最も安全な麻酔レジメンを記述することは、小児麻酔コミュニティの緊急の目標となっている。この研究の主な目的は、発達中の脳に対する麻酔薬の効果を定量化し、慎重に刺激するための最適な動物モデルおよび方法を開発することであった現在広く使用されている麻酔薬の安全性に関する設計調査を行った。
AIDNに関する前臨床文献の最近の体系的なレビューでは、著者らは900以上の研究3において著しい方法論的異質性を指摘している3 。多くの人がこれを臨床的に関連性が高く、よく設計された前臨床モデルと呼んでいると考えていましたが、これは数年間の研究にもかかわらずまだ存在していません。ほとんどのげっ歯類モデルは、必然的に、厳密な生理学的モニタリング、血液サンプリング、または機械的換気を許容しないアプローチを使用する。脳は生理学的障害に非常に敏感であるので、そのようなモデルの結果に頼るのは難しい。このモデルを開発するための第一の目標は、血液ガスパラメータ、体温、呼吸パラメータなどのすべての生理学的変数を必要に応じて監視および修正するように設計することでした。
4 。翻訳後の子豚モデルは、将来の臨床研究に役立つ適切な前臨床データに対するこの必要性に対処するように設計されているため、これらのレビューおよび論説において追求された臨床関連レベルを提供する。
GABAタイプA(GABA A )レセプターアゴニストおよび弱いNMDAレセプターアンタゴニストであるイソフルランは、世界中の臨床診療において一般的に使用される吸入麻酔剤である。イソフルランのような麻酔薬は、低血圧または低酸素症を誘発しない限り、安全であると考えられてきた。しかし、より微妙な効果が発生している可能性があります。脳が全身麻酔に曝されると、GABAのバランス淋病およびNMDA拮抗作用が崩壊し、細胞構造、接続性および機能に変化が生じる。さらに、GABAは一般的に阻害性の神経伝達物質であるが、未成熟な脳では興奮性であることが知られている5 。 GABAの興奮性から抑制性への移行が正確には理解されておらず、種に依存している可能性が高い。
脳内の興奮性入力と抑制性入力との間の不均衡が、いわゆる「脳成長スパート」の間に起こると、結果として生じる重要な分子経路の興奮毒性調節不全は、アポトーシス性神経変性のような異常な神経発達を導き得る。アポトーシスの増加に加えて、酸化的ストレスおよび炎症も誘発され、神経細胞の増殖、ニューロンの移動および軸索のアブレーションは抑制または調節不全になる。正味の結果は、神経認知障害であり、神経認知障害2 。
若い哺乳動物に対するイソフルランの神経毒性効果を直接測定するために、新生児の子豚が使用される。ピグレットは、他の哺乳動物と比較してヒトとCNSの類似性が高く、神経発達および神経解剖学的類似性により、AIDNの臨床関連哺乳類モデルにとって理想的な動物となっている。ヒトおよび子ブタの両方は、脳奇形、灰白質および白質の特徴および分布において類似性を共有する、幻覚脳を有する。子豚の海馬、基底核、および脳幹も、地形的にはヒトの海馬に類似している7 。発達的に、子豚は、周産期の脳の成長および髄鞘形成を受ける少数の非ヒト哺乳動物の1つである8 。子宮内では、ヒトおよび子ブタの両方の脳が、妊娠後期の妊娠期間中に著しい成長を受ける。相関して、出生時に、ヒトおよびブタの脳は、成人の脳のそれぞれ27%および25%である。磁気共鳴イメージングは、1週齢の子豚の脳が、ニューロンの成熟および樹状突起形成の点で、1ヶ月齢のヒトの脳とほぼ同等であることを明らかにした9 。さらに、子豚とヒトの脳は、神経発達のパターンに関して多くの類似点を共有している。例えば、リーリン10の発現およびmRNA配列、5-HTニューロン11の地形分布、および神経管閉鎖12は、ヒトにおいて見られるものと全て平行である。さらに、子豚とヒトのゲノムの間には大きな相同性がある13 。
動物モデルの妥当性は、ヒトの病理、特にヒト乳児の脳成熟および病理学に関連して理解されなければならない。既存の麻酔毒性試験の大部分は、げっ歯類モデルを使用し、少数は非ヒト霊長類モデル。しかし、げっ歯類や霊長類はAIDNを調べるのに理想的な動物ではないかもしれない。
広く使用されているが、げっ歯類の脳は、発達している間、ヒトの脳とは非常に異なる。最も顕著には、げっ歯類は脳炎(または滑らか)脳を有する。げっ歯類の脳には、より神経学的に複雑な生物の特徴である渦糸および脈絡膜が欠けている。げっ歯類の脳はまた、ヒトおよび子豚とは異なり、出生後の脳成長スパット14を受ける。吸入麻酔薬と異なる脳領域の脆弱性に変化があることが観察されている15 。したがって、AIDNを研究するための動物モデルは、小児患者に見られる可能性が高い麻酔誘発脳変化をモデル化するために、神経発達および神経解剖学的に類似した脳を有することが重要である。以前に記載されたように、子豚は、この役割にはるかに適しています。さらに、モリス水迷路で評価された空間学習や記憶などの齧歯類の神経認知検査の一般的な形態は、幼児の神経認知評価と直接的には関連性がなく、同等でもない16 。発達神経科学に子豚を使用する利点の1つは、早い時期にでも神経認知検査に非常に従順であることです。他の哺乳動物種に有用であると考えられる数多くの神経認知試験が、ブタで首尾よく使用され、検証されている。未だ進化している分野であるが、子豚の神経認知評価には、傾斜ビームモータ試験17,18や鏡面認識試験19など、人間の欠損をよりよく模倣するより複雑な試験が含まれる。子豚の外傷性脳損傷研究の一環として、傾斜ビームを用いた運動試験は、評価において高い信頼性を示すモータ機能のミラーテストは、周辺環境の記憶に加えて、反射イメージを認識して利用して、報酬を探すことを示しています。
一方、非ヒト霊長類は小児麻酔研究のより適切なモデルかもしれませんが、費用や使用の難しさを含む多くの禁止要因があります。さらに、早期飼育条件、特にストレスや母体分離に非常に敏感です。アロステリックモジュレーター、受容体 - リガンド親和性、翻訳後修飾、受容体サブユニット組成、および選択的スプライシング変異体のような、AIDNの研究にとって重要な因子は、霊長類の場合には未知である。これは、そのような概念に関連する遺伝子がクローン化されていないためです。対照的に、それらはブタにクローニングされている。このように、非ヒト霊長類21,22 では限られた研究しか行われていない。
子豚モデルは、げっ歯類および非ヒト霊長類モデルの利点を利用しています。費用効果が高く、ヒト以外の霊長類研究に比べて使いやすく、小児の脳と神経生理学的および神経生理学的に類似しています。神経科学の研究における子豚の使用は、小児の神経炎症状態を調べた多くの研究を含め、近年増加している。脳卒中24後の脳細胞死の減少、外傷性脳損傷後の神経新生25および発作時の酵素活性26は、新生児子豚を用いた研究のいくつかである。この実質的かつ増大する文献は、麻酔の研究のための臨床的に関連性があり再現性の高い子豚モデルの適性および持続性に強みを与えるシア誘導性神経毒性。
プロトコル
健康な家畜子豚( Sus scrofa)は、オハイオ州立大学機関動物管理および使用委員会(IACUC)によって承認された農場から得られる。すべての動物実験は、議定書承認後、オハイオ州立大学IACUC方針に従って行われます。
1.動物および動物の取り扱い
- この実験では、性別の潜在的交絡作用を排除するために、雄性子豚を使用する。注:最大の脳の成長の期間中に実験的な目標が動物に対する実験の影響の評価を含む場合は、14日を超える子ブタを使用しないでください。
- 環境に順応させるために、実験の少なくとも24時間前に子豚を飼育室に到着させるようにスケジュールする。
注:認可された獣医師によって監督された訓練された獣医技師は、日常的な動物のケアを提供しています。- 子ブタを個々の温度制御されたケージに保ち、栄養価を与える完全に商業的な仔ブタの牛乳代替物を自由に摂取させる。毛布とおもちゃを動物に供給してください。動物エンクロージャ内の温度を継続的に監視します。
- この予備的な実現可能性試験のために、イソフルランアームには18頭の子豚を、対照群には22頭の子豚を使用した。可能であれば、試験デザインに基づいてサンプルサイズの計算を行います。適切な長さの曝露のために、利用可能な子豚を対照群または曝露群に無作為化する。経験から、複数の研究者であっても、1日に2回以上の実験を行うことはできません(合計2匹)。
2.コントロール動物
- コントロール動物に対して実験的介入を行わないでください。
- 灌流および組織収集手順のために、顔コーンマスクを介して深い全身麻酔を誘導する。具体的には、24時間の馴化期間後、100%酸素中5%イソフルランまたは8%セボフルランで子豚を麻酔する<em>面コーンマスクを介して。誘導にデスフルランを使用しないでください。
注:麻酔導入から冷PBS灌流までの時間はできるだけ短くする必要があります。経験豊富な技術者が5分以内にこのプロセスを完了できます。- 外科用クランプを使用して結露 - ピンチ反射の欠如により適切な麻酔深度を確認する。
- 脳への低酸素性/虚血性の傷害を避けるために、低温リン酸緩衝生理食塩水(PBS)の灌流が始まるまで、適切な酸素供給、換気、および心拍出量の維持を確実にするためにパルスオキシメーターを用いて子豚を監視する。
注:組織の損傷に対してさらに保護するために、麻酔の誘導後に動物(頭部を含む)を氷に詰めてください。
- 経心臓灌流を行う。
注:パラホルムアルデヒドを使用するため、灌流処置は、煙霧フードの下で、または下降台の上で行うべきである。- 頭蓋骨を作るメスを使用して胸骨の長さに沿ってncision。切開の深さは、胸骨を露出させるのに十分でなければならない。
- 慎重に、心臓、肺、または横隔膜の損傷を避けるために、鋭い重いはさみを用いて正中線の胸骨切開術を行います。必要に応じて、怪我を避けるために、胸骨の後面と胸腔内の内容物の間に指を置いてください。横隔膜に小さな(指の大きさの)切開を作ることによって縦隔に指を動かす。
- 胸腔に入った後、自己保持型リトラクタを用いて胸郭を開いたままにする。
- 鉗子とハサミを使って心膜を切開し、鼓動する心臓を露出させる。心臓を傷つけないように注意してください。
- 左心室を特定し、心室の頂点にカニューレ(14G血管カテーテルなど)を注意深く配置する。針を外し、カテーテルを所定の位置に残す。
注:心室の後壁を穿刺しないように注意してください。カテーテルからの拍動性血液の戻りは、それが適切に配置されていることを示す。血液はこの時点で動物から容易に採取することができる。 - 右心房を特定したら、心房の大きな切開をはさみで行い、放血および灌流液の逃避を可能にすることにより、切開を行う。
注:吸入によるイソフルランは、心臓死が確認されるまで継続すべきである。心臓死は、直接的に観察される心拍出量の欠如によって確認される。
- 寒冷の灌流液を用いて子豚を灌流する(4 °C)ヘパリンを5単位/ mLの濃度で含有するリン酸緩衝生理食塩水(PBS)。毎分300mLで5分間または溶液が透明になるまで灌流する。
- 灌流中に灌流カニューレが外れないように注意してください。これと他のすべての灌流には市販の蠕動ポンプを使用してください。
- 再建のために骨髄切除術を施行する新鮮な組織分析のために脳の1つの半球を動かす。
注:このプロトコルは、新鮮な脳組織の半球の検索を可能にします。他の半球は固定されている。新鮮な組織が必要ない場合は、手順2.6に進んでください。- この手順の間、脳が冷たいままであることを保証するために、時間当たり50mLの速度で氷冷PBSの循環を続ける。
- メスを使用して穴の巨大さまでサジタル縫合の長さに沿って頭皮を縦に切開する。プロセス中に、頭蓋骨にスコアを作成するためにしっかりと圧力をかけてください。頭蓋骨を反射して頭蓋全体を露出させる。
- ロンギュを使用し、孔塞栓術で始めると、下にある脳組織を傷つけないように注意して、頭蓋骨と硬膜の間にロンゲールを挿入することによって、片側の頭蓋骨を取り外す。ロンギュを使って脳の柔組織から離れさせて、骨を部分的に取り除く。
- 頭蓋骨が取り除かれたら、切開して、根底にある脳組織を傷つけないように注意して、鉗子とハサミを使って練習してください。
- コーパスの声門を慎重に分割するために、2つの半球の間にメス刃を置きます。
- 鉗子の広いハンドル端などの平らなツールを使用して、静かに前頭葉を後退させ、徐々に脳神経を切断し、後ろから前に働かせる。半球の最も後部の面で、脊髄を切断するためにメスを使用します。半球をまとめて取り除く。
注:固定されていない脳組織は壊れやすいです。残りの半球の血液供給が中断されないように、半球を取り外すときは注意してください。 - 除去された半球を切断します。指示がある場合は、液体窒素浴中で-160℃に冷却した2-メチルブタン中で急速に凍結し、組織の破損を避け、すぐに後の分析のために-80℃で保存する。
注:脳を2 mm単位で冠状に切除することを推奨しますが、セクション分割は、具体的な実験目標に依存します。
- 灌流液を4%パラホルムアルデヒド(PFA)に変更する。毎分300mLのPFA灌流を少なくとも5分間継続する。
注意! PFAは有毒であり、皮膚、眼、または粘膜との接触を避ける。 PFAの煙霧を吸入しないでください。 - 筋肉にアルデヒド架橋が形成されるため、子豚の体が硬くなることが予想されます。 PFAの灌流が完了した後、ステップ2.5.5で説明したのと同じ方法で残りの半球を除去する。
注:適切に灌流された脳は薄く、完全に放血される。- 残りの半球を4℃の新鮮な4%PFAを入れた小さな容器に入れます。固定プロセスを完了するためにPFAの半球を24〜48時間維持する。
- 24〜48時間後、過剰固定を防ぐことが不可欠であるため、固定脳を0.1%アジ化ナトリウムを含むPBSの溶液に移す。過度の固定は、エピトープのキングまたは強力な非特異的バックグラウンド染色が含まれる。アジ化ナトリウムの添加は細菌の増殖を防止する。
注:組織は4℃で1ヶ月まで保存することができます。
3.イソフルラン(実験的)動物
注:麻酔薬または介入を使用することができますが、吸入の誘導にはデスフルランを推奨しません。
- 麻酔の導入と維持:
- 小児換気装置とモニタリング装置を備えた臨床麻酔ステーションを使用して麻酔を行う。
- 24時間の馴化期間の後、100%O 2中の8%セボフルランで顔面コーンマスクを介して子豚を麻酔する。
- 誘導期間中および研究中常にパルスオキシメトリー、非侵襲的血圧、心電図、および温度を継続的に監視する。
- 誘導後、セボフルランまたはイソフルールを滴定する。(典型的には3〜4%の濃度で)持続的な自発呼吸を確保しながら、適切な麻酔深度を可能にする濃度まで上昇させる。
- 周辺耳静脈に24 Gの末梢静脈カテーテルを置く( 図1 )。
- 気管挿管のため背側リカンベントの位置に子豚を置きます( 図2 、パネルA)。下咽頭の計装および気管挿管を容易にするために、Miller#1または#1.5ブレードを使用します。注:喉頭鏡検査では、経験豊富なオペレーターとアシスタントが必要です。
- アシスタントに喉頭の露出と声帯の可視化を容易にするためにドライガーゼを用いて動物の舌を置換させる( 図 2B )。
注:豚の喉頭蓋は形態学的にはヒトの喉頭蓋に類似している( 図 2C )。子豚のボーカルコーラルdsは喉頭入口( 図 2d)内で数ミリメートルの深さであるため、視覚化するのが困難である可能性がある。 - 喉頭蓋を置き換える:喉頭鏡の刃先を喉頭蓋の下に置き、刃を上に上げて喉頭を露出させる。
- 気管内にチューブを配置する前に、子豚が特に喉頭痙攣を起こしやすいので、気管内チューブの通過中に喉頭痙攣を防ぐために、2%リドカイン0.5mLを声帯に噴霧する。
- アシスタントに喉頭の露出と声帯の可視化を容易にするためにドライガーゼを用いて動物の舌を置換させる( 図 2B )。
- 3.0 mmのカフ付き気管チューブを置き、固定する。
- 聴診器およびEtCO 2モニタリングによる胸腔聴診を使用して、両側呼吸音および持続気道二酸化炭素を確保する。
- 子豚の肺を20cm H 2 Oの連続気道圧にまで膨らませる。気管チューブのカフを20cm Hの圧力で空気漏れを防ぐのに必要な最小圧力にまで膨らませる。 2 O、存在する場合には空気漏れを識別するために気管を聴く。
注:これは、間欠的陽圧換気中の粘膜虚血を防ぐために重要です。 - Normoxiaとnormocarbiaは麻酔中維持されます。
- 50%酸素/ 50%空気中で2%イソフルランの投与を開始する。 PaO 2を90〜100mmHgに維持するために酸素を滴定する。 3時間(または所望の実験期間)継続する。
- 眼の軟膏を眼に塗布して、麻酔の持続期間中の乾燥を防止する。
- 2%イソフルランの開始後に大腿動脈カテーテル法を開始する。
- 外科的部位の感染を防ぐために末梢静脈ラインを介して広域抗生物質の切開(セファゾリン、25mg / kg) を投与する。
- 適切な滅菌野を確保するために、着色クロルヘキシジンを使用して両方の鼠径部を滅菌し、適切な滅菌ドレープを置きます( 図3 B )。 生存手術に参加するスタッフは、最低限、外科用キャップ、マスク、無菌手袋、および眼の保護具を着用する必要があります。
- 指および中指を使用して鼠蹊部の折り目に大腿脈を触診する。
- メスを使用して、1.5cmの頭蓋骨切開を表面的に行います( 図 3C )。
- 外科用止血鉗子や鈍い先端がはさみのような鈍い器具を用いて、平滑筋の2つの頭部の間で解剖する( 図 3D )。
注:大腿神経細胞バンドルは、典型的には、これらの2つの筋肉の間およびその真ん中に見出される。 ( 図4A )。 - 血管ループまたはシルクタイを使用して、近位および遠位端で動脈を隔離する。ループを使用して、動脈を皮膚のレベルまで遠位に引き上げる( 図 4B )。
- 中近位のネクタイに牽引力をかけて血流を中断させ、一対の細動切開ハサミで小動脈切開を行う。
- 動脈を横切らないように注意してください。小さな動脈切開で十分である。あるいは、動脈にアクセスするための針とワイヤのアプローチを使用します( 図4C )。
- 近位のネクタイを穏やかに牽引することにより、この部分の処置中の任意の時点での過剰な失血を防ぐことができる。針とワイヤのアプローチを使用する場合は、ガイドワイヤー(キットに付属または別途入手)を針を通して動脈に5cmまで通します。
- 心電図検査の原因となる可能性があるため、ワイヤをさらに前進させないように注意してください。これが発生した場合は、すぐにワイヤを1〜2cm離してください。
- 容器の中にガイドワイヤーを残すよう注意しながら、針を容器から外す。カテーテルをワイヤー上および血管内に静かに通す( 図4 D)。
- 大腿動脈カテーテル挿入には、3フレンチの8センチメートルのカテーテルを使用します。カテーテルの先端が最初に血管の表面の壁に入ると、軽度の抵抗を期待する。
- 動脈切開アプローチを使用する場合は、カテーテルまたはポリエチレンチューブを直接血管に進めます。直ちに血液の採取を観察すること。
- 直ちに圧力変換器に取り付けられたカテーテルを取り付けます。カテーテルを正常生理食塩水で洗浄して、カテーテルの開存性を維持する。
- カテーテルを所定の位置に固定するための縫合を行う。汚れを防ぐために切開部を滅菌ガーゼで覆う。大腿動脈カテーテル法に対する経皮的アプローチを利用する。
注:経験豊かな技術者が超音波検査を実施していることを確認してください。
- カテーテルを所定の位置に固定するための縫合を行う。汚れを防ぐために切開部を滅菌ガーゼで覆う。大腿動脈カテーテル法に対する経皮的アプローチを利用する。
- 手術中の状態およびモニタリング:
- 子豚を強制空気加温装置で積極的に温め、直腸温度( 図3A )。
- 維持速度(ブタの体重(キログラム)、mL /時間の4倍)でデキストロース含有、等張液(リンガー乳酸塩または生理食塩水中5%デキストロース)を維持する。
- 摂動(低血圧、不整脈、低体温/高体温、低酸素症)のバイタルサインを監視する
注:正常な生命徴候範囲および異常の場合の対応する推奨管理を表1に要約する。 - 市販の血液分析システムを使用して、実験中に少なくとも毎時間、動脈血ガス(動脈血pH、pCO 2 、pO 2 )、電解質(重炭酸塩、塩基過不足、ナトリウム、カリウム、イオン化カルシウム)、ヘモグロビン、期間。大腿動脈カテーテルから動脈血サンプルを採取する。
注:異常が認められた場合の修正のための推奨事項とともに、通常の酸塩基と電解液の値表1にまとめられている 。
- イソフルラン暴露3時間後、大腿動脈カテーテルを外す。
- 近位の血管の絹を慎重に結んで出血を防ぐために大腿動脈を恒久的に閉塞させる。あるいは、血管クリップを使用します。
- 切開を閉じる前に完全な止血を確保する。切開部を10-20 mLの滅菌生理食塩水で灌流し、感染を防ぐ。
- 実験の終了時に、3-0の非吸収性縫合材料を用いて、単純な中断した縫合糸で皮膚切開部を閉じる。
- 疼痛管理のために0.5:1mL / kgの0.25%ブピバカインと1:200,000のエピネフリンを用いて創傷に浸潤させる。切開部を滅菌した外科用皮膚接着剤で覆う。
注:ドレッシングは必要ありません。
- 疼痛管理のために0.5:1mL / kgの0.25%ブピバカインと1:200,000のエピネフリンを用いて創傷に浸潤させる。切開部を滅菌した外科用皮膚接着剤で覆う。
- 麻酔薬を中止し、仔ブタを目覚めさせる。
- アワの徴候が現れたら気管内チューブを外す安定した血行動態、十分な酸素供給、適切な換気の徴候を伴い、ケーニング(目の開放、立てかけ、蹴り、口の開閉)
- 抜管後、酸素供給と換気の妥当性が確保されるまで補給用酸素をフェイスコーンで供給します。
- 追加の疼痛管理のために、ブプレノルフィン0.05mg / kgを皮下投与する。あるいは、経皮フェンタニルを使用することができる。
- 適切な場合は、子豚を家のかごに戻してください。胸骨の臥位を維持するのに十分な意識が回復するまで、仔ブタを放置しないでください。麻酔から完全に回復するまで動物を他の動物と共にケージに戻さないでください。
- 暖かい光でプライベートホームケージを積極的に暖めます。
- 訓練された獣医師または研究スタッフが麻酔後に動物を密接に監視する。豚の牛の代替品を提供する。
- 子豚に回復させる実験的な目標に応じて、48-72時間。
- 動物の術後不快感をコントロールするために経験した動物看護スタッフの裁量で、ブプレノルフィンをブタノルフィンで適切な用量で3時間ごとに皮下注射し、痛みのコントロールを確保する。
- 手術後最初の6時間およびその後4時間ごとに子豚を毎時監視する。上記の動物をコントロールするのと同じ方法で動物の犠牲と組織の調達を行います。
結果
40頭の子豚を研究した(18頭イソフルラン、22頭対照)。研究手順はすべての動物によって十分に許容された。調べられたすべての子ブタは男性であった。年齢または体重に関する群間に有意差はなかった( 表2、 図5 )。イソフルラン群における実験中の平均実験室値を表3に示す 。これらの値は、我々が2年間にわたって手術を行っている複数の技術者を有していたため、実験プロトコールが内部の一貫性および再現性を有することを示している。これらの数字は、生理的止血を維持するために手術中に実施しなければならない多くの調整と修正である。 CO 2保持、低体温、低血糖は、必要に応じて包括的なモニタリングと調整を避けた多くの混乱要因の一部です。
t "fo:keep-together.within-page =" 1 ">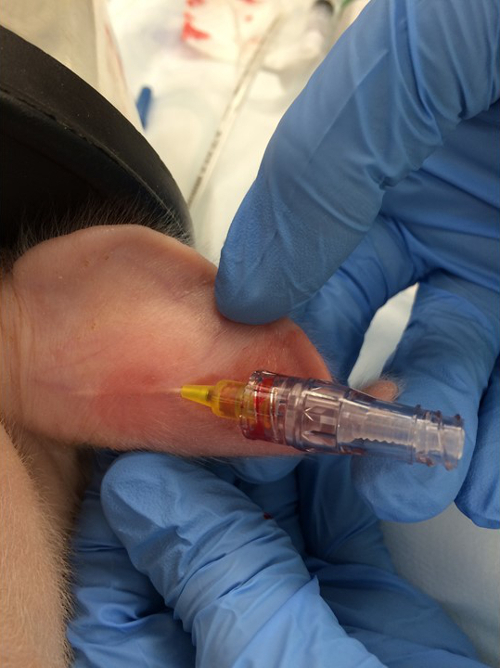
図1:。末梢静脈ラインの配置。 24 Gの静脈内カテーテルを周縁耳静脈に配置する。 この図の拡大版を見るには、ここをクリックしてください。
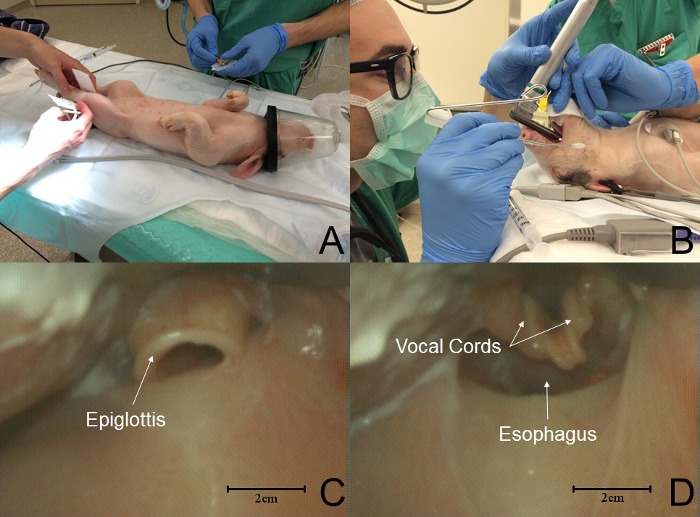
図2:ピグレット挿管におけるイベントのシーケンス。 ( A )挿管のために小豚を横臥位に置く。標準モニターが置かれます。 ( B )喉頭鏡検査医が喉頭鏡検査を行う間に、助手が口腔から舌を動かした。 ( C )喉頭蓋は形態学的にヒトのそれと同様である。この図では、thの先端刃は谷にあります。 ( D )ブタの喉頭の解剖学的構造はヒトのそれとは明らかに異なる;声帯は喉頭の入口まで数ミリメートルの深さである。この図では、刃の先端が喉頭蓋を露出させて喉頭を露出させている。 この図の拡大版を見るには、ここをクリックしてください。
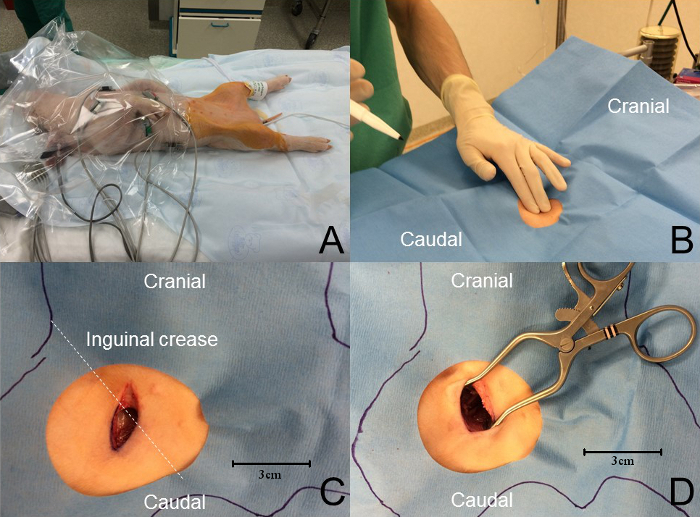
図3:大腿動脈アプローチ。 ( A )強制空気加温装置を用いて動物の温度を維持する。モニタリングは手順全体を通して使用されます。染色されたクロルヘキシジンで幅広い滅菌野を調製し、動物を有孔滅菌ドレープで覆う。 ( B )鼠蹊部の折り目の触診により大腿脈が現れる。 ( C )A cr鼠径部の皺にほぼ垂直で、長さが約1.5cmの腹腔内皮膚切開を大腿脈を覆うように行う。 ( D )鈍的切開が達成され、大腿神経細胞束が露出される。 この図の拡大版を見るには、ここをクリックしてください。
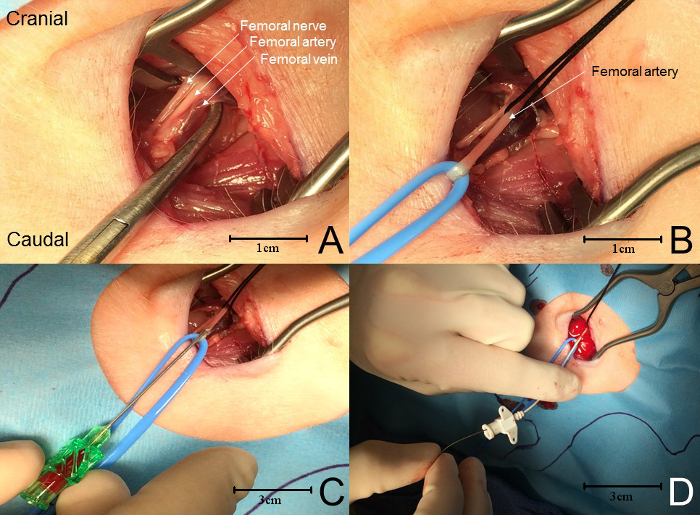
図4:大腿動脈カニューレ。 ( A )外側から内側に向かって、神経血管バンドルは、大腿神経、動脈、および静脈を含む。 ( B )血管ループおよび/または縫合を用いて大腿動脈を単離する。近位の結び目に持続的な張力があると、動脈が穿刺されている間に過剰な失血を防ぐ(血管の白化を参照)。 ( C )大腿骨を穿刺するために針が使用される動脈の後壁の穿孔を避ける。血液が戻ると、針を通してガイドワイヤーが動脈内に進められる。 ( D )針を外し、カテーテルをガイドワイヤ上を進めて 大腿動脈。 この図の拡大版を見るには、ここをクリックしてください。
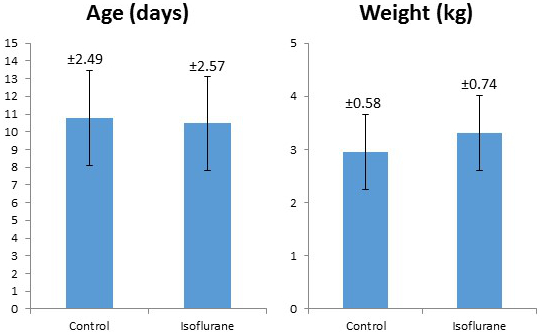
図5:対照およびイソフルラン処理小豚の平均体重および齢の比較。エラーバーは+/- 1標準偏差を表し、標準偏差値は各エラーバーの上に記載されています。
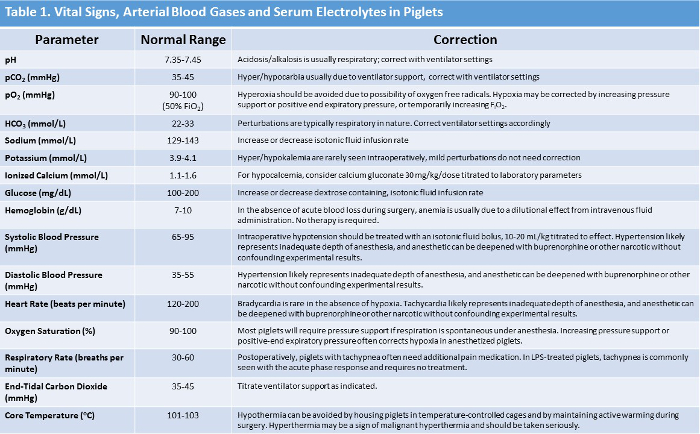
表1:正常な豚のバイタルサイン、Arteriの概要血液ガス、および血清電解質の値を提案する。 この表のより大きなバージョンを表示するには、ここをクリックしてください。
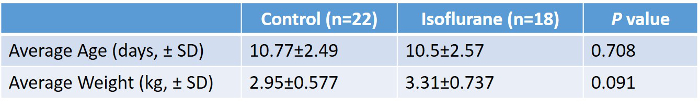
表2:イソフルラン処理小豚に対する対照の平均体重および齢のまとめ。対になっていない2尾のT検定が行われ、2つの群の間に有意差は見られなかった。 この表のより大きなバージョンを表示するには、ここをクリックしてください。
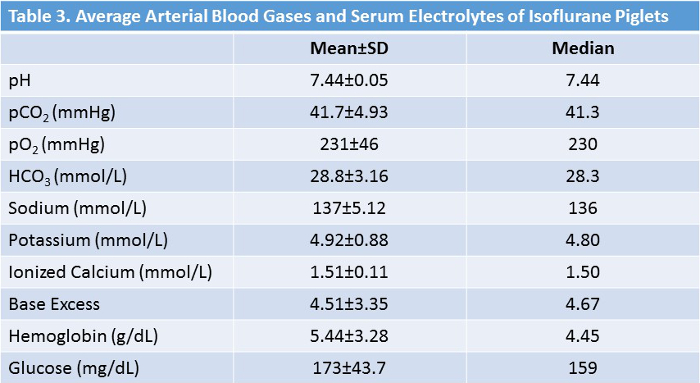
表3:イソフルラン処置動物の平均バイタルサインおよびラボ値。 thのコースの間にバイタルサインおよびラボ値の正常範囲からの偏差が速やかに是正される。 この表のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
クリティカルなプロトコルのステップ/トラブルシューティング
実験が始まると、非侵襲性生命徴候のモニタリングは誘導から始めるべきである。血圧、心拍数、酸素飽和度、直腸温度を容易に取得して監視することができます。これらの動物は全身麻酔下で迅速に低体温になることがあるので、子豚は十分な体温を維持するために温熱装置の下に置かれるべきである。末梢静脈カテーテルの迅速な配置は、誘発中に起こった場合の緊急事態の治療を可能にする。イソフルラン処置および屠殺処置の両方を通して、非侵襲的または侵襲的に子豚を連続的に監視することが重要である。子豚は、特に気道管理および挿管中に、プロトコールを通して複数の段階で非常に迅速に動脈酸素不飽和化を経験することができる。我々は、8%のセボフルランを使用して、人間の小児科の診療を再現し、かつ麻酔するために麻酔を誘発する誘導。しかしながら、5%イソフルランが首尾よく使用され、適切である。解剖学的な違いと喉頭痙攣の素因を考慮すると、子豚は挿管困難な場合があります。誘導および/または気道管理中に仔ブタが枯渇し始める場合、安全な酸素飽和レベルおよび十分な麻酔深度を再確立するために、100%酸素およびセボフルランを直ちにフェイスコーンを介して投与すべきである。麻酔の面は挿管可能な深さでなければならないが、過度の麻酔は無呼吸につながる可能性があることに留意する。動物の換気および酸素供給に関する継続的な警戒が必要であり、それに応じて吸入麻酔薬の滴定が必要である。その後、酸素補給が回復し、適切な麻酔が達成されたら、挿管を再開することができる。フェイスコーンによる陽圧換気が試みられる可能性がありますが、通常失敗します。喉頭痙攣が起こる場合、リドカイン溶液を直接vocに適用する気道挿管を可能にするように指示されている。
緊急時の薬物療法は常に利用可能であり、生理学的障害を是正するためにプロトコルの重要な部分で必要に応じて投与すべきである。子豚の麻酔および緊急薬の使用に関する徹底的な議論はこの原稿の範囲外であるが、スウィンドルの「実験室における豚:手術、麻酔、画像および実験技術」は優れた資源である。 27
同様に、子豚は、正中線胸骨切開の間に胸腔を開いた後、犠牲の間に急速に不飽和化し始める可能性がある。オペレーターは心臓を露出させるために迅速かつ安全に作業し、冷たいPBSを開始するために血管カテーテルを挿入する必要があります。脳への虚血性損傷を防ぐために、徹底的に冷PBS灌流(およびPFAによる迅速な固定)が必要である。
子豚に挿管されると、respi覚醒速度と呼吸終期の二酸化炭素追跡が始まる( 表1 )。適切な麻酔を維持しながら人工呼吸器のサポートを滴定することにより、子豚の呼吸終末の酸素供給と換気を安定させる。私たちは人間のできるだけ近いものを模倣するために機械換気を使用しています。酸化ストレスの可能性を最小限にするために、過酸素を避けるべきです。
イソフルラン子豚は、以下の2つの理由から大腿動脈カニューレ挿入を受ける:動脈血圧を連続的に監視すること。手順全体を通して酸塩基状態、血液ガス、および電解質を評価するために動脈血をサンプリングすることができる。大腿動脈のカニューレ挿入は困難であり得る。詳細はビデオをご覧ください。生存実験のために、この手順は、滅菌条件下で滅菌操作環境で行うべきである。大腿動脈のカニューレ挿入後、必要に応じて動脈血ガスおよび血清電解質の1時間ごとのモニタリングを開始し、ホメオスタシスを維持する( 表1 )。子ブタは、適切な血糖を維持するために、連続デキストロース含有等張液を受けるべきである。実験を通して、動物は正常体温について継続的に監視され、必要に応じて強制空気加温が提供されるべきである。低体温と温熱療法を避けることも同様に重要です。
このプロトコルは「新鮮な」脳と固定された神経組織の1つの半球の半球を提供するが、これは別の研究デザインに適応するように容易に適合させることができる。子豚からもサンプルを採取することができます。 CSFは、蛍光透視検査の案内の有無にかかわらず、仔ブタを麻酔した後に得ることができる。血液はまた、大腿動脈カテーテルからのものを含むプロトコールの様々な段階で、ならびに灌流の直前に血管カテーテルを介して左心室から直接採取することもできる。回復期はまた、延長されてもよいし、sh慢性または急性応答の検査のために、それぞれ矯正された。
技術の限界
このプロトコルとモデルは技術的に困難です。特に生存実験のためには、熟練した研究者および完全に供給される手術室が必要である。治験責任医師(およびプロトコルの特定の部分のアシスタント)は、このプロトコールの外科的および麻酔的成分の両方に快適でなければならない。ブタモデルは非ヒト霊長類よりはるかに低コストであるが、他の制限には、げっ歯類モデルに対する子豚の費用が含まれる。子豚のコストは、動物が得られる地域や牧場によって異なるが、1匹当たり500ドル未満であるのに対し、非ヒト霊長類は動物1匹当たり数千ドルであることが予想される。私たちの経験では、1匹あたりの平均費用は約200ドルです。
jove_content ">最後に、発達中のヒトの脳を模倣することが仔ブタモデルの目的であるため、新生児の子豚のみを使用すべきである。中枢神経系は急速な成長期間中に最も脆弱であり、出生直前の6週間から出生後5週間までの8日である.8歳の仔ブタを分娩日より遠くに使用することは、仔ブタモデルの臨床的関連性を弱める危険性をもたらす。ヒトとブタの脳の初期発生が比較されると、著しい類似点があります。出生時には、ヒトとブタの脳はそれぞれ成人体重の27%と25%です14ジョンソンの研究我々は、1匹の子豚の週が1匹の人間の月にほぼ等しいことを推測することができます9。これらの結果は、wh脳の体積データは、Workmanらの研究によって検証されている。我々は1-2ヵ月齢のヒトを近似させるために、7-14日齢の子豚を選択した。しかし、実験的な目標が子豚の脳の成長スパットの天頂を模倣することである場合は、より若い動物(1~5日齢)を使用することは賢明かもしれません。子豚は出産時に離乳することができるので、これは実現可能です。ブタモデルの使用は、ヒトとブタの出生後の脳の発達の間の類似点に関して新しいデータが利用可能になるにつれて適応する。代替/既存の方法に関する技術の意義
この子豚は、脳の発達および病態生理学的反応における重要な類似点を含む、ヒト新生児と著しい類似点を有する。したがって、臨床関連の哺乳動物モデルであり、概念実証研究は、子豚が麻酔性神経毒性の研究に適したモデルであることを示している他のタイプの発達神経科学研究にも容易に適応することができる。このモデルは、科学的な権限で、AIDNの程度およびメカニズムを調査して、低酸素症や高炭酸などの混乱を最小限にする懸念を最小限に抑えるように設計されている。これを達成するために、子宮摘出術は、同じ周術期外科的および麻酔的状態および小児患者の経験によるモニタリングで処置される。
テクニックを習得した後の今後の方向性と応用
前方へ進むにつれて、子豚は神経認知検査にも非常に従順である17 。この属性は、将来の実験における麻酔暴露後の神経認知結果の複雑で包括的な評価を可能にする。また、臨床現場では、子供が最も頻繁に麻酔を受けることが強調されるべきであるRA生理的ストレスを伴う手技(手術)。麻酔と手術後の炎症の間の相互作用、ならびに結果として生じるニューロンの傷害および/または毒性(げっ歯類および霊長類に見られるような)は、さらなる探索および重要な考慮に値する。新生児の子豚は、手術の混乱する影響なしに、発達中の脳に対する麻酔薬の効果のためのユニークで臨床的に関連するベースラインモデルを提供する(子供の一般的な臨床シナリオを模倣する)。異なるタイプの外科手術または他の混乱(虚血、脳傷害、遺伝的素因など )の影響は、このモデルを用いて確実に試験することができる。
研究室では、無傷の神経回路における麻酔とAIDNのメカニズムをさらに調べるために、複数の電気生理学的および電気化学的方法を使用する予定です。これらの技術には、神経伝達物質活性のインビボ測定、全細胞パッチクランプ記録、神経イメージング、および脳スライスにおける神経生理学的研究。未成熟脳における神経科学に関して、子豚は、非ヒト霊長類に存在する欠点のごくわずかのマウスモデルよりも、ヒトに関連性が高い。さらなる開発により、子豚は、ヒト発生神経科学研究の理想的なモデルとなり得る。
開示事項
著者らは、競合する利益がないと宣言している。
謝辞
著者らは、オハイオ州立大学研究所動物資源センター(ULAR)の貢献を認めたがっています。
資料
| Name | Company | Catalog Number | Comments |
| Liqui-Wean | Milk Specialities | 454836 | |
| Piglet Anesthesia Face-Cone Mask | VetEquip | 921428 | |
| Masterflex L/S Peristaltic Pump | Cole-Parmer | EW-77916-20 | Alternative peristaltic pumps can be used, as long as a constant and sufficient perfusion rate can be achieved |
| Masterflex L/S Pump Tubing, 25 ft | Cole-Parmer | EW-96410-24 | |
| 14 G angiocatheter | Becton-Dickson | 381164 | |
| 10x PBS | Thermo-Fisher Scientific | ||
| Paraformaldehyde powder | Sigma-Aldrich | P6148-5KG | Our lab makes this reagent from the powder as it is much more cost-effective. Prepared paraformaldehyde can also be purchased. |
| 2-methylbutane | Sigma-Aldrich | M32631-4L | |
| Needle holder | Teleflex | 152720 | |
| Right angle clamp | Teleflex | 496217 | |
| Rongeurs | Teleflex | 028120 | |
| Tenotomy scissors | Teleflex | 423480 | |
| Stitch scissors | Teleflex | 423440 | |
| McPherson Tying Forceps | Teleflex | 425200 | |
| Adson Tissue Forceps | Teleflex | 181223 | |
| 3-0 nylon suture | Medline | ETH627H | |
| Integra SL Anesthesia Workstation | DRE Veterinary | 2350 | This anesthesia workstation is chosen to best mimic the clinical monitoring experienced by pediatric patients in the operating room. Any anesthesia machine can be used as long as it allows for sufficient physiologic monitoring and intervention. |
| Laryngoscope handle | Teleflex | 8710000 | |
| Miller 1 Laryngoscope blade | Teleflex | 2216100 | |
| Bair Hugger | 3M | 750 | |
| Bair Hugger Torso Blanket | 3M | 540 | |
| iStat Handheld | Abbott Point of Care | 300 | Alternative point of care arterial blood gas analysis devices may be used |
| iStat Cartridges | Abbott Point of Care | CG8+ | |
| Dermabond Advanced Topic Skin Adhesive | Ethicon | DNX6 | |
| LMA Laryngotracheal Atomization Device | Teleflex | MAD720 | A cotton-tipped applicator soaked in local anesthetic can also be used |
| Sheridan CF 3.0 Cuffed Endotracheal Tube | Teleflex | 5-10106 | This model ETT was selected because it has a Murphy's eye, which is important to prevent ETT occlusion during the experiment |
| Pediatric Intubation Stylet | Smiths Medical | 100/120/100 | |
| 24 G angiocatheter | Becton-Dickson | 381112 | |
| #10 Disposable Scalpel | Ted Pella, Inc | 549-9-10 | |
| Arterial Pressure Monitoring Kit (3 French, 8 cm catheter) | Cook Medical | C-PMSY-300-FA | Simple polyethylene tubing with a luer-lock adapter can also be used |
| Intramedic PE90 Polyethylene tubing | Fisher Scientific | 14-170-12D | |
| Monoject Blunt Cannula | VWR International | 15141-144 |
参考文献
- Buie, V. C., Owings, M. F., DeFrances, C. J., Golosinskiy, A. National hospital discharge survey: 2006 annual summary. Vital Health Stat 13. (168), 1-79 (2010).
- Hays, S. R., Deshpande, J. K. Newly postulated neurodevelopmental risks of pediatric anesthesia. Curr Neurol Neurosci Rep. 11, 205-210 (2011).
- Disma, N., Mondardini, M. C., Terrando, N., Absalom, A. R., Bilotta, F. A systematic review of methodology applied during preclinical anesthetic neurotoxicity studies: important issues and lessons relevant to the design of future clinical research. Paediatr Anaesth. 26, 6-36 (2016).
- Loepke, A. W., Vutskits, L. What lessons for clinical practice can be learned from systematic reviews of animal studies? The case of anesthetic neurotoxicity. Paediatr Anaesth. 26, 4-5 (2016).
- Cherubini, E., Rovira, C., Gaiarsa, J. L., Corradetti, R., Ben Ari, Y. GABA mediated excitation in immature rat CA3 hippocampal neurons. International journal of developmental neuroscience. 8, 481-490 (1990).
- Kaindl, A. M., et al. Brief alteration of NMDA or GABAA receptor-mediated neurotransmission has long term effects on the developing cerebral cortex. Mol Cell Proteomics. 7, 2293-2310 (2008).
- Glauser, E. M. Advantages of piglets as experimental animals in pediatric research. Exp Med Surg. 24, 181-190 (1966).
- Dickerson, J., Dobbing, J. Prenatal and postnatal growth and development of the central nervous system of the pig. Proceedings of the Royal Society of London B: Biological Sciences. 166 (1005), 384-395 (1967).
- Conrad, M. S., Johnson, R. W. The domestic piglet: an important model for investigating the neurodevelopmental consequences of early life insults. Annu Rev Anim Biosci. 3, 245-264 (2015).
- Nielsen, K. B., et al. Reelin expression during embryonic development of the pig brain. BMC Neuroscience. 11, 75 (2010).
- Niblock, M. M., et al. Comparative anatomical assessment of the piglet as a model for the devleoping human medullary serotonergic system. Brain Res Brain Res Rev. 50 (1), 169-183 (2005).
- van Straaten, H. W., Peeters, M. C., Hekking, J. W., van der Lende, T. Neurulation in the pig embryo. Anat Embryol (Berl). 202 (2), 75-84 (2000).
- Goureau, A., et al. Conserved synteny and gene order difference between human chromosome 12 and pig chromosome 5. Cytogenetics and cell genetics. 94 (1-2), 49-54 (2001).
- Dobbing, J., Sands, J. Comparative aspects of the brain growth spurt. Early Human Development. 3 (1), 79-83 (1979).
- Istaphanous, G. K., et al. Characterization and quantification of isoflurane-induced developmental apoptotic cell death in mouse cerebral cortex. Anesth Analg. 116 (4), 845-854 (2013).
- Loepke, A. W., et al. The effects of neonatal isoflurane exposure in mice on brain cell viability, adult behavior, learning, and memory. Anesth Analg. 108 (1), 90-104 (2009).
- Sullivan, S., et al. Improved behavior, motor, and cognition assessment in neonatal piglets. J Neurotrauma. 30 (20), 1770-1779 (2013).
- Gieling, E. T., Nordquist, R. E., van der Staay, F. J. Assessing learning and memory in pigs. Anim Cogn. 14 (12), 151-173 (2011).
- Broom, D. M., Sena, H., Moynihan, K. L. Pigs learn what a mirror image represents and use it to obtain information. Animal Behaviour. 78 (5), 1037-1041 (2009).
- Martin, L. J., Spicer, D. M., Lewis, M. H., Gluck, J. P., Cork, L. C. Social deprivation of infant rhesus monkeys alters the chemoarchitecture of the brain: I. Subcortical regions. The Journal of neuroscience. 11 (11), 3344-3358 (1991).
- Rizzi, S., Ori, C., Jevtovic-Todorovic, V. Timing versus duration: determinants of anesthesia-induced developmental apoptosis in the young mammalian brain. Annals of the New York Academy of Sciences. 1199, 43-51 (2010).
- Brambrink, A. M., et al. Isoflurane-induced neuroapoptosis in the neonatal rhesus macaque brain. Anesthesiology. 112 (4), 834-841 (2010).
- Elmore, M. R., et al. Respiratory viral infection in neonatal piglets causes marked microglia activation in the hippocampus and deficits in spatial learning. J Neurosci. 34 (6), 2120-2129 (2014).
- Alonso-Alconada, D., et al. Brain cell death is reduced with cooling by 3.5 degrees C to 5 degrees C but increased with cooling by 8.5 degrees C in a piglet asphyxia model. Stroke. 46 (1), 275-278 (2015).
- Costine, B. A., et al. The subventricular zone in the immature piglet brain: anatomy and exodus of neuroblasts into white matter after traumatic brain injury. Developmental neuroscience. 37 (2), 115-130 (2015).
- Holtzman, D., et al. In vivo phosphocreatine and ATP in piglet cerebral gray and white matter during seizures. Brain research. 783 (1), 19-27 (1998).
- Swindle, M. M. . Swine in the Laboratory. , (2007).
- Workman, A. D., Charvet, C. J., Clancy, B., Darlington, R. B., Finlay, B. L. Modeling transformations of neurodevelopmental sequences across mammalian species. J Neurosci. 33 (17), 7368-7383 (2013).
- Lunney, J. K. Advances in swine biomedical model genomics. International journal of biological sciences. 3 (3), 179-184 (2007).
- Nemzek, J. A., Hugunin, K. M., Opp, M. R. Modeling sepsis in the laboratory: merging sound science with animal well-being. Comparative medicine. 58 (2), 120-128 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved