Method Article
Uso de um Modelo de Leitão para o Estudo da Neurotoxicidade de Desenvolvimento induzida por Anestesismo (AIDN): Uma Abordagem de Neurociências Translacionais
Neste Artigo
Resumo
A pesquisa de neurotoxicidade do desenvolvimento induzida por anestesia (AIDN) focalizou os roedores, que não são amplamente aplicáveis aos seres humanos. Os modelos de primatas não humanos são mais relevantes, mas são custo-proibitivos e difíceis de usar para a experimentação. O leitão, ao contrário, é um modelo animal clinicamente relevante, prático, ideal para o estudo da neurotoxicidade anestésica.
Resumo
A anestesia não pode ser evitada em muitos casos quando a cirurgia é necessária, particularmente em crianças. Pesquisas recentes em animais suscitaram preocupações de que a exposição à anestesia pode levar à apoptose neuronal, conhecida como neurotoxicidade de desenvolvimento induzida por anestesia (AIDN). Além disso, alguns estudos clínicos em crianças sugeriram que a exposição à anestesia pode levar a déficits de desenvolvimento neurológico mais tarde na vida. No entanto, um modelo animal ideal para estudo pré-clínico ainda não foi desenvolvido. O leitão neonatal representa um modelo valioso para o estudo pré-clínico, pois compartilham um número impressionante de semelhanças de desenvolvimento com humanos.
A anatomia e a fisiologia dos leitões permitem a implementação de condições perioperatórias humanas rigorosas nos procedimentos de sobrevivência e não sobrevivência. O cateterismo da artéria femoral permite um monitoramento próximo, permitindo assim a pronta correção de qualquer desvio dos sinais vitais e químicas do leitão. EuAlém disso, existem várias semelhanças de desenvolvimento entre leitões e recém-nascidos humanos. As técnicas necessárias para usar leitões para experimentação exigirão a experiência dominar. Um anestesista pediátrico é um membro crítico da equipe de investigação. Descrevemos, em um sentido geral, o uso adequado de um modelo de leitão para o estudo do desenvolvimento neurológico.
Introdução
Todos os anos, milhões de crianças nos EUA recebem anestesia geral, muitas delas com menos de 4 anos de idade 1 . A neurotoxicidade do desenvolvimento induzida por anestesia (AIDN) tornou-se um foco de pesquisa de anestesia pediátrica, uma vez que tornou-se imperativo adquirir uma compreensão dos efeitos da anestesia em cérebros imaturos. Pesquisas anteriores mostraram que os anestésicos comumente usados, como o isoflurano, podem causar aumento da apoptose neuronal no cérebro de animais jovens. Estudos em crianças produziram resultados equívocos 2 . Compreender a patogênese do AIDN, identificar potenciais alvos terapêuticos para sua prevenção ou melhoria, e descrever os regimes anestésicos mais seguros disponíveis tornaram-se objetivos urgentes da comunidade de anestesia pediátrica. O objetivo principal deste estudo foi desenvolver um ótimo modelo e método animal para quantificar os efeitos dos anestésicos no cérebro em desenvolvimento e estimular com cuidadoProjetou investigação sobre a segurança dos anestésicos atualmente amplamente utilizados.
Em uma revisão sistemática recente do atual corpo de literatura pré-clínica sobre AIDN, os autores observaram significativa heterogeneidade metodológica em mais de 900 estudos 3 . Muitos consideraram isso um apelo a um modelo pré-clínico clinicamente relevante, bem projetado, que ainda não existe apesar de vários anos de pesquisa sobre esse assunto. A maioria dos modelos de roedores, por necessidade, usa uma abordagem que não permite monitoramento fisiológico rigoroso, amostragem de sangue ou ventilação mecânica. Uma vez que o cérebro é exquisitamente sensível aos distúrbios fisiológicos, é difícil confiar nos resultados de tais modelos. Um objetivo primário para o desenvolvimento deste modelo foi projetá-lo de tal forma que todas as variáveis fisiológicas, tais como parâmetros de gás sanguíneo, temperatura corporal, parâmetros respiratórios etc., sejam monitoradas e corrigidas quando necessário.
Além disso, uma vez que a neurotoxicidade da anestesia provavelmente depende do progresso do desenvolvimento do cérebro no momento da exposição, deve ser escolhido um modelo animal que melhor imite o desenvolvimento e a estrutura do cérebro humano neonatal, para maximizar A relevância da tradução dos resultados 4 . O modelo de leitão translacional fornece o nível de relevância clínica procurado nessas revisões e editoriais, pois é projetado para atender a essa necessidade de dados pré-clínicos pertinentes que possam informar futuros estudos clínicos.
Isoflurano, um agonista do receptor do tipo A GABA (GABA A ) e um antagonista fraco do receptor NMDA, é um anestésico inalado comumente usado na prática clínica em todo o mundo. Os anestésicos como o isoflurano foram considerados seguros desde que não induzam hipotensão ou hipoxia; Ainda assim, podem ocorrer efeitos mais sutis. Quando o cérebro é exposto à anestesia geral, o saldo de GABA aO gonismo e o antagonismo de NMDA são interrompidos, resultando em alterações na arquitetura celular, conectividade e função. Além disso, enquanto o GABA é geralmente um neurotransmissor inibitório, é conhecido por ser excitatório em cérebros imaturos 5 . Precisamente quando a transição de GABA de excitatório para inibidor ocorre não é bem compreendida, e é provavelmente dependente de espécies.
Quando um desequilíbrio entre a entrada excitatória e inibitória no cérebro ocorre durante o chamado "jato de crescimento cerebral", a desregulação excitotóxica resultante de caminhos moleculares críticos pode levar ao desenvolvimento neurológico anormal, como a neurodegeneração apoptótica. Além do aumento da apoptose, o estresse oxidativo e a inflamação também podem ser induzidos, enquanto a proliferação de células neuronais, a migração neuronal e a arborização axonal tornam-se suprimidas ou desreguladas 6 . O resultado líquido é distúrbios neurocognitivos que podem persistir em adulTeor 2
Para medir diretamente os efeitos neurotóxicos do isoflurano em mamíferos jovens, utilizam-se leitões neonatais. Os leitões compartilham mais semelhanças do SNC com seres humanos do que qualquer outro mamífero e, como tal, suas semelhanças neurológicas e neuroanatômicas tornam-nos um animal ideal para um modelo clínico-relevante de mamífero da AIDN. Tanto os seres humanos quanto os leitões possuem cérebros girógenos, compartilhando semelhanças no caráter e distribuição de giroscópios cerebrais, matéria cinzenta e matéria branca. O hipocampo dos leitões, os gânglios basais e o tronco encefálico também são topográficamente semelhantes aos dos humanos 7 . Do ponto de vista do desenvolvimento, os leitões são um dos poucos mamíferos não humanos que sofrem crescimento cerebral perinatal e mielinização 8 . No útero, tanto os cérebros humanos como os de leitão de leitão sofrem um crescimento significativo durante a gestação no final do trimestre. Na correlação, no nascimento, os cérebros humanos e de leitão são 27% e 25% dos cérebros adultos, respectivamente. A ressonância magnética revelou que um cérebro de leitão de uma semana é aproximadamente equivalente a um cérebro humano de um mês em termos de maturação neuronal e arborização dendrítica 9 . Além disso, o leitão e o cérebro humano compartilham numerosas semelhanças em relação aos padrões de desenvolvimento neurológico. Por exemplo, a expressão e a sequência de mRNA da reelin 10 , a distribuição topográfica dos neurônios 5-HT 11 e o fechamento do tubo neural 12 são todos paralelos ao que se observa em seres humanos. Além disso, há uma extensa homologia entre os genomas dos leitões e dos humanos 13 .
A relevância de um modelo animal deve ser entendida no contexto da patologia humana, particularmente em relação à maturidade cerebral e pathobiologia do bebê humano. A maioria dos estudos de toxicidade de anestesia existentes usa um modelo de roedor, com alguns que utilizam não humanosModelos de primatas. No entanto, roedores e primatas podem não ser os animais ideais para investigar o AIDN.
Embora amplamente utilizados, os cérebros dos roedores são muito diferentes dos humanos ao longo do desenvolvimento. Mais notavelmente, os roedores possuem cérebros lissencefálicos (ou lisos). O cérebro dos roedores não possui os giros e os sulcos que são característicos de organismos mais neurológicamente complexos. O cérebro do roedor também sofre um surto de crescimento cerebral pós-natal 14 , diferente dos humanos e dos leitões. Observou-se que há variações na vulnerabilidade de diferentes regiões cerebrais ao anestésico inalado 15 . Portanto, deve ser importante que o modelo animal para estudar AIDN possua um cérebro que seja neurodesenvolvimento e neuroanatomicamente semelhante ao de um ser humano, de modo a melhor modelar as alterações cerebrais induzidas por anestesia que provavelmente serão observadas em pacientes pediátricos. Conforme descrito anteriormente, os leitões possuem um cérebro que euÉ muito mais adequado para esse papel. Além disso, as formas comuns de testes neurocognitivos de roedores, como a aprendizagem espacial e a memória avaliada no labirinto de água Morris, não são diretamente relevantes ou comparáveis às avaliações neurocognitivas em crianças pequenas 16 . Uma das vantagens de usar leitões para a neurociência do desenvolvimento é que elas são extremamente favoráveis aos testes neurocognitivos, mesmo em uma idade precoce. Numerosos testes neurocognitivos que são considerados úteis para outras espécies de mamíferos foram utilizados e validados com sucesso em suínos. Embora ainda seja um campo em evolução, a avaliação neurocognitiva em leitões inclui testes mais complexos que imitam os déficits humanos, como um teste do motor de feixe inclinado 17 , 18 e um teste de consciência espacial espelhado 19 . O teste do motor com o feixe inclinado, como parte do estudo traumático de lesões cerebrais em leitões, mostra alta confiabilidade na avaliaçãoDa função motora. O teste de espelho demonstra memória do ambiente envolvente, além de reconhecimento e utilização de uma imagem refletida para buscar recompensas alimentares.
Por outro lado, os primatas não humanos podem ser um modelo mais apropriado para estudos de anestesia pediátrica, mas há uma série de fatores proibitivos, incluindo custos e dificuldade de uso. Além disso, eles são extremamente sensíveis às primeiras condições de criação, particularmente ao estresse e à separação materna 20 . Fatores importantes para o estudo do AIDN, tais como moduladores alostéricos, afinidades receptor-ligando, modificações pós-tradução, composições de subunidades de receptores e variantes alternativas de splicing, são desconhecidos no caso dos primatas. Isso ocorre porque os genes relevantes para esses conceitos não foram clonados. Em contraste, eles foram clonados em porcos. Como tal, apenas o trabalho limitado foi realizado em primatas não humanos 21 , 22 .
O modelo de leitão capitaliza as vantagens dos modelos de roedores e primatas não humanos: é econômico, fácil de usar em relação aos estudos de primatas não humanos e é neuroanatomicamente e neurofisiologicamente semelhante ao cérebro humano pediátrico. O uso de leitões na pesquisa de neurociência cresceu nos últimos anos, incluindo uma série de estudos que examinaram as condições neuroinflamatórias pediátricas. Efeitos da infecção viral respiratória no hipocampo e aprendizagem espacial 23 , redução da morte das células cerebrais após o acidente vascular encefálico 24 , neurogênese após lesão cerebral traumática 25 e atividade enzimática durante convulsões 26 são alguns dos estudos que utilizaram leitões neonatais. Este corpo substancial e crescente de literatura dá força à adequação e sustentabilidade do modelo de leitão clinicamente relevante e altamente reproduzível para o estudo do anestheNeurotoxicidade induzida por sia.
Protocolo
Os leitões saudáveis e domésticos ( Sus scrofa) são obtidos de uma fazenda aprovada pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade Estadual de Ohio (IACUC). Todas as experiências com animais são realizadas de acordo com a política da IACUC da Universidade Estadual de Ohio, após a aprovação do protocolo.
1. Manejo de animais e animais
- Use leitões machos nesta experiência para eliminar os potenciais efeitos de confusão do sexo. NOTA: Se os objetivos experimentais incluem avaliação dos efeitos do experimento em animais, enquanto no período de crescimento cerebral máximo, não use leitões com mais de 14 dias.
- Agende os leitões para chegar ao viveiro pelo menos 24 h antes da experimentação para permitir aclimatação ao meio ambiente.
NOTA: Técnicos veterinários treinados supervisionados por veterinários licenciados fornecem cuidados de rotina para animais.- Mantenha os leitões em gaiolas individuais controladas pela temperatura e dê uma nutriçãoNally completo, substituto de leite de leitão comercial ad libitum. Forneça os animais com um cobertor e um brinquedo. Monitorar continuamente a temperatura nos compartimentos dos animais.
- Para este estudo de viabilidade preliminar, utilizaram 18 leitões para o braço de isoflurano e 22 leitões para o braço de controle. Execute cálculos de tamanho de amostra com base no design do estudo, quando possível. Randomize os leitões disponíveis para controle ou grupo de exposição para o período de exposição apropriado. A partir da experiência, mesmo com múltiplos investigadores, espera poder realizar não mais do que 2 experimentos por dia (2 animais no total).
2. Controle Animais
- Não realize a intervenção experimental em animais de controle.
- Induzir anestesia geral profunda através da máscara de cone de face para o procedimento de perfusão e coleta de tecidos. Especificamente, após o período de aclimatação de 24 horas, anestesiar os leitões com 5% de isoflurano ou 8% de sevoflurano em 100% de oxigênio <Em> através da máscara de rosto. Não use desflurano para indução.
NOTA: O tempo entre a indução de anestesia e a instituição de perfusão de PBS frio deve ser o mais curto possível. Técnicos experientes podem completar este processo em menos de 5 min.- Confirme a profundidade adequada da anestesia por falta de reflexo de pitada de bucal usando um grampo cirúrgico.
- Para evitar insetos hipóxicos / isquêmicos no cérebro, monitore o leitão usando um oxímetro de pulso para garantir a manutenção de oxigenação, ventilação e débito cardíaco adequados, até que a perfusão de solução salina-tampão fosfatada fria (PBS) comece.
NOTA: Para fornecer proteção adicional contra danos nos tecidos, embalar o animal (incluindo a cabeça) no gelo após a indução da anestesia.
- Realize uma perfusão transcardíaca.
NOTA: porque o paraformaldeído é utilizado, o procedimento de perfusão deve ser realizado sob uma exaustão ou em uma tabela de descarga descendente.- Faça um craniocaudal iNcisão ao longo do esterno usando um bisturi. A profundidade da incisão deve ser suficiente para expor o esterno.
- Com cuidado, execute uma esternotomia na linha média com um par de tesouras afiadas e pesadas, evitando danos ao coração, pulmões ou diafragma. Se necessário, coloque um dedo entre o aspecto posterior do esterno e o conteúdo intratorácico para evitar lesões. Manobra um dedo no mediastino fazendo uma pequena incisão (do tamanho do dedo) no diafragma.
- Depois de entrar na cavidade torácica, mantenha a caixa torácica aberta usando um retractor auto-retentor.
- Incentive o pericárdio usando fórceps e um par de tesouras, expondo o coração batendo. Tenha cuidado de não ferir o coração.
- Identifique o ventrículo esquerdo e coloque cuidadosamente uma cânula (como um angiocatéter de 14 G) através do ápice do ventrículo. Remova a agulha, deixando o cateter no lugar.
NOTA: Tenha cuidado para não perfurar a parede posterior do ventrículo.O retorno de sangue pulsátil do cateter indica que está devidamente colocado. O sangue pode ser facilmente amostrado a partir do animal neste ponto. - Depois de identificar o átrio direito, realize uma atriotomia fazendo uma grande incisão no átrio com tesoura para permitir a exsanguinação e a fuga de perfusado.
NOTA: O Isoflurano por inalação deve continuar até que a morte cardíaca seja confirmada. A morte cardíaca é confirmada pela falta direta de débito cardíaco observado.
- Perfusar o leitão usando um perfusado consistindo de frio (4 ° C) solução salina tamponada com fosfato (PBS) contendo heparina a uma concentração de 5 unidades por mL. Perfume a 300 mL por minuto por 5 minutos ou até a solução ficar limpa.
- Tenha cuidado de que a cânula de perfusão não se remova durante a perfusão. Use uma bomba peristáltica comercialmente disponível para esta e todas as outras perfusões.
- Faça uma hemicraniectomia para reMova um hemisfério do cérebro para análises de tecido fresco.
NOTA: Este protocolo permite a recuperação de um hemisfério de tecido cerebral fresco. O outro hemisfério é corrigido. Se não for necessário tecido fresco, pule para o passo 2.6.- Durante este procedimento, continue a circulação de PBS gelado a uma taxa de 50 mL por hora para garantir que o cérebro permaneça frio.
- Faça uma incisão longitudinal no couro cabeludo ao longo do comprimento da sutura sagital até o forame magnum usando um bisturi. Durante o processo, use pressão firme para criar uma pontuação no crânio. Reflita o couro cabeludo para expor todo o crânio.
- Usando rongeurs e começando no forame magnum, remova o crânio de um lado, inserindo os rongeurs entre o crânio e a dura-máter, com precaução para não ferir o tecido cerebral subjacente. Remova o osso em pedaços, usando os rongeurs para tirá-lo do parênquima cerebral.
- Uma vez que o crânio foi removido, incise e remova o duRa mater usando fórceps e tesouras, novamente com precaução para não ferir o tecido cerebral subjacente.
- Coloque uma lâmina de bisturi entre os dois hemisférios para dividir cuidadosamente o corpo caloso.
- Usando uma ferramenta plana, como a extremidade do punho largo da pinça, retrai gentilmente o lobo frontal, cortando gradualmente os nervos cranianos, trabalhando anterior à posterior. No aspecto mais posterior do hemisfério, use um bisturi para cortar a medula espinhal. Remova o hemisfério em bloco.
NOTA: O tecido cerebral não fixo é frágil. Tenha cuidado ao remover o hemisfério para evitar a interrupção do fornecimento de sangue do hemisfério restante. - Corte o hemisfério removido. Se indicado, imediatamente congelar-se em 2-metilbutano arrefecido a -160 ° C em um banho de nitrogênio líquido para evitar a quebra de tecido e imediatamente armazenado a -80 ° C para posterior análise.
OBSERVAÇÃO: Recomendamos a seção do cérebro coronariamente em incrementos de 2 mm usando uma matriz, mas um detalhe específicoO número de secções dependerá de objetivos experimentais específicos.
- Mude o perfusado para 4% de paraformaldeído (PFA). Continue a perfusão de PFA a 300 mL por minuto durante pelo menos 5 min.
CUIDADO! O PFA é tóxico, evita o contato com a pele, os olhos ou as mucosas. Não inalar fumos de PFA. - Espere que o corpo do leitão se endureça devido à formação de ligações cruzadas de aldeídos sendo criadas no músculo. Após a perfusão de PFA estar completa, remova o hemisfério restante de forma idêntica à descrita no passo 2.5.5.
NOTA: O cérebro perfeitamente perfundido será pálido e completamente exsanguinado.- Coloque o hemisfério restante em um recipiente pequeno com 4% de PFA fresco a 4 ° C. Mantenha o hemisfério em PFA por 24-48 h para completar o processo de fixação.
- Após 24-48 h, mova o cérebro fixo para uma solução de PBS contendo 0,1% de azida de sódio, pois é essencial para evitar a sobre fixação. A sobre fixação pode resultar em masRei do epitopo ou forte coloração de fundo não específica. A adição de azida de sódio evita o crescimento bacteriano.
NOTA: O tecido pode ser armazenado por até um mês a 4 ° C.
3. Animais de Isoflurano (Experimental)
NOTA: Qualquer anestesia ou intervenção pode ser usada, mas não recomendamos desflurano para indução por inalação.
- Indução e manutenção da anestesia:
- Realize a anestesia usando uma estação de trabalho de anestesia clínica equipada com ventilador pediátrico e dispositivos de monitoramento.
- Após o período de aclimatação de 24 h, anestesiar os leitões com 8% de sevoflurano em 100% de O2 através de máscara de cone.
- Monitorize continuamente oximetria de pulso, pressão arterial não invasiva, eletrocardiografia e temperatura durante o período de indução e em todos os momentos durante o procedimento de estudo.
- Após a indução, titube sevoflurano ou isofluRane para uma concentração que permita a profundidade adequada da anestesia, garantindo a respiração espontânea e sustentada (tipicamente a uma concentração de 3-4%).
- Coloque um cateter intravenoso periférico de 24 G na veia marginal da orelha ( Figura 1 ).
- Coloque o leitão na posição dorsal reclinada para intubação traqueal ( Figura 2 , painel A). Use uma lâmina Miller # 1 ou # 1.5 para facilitar a instrumentação da hipofaringe e intubação da traqueia. NOTA: Um operador experiente e assistente são necessários durante a laringoscopia.
- Um assistente desloca a língua do animal usando uma gaze seca para facilitar a exposição da laringe e a visualização das cordas vocais ( Figura 2 B ).
NOTA: A epiglota do leitão é morfologicamente semelhante à dos humanos ( Figura 2 C ). O cor vocal do leitãoDs podem ser difíceis de visualizar, uma vez que estão a vários milímetros de profundidade dentro da entrada da laringe ( Figura 2 D ). - Deslocar a epiglota: coloque a ponta da lâmina do laringoscópio debaixo da epiglota e levante a lâmina para cima para expor a laringe.
- Antes da colocação do tubo na traquéia, pulverizar os cordões vocais com 0,5 mL de lidocaína a 2% para prevenir o laringoespasmo durante a passagem do tubo endotraqueal, pois os leitões são especialmente propensos ao laringoespasmo.
- Um assistente desloca a língua do animal usando uma gaze seca para facilitar a exposição da laringe e a visualização das cordas vocais ( Figura 2 B ).
- Coloque e prenda um tubo traqueal de 3,0 mm.
- Assegurar sons respiratórios bilaterais e dióxido de carbono de maré final sustentado usando ausculta de tórax com um estetoscópio e monitoração de EtCO 2 .
- Influe os pulmões do leitão a uma pressão contínua da via aérea de 20 cm H 2 O. Em seguida, infle o manguito do tubo endotraqueal até a pressão mínima necessária para evitar vazamento de ar a uma pressão de 20 cm H 2 O, ouvindo a traquéia para identificar vazamento de ar, se presente.
NOTA: Isto é importante para prevenir a isquemia mucosa durante a ventilação por pressão positiva intermitente. - Normoxia e normocarbia são mantidas durante a anestesia.
- Comece a administração de 2% de isoflurano em 50% de oxigênio / 50% de ar. Titular oxigênio para manter PaO 2 de 90 - 100 mmHg. Continue por 3 h (ou duração experimental desejada).
- Aplique pomada oftálmica nos olhos para evitar a secura durante a duração da anestesia.
- Comece o cateterismo da artéria femoral após o início de 2% de isoflurano.
- Administrar pré-incisão de antibióticos de amplo espectro (cefazolina, 25 mg / kg) através da linha intravenosa periférica para prevenir a infecção no local cirúrgico.
- Esterilize as duas virilhas usando clorhexidina tonificada para garantir um campo estéril apropriado e coloque uma camada esterilizada apropriada ( Figura 3 B ). No mínimo, os funcionários que participam da cirurgia de sobrevivência devem usar uma tampa cirúrgica, máscara, luvas estéreis e proteção para os olhos.
- Palpate o pulso femoral no vinco inguinal usando os dedos do índice e do meio.
- Faça uma incisão superficial, de 1,5 cm, craniocaudal usando um bisturi ( Figura 3 C ).
- Disseminar entre as duas cabeças do músculo gracilis usando um instrumento contundente, como hemostato cirúrgico ou tesoura de ponta sem corte ( Figura 3 D ).
NOTA: O feixe neurovascular femoral é tipicamente encontrado entre os dois músculos e apenas profundo. ( Figura 4 A ). - Usando laços vasculares ou laços de seda, isolar a artéria na extremidade proximal e distal. Use o loop para puxar a artéria até o nível da pele distalmente ( Figura 4 B ).
- EnquantoColocando a tração no laço proximal suficiente para interromper o fluxo sanguíneo, faça uma pequena arteriotomia com um par de tijolos de tenotomia.
- Tenha cuidado para não transpor a artéria. Uma pequena arteriotomia é suficiente. Alternativamente, use uma abordagem de agulha e fio para acessar a artéria ( Figura 4 C ).
- Uma tração suave na gravata proximal evitará perda excessiva de sangue em qualquer ponto durante esta parte do procedimento. Se estiver usando a aproximação da agulha e do fio, passe o fio guia (fornecido com o kit ou obtido separadamente) através da agulha e dentro da artéria até 5 cm.
- Tenha cuidado para não avançar o fio, pois pode causar ectopia ventricular. Retire o fio imediatamente 1-2 cm se isso ocorrer.
- Retire a agulha da embarcação, tomando cuidado para deixar o fio guia no recipiente. Passe delicadamente o cateter sobre o fio e dentro do recipiente ( Figura 4 D).
- Use um cateter de 8 centimetros de 3 frases para cateterização da artéria femoral. Espere uma resistência suave quando a ponta do cateter entra pela primeira vez na parede superficial do vaso.
- Se estiver usando a abordagem de arteriotomia, avance o tubo de cateter ou de polietileno diretamente no vaso. O retorno do sangue deve ser observado imediatamente.
- Imediatamente, prenda o cateter ligado a um transdutor de pressão. Lave o cateter com solução salina normal para manter a permeabilidade do cateter.
- Coloque as suturas para garantir o cateter no lugar. Cubra a incisão com gaze estéril para evitar contaminação. Utilize uma abordagem percutânea para o cateterismo da artéria femoral.
NOTA: Certifique-se de que o ultra-som é realizado por um técnico experiente.
- Coloque as suturas para garantir o cateter no lugar. Cubra a incisão com gaze estéril para evitar contaminação. Utilize uma abordagem percutânea para o cateterismo da artéria femoral.
- Condições e monitoramento intra-operatórios:
- Aquecer ativamente o leitão com um dispositivo de aquecimento de ar forçado e monitorar continuamenteTemperatura rectal ( Figura 3 A ).
- Infundir o fluido isotônico contendo dextrose (5% de dextrose no lactato de Ringer ou soro fisiológico normal) na taxa de manutenção (4 vezes o peso do leitão em quilogramas, mL / h).
- Monitorar sinais vitais para perturbações (hipotensão, arritmia, hipo / hipertermia, hipoxia)
NOTA: Os intervalos de sinais vitais normais e o gerenciamento sugerido correspondente no caso de anormalidades estão resumidos na Tabela 1 . - Usando um sistema de análise de sangue comercialmente disponível, mede os gases do sangue arterial (pH arterial, pCO 2 , pO 2 ), eletrólitos (bicarbonato, excesso / déficit de base, sódio, potássio, cálcio ionizado), hemoglobina e glicose pelo menos por hora durante o experimento período. Desenhe a amostra de sangue arterial do cateter da artéria femoral.
NOTA: valores normais de ácido-base e eletrólitos, juntamente com recomendações para correção se as anormalidades forem vistas umaSão resumidos na Tabela 1 .
- Após 3 h de exposição a isoflurano, remova o cateter da artéria femoral.
- Cuidadosamente, prenda a seda vascular proximal para ocultar permanentemente a artéria femoral para prevenir o sangramento. Alternativamente, use um clipe vascular.
- Assegurar hemostasia completa antes de fechar a incisão. Irrigar a incisão com 10-20 mL de solução salina estéril para ajudar a prevenir a infecção.
- Na conclusão do experimento, feche a incisão da pele com suturas simples e interrompidas usando um material de sutura 3-0 não absorvível.
- Infiltrar a ferida usando 0,5-1 mL / kg de bupivacaína a 0,25% com 1: 200 000 de epinefrina para controle da dor. Revestir a incisão com um adesivo de pele cirúrgico estéril.
NOTA: Nenhum curativo é necessário.
- Infiltrar a ferida usando 0,5-1 mL / kg de bupivacaína a 0,25% com 1: 200 000 de epinefrina para controle da dor. Revestir a incisão com um adesivo de pele cirúrgico estéril.
- Interrompa a anestesia e deixa o leitão acordar.
- Remova o tubo endotraqueal após sinais de awaKening (abertura dos olhos, tentativas de ficar em pé, chutar e abrir e fechar a boca), com sinais de hemodinâmica estável, oxigenação adequada e ventilação adequada.
- Após a extubação, preste oxigênio suplementar através do cone do rosto até garantir a adequação da oxigenação e ventilação.
- Administrar buprenorfina 0,05 mg / kg por via subcutânea para controle adicional da dor. Alternativamente, o fentanilo transdérmico pode ser usado.
- Quando apropriado, devolva o leitão à sua gaiola de casa. Não deixe o leitão sem vigilância até recuperar a consciência suficiente para manter a decúbito esternal. Não devolva um animal a uma gaiola com outros animais até se recuperar completamente da anestesia.
- Aqueça ativamente a gaiola de casa privada com uma luz de aquecimento.
- Monitorar de perto o animal após anestesia por pessoal treinado de veterinária ou de pesquisa. Fornecer o substituto do leitão de leitão.
- Permita que os leitões recuperemPor 48-72 h, dependendo dos objetivos experimentais.
- Injectar leitões com buprenorfina por via subcutânea a uma dose apropriada, a cada três horas, conforme necessário, para garantir o controle da dor, a critério da equipe de cuidados dos animais experiente para controlar o desconforto pós-cirúrgico em animais.
- Monitore os leitões a cada hora durante as primeiras 6 h após a cirurgia e a cada 4 h depois disso. Realize sacrifícios de animais e aquisição de tecido de forma idêntica para controlar animais, descritos acima.
Resultados
Foram estudados 41 leitões (18 isoflurano, 22 de controle). Procedimentos de estudo foram bem tolerados por todos os animais. Todos os leitões estudados eram do sexo masculino. Não houve diferença significativa entre os grupos em relação à idade ou ao peso ( Tabela 2, Figura 5 ). Os valores laboratoriais médios durante a experimentação no grupo isoflurano são apresentados na Tabela 3 . Esses valores demonstram que o protocolo experimental possui consistência interna e reprodutibilidade, pois tínhamos vários técnicos que realizavam a cirurgia ao longo de dois anos. Não foram ditos por esses números os muitos ajustes e correções que tivemos para realizar durante as cirurgias para manter a hemostasia fisiológica. A retenção de CO 2 , a baixa temperatura corporal e a hipoglicemia são alguns dos fatores de confusão que evitamos através de monitoramento e ajuste abrangente conforme necessário.
T "fo: keep-together.within-page =" 1 ">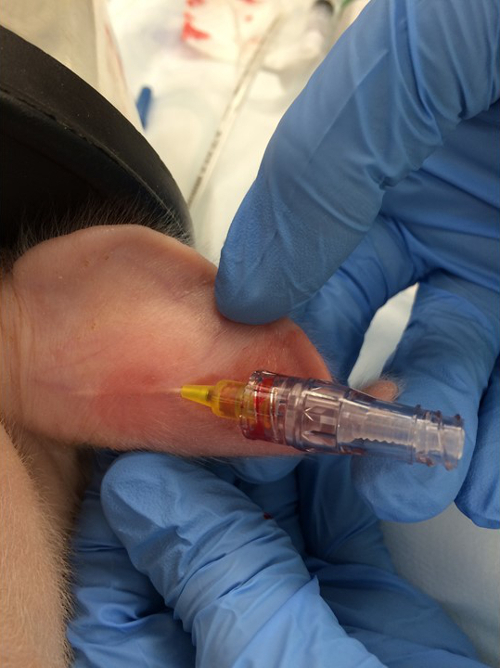
Figura 1:. Colocação da Linha Periférica Intravenosa. Um cateter intravenoso de 24 G é colocado na veia da orelha marginal. Clique aqui para ver uma versão maior desta figura.
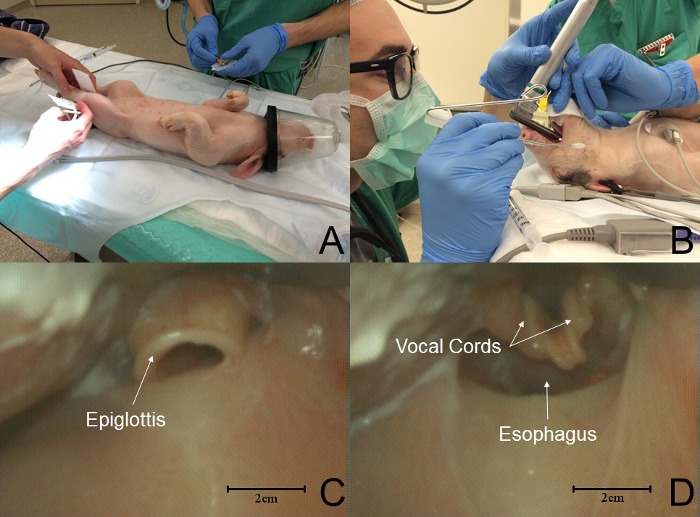
Figura 2: Sequência de Eventos na Intubação de Leitão. ( A ) Os leitões são colocados na posição lateral reclinada para intubação. Monitores padrão são colocados. ( B ) Um assistente deslocou a língua da cavidade oral enquanto o laringoscopista faz laringoscopia. ( C ) A epiglota é morfologicamente semelhante à de um ser humano. Neste gráfico, a ponta do thE a lâmina está na vallecula. ( D ) A anatomia laríngea porcina é distintamente diferente da dos humanos; Os cabos vocais são vários milímetros de profundidade até a entrada da laringe. Neste gráfico, a ponta da lâmina deslocou a epiglota, expondo a laringe. Clique aqui para ver uma versão maior desta figura.
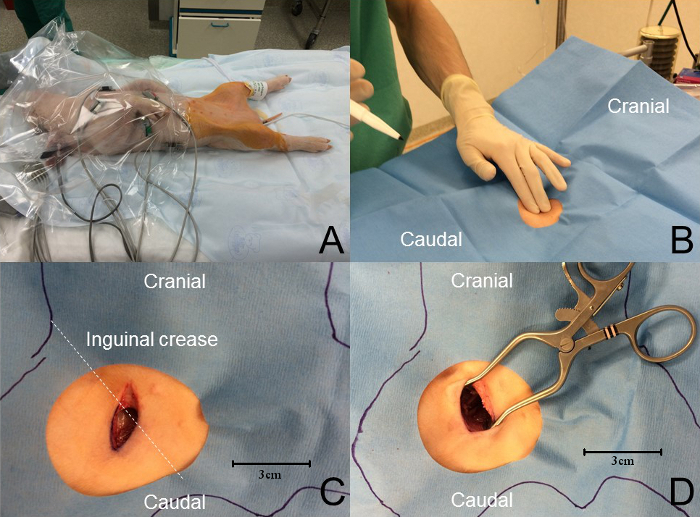
Figura 3: Abordagem da artéria femoral. ( A ) A temperatura do animal é mantida usando um dispositivo de aquecimento de ar forçado. O monitoramento é usado durante todo o procedimento. Um campo amplo e estéril é preparado com clorhexidina tonificada e o animal é coberto com uma camada esterilizada fenestrada. ( B ) A palpação no vinco inguinal revela o pulso femoral. ( C ) A crA incisão da pele aniocaudal, aproximadamente perpendicular ao vinco inguinal e aproximadamente 1,5 cm de comprimento, é realizada sobre o pulso femoral. ( D ) É conseguida uma dissecação sem corte para expor o feixe neurovascular femoral. Clique aqui para ver uma versão maior desta figura.
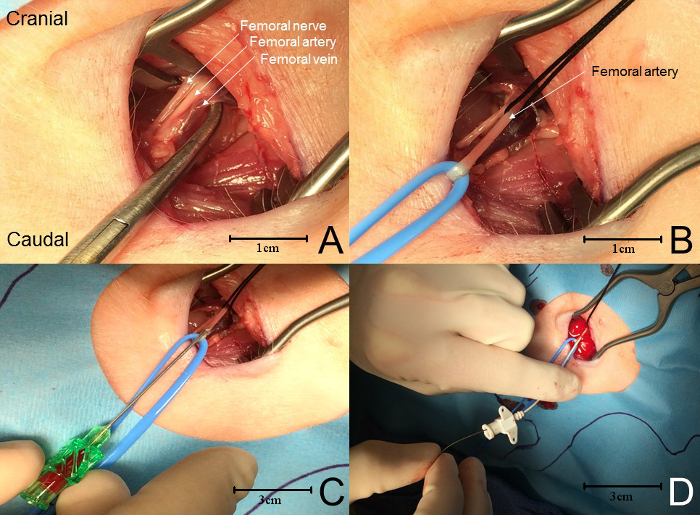
Figura 4: Cannulação da artéria femoral. ( A ) De lateral para medial, o feixe neurovascular contém o nervo femoral, a artéria e a veia. ( B ) A artéria femoral é isolada usando loops de vasos e / ou sutura. A tensão prolongada no laço proximal impede a perda excessiva de sangue enquanto a artéria é perfurada (ver clareamento do vaso). ( C ) Uma agulha é usada para perfurar o fêmur aRtery, evitando a perfuração da parede posterior da artéria. Quando o sangue retorna, um fio guia é avançado para a artéria através da agulha. ( D ) A agulha é removida e o cateter é avançado sobre o fio guia para o artéria femoral. Clique aqui para ver uma versão maior desta figura.
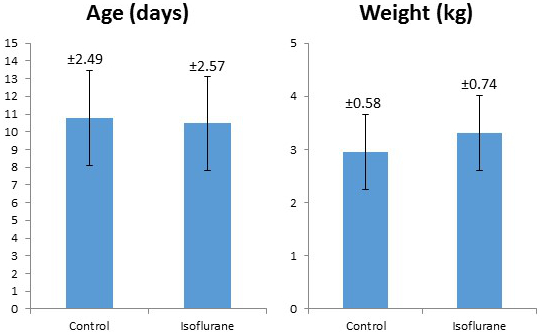
Figura 5: Comparação do peso médio e idade do controle e leitões tratados com isoflavano. As barras de erro representam +/- 1 desvio padrão, com o valor de desvio padrão observado acima de cada barra de erro.
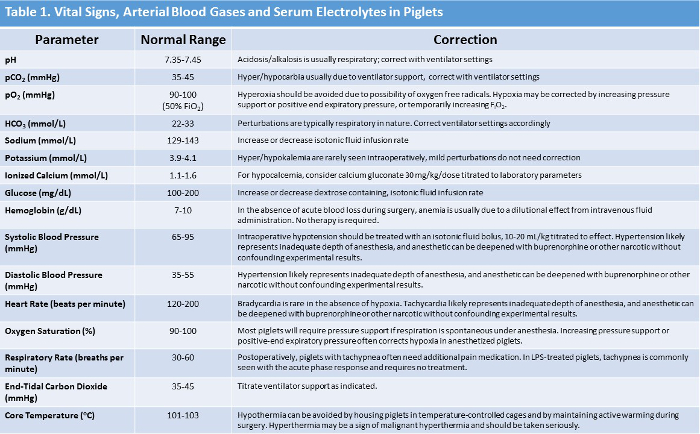
Tabela 1: Resumo dos sinais vitais do leitão normal, ArteriAl-sangue e valores de eletrólito sérico com métodos de correção sugeridos. Clique aqui para ver uma versão maior desta tabela.
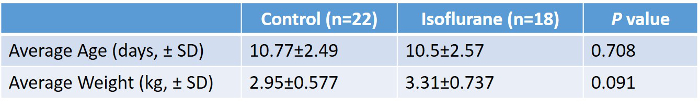
Tabela 2: Resumo do peso médio e idade do controle versus leitões tratados com isoflurano. Realizou-se um teste de T de duas caudas não comparado, não mostrando diferença significativa entre os dois grupos. Clique aqui para ver uma versão maior desta tabela.
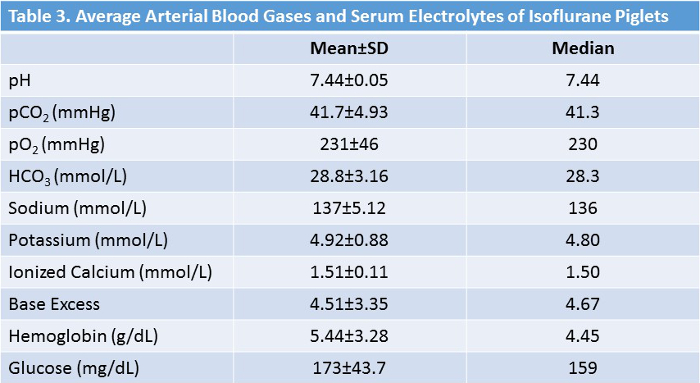
Tabela 3: sinais vitais médios e valores laboratoriais de animais tratados com isoflurano. Durante o curso daAs cirurgias, os desvios dos sinais vitais e os valores laboratoriais dos intervalos normais são prontamente corrigidos. Clique aqui para ver uma versão maior desta tabela.
Discussão
Etapas de protocolo crítico / solução de problemas
À medida que o experimento começa, o monitoramento de sinais vitais não invasivos deve começar com a indução. A pressão sanguínea, a freqüência cardíaca, a saturação de oxigênio e a temperatura retal podem ser facilmente obtidos e monitorados. O leitão deve estar sob um dispositivo de aquecimento de ar para manter a temperatura corporal adequada, pois esses animais podem se tornar hipotérmicos rapidamente sob anestesia geral. A colocação rápida de um cateter intravenoso periférico permite o tratamento de emergências se elas surgirem durante a indução. É importante monitorar continuamente o leitão, não invasivo ou invasivo, tanto no procedimento de isoflurano como no procedimento de sacrifício. O leitão pode experimentar dessaturação arterial de oxigênio muito rapidamente durante vários passos ao longo do protocolo, especialmente durante o manejo e intubação das vias aéreas. Utilizamos 8% de sevoflurano para induzir anestesia, a fim de replicar a prática pediátrica humana e de falarD indução. No entanto, 5% de isoflurano foi utilizado com sucesso e é apropriado. Dadas as diferenças na anatomia e uma predisposição ao laringoespasmo, o leitão pode ser difícil de intubar. Se o leitão começar a desaturar durante a administração de indução e / ou via aérea, 100% de oxigênio e sevoflurano devem ser administrados imediatamente por meio de um cone de face para restabelecer um nível seguro de saturação de oxigênio e uma profundidade adequada de anestesia. Tenha em mente que, enquanto o plano da anestesia deve ser suficientemente profundo para permitir a intubação, a anestesia excessiva pode levar à apneia. É necessária uma vigilância contínua em relação à ventilação e oxigenação do animal, com titulação do anestésico inalado em conformidade. A intubação pode então ser retraída uma vez que a oxigenação é restaurada e uma anestesia adequada foi alcançada. A ventilação por pressão positiva através do cone do rosto pode ser tentada, mas geralmente não tem êxito. Se ocorre laringoespasmo, a aplicação da solução de lidocaína diretamente ao vocalTodos os cordões são indicados para permitir a intubação traqueal.
Os medicamentos de emergência sempre devem estar disponíveis e devem ser administrados conforme necessário durante as partes críticas do protocolo para corrigir distúrbios fisiológicos. Embora uma discussão minuciosa do uso de drogas anestésicas e de emergência em leitões esteja fora do escopo deste manuscrito, Swindle's "Swine in the Laboratory: Cirurgia, Anestesia, Imagem e Técnicas Experimentais" é um excelente recurso. 27
Da mesma forma, o leitão pode começar a desatura-se rapidamente durante o sacrifício, depois de abrir a cavidade torácica durante a esternotomia da linha média. O operador deve trabalhar com rapidez, mas com segurança, para expor o coração e inserir o angiocatéter para iniciar o PBS frio. Uma perfusão completa de PBS fria (e fixação rápida com PFA, se indicado) é necessária para evitar danos isquêmicos ao cérebro.
Uma vez que o leitão tenha sido intubado, respiA taxa reativa e o rastreamento do dióxido de carbono da maré final começam ( Tabela 1 ). Estabilize a oxigenação e a ventilação das marés do leitão através da manutenção do suporte do ventilador, mantendo a anestesia adequada. Usamos ventilação mecânica para imitar o que é usado nos seres humanos o mais próximo possível. A hiperoxia deve ser evitada para minimizar as chances de estresse oxidativo.
Os leitões de isoflurano sofrem uma canulação da artéria femoral por 2 razões: monitorar continuamente a pressão arterial; E provar sangue arterial para avaliação do estado ácido-base, gases do sangue e eletrólitos ao longo do procedimento. A canulação da artéria femoral pode ser um desafio. Veja o vídeo para obter detalhes completos. Para experiências de sobrevivência, este procedimento deve ser feito em um ambiente operacional estéril sob condições estéreis. Após a canulação da artéria femoral, comece a monitorar por hora os gases do sangue arterial e os eletrólitos séricos, corrigindo o necessário paraMantenha a homeostase ( Tabela 1 ). O leitão deve receber fluido isotônico contendo dextrose contínuo para manter a glicemia adequada. Ao longo do experimento, o animal deve ser monitorado continuamente para a normotermia, e o aquecimento do ar forçado deve ser fornecido conforme necessário. É igualmente importante evitar hipotermia e hipertermia.
Embora este protocolo forneça um hemisfério de cérebro "fresco" e um hemisfério de tecido neural fixo, isso pode ser facilmente adaptado para acomodar projetos de estudo alternativos. Amostras adicionais podem ser coletadas do leitão também. O LCR pode ser obtido após anestesiar o leitão, com ou sem orientação fluoroscópica. O sangue também pode ser coletado do leitão em vários estágios do protocolo, incluindo o do cateter da artéria femoral, bem como diretamente do ventrículo esquerdo através do angiocatéter imediatamente antes da perfusão. O período de convalescença também pode ser alongado ou sh Para exame da resposta crônica ou aguda, respectivamente.
Limitações da Técnica
Este protocolo e modelo são tecnicamente desafiadores. É necessário um investigador qualificado e um conjunto operacional totalmente fornecido, particularmente para experimentos de sobrevivência. O investigador (e assistente, para certas porções do protocolo) deve estar confortável com os componentes cirúrgicos e anestésicos deste protocolo, o que pode exigir treinamento e experiência para dominar. Outras limitações incluem a despesa dos leitões em relação aos modelos de roedores, embora o modelo de leitão seja muito menos custo-proibitivo que os primatas não humanos. Embora o custo dos leitões varie dependendo da região e da fazenda a partir da qual os animais são obtidos, pode-se esperar que o custo por animal seja inferior a US $ 500, enquanto os primatas não humanos podem ser milhares de dólares por animal. Em nossa experiência, o custo médio por animal é tipicamente cerca de US $ 200.
Jove_content "> Finalmente, como é o propósito do modelo de leitão imitar o cérebro humano em desenvolvimento, apenas os leitões neonatais devem ser usados. O sistema nervoso central é mais vulnerável durante o período de crescimento rápido e em leitões, este período se estende desde Seis semanas antes do nascimento até cinco semanas após o nascimento 8. Utilizando leitões mais velhos mais distantes da data de parto correm o risco de enfraquecer a relevância clínica do modelo de leitão. Embora exista uma controvérsia significativa no que diz respeito à "equivalência" do desenvolvimento do cérebro de leitão para A de um recém nascido humano, há semelhanças impressionantes quando o desenvolvimento precoce do cérebro pós-natal entre seres humanos e porcos é comparado. No nascimento, os cérebros dos humanos e dos porcos são 27% e 25% do peso adulto, respectivamente. 14 Com base no trabalho de Johnson E colegas, podemos inferir que uma semana de leitão é aproximadamente equivalente a um mês humano. 9 Esses resultados, com base em wh Dados de volume ole-brain, foram validados pelo trabalho de Workman e colegas. 28 Selecionamos leitões de 7 a 14 dias de idade para aproximar um ser humano de 1-2 meses de idade. No entanto, pode ser prudente usar animais mais novos (1-5 dias de idade) se o objetivo experimental for imitar o zênite do surto de crescimento do cérebro do leitão. Isso é viável, pois os leitões podem ser desmamados no nascimento. Nosso uso do modelo de leitão se adaptará à medida que novos dados se tornem disponíveis em relação aos paralelos entre desenvolvimento de cérebro pós-natal humano e porco.Importância da técnica em relação aos métodos alternativos / existentes
O leitão possui semelhanças impressionantes com neonatos humanos, incluindo paralelos críticos no desenvolvimento do cérebro e respostas fisiopatológicas. É, portanto, um modelo de mamífero clinicamente relevante e o estudo de prova de conceito indica que o leitão é um modelo adequado para o estudo da neurotoxicidade anestésica"29 , 30. Também pode ser facilmente adaptado a outros tipos de pesquisa de neurociências do desenvolvimento. O modelo é projetado para investigar, com autoridade científica, a extensão eo mecanismo da AIDN minimizando as preocupações de que fatores de confusão, como hipoxia ou hipercarbia, são Causando danos neurológicos que podem ser mal interpretados como induzidos por anestesia. Para realizar isso, o leitão é tratado com as mesmas condições cirúrgicas e anestésicas perioperatórias e acompanhamento experimentado por pacientes pediátricos.
Diretrizes futuras e aplicativos após dominar a técnica
Avançando, os leitões também são muito favoráveis aos testes neurocognitivos 17 . Este atributo permitirá uma avaliação complexa e abrangente do resultado neurocognitivo após a exposição anestésica em experimentos futuros. Também deve ser enfatizado que, no cenário clínico, as crianças freqüentemente sofrem anestesia paraProcedimento fisiologicamente estressante (cirurgia). As interações entre anestesia e inflamação pós-cirúrgica, bem como a lesão neuronal resultante e / ou a toxicidade (como se observa em roedores e primatas) merecem maior exploração e consideração significativa. O leitão neonatal fornece um modelo de base inicialmente clinicamente relevante para os efeitos dos anestésicos no cérebro em desenvolvimento sem a influência confusa da cirurgia (imitando cenários clínicos comuns em crianças). O impacto de diferentes tipos de cirurgia ou outros fatores de confusão (isquemia, lesão cerebral, predisposição genética, etc. ) agora podem ser testados de forma confiável usando este modelo.
Em laboratório, planejamos utilizar múltiplos métodos eletrofisiológicos e eletroquímicos para investigar ainda mais mecanismos de anestesia e AIDN em circuitos neurais intactos. Estas técnicas incluem a medição in vivo da atividade do neurotransmissor, gravações de grampos-grampos de células inteiras, neuroimagem eInvestigações neurofisiológicas em fatias de cérebro. No que diz respeito à neurociência no cérebro imaturo, os leitões são mais relevantes para humanos do que os modelos murinos com poucas das desvantagens presentes com primatas não humanos. Com um maior desenvolvimento, os leitões podem ser o modelo ideal para a pesquisa de neurociência no desenvolvimento humano.
Divulgações
Os autores declaram que não têm interesses concorrentes.
Agradecimentos
Os autores gostariam de reconhecer as contribuições do Ohio State University Laboratory Animal Resource Center (ULAR).
Materiais
| Name | Company | Catalog Number | Comments |
| Liqui-Wean | Milk Specialities | 454836 | |
| Piglet Anesthesia Face-Cone Mask | VetEquip | 921428 | |
| Masterflex L/S Peristaltic Pump | Cole-Parmer | EW-77916-20 | Alternative peristaltic pumps can be used, as long as a constant and sufficient perfusion rate can be achieved |
| Masterflex L/S Pump Tubing, 25 ft | Cole-Parmer | EW-96410-24 | |
| 14 G angiocatheter | Becton-Dickson | 381164 | |
| 10x PBS | Thermo-Fisher Scientific | ||
| Paraformaldehyde powder | Sigma-Aldrich | P6148-5KG | Our lab makes this reagent from the powder as it is much more cost-effective. Prepared paraformaldehyde can also be purchased. |
| 2-methylbutane | Sigma-Aldrich | M32631-4L | |
| Needle holder | Teleflex | 152720 | |
| Right angle clamp | Teleflex | 496217 | |
| Rongeurs | Teleflex | 028120 | |
| Tenotomy scissors | Teleflex | 423480 | |
| Stitch scissors | Teleflex | 423440 | |
| McPherson Tying Forceps | Teleflex | 425200 | |
| Adson Tissue Forceps | Teleflex | 181223 | |
| 3-0 nylon suture | Medline | ETH627H | |
| Integra SL Anesthesia Workstation | DRE Veterinary | 2350 | This anesthesia workstation is chosen to best mimic the clinical monitoring experienced by pediatric patients in the operating room. Any anesthesia machine can be used as long as it allows for sufficient physiologic monitoring and intervention. |
| Laryngoscope handle | Teleflex | 8710000 | |
| Miller 1 Laryngoscope blade | Teleflex | 2216100 | |
| Bair Hugger | 3M | 750 | |
| Bair Hugger Torso Blanket | 3M | 540 | |
| iStat Handheld | Abbott Point of Care | 300 | Alternative point of care arterial blood gas analysis devices may be used |
| iStat Cartridges | Abbott Point of Care | CG8+ | |
| Dermabond Advanced Topic Skin Adhesive | Ethicon | DNX6 | |
| LMA Laryngotracheal Atomization Device | Teleflex | MAD720 | A cotton-tipped applicator soaked in local anesthetic can also be used |
| Sheridan CF 3.0 Cuffed Endotracheal Tube | Teleflex | 5-10106 | This model ETT was selected because it has a Murphy's eye, which is important to prevent ETT occlusion during the experiment |
| Pediatric Intubation Stylet | Smiths Medical | 100/120/100 | |
| 24 G angiocatheter | Becton-Dickson | 381112 | |
| #10 Disposable Scalpel | Ted Pella, Inc | 549-9-10 | |
| Arterial Pressure Monitoring Kit (3 French, 8 cm catheter) | Cook Medical | C-PMSY-300-FA | Simple polyethylene tubing with a luer-lock adapter can also be used |
| Intramedic PE90 Polyethylene tubing | Fisher Scientific | 14-170-12D | |
| Monoject Blunt Cannula | VWR International | 15141-144 |
Referências
- Buie, V. C., Owings, M. F., DeFrances, C. J., Golosinskiy, A. National hospital discharge survey: 2006 annual summary. Vital Health Stat 13. (168), 1-79 (2010).
- Hays, S. R., Deshpande, J. K. Newly postulated neurodevelopmental risks of pediatric anesthesia. Curr Neurol Neurosci Rep. 11, 205-210 (2011).
- Disma, N., Mondardini, M. C., Terrando, N., Absalom, A. R., Bilotta, F. A systematic review of methodology applied during preclinical anesthetic neurotoxicity studies: important issues and lessons relevant to the design of future clinical research. Paediatr Anaesth. 26, 6-36 (2016).
- Loepke, A. W., Vutskits, L. What lessons for clinical practice can be learned from systematic reviews of animal studies? The case of anesthetic neurotoxicity. Paediatr Anaesth. 26, 4-5 (2016).
- Cherubini, E., Rovira, C., Gaiarsa, J. L., Corradetti, R., Ben Ari, Y. GABA mediated excitation in immature rat CA3 hippocampal neurons. International journal of developmental neuroscience. 8, 481-490 (1990).
- Kaindl, A. M., et al. Brief alteration of NMDA or GABAA receptor-mediated neurotransmission has long term effects on the developing cerebral cortex. Mol Cell Proteomics. 7, 2293-2310 (2008).
- Glauser, E. M. Advantages of piglets as experimental animals in pediatric research. Exp Med Surg. 24, 181-190 (1966).
- Dickerson, J., Dobbing, J. Prenatal and postnatal growth and development of the central nervous system of the pig. Proceedings of the Royal Society of London B: Biological Sciences. 166 (1005), 384-395 (1967).
- Conrad, M. S., Johnson, R. W. The domestic piglet: an important model for investigating the neurodevelopmental consequences of early life insults. Annu Rev Anim Biosci. 3, 245-264 (2015).
- Nielsen, K. B., et al. Reelin expression during embryonic development of the pig brain. BMC Neuroscience. 11, 75 (2010).
- Niblock, M. M., et al. Comparative anatomical assessment of the piglet as a model for the devleoping human medullary serotonergic system. Brain Res Brain Res Rev. 50 (1), 169-183 (2005).
- van Straaten, H. W., Peeters, M. C., Hekking, J. W., van der Lende, T. Neurulation in the pig embryo. Anat Embryol (Berl). 202 (2), 75-84 (2000).
- Goureau, A., et al. Conserved synteny and gene order difference between human chromosome 12 and pig chromosome 5. Cytogenetics and cell genetics. 94 (1-2), 49-54 (2001).
- Dobbing, J., Sands, J. Comparative aspects of the brain growth spurt. Early Human Development. 3 (1), 79-83 (1979).
- Istaphanous, G. K., et al. Characterization and quantification of isoflurane-induced developmental apoptotic cell death in mouse cerebral cortex. Anesth Analg. 116 (4), 845-854 (2013).
- Loepke, A. W., et al. The effects of neonatal isoflurane exposure in mice on brain cell viability, adult behavior, learning, and memory. Anesth Analg. 108 (1), 90-104 (2009).
- Sullivan, S., et al. Improved behavior, motor, and cognition assessment in neonatal piglets. J Neurotrauma. 30 (20), 1770-1779 (2013).
- Gieling, E. T., Nordquist, R. E., van der Staay, F. J. Assessing learning and memory in pigs. Anim Cogn. 14 (12), 151-173 (2011).
- Broom, D. M., Sena, H., Moynihan, K. L. Pigs learn what a mirror image represents and use it to obtain information. Animal Behaviour. 78 (5), 1037-1041 (2009).
- Martin, L. J., Spicer, D. M., Lewis, M. H., Gluck, J. P., Cork, L. C. Social deprivation of infant rhesus monkeys alters the chemoarchitecture of the brain: I. Subcortical regions. The Journal of neuroscience. 11 (11), 3344-3358 (1991).
- Rizzi, S., Ori, C., Jevtovic-Todorovic, V. Timing versus duration: determinants of anesthesia-induced developmental apoptosis in the young mammalian brain. Annals of the New York Academy of Sciences. 1199, 43-51 (2010).
- Brambrink, A. M., et al. Isoflurane-induced neuroapoptosis in the neonatal rhesus macaque brain. Anesthesiology. 112 (4), 834-841 (2010).
- Elmore, M. R., et al. Respiratory viral infection in neonatal piglets causes marked microglia activation in the hippocampus and deficits in spatial learning. J Neurosci. 34 (6), 2120-2129 (2014).
- Alonso-Alconada, D., et al. Brain cell death is reduced with cooling by 3.5 degrees C to 5 degrees C but increased with cooling by 8.5 degrees C in a piglet asphyxia model. Stroke. 46 (1), 275-278 (2015).
- Costine, B. A., et al. The subventricular zone in the immature piglet brain: anatomy and exodus of neuroblasts into white matter after traumatic brain injury. Developmental neuroscience. 37 (2), 115-130 (2015).
- Holtzman, D., et al. In vivo phosphocreatine and ATP in piglet cerebral gray and white matter during seizures. Brain research. 783 (1), 19-27 (1998).
- Swindle, M. M. . Swine in the Laboratory. , (2007).
- Workman, A. D., Charvet, C. J., Clancy, B., Darlington, R. B., Finlay, B. L. Modeling transformations of neurodevelopmental sequences across mammalian species. J Neurosci. 33 (17), 7368-7383 (2013).
- Lunney, J. K. Advances in swine biomedical model genomics. International journal of biological sciences. 3 (3), 179-184 (2007).
- Nemzek, J. A., Hugunin, K. M., Opp, M. R. Modeling sepsis in the laboratory: merging sound science with animal well-being. Comparative medicine. 58 (2), 120-128 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados