Method Article
الجينوم التحرير وإخراج تمايز hPSCs عن التحقيق مع محددات النسب في تنمية البنكرياس الإنسان
* These authors contributed equally
In This Article
Summary
بروتوكولات لتوليد خطوط متحولة hPSC باستخدام منصة iCRISPR وتفرق hPSCs إلى خلايا تشبه β-الجلوكوز استجابة موصوفة. الجمع بين التكنولوجيا التحرير الجينوم مع التمايز الموجهة hPSC-يوفر منصة قوية لتحليل منهجي لدور المحددات النسب في التنمية البشرية وتطور المرض.
Abstract
استجواب وظائف الجينات في (hPSCs) أو تمييز الخلايا الجذعية المحفزة الإنسان تجديد الذات توفر منصة قيمة نحو فهم التنمية البشرية وتشريح آليات المرض في طبق. للاستفادة من هذا التطبيق المحتمل يتطلب كفاءة أدوات الجينوم التحرير لتوليد المسوخ hPSC في الجينات المرتبطة بالمرض، وكذلك في المختبر hPSC بروتوكولات التمايز لإنتاج أنواع الخلايا من الأمراض ذات الصلة أن ألخص بشكل وثيق في الجسم الحي نظرائهم. تم وضع منصة الجينوم تحرير فعالة لhPSCs اسمه iCRISPR من خلال استهداف بوساطة TALEN للتعبير كاسيت Cas9 في موضع AAVS1. هنا، يتم وصف البروتوكولات لتوليد خطوط Cas9 hPSC محرض باستخدام الخلايا المستزرعة في المتوسط محددة الصفات كيميائيا وشرط خالية المغذية. الإجراءات التفصيلية لاستخدام نظام iCRISPR للخروج المغلوب الجينات أو تغيرات جينية دقيقة في hPSCs، إما عن طريق نعلى مثلي نهاية الانضمام (NHEJ) أو عن طريق التعديلات النوكليوتيدات دقيقة باستخدام قالب إصلاح الموجه التماثل (HDR)، على التوالي، وترد. وتشمل هذه الإجراءات التقنية وصفا لتصميم وإنتاج، وترنسفكأيشن من الرنا دليل كريسبر (gRNAs)؛ قياس معدل التحور كريسبر التي كتبها T7E1 أو RFLP المقايسات. وإنشاء والتحقق من خطوط متحولة نسيلي. وأخيرا، فإننا الإجراءات وقائع لhPSC التمايز إلى خلايا تشبه β البنكرياس الجلوكوز تستجيب عن طريق محاكاة في التطور الجنيني البنكرياس الجسم الحي. الجمع بين التكنولوجيا iCRISPR مع توجه التمايز hPSC تمكن من دراسة منهجية وظيفة الجينات إلى زيادة فهمنا للآليات التنمية ومرض السكري البنكرياس.
Introduction
الخلايا الجذعية المحفزة الإنسان (hPSCs) لديها القدرة على حد سواء تجديد الذات وتؤدي لجميع المشتقات من ثلاث سلالات الجرثومية الجنينية. أنها توفر مصدرا قيما لاستبدال خلية العلاج والنمذجة المرض بمثابة منصة فريدة من نوعها لتلخيص العمليات الخلوية في سياق تنموي البشري. كما أنها تشكل مصدرا للخلايا التجريبية للتحجيم، تحليلات عالية الإنتاجية. غير أن التقدم كان محدودا بسبب تحديين رئيسيين: عدم وجود كفاءة أدوات التعديل الوراثي وصعوبة تلخص الخطوات التنموية الجنينية المعقدة في صحن الثقافة.
التعديل الوراثي هو أداة لا غنى عنها لدراسة وظيفة الجينات في التطور الطبيعي والمرض. ومع ذلك، في حين أن الجينات الكلاسيكية التي تستهدف النهج عبر إعادة التركيب مثلي أثبتت أن يكون أداة قوية لتشريح وظيفة الجين في الماوس الجذعية الجنينية خلايا (mESCs) 1، وهذا النهجوقد غير فعالة للغاية عندما تطبق على hPSCs 2 و 3. انضمام السريع مؤخرا، nucleases برمجة مواقع محددة من الطبيعة لاستخدامات المختبرية، بما في ذلك نيوكلييز اصبع الزنك (ZFNs)، النسخ الشبيهة المنشط nucleases المستجيب (TALENs)، وتتجمع interspaced بانتظام يكرر المتناوب قصيرة (كريسبر) / كريسبر المصاحب (CAS) نظم 4، يعني أن هندسة الجينوم أصبحت مهمة أسهل بكثير في مجموعة واسعة من الكائنات الحية وخطوط الخلايا، بما في ذلك في hPSCs. هذه الأدوات التحرير الجين الاستفادة من حقيقة أن nucleases خيالية مثل نوكلياز داخلية Cas9 يمكن أن تسمح مجموعة كاملة من التعديلات الجينية عن طريق حفز فواصل المزدوج تقطعت بهم السبل (DSBs) في أماكن محددة، مما اثار الذاتية الآلات إصلاح الحمض النووي لتفعيل إما غير مثلي إنهاء الانضمام (NHEJ) أو إصلاح الموجه التماثل (HDR). يمكن استغلالها سواء آليات التلاعب الجيني عن طريق حفز إييثإيه الإدراج عشوائي وطفرات الحذف (indels، عبر NHEJ)، لخلق طفرات انزياح الإطار التي تلغي الأليلات الجينات، أو استبدال النوكليوتيدات دقيقة (عبر تقرير التنمية البشرية)، أن ألخص الطفرات المريض لنمذجة الأمراض التي تصيب البشر أو لتصحيح طفرة مسببة للمرض للعلاج بالجينات .
كريسبر / بوساطة كاس هندسة الجينوم يتطلب عنصرين هما: موجهة RNA المستمر Cas9 نوكلياز داخلية ضرورية لانقسام الحمض النووي والحمض النووي الريبي كريسبر متغير (crRNA) و (tracrRNA) الازدواج تفعيل العابرة التي تحدد الاعتراف الهدف الحمض النووي. يمكن استبدال دوبلكس crRNA / tracrRNA مع واحد دليل الحمض النووي الريبي خيالية (gRNA)، الذي تم العثور على العمل بشكل أكثر كفاءة 5 و 6 و 7. في حين تم تكييف نظام / Cas9 كريسبر إلى أكثر الكائنات التجريبية وخطوط الخلايا، وتسليم والتعبير عن Cas9 وgRNA يختلف اختلافا كبيرا ويحتاج إلى مزيد من الأمثل لعشيعشية تحرير الجينوم كفاءة في كثير من النظم، بما في ذلك hPSCs 8. على منصة تحرير الجينوم كفاءة، iCRISPR، وقد تم تأسيسها في عام hPSCs 5. في هذا النظام، وقد استخدم نهج بوساطة TALEN لاستهداف كل من الأليلات من AAVS1 "التحوير الملاذ الآمن موضع" في المتحولة، أليل واحد مع transactivator العكسية التي تسيطر عليها التتراسيكلين (M2rtTA) والآخر مع وجود عنصر استجابة التتراسيكلين (TRE ) القيادة التعبير عن Cas9 (iCas9) في hPSCs. في خطوط نسيلي تأسيس (iCas9 hPSCs)، وأعرب عن Cas9 للغاية مع العلاج الدوكسيسيكلين. وفي الوقت نفسه، نظرا لصغر حجمها (100 الإقليم الشمالي)، gRNAs مفردة أو متعددة يمكن أن يتم تسليم بسهولة إلى iCas9 hPSCs مع كفاءة عالية، ويمكن توجيه Cas9 للانشقاق في مواقع محددة، مما يتيح كفاءة اختلال الجينات بوساطة NHEJ، فضلا عن تقرير التنمية البشرية بوساطة التعديلات النوكليوتيدات دقيقة في حضور قصيرة الحمض النووي المفرد الذين تقطعت بهم السبل (ssDNA) قوالب المانحة. النظام iCRISPR يمكن أن يكونيستخدم لتوليد بنجاح فريق من خطوط hPSC محاكية للمرض مع biallelic (متماثل أو مركب متخالف) أو متخالف الطفرات الخسارة من وظيفة في الجينات التنموية الهامة 5، 9. في حين أن عددا من الجماعات قد ذكرت التحرير الجين الفعال باستخدام كريسبر / كاس في hPSCs، يبقى نجاحا محدودا لعدد قليل من المختبرات الخبرات التكنولوجية. منصة iCRISPR تقدم حل فعال وإن كان بسيطا لتحرير الجين روتيني من قبل الباحثين من مختلف مستويات المهارة، وسبق استخدامها في عدد من الدراسات التي نشرت من قبل مجموعتنا وغيرها 9، 10، 11، 12. كما تم تمديد هذا النهج أيضا على إسكات محرض على أساس التعبير عن dCas9-KRAB 13.
جنبا إلى جنب مع التقدم في التقنية الجينوم التحريروقد تحققت بليد الحركة، وإدخال تحسينات كبيرة أيضا في صيانة hPSC والتمايز الموجهة. شروط الثقافة لhPSCs قد تطورت من الظروف المتوسطة الماوس المشع الليفية الجنينية (iMEF) لظروف خالية من التغذية على مكونات المصفوفة خارج الخلية المحددة، ومن الصياغات وسائل الإعلام المعقدة التي تعتمد على التغذية لتعريف كيميائيا 14. وقد خفضت هذه التحسينات التغير في hPSCs بسبب الخلافات دفعة إلى دفعة في المكونات استبدال إعداد والمصل خروج المغلوب iMEF، وبالتالي توفير بيئة أكثر استنساخه لhPSC التمايز. وفي الوقت نفسه، وتحسين معرفة مسارات الإشارات التي تحكم التطور الجنيني الإنسان، وكذلك الاكتشافات من الإنتاجية العالية عروض المخدرات، أدت إلى تحسين بروتوكولات التمايز 15، 16، 17، 18. هذه البروتوكولات تحاكي بشكل وثيق في فيفس الخطوات التنموية وتولد أنواع الخلايا التي تلخص بشكل وثيق في الجسم الحي نظرائهم. لhPSC التمايز في النسب البنكرياس، تحاكي بروتوكولات الأولية تطوير البنكرياس في وقت مبكر بشكل جيد ولكن في نهاية المطاف نسبيا ولدت خلايا β polyhormonal التي كانت من الظواهر الجنين غير ناضجة وردت ضعيفة لتحفيز الجلوكوز. التطورات الأخيرة 16، 17، 19، 20 سمحت للجيل من الخلايا مثل β البنكرياس الجلوكوز استجابة، والتي سوف تمكننا من تحقيق أحداث لاحقة، مثل تكوين ونضوج للخلايا β monohormonal.
هنا، ونحن بالتفصيل تطبيق خطوط تعديل الجينوم لدراسة تطوير البنكرياس عن طريق الجمع بين نظام iCRISPR مع المختبر في منصة التمايز القائم hPSC تجاه pancr الجلوكوز استجابةمثل β خلايا eatic. هذا الاقتران من أدوات التحرير الجينوم قوية مع تحسن بروتوكول التمايز hPSC ليس فقط يوفر سرعة وحجم اللازمة لتلبية الطلب المتزايد على التحقق من صحة العلاقة السببية المرض، ولكن أيضا يمكن التلاعب الجيني متطورة لاجراء مزيد من التحقيقات الآلية إلى سيطرة النسخي الكامنة وراء التطور الطبيعي والمرض 9 .
Protocol
ويستند هذا البروتوكول على عملنا مع خطوط hPSC H1، HUES8، وMEL-1 في حالة محددة كيميائيا وخالية من وحدة التغذية (يرجى الاطلاع على المواد والمعدات الجدول). لخطوط hPSC أخرى أو hPSCs حافظت في ظروف ثقافة مختلفة، فمن المستحسن مزيد من التحسين.
1. hPSC الثقافة في الحالة المعرفة وخالية من الطاعم كيميائيا
- التكيف مع ثقافة hPSC على مغذيات iMEF إلى حالة خالية من التغذية. في الحالات التي تكون فيها الخلايا المجمدة لا البقاء على قيد الحياة بشكل جيد عندما تعافى بشكل مباشر في حالة خالية من التغذية، واستعادة الخلايا في حالة iMEF أولا ثم التكيف مع حالة خالية من التغذية.
ملاحظة: بشكل عام، فإنه يأخذ 2 ممرات للhPSCs مثقف على مغذيات iMEF أن تتكيف مع ظروف خالية من التغذية. - تغيير المتوسط كل يوم وتمرير hPSCs عندما وصلت الخلايا ~ 80٪ confluency. بشكل عام، hPSCs مرور في ~ 1: 6 - 1:15 نسب كل 4-6 أيام. إضافة 10 ميكرومتر ROCK المانع Y-27632 ذوي الخوذات البيضاءأون الذوبان أو الركض الخلايا.
- قبل بذر hPSCs، أطباق ثقافة ما قبل معطف مع 5 ميكروغرام / مل (1 مل / 10 سم 2) اقتطاع الشكل البشري المؤتلف من vitronectin (VTN) لمدة 1 ساعة على الأقل في درجة حرارة الغرفة (RT). أيضا، إعداد الكامل المتوسطة يعرف كيميائيا بإضافة ملحق في الوسط القاعدي.
- إزالة مستنبت، وغسل خلايا مرة واحدة مع برنامج تلفزيوني بدون الكالسيوم والمغنيسيوم 2+ 2+، وعلاج الخلايا مع 0.5 ملي EDTA ل~ 2-5 دقيقة في RT.
- نضح EDTA قبل المستعمرات يكون فصل. مع pipetting لطيف، تفريق المستعمرات hPSC إلى قطع صغيرة وresuspend الخلايا في المتوسط كاملة.
- جمع hPSCs فصل وتدور أسفل الخلايا في 200 x ج لمدة 5 دقائق. Resuspend وhPSCs مكعبات في المتوسط كاملة والبذور الخلايا على لوحات مغلفة VTN.
2. توليد iCas9 خطوط hPSC
- النظام وتضخيم البلازميدات التالية: AAVS1-TALEN-L، AAVS1-TALEN-R، AAVS1-النيو M2rtTA، وAAVS1-بورو-iCas9.
ملاحظة: لتجنب أحداث إعادة التركيب غير متوقعة، استخدم Stbl3 الخلايا إعادة التركيب نقص المختصة لتحويل والتضخيم من البلازميدات عند 30 درجة مئوية. - عادة، وإعداد hPSCs في واحد 10 سم طبق (~ 1 × 10 7 الخلايا إذا ~ 80٪ متموجة) لأحد تستهدف التجربة.
ملاحظة: منذ Electroporation للوعادة ما يتسبب موت الخلايا كبيرا وبوساطة TALEN-استهداف الجينات في مكان AAVS1 يتطلب اختيار المضادات الحيوية، لا بد من المصنف لتحديد الخلايا المستهدفة بشكل صحيح على عدد كبير نسبيا من الخلايا. ويوصى الأمثل للتركيز الدواء لكل خط الخلية وكل حالة الثقافة. - في يوم -1، (اليوم قبل Electroporation لل)، إضافة 10 ميكرومتر ROCK المانع خلال تغيير وسائل الاعلام.
- في اليوم 0 (يوم Electroporation لل)، وإعداد لوحات مغلفة VTN في وقت مبكر.
- تنأى hPSCs إلى الخلايا وحيدة باليودنانوغرام 1X كاشف تفارق (يرجى الاطلاع على المواد والمعدات الجدول). لفترة وجيزة، وإزالة مستنبت، وغسل خلايا مرة واحدة مع برنامج تلفزيوني بدون الكالسيوم والمغنيسيوم 2+ 2+، وعلاج الخلايا مع كاشف تفارق 1X عند 37 درجة مئوية لمدة ~ 3 دقائق. نضح كاشف تفارق قبل الخلايا يكون فصل. مع pipetting لطيف، تفريق hPSCs في تعليق وحيد الخلية في 10.5 مل من المتوسط الشامل.
- تأخذ 0.5 مل تعليق خلية لحساب عدد الخلايا باستخدام عداد الخلية الآلي. بيليه hPSCs في 200 x ج لمدة 5 دقائق و resuspend الخلايا في البرد (4 درجات مئوية) في برنامج تلفزيوني في 12.5 × 10 6 خلية / مل.
- إضافة البلازميدات (انظر الجدول 1) إلى 800 ميكرولتر hPSC تعليق (12.5 × 10 6 خلية / مل) وتخلط جيدا. نقل الخليط إلى 0.4 سم كفيت electroporation والحفاظ على الجليد ل~ 5 دقائق.
- Electroporate الخلايا باستخدام نظام Electroporation للفي 250 V و 500 μF. في طب التوليد المستمر الوقتerved بعد Electroporation للعادة 9-13 مللي ثانية.
- بعد Electroporation لل، نقل الخلايا إلى أنبوب مخروطي 15 مل مع 5 مل من المتوسط الشامل استعد مسبقا. حاسمة لالاستهداف الناجح: استخدام hPSCs المتكاثرة الصحي والتعامل مع الخلايا بلطف جدا عند نقل، إعادة التعليق، وطلاء الخلايا بعد Electroporation لل.
- بيليه الخلايا في 200 x ج لمدة 5 دقائق. resuspend الخلايا في 10 مل من المتوسط كاملة مع 10 ميكرومتر مثبط ROCK ولوحة 1، 2.5، و 5 × 10 6 الخلايا على كل من الأطباق الثلاثة VTN المغلفة، 10 سم. وهذا يضمن أن واحدا على الأقل من لوحات سيكون لها مستعمرات كافية في خلية واحدة كثافة نسيلي لقطف مستعمرة.
- في يوم 1 (اليوم بعد Electroporation لل)، تغيير المتوسطة.
- في يوم 2-5، وبدء اختيار النيوميسين عندما كانت الخلايا ~ 60٪ متموجة. تغيير متوسطة يوميا مع 500 ميكروغرام / مل G418 كبريتات. موت الخلايا كبيرا بسبب selectioن ويلاحظ عادة بعد 2 أيام اختيار G418.
- في يوم 6، تغيير وسيط وبدون اختيار المضادات الحيوية.
- في يوم 7-9، وبدء اختيار بوروميسين. تغيير متوسطة يوميا مع 1 ميكروغرام / مل بوروميسين هيدروكلوريد. ينبغي مراعاة موت الخلايا كبيرا في اليوم التالي.
- في يوم 10، بدء تغيير المتوسطة يوميا دون اختيار المضادات الحيوية حتى hPSC المستعمرات وحيدة الخلية تصل إلى 1-2 مم في القطر.
ملاحظة: عادة، لوحظ 50 المستعمرات في صحن 10 سم، وبها 2.5 × 10 6 hPSCs مطلي يوم 0. - اختيار 12-24 المستعمرات تحت مجهر تشريحي. ميكانيكيا تفصيل المستعمرات hPSC إلى قطع صغيرة (~ 10 قطعة في مستعمرة) باستخدام إبرة 23-G (أ طرف الماصة 200 ميكرولتر هو أيضا غرامة) ونقل الخلايا مباشرة في المغلفة VTN-24 لوحات جيدة.
- تغيير المتوسطة يوميا حتى تصبح الخلايا متموجة. مرور الخلايا في كل بئر من 24 لوحات جيدا فيتكرار الآبار من 6 لوحات جيدا.
- عندما تصبح الخلايا متموجة في 6 لوحات جيدا، استخدام بئر واحدة لسهم المجمدة والبعض جيدا لاستخراج الحمض النووي الجيني لمزيد من التوصيف.
- توصيف والتحقق من صحة خطوط iCas9 التي وضعتها PCR التنميط الجيني، النشاف الجنوبي، تحليل RT-QPCR، تنميط نووي، وفحص تعدد القدرات. الرجوع إلى تشو وآخرون. 21 لإجراءات تجريبية مفصلة.
3. الجيل من hPSC المسخ خطوط باستخدام نظام iCRISPR
- جيل من خطوط خروج المغلوب hPSC
- تصميم gRNA والإنتاج
- اختيار المناطق المستهدفة في الجينات في المصالح لتعظيم إمكانية تعطيل من النوع البري وظيفة البروتين. الجينات المشروح جيدا، واختيار المنطقة المستهدفة المنبع من مجال وظيفي أساسي. بدلا من ذلك، gRNAs تصميم لاستهداف منطقة المصب من كودون البداية. اختيار لا يقل عن 2 مختلفةالمناطق لجينة من الفائدة.
- gRNAs التصميم باستخدام أداة تصميم كريسبر على الانترنت (http://crispr.mit.edu). لكل منطقة الهدف، تصميم 3 gRNAs مع قدرة منخفضة خارج الأهداف واستخدام واحد وفقا لأعلى كفاءة استهداف لتوليد خط متحولة نسيلي 22.
ملاحظة: من أجل تحقيق ارتفاع الجينوم كفاءة التحرير، فمن المستحسن لتقديم gRNA كما oligos RNA بدلا من DNA البلازميد بسبب كفاءة ترنسفكأيشن أعلى من الرنا صغيرة بالمقارنة مع البلازميدات في التجربة السابقة. - طلب 120 النوكليوتيدات (الإقليم الشمالي) oligos الحمض النووي الذي يحتوي على تسلسل المروج T7، المتغير 20 الإقليم الشمالي crRNA تسلسل الاعتراف (N) 20 (لا تشمل تسلسل حزب الأصالة والمعاصرة)، وثابت تسلسل دليل خيالية. تمييع oligos إلى 100 ميكرومتر حل الأسهم في ده 2 O وإعداد 250 نانومتر كحل العمل.
ملاحظة: TAATACGACTCACTATAGGG (N) 20 GTTTTAGAGCTAGAAATAGCAAGTTAAAATAAGGCTAGTCCGTTATCAACTTGAAAAAGTGGCACCGAGTCGGTGCTTTT - PCR-تضخيم oligos باستخدام T7F وTracrR الاشعال (انظر الجدول رقم 2) لإنتاج الحمض النووي (dsDNA) قالب المزدوج تقطعت بهم السبل لgRNA في النسخ المختبر (IVT). استخدام 50 ميكرولتر من PCR خليط التفاعل (انظر الجدول 3) والشروط دورة PCR (انظر الجدول 4).
- استخدام عالية الغلة عدة T7 النسخ لفي المختبر gRNA النسخ مع القالب تضخيم PCR في 20 ميكرولتر، في المختبر gRNA مزيج النسخ (انظر الجدول 5) وفقا لتعليمات الشركة الصانعة. تنقية المنتجات gRNA باستخدام النسخ عدة التنظيف وفقا لتعليمات الشركة الصانعة.
- أزل gRNAs بعد بروتوكول تنقية عالية الإنتاجية وفقا لتعليمات الشركة الصانعة (عادة ~ 50-100 ميكروغرام) في 100 ميكرولتر من شطف العازلة. ضبط تركيز إلى 320 نانوغرام / ميكرولتر (10 ميكرومتر) عندما يكون ذلك ممكنا ومخزن في -80 &# 176؛ ج حتى الاستخدام.
- PCR وسانجر تصميم تسلسل التمهيدي
- تصميم والتحقق من صحة الاشعال PCR تضخيم المنطقة المستهدفة، مع أحجام المنتج تتراوح عادة من ~ 500 - 1000 سنة مضت.
- تصميم سانجر الاشعال التسلسل ملزمة داخليا للمنتجات PCR للسماح التسلسل المباشر للمنتجات PCR بغير طهور.
- ترنسفكأيشن gRNA في iCas9 hPSCs
- في يوم -1، علاج خلايا iCas9 مع 2 ميكروغرام / مل الدوكسيسيكلين 24 ساعة قبل gRNA ترنسفكأيشن.
- في اليوم 0 من gRNA ترنسفكأيشن، وإعداد لوحات مغلفة VTN في وقت مبكر.
- فصل الخلايا iCas9 في الخلايا واحدة باستخدام 1X كاشف التفكك، كما هو موضح في الخطوة 2.5.
- بيليه hPSCs في 200 x ج لمدة 5 دقائق و resuspend الخلايا في ~ 0.5 × 10 6 خلية / مل في المتوسط كاملة تستكمل مع 2 ميكروغرام / مل الدوكسيسيكلين و 10 ميكرومتر ROCK المانع.
- لوحة 0.5 مل من الخلايا معلق في الآبار الفردية من 24 لوحات جيدا. إعداد آبار إضافية لخدمة ضوابط أنها غير transfected.
- لكل gRNA، وجعل خليط ترنسفكأيشن التالية: اخلطي A، 50 ميكرولتر من انخفاض سيرم + 1 ميكرولتر من gRNA (10 ميكرومتر). مزيج B، 50 ميكرولتر من انخفاض سيرم + 3 ميكرولتر من كاشف ترنسفكأيشن.
- الجمع بين مزيج A و B لجعل 100 ميكرولتر خليط. احتضان لمدة 5 دقائق على RT. إضافة 50 ميكرولتر من الخليط إلى الخلايا في الآبار مكررة من 24 لوحات جيدا وتخلط جيدا.
- في يوم 1، إجراء ترنسفكأيشن الثاني إذا لزم الأمر لزيادة كفاءة الاستهداف. خلاف ذلك، تغيير وسيط وبدون الدوكسيسيكلين.
- في يوم 2-3، تغيير المتوسطة يوميا.
- في يوم 4، استخراج الحمض النووي الجيني من جانب واحد من كل خلية مراقبة transfected وغير transfected باستخدام مجموعة استخراج الحمض النووي. ضبط تركيز إلى 50 نانوغرام / μL.
- PCR-تضخيم المناطق المستهدفة المرافقة تسلسل تستهدف gRNA وتقدير الكفاءة التحرير باستخدام T7 نوكلياز داخلية I (T7EI) الهضم أو طول تقييد جزء تعدد الأشكال (RFLP) فحص، كما هو موضح سابقا 5.
- T7EI فحص
- PCR-تضخيم المنطقة المستهدفة باستخدام بادئات تصميم والتحقق من صحتها في الخطوة 3.1.
- تحضير مخاليط (انظر الجدول 6) وأداء تمسخ الحمض النووي والتهجين من المنتجات PCR باستخدام الشروط المبينة في الجدول رقم (7).
ملاحظة: استنادا إلى تجربتنا، هو عموما ليس من الضروري تنقية المنتجات PCR لفحص T7EI عند استخدام لدينا حالة PCR. ومع ذلك، يمكن تنقية يكون مفيدا في حالات أخرى. - إجراء عملية الهضم T7EI عند 37 درجة مئوية لمدة 30 دقيقة باستخدام 10 ميكرولتر من التشويه والتحريف وتهجين PCR المنتج و 0.2 ميكرولتر (يو 2) من T7E1 (10 U / ميكرولتر).
- Resolvالبريد عينات PCR هضم T7E1 من قبل الكهربائي للهلام. استخدام يماغيج لتحديد شدة الفرقة النسبية للقطع والحمض النووي تقطيعه. حساب تردد INDEL باستخدام المعادلة التالية: (1 - (√ (1- (ب + ج)) / (أ + ب + ج))) × 100، حيث هو كثافة المنتج PCR عسر الهضم وb و c شدة من المنتجات المشقوق T7E1.
- RFLP فحص
ملاحظة: في الحالات التي يكون فيها الموقع التقييد على مقربة (<5 بي بي) إلى موقع الشق Cas9 (3 بي بي 5 "من تسلسل PAM)، لا يمكن أن يؤديها مقايسة RFLP لتحديد وتيرة INDEL.- استخدام نفس المنتجات PCR كما هو موضح في الخطوة 3.1.4.1.
- هضم المنتج PCR مع انزيم التقييد الذي يحتوي موقع قيود على مقربة من موقع Cas9 الانقسام.
- حل عينات PCR هضمها من قبل الكهربائي للهلام. استخدام يماغيج لتحديد شدة الفرقة النسبية للقطع والحمض النووي تقطيعه. حساب INDELتردد باستخدام الصيغة: أ / (أ + ب + ج) × 100، حيث هو كثافة المنتج PCR عسر الهضم وباء وجيم هي شدة المنتجات هضمها.
- إنشاء خطوط متحولة نسيلي
ملاحظة: تحرير الجينوم في hPSCs باستخدام نظام iCRISPR مع gRNA ترنسفكأيشن ذو كفاءة عالية، وليس هناك حاجة إلى اختيار المضادات الحيوية. إنشاء خطوط نسيلي، فمن الضروري أن البذور الخلايا في مناطق ذات كثافة منخفضة نسبيا لضمان تشكيل المستعمرات المشتقة وحيدة الخلية.- تحديد gRNAs وفقا لأعلى كفاءة تحرير (باستخدام T7EI أو RFLP الفحص) ومع بقاء الخلية جيد. استخدام مكررة المقابلة تماما لنسيلي إنشاء خط متحولة.
- تنأى hPSCs في تعليق وحيد الخلية باستخدام 1X كاشف التفكك، كما هو موضح في الخطوة 2.5. Replate 500، 1000، و 2000 الخلايا على كل من الأطباق الثلاثة VTN المغلفة، 10 سم.
- تغيير ش اليومي المتوسطntil وحيدة الخلية مستعمرات تصل ~ 2 مم في القطر.
- اختيار 24 - 48 مستعمرات لكل gRNA، اعتمادا على تقدير تستهدف الكفاءة من قبل T7EI و / أو فحص RFLP. ميكانيكيا تفصيل كل مستعمرة إلى قطع صغيرة (~ 10 قطعة في مستعمرة) باستخدام إبرة 23-G (أ طرف الماصة 200 ميكرولتر هو أيضا غرامة) وreplate الخلايا في مكررة، لوحات المغلفة VTN-96-جيدا. استخدام لوحة واحدة لاستخراج الحمض النووي الجيني وسانجر تسلسل ولوحة أخرى لمزيد من التوسع.
- عندما أصبحت الخلايا في لوحات 96-جيدا متموجة، استخراج الحمض النووي الجيني (بدون استخراج الفينول / الكلوروفورم) باستخدام بروتوكول بسيط، كما هو مبين أدناه.
- إزالة المتوسطة وغسل خلايا مرة واحدة مع برنامج تلفزيوني بدون الكالسيوم والمغنيسيوم 2+ 2+. إضافة 50 ميكرولتر من تحلل العازلة (5 ميكرولتر من بروتين كاف (10 ملغ / مل)، و 5 ميكرولتر من PCR العازلة 10X، و 40 ميكرولتر من ده 2 O) إلى كل بئر من لوحة 96-جيدا. ختم لوحة باستخدام فيلم لاصقة وincubaالشركة المصرية للاتصالات بين عشية وضحاها في 55 درجة مئوية.
- في اليوم التالي، ونقل لست] الخلية في 96-جيدا لوحة PCR واحتضان لمدة 10 دقيقة في 99 درجة مئوية في thermocycler لإبطال نشاط بروتين K.
- PCR-تضخيم المنطقة المستهدفة باستخدام نفس الاشعال كما لT7EI أو فحص RFLP، وذلك باستخدام 1 ميكرولتر من المحللة خلية كقالب.
- استخدام 1 ميكرولتر من الناتج PCR لسانجر تسلسل مع التمهيدي ملزمة داخليا للمنتج PCR.
- تضخيم استنساخ مع طفرات INDEL انزياح الإطار للأسهم المجمدة. أيضا، تضخيم بضع البرية من نوع الحيوانات المستنسخة من نفس التجربة استهداف لخدمة خطوط السيطرة كما إسوي لمزيد من التجارب.
- تصميم gRNA والإنتاج
- جيل من خطوط متحولة مع بعض التعديلات النوكليوتيدات دقيقة
ملاحظة: بالمقارنة مع المسوخ خروج المغلوب الناتجة عن نهاية غير المتجانسة الانضمام (NHEJ)، الدقيق تغيير النوكليوتيدات لا يمكن أن يتحقق من خلال الموجه تناظر إصلاح (HDR) في حضور الى اصلاح الحمض النوويقوالب ص. هذه التعديلات النوكليوتيدات دقيقة تسمح لتوليد الطفرات المريض محددة في البرية من نوع hPSCs ولتصحيح الطفرات في iPSCs المستمدة من المريض.- تصميم ssDNA كما قالب تقرير التنمية البشرية
- تصميم وإنتاج 2-3 gRNAs على مقربة من طفرة المريض محددة، كما هو موضح في الخطوة 3.1.1.
- تصميم الحمض النووي واحد الذين تقطعت بهم السبل (ssDNA) التي تحتوي على طفرة المريض محددة يحيط بها ~ 40 - 80 الإقليم الشمالي من التماثل على كل جانب كما قالب تقرير التنمية البشرية.
- للحد من قطع إضافية بعد الإصلاح الصحيح، وإدخال طفرة صامتة إلى القالب ssDNA في المنطقة ضمن تسلسل اعتراف gRNA وعلى مقربة من تسلسل حزب الأصالة والمعاصرة أو في تسلسل حزب الأصالة والمعاصرة نفسها، إن أمكن.
- إذا كان ذلك ممكنا، وتصميم طفرة صامتة لتقديم رواية موقع تقييد الهضم وكذلك بحيث أنها يمكن أن تستخدم لتقدير كفاءة إصلاح باستخدام فحص RFLP.
- gRNA / ssDNA شارك في ترنسفكأيشن وإنشاء خطوط نسيلي
- أداء شارك في ترنسفكأيشن من gRNA / ssDNA إلى خلايا iCas9، كما هو موضح في الخطوة 3.1.3، مع خليط ترنسفكأيشن ألف وباء لكل gRNA والسيطرة غير transfected، transfect الخلايا في الآبار مكررة من 24 لوحات جيدا. مزيج ج: 50 ميكرولتر من انخفاض سيرم + 1 ميكرولتر من gRNA (10 ميكرومتر) + 2 ميكرولتر من ssDNA (10 ميكرومتر). مزيج B: 50 ميكرولتر من انخفاض سيرم + 3 ميكرولتر من كاشف ترنسفكأيشن.
- بعد ترنسفكأيشن، استخراج الحمض النووي الجيني من جانب واحد من كل خلية مراقبة transfected وغير transfected وتقدير كفاءة إصلاح باستخدام T7EI و / أو فحص RFLP.
- التعرف على خليط gRNA / ssDNA وفقا لأعلى كفاءة إصلاح وبقاء الخلية جيد. استخدام مكررة المقابلة تماما لنسيلي إنشاء خط متحولة.
- اختيار 48-96 المستعمرات، اعتمادا على تقدير كفاءة استهداف من قبل T7EI و / أو RFLP الحمارعبد المنعم يوسف. بشكل عام، وكفاءة طفرة بوساطة HDR-أقل من خروج المغلوب طفرة ويحتاج إلى أن اختار بالتالي المزيد من المستعمرات.
- تسلسل، وتوسيع، والتحقق من صحة خطوط نسيلي، كما هو موضح في الخطوة 3.1.6.
- تصميم ssDNA كما قالب تقرير التنمية البشرية
4. في المختبر hPSC التمايز إلى خلايا β البنكرياس الجلوكوز استجابة
ملاحظة: في تمايز المختبر من المسوخ hPSC إلى أنواع الخلايا من الأمراض ذات الصلة يوفر منصة لنمذجة المرض في طبق. يركز بروتوكول التالية على التمايز في المختبر من hPSCs إلى خلايا β البنكرياس الجلوكوز تستجيب للدراسات التنموية والسكري البنكرياس 9 و 16 و 17.
- hPSC التمايز إلى الأديم الباطن نهائي
- الحفاظ على المسوخ hPSC وخطوط السيطرة من النوع البري في حالة محددة كيميائيا، وخالية من التغذية، كما وصفد في الخطوة 1.
- لإعداد hPSCs للتمايز، تنأى hPSCs باستخدام 1X كاشف التفكك وتفريقهم في تعليق وحيد الخلية في المتوسط كاملة.
- بيليه الخلايا في 200 x ج لمدة 5 دقائق واعادة تعليق الخلايا في المتوسط كاملة مع 10 ميكرومتر ROCK المانع. حساب عدد الخلايا والبذور الخلايا في ~ 1.4 × 10 5 خلية / سم 2 على لوحات مغلفة VTN.
- تغيير المتوسطة 24 ساعة بعد البذر.
- في اليوم 0، بدء التمايز بعد 48 ساعة، وعندما وصلت إلى الخلايا ~ 80٪ confluency.
ملاحظة: لتحقيق كفاءة عالية التمايز البنكرياس، وتحسين كثافة البذر ومستوى confluency في 48 ساعة يوصى لكل خط على حدة. - نضح المتوسطة hPSC وشطف خلايا مرة واحدة مع برنامج تلفزيوني بدون الكالسيوم والمغنيسيوم 2+ 2+.
- تغيير المتوسطة إلى اليوم 0 (D0) متوسطة التمايز.
- في يوم 1-2، تغيير ديfferentiation المتوسط يوميا، وفقا لصفات في الجدول 8.
- في يوم 3، وفحص علامات الأديم نهائية SOX17، FOXA2، وCXCR4 بواسطة تلوين مناعي والتدفق الخلوي التحليل.
- نهائي تمايز الأديم إلى السلف البنكرياس
- في يوم 3-9، ومواصلة تمايز الأديم الباطن نهائي تجاه النسب البنكرياس عن طريق تغيير متوسطة يوميا، وفقا لصفات في الجدول 9.
- في يوم 7، دراسة في وقت مبكر السلف البنكرياس (PP1) علامة PDX1 تلوين مناعي والتدفق الخلوي التحليل.
- في يوم 10، ودراسة لاحق السلف البنكرياس (PP2) علامات PDX1 وNKX6.1. وفي الوقت نفسه، تستعد لنقل خلايا PP2 إلى واجهة الهواء السائل لمزيد من التمايز إلى خلايا الغدد الصماء في البنكرياس.
- الغدد الصماء في البنكرياس تختلفentiation في واجهة الهواء السائل
- علاج الخلايا PP2 مع 10 ميكرومتر ROCK المانع 4 ساعات قبل التفكك.
- إزالة المتوسطة وشطف خلايا مرة واحدة مع برنامج تلفزيوني بدون الكالسيوم والمغنيسيوم 2+ 2+.
- إضافة 2 مل من كاشف تفارق 1x إلى خلايا PP2 في صحن واحد 10 سم واحتضان عند 37 درجة مئوية لمدة 2-3 دقيقة.
- نضح كاشف تفارق قبل الخلايا يكون فصل. إضافة 10 مل من BLAR المتوسطة وتفريق الخلايا PP2 إلى الخلايا واحد من قبل pipetting بلطف صعودا وهبوطا.
- جمع تعليق وحيد الخلية. حساب عدد الخلايا وبيليه في 200 x ج لمدة 5 دقائق.
- resuspend الكرية خلية في ~ 0.5 × 10 5 خلية / ميكرولتر في S5 التمايز المتوسطة وبقعة 5-10 ميكرولتر من الخلايا لكل بقعة على مرشح إدراج transwell. ضع 10-15 البقع في واحد إدراج 6-جيدا و~ 100 البقع في إدراج 10 سم.
- إضافة S5 المتوسطة إلى الجزء السفلي من كل إدراج transwell، ~ 1.5 مل لإدراج 6-جيدا و~ 8 مل وأو إدراج 10 سم.
- تغيير متوسطة يوميا مع وصفات في الجدول 10.
- دراسة البنكرياس علامات الغدد الصماء PDX1، NKX6.1 NEUROD1، NKX2.2، الأنسولين، والجلوكاجون في يوم 34 من تلطيخ مناعي والتدفق الخلوي تحليل 17.
- دراسة المستمدة hPSC وظيفة الخلية مثل β مع حفز إفراز الأنسولين الجلوكوز (هيئة التأمين) فحص 16 و 17.
النتائج
hPSC تعريف كيميائيا وخالية من الطاعم التكيف الثقافة والصيانة
hPSCs مثقف على مغذيات iMEF يمكن تكييفها بسرعة لوحات مغلفة VTN في حالة ثقافة خالية من التغذية. نفس النسبة تقسيم كثقافة المغذية iMEF طبيعية يمكن استخدامها خلال التكيف. ويبين الشكل 1A الأشكال التضاريسية نموذجية من hPSCs على مغذيات iMEF في المتوسط على أساس KSR وعلى السطح المطلي VTN في المتوسط خالية المغذية. ويبين الشكل 1B تغيير المورفولوجية نموذجي ونمو المستعمرات hPSC أثناء مرور الأول من التكيف (4 أيام). الخلايا يمكن أن يكون أبعد passaged أو تجميد للتجارب في المستقبل. تنفيذ 2-3 مقاطع من ثقافة التكيف قبل بدء التجارب التمايز. ينصح تنميط نووي أيضا بعد التكيف، على الرغم من أننا لم احظ شذوذ النمط النووي خلال مرحلة التكيف.
"FO: المحافظة على together.within الصفحات =" 1 "> AAVS1 توليد iCas9 hPSC خطوط من خلال TALEN بوساطة استهدافكما هو موضح سابقا، تم electroporated hPSCs مع زوج من AAVS1 البلازميدات TALEN وCas9 وM2rtTA البلازميدات 5. الشكل 2A وباء يظهر ناقلات المانحة مفصلة تستهدف التصميم والإجراء بأكمله لتوليد خطوط نسيلي iCas9 hPSC. بعد اختيار المضادات الحيوية، وكانت الحيوانات المستنسخة المشتقة وحيدة الخلية، عرض حجم كاف والتشكل hPSC نموذجية جاهزة للاستلام (10 - 12 يوما بعد Electroporation لل، الشكل 2C). عادة ~ 50٪ من الحيوانات المستنسخة مستهدفون بشكل صحيح دون التكامل العشوائية، كما تم التحقق منها من قبل جنوب النشاف (الشكل 2D) 5. التكامل عشوائي قد يتسبب التعبير المتسرب من Cas9 في غياب العلاج الدوكسيسيكلين.
كفاءة M الوراثيةodification في hPSCs باستخدام منصة iCRISPR
في تأسيس iCas9 hPSCs، وأعرب عن Cas9 مع العلاج الدوكسيسيكلين والموجهة إلى مكان المستهدف من قبل gRNAs transfected، حيث يولد DSBs. في حالة عدم وجود قالب إصلاح، إصلاح الحمض النووي من خلال NHEJ يولد indels، والتي غالبا ما تؤدي إلى تعطيل الجين أو خروج المغلوب. في ظل وجود قالب إصلاح (على سبيل المثال، وهو المانحة ssDNA)، تقرير التنمية البشرية يمكن استخدامها لتغيرات جينية محددة، مثل توليد طفرة المريض محددة في البرية من نوع الخلفية hPSC أو تصحيح متغير وراثي الأمراض المرتبطة في patient- iPSCs مشتقة (الشكل 3A). فإنه يأخذ ~ 1 الشهر لتوليد خطوط متحولة نسيلي باستخدام نظام iCRISPR. بعد iCas9 تحريض وgRNA ترنسفكأيشن، استخدمت T7EI و / أو RFLP فحوصات لتقييم Cas9 كفاءة القطع، وكانت المصنفة الخلايا transfected فيما بعد الخلايا وحيدة في أطباق 10 سم في منخفض الكثافة (~ 500-2، 000خلايا طبق / 10 سم). 10 - بعد 12 يوما، وضعت الحيوانات المستنسخة المشتقة وحيدة الخلية في آبار لوحة 96-جيدا للتوسع ومزيد من التوصيف (أي التنميط الجيني والنشاف الغربية) (الشكل 3B). منذ خروج المغلوب الجينات بوساطة iCRISPR هو كفاءة عالية، لا عملية الاختيار وتشارك، وعادة 20-50٪ المسوخ biallelic يمكن أن يتحقق بسهولة (الشكل 3C) 5. لتغيرات جينية فعالة ودقيقة، gRNAs وشارك في transfected مع الجهات المانحة ssDNA تحمل تسلسل التعديل المحدد (لتغيير صغير ولكن معين من تسلسل الجينوم). في كثير من الأحيان، لمنع إعادة القطع في الأليلات تعديل، فمن المستحسن أن تشمل طفرة صامتة على مقربة من أو في تسلسل حزب الأصالة والمعاصرة (الشكل 3D). مع هذا النظام، ~ تتحقق 10٪ من الحيوانات المستنسخة تحمل المطلوب بوساطة تقرير التنمية البشرية الجينوم تعديل دون إجراء أي تعديلات إضافية في كل من الأليلات (أرقام 3E). على السريع وصتعديل recise من الجينوم hPSC باستخدام منصة iCRISPR يسمح لنا لجعل بسرعة وكفاءة خطوط hPSC أن تكون بمثابة نماذج لدراسة التنمية البشرية ومرض.
التمايز كفاءة hPSCs نحو خلايا تشبه β-الجلوكوز استجابة
وقد سمح التقدم الذي أحرز مؤخرا في hPSC التمايز البنكرياس تطوير البروتوكولات التي ألخص عن كثب التطور الجنيني البنكرياس. hPSCs غير متمايزة متباينة لأول مرة في الأديم الباطن نهائي، ثم إلى PDX1 + الأسلاف البنكرياس في وقت مبكر (PP1) وPDX1 + NKX6.1 + لاحقة الخلايا الاولية البنكرياس (PP2)، وأخيرا إلى الجلوكوز استجابة خلايا 16 و 17 و 19 β مثل، 20 ، 23، 24. هذه protocكما تمت الأمثل شريان الحياة لتوليد موثوق PDX1 + NKX6.1 + الأسلاف البنكرياس ومثل β خلايا الجلوكوز استجابة 9. ويبين الشكل 4A ملاحق الكيميائية مفصلة المستخدمة في كل مرحلة من التمايز. عادة، ~ 80٪ confluency 2 بعد أيام من الطلاء خلية الأولي هو المثالي لبدء تمايز HUES8 hPSCs (الشكل 4B). اختبار عدة كثافة البذر مختلفة ينصح بشدة لاكتشاف حالة الأمثل لكل خط خلية معينة. عادة ما لا يقل عن 75٪ FOXA2 + SOX17 + الخلايا في مرحلة DE و 40٪ PDX1 + خلايا NKX6.1 + في مرحلة PP2 يمكن أن يتحقق (الشكل 4C). في مرحلة S5، وجود شكل تشبه هالة حول مجموع الخلايا هو مؤشر لبقاء جيد من الخلايا، وهو أمر مهم للمزيد من التمايز إلى NKX6.1 + CPEP + الجلوكوز استجابة خلايا تشبه β (الشكل 4D ). هذا البروتوكول هو مفيد لدراسة الإنسان البنكرياس د evelopment والمرض في طبق.

الشكل 1. hPSC تعريف كيميائيا وصيانة خالية من الطاعم والتكيف الثقافة من iMEF المغذية. (A) مثقف صور الممثل hPSCs على تغذية iMEF أو على VTN في يوم 4، جاهزة للتقسيم. (ب) التشكل نموذجي hPSCs أثناء مرور الأول من التكيف في الثقافة الحرة المغذية من وحدة تغذية iMEF. تم تقسيم اليوم 4 hPSCs مثقف على مغذيات iMEF ومطلي على لوحات مغلفة VTN في المتوسط محددة الصفات كيميائيا مع مثبط ROCK. وكانت نسبة تقسيم نفس نسبة تقسيم المعتادة للزراعة في ظروف التغذية iMEF. تم تغيير المتوسط كل يوم دون المانع ROCK. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
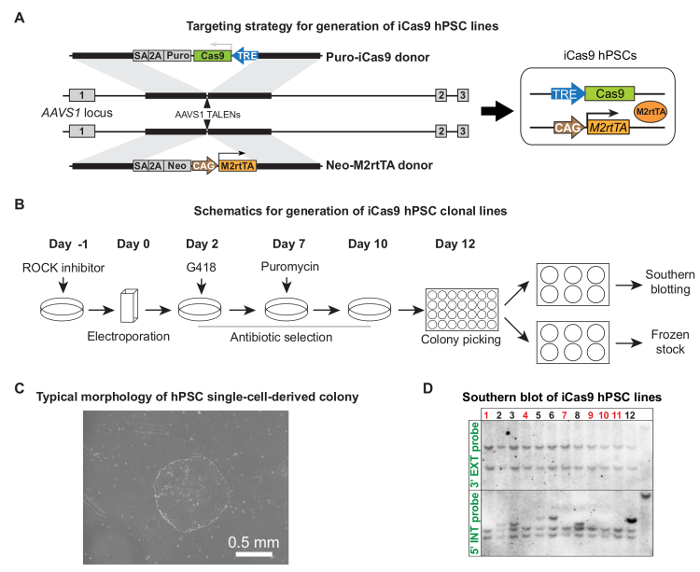
الشكل 2. توليد iCas9 خطوط hPSC. (أ) استهداف استراتيجية لتوليد خطوط iCas9 hPSC. استهدفت بورو-Cas9 المانحة والنيو M2rtTA المانحة في موضع AAVS1 البشري عن طريق زوج من AAVS1 TALENs. (ب) الخطط للعملية استهداف بأكملها، بما في ذلك Electroporation لل، واختيار المضادات الحيوية، قطف مستعمرة والتوسع، وتوصيف خط الخلية. (C) الممثل استنساخ وحيدة الخلية جاهزة ويمكن الحصول على حوالي 10 - 12 أيام بعد Electroporation لل. (D) أمثلة اللطخة الجنوبية لتحديد استنساخ المستهدفة بشكل صحيح دون التكامل إضافي اثنين من البلازميدات المانحة. يتم وضع علامة استنساخ الصحيحة باللون الأحمر. (A) و (D) ومقتبس من المرجع 5، بإذن.ig2large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
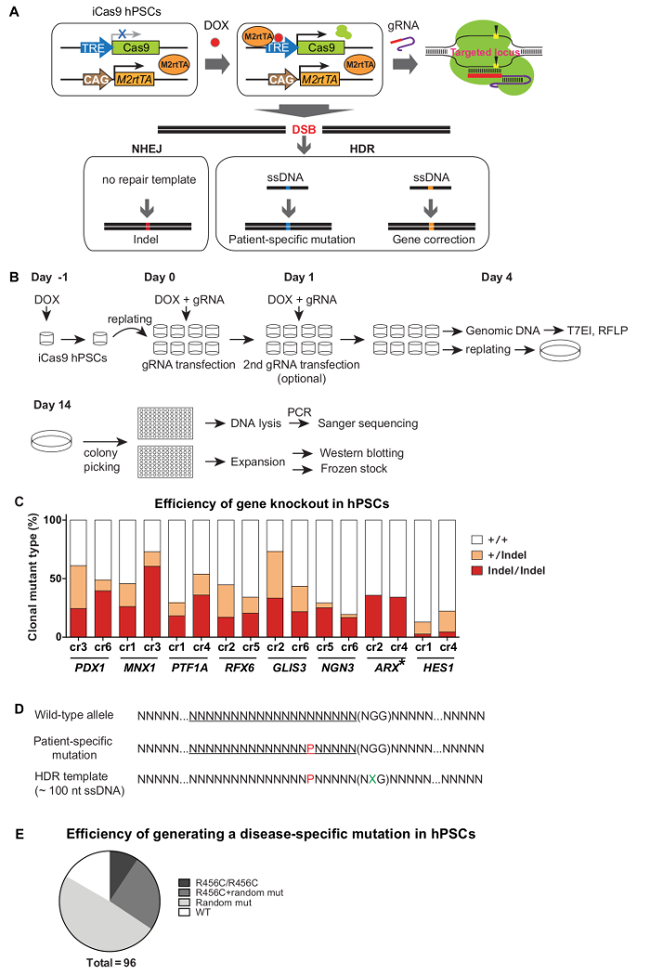
الشكل 3. تعديل الوراثي كفاءة في hPSCs باستخدام نظام iCRISPR. (أ) الخطط لتوليد المسوخ خروج المغلوب الجينات أو تعديل الجينات الدقيق باستخدام نظام iCRISPR. (ب) إجراء الاستهداف وإنشاء خط نسيلي. كفاءة خروج المغلوب (C) جين من خلال NHEJ في hPSCs 9. (D) تصميم وssDNA يحمل تعديل النوكليوتيدات محددة. P، في الحمراء: طفرة المريض محددة؛ X، باللون الأخضر: طفرة صامتة. (E) كفاءة تعديل النوكليوتيدات الدقيق بوساطة تقرير التنمية البشرية. وقدم تحور R456C دقيقة (الناجمة عن النوكليوتيدات C معين> تي طفرة) في موضع GATA6 باستخدام نظام iCRISPR.(يرجى الرجوع إلى مرجع 5 للحصول على معلومات أكثر تفصيلا). تم تكييف (C) و (E) من المرجع 9 و المرجع 5 على التوالي، مع الأذونات. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
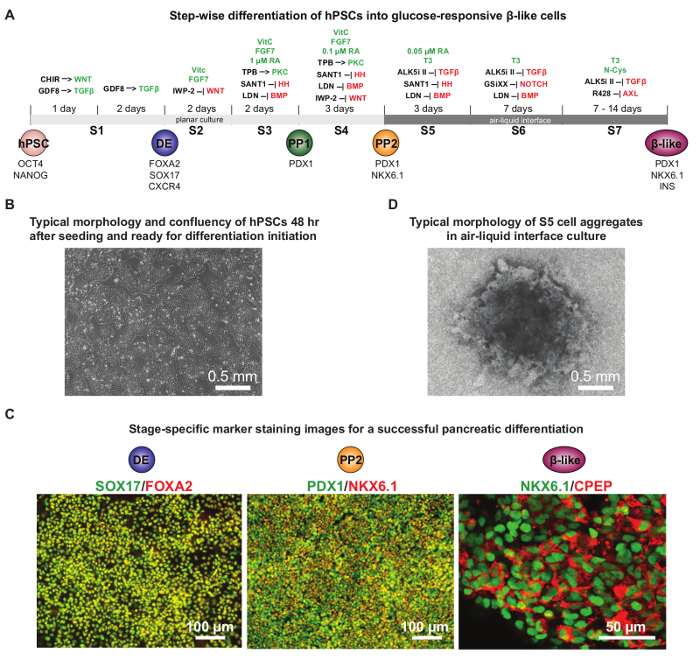
الشكل 4. إخراج hPSC التمايز إلى خلايا تشبه β البنكرياس الجلوكوز استجابة. (أ) الخطط للبروتوكول التمايز مفصل، مع المواد الكيميائية تستكمل في كل مرحلة من التمايز. ويسلط الضوء على مسارات الإشارات التي يتم تفعيلها أو مستعمل خلال التمايز باللون الأخضر أو الأحمر، على التوالي. CHIR: GSK3 المانع. GDF8: عامل النمو التمايز 8 أو myostatin، أحد أفراد الأسرة بروتين مركب بيتا. صاحب السمو: القنفذ. DE: الأديم النهائي. PP1:PDX1 + أوائل السلف البنكرياس. PP2: PDX1 + NKX6.1 + وقت لاحق من السلف البنكرياس. (ب) confluency نموذجي (70-80٪) من hPSCs 48 ساعة بعد الغرس عندما تكون جاهزة لبدء التمايز. (C) التمثيلية الصور مناعي تلطيخ يظهر التمايز الناجح في الأديم الباطن نهائي (DE) مرحلة (FOXA2 وSOX17 شارك في تلطيخ)، البنكرياس مرحلة السلف (PP2: PDX1 وNKX6.1 شارك في تلطيخ)، والجلوكوز استجابة β- مثل مرحلة الخلية (NKX6.1 وج الببتيد شارك في تلطيخ). بشكل عام، لتحقيق أكثر من 10٪ NKX6.1 + CPEP + الخلايا في مرحلة الخلية مثل β، و 75 في المائة على الأقل FOXA2 + SOX17 + خلايا DE و 40٪ PDX1 + مطلوبة خلايا NKX6.1 + PP2 في مراحل المقابلة. (D) التشكل نموذجي من مجموع الخلايا في مرحلة S5 على غشاء إدراج في ثقافة واجهة الهواء السائل. هاجرت الخلايا على قيد الحياة من وسط الركام (في الظلام) وترك بنية تشبه هالة على الحافة. (A ) و (D) ومقتبس من المراجع 9 مع الأذونات. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| البلازميد | كمية |
| AAVS1-TALEN-L | 5 ميكروغرام |
| AAVS1-TALEN-R | 5 ميكروغرام |
| AAVS1-بورو-iCas9 | 40 ميكروغرام |
| AAVS1-النيو M2rtTA | 40 ميكروغرام |
الجدول 1
| كتاب تمهيدي | تسلسل |
| T7F | TAATACGACTCACTATAGGG |
| TracrR | AAAAGCACCGACTCGGTGCC |
الجدول 2
| مكون | كمية |
| ده 2 O | 35.5 ميكرولتر |
| رد فعل العازلة 5X PCR | 10 ميكرولتر |
| مزيج dNTP (25 ملم) | 0.5 ميكرولتر |
| T7F (10 ميكرومتر) | 1.25 ميكرولتر |
| TracrR (10 ميكرومتر) | 1.25 ميكرولتر |
| T7-gRNA قالب IVT (250 نيوتن متر) | 1 ميكرولتر |
| البلمرة DNA | 0.5 ميكرولتر |
| إجمالي مزيج تفاعل PCR | 50 ميكرولتر |
الجدول 3
| شروط الدراجات PCR | |||
| عدد دورة | تفسد | حمى | تمديد |
| 1 | 94 درجة مئوية، 2 دقيقة | ||
| 31/02 | 94 درجة مئوية، 20 ثانية | 60 درجة مئوية، 20 ثانية | 72 درجة مئوية، 1 دقيقة |
| 32 | 72 درجة مئوية، 2 دقيقة | ||
الجدول 4
| مكون | المبلغ |
| T7 ATP | 2 ميكرولتر |
| T7 CTP | 2 ميكرولتر |
| T7 GTP | 2 ميكرولتر |
| T7 UTP | 2 ميكرولتر |
| عازلة T7 10X | 2 ميكرولتر |
| مزيج انزيم T7 | 2 ميكرولتر |
| PCR قالب تضخيمها | 8 ميكرولتر |
| الإجمالي في المختبر gRNA مزيج النسخ | 20 ميكرولتر |
| احتضان عند 37 درجة مئوية لمدة 6 ساعات ليلة وضحاها |
الجدول 5
| مكون | كمية (ميكرولتر) |
| غير المكرر، PCR المنتج | 8 |
| عازلة 2 10X | 2 |
| الماء المقطر (DH 2 O) | 10 |
الجدول 6
| تمسخ الحمض النووي والتهجين الظروف الدراجات | ||
| درجة الحرارة | المدة الزمنية | شروط Thermocycler |
| 95 ° C | 10 دقائق | |
| 85 ° C | 1 دقيقة | الطريق المنحدر إلى 85 درجة مئوية في 2 ° C / ثانية |
| 75 ° C | 1 دقيقة | الطريق المنحدر إلى 75 درجة مئوية عند 0.3 درجة مئوية / ثانية |
| 65 ° C | 1 دقيقة | الطريق المنحدر إلى 65 درجة مئوية عند 0.3 درجة مئوية / ثانية |
| 55 ° C | 1 دقيقة | الطريق المنحدر إلى 55 درجة مئوية عند 0.3 درجة مئوية / ثانية |
| 45 ° C | 1 دقيقة | الطريق المنحدر إلى 45 درجة مئوية عند 0.3 درجة مئوية / ثانية |
| 35 ° C | 1 دقيقة | الطريق المنحدر إلى 35 درجة مئوية عند 0.3 درجة مئوية / ثانية |
| 25 ° C | 1 دقيقة | الطريق المنحدر إلى 25 درجة مئوية عند 0.3 درجة مئوية / ثانية |
| 4 ° C | معلق | |
الجدول 7
| المسرح | يوم | وسائل الإعلام | ملحق | |
| S1 | D0 | S1 | GDF8 100 نانوغرام / مل | CHIR-99021 3 ميكرومتر |
| D1 | S1 | GDF8 100 نانوغرام / مل | CHIR-99021 0.3 ميكرومتر | |
| D2 | S1 | GDF8 100 نانوغرام / مل | ||
| S1 سائل الإعلام: MCDB 131 + 1X-الجلوتامين ملحق + 0.5٪ BSA + 1.5 جم / لتر NaHCO 3 + 10 ملي الجلوكوز | ||||
الجدول 8
د> S3| المسرح | يوم | وسائل الإعلام | ملحق | |||||||
| S2 | D3-D4 | S1 | LAA 0.25 ملي | FGF7 50 نانوغرام / مل | IWP-2 2.5 ميكرومتر | |||||
| D5-D6 | S3 | LAA 0.25 ملي | FGF7 50 نانوغرام / مل | SANT-1 0.25 ميكرومتر | RA 1 ميكرومتر | LDN 100 نانومتر | TPB 200 نانومتر | ITS-X 1: 200 | ||
| 4 س | D7-D9 | S3 | LAA 0.25 ملي | FGF7 2 نانوغرام / مل | SANT-1 0.25 ميكرومتر | RA 0.1 ميكرومتر | LDN 200 نانومتر | TPB 100 نانومتر | ITS-X 1: 200 | IWP-2 2.5 ميكرومتر |
| S3 وسائل الإعلام: MCDB 131 + 1X-الجلوتامين ملحق + 2٪ BSA + 2.5 جم / لتر NaHCO 3 + 10 ملي الجلوكوز | ||||||||||
الجدول 9
| المسرح | يوم | وسائل الإعلام | ملحق | |||||||
| S5 | D10-D12 | S5 | T3 1 ميكرومتر | ALK5i الثاني 10 ميكرومتر | SANT-1 0.25 ميكرومتر | RA 0.05 ميكرومتر | LDN 100 نانومتر | ITS-X 1: 200 | ZnSO4 10 ميكرومتر | الهيبارين 10 ميكروغرام / مل |
| S6 | D19 d13- | S5 | T3 1 ميكرومتر | ALK5i الثاني 10 ميكرومتر | GSiXX 100 نانومتر | LDN 100 نانومتر | ITS-X 1: 200 | ZnSO4 10 ميكرومتر | الهيبارين 10 ميكروغرام / مل | |
| S7 | D33 d20- | S5 | T3 1 ميكرومتر | ALK5i الثاني 10 ميكرومتر | N-السيستئين 1MM | Trolox 10 ميكرومتر | R428 2 ميكرومتر | ITS-X 1: 200 | ZnSO4 10 ميكرومتر | الهيبارين 10 ميكروغرام / مل |
| S5 سائل الإعلام: BLAR + 1X L-الجلوتامين ملحق + 2٪ BSA + 1.5 جم / لتر NaHCO 3 + 20 ملي الجلوكوز | ||||||||||
الجدول 10
Discussion
اعتبارات الوقت لتوليد خطوط المسخ
على الرغم من أن النهج الحديثة على أساس كريسبر / نظم كاس لتحرير الجينوم أدت إلى الاستهداف الناجح، فإن منصة أكثر كفاءة وعالمية يكون من الأفضل لنطاق أوسع تحليل وظيفة الجين. وتقدم منصة iCRISPR طريقة سريعة وفعالة لتقديم الطفرات إلى أي الجينات في المصالح 5، 9. أولا، طريقة تركيب gRNA PCR القائم يسمح للإنتاج مئات gRNAs في شكل المحتشدة في يوم واحد دون خطوات الاستنساخ تستغرق وقتا طويلا. ثانيا، مع الدوكسيسيكلين محرض Cas9 التعبير في iCas9 hPSCs، فإن الخطوة تنطوي على gRNA ترنسفكأيشن يتطلب سوى الحد الأدنى من العمل، وبالتالي، والتجارب التي تستهدف متعددة gRNA يمكن أن تتم بشكل متزامن. الثالثة، وذلك بسبب استهداف عالية الكفاءة للتحقيق مع نظامنا، وتحليل ~ 24-48 المستعمرات في gRNA transfected يجب أن يكون الإكتفاءicient لإنشاء monoallelic متعددة وخطوط متحولة biallelic لجين واحد، على الرغم من أن الكفاءة تختلف تبعا للمكان المستهدف. وبما أنه من الممكن للفرد مدربين لاختيار ميكانيكيا 384 المستعمرات (لوحات 4 × 96 أيضا) في جلسة واحدة، والتي ينبغي أن تأخذ ~ 4 ساعات تحت المجهر تشريح، من المتوقع أن تولد خطوط متحولة تؤثر على 12 الجينات داخل الفرد تدريب 12 شهر. الجيل مبسطة من المسوخ hPSC في وقت قصير يسمح للتحليل منهجي من مجموعة من عوامل النسخ و / أو مكونات مسار الإشارات التي تتفاعل مع بعضها البعض، وتنظيم العملية التنموية 9. بالإضافة إلى ذلك، كفاءة استهداف الجينات المضاعفة أيضا يفتح الباب للتحقيق في التفاعلات الوراثية الكامنة الصفات البشرية المعقدة.
جيل من التعديلات الوراثية دقيقة
اشتقاق iPSCs المريض محددة من الوصول إليها بسهولة نوع من الخلايا الجسدية الصورة والتمايز إلى أنواع الخلايا من الأمراض ذات الصلة توفر فرصة كبيرة لإثبات صحة وظيفية من الطفرات المرتبطة المرض. ومع ذلك، ويرجع ذلك إلى تفاوت كبير في الخلفية الوراثية بين الأفراد، مقارنات مباشرة بين iPSCs من المرضى ومن المتبرعين الأصحاء قد لا تسمح واحد للتمييز الظواهر المرض من تأثيرات الخلفية. وبالتالي، فمن الضروري لتوليد iPSCs السيطرة إسوي عن طريق تصحيح الطفرات المرض إلى تسلسل من النوع البري أو إدخال الطفرات المريض محددة في البرية من نوع الخلفية hPSC، كما اقترح آخرون 25 و 26. بالإضافة إلى (خالية) الطفرات الخسارة من وظيفة، يمكن للمرء الآن تشريح أكثر دقة آليات المرض من خلال إدخال المريض محددة تسلسل التعديلات في موضع الذاتية في hPSCs، بما في ذلك المريض hypermorphic، hypomorphic، neomorphic، أو المهيمنة سلبية الطفرات.
ntent "> التعديل الوراثي دقيقة توظف تقرير التنمية البشرية لإصلاح جهاز تسوية المنازعات في وجود قالب إصلاح. وبما أنه أقل كفاءة بكثير من إصلاح الحمض النووي بوساطة NHEJ، البلازميد المانحة التي تحتوي على طفرة المريض محددة، شريط كاسيت اختيار المخدرات، والأسلحة تناظر تم استخدامها سابقا كقالب إصلاح 2 بعد اختيار الدواء والتحقق من الطفرة المريض محددة، هناك حاجة إلى الخطوة الثانية عموما لإزالة كاسيت اختيار الدواء. في حين أن أنظمة لجنة المساواة العرقية، loxP وFLP-FRT الأكثر استخداما على نطاق واسع تترك وراءها تسلسل المتبقية في موضع الذاتية، وقد سمح باستخدام piggyBac ينقول لإزالة السلس للاختيار المخدرات كاسيت (27). وفي الآونة الأخيرة، وقد ثبت أيضا قوالب ssDNA قصيرة لدعم HDR كفاءة مع نوكلياز داخلي الحمض النووي المهندسة 28. وبالمقارنة مع البلازميد المانحة ، ssDNA يمكن توليفها بشكل مباشر، وبالتالي تلتف على خطوة استنساخ تستغرق وقتا طويلا. هنا، فقد يكونأون يظهر أنه بحلول gRNA وقالب ssDNA للحث على إصلاح الموجه تناظر transfecting المشارك، iCRISPR يمكن أن تستخدم لإدخال تعديلات النوكليوتيدات محددة بكفاءة عالية. هذا أمر بالغ الأهمية ليس فقط لتشريح دور النيوكليوتيدات الأساسية في مجالات وظيفية البروتين، ولكن أيضا لنمذجة الطفرات الأمراض البشرية، وربما تصحيح هذه الطفرات الأمراض المرتبطة للتدخل العلاجي. وقد يرجع ذلك إلى عدد كبير من مواضع قابلية أن ترتبط كل منها عدة متغيرات تسلسل، والنمذجة الأمراض المعقدة وmultigenic مثل مرض السكري يشكل تحديا للعلماء الوراثة. كمنصة iCRISPR هي متساهلة للجيل السريع لسلسلة أليلية أو لاستهداف الجين multiplexable، فإنه يمكن تسهيل التحقيق في مواضع الأمراض المرتبطة متعددة، سواء بصورة فردية أو بالاشتراك مع الخلفيات إسوي.استهداف الكفاءات وتأثيرات خارج الهدف
لدينا العثور على علاقة جيدة بين T7E1 ونتائج الفحص RFLP وعدد من خطوط متحولة التي حددها التسلسل. وهذا يؤكد على أهمية تنفيذ هذه المقايسات بالتوازي مع إنشاء خطوط نسيلي. في حين أن الكفاءة التي تستهدف تحقيقها قد تختلف اعتمادا على مواضع الجيني، في معظم التجارب استهداف الجينات واحدة، 20 - عثر على 60٪ من الحيوانات المستنسخة مع كل من الأليلات تحور (بما في ذلك في إطار وطفرات انزياح الإطار) 9. في الحالات التي تم إجراء استهداف الجينات المضاعفة، تم الحصول على ثلاثية استنساخ متحولة biallelic مع 5-10٪ الكفاءات 5. أجريت بوساطة ssDNA تقرير التنمية البشرية للعديد من الجينات أيضا للحصول تغيرات جينية دقيقة، مع الكفاءة للحصول على متماثل تدق في استنساخ تتراوح 1-10٪ 5. العمل مع كريسبر / كاس في hPSCs، أي طفرات في المحتملة المواقع بعيدا عن الهدف التي لا تشترك في نفس تسلسل الهدف gRNA لم يتم بعد الكشف عنمعشوقة = "XREF"> 5، 9، 12. وقد فشل كامل الجينوم التسلسل تؤدى في دراسة حديثة أيضا لتحديد الطفرات الكبيرة بعيدا عن الهدف في خطوط hPSC نسيلي تم إنشاؤها باستخدام كريسبر / كاس 29. ومع ذلك، لتقليل أي تأثير محتمل للالتباس الظواهر التي أدخلها الطفرات في المواقع تأثير بعيدا عن الهدف، ويقترح لتوليد خطوط متحولة مستقلة باستخدام اثنين على الأقل gRNAs مستقلة تستهدف سلاسل مختلفة داخل نفس الجين. الظواهر المماثلة الملحوظة في عدة أسطر الموضوعة باستخدام gRNAs مختلفة يمكن أن يحكم أساسا من احتمال أن يكون النمط الظاهري يأتي من تأثير بعيدا عن الهدف.
مقابل الثقافة المستقلة واستهداف تعتمد التغذية،
الأساليب التقليدية للثقافة hPSC تنطوي على صيانتها والتوسع في الخلايا المغذية في وسائل الإعلام التي تحتوي على مصل أو استبدال المصل الذي يتضمن همز الحيوانتصدير منتجاتها، مثل ألبومين المصل البقري. الخلايا المغذية، مصل، واستبدال الدم، والألبومين كل تحتوي على مكونات غير محددة معقدة وتظهر التباين دفعة كبيرة. التكيف مع حالة خالية من تغذية ومحددة كيميائيا يخفف كثيرا من الجهود من أجل صيانة hPSC، والأهم من ذلك، يزيد من تماسك التجارب التمايز. في الوقت الحاضر، هناك عدد قليل جدا من الدراسات التي تصف إجراءات تحرير الجينوم على hPSCs مثقف في ظروف ثقافة محددة تماما 30. لقد وجدنا أعلى كريسبر استهداف الكفاءات عندما أجريت gRNA ترنسفكأيشن وترسب نسيلي في ظروف خالية المغذية مقارنة مع الظروف والثقافة التي تعتمد على التغذية. ونحن نعتقد أن هذا يرجع إلى زيادة بقاء الخلية بعد ترنسفكأيشن والبذر وحيدة الخلية لتشكيل مستعمرة. وعلاوة على ذلك، وقد ثبت أن الخلايا المغذية سابقا لعزل الكواشف ترنسفكأيشن، وبالتالي خفض كفاءة ترنسفكأيشن.
الجمعتحرير الجينوم مع إخراج التمايز
وقد أثمرت البروتوكولات التمايز السابقة سوى جزء صغير من الخلايا الأنسولين الإيجابي، كانت الغالبية منها polyhormonal وتشبه خلايا الغدد الصماء الجنين 23. وقد سمح التقدم الزوار تمايز hPSCs في مثل بيتا الخلايا الجلوكوز استجابة أكثر نضجا 16، 17، 19، 20. يمكننا الحصول على روتيني لا يقل عن 75٪ خلايا الأديم نهائية، و 40٪ PDX1 + NKX6.1 + الأسلاف البنكرياس، وحوالي 20٪ NKX6.1 + CPEP + خلايا تشبه بيتا الجلوكوز استجابة باستخدام HUES8 hPSCs 9. عندما جنبا إلى جنب مع نظام تحرير الجينوم iCRISPR، وقد سهل هذا البروتوكول التمايز أكثر قوة تحليل عوامل النسخ التي تعتبر حاسمة بالنسبة إلى السلف والغدد الصماء مراحل البنكرياس التمايز البنكرياس. وهذا سيجعلمن الممكن، في الدراسات المستقبلية، لدراسة عدد كبير من الجينات المرض مرشح للتحقق من صحة وظيفية والتحقيق في الآليات التي تكمن وراء مرض السكري 9.
التطبيقات المستقبلية أو الاتجاهات
نظامنا iCRISPR قد تسهل جيل من التعديلات الجينوم أكثر تعقيدا، مثل إنشاء أليل مراسل من خلال استهداف الجينات باستخدام المانحة طويلة قوالب الحمض النووي ترميز علامات البروتين أو صحفيين الفلورسنت 12 HDR-توسط. لقد أظهرنا أنه نظرا إلى كريسبر عالية تستهدف الكفاءات التي تحققت في النظام، وهذه العملية لا يمكن أن يؤديها في hPSCs، دون الحاجة لاختيار المزيد من المخدرات (12). وعلاوة على ذلك، الجينات المضاعفة التي تستهدف يمكن استخدامها لتحقيق التفاعلات الوراثية الكامنة وراء المرض البشري المعقد، كما هو مبين في دراستنا الأخيرة، والتي نعتقد أنها أول مثال على هذا العمل 31. مجلس النوابويمكن أيضا ISPR استخدامها لفهم الرقابة التنظيمية الجين من خلال خلق الحذف إما في الرنا غير المرمزة noncoding الموجودة أو في الجينات المناطق التنظيمية، مثل المروجين ومحسنات. لتوليد بكفاءة المسوخ التنظيمية باستخدام iCRISPR، gRNAs يمكن أن تكون مصممة لتعطيل موقع ملزم للبروتين ملزمة الحمض النووي، بما في ذلك ولكن لا تقتصر على الآلات النسخي القاعدية أو عامل النسخ الأنسجة محددة. ويمكن أيضا ssDNA HDR-بوساطة قالب استخدامها ليتحور مواقع محددة ملزمة البروتين. وأخيرا، فإننا نتوقع أن مزيد من التحسين سيمكن استخدام منصة iCRISPR في hPSCs للتحاليل وراثية ارتفاع الناتج من الظواهر تعدد القدرات أو الظواهر المرض عندما يقترن في المختبر بروتوكول التمايز. هذه الدراسات بوساطة iCRISPR قد تسمح لتحديد أسرع من الجينات والدراسات ذات الصلة الوظيفية الأمراض المرتبطة مرشح.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وقد تم تمويل هذا العمل في جزء من المعاهد الوطنية للصحة / NIDDK (R01DK096239) وولاية نيويورك للعلوم الخلايا الجذعية (NYSTEM C029156). وأيد ZZ من قبل زمالة ما بعد الدكتوراه NYSTEM من مركز علم الأحياء الخلايا الجذعية من معهد سلون كيترينج.
Materials
| Name | Company | Catalog Number | Comments |
| Chemically defined medium (E8) | Thermo Fisher Scientific | A1517001 | Essential 8 basal medium and Essential 8 supplement included |
| Truncated recombinant human form of vitronectin | Thermo Fisher Scientific | A14700 | |
| ROCK inhibitor Y-27632 | Selleck Chemicals | S1049 | |
| Dissociation reagent (TrypLE Select enzyme) | Thermo Fisher Scientific | 12563029 | 1x, animal origin free, recombinant enzyme |
| G418 Sulfate | Thermo Fisher Scientific | 10131035 | Geneticin Selective Antibiotic |
| Puromycin dihydrochloride | Sigma-Aldrich | P8833 | Puromycin Selective Antibiotic |
| DNA Polymerase (Herculase II Fusion) | Agilent Technologies | 600679 | PCR kit |
| MEGAshortscript T7 Transcription kit | Thermo Fisher Scientific | AM1354 | |
| MEGAclear Transcription Clean-Up Kit | Thermo Fisher Scientific | AM1908 | |
| Doxycycline hyclate | Sigma-Aldrich | D9891 | |
| Opti-MEM medium | Thermo Fisher Scientific | 31985062 | Reduced Serum Medium |
| Lipofectamine RNAiMAX Transfection Reagent | Thermo Fisher Scientific | 13778150 | |
| DNeasy Blood & Tissue Kit | QIAGEN | 69504 | Genomic DNA extraction kit |
| Proteinase K | Roche | 3115879001 | |
| MCDB 131 medium | Thermo Fisher Scientific | 10372-019 | |
| BLAR medium | Thermo Fisher Scientific | Custom-made with a published formulation (Rezania et al., 2014) | |
| L-glutamine supplement (GlutaMAX) | Thermo Fisher Scientific | 35050061 | |
| NaHCO3 | Thermo Fisher Scientific | 144-55-8 | |
| Glucose | Sigma-Aldrich | G8769 | |
| BSA | LAMPIRE Biological Laboratories | 7500855 | Fatty acid free |
| GDF8 | PeproTech | 120-00 | |
| CHIR-99021 | Stemgent | 04-0004 | GSK-3 inhibitor |
| L-Ascorbic acid | Sigma-Aldrich | A4544 | Vitamin C |
| FGF7 | R&D Systems | 251-KG | |
| SANT1 | Tocris Bioscience | 1974 | Hedgehog inhibitor |
| RA | Sigma-Aldrich | R2625 | Retinoic acid |
| LDN | Stemgent | 04-0019 | BMP inhibitor |
| IWP-2 | Tocris Bioscience | 3533 | Wnt antagonist |
| ITS-X | Thermo Fisher Scientific | 51500-056 | |
| TPB | EMD Millipore | 565740-1MG | PKC activator |
| 3,3’,5-Triiodo-L-thyronine (T3) | Sigma-Aldrich | T6397 | |
| ALK5i II | Enzo Life Sciences | ALX-270-445 | ALK5 inhibitor II |
| ZnSO4 | Sigma-Aldrich | Z0251 | |
| Heparin | Sigma-Aldrich | H3149 | |
| GSiXX | EMD Millipore | 565789 | Gamma secretase inhibitor XX, NOTCH signaling inhibitor |
| N-Cys (N-acetyl cysteine) | Sigma-Aldrich | A9165 | |
| Trolox | EMD Millipore | 648471 | Vitamin E analogue |
| R428 | Selleck Chemicals | S2841 | AXL receptor tyrosine kinase inhibitor |
| 24 mm Transwell with insert | Corning Life Sciences | 3414 | |
| Gene Pulser Xcell Electroporation System | Bio-Rad | 1652660 | |
| 0.4 cm Electroporation Cuvettes | Bio-Rad | 1652081 | |
| AAVS1-TALEN-L | Addgene | 59025 | |
| AAVS1-TALEN-R | Addgene | 59026 | |
| AAVS1-Neo-M2rtTA | Addgene | 60843 | |
| AAVS1-Puro-iCas9 | Addgene | 58409 | |
| T7 Endonuclease I | NEB | M0302L | |
| Buffer 2 | NEB | B7002S | NEBuffer 2 |
| Long oligonucleotide | Eton Bioscience or IDT | ||
| SOX17 antibody | R&D Systems | AF1924 | 1:500 |
| FOXA2 antibody | Millipore | 07-633 | 1:100 |
| CXCR4-APC antibody | R&D Systems | FAB170A | 1:25 |
| PDX1 antibody | R&D Systems | AF2419 | 1:500 |
| NKX6.1 antibody | DSHB | F55A12 | 1:500 |
| NKX2.2 antibody | DSHB | 74.5A5 | 1:100 |
| NEUROD1 antibody | Santa Cruz Biotechnology | sc-1084 | 1:100 |
| Insulin antibody | Dako | A0564 | 1:2,000 |
| C-peptide antibody | DSHB | GN-ID4-c | 1:2,000 |
| Glucagon antibody | Sigma-Aldrich | G2654 | 1:1,000 |
References
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6 (6), 507-512 (2005).
- Zwaka, T. P., Thomson, J. A. Homologous recombination in human embryonic stem cells. Nat Biotechnol. 21 (3), 319-321 (2003).
- Eiges, R., et al. Establishment of human embryonic stem cell-transfected clones carrying a marker for undifferentiated cells. Curr Biol. 11 (7), 514-518 (2001).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- González, F., et al. An iCRISPR Platform for Rapid, Multiplexable, and Inducible Genome Editing in Human Pluripotent Stem Cells. Cell Stem Cell. 15 (2), 215-226 (2014).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Braam, S. R., et al. Improved genetic manipulation of human embryonic stem cells. Nat Methods. 5 (5), 389-392 (2008).
- Zhu, Z., et al. Genome Editing of Lineage Determinants in Human Pluripotent Stem Cells Reveals Mechanisms of Pancreatic Development and Diabetes. Cell Stem Cell. 18 (6), 755-768 (2016).
- Kotini, A. G., et al. Functional analysis of a chromosomal deletion associated with myelodysplastic syndromes using isogenic human induced pluripotent stem cells. Nat Biotechnol. 33 (6), 646-655 (2015).
- Carlson-Stevermer, J., et al. High-Content Analysis of CRISPR-Cas9 Gene-Edited Human Embryonic Stem Cells. Stem Cell Reports. 6 (1), 109-120 (2016).
- Zhu, Z., Verma, N., Gonzalez, F., Shi, Z. D., Huangfu, D. A CRISPR/Cas-Mediated Selection-free Knockin Strategy in Human Embryonic Stem Cells. Stem Cell Reports. 4 (6), 1103-1111 (2015).
- Mandegar, M. A., et al. CRISPR Interference Efficiently Induces Specific and Reversible Gene Silencing in Human iPSCs. Cell Stem Cell. 18 (4), 541-553 (2016).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nat Methods. 8 (5), 424-429 (2011).
- Rezania, A., et al. Production of functional glucagon-secreting alpha-cells from human embryonic stem cells. Diabetes. 60 (1), 239-247 (2011).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat Biotechnol. 32 (11), 1121-1133 (2014).
- Chen, S., et al. A small molecule that directs differentiation of human ESCs into the pancreatic lineage. Nat Chem Biol. 5 (4), 258-265 (2009).
- Nostro, M. C., et al. Efficient generation of NKX6-1+ pancreatic progenitors from multiple human pluripotent stem cell lines. Stem Cell Reports. 4 (4), 591-604 (2015).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO J. 34 (13), 1759-1772 (2015).
- Zhu, Z., Gonzalez, F., Huangfu, D. The iCRISPR platform for rapid genome editing in human pluripotent stem cells. Methods Enzymol. 546, 215-250 (2014).
- Soh, C. L., Huangfu, D. CRISPR/Cas9-Mediated Mutagenesis of Human Pluripotent Stem Cells in Defined Xeno-Free E8 Medium. Methods in Molecular Biology. 1498, (2017).
- D'Amour, K. A., et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nat Biotechnol. 24 (11), 1392-1401 (2006).
- Kelly, O. G., et al. Cell-surface markers for the isolation of pancreatic cell types derived from human embryonic stem cells. Nat Biotechnol. 29 (8), 750-756 (2011).
- Musunuru, K. Genome editing of human pluripotent stem cells to generate human cellular disease models. Dis Model Mech. 6 (4), 896-904 (2013).
- Hockemeyer, D., Jaenisch, R. Induced Pluripotent Stem Cells Meet Genome Editing. Cell Stem Cell. 18 (5), 573-586 (2016).
- Yusa, K., et al. Targeted gene correction of alpha1-antitrypsin deficiency in induced pluripotent stem cells. Nature. 478 (7369), 391-394 (2011).
- Chen, F., et al. High-frequency genome editing using ssDNA oligonucleotides with zinc-finger nucleases. Nat Methods. 8 (9), 753-755 (2011).
- Veres, A., et al. Low incidence of off-target mutations in individual CRISPR-Cas9 and TALEN targeted human stem cell clones detected by whole-genome sequencing. Cell Stem Cell. 15 (1), 27-30 (2014).
- Huang, X., et al. Production of Gene-Corrected Adult Beta Globin Protein in Human Erythrocytes Differentiated from Patient iPSCs After Genome Editing of the Sickle Point Mutation. Stem Cells. 33 (5), 1470-1479 (2015).
- Shi, Z. D., et al. Genome Editing in hPSCs Reveals GATA6 Haploinsufficiency and a Genetic Interaction with GATA4 in Human Pancreatic Development. Cell Stem Cell. , (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved