Method Article
Геном Редактирование и Направленная дифференцировка hPSCs для Допрос Lineage Факторы, определяющие в развитии человеческого потенциала Панкреатического
* Эти авторы внесли равный вклад
В этой статье
Резюме
Протоколы для генерации HPSC мутантные линии, используя платформу iCRISPR и дифференцировать hPSCs в глюкозу реагирующих бета-клеток, как описано. Объединение генома технологии редактирования с HPSC-направленной дифференцировки обеспечивает мощную платформу для систематического анализа роли линиджа детерминант в развитии человека и прогрессирования заболевания.
Аннотация
Допрос функции гена в самообновляющихся или дифференциации человеческих плюрипотентных стволовых клеток (hPSCs) предлагает ценную платформу к пониманию развития людских ресурсов и рассечения механизмов болезни в блюдо. Для того, чтобы извлечь выгоду из этого потенциального применения требует эффективных инструментов генома редактирования для создания HPSC мутантов в связанных с заболеванием генов, а также в пробирке протоколы дифференцировки HPSC вызывать заболевание релевантных типов клеток , которые тесно резюмировать их аналоги в естественных условиях. Эффективная платформа генома для редактирования hPSCs имени iCRISPR был разработан через Talen-опосредованной нацеливания экспрессионной кассеты cas9 в локус AAVS1. Здесь, протоколы для генерации индуцируемых линий cas9 HPSC с использованием клеток, культивированных в химически определенной среде и загрузочным устройством, свободных от состояния описаны. Подробные процедуры с использованием системы iCRISPR для гена нокаута или точных генетических изменений в hPSCs, либо через пна гомологичные конец присоединения (NHEJ) или с помощью точных нуклеотидных изменений с использованием шаблона гомологии направленного ремонта (HDR), соответственно, включены. Эти процедуры включают в себя технические описания конструкции, продукции и трансфекцию CRISPR направляющих РНК (gRNAs); измерение частоты мутаций CRISPR по T7E1 или ПДРФ анализов; а также создание и проверка клоновых мутантных линий. Наконец, мы летописные процедуры HPSC дифференциации в глюкозу реагирующих панкреатических бета-подобных клеток, имитируя в естественных условиях эмбрионального развития поджелудочной железы. Сочетание технологии iCRISPR с направленной HPSC дифференциации позволяет систематическое исследование функции гена, чтобы углубить наше понимание механизмов развития панкреатических и заболевания диабетом.
Введение
Человеческие плюрипотентные стволовые клетки (hPSCs) обладают способностью и самообновлению и дают начало всем производные трех эмбриональных зародышевых линий. Они обеспечивают ценный ресурс для заместительной клеточной терапии и моделирования заболевания, выступая в качестве уникальной платформы резюмировать клеточные процессы в человеческом контексте развития. Они также являются источником экспериментальных клеток для масштабируемых анализа с высокой пропускной способностью. Тем не менее, прогресс был ограничен из-за двух основных проблем: отсутствие эффективных инструментов генетической модификации и трудности в обобщал сложных эмбриональные стадии развития в культуре блюдо.
Генетическая модификация является незаменимым инструментом для изучения функции генов в нормальном развитии и болезни. Тем не менее, в то время как классический ген ориентации подходов путем гомологичной рекомбинации оказались мощным инструментом для рассекают функции генов в эмбриональных стволовых клетках мышей (mESCs) 1, этот подходбыл крайне неэффективным при применении к hPSCs 2, 3. Недавно бодрый присоединение программируемых, сайт-специфических нуклеаз от природы до лабораторного использования, в том числе цинка палец нуклеаз (ZFNs), активатора транскрипции, как эффекторных нуклеаз (Таленс) и кластерные регулярно interspaced коротких палиндромных повторов (CRISPR) / CRISPR-ассоциированных (КАС) системы 4, означает , что генной инженерии стала гораздо более легкой задачей , в широком диапазоне организмов и клеточных линий, в том числе в hPSCs. Эти редактирования гена инструменты использовать в своих интересах тот факт, что химерные нуклеазы, такие как эндонуклеазы cas9 может разрешить целый ряд генетических модификаций путем индукции двунитевых разрывов (DSBs) на точных местах, вызывая эндогенной репарации ДНК машины, чтобы активировать либо негомологичный конец присоединения (NHEJ) или гомологии направленного ремонта (HDR). Оба механизма могут быть использованы для генетических манипуляций путем индукции eithэр случайная вставка и удаление мутации (вставки подсчитывали ; через NHEJ), для создания сдвига рамки мутации , которые сводят на нет аллелей гена, или точные нуклеотидные замены (через HDR), резюмировать мутации пациента , для моделирования заболеваний человека или исправить болезнетворный мутации для генной терапии ,
CRISPR / Cas-опосредованной генной инженерии необходимы два компонента: постоянная РНК наведением cas9 эндонуклеазы, необходимую для расщепления ДНК и РНК переменной CRISPR (crRNA) и транс-активационного (tracrRNA) дуплекса, который определяет признание целевой ДНК. CrRNA / tracrRNA дуплекс может быть заменен одной химерного направляющей РНК (gRNA), которые были найдены более эффективно 5, 6, 7 работать. В то время как система CRISPR / cas9 была адаптирована к большинству экспериментальных организмов и клеточных линий, доставки и экспрессии cas9 и gRNA значительно варьируется и должна быть дополнительно оптимизирована для ACHIНакануне редактирования эффективный геном во многих системах, в том числе hPSCs 8. Эффективный геном-редактирования платформы, iCRISPR, была создана в hPSCs 5. В этой системе Talen-опосредованной подход был использован целевой как аллели "трансген безопасной гавани локуса" AAVS1 в транс, один аллель с обратным тетрациклиновой управлением трансактиватора (M2rtTA) , а другой с элементом ответа тетрациклин (TRE ) вождения выражение cas9 (iCas9) в hPSCs. В установленных клоновых линиях (iCas9 hPSCs), cas9 высоко экспрессируется с лечением доксициклина. В то же время, из-за своего небольшого размера (100 нт), одиночные или множественные gRNAs могут быть легко доставлены в iCas9 hPSCs с высокой эффективностью и может направить cas9 для расщепления по конкретным участкам, обеспечивая эффективную NHEJ-опосредованного нарушения гена, а также HDR-опосредованной точные нуклеотидные модификации в присутствии коротких одноцепочечной ДНК (оцДНК) шаблонов доноров. Система iCRISPR может бытьиспользуется , чтобы успешно генерировать панель заболевания имитирующие линий HPSC с биаллельных (гомозиготным или гетерозиготным соединение) или гетерозиготных с потерей функции мутаций в важных генов развития 5, 9. В то время как число групп сообщали эффективного редактирования гена с использованием CRISPR / Условный hPSCs, успех остается ограниченным небольшим числом технологически развитыми лабораторий. Платформа iCRISPR предлагает эффективное еще простое решение для обычного редактирования генов исследователями различных уровней квалификации, и он уже использовался в ряде опубликованных исследований нашей группой и другими 9, 10, 11, 12. Этот подход также был продлен до индуцируемого глушителей на основе экспрессии dCas9-KRAB 13.
Наряду с прогрессом в геном редактирования технотысяч-, значительные улучшения были также достигнуты в обеспечении HPSC и направленной дифференцировки. Условия культивирования для hPSCs эволюционировали от облученного мышиных эмбриональных фибробластов (КПКО) фидерной зависит фидерными свободных условий на определенных компонентов внеклеточного матрикса, а также от сложных композиций средств для химически определенных условиях среды 14. Такие улучшения уменьшили изменчивость hPSCs вследствие партии к партии различий в КПКО подготовка и Нокаут сывороточных компонентов замены, и, таким образом, обеспечивают более воспроизводимую среду для HPSC дифференциации. В то же время, расширение знаний о путях передачи сигналов , регулирующих эмбриональное развитие человека, а также открытия с высокой пропускной способностью скринингов лекарственных средств, привели к улучшению дифференцировки протоколов 15, 16, 17, 18. Эти протоколы более тесно имитировать в Львовео стадии развития и генерируют типы клеток , которые тесно резюмировать их аналоги в естественных условиях. Для HPSC дифференцировки в поджелудочной линии, первоначальные протоколы передразнил раннего развития поджелудочной железы относительно хорошо, но в конце концов, генерируемый polyhormonal бета-клеток, которые были незрелых плода фенотипов и откликнулся плохо к глюкозе стимуляции. Последние достижения 16, 17, 19, 20 позволили для выработки глюкозы реагировать панкреатических бета-подобных клеток, что позволит нам исследовать более поздние события, такие как формирование и дальнейшее созревание monohormonal бета - клеток.
Здесь мы подробно применение генома-модифицированных линий для изучения развития поджелудочной железы путем комбинирования системы iCRISPR с HPSC на основе экстракорпорального дифференциации платформы по отношению к глюкозе реагирующих pancreatic бета-подобные клетки. Такое соединение мощных инструментов для редактирования генома с улучшенным протоколом HPSC дифференцировки предлагает не только скорость и масштаб , необходимый для удовлетворения растущего спроса на проверки причинно - следственной связи заболевания, но также позволяет сложные генетические манипуляции для дальнейших механистической расследования транскрипционный контроль , лежащие в основе нормального развития и болезни 9 ,
протокол
Этот протокол основан на работе с HPSC линиями H1, HUES8 и MEL-1 в химически определенной и фидерных свободном состоянии (Пожалуйста , смотрите материалы и оборудование таблицу). Для других линий HPSC или hPSCs эксплуатируемых в различных условиях культивирования, рекомендуется дальнейшая оптимизация.
1. HPSC культура в Химически Defined и фидерных свободном состоянии
- Адаптировать культуру HPSC на КПКО кормушки к кормушке-свободном состоянии. В тех случаях, когда замороженные клетки не выживают хорошо, когда непосредственно извлеченного в фидер-свободном состоянии, восстановление клеток в КПКО состоянии, а затем адаптироваться к фидер-свободном состоянии.
Примечание: В общем, это занимает 2 места для hPSCs культивируют на КПКО фидеров быть адаптированы к фидерной-свободном состоянии. - Изменение носителя каждый день и проход в hPSCs, когда клетки достигли ~ 80% слитности. В общем, прохождение hPSCs на ~ 1: 6 - 1:15 соотношения каждые 4 - 6 дней. Добавьте 10 мкМ ингибитора ROCK Y-27632 WHEN разморозки или пересева клеток.
- До посеве hPSCs, предварительное покрытие чашки для культивирования с 5 мкг / мл (1 мл / 10 см 2) усеченного рекомбинантного человеческого формы витронектина (ВТН) в течение не менее 1 ч при комнатной температуре (RT). Кроме того, подготовить полный химически определенной среде путем добавления добавки в основной среде.
- Удалить культуральной среды, промыть клетки один раз с PBS без Са 2+ и Mg 2+, и обработать клетки с помощью 0,5 мМ ЭДТА в течение ~ 2 - 5 мин при комнатной температуре.
- Аспирируйте ЭДТА до того, как колонии отдельно. С осторожно пипеткой, дисперсных колонии HPSC на мелкие кусочки и клетки вновь суспендируют в полной среде.
- Собирают Диссоцииро- hPSCs и спином вниз клетки при 200 мкг в течение 5 мин. Ресуспендируют осаждали hPSCs в полной среде и семян клеток на пластинах ВТН покрытием.
2. Генерация iCas9 HPSC линий
- Заказать и усилить следующие плазмиды: AAVS1-Talen-L, AAVS1-TАЛЕН-R, AAVS1-Neo-M2rtTA и AAVS1-Puro-iCas9.
Примечание: Для того, чтобы избежать неожиданных событий рекомбинации, используют рекомбинантные-дефицитных Stbl3 компетентных клеток для преобразования и усиления плазмид при 30 ° С. - Как правило, готовят hPSCs в одном 10-см чашку (~ 1 × 10 7 клеток при ~ 80% сливающийся) для одного эксперимента таргетирования.
Примечание: Так как электропорация обычно приводит к значительной гибели клеток и Таленом-опосредованного генного таргетинга в локусе AAVS1 требует выбора антибиотик, относительно большое количество ячеек должны быть посеяны , чтобы правильно идентифицировать целевые клетки. Оптимизация для концентрации лекарственного средства рекомендуется для каждой клеточной линии и каждого условия культивирования. - В день -1, (за день до электропорации), добавляют ингибитор ROCK 10 мкМ в течение смены носителя.
- В день 0 (в день электропорации), готовят пластины ВТН-покрытием заранее.
- Диссоциировать hPSCs на отдельные клетки USIнг 1x реагент диссоциации (см Материал и оборудование Стол). Если коротко, то удалить культуральной среды, промыть клетки один раз с PBS без Са 2+ и Mg 2+, и обработать клетки с 1х реагентом диссоциации при 37 ° С в течение ~ 3 мин. Аспирируйте реагента диссоциации до того, как клетки отсоединяются. С осторожно пипеткой, рассеивать hPSCs в одноклеточной суспензии в 10,5 мл полной среды.
- Взять по 0,5 мл клеточной суспензии для подсчета количества клеток с использованием автоматического счетчика клеток. Гранул hPSCs при 200g в течение 5 мин и клетки вновь суспендируют в холодном (4 ° С) PBS при 12,5 х 10 6 клеток / мл.
- Добавьте плазмид (таблица 1) в 800-мкл HPSC суспензии (12,5 × 10 6 клеток / мл) и хорошо перемешать. Перенести смесь до 0,4 см кювету для электропорации и держать на льду в течение ~ 5 мин.
- Электропорации клетки с помощью системы электропорации при 250 В и 500 мкФ; временная константа наблerved после электропорации, как правило, 9 - 13 мс.
- После электропорации, передача клетки в коническую пробирку объемом 15 мл с 5 мл подогретого полной среде. Критический для успешного нацеливания: Используйте здоровый пролиферирующих hPSCs и обрабатывать клетки очень осторожно при передаче, ресуспендирования и металлизированный клетки после электропорации.
- Гранул клетки при 200 мкг в течение 5 мин. Ресуспендируют клеток в 10 мл полной среды с ингибитором 10 мкМ ROCK и пластины 1, 2.5 и 5 × 10 6 клеток на каждую из трех ВТН покрытием, 10-см чашки; это гарантирует, что по крайней мере одна из пластин будет иметь достаточное количество колоний на одноклеточной клональной плотности для захвата колоний.
- На 1 -й день (на следующий день после электропорации), изменить среду.
- В дни 2 - 5, начните неомицина выбор , когда клетки ~ 60% сплошности. Изменение среды ежедневно с 500 мкг / мл G418 сульфата; значительная гибель клеток вследствие selectioп обычно наблюдается через 2 дня после отбора G418.
- На 6 -й день, изменить среду без выбора антибиотика.
- В дни 7-9, начните выбор пуромицин. Изменение носителя ежедневно с 1 мкг / мл пуромицин-дигидрохлорид; значительная гибель клеток должна наблюдаться на следующий день.
- На 10 -й день, начинают менять среду ежедневно без выбора антибиотика , пока колонии одноклеточные HPSC не достигнет 1 - 2 мм в диаметре.
Примечание: Как правило, 50 колоний в 10 см чашку наблюдаются с 2,5 х 10 6 hPSCs высевают на день 0. - Встреча 12 - 24 колоний под стереомикроскопа. Механически дезагрегации колонии HPSC на мелкие кусочки (~ 10 штук в колонии) с использованием 23-G иглу (пипеткой наконечник 200-мкл также отлично) и передавать клеток непосредственно в ВТН, покрытых 24-луночных планшетах.
- Изменение среды ежедневно до тех пор, пока клетки не станут вырожденная. Прохождение клеток в каждую лунку 24-луночных планшетах вдублируют лунки 6-луночных планшетах.
- Когда клетки становятся сливающийся в 6-луночные планшеты, используют одну скважину для замороженной, а другой хорошо для экстракции геномной ДНК для дальнейшей характеристики.
- Охарактеризуйте и проверки установленных iCas9 линий с помощью ПЦР-генотипирования, Саузерну, анализ RT-КПЦР, кариотипирование и плюрипотентности анализа. Обратитесь к Чжу и др. 21 для детальных экспериментальных процедур.
3. Генерация HPSC мутантных линий Использование iCRISPR системы
- Генерация HPSC нокаутных линий
- разработка и производство gRNA
- Выберите целевые регионы в представляющего интерес гена, чтобы максимально увеличить возможность нарушения функции белка дикого типа. Для хорошо аннотированных генов, выбрать целевой регион вверх по течению существенной функциональной области. В качестве альтернативы, дизайн gRNAs целевой регион ниже по потоку от стартового кодона. Выберите по крайней мере, 2 различныхрегионов для представляющего интерес гена.
- Дизайн gRNAs с помощью инструмента проектирования онлайн CRISPR (http://crispr.mit.edu). Для каждой целевой области, дизайн 3 gRNAs с низким потенциалом офф-мишеней и использовать один с самой высокой эффективностью ориентации для генерации клонами мутантной линии 22.
Примечание: Для достижения эффективности редактирования высокого генома, рекомендуется поставить gRNA в РНК олигонуклеотиды, а не в качестве плазмидной ДНК из-за более высокой эффективности трансфекции малых РНК по сравнению с плазмидами, в прошлом опыте. - Заказ 120 нуклеотид (нуклеотиды) олигонуклеотиды ДНК , содержащие последовательности промотора Т7, переменная последовательность узнавания 20-нт crRNA (N) , 20 (не включают в себя последовательность РАМ), а постоянная последовательность химерной руководство. Развести олиго до 100 мкМ исходного раствора в DDH 2 O и подготовить 250 нм в качестве рабочего раствора.
Примечание: TAATACGACTCACTATAGGG (N) 20 GTTTTAGAGCTAGAAATAGCAAGTTAAAATAAGGCTAGTCCGTTATCAACTTGAAAAAGTGGCACCGAGTCGGTGCTTTT - ПЦР-амплификации с использованием олигонуклеотидов T7F и TracrR праймеров (смотри таблицу 2) для получения ДНК (дцДНК) Шаблон двухцепочечной для gRNA экстракорпорального транскрипции (IVT). Используйте 50 мкл реакционной смеси ПЦР (таблица 3) и условия ПЦР цикл (таблица 4).
- Используйте высокопродуктивный T7 транскрипции набор для экстракорпорального gRNA транскрипции с ПЦР-амплификации матрицы в 20 мкл, в пробирке gRNA транскрипции смесь (таблица 5) в соответствии с инструкциями изготовителя. Очищают продукты gRNA с помощью транскрипции набора очистке в соответствии с инструкциями изготовителя.
- Элюировать gRNAs следуя протоколу очистки высокой пропускной способностью в соответствии с инструкциями изготовителя (обычно ~ 50 - 100 мкг) в 100 мкл буфера для элюции. Отрегулируйте концентрацию до 320 нг / мкл (10 мкМ), когда это возможно, и хранить при температуре -80 &# 176; С до использования.
- ПЦР и Sanger секвенирования дизайн праймера
- Проектирование и проверка праймеров для ПЦР амплификации область-мишень, с размерами продукции, как правило, в пределах от ~ 500 - 1000 пар оснований.
- Конструкция Sanger секвенирования праймеров связывающие внутренне ПЦР продуктов, чтобы обеспечить прямое секвенирование продуктов ПЦР без дополнительной очистки.
- gRNA трансфекцию в iCas9 hPSCs
- В день -1, лечения клеток iCas9 с 2 мкг / мл доксициклина за 24 ч до gRNA трансфекции.
- На день 0 gRNA трансфекции, подготовить пластины ВТН-покрытием заранее.
- Диссоциируют клетки iCas9 в отдельные клетки с использованием реагента 1x диссоциации, как описано в пункте 2.5.
- Гранул hPSCs при 200g в течение 5 мин и ресуспендирования клеток в ~ 0,5 × 10 6 клеток / мл в полной среде , дополненной 2 мкг / мл доксициклина и ингибитора ROCK 10 мкМ.
- Тарелка 0,5 мл ресуспензированной клеток в отдельные лунки 24-луночных планшетов. Подготовьте дополнительные скважины, чтобы служить в качестве не-трансфицированные управления.
- Для каждого gRNA введите следующие трансфекции смеси: Смешайте 50 мкл уменьшенном сыворотки среды + 1 мкл gRNA (10 мкМ); Смешать В, 50 мкл восстановленного сыворотки среды + 3 мкл реагента для трансфекции.
- Комбинат Mix А и В, чтобы сделать 100 мкл смеси. Выдержите в течение 5 мин при комнатной температуре. Добавить 50 мкл смеси для клеток в дублированных лунки 24-луночных планшетов и хорошо перемешать.
- На 1 -й день, выполнить вторую трансфекцию , если это необходимо для дальнейшего повышения эффективности таргетинга. В противном случае, изменить среду без доксициклина.
- В дни 2 - 3, изменить среду ежедневно.
- На 4 -й день, экстракт геномной ДНК из одной из лунок каждого трансфицированных и не трансформированных клеток управления с использованием набора для экстракции ДНК. Отрегулируйте концентрацию до 50 нг / μЛ.
- ПЦР-амплификации целевых регионов , фланкирующие нацеливающие последовательности gRNA и оценить эффективность редактирования с использованием Т7 эндонуклеазы I (T7EI) переваривание или полиморфизма длин рестрикционных фрагментов (ПДРФ) анализа, как было описано выше 5.
- T7EI анализ
- ПЦР-амплификации района-мишени с использованием праймеров, разработанных и проверенных на этапе 3.1.
- Готовят смеси (таблица 6) и выполнить денатурации ДНК и гибридизации ПЦР - продуктов с использованием условий , описанных в таблице 7.
Примечание: Основываясь на нашем опыте, то, как правило, нет необходимости для очистки продуктов ПЦР для анализа T7EI при использовании нашего состояния ПЦР. Тем не менее, очистка может быть полезным в других условиях. - Выполните переваривание T7EI при 37 ° С в течение 30 мин с использованием 10 мкл денатурированной и гибридизовали ПЦР-продукта и 0,2 мкл (2 и) T7E1 (10 ед / мкл).
- РезолвЕ T7E1-переваренной образцов для ПЦР с помощью гель-электрофореза. Используйте ImageJ для определения относительных интенсивностей полос обрезная и необрезная ДНК. Вычислить частоту INDEL по следующей формуле: (1 - (√ (1- (B + C)) / (A + B + C))) х 100, где а интенсивность непереваренной продукта ПЦР и б и интенсивностей T7E1-расщепленных продуктов.
- ПДРФ анализ
Примечание: В тех случаях, когда сайт рестрикции находится в непосредственной близости (<5 пар оснований) на сайт расщепления cas9 (3 п.о. 5 'последовательности РАМ), анализ методом ПДРФ может быть выполнена для количественного определения частоты INDEL.- Используйте те же продукты ПЦР, как описано в шаге 3.1.4.1.
- Дайджест ПЦР-продукта ферментом рестрикции, который содержит сайт рестрикции в непосредственной близости от сайта расщепления cas9.
- Устранить переваренных образцы для ПЦР с помощью гель-электрофореза. Используйте ImageJ для определения относительных интенсивностей полос обрезная и необрезная ДНК. Вычислить INDELЧастота по следующей формуле: а / (а + Ь + с) х 100, где а интенсивность непереваренной продукта ПЦР и б и интенсивности переваренных продуктов.
- Создание клоновых мутантных линий
Примечание: редактирование Геном в hPSCs с использованием системы iCRISPR с gRNA трансфекцией высокоэффективен, и нет выбора антибиотика не требуется. Чтобы установить клональных линий, необходимо при посевной клеточный материал относительно низкой плотности, чтобы обеспечить образование одноклеточного полученных из колоний.- Определение gRNAs с самой высокой эффективностью редактирования (с помощью T7EI или ПДРФ анализ) и с хорошей выживаемости клеток. Используйте соответствующий дубликат хорошо для клонального установления мутантной линии.
- Диссоциировать hPSCs в суспензию одной клетки с использованием реагента 1x диссоциации, как описано в пункте 2.5. Replate 500, 1000, и 2000 клеток на каждую из трех ВТН покрытием, 10-см чашки.
- Изменение средней дневной Until в одноклеточных колонии достигают ~ 2 мм в диаметре.
- Pick 24 - 48 колоний для каждого gRNA, в зависимости от оценки эффективности ориентации на T7EI и / или ПДРФ-анализа. Механически дезагрегации каждой колонии на небольшие кусочки (~ 10 штук в колонии) с помощью иглы 23-G (пипеткой наконечник 200-мкл также отлично) и replate клетки в дублированных ВТН покрытием, 96-луночные планшеты. Используйте одну пластину для извлечения геномной ДНК и Sanger секвенирования и другой пластины для дальнейшего расширения.
- Когда клетки в 96-луночные планшеты стали конфлюентными, извлекать геномную ДНК (без экстракции фенол / хлороформ) с использованием простого протокола, как описано ниже.
- Удалите среду и промыть клетки один раз PBS без Са 2+ и Mg 2+. Добавьте 50 мкл буфера для лизиса (5 мкл протеиназы К (10 мг / мл), 5 мкл ПЦР буфера 10х и 40 мкл DDH 2 O) в каждую лунку 96-луночного планшета. Уплотнение пластины, используя клейкую пленку и Инкубаторыт.е в течение ночи при 55 ° C.
- На следующий день, передача клеточных лизатов в 96-луночный ПЦР планшета и инкубируют в течение 10 мин при температуре 99 ° С в амплификатор, чтобы инактивировать протеиназы К.
- ПЦР-амплификации района-мишени с использованием тех же праймеров, что и для T7EI или ПДРФ анализа, с использованием 1 мкл лизата клеток в качестве матрицы.
- С помощью 1 мкл ПЦР-продукта для Sanger секвенирования с праймером связывания внутри для ПЦР-продукта.
- Amplify клонов с INDEL мутаций со сдвигом рамки для замороженных запасов. Кроме того, усилить пару клонов дикого типа из того же эксперимента прицеливания, чтобы служить в качестве изогенных линий управления для дальнейших экспериментов.
- разработка и производство gRNA
- Генерация мутантных линий с точными нуклеотидных изменений
Примечание: По сравнению с нокаутных мутантов порожденных негомологичной конце присоединения (NHEJ), точная нуклеотид изменение может быть достигнуто за счет гомологии направленного ремонта (HDR) в присутствии ДНК строг шаблоны. Такие точные нуклеотидные изменения позволяют для генерации мутаций конкретного пациента в hPSCs дикого типа и для коррекции мутаций в ИПСК пациентов происхождения.- Дизайн оцДНК в качестве шаблона HDR
- Конструкция и производят 2 - 3 gRNAs в непосредственной близости от мутации конкретного пациента, как описано в пункте 3.1.1.
- Дизайн одноцепочечной ДНК (оцДНК), содержащий мутацию конкретного пациента, фланкированный ~ 40 - 80 нт гомологии с каждой стороны в качестве шаблона HDR.
- Чтобы уменьшить дополнительное резку после правильного ремонта, ввести молчащую мутацию в шаблон оцДНК в области в пределах последовательности распознавания gRNA и в непосредственной близости от последовательности РАМ, или в последовательности PAM сам по себе, если это возможно.
- Если это возможно, проектировать беззвучный мутацию вводить новый сайт расщепления рестриктазами, а также таким образом, что он может быть использован для оценки эффективности ремонта с использованием анализа ПДРФ.
- GRNA / оцДНК Котрансфекция и создание клоновых линий
- Выполните котрансфекции gRNA / оцДНК в клетках iCas9, как описано на стадии 3.1.3, с трансфекцией смеси А и В. Для каждого gRNA и не трансфицированные контроля, трансфекции клеток в дублированных лунках 24-луночных планшетов. Смешайте: 50 мкл восстановленного сыворотки среда + 1 мкл gRNA (10 мкМ) + 2 мкл оцДНК (10 мкМ). Смешайте B: 50 мкл восстановленного сыворотки среды + 3 мкл реагента для трансфекции.
- После трансфекции извлечения геномной ДНК из одной из лунок каждого трансфицированных и не трансформированных клеток управления и оценки эффективности ремонта с помощью T7EI и / или ПДРФ анализа.
- Определить смесь gRNA / оцДНК с самой высокой эффективностью ремонта и хорошей выживаемости клеток. Используйте соответствующий дубликат хорошо для клонального установления мутантной линии.
- Pick 48 - 96 колоний, в зависимости от оценки эффективности таргетинга по T7EI и / или ПДРФ попкуау. В общем, эффективность HDR-опосредованной мутации ниже, чем Нокаут мутации и, таким образом, большего числа колоний, должны быть подобраны.
- Последовательность, расширение и проверки клоновых линий, как описано в шаге 3.1.6.
- Дизайн оцДНК в качестве шаблона HDR
4. Экстракорпоральное HPSC дифференцировке в глюкозо-отзывчивым панкреатических -клеток
Примечание: В пробирке дифференциации HPSC мутантов в болезни соответствующих типов клеток обеспечивает платформу для моделирования заболевания в чашке. Следующий протокол фокусируется на дифференциации в пробирке hPSCs в глюкозу реагирующих панкреатических -клеток поджелудочной развития и диабетических исследований 9, 16, 17.
- HPSC дифференциация на окончательное энтодермы
- Поддерживать HPSC мутантов и контрольных линий дикого типа в химически определенной и фидерных свободном состоянии, как описаноd на шаге 1.
- Для приготовления hPSCs для дифференциации, диссоциируют hPSCs с использованием реагента 1x диссоциации и разогнать их в суспензии одноклеточных в полной среде.
- Гранул клетки при 200 мкг в течение 5 мин и вновь приостановить клеток в полной среде с ингибитором ROCK 10 мкМ. Подсчитайте количество клеток и семян клеток при ~ 1,4 × 10 5 клеток / см 2 на пластинах ВТН покрытием.
- Изменение среды через 24 ч после посева.
- В день 0 начинают дифференцировку через 48 ч, когда клетки достигли ~ 80% сплошности.
ПРИМЕЧАНИЕ: Для достижения высокой эффективности панкреатический дифференциации, оптимизации плотности посева и уровень сплошности в 48 часов рекомендуется для каждой отдельной линии. - Аспирируйте среду HPSC и промойте клетки один раз PBS без Са 2+ и Mg 2+.
- Изменение среды дифференциации день 0 (D0) среды.
- В дни 1 - 2, изменить диfferentiation среда ежедневно, по рецептам в таблице 8.
- На 3 -й день, рассмотреть окончательные маркеры энтодермы SOX17, Foxa2 и CXCR4 от иммунофлуоресцентного окрашивания и проточной цитометрии анализа.
- Definitive эндодермы дифференциации в поджелудочной прародителя
- В дни 3 - 9, по- прежнему окончательное энтодермы дифференциации по отношению к панкреатической линии путем замены среды ежедневно, по рецептам в таблице 9.
- На 7 -й день, изучить раннюю панкреатический прародитель (PP1) маркера Pdx1 путем иммунофлуоресцентного окрашивания и проточной цитометрии анализа.
- На 10 -й день, рассмотрим позже (панкреатический предшественников PP2) маркеры Pdx1 и Nkx6.1. В то же время, готовятся к передаче клетки PP2 в воздушно-жидкостной интерфейс для дальнейшей дифференциации в панкреатических эндокринных клеток.
- Панкреатических эндокринных отличаютсяentiation в воздушно-жидкостной интерфейс
- Лечить клетки PP2 с ингибитором ROCK 10 мкМ 4 ч до диссоциации.
- Удалите среду и промыть клетки один раз PBS без Са 2+ и Mg 2+.
- Добавьте 2 мл 1х реагента диссоциации клеток PP2 в одном 10-см чашку и инкубировать при 37 ° С в течение 2 - 3 мин.
- Аспирируйте реагента диссоциации до того, как клетки отсоединяются. Добавить 10 мл blár среды и дисперсных клетки ПП2 в отдельные клетки, осторожно пипеткой вверх и вниз.
- Сбор суспензии одноклеточных. Подсчитайте число клеток и осадок при 200 мкг в течение 5 мин.
- Ресуспендируют осадок клеток в ~ 0,5 × 10 5 клеток / мкл в S5 дифференциации среды и пятно 5 - 10 мкл клеток на месте на Transwell вставки фильтра. Поместите 10 - 15 мест в одной вставке 6-а и ~ 100 мест в 10-см вставкой.
- Добавить S5 среды в нижней части каждой Transwell вставки, ~ 1,5 мл в течение 6-луночных пластин и ~ 8 мл фили 10-см вставками.
- Изменение среды ежедневно с рецептами в таблице 10.
- Изучить панкреатических эндокринных маркеры Pdx1, Nkx6.1 NEUROD1, Nkx2.2, инсулином и глюкагон на день 34 с помощью иммунофлуоресцентного окрашивания и проточной цитометрии анализа 17.
- Изучить HPSC производный бета-подобные функции клеток с помощью анализа глюкозой секреции инсулина стимулируется (СБИС) 16, 17.
Результаты
HPSC Химически Определено и фидеров свободной культуры Адаптация и техническое обслуживание
hPSCs, культивируемые на КПКО фидеров могут быть быстро адаптированы к пластинам ВТН покрытием в податчик свободных условиях культивирования. То же самое отношение расщепления как нормальный КПКО фидера культуры могут быть использованы в процессе адаптации. На рисунке 1A показаны типичные морфологией hPSCs на КПКО фидеров в KSR среде на основе и на поверхности ВТН покрытием в фидерной свободной среде. Фигура 1В показывает типичную морфологическое изменение и рост HPSC колоний во время первого прохождения адаптации (4 дня). Клетки могут быть дополнительно пассировать или заморожен для будущих экспериментов. Проводят 2 - 3 пассажей адаптации культуры перед началом экспериментов дифференцировки. Кариотипирование также рекомендуется после адаптации, хотя мы не наблюдали аномалии кариотипа во время фазы адаптации.
"ВОК: Keep-together.within-страницу =" 1 "> Генерация iCas9 HPSC линий через Talen опосредованной AAVS1 таргетингаКак было показано ранее, hPSCs подвергали электропорации с парой AAVS1 Таленом плазмид и cas9 и M2rtTA плазмид 5. Рисунок 2А и В показывает детальный вектор доноров таргетирования дизайн и всю процедуру для создания iCas9 HPSC клоновых линий. После выбора антибиотика, одноклеточные клоны , отображающие адекватный размер и типичная морфология HPSC были готовы быть собраны (10 - 12 дней после электропорации, Рис 2С). Обычно ~ 50% клонов правильно ориентированы без случайных интегрирований, проверяемого Саузерн - блоттинга (рис 2D) 5. Случайная интеграция может привести к вытекающей выражение cas9 при отсутствии лечения доксициклином.
Эффективное Генетическая Modification в hPSCs Используя платформу iCRISPR
В установленном iCas9 hPSCs, cas9 выражается с лечением доксициклина и направляется к своей целевой локуса трансфицированных gRNAs, где он генерирует DSBs. При отсутствии шаблона ремонта, восстановление ДНК через NHEJ генерирует вставкам, которые часто приводят к нарушению гена или нокаута. При наличии шаблона ремонта (например, донор одноцепочечной), HDR могут быть использованы для получения точных генетических изменений, таких как генерирование мутации конкретного пациента в HPSC фоне дикого типа или коррекции связанных с заболеванием генетический вариант в пациенто полученные иПСК (рис. 3А) Она занимает ~ 1 месяц для создания клоновых линий мутантных с использованием системы iCRISPR. После того, как iCas9 индукции и gRNA трансфекцией, T7EI и / или ПДРФ анализы были использованы для оценки эффективности резания cas9, и трансфицированные клетки высевают позже в виде отдельных клеток в 10-см чашки при низкой плотности (~ 500 - 2 000клеток / 10 см чашку). 10 - 12 дней спустя, одноклеточные клоны были помещены в лунки 96-луночного планшета для расширения и дальнейшей характеристики (то есть, генотипирования и вестерн - блоттинга) (рис 3б). Так как iCRISPR опосредованную нокаут гена является высокоэффективным, ни один процесс выбора не участвует, и , как правило , 20 - 50% биаллельных мутанты могут быть легко достигнуты (3С) 5. Для получения эффективных и точных генетических изменений, gRNAs котрансфицируют с донором оцДНК, несущей определенную последовательность изменений (для небольшого, но конкретного изменения последовательности генома). Часто, чтобы предотвратить повторное резание в модифицированных аллели, рекомендуется включить тихую мутацию в непосредственной близости или в последовательности PAM (Рисунок 3D). С помощью этой системы, ~ 10% клонов , несущих нужный HDR-опосредованной модификации генома без дополнительных изменений в обоих аллелей достигаются (Рисунки 3Е). Быстрое и рrecise модификация HPSC генома с использованием платформы iCRISPR позволяет нам быстро и эффективно сделать линии HPSC, которые служат в качестве моделей для изучения человеческого развития и болезней.
Эффективное Дифференциация hPSCs к глюкозо-отзывчивым бета-подобные клетки
Недавний прогресс в HPSC поджелудочной железы дифференциации позволило разработать протоколы, которые тесно перепросматривать панкреатический эмбрионального развития. Неопределенная hPSCs первый дифференцировались в окончательном энтодермы, а затем в Pdx1 + ранние панкреатических клеток - предшественников (PP1) и Pdx1 + Nkx6.1 + поздних панкреатических клеток - предшественников (PP2), и , наконец , в глюкозо-отзывчивым β-клетки , как 16, 17, 19, 20 , 23, 24. Эти protocолы были дополнительно оптимизированы , чтобы надежно генерировать Pdx1 + Nkx6.1 + панкреатических клеток - предшественников и глюкозо-отзывчивым бета-клеток , как 9. На фиг.4А показаны подробные химические добавки , используемые на каждой стадии дифференцировки. Как правило, ~ 80% конфлюэнтности через 2 дня после первоначального посева клеток , идеально подходит для запуска дифференциации HUES8 hPSCs (фиг.4В). Тестирование нескольких различных плотностей посевные настоятельно рекомендуется открыть оптимизированную условие для каждой конкретной клеточной линии. Как правило , по меньшей мере , 75% Foxa2 + SOX17 + клеток на стадии и 40% Pdx1 DE + Nkx6.1 + клетки на стадии PP2 может быть достигнута (рис 4C). На этапе S5, наличие ауры-образную форму вокруг совокупности клеток является показателем хорошей выживаемости клеток, что важно для дальнейшей дифференциации к Nkx6.1 + CPEP + глюкозы реагировать бета-подобные клетки (рис 4D ). Этот протокол полезен для изучения поджелудочной железы человека д АЗВИТИЕ и болезнь в блюдо.

Рисунок 1. HPSC Химически Defined и фидерных бесплатное техническое обслуживание и культура Адаптация от КПКО кормушки. (A) Типичные изображения hPSCs культивировали на КПКО фидера или ВТН на 4 -й день, готов разделить. (B) Типичная морфология hPSCs во время первого прохождения адаптации в фидерной свободной культуры от КПКО фидера. День 4 hPSCs, культивируемые на КПКО кормушки были разделены и высевают на пластинах ВТН покрытием в химически определенной среде с ингибитором ROCK. Отношение расщепление было таким же, как обычно соотношение расщепления для культивирования в условиях КПКО подачи. Среду меняли каждый день без ингибитора ROCK. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
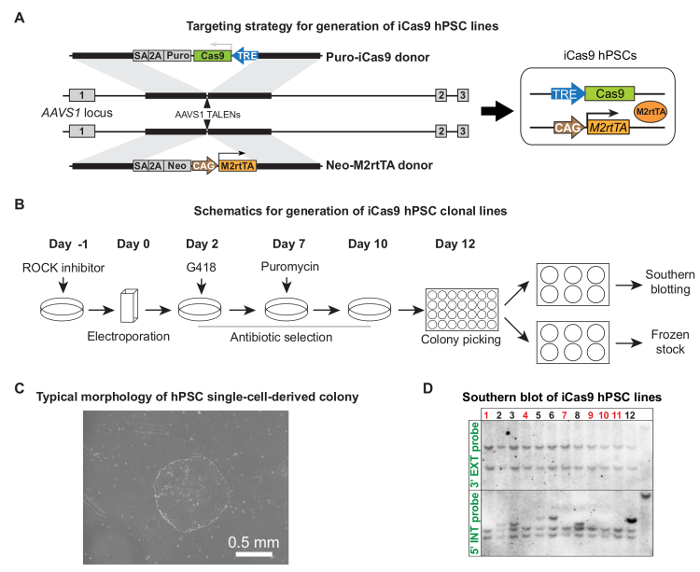
Рисунок 2. Генерация iCas9 HPSC линий. (A) Ориентация стратегии для генерации iCas9 HPSC линий. Пуро-cas9 доноров и нео-M2rtTA доноров были направлены в человеческий AAVS1 локуса парой AAVS1 Таленс. (Б) Схематическое всего процесса установления целевых ориентиров, включая электропорации, отбор антибиотика, сбор колоний и расширения, а также клеточной линии характеристики. (C) представитель клон одноклеточного готов быть выбраны в пределах 10 - 12 дней после электропорации. (D) Southern примеры блоттинга для идентификации клонов правильно целевых без дополнительной интеграции двух плазмид доноров. Правильные клоны отмечены красным цветом. (А) и (D) были адаптированы из ссылки 5, с разрешения автора .ig2large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
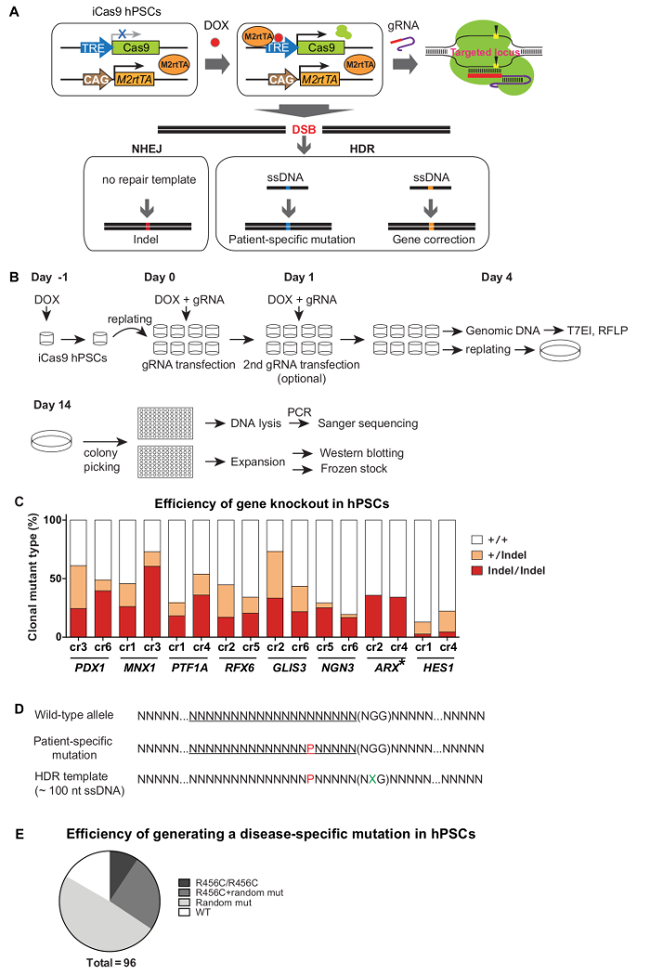
Рисунок 3. Эффективное генетической модификации в hPSCs Используя iCRISPR системы. (A) Schematics для генерации генных мутантов или нокаутных точной генной модификации с использованием системы iCRISPR. (B) Процедура прицеливания и создание клоновая линии. (C) Gene эффективность Нокаут через NHEJ в hPSCs 9. (D) Конструкция из одноцепочечной ДНК , несущей определенную нуклеотидную модификацию. P, в красном: пациент-специфической мутации; X, в зеленый цвет: тихая мутация. (Е) Эффективность HDR-опосредованной точной нуклеотидной модификации. Точная мутация R456C (вызвана специфической нуклеотидной C> T мутации) в GATA6 локус был введен с использованием системы iCRISPR.(См ссылку 5 для получения более подробной информации). (С) и (Е) были адаптированы из работе9 и порядковый номер 5, соответственно, с разрешениями. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
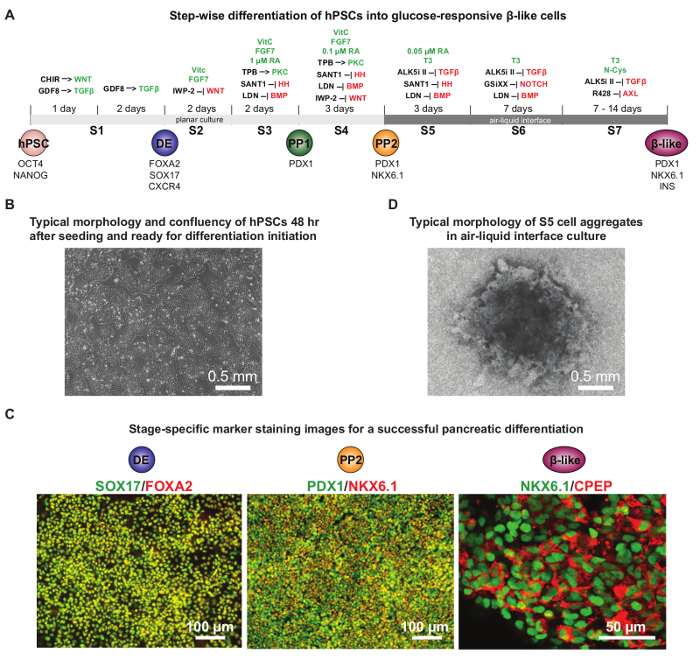
Рисунок 4. Направленный HPSC Дифференцировка в глюкозо-отзывчивым панкреатических бета-подобных клеток. (А) Схематическое подробного протокола дифференциации, с химическими веществами , дополненной на каждой стадии дифференцировки. Сигнальных путей, которые активируются или подавляются во время дифференцировки выделены зеленым или красным цветом, соответственно. Чир ингибитор GSK3; фактор роста дифференциации 8 или миостатин, член семейства белков TGF-бета;: GDF8 HH: Hedgehog; DE: Definitive энтодермы; PP1:Pdx1 + ранний панкреатический прародитель; PP2: Pdx1 + Nkx6.1 + позже панкреатический прародителем. (B) Типичный конфлуэнтности (70 - 80%) hPSCs 48 ч после посева , когда готовы к инициации дифференцировки. (C) Представитель иммунофлуоресцентного окрашивания изображения , показывающие успешную дифференциацию на окончательное энтодермы (DE) стадии (Foxa2 и SOX17 совместное окрашивание), панкреатический этап прародитель (PP2: Pdx1 и Nkx6.1 совместное окрашивание) и глюкозо-отзывчивым β- как клеточной стадии (Nkx6.1 и С-пептида совместного окрашивания). В целом, для достижения более чем на 10% Nkx6.1 + CPEP + клеток на стадии клеточного бета-как, по меньшей мере, 75% Foxa2 + SOX17 клетки + DE и 40% Pdx1 + клетки Nkx6.1 + PP2 необходимы на соответствующих этапах. (D) Типичная морфология клеток агрегата на этапе S5 на вставке через мембранный фильтр в интерфейсе культуры воздух-жидкость. Выжившие клетки мигрировали к центру агрегата (в темный) и оставил ауру-подобную структуру на краю. (A ) и (D) были адаптированы из Reference 9 с разрешениями. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| плазмида | Количество |
| AAVS1-Talen-L | 5 мкг |
| AAVS1-Talen-R | 5 мкг |
| AAVS1-Puro-iCas9 | 40 мкг |
| AAVS1-Neo-M2rtTA | 40 мкг |
Таблица 1
| грунтовка | Последовательность |
| T7F | TAATACGACTCACTATAGGG |
| TracrR | AAAAGCACCGACTCGGTGCC |
Таблица 2
| Компонент | Количество |
| DDH 2 O | 35,5 мкл |
| реакционного буфера 5х ПЦР | 10 мкл |
| дНТФ смесь (25 мМ) | 0,5 мкл |
| T7F (10 мкМ) | 1,25 мкл |
| TracrR (10 мкМ) | 1,25 мкл |
| T7-gRNA шаблон IVT (250 нМ) | 1 мкл |
| ДНК-полимеразы | 0,5 мкл |
| Общая реакция смеси ПЦР | 50 мкл |
Таблица 3
| Условия велосипедных ПЦР | |||
| номер цикла | денатурировать | отжигать | простираться |
| 1 | 94 ° С, 2 мин | ||
| 2-31 | 94 ºC, 20 сек | 60 ºC, 20 сек | 72 ° С, 1 мин |
| 32 | 72 ° С, 2 мин | ||
Таблица 4
| Компонент | Сумма |
| T7 АТФ | 2 мкл |
| T7 CTP | 2 мкл |
| T7 GTP | 2 мкл |
| T7 UTP | 2 мкл |
| буфер T7 10x | 2 мкл |
| Смесь ферментов T7 | 2 мкл |
| ПЦР-амплификации шаблон | 8 мкл |
| Всего в пробирке gRNA транскрипции смесь | 20 мкл |
| Инкубировать при 37 ° С в течение 6 часов на ночь |
Таблица 5
| Компонент | Сумма (мкл) |
| Неочищенную ПЦР продукта | 8 |
| Буфер 2 10x | 2 |
| Дистиллированная вода (дН 2 O) | 10 |
Таблица 6
| ДНК денатурации и гибридизации условия велоспорта | ||
| температура | продолжительность | условия Термоциклеры |
| 95 ° C | 10 минут | |
| 85 ° C | 1 мин | Рампа до 85 ° С при 2 ° С / сек |
| 75 ° C | 1 мин | Рампа до 75 ° С при 0,3 ° С / с |
| 65 ° C | 1 мин | Рампа до 65 ° С при 0,3 ° С / с |
| 55 ° C | 1 мин | Рампа до 55 ° С при 0,3 ° С / сек |
| 45 ° C | 1 мин | Рампа до 45 ° С при 0,3 ° С / сек |
| 35 ° C | 1 мин | Рампа до 35 ° С при 0,3 ° С / с |
| 25 ° C | 1 мин | Рампа до 25 ° С при 0,3 ° С / с |
| 4 ° C | Держать | |
Таблица 7
| стадия | День | СМИ | дополнение | |
| S1 | d0 | S1 | GDF8 100 нг / мл | Чир-99021 3 мкМ |
| d1 | S1 | GDF8 100 нг / мл | Чир-99021 0,3 мкМ | |
| d2 | S1 | GDF8 100 нг / мл | ||
| S1 СМИ: MCDB 131 + 1x L-глютамин добавка + 0,5% БСА + 1,5 г / л NaHCO 3 + 10 мМ глюкозы | ||||
Таблица 8
| стадия | День | СМИ | дополнение | |||||||
| S2 | Д3-Д4 | S1 | LAA 0,25 мМ | FGF7 50 нг / мл | ИВП-2 2,5 мкМ | |||||
| S3 | d5-d6 | S3 | LAA 0,25 мМ | FGF7 50 нг / мл | САНТ-1 0,25 мкМ | Р.А. 1 мкМ | LDN 100 нмоль | СПТ 200 нМ | ИТС-X 1: 200 | |
| S4 | d7-D9 | S3 | LAA 0,25 мМ | FGF7 2 нг / мл | САНТ-1 0,25 мкМ | Р.А. 0,1 мкМ | LDN 200 нМ | СПТ 100 нмоль | ИТС-X 1: 200 | ИВП-2 2,5 мкМ |
| S3 СМИ: MCDB 131 + 1x L-глютамин добавка + 2% БСА + 2,5 г / л NaHCO 3 + 10 мМ глюкозы | ||||||||||
Таблица 9
| стадия | День | СМИ | дополнение | |||||||
| S5 | d10-d12 | S5 | T3 1 мкМ | ALK5i II 10 мкМ | Сант-1 0,25 мкМ | RA 0,05 мкМ | LDN 100 нМ | ИТС-X 1: 200 | ZnSO4 10 мкМ | Гепарин 10 мкг / мл |
| S6 | d13- d19 | S5 | T3 1 мкМ | ALK5i II 10 мкМ | GSiXX 100 нМ | LDN 100 нМ | ИТС-X 1: 200 | ZnSO4 10 мкМ | Гепарин 10 мкг / мл | |
| S7 | d20- d33 | S5 | T3 1 мкМ | ALK5i II 10 мкМ | N-Cys 1mM | Тролокс 10 мкМ | R428 2 мкМ | ИТС-X 1: 200 | ZnSO4 10 мкМ | Гепарин 10 мкг / мл |
| S5 Носитель: blár + 1x L-глютамин добавка + 2% БСА + 1,5 г / л NaHCO 3 + 20 мМ глюкозы | ||||||||||
Таблица 10
Обсуждение
Время Соображения для генерации мутантных линий
Хотя в последнее время подходы, основанные на CRISPR / Cas систем для редактирования генома привели к успешному прицеливания, более эффективной и универсальной платформой была бы предпочтительнее для более масштабных анализов функции генов. Платформа iCRISPR предлагает быстрый и эффективный способ введения мутаций в любой интерес гена 5, 9. Во-первых, ПЦР на основе метода синтеза gRNA позволяет производить сотни gRNAs в формате выстроил в один день без затрат времени стадий клонирования. Во-вторых, с доксициклин-индуцируемой экспрессии cas9 в iCas9 hPSCs стадию с участием gRNA трансфекцию требует лишь минимальное количество работы, и, таким образом, многократный gRNA таргетингом эксперименты могут проводиться одновременно. В-третьих, в связи с высокой адресности эффективности, достигаемые с помощью нашей системы, анализ ~ 24 - 48 колоний на gRNA трансфицированных должно быть Suffциент устанавливать несколько моноаллельную и биаллельной мутантных линий для одного гена, хотя эффективность варьируются в зависимости от локуса-мишени. Так как это возможно для подготовленных индивидуальных механически отбора 384 колоний (4 х 96-луночные планшеты) на одном заседании, который должен занять ~ 4 часа под микроскопом рассекает, обученный человек может быть как ожидается, генерировать мутантные линии, влияющие на 12 генов в 12 месяцев. Обтекаемый поколение HPSC мутантов в течение короткого времени позволяет проводить систематический анализ массива факторов транскрипции и / или компонентов сигнального пути , которые взаимодействуют друг с другом, регулируя процесс развития 9. Кроме того, эффективный мультиплексированный ген нацеливание также открывает дверь к исследованию генетических взаимодействий лежащих в основе сложных человеческих черт.
Генерация точных генетических изменений
Вывод конкретного пациента ИПСК из легко доступных соматического типа клеток s и дифференциация в болезни соответствующих типов клеток обеспечивают большую возможность для функциональной проверки связанных с заболеванием мутаций. Тем не менее, из-за значительной изменчивости генетического фона между отдельными лицами, прямое сравнение ИПСК от пациентов и здоровых доноров может не позволяют отличить фенотипов болезнь от фоновых эффектов. Поэтому необходимо сформировать изогенных ИПСК управления путем коррекции мутации болезни назад к последовательности дикого типа или ввести мутации конкретного пациента в HPSC фоне дикого типа, как это было предложено другими 25, 26. В дополнение к пропадание функции (NULL) мутаций, можно теперь более точно проанализируем механизмы болезней с помощью введения изменений последовательности конкретного пациента в эндогенного локуса в hPSCs, включая гиперморфный, гипоморфными, neomorphic или доминантно-негативного пациента мутации.
ntent "> Точная генетическая модификация использует HDR для ремонта DSB в присутствии шаблона ремонта. Так как он намного менее эффективен, чем NHEJ-опосредованного репарации ДНК, донор плазмиду, содержащую пациента-специфической мутации, кассета выбора лекарственного средства, а также плечами гомологии ранее использовалась в качестве шаблона ремонта 2. После выбора лекарственного средства и проверки мутации конкретного пациента, второй этап , как правило , требуется для извлечения кассеты выбора лекарственного средства. в то время как наиболее широко используемые системы Cre-LoxP и FLP-FRT оставить позади остаточное последовательность в эндогенном локусе, использование PiggyBac транспозону позволило бесшовной удаления кассеты выбор препарата 27. в последнее время , короткие шаблоны оцДНК также было показано , чтобы поддерживать эффективное HDR с конструированными эндонуклеаз 28 ДНК. по сравнению с плазмидой - донора , оцДНК может быть непосредственно синтезирован и, таким образом, обходит трудоемким этапом клонирования. При этом он имеет бытьен показали, что, по со-трансфекцию gRNA и шаблон оцДНК для индукции гомологии направленного ремонта, iCRISPR могут быть использованы для введения конкретных нуклеотидные модификации с высокой эффективностью. Это очень важно для не только рассекает роль основных нуклеотидов внутри белковых функциональных доменов, но и для моделирования мутации человеческих болезней и потенциально исправления этих ассоциированной с заболеванием мутации для терапевтического вмешательства. Из-за большого количества восприимчивости локусов, каждый из которых связан с несколькими вариантами последовательности, моделирования сложных и мультигенной заболеваний, таких как сахарный диабет является проблемой для генетиков. В качестве платформы iCRISPR носит разрешительный характер для быстрой генерации серии аллельного или multiplexable гена прицеливания, он может облегчить исследование множественной ассоциированной с заболеванием локусов, либо по отдельности, либо в сочетании с изогенных фоном.Ориентация на повышение эффективности и Off-целевые эффекты
У нас есть обнаружили хорошую корреляцию между T7E1 и результатов анализа ПДРФ и числа мутантных линий, определенных с помощью секвенирования. Это подчеркивает важность выполнения этих анализов параллельно с созданием клоновых линий. В то время как нацеливающие эффективность достигаемые может варьироваться в зависимости от геномных локусов, в большинстве одного гена-нацеливание экспериментов, 20 - 60% клонов были обнаружены оба аллеля мутировали ( в том числе и в рамке считывания и мутации) со сдвигом рамки 9. В тех случаях , когда был выполнен мультиплексированный ген нацеливание, тройные биаллельных мутантные клоны с 5-10% эффективности были получены 5. оцДНК-опосредованной HDR из нескольких генов были выполнены также для получения точных генетических изменений, с эффективностью получения гомозиготными забивные клонов в пределах от 1 - 10% 5. Работа с CRISPR / Cas в hPSCs, любые мутации в потенциальных местах вне цели, которые не разделяют ту же gRNA целевую последовательность еще предстоит обнаружитьдеваха = "Xref"> 5, 9, 12. Секвенирование всего генома проводили в недавнем исследовании также не выявили существенных вне целевых мутаций в клоновых линиях HPSC генерируется с использованием CRISPR / Cas 29. Тем не менее, чтобы свести к минимуму потенциальный эффект путая фенотипы, введенные мутации в офф-целевых сайтов эффекта, предполагается генерировать независимые мутантные линии с использованием по меньшей мере двух независимых gRNAs, ориентированных на различные последовательности в пределах одного гена. Подобные фенотипы, наблюдаемые в нескольких строках генерироваться с использованием различных gRNAs может принципиально исключить возможность, что фенотип приходит из вне целевого эффекта.
Feeder-зависимых по сравнению с независимой культуры и таргетинга
Традиционные методы HPSC культуры включают их техническое обслуживание и расширение на фидерных клеток в средах, содержащих сыворотку или замены сыворотки, которая включает животных Проддукты, такие как бычий сывороточный альбумин. Питающие клетки, сыворотка, сыворотка замены, и альбумин содержат сложные, неопределенные компоненты и показать значительную изменчивость партии. Адаптация к кормушке, химически заданное состояние значительно сокращает усилия для поддержания HPSC и, что более важно, повышает согласованность дифференциации экспериментов. В настоящее время существует очень мало исследований , которые описывают процедуры редактирования генома на hPSCs культивировали в полностью определенных условиях культивирования 30. Мы обнаружили высокую эффективность CRISPR таргетирования при gRNA трансфекция и клоновая осаждение проводили в фидерных свободных условиях по сравнению с фидерными зависящих от условий культивирования. Мы считаем, что это связано с увеличением выживаемости клеток после трансфекции и одноклеточного высева для образования колоний. Кроме того, клетки-фидеры было показано ранее для секвестрации реагентов трансфекции, тем самым снижая эффективность трансфекции.
ОбъединениеГеном Редактирование с помощью направленной дифференцировки
Предыдущие протоколы дифференцировки дали лишь небольшую часть инсулина-позитивных клеток, большинство из которых были polyhormonal и напоминали эмбриональные эндокринных клеток 23. Недавний прогресс позволил дифференцировать hPSCs в более зрелых глюкозы реагировать бета-клеток , как 16, 17, 19, 20. Мы можем обычно получить , по меньшей мере , 75% однозначных эндодермы клетки, 40% Pdx1 + Nkx6.1 + панкреатические клетки - предшественники, и около 20% Nkx6.1 + CPEP + глюкоза реагирующих бета-подобные клетки , используя HUES8 hPSCs 9. В сочетании с системой редактирования генома iCRISPR, это более надежный протокол дифференциации способствовал анализ факторов транскрипции, которые имеют решающее значение для панкреатических предшественниках и эндокринных стадиях дифференцировки поджелудочной железы. Это сделаетВозможно, в будущих исследованиях, чтобы изучить большое количество генов - кандидатов заболевания для функциональной проверки и расследования в механизмах, лежащих в основе сахарного диабета 9.
Будущие приложения или направления
Наша система iCRISPR может способствовать генерации более сложных геномных модификаций, таких как создание репортер аллели через HDR-опосредованного генного таргетинга с использованием ДНК - матриц , длиной донорские кодирующего белок метки или флуоресцентные репортеров 12. Мы показали , что, из - за высокой CRISPR ориентации эффективность достигается в системе, этот процесс может быть выполнен в hPSCs, без необходимости выбора дополнительно наркотиков 12. Кроме того, мультиплексированный ген ориентации может быть использован для исследования генетических взаимодействий основной комплекс болезни человека, как это показано в нашем недавнем исследовании, которое по нашему мнению , является первым примером такой работы 31. ICRИСПИ также могут быть использованы для понимания ген-регул торный контроль путем создания делеции либо в некодирующих РНК или в гене регуляторных областей, таких как промоторы и энхансеры. Для того, чтобы эффективно генерировать регуляторных мутантов с использованием iCRISPR, gRNAs могут быть разработаны, чтобы сорвать сайт связывания белка, ДНК-связывающим, в том числе, но не ограничиваясь базального транскрипционного аппарата или тканесецифического фактора транскрипции. оцДНК шаблон опосредованную HDR также могут быть использованы для мутировать специфический белок-связывающие сайты. Наконец, мы предполагаем , что дальнейшая оптимизация позволит использовать платформу iCRISPR в hPSCs для более высокой пропускной способности генетического анализа плюрипотентности фенотипов или фенотипы заболевания , когда в сочетании с экстракорпорального протоколом дифференцировки в. Эти iCRISPR-опосредованного исследования могут позволить для более быстрой идентификации кандидатов, ассоциированных с заболеваниями генов и изучение их функциональной значимости.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа была частично финансируется NIH / NIDDK (R01DK096239) и штата Нью-Йорк стволовой клетки наук (NYSTEM C029156). ZZ была поддержана NYSTEM докторантуру из Центра биологии стволовых клеток из Sloan Kettering института.
Материалы
| Name | Company | Catalog Number | Comments |
| Chemically defined medium (E8) | Thermo Fisher Scientific | A1517001 | Essential 8 basal medium and Essential 8 supplement included |
| Truncated recombinant human form of vitronectin | Thermo Fisher Scientific | A14700 | |
| ROCK inhibitor Y-27632 | Selleck Chemicals | S1049 | |
| Dissociation reagent (TrypLE Select enzyme) | Thermo Fisher Scientific | 12563029 | 1x, animal origin free, recombinant enzyme |
| G418 Sulfate | Thermo Fisher Scientific | 10131035 | Geneticin Selective Antibiotic |
| Puromycin dihydrochloride | Sigma-Aldrich | P8833 | Puromycin Selective Antibiotic |
| DNA Polymerase (Herculase II Fusion) | Agilent Technologies | 600679 | PCR kit |
| MEGAshortscript T7 Transcription kit | Thermo Fisher Scientific | AM1354 | |
| MEGAclear Transcription Clean-Up Kit | Thermo Fisher Scientific | AM1908 | |
| Doxycycline hyclate | Sigma-Aldrich | D9891 | |
| Opti-MEM medium | Thermo Fisher Scientific | 31985062 | Reduced Serum Medium |
| Lipofectamine RNAiMAX Transfection Reagent | Thermo Fisher Scientific | 13778150 | |
| DNeasy Blood & Tissue Kit | QIAGEN | 69504 | Genomic DNA extraction kit |
| Proteinase K | Roche | 3115879001 | |
| MCDB 131 medium | Thermo Fisher Scientific | 10372-019 | |
| BLAR medium | Thermo Fisher Scientific | Custom-made with a published formulation (Rezania et al., 2014) | |
| L-glutamine supplement (GlutaMAX) | Thermo Fisher Scientific | 35050061 | |
| NaHCO3 | Thermo Fisher Scientific | 144-55-8 | |
| Glucose | Sigma-Aldrich | G8769 | |
| BSA | LAMPIRE Biological Laboratories | 7500855 | Fatty acid free |
| GDF8 | PeproTech | 120-00 | |
| CHIR-99021 | Stemgent | 04-0004 | GSK-3 inhibitor |
| L-Ascorbic acid | Sigma-Aldrich | A4544 | Vitamin C |
| FGF7 | R&D Systems | 251-KG | |
| SANT1 | Tocris Bioscience | 1974 | Hedgehog inhibitor |
| RA | Sigma-Aldrich | R2625 | Retinoic acid |
| LDN | Stemgent | 04-0019 | BMP inhibitor |
| IWP-2 | Tocris Bioscience | 3533 | Wnt antagonist |
| ITS-X | Thermo Fisher Scientific | 51500-056 | |
| TPB | EMD Millipore | 565740-1MG | PKC activator |
| 3,3’,5-Triiodo-L-thyronine (T3) | Sigma-Aldrich | T6397 | |
| ALK5i II | Enzo Life Sciences | ALX-270-445 | ALK5 inhibitor II |
| ZnSO4 | Sigma-Aldrich | Z0251 | |
| Heparin | Sigma-Aldrich | H3149 | |
| GSiXX | EMD Millipore | 565789 | Gamma secretase inhibitor XX, NOTCH signaling inhibitor |
| N-Cys (N-acetyl cysteine) | Sigma-Aldrich | A9165 | |
| Trolox | EMD Millipore | 648471 | Vitamin E analogue |
| R428 | Selleck Chemicals | S2841 | AXL receptor tyrosine kinase inhibitor |
| 24 mm Transwell with insert | Corning Life Sciences | 3414 | |
| Gene Pulser Xcell Electroporation System | Bio-Rad | 1652660 | |
| 0.4 cm Electroporation Cuvettes | Bio-Rad | 1652081 | |
| AAVS1-TALEN-L | Addgene | 59025 | |
| AAVS1-TALEN-R | Addgene | 59026 | |
| AAVS1-Neo-M2rtTA | Addgene | 60843 | |
| AAVS1-Puro-iCas9 | Addgene | 58409 | |
| T7 Endonuclease I | NEB | M0302L | |
| Buffer 2 | NEB | B7002S | NEBuffer 2 |
| Long oligonucleotide | Eton Bioscience or IDT | ||
| SOX17 antibody | R&D Systems | AF1924 | 1:500 |
| FOXA2 antibody | Millipore | 07-633 | 1:100 |
| CXCR4-APC antibody | R&D Systems | FAB170A | 1:25 |
| PDX1 antibody | R&D Systems | AF2419 | 1:500 |
| NKX6.1 antibody | DSHB | F55A12 | 1:500 |
| NKX2.2 antibody | DSHB | 74.5A5 | 1:100 |
| NEUROD1 antibody | Santa Cruz Biotechnology | sc-1084 | 1:100 |
| Insulin antibody | Dako | A0564 | 1:2,000 |
| C-peptide antibody | DSHB | GN-ID4-c | 1:2,000 |
| Glucagon antibody | Sigma-Aldrich | G2654 | 1:1,000 |
Ссылки
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6 (6), 507-512 (2005).
- Zwaka, T. P., Thomson, J. A. Homologous recombination in human embryonic stem cells. Nat Biotechnol. 21 (3), 319-321 (2003).
- Eiges, R., et al. Establishment of human embryonic stem cell-transfected clones carrying a marker for undifferentiated cells. Curr Biol. 11 (7), 514-518 (2001).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- González, F., et al. An iCRISPR Platform for Rapid, Multiplexable, and Inducible Genome Editing in Human Pluripotent Stem Cells. Cell Stem Cell. 15 (2), 215-226 (2014).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Braam, S. R., et al. Improved genetic manipulation of human embryonic stem cells. Nat Methods. 5 (5), 389-392 (2008).
- Zhu, Z., et al. Genome Editing of Lineage Determinants in Human Pluripotent Stem Cells Reveals Mechanisms of Pancreatic Development and Diabetes. Cell Stem Cell. 18 (6), 755-768 (2016).
- Kotini, A. G., et al. Functional analysis of a chromosomal deletion associated with myelodysplastic syndromes using isogenic human induced pluripotent stem cells. Nat Biotechnol. 33 (6), 646-655 (2015).
- Carlson-Stevermer, J., et al. High-Content Analysis of CRISPR-Cas9 Gene-Edited Human Embryonic Stem Cells. Stem Cell Reports. 6 (1), 109-120 (2016).
- Zhu, Z., Verma, N., Gonzalez, F., Shi, Z. D., Huangfu, D. A CRISPR/Cas-Mediated Selection-free Knockin Strategy in Human Embryonic Stem Cells. Stem Cell Reports. 4 (6), 1103-1111 (2015).
- Mandegar, M. A., et al. CRISPR Interference Efficiently Induces Specific and Reversible Gene Silencing in Human iPSCs. Cell Stem Cell. 18 (4), 541-553 (2016).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nat Methods. 8 (5), 424-429 (2011).
- Rezania, A., et al. Production of functional glucagon-secreting alpha-cells from human embryonic stem cells. Diabetes. 60 (1), 239-247 (2011).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat Biotechnol. 32 (11), 1121-1133 (2014).
- Chen, S., et al. A small molecule that directs differentiation of human ESCs into the pancreatic lineage. Nat Chem Biol. 5 (4), 258-265 (2009).
- Nostro, M. C., et al. Efficient generation of NKX6-1+ pancreatic progenitors from multiple human pluripotent stem cell lines. Stem Cell Reports. 4 (4), 591-604 (2015).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO J. 34 (13), 1759-1772 (2015).
- Zhu, Z., Gonzalez, F., Huangfu, D. The iCRISPR platform for rapid genome editing in human pluripotent stem cells. Methods Enzymol. 546, 215-250 (2014).
- Soh, C. L., Huangfu, D. CRISPR/Cas9-Mediated Mutagenesis of Human Pluripotent Stem Cells in Defined Xeno-Free E8 Medium. Methods in Molecular Biology. 1498, (2017).
- D'Amour, K. A., et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nat Biotechnol. 24 (11), 1392-1401 (2006).
- Kelly, O. G., et al. Cell-surface markers for the isolation of pancreatic cell types derived from human embryonic stem cells. Nat Biotechnol. 29 (8), 750-756 (2011).
- Musunuru, K. Genome editing of human pluripotent stem cells to generate human cellular disease models. Dis Model Mech. 6 (4), 896-904 (2013).
- Hockemeyer, D., Jaenisch, R. Induced Pluripotent Stem Cells Meet Genome Editing. Cell Stem Cell. 18 (5), 573-586 (2016).
- Yusa, K., et al. Targeted gene correction of alpha1-antitrypsin deficiency in induced pluripotent stem cells. Nature. 478 (7369), 391-394 (2011).
- Chen, F., et al. High-frequency genome editing using ssDNA oligonucleotides with zinc-finger nucleases. Nat Methods. 8 (9), 753-755 (2011).
- Veres, A., et al. Low incidence of off-target mutations in individual CRISPR-Cas9 and TALEN targeted human stem cell clones detected by whole-genome sequencing. Cell Stem Cell. 15 (1), 27-30 (2014).
- Huang, X., et al. Production of Gene-Corrected Adult Beta Globin Protein in Human Erythrocytes Differentiated from Patient iPSCs After Genome Editing of the Sickle Point Mutation. Stem Cells. 33 (5), 1470-1479 (2015).
- Shi, Z. D., et al. Genome Editing in hPSCs Reveals GATA6 Haploinsufficiency and a Genetic Interaction with GATA4 in Human Pancreatic Development. Cell Stem Cell. , (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены