Method Article
基因组编辑和hPSCs定向分化为胰腺癌发展讯问谱系行列式
摘要
协议来生成使用iCRISPR平台HPSC突变系和分化hPSCs成葡萄糖反应β样细胞中有描述。结合基因组编辑技术,HPSC-定向分化为血统决定因素在人的发展和疾病发展中的作用的系统分析了强大的平台。
摘要
在自我更新和分化的人类多能干细胞(hPSCs)询问基因功能提供了对理解人类的发展和在培养皿中解剖疾病机制的宝贵平台。利用这一潜在的应用需要高效率的基因组编辑工具,以产生在疾病相关基因HPSC的突变体,以及在体外 HPSC分化协议以产生疾病相关的细胞类型紧密概括其在体内的对应。命名iCRISPR为hPSCs一种高效的基因组编辑平台已经通过Cas9表达盒在AAVS1轨迹TALEN介导的靶向开发的。这里,对于使用在化学上确定的培养基和无饲养条件培养的细胞诱导Cas9 HPSC线产生的协议进行了描述。使用iCRISPR系统用于基因敲除或hPSCs精确的遗传改变的详细过程,或者到n上同源末端连接(NHEJ)或通过使用同源性定向修复(HDR)模板精确核苷酸改变分别被包括在内。这些技术程序包括设计,制作的描述,以及CRISPR导的RNA(gRNAs)的转染;通过T7E1或RFLP测定的CRISPR突变率的测量;并建立和克隆突变品系验证。最后,我们纪事程序HPSC分化通过体内胰腺胚胎发育模仿成葡萄糖反应胰岛β细胞样细胞。结合iCRISPR技术和定向分化HPSC使基因功能的系统检查,以进一步推动我们的胰腺发育和糖尿病的发病机制的认识。
引言
人类多能干细胞(hPSCs)有能力既自我更新和产生的三个胚系的衍生。它们由作为一个独特的平台在人类发育上下文概括细胞过程提供用于细胞置换治疗和疾病建模的宝贵资源。它们也是实验电池为可伸缩的,高通量分析的来源。然而,进展有限,因为两个主要挑战:缺乏有效的遗传修饰的工具和在扼要在培养皿复杂胚胎发育的步骤的难度。
基因改良是一个不可缺少的工具来研究正常发育和疾病的基因功能。然而,虽然经典的基因打靶通过同源重组的方法已经被证明是解剖基因功能在小鼠胚胎干细胞(mESCs)的强有力的工具1中 ,这种方法当应用于hPSCs 2,3一直非常低效的。最近从自然到实验室使用可编程的,位点特异性核酸酶,包括锌指核酸酶(ZFN),转录活化剂 - 样效应核酸(TALENS),和群集定期相互间隔短回文重复序列(CRISPR)/ CRISPR相关的轻快加入(CAS)系统4,是指基因组工程已经成为一个广泛的生物和细胞系的一个更容易的任务,包括在hPSCs。这些基因的编辑工具采取的事实,即嵌合核酸酶如Cas9核酸内切酶可以通过诱导在精确的位置双链断裂(DSB的),从而触发内源性DNA修复机制允许遗传修饰的整个范围来激活或者非同源末端连接(NHEJ)或同源定向修复(HDR)。这两种机制可通过诱导eith被利用基因操纵呃随机插入和缺失突变(插入缺失; 经由 NHEJ),以创建抵消基因的等位基因,或精确的核苷酸取代(通过HDR)移码突变,以概括为人类疾病模型患者突变或以校正用于基因治疗的一个致病突变。
CRISPR / CAS介导的基因组工程需要两个组成部分:必要的DNA裂解和可变CRISPR RNA(crRNA)和反式激活(tracrRNA)双工恒RNA引导Cas9核酸内切酶,指定DNA目标识别。所述crRNA / tracrRNA双工可以用单个嵌合导向的RNA(gRNA),这已经被发现更有效的5,6,7的工作所取代。而CRISPR / Cas9系统已经适应大多数实验生物体和细胞系的Cas9和gRNA显著变化的递送和表达,需要进一步优化,以阿希前夜高效的基因组编辑在很多系统中,包括hPSCs 8。一个高效的基因组编辑平台,iCRISPR,已建立了hPSCs 5。在这个系统中,一个TALEN介导的方法已被用于靶向反式 ,一个等位基因与反向四环素控制式激活(M2rtTA)和其他具有四环素响应元素中的"转基因安全港轨迹"AAVS1的两个等位基因(TRE )驱动Cas9(iCas9在hPSCs的表达式)。在建立无性系(iCas9 hPSCs),Cas9高度用强力霉素治疗表示。同时,由于它的小尺寸(100个核苷酸),单个或多个gRNAs可以容易地输送到iCas9 hPSCs具有高效率和可以直接Cas9位点特异性切割,从而实现高效的NHEJ介导的基因破坏,以及HDR介在短的单链DNA(ssDNA)供体模板的存在下精确核苷酸修饰。该iCRISPR系统可以是用于成功地产生的疾病模仿HPSC线与双等位基因(纯合或杂合化合物)或失功能杂合突变面板中重要发育基因5,9。虽然一些团体已经报道hPSCs使用CRISPR / CAS有效的基因编辑,成功仍然是有限的少数熟练掌握技术实验室。所述iCRISPR平台提供由不同技术水平的研究人员进行常规基因编辑的有效而简单的解决方案,并且它已经在若干由我们的组和其他9,10,11,12日公布的研究中使用。这一做法也得到了进一步延伸到基于dCas9-KRAB 13的表达诱导沉默。
随着基因组编辑TECHNO进度迟缓,显著改进也已经在HPSC维护和定向分化来实现。为hPSCs培养条件从照射小鼠胚胎成纤维细胞(IMEF)馈线依赖上定义的细胞外基质成分无饲养条件,并从复杂培养基配方,以合成培养基条件14发展而来的。这些改进减少了在由于IMEF制备和敲除血清替代品组件批次到批次差异hPSCs的变异性,并且因此提供用于HPSC分化更可再现的环境。同时,改善了信令从高通量药物掩护了人类胚胎发育的途径,以及发现的知识,导致改善分化协议15,16,17,18。这些协议在VIV更加紧密地模仿Ø发展步骤和生成的细胞类型密切概括其在体内的同行。对于HPSC分化为胰腺谱系,初步协议模仿早期胰腺发育相对完善,但最终产生的不成熟胎儿的表型和不良反应,以葡萄糖刺激polyhormonalβ细胞。最近的进步16,17,19,20已经允许葡萄糖反应胰岛β细胞样细胞,这将使我们能够调查后的事件,诸如形成和monohormonalβ细胞的进一步成熟的产生。
在这里,我们详细介绍了胰腺发育的研究基因组修饰的线条由iCRISPR系统与基于HPSC- 体外分化平台对葡萄糖响应pancr结合应用eaticβ样细胞。强大的基因组编辑工具具有改进的HPSC分化协议这种耦合不仅提供必要的速度和规模,以满足验证疾病的因果关系的不断增长的需求,同时也能够为进一步的机理调查转录调控的正常发育和疾病9背后复杂的遗传操作。
研究方案
该协议是基于我们与HPSC线H1,HUES8和MEL-1在化学定义和无饲养条件(请参阅材料和设备表 )工作。对于其他HPSC线或保持在不同的培养条件hPSCs,建议进一步优化。
1. HPSC文化中的化学定义和无饲养条件
- 适应于IMEF馈线的无饲养层条件下HPSC文化。在时,在无饲养层条件下直接回收冷冻细胞就无法生存的情况下,收回IMEF条件下细胞,然后再适应无饲养层条件。
注意:一般来说,需要2次传代对IMEF馈线培养hPSCs要适应于无饲养条件。 - 每天和通道当细胞已经达到〜80%汇合的hPSCs改变介质。一般情况下,在约1通道hPSCs:6 - 10天 - 1:15每4比率。加入10μMROCK抑制剂Y-27632 WH烯解冻或传代细胞。
- 事先用5微克/毫升(1毫升/ 10 cm 2)的玻连蛋白(VTN)的截短的重组人形式播种hPSCs,预涂培养皿在室温(RT)下至少1小时。此外,通过增加补充到培养基准备完整的化学成分确定的培养基。
- 除去培养基,用PBS洗一次细胞不含Ca 2+和Mg 2+,及用0.5mM EDTA处理细胞为〜2 -在RT 5分钟。
- 吸出EDTA殖民地已经脱离了。轻轻吹打,分散HPSC菌落成小块并悬浮细胞在完全培养基中。
- 收集解离hPSCs,并在200 xg离心降速细胞5分钟。重悬在完全培养基中的沉淀hPSCs和种子上VTN包被的板的细胞。
2.代iCas9 HPSC线路
- 为了健全下列质粒:AAVS1-TALEN-L,AAVS1-TALEN-R,AAVS1-NEO-M2rtTA和AAVS1 - 普罗-iCas9。
注:为避免意外的重组事件,使用质粒的转化和扩增重组缺陷Stbl3感受态细胞在30℃。 - 通常情况下,对于一种定位实验制备hPSCs在一个10厘米的培养皿(〜1×10 7细胞如果〜80%汇合)。
注意:由于电穿孔通常导致显著细胞死亡和TALEN介导的基因在AAVS1轨迹定位需要抗生素选择,需要将接种,以确定正确地靶向细胞相对大量的细胞。建议对每个细胞系,每个培养条件优化对于药物浓度。 - 在-1天 ,(电前一天),媒体的变化过程中添加10μMROCK抑制剂。
- 在第0天 ,(电穿孔的天),事先准备VTN包被的平板。
- 解离hPSCs成单个细胞USING 1X分离试剂(请参阅材料和设备表 )。简言之,去除培养基,用PBS洗一次细胞不含Ca 2+和Mg 2+,以及治疗与1倍的解离试剂将细胞在37℃〜3分钟。吸出解离试剂的细胞脱离之前。轻轻吹打,分散hPSCs成单细胞悬浮液在10.5毫升完全培养基。
- 取0.5毫升细胞悬液,计数使用自动细胞计数细胞数。沉淀hPSCs在200×g离心5分钟,并在12.5×10 6个细胞/ mL重悬细胞于冷(4℃)PBS中。
- 添加质粒( 见表1)到800μLHPSC悬挂(12.5×10 6细胞/ mL)拌匀。将该混合物转移至一个0.4厘米电穿孔杯中,并保持在冰上〜5分钟。
- 使用电系统在250 V和500μF电穿孔细胞;时间常数OBS电后erved通常为9 - 13毫秒。
- 电穿孔后,将细胞转移到15毫升锥形管用5毫升预热的完全培养基。 关键成功定位:使用健康的增殖hPSCs和传输时,重悬和后电镀细胞非常轻拿轻放的细胞。
- 沉淀细胞,在200×g离心5分钟。重悬在10毫升完全培养基将细胞与10μM的ROCK抑制剂和板1,2.5和5×10 6个细胞至每三个VTN-被覆10厘米的菜肴;这保证了在板中的至少一个将在菌落拾取单细胞克隆的密度足够菌落。
- 在第1天 (电穿孔后的第二天),改变介质。
- 在天2 - 5,启动新霉素选择当细胞〜60%汇合。每日用500微克/毫升G418硫酸盐改变介质;显著的细胞死亡是由于的SelectIOñG418筛选后第2天,通常观察到。
- 第6天 ,改变介质无抗生素的选择。
- 天7-9,嘌呤开始选择。每日用1μg/ ml嘌呤霉素盐酸盐改变介质;显著细胞死亡应当观察第二天。
- 第10天 ,每天开始改变介质无抗生素的选择,直到HPSC单细胞集落达到10 -直径为2毫米。
注意:典型地,在10-cm培养皿50个菌落与2.5×10 6 hPSCs观察镀在第0天。 - 挑选12 - 立体显微镜下24殖民地。机械分解的HPSC菌落成小块(每个菌落10个),使用23-G针(200微升吸管尖也是细)并直接转移细胞进入VTN-包被的24孔板中。
- 每天更换培养基,直到细胞变得汇合。通道中的细胞在24孔板的每个孔进重复6孔板的孔中。
- 当细胞成为6孔板汇合,用一个孔为一个冷冻的储存和其它公用于基因组DNA提取用于进一步表征。
- 鉴定和验证通过PCR基因分型,Southern印迹,RT-qPCR的分析,染色体核型分析,并分析多能性既定iCas9线。参阅Zhu 等人。 21详细的实验步骤。
3. HPSC突变系的产生使用iCRISPR系统
- HPSC的淘汰赛线代
- gRNA设计和生产
- 选择目标区域中的感兴趣的基因,以最大限度地提高破坏野生型蛋白的功能的可能性。对于注释良好的基因,选择一个重要的功能结构域上游的目标区域。可替代地,设计gRNAs定位的起始密码子的下游区域。选择的至少2个不同的区域的感兴趣的基因。
- 使用在线CRISPR设计工具(http://crispr.mit.edu)设计gRNAs。对于每一个目标区域,设计3 gRNAs与潜在的低脱靶,并使用一个与生成克隆突变系22的最高目标效率。
注意:为了实现高的基因组编辑效率,建议提供gRNA作为RNA的寡核苷酸而不是作为由于相比于过去的经验质粒小RNA的转染效率较高质粒DNA。 - 命令120核苷酸(nt)的含有T7启动子序列的DNA寡聚物,可变20 nt的crRNA识别序列(N),20(不包括在PAM序列),以及恒定嵌合指导序列。稀释寡聚至100微米原液在DDH 2 O和制备250纳米作为工作溶液。
注:TAATACGACTCACTATAGGG(N)20 GTTTTAGAGCTAGAAATAGCAAGTTAAAATAAGGCTAGTCCGTTATCAACTTGAAAAAGTGGCACCGAGTCGGTGCTTTT - PCR的扩增使用T7F和TracrR引物的寡核苷酸( 见表2),以产生双链DNA(dsDNA)的用于gRNA 体外转录(IVT)的模板。使用PCR反应混合物( 见表3)和PCR循环条件为50微升( 见表4)。
- 在20μL使用体外转录gRNA高产T7转录试剂盒与PCR扩增的模板, 在体外转录gRNA组合( 见表5)按照制造商的说明。净化用转录清理试剂盒按照制造商的说明在gRNA产品。
- 洗脱gRNAs继高通量纯化协议按照制造商的说明 - 在100微升的洗脱缓冲液(典型〜50 100微克)。调至浓度为320毫微克/微升(10μM)时可能的,并且存储在-80#176; C,直到使用。
- PCR和Sanger测序引物设计
- 验证设计和PCR引物扩增目标区域,随着产品尺寸范围一般为500〜 - 1000基点。
- 设计桑格测序引物内部结合到PCR产物,以允许对PCR产物的直接测序无需纯化。
- gRNA转染iCas9 hPSCs
- 在-1天 ,治疗iCas9细胞2微克/毫升强力霉素前24小时gRNA转染。
- 在gRNA转染0天 ,提前准备VTN-涂层板。
- 离解iCas9细胞进入使用1倍的解离试剂单个细胞,如在步骤2.5中描述。
- 沉淀hPSCs在200×g离心5分钟,并在重悬细胞〜在补充有2微克/毫升的强力霉素和10μMROCK抑制剂的完全培养基0.5×10 6个细胞/ mL。
- 板0.5毫升悬浮细胞到24孔板各个孔的。准备补充井作为非转染控制。
- 对于每一个gRNA,进行以下转染混合物:混合降低血清培养基的50微升+ 1 gRNA(10微米)微升;混合物B,转染试剂微升血清培养基+ 3降低的50微升。
- 结合混合A和B,使100微升的混合物。在室温下孵育5分钟。添加50微升该混合物的细胞在24孔板的一式两份孔中,并充分混合。
- 在第1天 ,如果需要,以进一步提高靶向效率进行第二次转染。否则,请在介质中无强力霉素。
- 在天2 - 3,每天更换介质。
- 第4天 ,从使用DNA提取试剂盒的每个转染的和未转染的对照细胞的一个孔中提取基因组DNA。调至浓度为50纳克/μL.
- PCR的扩增侧翼gRNA靶向序列的目标区域并使用T7核酸内切酶I(T7EI)消化或限制性片段长度多态性(RFLP)分析估计编辑效率,如前面5所述。
- T7EI法
- PCR的扩增使用设计并在步骤3.1验证的引物的目标区域。
- 制备的混合物( 见表6),并使用表7所列条件,PCR产物的DNA变性和杂交。
注意:根据我们的经验,通常是没有必要使用我们的PCR条件时以纯化PCR产物为T7EI测定。然而,纯化可以在其它条件下是有益的。 - 在37℃下执行T7EI消化使用的变性10μL的30分钟,杂交PCR产物和T7E1 0.2微升(2U)(10U /μL)。
- RESOLV用凝胶电泳e本T7E1消化PCR样品。使用ImageJ的确定切割和未切割DNA的相对带强度。使用公式计算插入缺失频率:(1 - (√(1-(B + C))/(A + B + C)))×100,其中a是未消化PCR产物和b和c的强度所述T7E1切割的产品的强度。
- RFLP分析
注:在哪里的限制性位点是在靠近例(<5碱基对)到一个Cas9切割位点(在PAM序列的3碱基5'),可以进行一个RFLP测定以量化INDEL频率。- 如步骤3.1.4.1所述使用相同的PCR产物。
- 消化与包含在靠近Cas9切割位点的限制性位点的限制性酶对PCR产物。
- 通过凝胶电泳解析消化的PCR样品。使用ImageJ的确定切割和未切割DNA的相对带强度。计算插入缺失使用公式频率:一个/(A + B + C)×100,其中a是未消化PCR产物和b和c的强度是消化产物的强度。
- 克隆突变系的建立
注意:在使用iCRISPR系统gRNA染hPSCs基因组编辑是高效,并且不需要抗生素选择。建立无性系,有必要在比较低的密度播种细胞,以确保单细胞的集落的形成。- 确定最高编辑效率(使用T7EI或RFLP分析),并具有良好的细胞存活gRNAs。使用相应的副本以及用于克隆突变系的建立。
- 解离hPSCs成使用1倍的解离试剂的单细胞悬浮液,如在步骤2.5中描述。 Replate 500,1000,和2,000个细胞到每个的三个VTN-被覆10厘米菜肴。
- 改变介质的日常üNTIL单细胞集落达到〜2毫米的直径。
- 挑24 - 48菌落每个gRNA,根据由T7EI和/或RFLP测定靶向效率的估计。机械地分解各菌落成小块(每个菌落10个),使用23-G针(200微升吸管尖也是细)和replate细胞一式两份VTN-涂覆的96孔板。使用用于基因组DNA的提取和Sanger测序,且另一板进一步扩张一个板。
- 当在96孔板的细胞已经成为汇合时,用一个简单的协议中提取的基因组DNA(无苯酚/氯仿萃取),如下所述。
- 除去培养基并用PBS洗一次细胞不含Ca 2+和Mg 2+。添加50微升裂解缓冲液(5 5蛋白酶K液(10毫克/毫升),PCRμL的缓冲10倍,和DDH 2 O的40微升)到96孔板的每个孔中。封用粘接膜和incuba板TE过夜55℃。
- 第二天,在99℃的热循环转移细胞裂解物到96孔PCR板,孵育10分钟以灭活蛋白酶K.
- PCR的扩增使用相同的引物作为用于T7EI或RFLP测定目标区域,使用细胞裂解物作为模板的1微升。
- 使用该PCR产物为Sanger测序的1微升用底漆内部结合到PCR产物。
- 放大与移码突变,插入缺失冷冻库存克隆。此外,放大一对夫妇的野生型克隆来自同一个目标的实验,以服务为进一步的实验,等基因控制线。
- gRNA设计和生产
- 突变线,精确的核苷酸改变代
注:通过非同源末端连接(NHEJ)中产生敲除突变体相比,精确核苷酸改变可通过同源性定向修复(HDR)中的DNA修理,建筑安装的存在下实现的ř模板。这种精确的核苷酸改变允许在野生型hPSCs患者特异性突变的产生和在患者来源的iPSC突变的校正。- 单链DNA的设计为模板HDR
- 产生设计和2 - 接近3 gRNAs给患者特异性突变,如在步骤3.1.1说明。
- 设计含有〜40两侧的患者特异性突变的单链DNA(ssDNA) - 80 nt的同源性在每一侧作为一个HDR模板。
- 到正确的修复后减少额外的切割,引入沉默突变的单链DNA模板在该区域gRNA识别序列本身内,并在靠近PAM序列或在PAM顺序,如果可能的话。
- 如果可能的话,设计沉默突变引入一个新的限制性消化位点,以及,以便它可以被用来估计使用RFLP分析的维修效率。
- gRNA /单链DNA共转染,并建立无性系
- 执行gRNA /单链DNA的共转染入iCas9细胞,如在步骤3.1.3所述,转染混合物A和B.对于每个gRNA和非转染的对照,转染细胞的24孔板重复孔中。混合答:降低血清培养基+ 1 gRNA的μL(10μM)+ 2单链DNAμL(10微米)50微升。混合A:转染试剂微升血清培养基+ 3降低的50微升。
- 转染后,从每个转染的和未转染的对照细胞的一个孔中提取基因组DNA,并估计使用T7EI和维修效率/或RFLP测定。
- 识别与修为最高的效率和良好的细胞存活的gRNA /单链DNA的混合物。使用相应的副本以及用于克隆突变系的建立。
- 挑选48 - 96殖民地,这取决于目标效率由T7EI和/或RFLP屁股估计唉。在一般情况下,HDR介导突变的效率比敲除突变降低,因而更菌落需要被拾取。
- 序,展开,并验证无性系,如在步骤3.1.6说明。
- 单链DNA的设计为模板HDR
4. 在体外分化HPSC成葡萄糖敏感的胰腺β细胞
注意: 在 HPSC突变体体外分化成疾病相关的细胞类型提供了一种在盘疾病建模平台。以下方案着重于hPSCs的体外分化成葡萄糖反应胰腺β细胞为胰腺发育和糖尿病研究9,16,17。
- HPSC分化成定型内胚层
- 保持HPSC突变体和野生型对照线路中的化学上确定的和无饲养条件下,如描述d在步骤1。
- 为了制备hPSCs分化,分离使用1倍的解离试剂hPSCs,并将它们分散到在完全培养基中的单细胞悬浮液。
- 沉淀细胞,在200×g离心5分钟,重新悬浮细胞与10μM的ROCK抑制剂的完全培养基。计数细胞数,并在种子细胞〜上VTN-涂层板1.4×10 5个细胞/ cm 2。
- 播种后改变介质24小时。
- 在第0天 ,48小时后开始分化,当细胞已经达到〜80%汇合。
注:要实现胰高效率的分化,优化在48小时汇合的接种密度和水平,建议为每个行。 - 吸出HPSC中,不含Ca 2+和镁离子一旦与PBS冲洗细胞。
- 改变介质分化0天(D0)中。
- 天1 - 2,改变迪每日介质fferentiation,根据表8中的配方。
- 第3天 ,检查定形内胚层标记SOX17,FOXA2和CXCR4经免疫荧光染色和流式细胞仪分析。
- 定型内胚层分化成胰腺祖
- 关于天3 - 9,继续朝向胰腺谱系定形内胚层分化通过每日更换培养基,按表9中的配方。
- 在第7天 ,检查由免疫荧光染色的早期胰腺祖(PP1)标志PDX1和流式细胞仪分析。
- 第10天 ,检查后胰腺祖(PP2)标记PDX1和NKX6.1。同时,准备PP2细胞转移到气 - 液界面对于进一步分化成胰腺内分泌细胞。
- 胰腺内分泌差异entiation在气 - 液界面
- 分离前4小时治疗PP2细胞10μMROCK抑制剂。
- 取下中,不含Ca 2+和镁离子一旦与PBS冲洗细胞。
- 添加2mL的1×解离试剂与PP2细胞在一个10-cm培养皿中,在37℃下2孵育 - 3分钟。
- 吸出解离试剂的细胞脱离之前。加入10 mL BLAR介质和向下轻轻吹打起来,驱散PP2细胞成单个细胞。
- 收集单细胞悬浮液。计数细胞数和沉淀,在200×g离心5分钟。
- 重悬细胞沉淀在约0.5×10 5个细胞/μL在S5中分化培养基和点5 -每个点单元10微升上的Transwell小插入滤波器。将10 - 在一个6孔插入15点和100〜斑点在10厘米的刀片。
- S5介质添加到每个Transwell小刀片的底部,〜1.5毫升为6孔插入和〜8毫升˚F或10厘米插入。
- 每日与表10中的配方改变介质。
- 检查胰腺内分泌标志物PDX1,NKX6.1 NEUROD1,NKX2.2,胰岛素和胰高血糖素对免疫荧光染色34天和流式细胞仪分析17。
- 检查用葡萄糖刺激的胰岛素分泌(GSIS)测定16,17 HPSC源性β样细胞的功能。
结果
HPSC化学定义和免费馈线文化适应与维护
上IMEF馈线培养hPSCs可以迅速适应在无饲养层培养条件VTN包被的平板。相同的分光比为正常IMEF馈线培养可以适应期间使用。 图1A示出了在基于KSR的培养基以及在无饲养介质VTN涂覆表面IMEF馈线hPSCs的典型形态。 图1B显示了一个典型的形态学变化和HPSC菌落的适应(4天)在第一通道中的生长。该细胞可以是进一步传代或冷冻以供将来的实验。开始分化实验前适应文化的3代 - 开展2。核型分析还建议调整之后,虽然我们还没有在适应阶段观察染色体核型异常。
"FO:保together.within页="1">通过iCas9 HPSC系的产生TALEN介导AAVS1瞄准如先前所示,hPSCs用一对AAVS1 TALEN质粒和Cas9和M2rtTA质粒5的电穿孔。 图2A和B示出了针对设计和整个过程,以产生iCas9 HPSC无性系详细供体载体。抗生素选择后,显示适当大小和典型HPSC形态的单细胞来源的克隆,准备被拾取(10 -电穿孔后12天, 图2C)。一般〜克隆的50%被正确定位没有随机整合,如通过Southern印迹( 图2D)5验证。随机整合可能导致在没有强力霉素治疗Cas9的渗漏表达。
高效的基因中号odification在hPSCs使用iCRISPR平台
在建立iCas9 hPSCs,Cas9表示与多西环素治疗和通过转染gRNAs,在那里它产生双链断裂引导到其目标轨迹。在没有修复模板,通过NHEJ DNA修复生成插入缺失,这往往导致基因破坏或敲除。在修复模板( 例如,一个单链DNA供体)的存在下,HDR可以用于精确的遗传改变,如在野生型HPSC背景生成患者特异性突变或校正在患者-疾病相关基因变体衍生的iPSC( 图3A)。这需要约1个月至产生使用iCRISPR系统克隆突变系。 iCas9诱导和gRNA转染,经过T7EI和/或RFLP测定法用于评估Cas9切割效率,并且转染的细胞后接种为单细胞成10厘米菜以低密度(〜500 - 2,000细胞/ 10-cm培养皿)。 10 - 19天之后,单细胞来源的克隆置于膨胀和进一步表征( 即,基因分型和Western印迹)( 图3B)的96孔平板的孔中。由于iCRISPR介导的基因敲除效率高,无选择的过程涉及,且通常为20 - 50%的等位基因突变体都可以轻松实现( 图3C)5。为了有效地和精确的遗传改变,gRNAs共转染带有ssDNA的供体携带特定序列改变(对于基因组序列的一个小的,但是具体的变化)。通常情况下,为了防止再切削改性等位基因,建议包括在靠近或在PAM顺序( 图3D)一个沉默突变。有了这个系统,〜携带所需的HDR介导的基因组修饰,而不另外改变在两个等位基因克隆的10%被达到( 图3E)。快速和p使用iCRISPR平台HPSC基因组的修饰recise使我们能够快速,有效地充当模型研究人类发育和疾病HPSC线。
hPSCs高效分化对葡萄糖敏感的β样细胞
在HPSC胰腺分化的最新进展已经允许紧密重演胰腺胚胎发育的协议的发展。未分化hPSCs先分化成定形内胚层,然后进入PDX1 +胰腺癌早期祖细胞(PP1)和PDX1 + NKX6.1 +后胰腺祖细胞(PP2),并最终转化为葡萄糖敏感的β细胞样细胞16,17,19,20 ,23,24。这些protoc醇进一步优化,以可靠地产生PDX1 + NKX6.1 +胰祖细胞和葡萄糖反应β样细胞9。 图4A示出了在分化的每个阶段使用的详细的化学品。一般,〜80%汇合的初始细胞接种后第2天是理想的起始HUES8 hPSCs( 图4B)的分化。测试几个不同的接种密度强烈建议去发现每一个特定的细胞系的最佳条件。通常至少75%FOXA2 + SOX17可以达到+细胞在DE阶段和40%PDX1 + NKX6.1 +细胞在PP2阶段( 图4C)。在S5中的阶段,细胞聚集体周围的气氛状的存在是细胞的良好生存,这对于进一步分化成NKX6.1 + CPEP +葡萄糖反应β样细胞( 图4D重要的指标)。此协议是研究人类胰腺癌ð有用才有发展和疾病在培养皿中。

图1. HPSC化学定义和无饲养维护和IMEF馈线文化适应。 (A)中hPSCs的代表性图像上IMEF馈线或VTN培养第4天,准备进行分割。 (B)的适配的第一通道成无饲养培养从IMEF馈线期间hPSCs的典型的形态。第4天hPSCs上IMEF馈线培养与ROCK抑制剂化学上确定的培养基中分离并铺于VTN包被的平板。分束比是一样的通常的分光比为IMEF馈线条件培养。培养基每天更换,而不ROCK抑制剂。 请点击此处查看该图的放大版本。
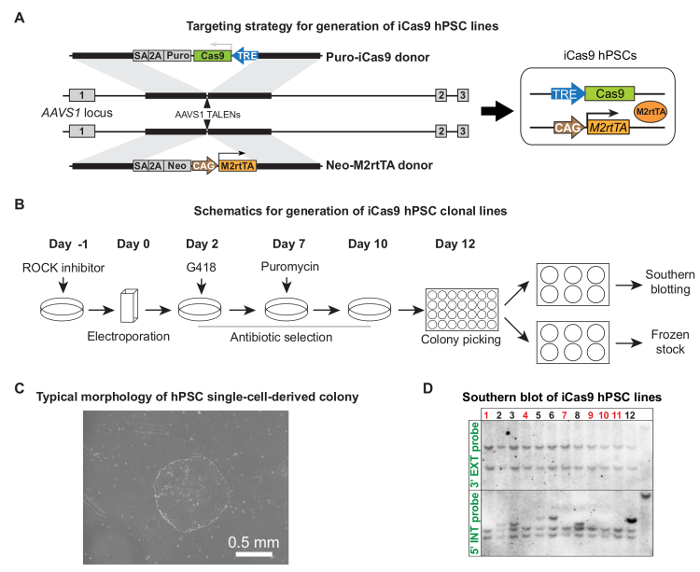
图2.生成iCas9 HPSC线。 ( 一 )针对策略的iCas9 HPSC线的产生。普罗-Cas9捐助者和新M2rtTA供者由一对AAVS1 TALENS有针对性的进入人AAVS1轨迹。整个目标的过程,包括电,抗生素选择,菌落采摘和扩张,细胞系鉴定的(B)原理图。 12天电后- (C)代表的单细胞克隆准备在10左右采摘。 ( 四 )确定正确的目标没有克隆两次捐助者质粒的额外的集成Southern印迹的例子。正确的克隆被标记为红色。 (A)和(D)改编自参考文献5,用许可。ig2large.jpg"目标="_空白">点击此处查看该图的放大版本。
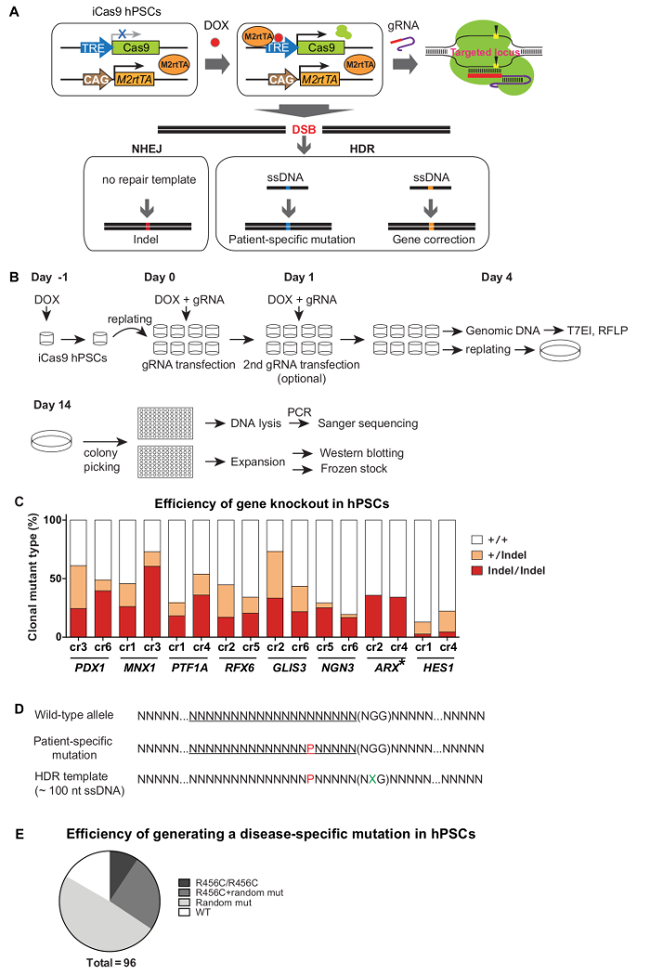
在hPSCs使用iCRISPR系统图3.高效遗传修饰。 (A)的示意图用于基因敲除的突变体,或使用iCRISPR系统精确基因修饰的产生。 ( 二 )针对程序和无性系的建立。在hPSCs 9至NHEJ(C)基因敲除的效率。一个单链DNA携带特定核苷酸修饰的(D)的设计。 P,红色:患者特异突变; X,绿色:沉默突变。 ( 五 )HDR-介导的精确核苷酸修饰的效率。精确R456C突变(引起的一种特定核苷酸C> T突变)的基因GATA6是使用iCRISPR系统介绍。(参考5更详细的信息)。 (C)和(E)改编自参考9和参考5,分别与权限。 请点击此处查看该图的放大版本。
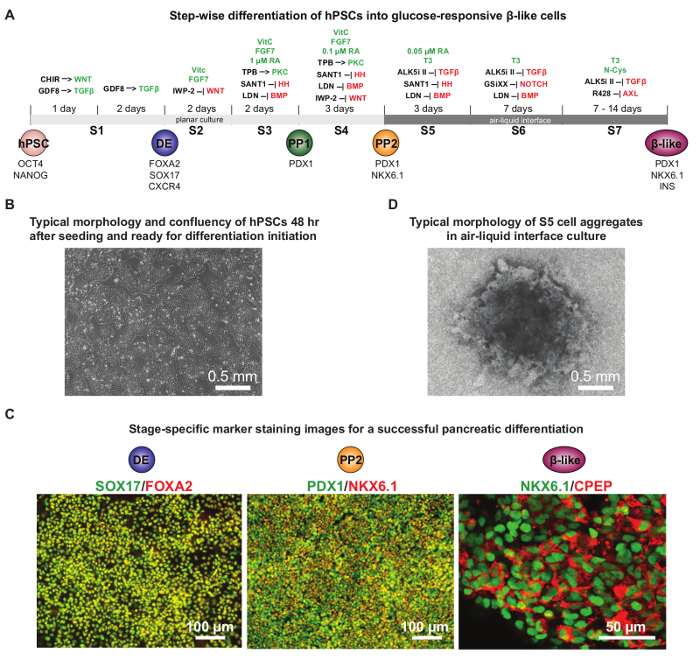
图4.定向分化HPSC成葡萄糖敏感的胰岛β样细胞。 (A)中的详细分化方案的原理图,与在分化的每个阶段补充的化学品。被分化过程中激活或抑制信号通路分别在高亮绿色或红色。 CHIR:GSK3抑制剂; GDF8:生长分化因子8或肌肉生长抑制素,一个TGF-β蛋白家族成员; HH:刺猬; DE:定型内胚层; PP1:PDX1 +的早期胰腺祖; PP2:PDX1 + NKX6.1 +后胰腺祖。 ( 二 )典型汇合-的hPSCs 48(70 80%)后播种h当准备开始分化。 (C)的代表性免疫染色的图像显示在定形内胚层的成功分化(DE)阶段(FOXA2和SOX17共染色),胰腺祖阶段(PP2:PDX1和NKX6.1共染色),和葡萄糖反应性β-像细胞阶段(NKX6.1和c肽共染色)。在一般情况下,在将β状细胞阶段实现10%以上的NKX6.1 + CPEP +细胞中,至少75%FOXA2 + SOX17 + DE细胞和40%的PDX1 +在相应的阶段需要NKX6.1 + PP2细胞。 (D)在对中的空气-液体界面培养插入过滤膜的S5阶段的细胞聚集体的典型的形态。存活的细胞已迁移至总(深)的中心和边缘留有一个光环状结构。 (A )和(D)改编自参考9权限。 请点击此处查看该图的放大版本。
| 质粒 | 量 |
| AAVS1-TALEN-L | 5微克 |
| AAVS1-TALEN-R | 5微克 |
| AAVS1 - 普罗-iCas9 | 40微克 |
| AAVS1-NEO-M2rtTA | 40微克 |
表格1
| 底漆 | 序列 |
| T7F | TAATACGACTCACTATAGGG |
| TracrR | AAAAGCACCGACTCGGTGCC |
表2
| 零件 | 量 |
| DDH 2 O的 | 35.5微升 |
| 5X PCR反应缓冲液 | 10μL |
| dNTP混合物(25毫摩尔) | 0.5μL |
| T7F(10μM) | 1.25微升 |
| TracrR(10μM) | 1.25微升 |
| T7-gRNA IVT模板(250纳米) | 1μL |
| DNA聚合酶 | 0.5μL |
| 总PCR反应混合物 | 50μL |
表3
| PCR循环条件 | |||
| 循环次数 | 变性 | 退火 | 延伸 |
| 1 | 94ºC,2分钟 | ||
| 2-31 | 94ºC,20秒 | 60ºC,20秒 | 72ºC,1分钟 |
| 32 | 72ºC,2分钟 | ||
表4
| 零件 | 的金额 |
| T7 ATP | 2μL |
| T7 CTP | 2μL |
| T7 GTP | 2μL |
| T7 UTP | 2μL |
| T7 10X缓冲 | 2μL |
| T7酶混合物 | 2μL |
| PCR扩增模板 | 8μL |
| 共体外转录gRNA混合 | 20μL |
| 在37ºC6小时到过夜 |
表5
| 零件 | 量(微升) |
| 未纯化PCR产物 | 8 |
| 缓冲区2 10倍 | 2 |
| 蒸馏水(DH 2 O) | 10 |
表6
| DNA变性和杂交循环条件 | ||
| 温度 | 为期 | 热循环仪条件 |
| 95℃ | 10分钟 | |
| 85°C | 1分钟 | 加速到85℃,2℃/秒 |
| 75℃ | 1分钟 | 加速到75℃,0.3℃/秒 |
| 65℃ | 1分钟 | 斜到65℃以0.3℃/秒 |
| 55°C | 1分钟 | 加速到55℃,0.3℃/秒 |
| 45°C | 1分钟 | 斜到45℃以0.3℃/秒 |
| 35℃ | 1分钟 | 斜到35℃以0.3℃/秒 |
| 25℃ | 1分钟 | 斜到25℃以0.3℃/秒 |
| 4℃ | 保持 | |
表7
| 阶段 | 天 | 媒体 | 补充 | |
| S1 | D0 | S1 | GDF8 100毫微克/毫升 | CHIR-99021 3μM |
| D1 | S1 | GDF8 100毫微克/毫升 | CHIR-99021 0.3μM | |
| D2 | S1 | GDF8 100毫微克/毫升 | ||
| S1媒体:MCDB 131 + 1X L-谷氨酰胺补充+ 0.5%BSA + 1.5 g / L的碳酸氢钠3 + 10毫米的葡萄糖 | ||||
表8
| 阶段 | 天 | 媒体 | 补充 | |||||||
| S2 | D3-D4 | S1 | 左心耳 0.25毫米 | FGF7 50毫微克/毫升 | IWP-2 2.5μM | |||||
| S3 | D5,D6 | S3 | 左心耳 0.25毫米 | FGF7 50毫微克/毫升 | SANT-1 0.25μM | RA 1μM | LDN 100纳米 | TPB 200纳米 | ITS-X 1:200 | |
| S4 | D7-D9 | S3 | 左心耳 0.25毫米 | FGF7 2毫微克/毫升 | SANT-1 0.25μM | RA 0.1μM | LDN 200纳米 | TPB 100纳米 | ITS-X 1:200 | IWP-2 2.5μM |
| S3媒体:MCDB 131 + 1×L-谷氨酰胺补充+ 2%BSA + 2.5克/升的NaHCO 3 + 10mM葡萄糖 | ||||||||||
表9
| 阶段 | 天 | 媒体 | 补充 | |||||||
| S5 | D10-D12 | S5 | T3 1μM | ALK5i II 10μM | SANT-1 0.25μM | RA 0.05μM | LDN 100纳米 | ITS-X 1:200 | 硫酸锌10μM | 肝素10微克/毫升 |
| S6 | d13- D19 | S5 | T3 1μM | ALK5i II 10μM | GSiXX 100纳米 | LDN 100纳米 | ITS-X 1:200 | 硫酸锌10μM | 肝素10微克/毫升 | |
| S7 | d20- D33 | S5 | T3 1μM | ALK5i II 10μM | 的N- 1mM的半胱氨酸 | 水溶性维生素E 10μM | R428 2μM | ITS-X 1:200 | 硫酸锌10μM | 肝素10微克/毫升 |
| S5媒体:BLAR + 1X L-谷氨酰胺补充+ 2%BSA + 1.5 g / L的碳酸氢钠3 + 20毫米的葡萄糖 | ||||||||||
表10
讨论
为了产生突变系时间注意事项
虽然基于基因组编辑CRISPR / CAS系统的最新方法已经导致了成功定位,更有效和通用平台将是可取的大规模基因功能进行了分析。该iCRISPR平台提供了一个快速,高效的方法来引入突变感兴趣5,9任何基因。第一,基于PCR的gRNA合成方法允许在不耗时的克隆步骤生产数百gRNAs的排列格式在一天的。其次,随着iCas9 hPSCs强力霉素诱导Cas9表达,涉及gRNA转染的步骤仅需要工作的最小量,因此,多gRNA靶向实验可以同时进行。第三,由于高的定位效率可达到与我们的系统,分析〜24 - 每gRNA转染48菌落应SUFF虽然效率取决于目标轨迹icient建立多个单等位基因和双等位基因突变系为一单个基因。由于它是可行的受过训练的个体以机械地挑384菌落(4×96孔板)在一个坐位,其中应考虑在解剖显微镜下〜4小时,经过培训的个人可以预期产生影响内12个基因突变系12个月。在很短的时间内流线型代HPSC突变体允许对与彼此交互,调节发育进程9的转录因子和/或信号传导途径组分的阵列的系统的分析。此外,有效的复用基因打靶也打开大门,调查遗传相互作用底层复杂的人类特征。
精确的遗传修饰的生成
特定病人的iPS细胞,从方便体细胞类型推导 S和分化为疾病相关的细胞类型提供疾病相关的基因突变的功能验证的大好机会。然而,由于在个体之间的遗传背景的相当大的可变性,从患者的iPSC之间和来自健康供体的直接比较可能不允许一个从背景效果区分疾病表型。因此,有必要通过校正所述疾病突变回野生型序列以产生同基因控制的iPSC或引入患者特异性突变引入野生型HPSC背景,提出了由他人25,26。除了失功能(空)的突变,人们现在可以更精确地通过引入患者特异性序列改变的解剖疾病机制成hPSCs内源性基因座,包括hypermorphic,亚效等位基因,neomorphic,或显性负患者突变。
ntent">精确遗传修饰以修复模板的存在下使用的HDR为DSB修复,由于它是有效得多小于NHEJ介导的DNA修复,含有该特定病人的突变,一个药物选择盒和同源臂的供体的质粒先前已用作修复模板2。药物筛选和患者特异性突变的验证后,一般需要第二步骤以除去药物选择盒。尽管使用最广泛的Cre-loxP序列和FLP-FRT系统留下内源性基因座残余序列,使用转座子piggyBac的已经允许无缝除去药物选择盒27的。最近,短的ssDNA模板也已经显示,以支持高效的HDR与工程改造的DNA内切核酸酶28,相对于一个供体的质粒,单链DNA可以直接合成,从而绕过费时克隆步骤,在这里,它具有可烯表明,通过共转染gRNA和一个单链DNA模板以诱导同源定向修复,iCRISPR可用于引入以高效率特异性核苷酸修饰。这不仅对于解剖必需核苷酸的蛋白功能域内的作用,而且还用于模拟人类疾病的突变和潜在校正干预治疗这些疾病相关的突变的关键。由于大量的易感性基因座即各自与多个序列变体相关联,造型复杂和多基因疾病,如糖尿病一直遗传学家一个挑战。作为iCRISPR平台是允许的用于快速产生的等位基因系列或multiplexable基因打靶,它可以促进多种疾病相关的基因座的调查,无论是单独或与同基因背景的组合。瞄准效率和脱靶效应
我们有发现T7E1和RFLP分析结果和通过测序鉴定突变体线的数目之间的良好的相关性。这强调平行设立的无性系进行这些试验的重要性。而获得可根据基因组位点有所不同,在大多数的单基因靶向实验靶向效率,20 -克隆的60%的被发现与两个等位基因的突变(包括在帧和移码突变)9。在被执行多重基因打靶的情况下,获得了5 5-10%的效率三重双等位基因突变克隆。还进行了几个基因的单链DNA介导的HDR,以获得精确的遗传变异,具有纯合子获得敲的克隆,从1的效率- 10%5。在不共享同一gRNA靶序列潜在的脱靶部位在hPSCs与CRISPR / CAS工作,任何突变尚未被检测小姑娘="外部参照"> 5,9,12。在最近的研究中进行全基因组测序也未能识别克隆HPSC线大幅偏离目标突变使用CRISPR / CAS 29产生的。然而,为了最大限度地减少混淆通过在脱靶效应位点突变引入表型的任何潜在的影响,建议以产生使用至少两个独立gRNAs相同基因内靶向不同序列的独立突变品系。使用不同gRNAs可以主要排除表型来自一个脱靶效应的可能性产生的多行观察到类似的表型。
馈线依赖与独立的文化和目标
对于HPSC文化传统的方法涉及其在含血清或血清替代品,包括动物督促媒体在饲养层细胞的维护和扩展UCTS,如牛血清白蛋白。饲养细胞,血清,血浆置换,以及白蛋白都含有复杂的,不确定的成分和表现出相当一批变异。适应无饲养和化学成分确定的条件显著减少HPSC维护和,更重要的是,增加的分化实验的一致性的努力。目前,这里并没有描述在完全定义的培养条件下培养30基因组hPSCs编辑过程很少有研究。我们发现CRISPR较高时gRNA转染和克隆沉积是在无饲养条件相比,馈线相关的培养条件进行靶向效率。我们认为,这是由于转染和单细胞接种于集落形成后增加的细胞存活。此外,饲养细胞先前已经显示出螯合转染试剂,从而降低了转染效率。
结合基因组编辑与定向分化
以前分化协议已经仅产生胰岛素阳性细胞的一小部分,其中大部分是polyhormonal和类似胎儿内分泌细胞23。最近的进展已经允许hPSCs分化成更成熟葡萄糖反应β样细胞16,17,19,20。我们可以经常获得至少75%的定形内胚层细胞中,40%的PDX1 + NKX6.1 +胰祖细胞,并在20%左右NKX6.1 + CPEP +葡萄糖反应β样细胞使用HUES8 hPSCs 9。当与iCRISPR基因组编辑系统相结合,这更强大的分化方案促进了转录因子是胰腺分化的胰腺祖和内分泌阶段至关重要的分析。这将使它可能,在今后的研究,以检查大量的候选疾病基因的功能验证和调查背后糖尿病9的机制。
未来的应用方向或
我们的iCRISPR系统可以便于更复杂的基因组修饰,如通过建立记者等位基因的产生HDR介导的基因使用长供体的DNA模板编码蛋白质标签或荧光报告12定位。我们已经表明的是,由于高CRISPR定位系统中获得的效率,这个过程可以在hPSCs来执行,而不需要进一步的药物选择12。此外,复用基因打靶,可以用来研究基因相互作用的潜在复杂的人类疾病,如在我们最近的研究,我们认为这是此类工作31的第一个例子。 ICRISPR也可用于通过创建缺失或在非编码RNA或基因的调节区,如启动子和增强理解基因调节控制。使用iCRISPR有效地产生调节突变体,gRNAs可被设计为破坏的DNA结合蛋白的结合位点,包括但不限于基础转录机制或组织特异性转录因子。单链DNA模板介导的HDR还可以用于改动特定的蛋白质结合位点。最后,我们设想,当与体外分化方案合并进一步优化将使利用iCRISPR平台hPSCs的多能性表型或疾病表型的更高的通量遗传分析。这些iCRISPR介导的研究可以允许的候选疾病相关基因及其功能相关的研究的更快速鉴定。
披露声明
作者什么都没有透露。
致谢
这项工作是由美国国立卫生研究院/ NIDDK(R01DK096239)和纽约州干细胞科学(NYSTEM C029156)部分资助。 ZZ被从中心NYSTEM博士后研究的斯隆凯特林研究所干细胞生物学的支持。
材料
| Name | Company | Catalog Number | Comments |
| Chemically defined medium (E8) | Thermo Fisher Scientific | A1517001 | Essential 8 basal medium and Essential 8 supplement included |
| Truncated recombinant human form of vitronectin | Thermo Fisher Scientific | A14700 | |
| ROCK inhibitor Y-27632 | Selleck Chemicals | S1049 | |
| Dissociation reagent (TrypLE Select enzyme) | Thermo Fisher Scientific | 12563029 | 1x, animal origin free, recombinant enzyme |
| G418 Sulfate | Thermo Fisher Scientific | 10131035 | Geneticin Selective Antibiotic |
| Puromycin dihydrochloride | Sigma-Aldrich | P8833 | Puromycin Selective Antibiotic |
| DNA Polymerase (Herculase II Fusion) | Agilent Technologies | 600679 | PCR kit |
| MEGAshortscript T7 Transcription kit | Thermo Fisher Scientific | AM1354 | |
| MEGAclear Transcription Clean-Up Kit | Thermo Fisher Scientific | AM1908 | |
| Doxycycline hyclate | Sigma-Aldrich | D9891 | |
| Opti-MEM medium | Thermo Fisher Scientific | 31985062 | Reduced Serum Medium |
| Lipofectamine RNAiMAX Transfection Reagent | Thermo Fisher Scientific | 13778150 | |
| DNeasy Blood & Tissue Kit | QIAGEN | 69504 | Genomic DNA extraction kit |
| Proteinase K | Roche | 3115879001 | |
| MCDB 131 medium | Thermo Fisher Scientific | 10372-019 | |
| BLAR medium | Thermo Fisher Scientific | Custom-made with a published formulation (Rezania et al., 2014) | |
| L-glutamine supplement (GlutaMAX) | Thermo Fisher Scientific | 35050061 | |
| NaHCO3 | Thermo Fisher Scientific | 144-55-8 | |
| Glucose | Sigma-Aldrich | G8769 | |
| BSA | LAMPIRE Biological Laboratories | 7500855 | Fatty acid free |
| GDF8 | PeproTech | 120-00 | |
| CHIR-99021 | Stemgent | 04-0004 | GSK-3 inhibitor |
| L-Ascorbic acid | Sigma-Aldrich | A4544 | Vitamin C |
| FGF7 | R&D Systems | 251-KG | |
| SANT1 | Tocris Bioscience | 1974 | Hedgehog inhibitor |
| RA | Sigma-Aldrich | R2625 | Retinoic acid |
| LDN | Stemgent | 04-0019 | BMP inhibitor |
| IWP-2 | Tocris Bioscience | 3533 | Wnt antagonist |
| ITS-X | Thermo Fisher Scientific | 51500-056 | |
| TPB | EMD Millipore | 565740-1MG | PKC activator |
| 3,3’,5-Triiodo-L-thyronine (T3) | Sigma-Aldrich | T6397 | |
| ALK5i II | Enzo Life Sciences | ALX-270-445 | ALK5 inhibitor II |
| ZnSO4 | Sigma-Aldrich | Z0251 | |
| Heparin | Sigma-Aldrich | H3149 | |
| GSiXX | EMD Millipore | 565789 | Gamma secretase inhibitor XX, NOTCH signaling inhibitor |
| N-Cys (N-acetyl cysteine) | Sigma-Aldrich | A9165 | |
| Trolox | EMD Millipore | 648471 | Vitamin E analogue |
| R428 | Selleck Chemicals | S2841 | AXL receptor tyrosine kinase inhibitor |
| 24 mm Transwell with insert | Corning Life Sciences | 3414 | |
| Gene Pulser Xcell Electroporation System | Bio-Rad | 1652660 | |
| 0.4 cm Electroporation Cuvettes | Bio-Rad | 1652081 | |
| AAVS1-TALEN-L | Addgene | 59025 | |
| AAVS1-TALEN-R | Addgene | 59026 | |
| AAVS1-Neo-M2rtTA | Addgene | 60843 | |
| AAVS1-Puro-iCas9 | Addgene | 58409 | |
| T7 Endonuclease I | NEB | M0302L | |
| Buffer 2 | NEB | B7002S | NEBuffer 2 |
| Long oligonucleotide | Eton Bioscience or IDT | ||
| SOX17 antibody | R&D Systems | AF1924 | 1:500 |
| FOXA2 antibody | Millipore | 07-633 | 1:100 |
| CXCR4-APC antibody | R&D Systems | FAB170A | 1:25 |
| PDX1 antibody | R&D Systems | AF2419 | 1:500 |
| NKX6.1 antibody | DSHB | F55A12 | 1:500 |
| NKX2.2 antibody | DSHB | 74.5A5 | 1:100 |
| NEUROD1 antibody | Santa Cruz Biotechnology | sc-1084 | 1:100 |
| Insulin antibody | Dako | A0564 | 1:2,000 |
| C-peptide antibody | DSHB | GN-ID4-c | 1:2,000 |
| Glucagon antibody | Sigma-Aldrich | G2654 | 1:1,000 |
参考文献
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6 (6), 507-512 (2005).
- Zwaka, T. P., Thomson, J. A. Homologous recombination in human embryonic stem cells. Nat Biotechnol. 21 (3), 319-321 (2003).
- Eiges, R., et al. Establishment of human embryonic stem cell-transfected clones carrying a marker for undifferentiated cells. Curr Biol. 11 (7), 514-518 (2001).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- González, F., et al. An iCRISPR Platform for Rapid, Multiplexable, and Inducible Genome Editing in Human Pluripotent Stem Cells. Cell Stem Cell. 15 (2), 215-226 (2014).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Braam, S. R., et al. Improved genetic manipulation of human embryonic stem cells. Nat Methods. 5 (5), 389-392 (2008).
- Zhu, Z., et al. Genome Editing of Lineage Determinants in Human Pluripotent Stem Cells Reveals Mechanisms of Pancreatic Development and Diabetes. Cell Stem Cell. 18 (6), 755-768 (2016).
- Kotini, A. G., et al. Functional analysis of a chromosomal deletion associated with myelodysplastic syndromes using isogenic human induced pluripotent stem cells. Nat Biotechnol. 33 (6), 646-655 (2015).
- Carlson-Stevermer, J., et al. High-Content Analysis of CRISPR-Cas9 Gene-Edited Human Embryonic Stem Cells. Stem Cell Reports. 6 (1), 109-120 (2016).
- Zhu, Z., Verma, N., Gonzalez, F., Shi, Z. D., Huangfu, D. A CRISPR/Cas-Mediated Selection-free Knockin Strategy in Human Embryonic Stem Cells. Stem Cell Reports. 4 (6), 1103-1111 (2015).
- Mandegar, M. A., et al. CRISPR Interference Efficiently Induces Specific and Reversible Gene Silencing in Human iPSCs. Cell Stem Cell. 18 (4), 541-553 (2016).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nat Methods. 8 (5), 424-429 (2011).
- Rezania, A., et al. Production of functional glucagon-secreting alpha-cells from human embryonic stem cells. Diabetes. 60 (1), 239-247 (2011).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat Biotechnol. 32 (11), 1121-1133 (2014).
- Chen, S., et al. A small molecule that directs differentiation of human ESCs into the pancreatic lineage. Nat Chem Biol. 5 (4), 258-265 (2009).
- Nostro, M. C., et al. Efficient generation of NKX6-1+ pancreatic progenitors from multiple human pluripotent stem cell lines. Stem Cell Reports. 4 (4), 591-604 (2015).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO J. 34 (13), 1759-1772 (2015).
- Zhu, Z., Gonzalez, F., Huangfu, D. The iCRISPR platform for rapid genome editing in human pluripotent stem cells. Methods Enzymol. 546, 215-250 (2014).
- Soh, C. L., Huangfu, D. CRISPR/Cas9-Mediated Mutagenesis of Human Pluripotent Stem Cells in Defined Xeno-Free E8 Medium. Methods in Molecular Biology. 1498, (2017).
- D'Amour, K. A., et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nat Biotechnol. 24 (11), 1392-1401 (2006).
- Kelly, O. G., et al. Cell-surface markers for the isolation of pancreatic cell types derived from human embryonic stem cells. Nat Biotechnol. 29 (8), 750-756 (2011).
- Musunuru, K. Genome editing of human pluripotent stem cells to generate human cellular disease models. Dis Model Mech. 6 (4), 896-904 (2013).
- Hockemeyer, D., Jaenisch, R. Induced Pluripotent Stem Cells Meet Genome Editing. Cell Stem Cell. 18 (5), 573-586 (2016).
- Yusa, K., et al. Targeted gene correction of alpha1-antitrypsin deficiency in induced pluripotent stem cells. Nature. 478 (7369), 391-394 (2011).
- Chen, F., et al. High-frequency genome editing using ssDNA oligonucleotides with zinc-finger nucleases. Nat Methods. 8 (9), 753-755 (2011).
- Veres, A., et al. Low incidence of off-target mutations in individual CRISPR-Cas9 and TALEN targeted human stem cell clones detected by whole-genome sequencing. Cell Stem Cell. 15 (1), 27-30 (2014).
- Huang, X., et al. Production of Gene-Corrected Adult Beta Globin Protein in Human Erythrocytes Differentiated from Patient iPSCs After Genome Editing of the Sickle Point Mutation. Stem Cells. 33 (5), 1470-1479 (2015).
- Shi, Z. D., et al. Genome Editing in hPSCs Reveals GATA6 Haploinsufficiency and a Genetic Interaction with GATA4 in Human Pancreatic Development. Cell Stem Cell. , in press (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。