A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مقايسة تثبيط (مرحبا) هيماجلوتينيشن أمثل لقياس الأجسام المضادة الخاصة بالإنفلونزا التتر
* These authors contributed equally
In This Article
Summary
البروتوكولات المقدمة تصف كيفية القيام مقايسة تثبيط hemagglutination كمياً التتر الأجسام المضادة الخاصة بالإنفلونزا من عينات المصل من المستلمين لقاح الإنفلونزا. الفحص الأول يحدد التركيزات المثلى مستضد الفيروسية بواسطة hemagglutination. الفحص الثاني يوضحها التتر الأجسام المضادة الخاصة بالإنفلونزا بتثبيط هيماجلوتينيشن.
Abstract
ويشيع استخدام جسم التتر كعلامات بديلة لحماية مصلية ضد الإنفلونزا ومسببات الأمراض الأخرى. معرفة تفصيلية بجسم إنتاج ما قبل وما بعد التطعيم مطلوب لفهم الحصانة التي يسببها اللقاح. توضح هذه المقالة بروتوكول نقطة بنقطة يمكن الاعتماد عليها لتحديد الأجسام المضادة الخاصة بالإنفلونزا التتر. البروتوكول الأول وصف أسلوب لتحديد مستضد المبالغ اللازمة هيماجلوتينيشن، التي توحد التركيزات للاستخدام اللاحق في البروتوكول الثاني (مقايسة hemagglutination، مقايسة هكتار). البروتوكول الثاني يصف التحديد الكمي للأجسام المضادة الخاصة بالإنفلونزا التتر ضد سلالات فيروسية مختلفة باستخدام مسلسل إضعاف البشرية المصل أو خلية ثقافة سوبيرناتانتس (هيماجلوتينيشن بتثبيط الإنزيم، مرحبا بالانزيم).
على سبيل مثال التطبيقي، نعرض استجابة الأجسام المضادة لمجموعة صحية، الذي تلقي لقاح إنفلونزا المعطل تمكنت. بالإضافة إلى ذلك، يتم عرض ه بين فيروسات الإنفلونزا المختلفة ويتم شرح طرق لتقليل ه باستخدام أنواع مختلفة من الحيوانات من خلايا الدم الحمراء (كرات الدم الحمراء). ويسلط الضوء على المناقشة مزايا وعيوب من فحوصات المقدمة وكيفية تصميم التتر الخاصة بالإنفلونزا جسم يمكن تحسين الفهم للحصانة المتصلة باللقاحات.
Introduction
الإصابة بفيروس الإنفلونزا يرتبط بقدر كبير من الاعتلال والوفاة، وارتفاع تكاليف الرعاية الصحية1،2،،من34. على وجه الخصوص، كبار السن والأطفال حديثي الولادة والنساء الحوامل والمرضى الذين يعانون من الأمراض المزمنة في خطر للنتائج السريرية أكثر شدة. ولذلك، التطعيم ضد تعميم سلالات فيروس الإنفلونزا هو التدبير الرئيسي لتقليل عبء المرض في هذه المجموعات السكانية المعرضة للخطر. زيادة الاستجابة المناعية الفردية بعد التطعيم، مثلاً، والأجسام المضادة الخاصة بالإنفلونزا عتبة واقية، يقلل من خطر الفردية من العدوى، وبشكل عام احتمال انتقال العدوى الفيروسية ضمن عدد سكان 5. فهم مفصل استجابة مناعية خلطيه الناجمة عن اللقاحات في مختلف قطاعات السكان، وعبر مختلف الفئات العمرية عنصر أساسي للإجابة على أسئلة سريرية هامة6،،من78 , 9، مثل: لماذا يكون بعض المرضى المسنين العدوى رغم التلقيح السابق؟ ما هو "جيد" و "كافية" الناجمة عن اللقاحات حماية؟ كم مرة ينبغي تطبيق لقاح مريض إيمونوسوبريسيد للوصول إلى الحماية التتر؟ ما هي الجرعة الأكثر فعالية؟ ما هو أثر رواية adjuvant في جسم التطعيم بعد انتهاء التتر؟ قياس إنتاج الأجسام المضادة الخاصة باللقاحات قد تساعد على الإجابة على هذه الأسئلة الهامة وتحسين نتائج التلقيح.
التحديد الكمي التتر الأجسام المضادة الخاصة بالفيروس يمكن أن يؤديها مع مختلف طرق مناعية. وهذا يشمل المرحلة الصلبة10 أو المستندة إلى حبة فحوصات11 أليسا، مرحبا بالانزيم12، وتحييد فحوصات13. الأساليب المستندة إلى أليسا السماح بفرز كميات كبيرة نسبيا من عينات مصل ضد المستضدات المختلفة. أيضا، يمكن استكشاف الغلوبولين المناعي (Ig) م الخاصة بالعوامل الممرضة ومفتش بشكل منفصل. على الرغم من أن الخصائص مستضد، مثلاً، وتسلسل خطي من الأحماض الأمينية أو جسيمات شبيهة بالفيروس قد تؤثر على الربط من الأجسام المضادة، الطائفة من المحتمل [ابيتوبس] واسعة جداً، وعدم تقديم معلومات عن ما إذا كان جسم وقد رد صلة وظيفية.
وفي المقابل، مقايسة تحييد يحدد إمكانات أجسام مضادة لمنع انتقال العدوى إلى الخلايا وظيفيا ويعكس ذلك تحييد المحتملة. ومع ذلك، هذا الأسلوب المكثف جداً العمل، يتطلب استزراع محددة الخلية خطوط وتعيش الفيروسات، وعليه، هو مضيعة للوقت ومكلفة، وتتطلب معدات خاصة.
توضح هذه المقالة خطوة بخطوة بروتوكول المستندة إلى منظمة الصحة العالمية مرحبا12 كمياً التتر الأجسام المضادة الخاصة بالإنفلونزا. هيماجلوتينيشن تأثير مميزة لبعض الفيروسات مما أدى إلى تراص من الكريات الحمراء. تثبيط هذا التأثير مع المريض الأمصال يسمح بقياس تركيزات الأجسام المضادة المثبطة، مما يعكس تأثير تحييد.
وقد قمنا بتعديل سير العمل من منظمة الصحة العالمية-بروتوكول للسماح معالجة أكثر كفاءة من عينات متعددة في نفس الوقت، ومما يقلل من الوقت اللازم. ويصف البروتوكول الأول تحديد إمكانات تراص مستضد الإنفلونزا خاصة. في القيام بذلك، يتم تحديد تركيز مستضد الإنفلونزا الصحيح للبروتوكول الثاني. وينبغي أن يتكرر هذا الجزء مع كل مستضد الفيروسية الجديدة، فضلا عن كل دفعة من الدم.
البروتوكول الثاني يصف تصميم التتر الأجسام المضادة الخاصة بالإنفلونزا. البروتوكولات المقدمة هي الأمثل للتحقيق في عينات مصل الدم البشري وفيروس الإنفلونزا ومع ذلك، يمكن تطبيقه أيضا لعينات المصل الماوس أو supernatants ثقافة الخلية من حفز الخلايا المناعية، مثلاً، ب-الخلايا الخاصة بالفيروس. ويمكن تحديد النتائج كالتتر المقاسة المطلق. في العديد من الدراسات اللقاح، ترد التتر هندسي وفاصل الثقة 95% لكل السكان خاصة. للتفسير، أو سيروبروتيكشن، أو الدراسة تستخدم غالباً لوصف قابلية السكان لفيروس معين. ويعرف سيروبروتيكشن عيار ≥1:40، والدراسة كما تزيد عيار أكثر من النوبات مع تحقيق التتر سيروبروتيكتيفي بين اثنين من النقاط الزمنية (الأكثر استخداماً وتستخدم قبل التطعيم والتلقيح بعد 30 يوما).
كلا البروتوكولين سهلة الاستخدام، ويمكن أن تتكيف مع طائفة واسعة من الأسئلة البحثية. على وجه الخصوص، يمكن استخدامها لتحديد موثوقية وسرعة التتر الأجسام المضادة ضد الفيروسات الأخرى المختلفة مع القدرة على هيماجلوتينيشن، مثل الحصبة الألمانية، والنكاف، الحصبة أو بوليومافيروسيس14،15،16 .
Access restricted. Please log in or start a trial to view this content.
Protocol
تمت الموافقة على دراسة البروتوكولات عن طريق مجلس المراجعة الأخلاقية المحلية (www.EKNZ.ch) وتم الحصول على الموافقة الخطية من جميع المشاركين.
1. جمع المصل
- جمع عينات مصل الدم من البشر في وقت النقاط المثيرة للاهتمام. لهذه الدراسة، جمعنا الأمصال في الأيام 0 (وقت التطعيم ضد الإنفلونزا)، + 7، + 30، + 60 و + 180 بعد التطعيم.
- للحصول على المصل، الطرد المركزي أنابيب العينة في س 1,200 ز لمدة 10 دقائق في درجة حرارة الغرفة (20-25 درجة مئوية).
ملاحظة: يجب تخزين العينات غير تثفيل الدم عند 4 درجة مئوية، وذلك لمدة لا تزيد على 24 ساعة. - قاسمة المصل في أنابيب مختلفة (cryo-قنينات) وتجميد في-80 درجة مئوية حتى الاستخدام.
- إجراء فحوصات لاحقة باتشويسي، بما في ذلك جميع الوقت--النقاط لشخص واحد للحد من تقلب داخل مريض.
2-إعداد مولدات المضادات
تحذير: يتم استخدام خمسة مولدات مختلفة (انظر الجدول للمواد). إعداد مولدات المضادات في مختبر للسلامة الأحيائية المستوى 2 (BSL-2).
- وفقا لإرشادات الشركة المصنعة، إعادة تشكيل مجموع محتويات امبول مستضد الإنفلونزا المجففة بالتبريد واحدة مع 1.0 مل ماء المقطر وتسمح مستضد المنحلة الوقوف على الأقل لمدة 5 دقائق في درجة حرارة الغرفة قبل المتابعة.
- الكوة حل مستضد 1.5 مل أنابيب وتجميد في-80 درجة مئوية حتى استخدامها مرة أخرى.
3-إعداد فيلتراتي الكوليرا
ملاحظة: يتم استخدام فيلتراتي الكوليرا مستقبلات تدمير إنزيم (استخلاص) وفقا لبروتوكول منظمة الصحة العالمية12. يؤدي هذا إلى إزالة مثبطات الفطرية من المصل الذي يتعارض مع المقايسة17.
- إعادة تشكيل استخلاص المجففة بالتبريد وفقا لإرشادات الشركة المصنعة.
- تخزين الحل التدمير في أنبوب 15 مل عند 4 درجة مئوية حتى استخدامها مرة أخرى.
4-ها الإنزيم
ملاحظة: لضمان أن فحوصات مرحبا قابلة للمقارنة بين عدة لوحات، يجب استخدام نفس الكمية من جزيئات الفيروس لكل لوحة. مقايسة هكتار (وتسمى أيضا معايرة هكتار) تتم لقياس جزيئات الفيروس اللازمة هيماجلوتيناتيون، ويتم تسجيلها في وحدات هكتار. "وحدة" هيماجلوتينيشن هو وحدة تنفيذية تعتمد على الطريقة المستخدمة لمعايرة هكتار وليس مقياسا لكمية مطلقة من الفيروس. وهكذا، يعرف وحدة ها كمية الفيروس بحاجة إلى أجلوتيناتي بتساوي حجم تعليق ربك موحدة. ووفقا لمنظمة الصحة العالمية، الكمية القياسية المستخدمة للمقايسة مرحبا 4 وحدات هكتار لكل 25 ميليلتر. لتوضيح مبدأ المقايسة ها انظر الشكل 1.

الشكل 1 : مبدأ hemagglutination وتثبيط هيماجلوتينيشن. هيماجلوتينيشن لا يحدث في حالة مراقبة سلبية دون الفيروسات والأجسام المضادة (العمود الأيمن)، والكريات الحمراء هيماجلوتيناتي إلا بوجود فيروس الإنفلونزا (العمود الأوسط). ومع ذلك، يمكن أن يحدث عندما هيماغلوتينين فيروس إنفلونزا محظور بواسطة الأجسام المضادة الخاصة بالفيروس ثم لا هيماجلوتينيشن (العمود الأيمن). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
ملاحظة: كرات الدم الحمراء المستخدمة تعتمد على نوع فيروس الإنفلونزا في المقايسة (الجدول 1). علاوة على ذلك، تختلف فترة حضانة المرض، فضلا عن ظهور الخلايا غير أجلوتيناتيد للحصول على أنواع مختلفة من لوحات عيار الدقيقة 96، حسنا، (الجدول 2).
| مستضد الإنفلونزا | (H1N1) A/كاليفورنيا/7/09 | A/سويسرا/9715293/2013 (H3N2) | A/تكساس/50/2012 (H3N2) | ب/بريسبان/60/08 | ب/ماساتشوستس/02/2012 | ||
| الأنواع ربك | الدجاج | خنزير غينيا | خنزير غينيا | تركيا | تركيا | ||
الجدول 1: المستضدات الإنفلونزا والأنواع المطابقة لكرات الدم الحمراء. ووفقا لإرشادات الشركة المصنعة (NIBSC).
| الأنواع ربك | الدجاج | تركيا | خنزير غينيا | النوع البشري س |
| تركيز لكرات الدم الحمراء (v/v) | 0.75 في المائة | 0.75 في المائة | 1% | 1% |
| نوع لوحة ميكروتيتير | أسفل الخامس | أسفل الخامس | أسفل يو | أسفل يو |
| وقت الحضانة، الرايت | 30 دقيقة | 30 دقيقة | 1 ساعة | 1 ساعة |
| مظهر الخلايا غير أجلوتيناتيد | زر * | زر * | هالة | هالة |
الجدول 2: الاعتداء الشروط مع الأنواع المختلفة من كرات الدم الحمراء. ووفقا لبروتوكول منظمة الصحة العالمية. (* التدفقات عند إمالة).
-
إعداد تعليق ربك
- تمييع تعليق الأسهم ربك (10 ٪، v/v؛ باستثناء النوع البشري س) (انظر الجدول للمواد) مع الفوسفات مخزنة المالحة (PBS) جعل تركيزات السليم للطيور والثدييات في كرات الدم الحمراء 0.75 في المائة و 1 في المائة، على التوالي.

الشكل 2 : لوحة تصميم المقايسة هكتار. يتم إجراء المعايرة هكتار في التكرارات. لا يوجد مستضد أضيفت إلى الصفوف التحكم. أيضا انظر الشكل 4 لتحديد تركيز مستضد أفضل. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
-
إعداد لوحة عيار 96-البئر الصغير
ملاحظة: انظر الشكل 2 للمحة عامة عن تصميم لوحة.- إضافة 25 ميليلتر من برنامج تلفزيوني للآبار 1 إلى 12 من كل صف المستخدمة من صفيحة عيار الدقيقة 96-جيدا باستخدام الأقنية ماصة (الشكل 2). استخدم لوحة على شكل V عيار الصغرى عند العمل مع إنفلونزا الطيور كرات الدم الحمراء، مثل الدجاج وتركيا. استخدم لوحة على شكل U عيار الصغرى عند العمل مع الثدييات كرات الدم الحمراء، مثل خنزير غينيا والنوع البشري س (الجدول 2).
- إضافة 25 ميليلتر من مستضد الإنفلونزا إلى البئر الأولى المستضد الصفوف التي يتم ترتيبها في التكرارات. يتم إضافة لا مستضد على الصفوف في عنصر التحكم. لا ينبغي أن الصفوف التحكم إظهار تأثير hemagglutination وتكون بمثابة عناصر سلبية (الشكل 2).
- أداء إضعاف إضعاف مسلسل بنقل 25 ميليلتر من البئر الأولى المستضد-الصفوف إلى آبار متتالية باستخدام ماصة الأقنية. مزيج كل خطوة التخفيف من بيبيتينج صعودا وهبوطاً بلطف 10 مرات.
- تجاهل ميليلتر 25 النهائي من الآبار الأخيرة.
- إضافة 25 ميليلتر من برنامج تلفزيوني للآبار 1 إلى 12 من كل صف المستخدمة باستخدام الأقنية ماصة، بغية التوصل إلى إجمالي حجم 50 ميليلتر كل بئر.
- إضافة 50 ميليلتر من تعليق ربك كل المستخدمة جيدا باستخدام ماصة الأقنية.
- اضغط على اللوحة بعناية 10 مرات على كافة الجوانب الأربعة المزيج.
- وتغطي اللوحة مع غطاء واحتضان في درجة حرارة الغرفة للمقدار المناسب من الوقت اعتماداً ربك الأنواع المستخدمة (انظر الجدول 2). عدم نقل اللوحة حين تفرخ.
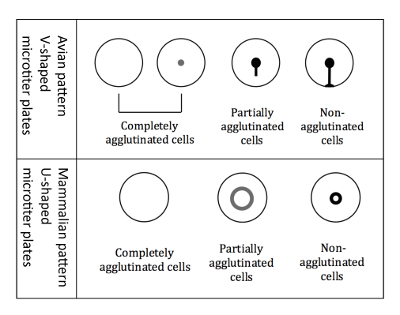
الشكل 3 : أنماط تراص للطيور والثدييات في كرات الدم الحمراء. لوحات على شكل V عيار الصغيرة المستخدمة عند العمل مع إنفلونزا الطيور كرات الدم الحمراء. تتم قراءات في وضع لوحة مائلة، وكرات الدم الحمراء غير أجلوتيناتيد بدء تشغيل أسفل تشكيل شكل مثل المسيل للدموع. لوحات ميكروتيتير على شكل U وتستخدم عند العمل مع الثدييات كرات الدم الحمراء. ثم يتم تنفيذ قراءات في موقف غير إمالة، وتشكل كرات الدم الحمراء غير أجلوتيناتيد بهالة صغيرة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
-
قراءة لوحة
ملاحظة: قراءات مختلفة قليلاً عند استخدام كرات الدم الحمراء الطيور مقارنة بالثدييات كرات الدم الحمراء، بسبب آبار مختلفة عيار الجزئي على شكل (الشكل 3).- قراءات من إنفلونزا الطيور كرات الدم الحمراء
- إمالة لوحة 90° 25 ثانية.
ملاحظة: إمالة اللوحة أمر حاسم للتفريق بين أنماط إنفلونزا الطيور، نظراً لأن جميع من ثلاثة أنواع مختلفة من أنماط تراص (أجلوتيناتيد كلياً وجزئياً أجلوتيناتيد وغير أجلوتيناتيد) يظهر كزر عندما لا يميل. - علامة النتائج فورا، بينما اللوحة لا تزال في موقف يميل، بشأن مخطط مطبوعة من لوحة 96-جيدا. وترد في الشكل 3أنماط تراص كرات الدم الحمراء إنفلونزا الطيور.
- إمالة لوحة 90° 25 ثانية.
- قراءات من الثدييات كرات الدم الحمراء
- وضع علامة على النتائج على مخطط مطبوعة من لوحة 96، حسنا، دون إمالة اللوحة (الموضع الأفقي على مقاعد البدلاء).
ملاحظة: عند حدوث هيماجلوتينيشن الخلايا أجلوتيناتيد لا تترسب في القاع، بينما تظهر الخلايا غير أجلوتيناتيد كهالة في أسفل البئر. هالة الخلايا أجلوتيناتيد جزئيا أقل كثافة والتي يبلغ قطرها أكبر (الشكل 3).
- وضع علامة على النتائج على مخطط مطبوعة من لوحة 96، حسنا، دون إمالة اللوحة (الموضع الأفقي على مقاعد البدلاء).
- تصميم 4 هكتار الوحدات.
ملاحظة: نقطة نهاية المعايرة ها هو البئر الأخيرة التي يحدث فيها هيماجلوتينيشن كاملة. ويتضمن هذا جيدا 1 هكتار وحدة من الفيروس. بسبب تخفيف إضعاف للمستضد، بئرين قبل نقطة نهاية المعايرة هكتار من البئر الذي يحتوي على 4 وحدات هكتار من الفيروسات (الشكل 4).
- قراءات من إنفلونزا الطيور كرات الدم الحمراء

الشكل 4 : قراءات للمعايرة هكتار مع إنفلونزا الطيور كرات الدم الحمراء لتحديد عيار 4 هكتار الوحدات. مستضد مثلى المبلغ المطلوب ل hemagglutination يقاس بمقايسة hemagglutination (مستضد معايرة الإنزيم). بئر الماضي حيث يحدث hemagglutination كاملة نقطة نهاية المعايرة هكتار ويحتوي على 1 هكتار وحدة. بسبب تخفيف إضعاف للمستضد، بئرين قبل نقطة نهاية المعايرة هكتار، يناظر عيار 4 هكتار الوحدات. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
5-مرحبا بالانزيم
ملاحظة: قد تم تحسين تدفق العمل البروتوكول للسماح معالجة أكثر كفاءة من عينات متعددة في نفس الوقت، باستخدام PCR أنبوب المشارب و cycler حرارية (انظر أدناه).
-
إعداد عينات المصل
ملاحظة: تحضير عينات المصل في مختبر BSL-2.- ذوبان الجليد عينات مصلية المجمدة لكل نقطة الوقت لكل شخص (راجع الخطوة 1، 2) في درجة حرارة الغرفة.
- إضافة قاسمة 10 ميليلتر من كل عينة المصل المذابة إلى أنبوب قطاع أنابيب PCR (10-أنابيب في قطاع واحد).
ملاحظة: ميزة كبيرة لاستخدام شرائط أنبوب PCR أنه يمكن استخدام ماصة متعددة القنوات للخطوات التالية في مقايسة مرحبا؛ وهذا يوفر الكثير من الوقت عند اختبار كمية كبيرة من عينات مصلية وعند أداء تكرار التدابير نفس العينات لجسم التتر ضد سلالات مختلفة من الفيروس. - تخزين عينات مصلية الكوتيد في شرائط أنبوب PCR في-80 درجة مئوية حتى الاستخدام.
- يوم واحد قبل إجراء الفحص مرحبا، ذوبان الجليد مختبرين عينة المصل من الفائدة في درجة حرارة الغرفة.
- إضافة 10 ميليلتر من المصل المضاد المناسب لأنبوب PCR فارغة.
ملاحظة: لتكون بمثابة عنصر إيجابي، يجب أن تطابق المصل المضاد ضد فيروس محددة الفيروس المستخدمة. يسمح عنصر التحكم إيجابية لتوحيد الأداء لوحة عبر لوحات متعددة. - إضافة 30 ميليلتر من الكوليرا فيلتراتي حل لكل قاسمة المصل والمصل المضاد (3 مجلدات من filtrate الكوليرا إلى حجم 1 من المصل) باستخدام ماصة متعددة القنوات.
- تبقى أنابيب PCR في رف بكر 96-جيدا أو مربع تلميح فارغ ودوامه ل 5 ق.
- احتضان هذه العينات بين عشية وضحاها في 37 درجة مئوية باستخدام cycler حرارية.
- احتضان هذه العينات في 56 درجة مئوية لمدة 30 دقيقة لإلغاء تنشيط filtrate الكوليرا cycler حرارية استخدام.
ملاحظة: اعتماداً على cycler الحرارية، يمكن برمجة هذه الخطوة زيادة أتمتة العملية. - تبقى أنابيب PCR في رف بكر 96-جيدا أو مربع تلميح فارغ ودوامه ل 5 ق.
- تخزين العينات في 4 درجات مئوية في الثلاجة حتى الاستخدام للمقايسة مرحبا.

الشكل 5 : لوحة تصميم وسير العمل للمقايسة مرحبا. ويمكن قياس خمس نقاط زمنية لشخصين على لوح واحد. عيار مرحبا يتراوح بين 8 إلى 1,024. مصل المضاد للمستضد تستخدم بمثابة عنصر إيجابي وأنجز معايرة مرة أخرى للتحقق من حالة تمييع مستضد يساوي 4 هكتار الوحدات. يتم عرض المسلسل تمييع عينة المصل لمتلقي اللقاحات الفردية 2. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
-
مرحبا الإنزيم
ملاحظة: لتوضيح مبدأ المقايسة مرحبا انظر الشكل 1. تبعاً للفيروس، وتستخدم أنواع مختلفة من كرات الدم الحمراء للمقايسة (الجدول 1). وتستخدم الأنواع المختلفة من كرات الدم الحمراء في أنواع مختلفة من لوحات 96-جيدا، وتختلف فترة حضانة المرض، فضلا عن ظهور الخلايا غير أجلوتيناتيد (الجدول 2). للمقايسة مرحبا، 4 وحدات هكتار من الفيروسات أو مستضد تضاف إلى سلسلة إضعاف إضعاف من العينات.-
إعداد الحل مستضد
- حساب حجم الحل مستضد اللازمة وفقا لعدد لوحات 96-كذلك تستخدم (25 ميليلتر مستضد الواحدة × 96 = 2,400 ميليلتر مستضد جيدا كل لوح 96-جيدا؛ إضافة 100 ميليلتر كل لوح إضافي بسبب استخدام خزان للأقنية ماصة؛ ما مجموعة 2.5 مل أنتيجي n للوحة الواحدة).
ملاحظة: على سبيل المثال، إذا كان قياس عينات مصلية 100 ثم 10 لوحات المطلوبة (10 عينات للوحة الواحدة): 2.5 مل × 10 = 25 مل من محلول مستضد حاجة في المجموع. - إعداد تمييع 4 هكتار وحدات مناسبة لحجم المحسوبة باستخدام برنامج تلفزيوني.
ملاحظة: يتم تحديد 4 هكتار وحدات للمقايسة هكتار. للمقدار المناسب من مستضد، تقسيم حجم المحسوبة بعيار الموافق 4 هكتار وحدات. على سبيل المثال، 4 هكتار وحدات تتوافق مع إضعاف 1/64، ونحن بحاجة 15,000 هناك حاجة ميليلتر حل مستضد: 15,000/64 = 234.4 ميليلتر مستضد الإنفلونزا المجففة بالتبريد المذاب يتم إضافتها.
- حساب حجم الحل مستضد اللازمة وفقا لعدد لوحات 96-كذلك تستخدم (25 ميليلتر مستضد الواحدة × 96 = 2,400 ميليلتر مستضد جيدا كل لوح 96-جيدا؛ إضافة 100 ميليلتر كل لوح إضافي بسبب استخدام خزان للأقنية ماصة؛ ما مجموعة 2.5 مل أنتيجي n للوحة الواحدة).
-
إعداد تعليق ربك
- حساب حجم تعليق ربك اللازمة وفقا لعدد لوحات عيار الدقيقة 96-كذلك تستخدم (50 تعليق ربك ميليلتر الواحدة وكذلك × 96 = 4,800 ميليلتر ربك تعليق كل لوح 96-جيدا؛ إضافة 200 ميليلتر كل لوح إضافي بسبب استخدام خزان ماصة الأقنية) .
- تمييع تعليق الأسهم ربك (عادة 10%، والخامس/الخامس؛ باستثناء النوع البشري س) مع برنامج تلفزيوني لجعل تركيزات السليم للطيور والثدييات في كرات الدم الحمراء 0.75 في المائة و 1 في المائة، على التوالي.
-
إعداد لوحة عيار 96-البئر الصغير
- قم بتسمية لوحات عيار الدقيقة 96-جيدا (معرف عينة والتحكم الإيجابي ومعايرة مرة أخرى). الرجاء التحقق من اتجاه لوحة في الشكل 5 بعناية.
- إضافة 25 ميليلتر من برنامج تلفزيوني لكل بئر ما عدا إلى البئر الأولى الصف "إلى معايرة" (الشكل 5، 12ث صف) باستخدام ماصة متعددة القنوات.
ملاحظة: أجرى معايرة مرة أخرى للتحقق من حالة تمييع مستضد المستخدمة يساوي 4 هكتار وحدات. يشار إلى مستضد عيار 4 هكتار وحدات إذا هيماجلوتينيشن يحدث في الآبار الثلاث الأولى من الصف "إلى المعايرة" ولكن ليس في الرابع أيضا. - إضافة 50 ميليلتر الحل مستضد استعداد (الموصوفة في 5.2.1) إلى البئر الأولى من الصف "إلى معايرة" (صفال 12).
- إضافة 25 ميليلتر من العينات المعالجة باستخلاص المصل إلى الآبار الأولى للصفوف من 1 إلى 10 على كل لوحة، باستخدام ماصة متعددة القنوات.
- إضافة 25 ميليلتر من المصل المضاد المناسب للبئر الأولى للصفال 11 كعنصر إيجابي.
- إجراء تخفيف إضعاف المسلسل بنقل 25 ميليلتر من البئر الأولى لكل صف (1-12) إلى آبار متتالية باستخدام ماصة الأقنية. مزيج من بيبيتينج صعودا ونزولاً من 10-15 مرة لكل خطوة من خطوات تمييع. يمكن استخدام نفس نصائح لكل خطوة تمييع كل عينة.
- تجاهل ميليلتر 25 النهائي من الآبار الأخيرة.
- إضافة 25 ميليلتر من مستضد الحل باستخدام ماصة متعددة القنوات لكل بئر من الصفوف 1 إلى 11 (عينات المصل والمصل المضاد). يمكن استخدام نفس نصائح إذا أنها لا تلمس الآبار.
- إضافة 25 ميليلتر من برنامج تلفزيوني بدلاً من antigen لكل بئر من الصف "إلى معايرة" (صفال 12).
- اضغط على اللوحة بعناية 10 مرات على كافة الجوانب الأربعة المزيج.
- وتغطي اللوحة مع غطاء واحتضان في درجة حرارة الغرفة لمدة 30 دقيقة. عدم نقل اللوحة حين تفرخ.
- إضافة 50 ميليلتر من تعليق ربك لكل بئر.
- اضغط على اللوحة بعناية 10 مرات على كل الأطراف 4 لمزيج.
- وتغطي اللوحة مع غطاء واحتضان في درجة حرارة الغرفة للمقدار المناسب من الوقت اعتماداً ربك الأنواع المستخدمة (انظر الجدول 2). عدم نقل اللوحة حين تفرخ.
-
قراءة لوحة
ملاحظة: هو عيار مرحبا المتبادلة لتمييع (مضادات) المصل الذي يمنع تماما هيماجلوتينيشن الماضي. من المهم أن تنظر أن كان الفعل المخفف الأمصال المعالجة باستخلاص 1:4 وبعد الخطوة تمييع المسلسل، وسيرا في الآبار الأولى المخفف 1:8، الذي يقابل عيار مرحبا من 8.- قراءات من إنفلونزا الطيور كرات الدم الحمراء
- إمالة لوحة 90° 25 ثانية.
ملاحظة: إمالة اللوحة أمر حاسم للتفريق بين أنماط إنفلونزا الطيور، نظراً لأن جميع من ثلاثة أنواع مختلفة من أنماط تراص (أجلوتيناتيد كلياً وجزئياً أجلوتيناتيد وغير أجلوتيناتيد) يظهر كزر عندما لا يميل. - علامة النتائج فورا، بينما اللوحة لا تزال في موقف يميل، بشأن مخطط مطبوعة من لوحة 96-جيدا. يتم عرض أنماط تراص إنفلونزا الطيور كرات الدم الحمراء في الشكل 3.
- إمالة لوحة 90° 25 ثانية.
- قراءات من الثدييات كرات الدم الحمراء
- وضع علامة على النتائج على مخطط مطبوعة من لوحة 96، حسنا، دون إمالة اللوحة.
ملاحظة: عند حدوث هيماجلوتينيشن الخلايا أجلوتيناتيد لم يستقر حين تظهر الخلايا غير أجلوتيناتيد كهالة في أسفل البئر. هالة الخلايا أجلوتيناتيد جزئيا أقل كثافة والتي يبلغ قطرها أكبر (الشكل 3). - تحديد مرحبا لكل عينة ونقلها إلى طاولة الحاسوب (الشكل 6)
- ملاحظة: تم تحديد آبار أجلوتيناتيد جزئيا كعيار أقل. على سبيل المثال، إذا كانت عينة مصل يمنع تماما هيماجلوتينيشن ما يصل إلى 4 جيدا (تمييع 1:64) و 5th جيدا جزئيا هو أجلوتيناتيد (تمييع 1:128)، ثم يتم تعيين عيار مرحبا بعيار أقل 64 للتحليل النهائي (الشكل 6، الصفال 4).
- وضع علامة على النتائج على مخطط مطبوعة من لوحة 96، حسنا، دون إمالة اللوحة.
- قراءات من إنفلونزا الطيور كرات الدم الحمراء
-
إعداد الحل مستضد

الرقم 6 : قراءات للمقايسة مرحبا بكرات الدم الحمراء الطيور. ما قبل وما بعد التطعيم الناجم عن الإنفلونزا استجابة جسم معين يحدده مرحبا المقايسة. في هذا المثال، شخص واحد لديه أعلى مرحبا التتر من شخص اثنين. إظهار كلا الشخصين استجابة الأجسام المضادة بعد التطعيم؛ 180 يوما بعد التلقيح التتر جسم كل الأشخاص انخفضت مرة أخرى. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Access restricted. Please log in or start a trial to view this content.
النتائج
استجابة جسم المستحث ما قبل وما بعد التطعيم ضد الإنفلونزا أ H3N2
تم تقييم استجابة الأجسام المضادة الناجمة عن اللقاحات في 26 صحية من المتطوعين الذين تلقوا لقاح إنفلونزا المعطل فرعية للتنسيق المحتوية على إنفلونزا A/H1N1/كاليفورنيا/2009، A/H3N2/تكساس/2012 وب/ماساتشوستس/02/2012 ق...
Access restricted. Please log in or start a trial to view this content.
Discussion
القياس الكمي لما قبل وبعد التطعيم ضد الإنفلونزا الفيروس أضداد معينة التتر أداة هامة ضرورية للدراسات لقاح. تستند إلى تدابير بديلة للحماية ضد الإصابة بعدوى الفيروس، مثل سيروبروتيكشن (> 01:40) أو السيرولوجي (زيادة عيار النوبات)، يمكن أن تكون استراتيجيات التطعيم الأمثل9. استخدام ال?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وأيده عبد اللطيف. المنح بحثية من برنامج "نقاط أمبيزيوني سنسف" (PZ00P3_154709)، "فورشونجسفوند، Förderung ستراتيجيشير بروجيكتي" جامعة بازل وأزل ستيفتونجسينفيكتيونسكرانخيتين Stiftung رينر بانجيتير. وأيد ل. ك. منحة من جامعة غراتس "التقنية، النمسا". ج. ل. تعترف الدعم بزمالة إيفد مبادرة SystemsX.ch في نظم برنامج البيولوجيا (استدعاءال 9).
Acknowledgements
لا شيء.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 25 ml Disposable Multichannel Pipette Reservoirs | Integra | 4312 | |
| 8-well PCR tubes | Brand GMBH | 781332 | For serum aliquots |
| 96-well microtiter plate, U-shaped | TPP | 92097 | For HI assay when using mammalian RBCs |
| 96-well microtiter plate, V-shaped | Corning Costar | 3897 | For HI assay when using avian RBCs |
| Aqua ad iniect. Steril | Bichsel AG | 1000004 | For preparing influenza antigen and cholera filtrate solutions |
| Chicken RBC (10%) | Cedarlane | CLC8800 | 10% suspension of chicken red blood cells in Alsever's solution |
| Cholera filtrate | Sigma-Aldrich | C8772 | Used as receptor destroying enzyme (RDE) |
| Dulbecco's PBS | Sigma-Aldrich | D8537 | For diluting the serum samples, RBCs and antigens |
| Eppendorf Multichannel pipette, 12-channel, 10-100 µl | Sigma-Aldrich | Z683949 | |
| Eppendorf Multichannel pipette, 8-channel, 10-100 µl | Sigma-Aldrich | Z683930 | |
| Guinea Pig RBC (10%) | Cedarlane | CLC1800 | 10% suspension of guinea pig red blood cells in Alsever's solution |
| Influenza Anti-A/California/7/09 HA serum | NIBSC | 14/134 | Used as positive control at the HI assay |
| Influenza Anti-A/Switzerland/9715293/2013-like HA serum | NIBSC | 14/272 | Used as positive control at the HI assay |
| Influenza Anti-A/Texas/50/2012-Like HA Serum | NIBSC | 13/178 | Used as positive control at the HI assay |
| Influenza Anti-B/Brisbane/60/2008-HA serum | NIBSC | 13/254 | Used as positive control at the HI assay |
| Influenza Anti-B/Massachusetts/02/2012 HA serum | NIBSC | 13/182 | Used as positive control at the HI assay |
| Influenza antigen A/California/7/09 (H1N1)(NYMC-X181) | NIBSC | 12/168 | Inactivated, partially purified A/California/7/09 (H1N1)(NYMC-X181) virus (ca. 46µgHA/ml) |
| Influenza antigen A/Switzerland/9715293/2013 (NIB88) | NIBSC | 14/254 | Inactivated, partially purified A/Switzerland/9715293/2013 (NIB88) virus (ca. 55µgHA/ml) |
| Influenza antigen A/Texas/50/2012 (H3N2)(NYMCX-223) | NIBSC | 13/112 | Inactivated, partially purified A/Texas/50/2012 (H3N2)(NYMCX-223) virus (ca. 74µgHA/ml) |
| Influenza antigen B/Brisbane/60/2008 | NIBSC | 13/234 | Inactivated, partially purified B/Brisbane/60/2008 virus (ca. 42µgHA/ml) |
| Influenza antigen B/Massachusetts/02/2012 | NIBSC | 13/134 | Inactivated, partially purified B/Massachusetts/02/2012 virus (ca. 35µgHA/ml) |
| Serum-Tubes | S-Monovette, Sardstedt | 01.1601.100 | For serum extraction with clotting activator |
| Single Donor Human RBC, Type 0 | Innovative Research | IPLA-WB3 | Suspension of single donor human red blood cells in Alsever's solution (ca. 26%) |
| Turkey RBC (10%) | Cedarlane | CLC1180 | 10% suspension of turkey red blood cells in Alsever's solution |
| Phosphate Buffered Saline (PBS) | Gibco |
References
- Prevention and control of seasonal influenza with vaccines. Recommendations of the Advisory Committee on Immunization Practices--United States, 2013-2014. MMWR Recomm Rep. 62, Centers for Disease, C. & Prevention. RR-07 1-43 (2013).
- Dominguez-Cherit, G., et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 302 (17), 1880-1887 (2009).
- Fox, B. D., et al. Pandemic influenza (H1N1): impact on lung transplant recipients and candidates. J Heart Lung Transplant. 29 (9), 1034-1038 (2010).
- Piercy, J., Miles, A., Krankheiten, S. B. fG. S. V., Values, M. The Economic Impact of Influenza in Switzerland: Interpandemic Situation. , Swiss Federal Office of Public Health, Division of Epidemiology and Infectious Diseases, Section of Viral Diseases and Sentinel Systems. (2003).
- Barclay, V. C., et al. Positive network assortativity of influenza vaccination at a high school: implications for outbreak risk and herd immunity. PLoS One. 9 (2), 87042(2014).
- Baluch, A., et al. Randomized controlled trial of high-dose intradermal versus standard-dose intramuscular influenza vaccine in organ transplant recipients. Am J Transplant. 13 (4), 1026-1033 (2013).
- Haralambieva, I. H., et al. The Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in Older Subjects. PLoS One. 10 (3), 0122282(2015).
- Egli, A., et al. Vaccine adjuvants--understanding molecular mechanisms to improve vaccines. Swiss Med Wkly. 144, 13940(2014).
- O'Shea, D., Widmer, L. A., Stelling, J., Egli, A. Changing face of vaccination in immunocompromised hosts. Curr Infect Dis Rep. 16 (9), 420(2014).
- Meulemans, G., Carlier, M. C., Gonze, M., Petit, P. Comparison of hemagglutination-inhibition, agar gel precipitin, and enzyme-linked immunosorbent assay for measuring antibodies against influenza viruses in chickens. Avian Dis. 31 (3), 560-563 (1987).
- Martins, T. B. Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile. Clin Diagn Lab Immunol. 9 (1), 41-45 (2002).
- Webster, R., Cox, N., Stöhr, K. WHO Animal Influenza Manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
- Mittelholzer, C. M., et al. Human cell lines used in a micro neutralization test for measuring influenza-neutralizing antibodies. Scand J Immunol. 63 (4), 257-263 (2006).
- Hamilton, R. S., Gravell, M., Major, E. O. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol. 38 (1), 105-109 (2000).
- Kumakura, S., et al. Comparison of hemagglutination inhibition assay and enzyme immunoassay for determination of mumps and rubella immune status in health care personnel. J Clin Lab Anal. 27 (5), 418-421 (2013).
- Ogundiji, O. T., Okonko, I. O., Adu, F. D. Determination of measles hemagglutination inhibiting antibody levels among school children in Ibadan, Nigeria. J Immunoassay Immunochem. 34 (2), 208-217 (2013).
- Cwach, K. T., Sandbulte, H. R., Klonoski, J. M., Huber, V. C. Contribution of murine innate serum inhibitors toward interference within influenza virus immune assay. Influenza Other Respir Viruses. 6 (2), 127-135 (2012).
- Lee, P. S., et al. Receptor mimicry by antibody F045-092 facilitates universal binding to the H3 subtype of influenza virus. Nat Commun. 5, 3614(2014).
- Blumel, B., et al. Age-related prevalence of cross-reactive antibodies against influenza A(H3N2) variant virus, Germany, 2003 to 2010. Euro Surveill. 20 (32), 16-24 (2015).
- Reber, A. J., et al. Seasonal Influenza Vaccination of Children Induces Humoral and Cell-Mediated Immunity Beyond the Current Season: Cross-reactivity with Past and Future Strains. J Infect Dis. , (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved