Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оптимизированный Hemagglutination Assay ингибирование (HI) поддается гриппа специфические антитела титры
* Эти авторы внесли равный вклад
В этой статье
Резюме
Представлены протоколы описывают, как выполнять пробирного торможение гемагглютинации поддается титры гриппа специфические антитела от образцов сыворотки получателей вакцины против гриппа. Первая проба определяет оптимальный вирусного антигена концентрации гемагглютинации. Вторая проба дает количественную оценку гриппа специфические антитела титры на торможение гемагглютинации.
Аннотация
Титры антител часто используются в качестве суррогатных маркеров для серологических защиты против гриппа и других патогенов. Для понимания вакцины индуцированной иммунитет требуется детальное знание продукции антитела до и после вакцинации. Эта статья описывает надежный протокол точка за точкой для определения гриппа специфические антитела титры. Первый протокол описывает метод для определения антигена сумм, требуемых для гемагглютинации, которая стандартизирует концентрации для последующего использования во втором протоколе (hemagglutination assay, пробирного HA). Второй протокол описывает количественная оценка титры гриппа специфические антитела против различных вирусных штаммов, используя последовательный разбавление человеческой сыворотки или клетки культуры supernatants (пробирного торможение гемагглютинации, Привет пробирного).
В качестве примера прикладной мы показываем реакции антитела здорового когорты, который получил трехвалентного инактивированной противогриппозной вакцины. Кроме того показано перекрестной реактивности между различными гриппа и описаны методы для сведения к минимуму перекрестной реактивности с использованием различных типов животных красных кровяных телец (эритроцитов). Обсуждение освещает преимущества и недостатки представленных анализов и как определение титры гриппа специфические антитела могут улучшить понимание связанных с вакциной иммунитета.
Введение
Заражение вирусом гриппа связано с значительным заболеваемости, смертности и высокие расходы на здравоохранение в1,2,3,4. В частности пожилых людей, новорожденных, беременных женщин и пациентов с хронической болезнью подвергаются риску для более серьезных клинических исходов. Таким образом вакцинация против циркулирующих штаммов вируса гриппа является основной мерой для уменьшения бремени болезней в этих групп риска. Увеличение индивидуальной иммунной реакции после вакцинации, например, грипп специфические антитела выше защитная порога, уменьшает индивидуальный риск заражения и в общем вероятность передачи вируса среди населения 5. глубокое понимание вакцины индуцированной гуморального иммунного ответа в различных популяциях и через различных возрастных групп является ключевым элементом для ответа важные клинические вопросы6,,78 , 9, такие как: почему у некоторых пожилых пациентов инфекции несмотря на предыдущей вакцинации? Что такое «хорошо» и «достаточной» вакцина индуцированной защита? Как часто следует применять к ослабленным пациенту достичь защитные титры вакцины? Что является наиболее эффективным дозировка? Что такое влияние новых адъювантов на титры антител после вакцинации? Измерение вакцины специфических антител может помочь ответить на эти важные вопросы и улучшить результаты вакцинации.
Количественная оценка титры вирус специфических антител может выполняться с различными иммунологических методов. Это включает в себя твердофазный10 или на основе бисера assays ELISA11 , Привет пробирного12и нейтрализации анализов13. Методы, основанные на ИФА позволяют скрининг относительно большое количество образцов сыворотки против различных антигенов. Кроме того можно отдельно изучить возбудителя-иммуноглобулина М (Ig) и IgG. Хотя характеристики антиген, например, линейные аминокислотной последовательности или вирусоподобных частиц может повлиять связывание антител, спектр потенциальных epitopes очень широк и не предоставляют информацию о ли антитела Ответ имеет функциональное значение.
В противоположность этому нейтрализация assay определяет потенциал антител функционально подавлять заражения клеток и таким образом отражает нейтрализации потенциальных. Однако этот метод является очень трудоемким, требует культивирование специфических клеток линии и жить вирусы, и поэтому она является длительным, дорогостоящим и требует специального оборудования.
Эта статья описывает шаг за шагом на основе Всемирной организации здравоохранения ВОЗ Привет протокол12 к количественно гриппа специфические антитела титры. Hemagglutination является характерным эффект некоторых вирусов, ведущих к Агглютинация эритроцитов. Ингибирование этот эффект с пациентами сыворотки позволяет измерения концентрации ингибирующее антитела, который отражает нейтрализующего эффекта.
Мы изменили процесс ВОЗ-протокола позволяет более эффективной обработки нескольких образцов в то же время и тем самым уменьшая необходимое время. Первый протокол описывает определение агглютинации потенциал конкретного гриппа антигена. Поступая таким образом, для второго протокола определяется концентрация антигена правильный гриппа. Эта часть должна быть повторена с каждой новой вирусного антигена, так как каждая партия крови.
Второй протокол описывает определение гриппа специфические антитела титры. Представлены протоколы оптимизированы для расследования вируса гриппа и образцы сыворотки крови человека, однако, он также может применяться для образцов сыворотки мыши или supernatants культуры клеток от стимулированных иммунокомпетентных клеток, например, вирус специфических B-клетки. Результаты могут быть определены как абсолютных измерений титры. Во многих исследованиях вакцины геометрическое титры и 95% доверительный интервал отображаются для каждого конкретного населения. Для интерпретации, серопротекции или сероконверсия часто используются для описания восприимчивость населения к определенным вирусом. Серопротекции определяется как титр ≥1:40 и сероконверсии, ростом более чем 4 раза титр с достижением титры seroprotective между двумя моментами времени (наиболее часто используются предварительно вакцинации и 30 дней после вакцинации).
Оба протокола, просты в использовании, и они могут быть адаптированы к широкому спектру вопросов исследования. В частности, они могут использоваться для определения надежно и быстро титры антител против различных других вирусов с емкостью для гемагглютинации, например, краснухи, эпидемического паротита, кори и polyomaviruses14,15,16 .
Access restricted. Please log in or start a trial to view this content.
протокол
Протоколы обучения были утверждены через местные этические Наблюдательный Совет (www.EKNZ.ch) и письменное информированное согласие было получено от всех участников.
1. сыворотка коллекция
- Сбор образцов сыворотки от людей на времени точек интереса. Для этого исследования мы собрали сера дней 0 (время вакцинации против гриппа), + 7, + 30, 60 и 180 после вакцинации.
- Для получения сыворотки, центрифуга пробоотборные трубки на 1200 x g 10 мин при комнатной температуре (20-25 ° C).
Примечание: Образцы крови центрифугируется не следует хранить при 4 ° C и не более 24 ч. - Алиготе сыворотки в различные трубы (крио ампул) и замораживания при температуре-80 ° C до использования.
- Выполнение последующих анализов экстракторах, включая все время точки одного человека для уменьшения изменчивости в пациента.
2. Подготовка антигены
Предупреждение: Используются пять различных антигенов (см. Таблицу материалы). Подготовьте антигенов в лаборатории биобезопасности уровня 2 (BSL-2).
- Согласно инструкциям производителя воссоздания общее содержимое одной ампуле антигена лиофилизированные гриппа в 1,0 мл дистиллированной воды и позволяют растворенного антигена стоять не менее 5 мин при комнатной температуре перед продолжением.
- Аликвота антигена решение 1,5 мл пробирок и заморозить при температуре-80 ° C до дальнейшего использования.
3. Подготовка холеры фильтрата
Примечание: Холера фильтрат используется как рецептор, уничтожив фермента (РДЭ) согласно ВОЗ протокол12. Это удаляет врожденной ингибиторы из сыворотки, которая будет мешать пробирного17.
- Воссоздать лиофилизированные РДЭ согласно инструкциям производителя.
- Храните РДЭ решение в 15 мл на 4 ° C до дальнейшего использования.
4. га Assay
Примечание: Для обеспечения сопоставимости между несколькими пластинами Привет анализов, то же количество вирусных частиц должен использоваться для каждой пластины. HA (также называемый HA титрование) выполняется для количественного определения необходимых для гемагглютинации частицы вируса и записывается в единицах HA. «Единица» гемагглютинации является оперативное подразделение, зависит от метода, используемого для HA титрования и не является измерение абсолютного количества вируса. Таким образом HA единица определяется как количество вируса, необходимо склееных равное количество стандартизированных подвеска РБК. По данным ВОЗ стандартный размер, используемый для HI assay-4 HA единиц в 25 мкл. Для иллюстрации принципа HA assay смотрите Рисунок 1.

Рисунок 1 : Принцип гемагглютинации и торможение гемагглютинации. Не гемагглютинации происходит в отрицательный контроль ситуации без вирусов и антител (левая колонка) и эритроцитах hemagglutinate только в присутствии вируса гриппа (средний столбец). Однако, когда гемагглютинина вируса гриппа блокируется вирус специфических антител, то не гемагглютинации может произойти (правая колонка). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Примечание: Используемые RBCs зависит от типа вируса гриппа в assay (Таблица 1). Кроме того для различных типов плит 96-луночных микро титр, время инкубации, а также внешний вид ячеек не склеенный отличаются (Таблица 2).
| Гриппа антиген | A/California/7/09 (H1N1) | A/Швейцария/9715293/2013 (H3N2) | A/Техас/50/2012 (H3N2) | B/Брисбен/60/08 | B/Массачусетс/02/2012 | ||
| Виды РБК | Курица | Морская свинка | Морская свинка | Турция | Турция | ||
Таблица 1: гриппа антигены и соответствующих видов БС. Согласно инструкциям изготовителя (NIBSC).
| Виды РБК | Курица | Турция | Морская свинка | O тип человека |
| Концентрации эритроцитов (v/v) | 0.75% | 0.75% | 1% | 1% |
| Тип плиты микротитровальных | V снизу | V снизу | U снизу | U снизу |
| Время инкубации, RT | 30 мин. | 30 мин. | 1 час | 1 час |
| Внешний вид-склеенный ячеек | Кнопку * | Кнопку * | гало | гало |
Таблица 2: Assay условий с разными видами RBCs. Согласно протоколу ВОЗ. (* протекает при наклоне).
-
Приготовление суспензии РБК
- Разбавить РБК акции подвески (10%, v/v; за исключением человеческого типа O) (см. Таблицу материалы) с фосфатом буфер солевой раствор (PBS), с тем чтобы сделать надлежащий концентрации для птиц и млекопитающих RBCs 0,75% и 1%, соответственно.

Рисунок 2 : Пластина дизайн ха assay. HA Титрование осуществляется в дубликаты. Антиген не был добавлен в строках элемента управления. Также см. Рисунок 4 для определения лучших концентрации антигена. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
-
Подготовка 96-луночных микро титр пластины
Примечание: Обзор дизайн плита рис.- Добавьте 25 мкл PBS скважин 1-12 каждой используемой строке 96-луночных микро титр пластины с помощью многоканальные пипетки (рис. 2). При работе с птичьим RBCs, как курица и Турции используйте микро титр, V-образные пластины. При работе с млекопитающих RBCs, как морская свинка и человеческого типа O (Таблица 2), используйте микро титр, U-образные пластины.
- Добавьте 25 мкл гриппа антигена в первой скважины антиген-строк, которые расположены в дубликаты. Не антиген добавляется в строках элемента управления. Строки элемента управления не должны показать эффект гемагглютинации и служат негативный контроль (рис. 2).
- Выполните последовательный 2 раза разрежения путем передачи 25 мкл от первой скважины антиген-строк последовательных скважин с помощью многоканальных дозаторов. Mix каждый шаг в разбавления закупорить вверх и вниз осторожно 10 раз.
- Сбросить окончательные 25 мкл последних скважин.
- Добавьте 25 мкл PBS скважин 1-12 из каждой строки, используемые с помощью многоканальные пипетки, достигнуть суммарный объем 50 мкл в колодец.
- Добавьте 50 мкл суспензии РБК в каждую используется также с помощью многоканальных дозаторов.
- Нажмите пластины тщательно 10 раз на всех четырех сторонах смешивать.
- Крышка с крышкой и инкубировать и при комнатной температуре на соответствующее количество времени в зависимости от используемого вида РБК (см. таблицу 2). Не перемещайте пластины при инкубации.
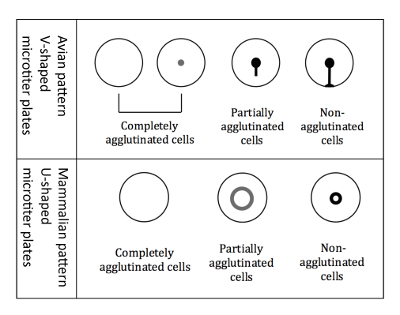
Рисунок 3 : Агглютинации виды птиц и млекопитающих RBCs. V-образный микро титр пластины используются при работе с птичьим эритроцитов. Индикация производится в положении наклонной пластине, и не склеенный эритроциты начинают бежать вниз формирования слезоточивый образную форму. Микротитровальных U-образные пластины используются при работе с млекопитающих эритроцитов. Индикация затем выполняется в положении, не наклонена, а -склеенный RBCs образуют небольшой ореол. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
-
Читая пластины
Примечание: Индикация немного отличается, при использовании птичьего RBCs, по сравнению с млекопитающих RBCs, из-за различные формы микро титр скважин (рис. 3).- Индикация птичьего эритроцитов
- Наклона пластины 90° для 25 s.
Примечание: Наклона пластины имеет решающее значение для дифференциации птичьего шаблонов, потому что все три различных типа шаблонов агглютинации (полностью склеенный, частично склеенный и не склеенный) появляются как кнопку, когда не наклонена. - Марк результаты немедленно, в то время как плита находится все еще в наклонном положении, на печатной схеме 96-луночных пластины. Аглютинация модели птичьего RBCs показаны на рисунке 3.
- Наклона пластины 90° для 25 s.
- Индикация млекопитающих эритроцитов
- Марк результаты на печатной схеме 96-луночных пластины, не наклоняя пластину (горизонтальное положение на стенде).
Примечание: При возникновении гемагглютинации, agglutinated клетки не оседают на дно, а не склеенный клетки появляются как гало в нижней части скважины. Гало частично agglutinated клеток менее интенсивным и имеет больший диаметр (рис. 3).
- Марк результаты на печатной схеме 96-луночных пластины, не наклоняя пластину (горизонтальное положение на стенде).
- Определение единиц 4 га.
Примечание: HA титрования конечной точки является последний хорошо, где происходит полное гемагглютинации. Это хорошо содержит 1 HA единица вируса. Из-за 2 раза разведений антигена две скважины впереди HA конечной точки титрования является хорошо, содержащий 4 единицы HA вируса (рис. 4).
- Индикация птичьего эритроцитов

Рисунок 4 : Индикация HA титрования с птичьим RBCs для определения титра 4 HA единиц. Оптимальное антигена сумма, необходимая для гемагглютинации измеряется hemagglutination assay (пробирного титрирование антигена). Последний также, где происходит полное гемагглютинации HA конечной точки титрования и содержит 1 HA единица. Из-за 2 раза разведений антигена, две скважины впереди HA конечной точки титрования, титр соответствует 4 HA единиц. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
5. Привет Assay
Примечание: Рабочий поток протокола был оптимизирован для позволяют более эффективной обработки нескольких образцов в то же время, с помощью ПЦР трубку полосы и термо циклователь (см. ниже).
-
Подготовка образцов сыворотки
Примечание: Подготовка образцов сыворотки в лаборатории BSL-2.- Оттепель замороженных сыворотки образцы каждой точке времени каждого человека (см. шаг 1.2) при комнатной температуре.
- Добавьте Алиготе 10 мкл каждого образца талой сыворотки трубки ПЦР трубки газа (10-трубы в одну полоску).
Примечание: Большое преимущество с помощью ПЦР трубки полоски является что многоканальные пипетки может использоваться для следующих шагов в HI assay; Это экономит много времени при тестировании большое количество образцов сыворотки и при повторном выполнении мер же образцов для титры антител против различных вирусных штаммов. - Храните образцы aliquoted сыворотки в полоски трубки ПЦР-80 ° c до использования.
- Один день до HI генотипирования, оттепель аликвоты образцов сыворотки интерес при комнатной температуре.
- Добавление пустой ПЦР-пробирку 10 мкл соответствующего сыворотки.
Примечание: В качестве позитивного управления, сыворотки против конкретных вирус должен соответствовать используется вирусом. Положительный контроль позволяет для стандартизации исполнении пластину через несколько пластин. - Мкл 30 холеры фильтрата раствора для каждого сыворотки Алиготе и сыворотки (3 тома холеры фильтрата 1 объем сыворотки) с помощью многоканальных дозаторов.
- Держите ПЦР трубы в PCR 96-луночных стойку или пустой подсказка box и вихревые для 5 s.
- Проинкубируйте образцы на ночь при 37 ° C, с помощью термо cycler.
- Проинкубируйте образцы на 56 ° C за 30 минут, чтобы инактивировать холеры фильтрата, с помощью термо cycler.
Примечание: В зависимости от термо велосипедист, этот шаг может быть запрограммирован для дальнейшей автоматизации процесса. - Держите ПЦР трубы в PCR 96-луночных стойку или пустой подсказка box и вихревые для 5 s.
- Храните образцы на 4 ° C в холодильник до использования для HI assay.

Рисунок 5 : Пластина дизайн и процесс анализа HI. Пять точек времени два народа могут быть измерены на одной табличке. Титр Привет колеблется от 8 до 1 024. Сыворотки используется антигена служил положительный контроль и обратно титрования была выполнена для проверки, если антигена разрежения равен 4 HA единиц. Для 2 отдельные вакцины получателей отображается серийный разбавления пробы сыворотки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
-
Привет пробирного
Примечание: Для иллюстрации принципа Привет assay смотрите Рисунок 1. В зависимости от вируса различные виды RBCs используются для assay (Таблица 1). Различные виды RBCs используются в различных типах 96-луночных плит, и время инкубации, а также внешний вид ячеек не склеенный отличается (Таблица 2). Для assay Привет 4 единицы HA вируса или антигена добавляются в 2 раза разрежения серии образцов.-
Приготовление раствора антигена
- Рассчитать объем раствора антигена, необходимые согласно количество 96-луночных пластин, используемых (25 мкл антигена в хорошо × 96 = 2400 мкл антигена на 96-луночных пластину; 100 мкл на пластину дополнительных за счет использования водохранилища для многоканальных дозаторов; всего 2,5 мл antige n на пластину).
Примечание: например, если измерение 100 образцов сыворотки затем 10 пластины являются необходимыми (10 образцов на пластину): 2,5 мл x 10 = 25 мл раствора антигена, требуется в общей сложности. - Подготовьте надлежащего растворения 4 HA единиц для вычислительного объема с помощью PBS.
Примечание: 4 HA единиц определяются для HA assay. Для соответствующего количества антигена разделите расчетный объем титр, соответствующий 4 HA единиц. Например, 4 га единицы соответствуют разбавления 1/64, и нам нужны 15000 мкл раствора антигена необходимы: 15000/64 = 234.4 добавляются мкл растворенного лиофилизированные гриппа антигена.
- Рассчитать объем раствора антигена, необходимые согласно количество 96-луночных пластин, используемых (25 мкл антигена в хорошо × 96 = 2400 мкл антигена на 96-луночных пластину; 100 мкл на пластину дополнительных за счет использования водохранилища для многоканальных дозаторов; всего 2,5 мл antige n на пластину).
-
Приготовление суспензии РБК
- Рассчитать объем РБК подвеска, необходимых согласно количество 96-луночных микро титр пластин, используемых (50 мкл суспензии РБК в хорошо × 96 = 4800 мкл суспензии РБК в 96-луночных плита; 200 мкл на пластину дополнительных за счет использования водохранилища для многоканальных дозаторов) .
- Разбавить РБК акции подвеска (обычно 10%, v/v; за исключением человеческого типа O) с PBS сделать надлежащей концентрации для птиц и млекопитающих RBCs 0,75% и 1%, соответственно.
-
Подготовка 96-луночных микро титр пластины
- Ярлык 96-луночных микро титр пластины (пример ID, положительный контроль и обратно титрование). Пожалуйста внимательно проверьте пластины ориентации на рисунке 5 .
- 25 мкл PBS на каждый хорошо за исключением первой скважины «назад титрования» строки (рис. 5, 12-й строки) с помощью многоканальных дозаторов.
Примечание: Обратно титрования была выполнена для проверки, если используется антигена разрежения равен 4 HA единиц. Антиген титр 4 HA единиц указывается если гемагглютинации происходит в первых трех скважинах «назад титрования» строки, но не в четвертом хорошо. - Добавьте 50 мкл раствора подготовленный антигена (описано в разделе 5.2.1) первой скважины «назад титрования» строки (12-й строке).
- 25 мкл образцов сыворотки РДЭ лечение, для первых скважин строк с 1 по 10 на каждой табличке, используя многоканальные пипетки.
- Добавьте 25 мкл соответствующего сыворотки в первой скважины 11-й строке как позитивный элемент управления.
- Выполните 2 раза серийных разведений путем передачи 25 мкл от первой скважины каждой строки (1-12) последовательных скважин с помощью многоканальных дозаторов. Смешайте закупорить вверх и вниз на 10 - 15 раз для каждого шага разрежения. Же советы могут использоваться для каждого шага разрежения на сэмпл.
- Сбросить окончательные 25 мкл последних скважин.
- Добавьте 25 мкл раствора антигена с помощью многоканальных дозаторов для каждой скважины строк 1-11 (образцов сыворотки крови и сыворотки). Же советы может использоваться, если они не прикасайтесь скважин.
- Добавьте 25 мкл PBS вместо антигена в каждой скважине строке «назад титрования» (12-й строке).
- Нажмите пластины тщательно 10 раз на всех четырех сторонах смешивать.
- Крышка с крышкой и инкубировать при комнатной температуре за 30 мин. Не перемещайте пластины при инкубации.
- Добавьте 50 мкл суспензии РБК каждый хорошо.
- Нажмите пластины тщательно 10 раз на всех 4 сторон смешивать.
- Крышка с крышкой и инкубировать и при комнатной температуре на соответствующее количество времени в зависимости от используемого вида РБК (см. таблицу 2). Не перемещайте пластины при инкубации.
-
Читая пластины
Примечание: Привет титр — это последний разбавления (анти-) сыворотки, который полностью подавляет гемагглютинации. Важно учесть, что РДЭ лечение sera разводили уже 1:4 и после шага серийный разрежения, сера в первых скважин являются разбавленных 1:8, который соответствует титр HI 8.- Индикация птичьего эритроцитов
- Наклона пластины 90° для 25 s.
Примечание: Наклона пластины имеет решающее значение для дифференциации птичьего шаблонов, потому что все три различных типа шаблонов агглютинации (полностью склеенный, частично склеенный и не склеенный) появляются как кнопку, когда не наклонена. - Марк результаты немедленно, в то время как плита находится все еще в наклонном положении, на печатной схеме 96-луночных пластины. Аглютинация модели птичьего RBCs показаны на рисунке 3.
- Наклона пластины 90° для 25 s.
- Индикация млекопитающих эритроцитов
- Марк результаты на печатной схеме 96-луночных пластины, без наклона пластины.
Примечание: При возникновении гемагглютинации, agglutinated клетки не поселиться в то время как не склеенный клетки появляются как гало в нижней части скважины. Гало частично agglutinated клеток менее интенсивным и имеет больший диаметр (рис. 3). - Определить Привет каждого образца и перенести его на таблицей компьютерного (рис. 6)
- Примечание: Частично склеенный скважин были определены как нижняя титр. Например если образец сыворотки полностью подавляет гемагглютинации до 4 хорошо (разбавления 1: 64) и 5й хорошо (1:128 разрежения) частично склеенный, то Привет титр устанавливается на нижнем титр 64 для окончательного анализа (рис. 6, 4 ряде ).
- Марк результаты на печатной схеме 96-луночных пластины, без наклона пластины.
- Индикация птичьего эритроцитов
-
Приготовление раствора антигена

Рисунок 6 : Индикация пробирного Привет с птичьим RBCs. До и после вакцинации индуцированной гриппа, специфическое антитело ответ определяется пробирного HI. В этом примере человек имеет более высокие титры Привет чем человек, два. Оба лица показывают реакции антитела после вакцинации; через 180 дней после вакцинации титры антител обоих лиц вновь снизились. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Access restricted. Please log in or start a trial to view this content.
Результаты
Ответ до и после вакцинации индуцированных антитела против гриппа H3N2
Вакцина индуцированной антител ответ оценивалась в 26 здоровых добровольцев, кто получил инактивированных трехвалентного Субблок противогриппозной вакцины, содержащие гриппа A/H1N1/Калифо...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Количественная оценка до и после вакцинации против гриппа вирус специфическое антитело титры является важным инструментом необходимых для исследования вакцины. На основании суррогатного меры защиты против вирусной инфекции, такие как серопротекции (> 1:40) или сероконверсия (титр 4-кра?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
А.е. была поддержана исследовательских грантов от программы «Оценка Ambizione SNSF» (PZ00P3_154709), «Forschungsfond, Förderung strategischer Projekte» Базельский университет, Базель Stiftungsinfektionskrankheiten и Bangeter Rhyner Stiftung. Л.к. была поддержана грантом технический университет в Граце, Австрия. J.L. признает поддержку iPhD братство SystemsX.ch инициативы в программе биологии систем (9й вызов).
Благодарности
нет.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 25 ml Disposable Multichannel Pipette Reservoirs | Integra | 4312 | |
| 8-well PCR tubes | Brand GMBH | 781332 | For serum aliquots |
| 96-well microtiter plate, U-shaped | TPP | 92097 | For HI assay when using mammalian RBCs |
| 96-well microtiter plate, V-shaped | Corning Costar | 3897 | For HI assay when using avian RBCs |
| Aqua ad iniect. Steril | Bichsel AG | 1000004 | For preparing influenza antigen and cholera filtrate solutions |
| Chicken RBC (10%) | Cedarlane | CLC8800 | 10% suspension of chicken red blood cells in Alsever's solution |
| Cholera filtrate | Sigma-Aldrich | C8772 | Used as receptor destroying enzyme (RDE) |
| Dulbecco's PBS | Sigma-Aldrich | D8537 | For diluting the serum samples, RBCs and antigens |
| Eppendorf Multichannel pipette, 12-channel, 10-100 µl | Sigma-Aldrich | Z683949 | |
| Eppendorf Multichannel pipette, 8-channel, 10-100 µl | Sigma-Aldrich | Z683930 | |
| Guinea Pig RBC (10%) | Cedarlane | CLC1800 | 10% suspension of guinea pig red blood cells in Alsever's solution |
| Influenza Anti-A/California/7/09 HA serum | NIBSC | 14/134 | Used as positive control at the HI assay |
| Influenza Anti-A/Switzerland/9715293/2013-like HA serum | NIBSC | 14/272 | Used as positive control at the HI assay |
| Influenza Anti-A/Texas/50/2012-Like HA Serum | NIBSC | 13/178 | Used as positive control at the HI assay |
| Influenza Anti-B/Brisbane/60/2008-HA serum | NIBSC | 13/254 | Used as positive control at the HI assay |
| Influenza Anti-B/Massachusetts/02/2012 HA serum | NIBSC | 13/182 | Used as positive control at the HI assay |
| Influenza antigen A/California/7/09 (H1N1)(NYMC-X181) | NIBSC | 12/168 | Inactivated, partially purified A/California/7/09 (H1N1)(NYMC-X181) virus (ca. 46µgHA/ml) |
| Influenza antigen A/Switzerland/9715293/2013 (NIB88) | NIBSC | 14/254 | Inactivated, partially purified A/Switzerland/9715293/2013 (NIB88) virus (ca. 55µgHA/ml) |
| Influenza antigen A/Texas/50/2012 (H3N2)(NYMCX-223) | NIBSC | 13/112 | Inactivated, partially purified A/Texas/50/2012 (H3N2)(NYMCX-223) virus (ca. 74µgHA/ml) |
| Influenza antigen B/Brisbane/60/2008 | NIBSC | 13/234 | Inactivated, partially purified B/Brisbane/60/2008 virus (ca. 42µgHA/ml) |
| Influenza antigen B/Massachusetts/02/2012 | NIBSC | 13/134 | Inactivated, partially purified B/Massachusetts/02/2012 virus (ca. 35µgHA/ml) |
| Serum-Tubes | S-Monovette, Sardstedt | 01.1601.100 | For serum extraction with clotting activator |
| Single Donor Human RBC, Type 0 | Innovative Research | IPLA-WB3 | Suspension of single donor human red blood cells in Alsever's solution (ca. 26%) |
| Turkey RBC (10%) | Cedarlane | CLC1180 | 10% suspension of turkey red blood cells in Alsever's solution |
| Phosphate Buffered Saline (PBS) | Gibco |
Ссылки
- Prevention and control of seasonal influenza with vaccines. Recommendations of the Advisory Committee on Immunization Practices--United States, 2013-2014. MMWR Recomm Rep. 62, Centers for Disease, C. & Prevention. RR-07 1-43 (2013).
- Dominguez-Cherit, G., et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 302 (17), 1880-1887 (2009).
- Fox, B. D., et al. Pandemic influenza (H1N1): impact on lung transplant recipients and candidates. J Heart Lung Transplant. 29 (9), 1034-1038 (2010).
- Piercy, J., Miles, A., Krankheiten, S. B. fG. S. V., Values, M. The Economic Impact of Influenza in Switzerland: Interpandemic Situation. , Swiss Federal Office of Public Health, Division of Epidemiology and Infectious Diseases, Section of Viral Diseases and Sentinel Systems. (2003).
- Barclay, V. C., et al. Positive network assortativity of influenza vaccination at a high school: implications for outbreak risk and herd immunity. PLoS One. 9 (2), 87042(2014).
- Baluch, A., et al. Randomized controlled trial of high-dose intradermal versus standard-dose intramuscular influenza vaccine in organ transplant recipients. Am J Transplant. 13 (4), 1026-1033 (2013).
- Haralambieva, I. H., et al. The Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in Older Subjects. PLoS One. 10 (3), 0122282(2015).
- Egli, A., et al. Vaccine adjuvants--understanding molecular mechanisms to improve vaccines. Swiss Med Wkly. 144, 13940(2014).
- O'Shea, D., Widmer, L. A., Stelling, J., Egli, A. Changing face of vaccination in immunocompromised hosts. Curr Infect Dis Rep. 16 (9), 420(2014).
- Meulemans, G., Carlier, M. C., Gonze, M., Petit, P. Comparison of hemagglutination-inhibition, agar gel precipitin, and enzyme-linked immunosorbent assay for measuring antibodies against influenza viruses in chickens. Avian Dis. 31 (3), 560-563 (1987).
- Martins, T. B. Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile. Clin Diagn Lab Immunol. 9 (1), 41-45 (2002).
- Webster, R., Cox, N., Stöhr, K. WHO Animal Influenza Manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
- Mittelholzer, C. M., et al. Human cell lines used in a micro neutralization test for measuring influenza-neutralizing antibodies. Scand J Immunol. 63 (4), 257-263 (2006).
- Hamilton, R. S., Gravell, M., Major, E. O. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol. 38 (1), 105-109 (2000).
- Kumakura, S., et al. Comparison of hemagglutination inhibition assay and enzyme immunoassay for determination of mumps and rubella immune status in health care personnel. J Clin Lab Anal. 27 (5), 418-421 (2013).
- Ogundiji, O. T., Okonko, I. O., Adu, F. D. Determination of measles hemagglutination inhibiting antibody levels among school children in Ibadan, Nigeria. J Immunoassay Immunochem. 34 (2), 208-217 (2013).
- Cwach, K. T., Sandbulte, H. R., Klonoski, J. M., Huber, V. C. Contribution of murine innate serum inhibitors toward interference within influenza virus immune assay. Influenza Other Respir Viruses. 6 (2), 127-135 (2012).
- Lee, P. S., et al. Receptor mimicry by antibody F045-092 facilitates universal binding to the H3 subtype of influenza virus. Nat Commun. 5, 3614(2014).
- Blumel, B., et al. Age-related prevalence of cross-reactive antibodies against influenza A(H3N2) variant virus, Germany, 2003 to 2010. Euro Surveill. 20 (32), 16-24 (2015).
- Reber, A. J., et al. Seasonal Influenza Vaccination of Children Induces Humoral and Cell-Mediated Immunity Beyond the Current Season: Cross-reactivity with Past and Future Strains. J Infect Dis. , (2016).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены