JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인플루엔자-특정 항 체 Titers 계량에 최적화 된 Hemagglutination 억제 (HI) 분석 결과
* 이 저자들은 동등하게 기여했습니다
요약
제시 프로토콜 인플루엔자 백신 받는 사람 혈 청 샘플에서 인플루엔자-특정 항 체 titers 척도를 hemagglutination 억제 시험을 수행 하는 방법을 설명 합니다. 첫 번째 분석 결과 hemagglutination에 의해 최적의 바이러스 성 항 원 농도를 결정합니다. 두 번째 분석 결과 hemagglutination 저해 하 여 인플루엔자-특정 항 체 titers 단정.
초록
항 체 titers 인플루엔자와 다른 병원 체에 대 한 혈 청 학적인 보호에 대 한 대리 표식으로 일반적으로 사용 됩니다. 사전 및 사후 예방 접종 항 체 생산의 상세한 지식은 백신 유도 면역을 이해 해야 합니다. 이 문서에서는 인플루엔자-특정 항 체 titers를 확인 하는 신뢰할 수 있는 포인트 프로토콜을 설명 합니다. 첫 번째 프로토콜 hemagglutination, 두 번째 프로토콜 (hemagglutination 분석 결과, 분석 결과 HA)에 후속 사용 농도 표준화에 필요한 항 원 금액을 지정 하는 방법을 설명 합니다. 두 번째 프로토콜 인간의 혈 청 또는 셀 문화 supernatants (hemagglutination 저해 분석 결과,이 분석 결과)의 직렬 희석을 사용 하 여 다른 바이러스 성 긴장에 대 한 인플루엔자-특정 항 체 titers의 정량화를 설명 합니다.
적용 예를 들어, 우리는 trivalent inactivated 인플루엔자 백신을 접종 하는 건강 한 코 호트의 항 체 응답을 보여줍니다. 또한, 다른 인플루엔자 바이러스 사이의 분 표시 되 고 동물 적혈구 (Rbc)의 다른 종류를 사용 하 여 분을 최소화 하는 방법을 설명 했다. 토론 하이라이트 장점과 제시 분석의 단점 및 어떻게 인플루엔자-특정 항 체 titers 결정 백신 관련 면역의 이해를 향상 시킬 수 있습니다.
서문
인플루엔자 바이러스 감염 상당한 질병 률, 사망률, 및 높은 의료 비용1,2,,34와 연결 됩니다. 특히, 신생아, 임산부, 노인과 만성 질병을 가진 환자는 더 심한 임상 결과 대 한 위험이 있습니다. 따라서, 순환 하는 인플루엔자 바이러스 변종에 대 한 예방 접종이 고 위험도 인구에 있는 질병의 부담을 줄이기 위하여 기본 척도 이다. 예방 접종, 예를 들면, 보호 임계값 이상 인플루엔자-특정 항 체 후 개별 면역 반응의 증가 감염의 개별 위험과 일반 인구 내에서 바이러스 성 전송의 가능성을 감소 5. 백신 유도 체액 면역 반응의 다른 인구에 다양 한 연령층에 걸쳐 자세한 이해는 중요 한 임상 질문6,,78 대답 하는 핵심 요소 , 9와 같은: 왜 일부 노인 환자 이전 예방 접종에도 불구 하 고 감염을 해야 합니까? "좋은"와 "충분 한" 백신 유도 보호는 무엇입니까? 얼마나 자주 백신 보호 titers 도달 immunosuppressed 환자에 게 적용 한다? 가장 효과적인 복용량 무엇입니까? 예방 접종 후 항 체 titers에 소설 보조의 영향 이란 무엇입니까? 백신 관련 항 체 생산의 측정 이러한 중요 한 질문에 대답 하 고 예방 접종 결과 개선 하는 데 도움이 있습니다.
바이러스 특정 항 체 titers의 정량화는 다양 한 면역 방법으로 수행할 수 있습니다. 이 고체 상10 또는 비드 기반 ELISA11 분석 실험,이 분석 결과12및 중화 분석 실험13포함 됩니다. ELISA 기반 메서드는 상대적으로 많은 양의 다양 한 항 원에 대 한 혈 청 샘플의 검사를 수 있습니다. 또한, 병원 체 관련 면역 글로불린 (Ig) M와 IgG 수 수 별도로 탐험. 항 원, 예를 들면, 선형 아미노산 시퀀스 또는 바이러스와 같은 입자의 특성 항 체의 바인딩을 영향을 미칠 수 있습니다, 비록 잠재적인 epitopes의 스펙트럼은 매우 광범위 하 고 여부 항 체에 정보를 제공 하지 않습니다. 응답 기능 관련이 있다.
반면, 중화 시험 기능 세포의 감염을 억제 하는 항 체의 잠재력을 결정 하 고 따라서 잠재적인 중립화를 반영 한다. 그러나,이 방법은 매우 노동 집약 이다, 라인 세포 및 바이러스, 라이브 특정의 경작 그리고 그러므로, 그것은 소모, 비싼, 특별 한 장비가 필요 합니다 필요 합니다.
이 문서에서는 인플루엔자-특정 항 체 titers 척도를 세계 보건 기구 WHO 기반이 프로토콜12 는 단계별 설명. Hemagglutination은 적혈구의 교착을 선도 하는 일부 바이러스의 특성 효과 이다. 환자 혈 청이이 효과의 저해 중화 효과 반영 하는 억제 항 체 농도의 측정을 허용 한다.
우리는 동시에 여러 샘플의 효율적 처리 및 필요한 시간을 줄일 수 있도록 WHO 프로토콜의 워크플로 수정 했습니다. 첫 번째 프로토콜 특정 인플루엔자 항 원의 교착 잠재력의 결정을 설명합니다. 이 과정에서 두 번째 프로토콜에 대 한 올바른 인플루엔자 항 원 농도 결정 됩니다. 이 부분은 혈액의 각 배치 뿐 아니라 모든 새로운 바이러스 성 항 원, 반복 한다.
두 번째 프로토콜 인플루엔자-특정 항 체 titers 결정을 설명합니다. 그러나 제시 프로토콜 인플루엔자 바이러스와 인간 혈 청 샘플의 수사를 위해 최적화 된, 그것은 또한 적용할 수 마우스 혈 청 샘플 또는 셀 문화 supernatants 자극된 면역 세포, 예를 들어, 바이러스 특정 B 세포에서. 절대 측정된 titers로 결과 확인할 수 있습니다. 많은 백신 연구,은 titers 및 95% 신뢰 구간에는 각 특정 인구 표시 됩니다. 해석, seroprotection 또는 혈에 대 한 특정 바이러스 인구의 민감성을 설명 하기 위해 자주 사용 됩니다. Seroprotection 이상 4-fold titer 두 시간 점 (가장 일반적으로 사전 예방 접종과 30 일 사후 예방 접종에 사용 되는) 사이 seroprotective titers 달성과 증가의 ≥1:40, 그리고 혈 titer로 정의 됩니다.
두 프로토콜은 사용 하기 쉽게 하 고 그들은 연구 질문의 광범위 한 범위에 적용할 수 있습니다. 특히, 안정적이 고 신속 하 게 결정 하기 위해 사용할 수 있습니다 hemagglutination, 홍 역, polyomaviruses, 유행 성 이하선염, 또는 풍 진14,15,16 등에 대 한 용량을 가진 다른 다양 한 바이러스에 대 한 항 체 titers .
Access restricted. Please log in or start a trial to view this content.
프로토콜
연구 프로토콜 로컬 윤리 검토 위원회 (www.EKNZ.ch)를 통해 승인 하 고 모든 참가자 로부터 서 면된 동의 얻어.
1. 혈 청 컬렉션
- 인간 관심의 시간 시점에서 혈 청 샘플을 수집 합니다. 이 연구를 위해 우리는 예방 접종 후 0 (독감 예방 접종의 시간), + 7, + 30, 60, 및 180 일에서 세라를 수집.
- 혈 청을 얻기 위해 상 온 (20-25 ° C)에서 10 분 동안 1200 x g에서 샘플 튜브 원심.
참고: 4 ° C, 그리고 24 시간 보다는 더 이상 비 centrifuged 혈액 샘플 저장 되어야 한다. - 약 수 다른 튜브 (cryo-튜브) 및 사용까지-80 ℃에서 동결으로 혈 청.
- 수행 후속 분석 실험 batch-wise, 모든 시간-포인트 환자 내에서 다양성을 줄이기 위해 한 사람의 포함 하 여.
2입니다. 항 원 준비
주의: 5 가지 항 사용 됩니다 ( 재료의 표참조). Biosafety 수준 2 (BSL-2) 실험실에서 항 원 준비.
- 제조업체의 지침에 따라 1.0 mL 증류수와 한 동결 건조 된 인플루엔자 항 원 앰 풀의 전체 내용을 다시 구성 하 고 진행 하기 전에 실 온에서 5 분의 최소 서 녹아 항을 허용 합니다.
- Aliquot 1.5 mL를 항 원 솔루션 튜브 및 추가 사용까지-80 ° C에서 동결.
3입니다. 콜레라 여과 액의 준비
참고: 콜레라 filtrate 파괴 하는 효소 (RDE) WHO 프로토콜12에 따라 수용 체로 사용 됩니다. 이 분석 결과17를 방해할 것 이다 혈 청에서 타고 난 억제제를 제거 합니다.
- 제조업체의 지침에 따라 동결 건조 된 RDE reconstitute
- 추가 사용 때까지 4 ° C에서 15 mL 튜브에 RDE 솔루션을 저장 합니다.
4. 하 분석 결과
참고:이 분석 여러 판 사이의 비교 되도록 바이러스 입자의 동일한 금액 각 접시 사용할 수 있어야 합니다. (HA 적정 라고도 함) 하 분석 결과 바이러스 입자 hemagglutination에 필요한 계량 하기 수행 되 고 HA 단위로 기록 됩니다. Hemagglutination의 "단위" HA 적정에 사용 되는 방법에 의존 한 운영 단위 이며 바이러스의 절대 금액의 측정 되지 않습니다. 따라서, HA 단위 표준화 된 RBC 정지의 동등한 볼륨 agglutinate 필요가 바이러스의 금액으로 정의 됩니다. 에 따르면 WHO는,이 분석 결과 대 한 사용 표준 금액 25 µ L 당 4 하 단위입니다. HA 분석 결과의 원리의 이해를 돕기 위해 그림 1을 참조 하십시오.

그림 1 : Hemagglutination 및 hemagglutination 금지의 원칙. 아니 hemagglutination 없이 바이러스와 항 체 (왼쪽된 열), 부정적인 컨트롤 상황에서 발생 하 고 적혈구 인플루엔자 바이러스 (중간 열)의 존재만 hemagglutinate. 그러나, 조류 독감 바이러스의 바이러스 특정 항 체 다음 아무 hemagglutination에 의해 차단 되는 때 (오른쪽 열)을 발생할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
참고: 사용 하는 Rbc 분석 결과 (표 1)에서 인플루엔자 바이러스의 종류에 따라 달라 집니다. 또한, 96-잘 마이크로 titer 접시의 다양 한 종류, 보육 시간 뿐만 아니라 비 agglutinated 셀의 모양을 (표 2) 다.
| 인플루엔자 항 원 | A/캘리포니아/7/09 (H1N1) | A/스위스/9715293/2013 (H3N2) | A/텍사스/50/2012 (H3N2) | B/브리즈번/60/08 | B/매사 추세 츠/02/2012 | ||
| RBC 종 | 치킨 | 기니 돼지 | 기니 돼지 | 터키 | 터키 | ||
표 1: 인플루엔자 항 원 및 해당 종의 Rbc. 제조업체의 지침 (NIBSC) 따라.
| RBC 종 | 치킨 | 터키 | 기니 돼지 | 인간의 유형 O |
| Rbc (v/v)의 농도 | 0.75% | 0.75% | 1% | 1% |
| 결정 접시의 유형 | V 하단 | V 하단 | U 하단 | U 하단 |
| 보육 시간, RT | 30 분 | 30 분 | 1 시간 | 1 시간 |
| 비 agglutinated 셀의 모양 | 버튼 * | 버튼 * | 헤일로 | 헤일로 |
표 2: Rbc의 다른 종족과 조건 시험. WHO 프로토콜에 따르면. (* 기울이면 흐름).
-
RBC 서 스 펜 션의 준비
- RBC 재고 현 탁 액 희석 (10%, v/v; 인간의 유형 O를 제외 하 고) ( 재료의 표참조)와 성 식 염 수 (PBS) 0.75%와 1%의 조류 및 포유류 RBCs에 대 한 적절 한 농도 각각 있도록 버퍼링.

그림 2 : 하 분석 결과의 디자인 접시. HA 적정 중복에서 수행 됩니다. 아니 항 제어 행에 추가 되었습니다. 또한 최고의 항 원 농도의 결정에 대 한 그림 4 를 참조 하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
-
96-잘 마이크로 Titer 접시의 준비
참고: 격판덮개 디자인에 대 한 그림 2 를 참조 하십시오.- (그림 2) 멀티 채널 피 펫을 사용 하 여 PBS의 25 µ L 96 잘 마이크로 titer 플레이트의 사용된 행 각의 우물 1 ~ 12를 추가 합니다. V 모양의 마이크로 titer 플레이트를 사용 하 여 닭 및 칠면조 같은 조류 Rbc 작업할 때. U 자 모양의 마이크로 titer 플레이트를 사용 하 여 포유류 Rbc, 기니 피그와 인간의 유형 O 처럼 (표 2)와 함께 작업 하는 경우.
- 중복에서 배열 되는 항 원 행, 첫 번째 우물에 인플루엔자 항 원의 25 µ L를 추가 합니다. 아니 항 제어 행에 추가 됩니다. 컨트롤 행 하지 hemagglutination 효과 표시 하 고 부정적인 컨트롤 (그림 2)으로 제공 해야 합니다.
- 멀티 채널 피 펫을 사용 하 여 연속 웰 스 항 원 행의 첫 번째 우물에서 25 µ L를 전송 하 여 직렬 2-fold 희석을 수행 합니다. 부드럽게 10 번 위아래로 pipetting으로 각 희석 단계를 혼합.
- 최근 웰 스의 최종 25 µ L를 삭제 합니다.
- 잘 당 50 µ L의 총 볼륨에 도달 하기 위해서는 멀티 채널 피 펫을 사용 하 여 사용된 하는 각 행의 웰 스 1 ~ 12에 PBS의 25 µ L를 추가 합니다.
- 멀티 채널 피 펫을 사용 하 여 잘 사용 하는 각 증권 서 스 펜 션의 50 µ L를 추가 합니다.
- 누릅니다 접시 신중 하 게 10 번 혼합 모든 4 개의 측에.
- 뚜껑을 가진 접시를 커버 하 고 는 RBC 종 사용된 (표 2참조)에 따라 시간의 적절 한 금액에 대 한 실 온에서 품 어. 잠복기 동안 접시를 이동 하지 마십시오.
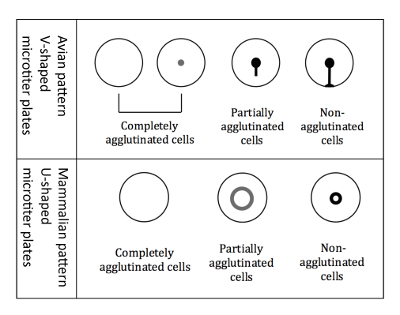
그림 3 : 조류 및 포유류 RBCs의 교착 패턴. V 모양의 마이크로 titer 접시 조류 RBCs를 작업할 때 사용 됩니다. 판독 기울이면된 플레이트 위치에서 수행 되 고 비 agglutinated Rbc 형성 눈물 모양 아래로 실행 시작. U 자 모양의 결정 플레이트 포유류 RBCs를 작업할 때 사용 됩니다. 판독 비 기울이면 위치에서 다음 수행 하 고 비 agglutinated Rbc 형성 작은 후광. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
-
접시를 읽고
참고: 다른 모양의 마이크로 titer 우물 (그림 3) 때문에 포유류 RBCs에 비해 조류 RBCs를 사용 하 여 판독은 약간 다릅니다.- 조류 RBCs의 판독
- 플레이트 25 90 ° 기울기 s.
참고: 모든 세 가지 유형의 교착 패턴 (완전히 agglutinated, 부분적으로 agglutinated 및 비 agglutinated) 하지 기울이면 버튼으로 표시 하기 때문에 조류 패턴의 분화에 대 한 중요 한은 접시를 기울이기. - 접시는 96 잘 접시의 인쇄 방식에 기울어진된 위치에 아직도 하는 동안 결과 즉시 표시 합니다. 조류 RBCs의 교착 패턴은 그림 3에 나와 있습니다.
- 플레이트 25 90 ° 기울기 s.
- 포유류 RBCs의 판독
- 플레이트 (벤치에 수평 위치)을 기울이기 없이 96 잘 접시의 인쇄 방식에 결과 표시 합니다.
참고: hemagglutination 경우 agglutinated 셀 할 침전 하지 아래로, 반면 비 agglutinated 셀 아래쪽 우물의 후광으로 나타납니다. 부분적으로 agglutinated 셀의 후광 덜 강렬 하 고는 더 큰 직경 (그림 3).
- 플레이트 (벤치에 수평 위치)을 기울이기 없이 96 잘 접시의 인쇄 방식에 결과 표시 합니다.
- 4 HA 단위의 결정입니다.
참고: HA 적정 끝점은 마지막 잘 완전 한 hemagglutination 발생 합니다. 이것 잘 바이러스의 1 하 단위를 포함 한다. 항 원의 2-fold 희석 하 적정 끝점 앞서 두 우물 이므로 바이러스 (그림 4)의 4 하 단위를 포함 하는 우물.
- 조류 RBCs의 판독

그림 4 : 4 HA 단위의 titer를 결정 하기 위해 조류 Rbc와 HA 적정의 판독. Hemagglutination에 필요한 최적의 항 원 금액 hemagglutination 분석 결과 (항 원 적정 분석 결과)에 의해 측정 됩니다. 완전 한 hemagglutination가 발생 하는 마지막 잘 하 적정 끝점 이며 1 하 단위를 포함 합니다. 항 원, HA 적정 끝점 앞서 두 우물의 2-fold 희석 때문에 titer 4 하 단위에 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
5. 안녕하세요 분석 결과
참고: 프로토콜의 작업 흐름은 동시에 여러 개의 샘플의 더 효율적인 처리를 허용, PCR를 사용 하 여 튜브 줄무늬 고 열 cycler (아래 참조)에 최적화 되었습니다.
-
혈 청 샘플의 준비
참고: BSL-2 실험실에서 혈 청 샘플 준비.- 모든 사람의 각 시간 점의 냉동된 혈 청 샘플을 녹여 (단계 1.2 참조) 실내 온도에.
- PCR 튜브 스트립 (1 개의 지구에 있는 10-튜브) 튜브를 각 해 동된 혈 청 샘플의 10 µ L의 약 수를 추가 합니다.
참고: 큰의 PCR 튜브 스트립을 사용 하 여 장점은 멀티 채널 피 펫이 분석 결과;의 다음 단계에 사용할 수 있습니다. 이 때 많은 양의 혈 청 샘플을 테스트 및 다른 바이러스 변종에 대 한 항 체 titers에 대 한 동일한 샘플의 측정을 반복 수행 하는 경우 시간을 많이 저장 합니다. - -80 ° C에서 PCR 튜브 스트립 사용까지 aliquoted 혈 청 샘플을 저장 합니다.
- 이 분석 결과 수행 하기 전에 1 일 실 온에서의 혈 청 샘플 aliquots 녹여.
- 빈 PCR 튜브에 적절 한 항 혈 청의 10 µ L를 추가 합니다.
참고: 긍정적인 통제로 봉사 하는 특정 바이러스에 대 한 항 혈 청 사용된 바이러스를 일치 해야 합니다. 긍정적인 통제 여러 접시에 접시 성능의 표준화에 대 한 수 있습니다. - 멀티 채널 피 펫을 사용 하 여 30 µ L 콜레라 filtrate 솔루션의 각 혈 청 약 수를 항 혈 청 (혈 청의 1 볼륨을 콜레라 filtrate의 3 볼륨)을 추가 합니다.
- PCR 96 잘 랙 또는 빈 팁-상자와 5 소용돌이에 PCR 튜브를 계속 s.
- 사용 하 여 열 cycler 37 ° C에서 하룻밤 샘플을 품 어.
- 콜레라 filtrate 열 cycler를 사용 하 여 비활성화를 30 분 동안 56 ° C에서 샘플을 품 어.
참고: 열 cycler에 따라이 단계는 과정을 더 자동화를 프로그래밍할 수 있습니다. - PCR 96 잘 랙 또는 빈 팁-상자와 5 소용돌이에 PCR 튜브를 계속 s.
- 이 분석 결과 대 한 사용까지 냉장고에 4 ° C에서 샘플을 저장 합니다.

그림 5 : 디자인 및 워크플로이 분석 결과의 접시. 한 접시에 2 명의 사람들의 5 시간 포인트를 측정할 수 있습니다. 안녕 titer 1024 8에서 배열 한다. 사용된 항 원의 항 혈 청 긍정적인 제어로 역임 하 고 다시 적정 항 원 희석 4 하 단위 같음 경우 확인 위해 수행 되었습니다. 혈 청 샘플의 직렬 희석 2 개별 백신 받는 사람에 대 한 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
-
안녕하세요 분석 결과
참고:이 분석 결과의 원리의 삽화 그림 1참조. 바이러스, 따라 Rbc의 종 분석 결과 (표 1)에 사용 됩니다. Rbc의 종 96 잘 접시의 다양 한 종류에 사용 되 고 부 화 시간 뿐만 아니라 비 agglutinated 셀의 모양을 다릅니다 (표 2). 이 분석 결과 대 한 바이러스의 항 원 4 하 단위는 샘플의 2-fold 희석 시리즈에 추가 됩니다.-
항 원 솔루션의 준비
- 계산 사용 하는 96 잘 접시의 수에 따라 필요한 항 원 솔루션의 볼륨 (25 µ L 항 원 당 96 잘 접시; 잘 × 96 = 2400 µ L 항 원 당 100 µ L 플레이트 멀티 채널 피 펫;에 대 한 저수지의 사용으로 인해 추가 당 추가 총 antige의 2.5 mL 접시 당 n)입니다.
참고: 예를 들어 100 세럼 샘플을 측정 하는 경우 다음 10 접시는 필요한 (접시 당 10 샘플): 항 원 솔루션 총에서 필요의 2.5 mL x 10 = 25 mL. - PBS를 사용 하 여 계산 된 볼륨에 대 한 4 HA 단위의 적절 한 희석을 준비 합니다.
참고: 4 하 단위 하 분석 결과 대 한 결정 됩니다. 적절 한 양의 항 원에 대 한 계산된 볼륨 4 하 단위 해당 titer 나눕니다. 예를 들어 4 하 단위 1/64의 희석에 해당 하 고 우리가 필요한 15000 µ L 항 원 솔루션의 필요: 15000/64 = 234.4 녹아 동결 건조 된 인플루엔자 항 원의 µ L 추가 됩니다.
- 계산 사용 하는 96 잘 접시의 수에 따라 필요한 항 원 솔루션의 볼륨 (25 µ L 항 원 당 96 잘 접시; 잘 × 96 = 2400 µ L 항 원 당 100 µ L 플레이트 멀티 채널 피 펫;에 대 한 저수지의 사용으로 인해 추가 당 추가 총 antige의 2.5 mL 접시 당 n)입니다.
-
RBC 서 스 펜 션의 준비
- RBC 서 스 펜 션 사용 96-잘 마이크로 titer 번호판의 수에 따라 필요한 양의 계산 (50 µ L RBC 정지 당 96 잘 접시; 잘 × 96 = 4800 µ L RBC 정지 당 200 µ L 플레이트 멀티 채널 피 펫에 대 한 저수지의 사용으로 인해 추가 당 추가) .
- RBC 재고 현 탁 액 희석 (일반적으로 10%, v/v; 인간의 유형 O를 제외 하 고) 각각 0.75%와 1%의 조류 및 포유류 RBCs에 대 한 적절 한 농도 만들기 위해 PBS를 가진.
-
96-잘 마이크로 titer 접시의 준비
- 레이블을 96 잘 마이크로 titer 플레이트 (샘플 ID, 긍정적인 제어, 그리고 다시 적정). 그림 5 의 접시 방향을 신중 하 게 확인 하시기 바랍니다.
- "다시 적정" 행 (그림 5, 12번째 행)의 첫 번째 음을 제외 하 고 모든 잘을 PBS의 25 µ L를 추가 멀티 채널 피 펫을 사용 하 여.
참고: 다시 적정 사용된 항 원 희석 4 하 단위 같음 경우 확인 위해 수행 되었습니다. 4 HA 단위의 항 titer 표시 됩니다 hemagglutination 발생 합니다 4에 "다시 적정" 행의 처음 세 개의 우물만 잘. - "다시 적정" 행 (12번째 행)의 첫 번째 잘 준비 된 항 원 솔루션 (5.2.1 참조)의 50 µ L를 추가 합니다.
- 멀티 채널 피 펫을 사용 하 여 각 접시에 1 ~ 10 행의 첫 번째 우물을 RDE 치료 혈 청 샘플의 25 µ L를 추가 합니다.
- 긍정적인 통제로 11번째 행의 첫 번째 우물에 적절 한 항 혈 청의 25 µ L를 추가 합니다.
- 멀티 채널 피 펫을 사용 하 여 연속 웰 스 (1-12) 각 행의 첫 번째 우물에서 25 µ L를 전송 하 여 직렬 2-fold 희석을 수행 합니다. 위쪽 및 아래쪽 각 희석 단계에 대 한 10-15 회를 pipetting으로 혼합. 같은 팁 샘플 당 각 희석 단계에 사용할 수 있습니다.
- 최근 웰 스의 최종 25 µ L를 삭제 합니다.
- 행 1 ~ 11 (혈 청 샘플 및 항 혈 청)의 각 음에 멀티 채널 피 펫을 사용 하 여 항 원 솔루션의 25 µ L를 추가 합니다. 그들은 우물을 만지지 않는 경우 같은 팁을 사용할 수 있습니다.
- "다시 적정" 행 (12번째 행)의 각 음에 항 원 대신 PBS의 25 µ L를 추가 합니다.
- 누릅니다 접시 신중 하 게 10 번 혼합 모든 4 개의 측에.
- 뚜껑을 가진 접시를 커버 하 고 30 분 동안 실 온에서 품 어. 잠복기 동안 접시를 이동 하지 마십시오.
- 모든 우물에 RBC 서 스 펜 션의 50 µ L를 추가 합니다.
- 누릅니다 접시 신중 하 게 10 번 혼합 4 면 모두에.
- 뚜껑을 가진 접시를 커버 하 고 는 RBC 종 사용된 (표 2참조)에 따라 시간의 적절 한 금액에 대 한 실 온에서 품 어. 잠복기 동안 접시를 이동 하지 마십시오.
-
접시를 읽고
참고: 안녕 titer (안티-) 혈 청을 완전히 억제 hemagglutination의 마지막 희석의 역 이다. 그것은 RDE 취급 세라 1: 4와 직렬 희석 단계 후에 이미 희석 했다, 첫 번째 스에서 세라 희석된 1:8, 8의 안녕 titer에 해당 하는 고려 하는 것이 중요.- 조류 RBCs의 판독
- 플레이트 25 90 ° 기울기 s.
참고: 모든 세 가지 유형의 교착 패턴 (완전히 agglutinated, 부분적으로 agglutinated 및 비 agglutinated) 하지 기울이면 버튼으로 표시 하기 때문에 조류 패턴의 분화에 대 한 중요 한은 접시를 기울이기. - 접시는 96 잘 접시의 인쇄 방식에 기울어진된 위치에 아직도 하는 동안 결과 즉시 표시 합니다. 조류 RBCs의 교착 패턴은 그림 3에 나와 있습니다.
- 플레이트 25 90 ° 기울기 s.
- 포유류 RBCs의 판독
- 접시를 기울이기 없이 96 잘 접시의 인쇄 방식에 결과 표시 합니다.
참고: hemagglutination 경우 agglutinated 셀 할 침전 하지 비 agglutinated 셀 아래쪽 우물의 후광으로 표시 하는 반면. 부분적으로 agglutinated 셀의 후광 덜 강렬 하 고는 더 큰 직경 (그림 3). - 각 샘플의 안녕을 확인 하 고 컴퓨터 기반 테이블 (그림 6)에 전송
- 참고: 부분적으로 agglutinated 우물 낮은 titer로 결정 했다. 예를 들어 혈 청 샘플 완전히 억제 잘 4까지 hemagglutination (1: 64 희석)와 5일 잘 하는 경우 (모범 희석) agglutinated 부분적으로 다음이 titer 최종 분석 (그림 6에 대 한 낮은 titer 64로 설정 되어 4번째 행)입니다.
- 접시를 기울이기 없이 96 잘 접시의 인쇄 방식에 결과 표시 합니다.
- 조류 RBCs의 판독
-
항 원 솔루션의 준비

그림 6 : 조류 Rbc와이 분석 결과의 판독. 사전 및 사후 예방 접종 독감이 분석 결과 의해 결정은 특정 항 체 응답을 유도 한다. 이 예제에서는 한 사람이 두 사람 보다 더 높은 titers 합니다. 두 사람; 예방 접종 후 항 체 응답을 보여 두 사람의 항 체 titers 다시 감소 예방 접종 후 180 일. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
인플루엔자 A H3N2에 대 한 사전 및 사후 예방 접종 유도 항 체 응답
백신 유발 항 체 응답 26 건강 한 자원 봉사자는 사 3가 소 단위 독감 백신을 접종, 포함 된 인플루엔자 A/H1N1/캘리포니아/2009 A/H3N2/텍사스/2012, B/매사 추세 츠/02/2012는 2014 이전에 평가 되었다 / 2015 독감 시즌입니다. 그림 6 2 백신 수령인의 대표적인 예를 보여 줍니다. 흥미...
Access restricted. Please log in or start a trial to view this content.
토론
사전 및 사후 예방 접종 독감 바이러스 titers 특정 항 체의 정량화 백신 연구에 필요한 중요 한 도구입니다. Seroprotection 같은 바이러스 감염에 대 한 보호의 대리 측정에 따라 (> 1시 40분) 또는 혈 (4-fold titer 증가), 예방 접종 전략 수9에 최적화 된. 제공 된 프로토콜을 사용 하 여 확인할 수 있습니다: (i) 특정 바이러스, 및 (ii) 항 체 titers 관심의 바이러스에 대 한 hemagglutination 잠재력....
Access restricted. Please log in or start a trial to view this content.
공개
A.E.에 의해 지원 되었다 연구 보조금 (PZ00P3_154709), "SNSF Ambizione 점수" 프로그램에서 "Forschungsfond, Förderung strategischer Projekte" 바젤의 대학, Stiftungsinfektionskrankheiten 바젤, 및 Bangeter Rhyner 재단. L.K. 기술 대학의 그라츠, 오스트리아의 교부 금에 의해 지원 되었다. : J.L. 시스템 생물학 프로그램 (9번째 전화)에서 SystemsX.ch 이니셔티브의 iPhD 친교에 의해 지원을 인정합니다.
감사의 말
없음입니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 25 ml Disposable Multichannel Pipette Reservoirs | Integra | 4312 | |
| 8-well PCR tubes | Brand GMBH | 781332 | For serum aliquots |
| 96-well microtiter plate, U-shaped | TPP | 92097 | For HI assay when using mammalian RBCs |
| 96-well microtiter plate, V-shaped | Corning Costar | 3897 | For HI assay when using avian RBCs |
| Aqua ad iniect. Steril | Bichsel AG | 1000004 | For preparing influenza antigen and cholera filtrate solutions |
| Chicken RBC (10%) | Cedarlane | CLC8800 | 10% suspension of chicken red blood cells in Alsever's solution |
| Cholera filtrate | Sigma-Aldrich | C8772 | Used as receptor destroying enzyme (RDE) |
| Dulbecco's PBS | Sigma-Aldrich | D8537 | For diluting the serum samples, RBCs and antigens |
| Eppendorf Multichannel pipette, 12-channel, 10-100 µl | Sigma-Aldrich | Z683949 | |
| Eppendorf Multichannel pipette, 8-channel, 10-100 µl | Sigma-Aldrich | Z683930 | |
| Guinea Pig RBC (10%) | Cedarlane | CLC1800 | 10% suspension of guinea pig red blood cells in Alsever's solution |
| Influenza Anti-A/California/7/09 HA serum | NIBSC | 14/134 | Used as positive control at the HI assay |
| Influenza Anti-A/Switzerland/9715293/2013-like HA serum | NIBSC | 14/272 | Used as positive control at the HI assay |
| Influenza Anti-A/Texas/50/2012-Like HA Serum | NIBSC | 13/178 | Used as positive control at the HI assay |
| Influenza Anti-B/Brisbane/60/2008-HA serum | NIBSC | 13/254 | Used as positive control at the HI assay |
| Influenza Anti-B/Massachusetts/02/2012 HA serum | NIBSC | 13/182 | Used as positive control at the HI assay |
| Influenza antigen A/California/7/09 (H1N1)(NYMC-X181) | NIBSC | 12/168 | Inactivated, partially purified A/California/7/09 (H1N1)(NYMC-X181) virus (ca. 46µgHA/ml) |
| Influenza antigen A/Switzerland/9715293/2013 (NIB88) | NIBSC | 14/254 | Inactivated, partially purified A/Switzerland/9715293/2013 (NIB88) virus (ca. 55µgHA/ml) |
| Influenza antigen A/Texas/50/2012 (H3N2)(NYMCX-223) | NIBSC | 13/112 | Inactivated, partially purified A/Texas/50/2012 (H3N2)(NYMCX-223) virus (ca. 74µgHA/ml) |
| Influenza antigen B/Brisbane/60/2008 | NIBSC | 13/234 | Inactivated, partially purified B/Brisbane/60/2008 virus (ca. 42µgHA/ml) |
| Influenza antigen B/Massachusetts/02/2012 | NIBSC | 13/134 | Inactivated, partially purified B/Massachusetts/02/2012 virus (ca. 35µgHA/ml) |
| Serum-Tubes | S-Monovette, Sardstedt | 01.1601.100 | For serum extraction with clotting activator |
| Single Donor Human RBC, Type 0 | Innovative Research | IPLA-WB3 | Suspension of single donor human red blood cells in Alsever's solution (ca. 26%) |
| Turkey RBC (10%) | Cedarlane | CLC1180 | 10% suspension of turkey red blood cells in Alsever's solution |
| Phosphate Buffered Saline (PBS) | Gibco |
참고문헌
- Prevention and control of seasonal influenza with vaccines. Recommendations of the Advisory Committee on Immunization Practices--United States, 2013-2014. MMWR Recomm Rep. 62, Centers for Disease, C. & Prevention. RR-07 1-43 (2013).
- Dominguez-Cherit, G., et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 302 (17), 1880-1887 (2009).
- Fox, B. D., et al. Pandemic influenza (H1N1): impact on lung transplant recipients and candidates. J Heart Lung Transplant. 29 (9), 1034-1038 (2010).
- Piercy, J., Miles, A., Krankheiten, S. B. fG. S. V., Values, M. The Economic Impact of Influenza in Switzerland: Interpandemic Situation. , Swiss Federal Office of Public Health, Division of Epidemiology and Infectious Diseases, Section of Viral Diseases and Sentinel Systems. (2003).
- Barclay, V. C., et al. Positive network assortativity of influenza vaccination at a high school: implications for outbreak risk and herd immunity. PLoS One. 9 (2), 87042(2014).
- Baluch, A., et al. Randomized controlled trial of high-dose intradermal versus standard-dose intramuscular influenza vaccine in organ transplant recipients. Am J Transplant. 13 (4), 1026-1033 (2013).
- Haralambieva, I. H., et al. The Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in Older Subjects. PLoS One. 10 (3), 0122282(2015).
- Egli, A., et al. Vaccine adjuvants--understanding molecular mechanisms to improve vaccines. Swiss Med Wkly. 144, 13940(2014).
- O'Shea, D., Widmer, L. A., Stelling, J., Egli, A. Changing face of vaccination in immunocompromised hosts. Curr Infect Dis Rep. 16 (9), 420(2014).
- Meulemans, G., Carlier, M. C., Gonze, M., Petit, P. Comparison of hemagglutination-inhibition, agar gel precipitin, and enzyme-linked immunosorbent assay for measuring antibodies against influenza viruses in chickens. Avian Dis. 31 (3), 560-563 (1987).
- Martins, T. B. Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile. Clin Diagn Lab Immunol. 9 (1), 41-45 (2002).
- Webster, R., Cox, N., Stöhr, K. WHO Animal Influenza Manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
- Mittelholzer, C. M., et al. Human cell lines used in a micro neutralization test for measuring influenza-neutralizing antibodies. Scand J Immunol. 63 (4), 257-263 (2006).
- Hamilton, R. S., Gravell, M., Major, E. O. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol. 38 (1), 105-109 (2000).
- Kumakura, S., et al. Comparison of hemagglutination inhibition assay and enzyme immunoassay for determination of mumps and rubella immune status in health care personnel. J Clin Lab Anal. 27 (5), 418-421 (2013).
- Ogundiji, O. T., Okonko, I. O., Adu, F. D. Determination of measles hemagglutination inhibiting antibody levels among school children in Ibadan, Nigeria. J Immunoassay Immunochem. 34 (2), 208-217 (2013).
- Cwach, K. T., Sandbulte, H. R., Klonoski, J. M., Huber, V. C. Contribution of murine innate serum inhibitors toward interference within influenza virus immune assay. Influenza Other Respir Viruses. 6 (2), 127-135 (2012).
- Lee, P. S., et al. Receptor mimicry by antibody F045-092 facilitates universal binding to the H3 subtype of influenza virus. Nat Commun. 5, 3614(2014).
- Blumel, B., et al. Age-related prevalence of cross-reactive antibodies against influenza A(H3N2) variant virus, Germany, 2003 to 2010. Euro Surveill. 20 (32), 16-24 (2015).
- Reber, A. J., et al. Seasonal Influenza Vaccination of Children Induces Humoral and Cell-Mediated Immunity Beyond the Current Season: Cross-reactivity with Past and Future Strains. J Infect Dis. , (2016).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유