Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un test d’Inhibition (HI) hémagglutination optimisé pour quantifier les titres d’anticorps spécifiques à la grippe
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les protocoles présentés décrivent comment effectuer un test d’inhibition hémagglutination afin de quantifier les titres d’anticorps spécifiques à la grippe d’échantillons de sérum des destinataires de vaccin contre la grippe. Le premier dosage détermine la concentration optimale d’antigène viral par hémagglutination. Le deuxième essai quantifie les titres d’anticorps spécifiques à la grippe par l’inhibition de l’hémagglutination.
Résumé
Les titres d’anticorps sont couramment utilisés comme marqueurs de substitution pour protection sérologique contre la grippe et d’autres agents pathogènes. Une connaissance approfondie de la production d’anticorps avant et après la vaccination est nécessaire pour comprendre l’immunité induite par le vaccin. Cet article décrit un protocole fiable de point par point afin de déterminer les titres d’anticorps spécifiques à la grippe. Le premier protocole décrit une méthode pour spécifier les montants d’antigène nécessaires d’hémagglutination, qui standardise les concentrations pour une utilisation ultérieure dans le second protocole (test d’hémagglutination, HA test). Le deuxième protocole décrit la quantification des titres d’anticorps spécifiques à la grippe contre différentes souches virales en utilisant une dilution en série de humaine sérique ou cellule surnageants de culture (hemagglutination inhibition test, test HI).
Ainsi appliquée, nous montrons la réponse en anticorps d’une cohorte en bonne santé, qui a reçu un vaccin antigrippal inactivé trivalent. En outre, la réactivité croisée entre les différents virus apparaît et méthodes pour minimiser les réactions croisées à l’aide de différents types d’animaux des globules rouges (hématies) sont expliquées. Le débat met en évidence les avantages et les inconvénients des essais présentés et comment la détermination des titres d’anticorps spécifiques à la grippe peut améliorer la compréhension de l’immunité liée au vaccin.
Introduction
Infection par le virus de la grippe est associée à une morbidité considérable, la mortalité et des coûts de santé élevés1,2,3,4. En particulier, personnes âgées, nouveaux-nés, femmes enceintes et les patients atteints de maladie chronique courent le risque de complications cliniques plus sévères. Vaccination contre les souches du virus grippal en circulation est donc la principale mesure d’alléger le fardeau de la maladie chez ces populations à risque élevé. L’augmentation de la réponse immunitaire individuelle après la vaccination, par exemple, des anticorps spécifiques à la grippe au-dessus d’un seuil de protection, réduit le risque individuel d’infection, en général la probabilité de transmission du virus au sein d’une population 5. une compréhension détaillée de l’induite par le vaccin immunitaire humorale chez les différentes populations et divers groupes d’âge est un élément clé pour répondre à des questions cliniques importantes6,7,8 , 9, telles que : pourquoi certains patients âgés ont-ils des infections malgré la vaccination précédente ? Ce qui est une protection induite par le vaccin « bonne » et « suffisante » ? Combien de fois un vaccin devraient-elles s’appliquer à un patient immunodéprimés rejoindre des titres protecteurs ? Quel est le dosage plus efficace ? Quel est l’impact d’un nouvel adjuvant sur les titres d’anticorps après la vaccination ? La mesure de la production de vaccin spécifique d’anticorps peut aider à répondre à ces questions importantes et d’améliorer les résultats de la vaccination.
La quantification des titres d’anticorps spécifiques du virus peut être effectuée avec différentes méthodes immunologiques. Cela inclut phase solide10 ou axée sur le talon des tests ELISA11 , HI test12et neutralisant essais13. Méthodes ELISA permettent de dépister des quantités relativement importantes de sérums contre les différents antigènes. En outre, immunoglobuline (Ig) M et des IgG spécifiques peuvent être explorées séparément. Bien que les caractéristiques d’un antigène, par exemple, la séquence linéaire d’acides aminés ou les particules virales peuvent influer sur la liaison des anticorps, le spectre des épitopes potentiels est très large et ne fournit pas d’informations sur si un anticorps réponse a pertinence fonctionnelle.
En revanche, le test de neutralisation détermine le potentiel d’anticorps fonctionnellement inhiber l’infection de cellules et reflète par conséquent le potentiel de neutralisation. Toutefois, cette méthode est très demande beaucoup de travail, nécessite la mise en culture du particulier de lignées cellulaires et de vivre virus, et donc, c’est fastidieux, coûteux et nécessite un équipement spécial.
Cet article décrit une étape par étape le HI axée sur l’Organisation mondiale de la santé OMS protocole12 afin de quantifier les titres d’anticorps spécifiques à la grippe. Hémagglutination est un effet caractéristique de certains virus entraînant l’agglutination des érythrocytes. L’inhibition de cet effet avec le sérum du patient permet la mesure des concentrations d’anticorps inhibiteurs, qui reflète un effet neutralisant.
Nous avons modifié le workflow of the WHO-Protocole afin de permettre une gestion plus efficace des échantillons multiples en même temps et en réduisant le temps requis. Le premier protocole décrit la détermination du potentiel d’agglutination d’un antigène spécifique de la grippe. Ce faisant, la concentration de l’antigène grippe correcte est déterminée pour le deuxième protocole. Cette partie doit être répétée avec chaque nouvel antigène viral, ainsi que chaque lot de sang.
Le deuxième protocole décrit la détermination des titres d’anticorps spécifiques à la grippe. Les protocoles présentés sont optimisés pour l’étude des virus de la grippe et des échantillons de sérum humain, cependant, il peut également être appliquée pour les échantillons de sérum de souris ou les surnageants de culture cellulaire de cellules immunitaires stimulées, par exemple, les lymphocytes B spécifiques du virus. Résultats peuvent être déterminées comme des titres mesurés absolues. Dans de nombreuses études de vaccin, les moyenne géométrique des titres et l’intervalle de confiance de 95 % sont indiqués pour chaque population particulière. Pour l’interprétation, la séroprotection ou séroconversion sont souvent utilisés pour décrire la sensibilité d’une population à un certain virus. Séroprotection est définie comme un titre de ≥1:40 et la séroconversion comme un titre de plus de 4 fois augmentent avec la réalisation des titres séroprotecteurs entre deux points dans le temps (le plus souvent avant la vaccination et 30 jours après la vaccination sont utilisés).
Les deux protocoles sont faciles à utiliser et peuvent être adaptés à un large éventail de questions de recherche. En particulier, ils peuvent servir à déterminer rapidement et de façon fiable les titres d’anticorps contre divers autres virus capable d’hémagglutination, telles que la rougeole, Polyomavirus, oreillons ou la rubéole14,15,16 .
Access restricted. Please log in or start a trial to view this content.
Protocole
Les protocoles d’étude ont été approuvées par la Commission d’examen éthique local (www.EKNZ.ch) et le consentement éclairé a été obtenu de tous les participants.
1. sérum Collection
- Prélever des échantillons de sérum d’êtres humains à des points d’intérêt. Pour cette étude, nous avons recueilli des sérums à 0 (moment de la vaccination contre la grippe), + 7, + 30, + 60 et + 180 jours après la vaccination.
- Pour obtenir le sérum, centrifuger les tubes à échantillon à 1 200 g pendant 10 min à température ambiante (20-25 ° C).
NOTE : Échantillons de sang Non centrifugés doivent être stockés à 4 ° C et pour pas plus de 24h. - Aliquoter le sérum dans différents tubes (cryo-flacons) et congélation à-80 ° C jusqu'à l’utilisation.
- Effectuer les essais ultérieurs batch-wise, y compris tous les temps-points de la personne à réduire la variabilité au sein d’un patient.
2. préparation des antigènes
ATTENTION : Cinq antigènes différents sont utilisés (voir Table des matières). Préparer les antigènes dans un laboratoire de niveau de biosécurité 2 (BSL-2).
- Selon les instructions du fabricant, reconstituer le contenu total d’une ampoule d’antigène lyophilisé de grippe avec 1,0 mL d’eau distillée et laisser l’antigène dissous au repos pendant un minimum de 5 min à température ambiante avant de procéder.
- Aliquote la solution d’antigène à 1,5 mL tubes et congeler à-80 ° C jusqu'à l’utilisation ultérieure.
3. préparation du filtrat de choléra
Nota : Filtrat de choléra est utilisé comme un récepteur destruction enzymatique (RDE) selon le protocole WHO12. Cette commande supprime le sérum qui perturberaient les test17inhibiteurs innées.
- Reconstituer le RDE lyophilisée selon les instructions du fabricant.
- Conserver la solution RDE dans un tube de 15 mL à 4 ° C jusqu'à l’utilisation ultérieure.
4. HA Assay
Remarque : Pour s’assurer que les dosages de HI sont comparables entre plusieurs planches, la même quantité de particules virales doit servir pour chaque plaque. Le test de HA (aussi appelé le titrage du HA) est effectué afin de quantifier les particules virales nécessaires d’hémagglutination et est enregistré dans les unités de HA. Une « unité » de l’hémagglutination est une unité opérationnelle dépend de la méthode utilisée pour le titrage du HA et n’est pas une mesure du montant absolu du virus. Ainsi, une unité HA est définie comme la quantité de virus pour agglutine un volume égal d’une suspension de RBC normalisé. Selon l’OMS, la quantité standard utilisée pour le dosage de HI est 4 HA unités par 25 µL. Pour une illustration du principe de l’essai HA Voir la Figure 1.

Figure 1 : Principe d’hémagglutination et inhibition de l’hémagglutination. Aucun hémagglutination se trouve dans une situation de contrôle négatif sans virus et des anticorps (colonne de gauche) et les érythrocytes ne résultats qu’en présence de virus de la grippe (colonne du milieu). Toutefois, lorsque l’hémagglutinine du virus de la grippe est bloquée par des anticorps spécifiques du virus alors aucun hémagglutination peut survenir (colonne de droite). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Remarque : Les globules rouges utilisés sont dépendants du type de virus de la grippe dans l’analyse (tableau 1). En outre, pour différents types de plaques de 96 puits micro titre, le temps d’incubation ainsi que l’apparition des cellules non agglutinées, formant ainsi différents (tableau 2).
| Antigène de l’influenza | A/California/7/09 (H1N1) | A/Suisse/9715293/2013 (H3N2) | A/Texas/50/2012 (H3N2) | B/Brisbane/60/08 | B/Massachusetts/02/2012 | ||
| Espèces de RBC | Poulet | Cochon d’Inde | Cochon d’Inde | Turquie | Turquie | ||
Tableau 1 : antigènes grippaux et espèces correspondantes de globules rouges. Selon les instructions du fabricant (NIBSC).
| Espèces de RBC | Poulet | Turquie | Cochon d’Inde | Humain de type O |
| Concentration de globules rouges (v/v) | 0,75 % | 0,75 % | 1 % | 1 % |
| Type de plaque de microtitration | Fond en V | Fond en V | Bas U | Bas U |
| Temps d’incubation, RT | 30 min | 30 min | 1 heure | 1 heure |
| Apparition de cellules non agglutinées, formant ainsi | Bouton * | Bouton * | Halo | Halo |
Tableau 2 : analyse des conditions avec différentes espèces de globules rouges. Selon le protocole de l’OMS. (* coule lorsque incliné).
-
Préparation de la Suspension de RBC
- Diluer la suspension stock RBC (10 %, v/v ; sauf humain de type O) (voir la Table des matières) avec phosphate buffered saline (PBS), afin de rendre les concentrations appropriées pour oiseaux et mammifères RBCs de 0,75 % et 1 %, respectivement.

Figure 2 : Plaque de conception de l’essai HA. Le titrage du HA est effectué en double. Pas d’antigène a été ajouté pour les lignes de contrôle. Voir aussi la Figure 4 pour la détermination de la meilleure concentration de l’antigène. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Préparation de la plaque de 96 puits Micro titre
Remarque : Voir la Figure 2 pour un aperçu de la conception de la plaque.- Ajouter 25 µL de PBS à puits 1 à 12 de chaque ligne utilisée d’une plaque de 96 puits micro titre à l’aide d’une pipette multicanaux (Figure 2). Utilisez la plaque en forme de V micro titre lorsque vous travaillez avec des globules rouges aviaires, comme le poulet et de dinde. Utilisez la plaque en forme de U micro titre lorsque vous travaillez avec des hématies chez les mammifères, comme cobaye et humain de type O (tableau 2).
- Ajouter 25 µL de l’antigène du virus grippal pour le premier puits de l’antigène-lignes, qui sont disposées en doublons. Aucun antigène n’est ajouté pour les lignes de contrôle. Les lignes de contrôle ne devraient pas montrer un effet d’hémagglutination et servent de témoins négatifs (Figure 2).
- Effectuer une dilution en série 2 fois en transférant 25 µL du premier puits de l’antigène-lignes à Herbert George wells successives à l’aide d’une pipette multicanaux. La composition de chaque étape de dilution de pipetage et descendre doucement 10 fois.
- Jeter la finale 25 µL des derniers puits.
- Ajouter 25 µL de PBS aux puits 1 à 12 de chaque ligne utilisée à l’aide d’une pipette multicanaux, afin d’atteindre un volume total de 50 µL / puits.
- Ajouter 50 µL de la suspension de RBC à chacun utilisé bien en utilisant une pipette multicanaux.
- Tapoter la plaque soigneusement 10 fois sur les quatre côtés pour mélanger.
- Couvrir la plaque avec un couvercle et laisser incuber à température ambiante le montant approprié de temps selon la RBC espèces utilisé (voir tableau 2). Ne pas déplacer la plaque tout en incubation.
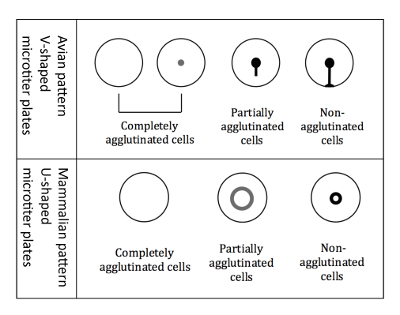
Figure 3 : Modèles agglutination des globules rouges oiseaux et mammifères. Plaques en forme de V micro titre sont utilisés lorsque vous travaillez avec des hématies aviaires. La lecture est effectuée dans une position inclinée de la plaque et non agglutinées, formant ainsi les globules rouges commencent à courir vers le bas formant une forme de larme. Plaques de microtitration en U sont utilisés lorsque vous travaillez avec des globules rouges chez les mammifères. La lecture est alors exécutée dans une position non inclinée, et non agglutinées, formant ainsi les globules rouges forment un petit halo. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Lecture de la plaque
Remarque : L’affichage est légèrement différente lorsque vous utilisez aviaires globules rouges par rapport aux globules rouges chez les mammifères, en raison des puits de différente forme titre micro (Figure 3).- Lecture de globules rouges aviaires
- Inclinaison de la plaque de 90° pour 25 s.
NOTE : Inclinaison de la plaque est cruciale pour la différenciation des modèles aviaires, parce que tous les trois types différents de modèles d’agglutination (complètement agglutinés, partiellement agglutinés et non agglutinés) apparaissent sous forme de bouton lorsque ne pas incliné. - Marquer les résultats immédiatement, tandis que la plaque est toujours en position inclinée, un schéma d’imprimés de la plaque à 96 puits. Les patrons de l’agglutination de la SCFR aviaire sont indiquées à la Figure 3.
- Inclinaison de la plaque de 90° pour 25 s.
- Lecture de globules rouges chez les mammifères
- Marquer les résultats concernant un régime d’imprimés de la plaque à 96 puits, sans l’incliner l’assiette (position horizontale sur le banc).
Remarque : En cas d’hémagglutination, les cellules agglutinés ne vous contentez pas vers le bas, alors que les cellules non-agglutinés apparaissent comme un halo au fond du puits. Le halo des cellules partiellement agglutinés est moins intense et a un diamètre plus grand (Figure 3).
- Marquer les résultats concernant un régime d’imprimés de la plaque à 96 puits, sans l’incliner l’assiette (position horizontale sur le banc).
- Détermination de 4 unités HA.
Remarque : Le point de fin de titrage HA est le dernier puits où hémagglutination complète se produit. Ce paquet contient bien 1 unité HA du virus. En raison du facteur 2 dilutions de l’antigène, deux puits devant le point de terminaison titrage HA est le puits qui contient 4 unités HA du virus (Figure 4).
- Lecture de globules rouges aviaires

Figure 4 : Lecture du titrage HA avec aviaires RBCs pour déterminer le titre de 4 unités HA. La quantité d’antigène optimale requise pour l’hémagglutination est mesurée par le test d’hémagglutination (essai de titrage de l’antigène). Le dernier puits où hémagglutination complète se produit est le point de terminaison titrage HA et contient 1 unité de HA. En raison des 2 fois les dilutions de l’antigène, deux puits devant le point de terminaison titrage HA, le titre correspond à 4 unités de HA. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
5. HI Assay
NOTE : Le flux de travail du protocole a été optimisé pour permettre une gestion plus efficace des échantillons multiples en même temps, à l’aide de la PCR tube rayé et un cycleur thermique (voir ci-dessous).
-
Préparation des échantillons de sérum
NOTE : Préparer les échantillons de sérum dans un laboratoire BSL-2.- Décongeler les échantillons de sérum congelé de chaque instant de chaque personne (Voir l’étape 1.2) à température ambiante.
- Ajouter une partie aliquote de 10 µL de chaque échantillon de sérum décongelés dans un tube d’une bande de tube PCR (10-tubes dans une bande).
NOTE : Le gros avantage de l’utilisation de bandes de tube PCR est qu’une pipette multicanaux peut être utilisée pour les opérations suivantes dans le test HI ; Cela permet d’économiser beaucoup de temps lors de l’essai d’une grande quantité d’échantillons de sérum et lors de l’exécution pour mesures répétées des mêmes échantillons les titres d’anticorps contre les souches de virus différents. - Stocker les échantillons de sérum aliquotés dans les bandes de tubes PCR à-80 ° C jusqu'à l’utilisation.
- Un jour avant le test HI est réalisé, décongeler les aliquotes d’échantillon de sérum d’intérêt à la température ambiante.
- Ajouter 10 µL de l’antisérum approprié dans un tube PCR.
Remarque : Pour servir comme témoin positif, le anti-sérum contre un virus spécifique doit correspondre le virus utilisé. Le contrôle positif permet de normalisation de la performance de plaque sur plusieurs plaques. - Ajouter 30 µL de solution de filtrat de choléra chaque aliquote de sérum et le sérum (3 volumes de filtrat de choléra à 1 volume de sérum) à l’aide d’une pipette multicanaux.
- Garder les tubes PCR dans un rack de PCR 96 puits ou une astuce-boîte vide et vortexer pendant 5 s.
- Incuber les échantillons pendant une nuit à 37 ° C à l’aide d’un cycleur thermique.
- Incuber les échantillons à 56 ° C pendant 30 min inactiver le filtrat de choléra à l’aide d’un cycleur thermique.
Remarque : Selon le cycleur thermique, cette étape peut être programmée pour automatiser davantage le processus. - Garder les tubes PCR dans un rack de PCR 96 puits ou une astuce-boîte vide et vortexer pendant 5 s.
- Stocker les échantillons à 4 ° C dans le réfrigérateur jusqu'à l’utilisation pour le dosage de HI.

Figure 5 : Plaque de conception et flux de travail de l’essai de HI. Cinq points dans le temps de deux personnes peuvent être mesurés sur une seule plaque. Le titre HI varie de 8 à 1 024. Un anti-sérum de l’antigène utilisé a été un témoin positif et un titrage en retour a été effectué afin de vérifier si la dilution d’antigène est égale à 4 unités HA. Les dilutions de l’échantillon de sérum sont indiquée pour 2 chaque vaccinées. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Salut test
Remarque : Pour une illustration du principe de l’essai HI Voir la Figure 1. Selon le virus, différentes espèces de globules rouges sont utilisés pour l’essai (tableau 1). Les différentes espèces de globules rouges sont utilisés dans différents types de plaques à 96 puits, et le temps d’incubation ainsi que l’apparition des cellules non agglutinées diffère (tableau 2). Pour le dosage de HI, 4 unités HA de virus ou d’antigène sont ajoutées à la série de 2 fois de dilution des échantillons.-
Préparation de la solution d’antigène
- Calculer le volume de solution d’antigène nécessaire selon le nombre de plaques de 96 puits utilisé (l’antigène 25 µL par bien l’antigène × 96 = 2 400 µL par plaque à 96 puits ; ajouter 100 µL par plaque supplémentaire en raison de l’utilisation d’un réservoir pour la pipette multicanaux ; au total 2,5 mL d’antige n par plaque).
NOTE : par exemple, si 100 échantillons de sérum de mesure alors 10 plaques sont nécessaires (10 échantillons par plaque) : 2,5 mL x 10 = 25 mL de solution d’antigène nécessaire au total. - Préparer la dilution appropriée de 4 HA unités pour le volume calculé à l’aide de PBS.
Remarque : les 4 HA unités sont déterminées pour le dosage HA. Le montant approprié de l’antigène, divisez le volume calculé par le titre correspondant à 4 unités HA. Par exemple, 4 HA unités correspondent à une dilution de 1/64, et nous avions besoin de 15 000 µL de solution d’antigène sont nécessaires : 15 000/64 = 234,4 µL de l’antigène de l’influenza lyophilisé dissous sont ajoutés.
- Calculer le volume de solution d’antigène nécessaire selon le nombre de plaques de 96 puits utilisé (l’antigène 25 µL par bien l’antigène × 96 = 2 400 µL par plaque à 96 puits ; ajouter 100 µL par plaque supplémentaire en raison de l’utilisation d’un réservoir pour la pipette multicanaux ; au total 2,5 mL d’antige n par plaque).
-
Préparation de la suspension de RBC
- Calculer le volume de la suspension de RBC nécessaire selon le nombre de plaques de 96 puits micro titre utilisé (50 µL de suspension de RBC par bien × 96 = 4 800 µL de suspension de RBC par plaque à 96 puits ; ajouter 200 µL par plaque supplémentaire en raison de l’utilisation d’un réservoir pour la pipette multicanaux) .
- Diluer la suspension stock RBC (normalement 10 %, v/v ; sauf humain de type O) avec du PBS pour faire les concentrations appropriées pour oiseaux et mammifères RBCs de 0,75 % et 1 %, respectivement.
-
Préparation de la plaque de 96 puits micro titre
- Étiqueter les plaques de 96 puits micro titre (échant, contrôle positif et titrage en retour). S’il vous plaît vérifier l’orientation de la plaque en Figure 5 .
- Ajouter 25 µL de PBS à chaque bien sauf pour le premier puits de la ligne « retour titrage » (Figure 5, 12ème ligne) à l’aide de la pipette multicanaux.
Remarque : Un titrage en retour a été effectué afin de vérifier si la dilution de l’antigène utilisé est égal à 4 unités HA. Un titre d’antigène de 4 unités HA est indiqué si hémagglutination se produit dans les trois premiers puits de la ligne « titrage de retour », mais pas dans le quatrième bien. - Ajouter 50 µL de la solution d’antigène préparée (voir 5.2.1) dans le premier puits de la ligne « retour titrage »(12 ligne) .
- Ajouter 25 µL des échantillons de sérum RDE traités dans les premiers puits de lignes 1 à 10 sur chaque assiette, à l’aide de la pipette multicanaux.
- Ajouter 25 µL de anti-sérum approprié pour le premier puits de la 11ème ligne comme témoin positif.
- Effectuer des dilutions successives 2 fois en transférant 25 µL du premier puits de chaque ligne (1-12) aux puits successifs à l’aide d’une pipette multicanaux. La composition de pipetage de haut en bas 10 - 15 fois pour chaque étape de dilution. Les mêmes conseils peuvent être utilisés pour chaque étape de dilution par échantillon.
- Jeter la finale 25 µL des derniers puits.
- Ajouter 25 µL de la solution d’antigène en utilisant une pipette multicanaux pour chaque puits de lignes 1 à 11 (échantillons de sérum et sérum). Les mêmes conseils peuvent être utilisés si elles ne touchent pas les puits.
- Ajouter 25 µL de PBS au lieu de l’antigène dans chaque loge de la ligne « retour titrage »(12 ligne) .
- Tapoter la plaque soigneusement 10 fois sur les quatre côtés pour mélanger.
- Couvrir la plaque avec un couvercle et laisser incuber à température ambiante pendant 30 min. Ne pas déplacer la plaque tout en incubation.
- Ajouter 50 µL de la suspension de RBC dans chaque cupule.
- Tapoter la plaque soigneusement 10 fois sur les 4 côtés pour mélanger.
- Couvrir la plaque avec un couvercle et laisser incuber à température ambiante le montant approprié de temps selon la RBC espèces utilisé (voir tableau 2). Ne pas déplacer la plaque tout en incubation.
-
Lecture de la plaque
NOTE : Le titre HI correspond à l’inverse de la dernière dilution du sérum (anti-) qui inhibe complètement hémagglutination. Il est important de considérer que les sérums RDE traités étaient déjà dilués 1:4 et après l’étape de dilution en série, le sérum dans les premier puits est dilué 1:8, ce qui correspond à un titre HI 8.- Lecture de globules rouges aviaires
- Inclinaison de la plaque de 90° pour 25 s.
NOTE : Inclinaison de la plaque est cruciale pour la différenciation des modèles aviaires, parce que tous les trois types différents de modèles d’agglutination (complètement agglutinés, partiellement agglutinés et non agglutinés) apparaissent sous forme de bouton lorsque ne pas incliné. - Marquer les résultats immédiatement, tandis que la plaque est toujours en position inclinée, un schéma d’imprimés de la plaque à 96 puits. Les patrons de l’agglutination des globules rouges aviaires sont indiquées à la Figure 3.
- Inclinaison de la plaque de 90° pour 25 s.
- Lecture de globules rouges chez les mammifères
- Marquer les résultats concernant un régime d’imprimés de la plaque à 96 puits, sans inclinaison de la plaque.
Remarque : En cas d’hémagglutination, les cellules agglutinés ne vous contentez pas vers le bas alors que non agglutinées, formant ainsi les cellules apparaissent comme un halo au fond du puits. Le halo des cellules partiellement agglutinés est moins intense et a un diamètre plus grand (Figure 3). - Déterminer le salut de chaque échantillon et le transférer dans un tableau informatisé (Figure 6)
- NOTE : Partiellement agglutinés puits ont déterminé un titre inférieur. Par exemple, si un échantillon de sérum inhibe complètement hémagglutination jusqu'à la 4e puits (dilution 1 : 64) et le 5ème bien (dilution 1 : 128) est partiellement agglutinée, puis le titre HI a la valeur la plus faible titre 64 pour l’analyse finale (Figure 6, 4ème rang).
- Marquer les résultats concernant un régime d’imprimés de la plaque à 96 puits, sans inclinaison de la plaque.
- Lecture de globules rouges aviaires
-
Préparation de la solution d’antigène

Figure 6 : Lecture du test HI avec aviaires RBCs. La grippe induite pre- et post-vaccinatoires réponse d’anticorps spécifiques est déterminée par dosage de HI. Dans cet exemple, personne a des titres plus élevés de HI que personne deux. Les deux personnes montrent une réponse en anticorps après la vaccination ; 180 jours après la vaccination, que les titres d’anticorps résultant de ces deux personnes sont encore une fois diminuées. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Résultats
Réponse en anticorps induits avant et après la vaccination contre la grippe A H3N2
La réponse immunitaire induite par le vaccin a été évaluée chez des volontaires sains 26 ayant reçu un vaccin sous-unitaire trivalent inactivé contenant de la grippe A/H1N1/California/2009 A/H3N2/Texas/2012 et B/Massachusetts/02/2012 avant le 2014 / saison grippale de 2015. La figure 6 montre un exemple représentatif de 2 vaccinées. Fait intéress...
Access restricted. Please log in or start a trial to view this content.
Discussion
Quantification des titres d’anticorps spécifiques de pré- et post-vaccinatoires grippe virus est un outil important et nécessaire pour les études de vaccin. Basé sur les mesures de substitution de protection contre l’infection par le virus, comme la séroprotection (> 01:40) ou séroconversion (titre 4 fois augmentation), vaccination stratégies peuvent être optimisés9. En utilisant les protocoles fournis peut déterminer : (i) le potentiel d’hémagglutination d’un virus particulie...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
A.E. a été appuyée par une recherche des subventions du programme « FNS Ambizione Score » (PZ00P3_154709), « Forschungsfond, Förderung strategischer Projekte » Université de Bâle, Bâle Stiftungsinfektionskrankheiten et Bangeter Rhyner Stiftung. L.K. a été financée par une subvention de l’Université de Graz, en Autriche technique. J.L. reconnaît la prise en charge par une bourse iPhD de l’initiative de SystemsX.ch au programme de biologie des systèmes (9ème appel).
Remerciements
aucun.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 25 ml Disposable Multichannel Pipette Reservoirs | Integra | 4312 | |
| 8-well PCR tubes | Brand GMBH | 781332 | For serum aliquots |
| 96-well microtiter plate, U-shaped | TPP | 92097 | For HI assay when using mammalian RBCs |
| 96-well microtiter plate, V-shaped | Corning Costar | 3897 | For HI assay when using avian RBCs |
| Aqua ad iniect. Steril | Bichsel AG | 1000004 | For preparing influenza antigen and cholera filtrate solutions |
| Chicken RBC (10%) | Cedarlane | CLC8800 | 10% suspension of chicken red blood cells in Alsever's solution |
| Cholera filtrate | Sigma-Aldrich | C8772 | Used as receptor destroying enzyme (RDE) |
| Dulbecco's PBS | Sigma-Aldrich | D8537 | For diluting the serum samples, RBCs and antigens |
| Eppendorf Multichannel pipette, 12-channel, 10-100 µl | Sigma-Aldrich | Z683949 | |
| Eppendorf Multichannel pipette, 8-channel, 10-100 µl | Sigma-Aldrich | Z683930 | |
| Guinea Pig RBC (10%) | Cedarlane | CLC1800 | 10% suspension of guinea pig red blood cells in Alsever's solution |
| Influenza Anti-A/California/7/09 HA serum | NIBSC | 14/134 | Used as positive control at the HI assay |
| Influenza Anti-A/Switzerland/9715293/2013-like HA serum | NIBSC | 14/272 | Used as positive control at the HI assay |
| Influenza Anti-A/Texas/50/2012-Like HA Serum | NIBSC | 13/178 | Used as positive control at the HI assay |
| Influenza Anti-B/Brisbane/60/2008-HA serum | NIBSC | 13/254 | Used as positive control at the HI assay |
| Influenza Anti-B/Massachusetts/02/2012 HA serum | NIBSC | 13/182 | Used as positive control at the HI assay |
| Influenza antigen A/California/7/09 (H1N1)(NYMC-X181) | NIBSC | 12/168 | Inactivated, partially purified A/California/7/09 (H1N1)(NYMC-X181) virus (ca. 46µgHA/ml) |
| Influenza antigen A/Switzerland/9715293/2013 (NIB88) | NIBSC | 14/254 | Inactivated, partially purified A/Switzerland/9715293/2013 (NIB88) virus (ca. 55µgHA/ml) |
| Influenza antigen A/Texas/50/2012 (H3N2)(NYMCX-223) | NIBSC | 13/112 | Inactivated, partially purified A/Texas/50/2012 (H3N2)(NYMCX-223) virus (ca. 74µgHA/ml) |
| Influenza antigen B/Brisbane/60/2008 | NIBSC | 13/234 | Inactivated, partially purified B/Brisbane/60/2008 virus (ca. 42µgHA/ml) |
| Influenza antigen B/Massachusetts/02/2012 | NIBSC | 13/134 | Inactivated, partially purified B/Massachusetts/02/2012 virus (ca. 35µgHA/ml) |
| Serum-Tubes | S-Monovette, Sardstedt | 01.1601.100 | For serum extraction with clotting activator |
| Single Donor Human RBC, Type 0 | Innovative Research | IPLA-WB3 | Suspension of single donor human red blood cells in Alsever's solution (ca. 26%) |
| Turkey RBC (10%) | Cedarlane | CLC1180 | 10% suspension of turkey red blood cells in Alsever's solution |
| Phosphate Buffered Saline (PBS) | Gibco |
Références
- Prevention and control of seasonal influenza with vaccines. Recommendations of the Advisory Committee on Immunization Practices--United States, 2013-2014. MMWR Recomm Rep. 62, Centers for Disease, C. & Prevention. RR-07 1-43 (2013).
- Dominguez-Cherit, G., et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 302 (17), 1880-1887 (2009).
- Fox, B. D., et al. Pandemic influenza (H1N1): impact on lung transplant recipients and candidates. J Heart Lung Transplant. 29 (9), 1034-1038 (2010).
- Piercy, J., Miles, A., Krankheiten, S. B. fG. S. V., Values, M. The Economic Impact of Influenza in Switzerland: Interpandemic Situation. , Swiss Federal Office of Public Health, Division of Epidemiology and Infectious Diseases, Section of Viral Diseases and Sentinel Systems. (2003).
- Barclay, V. C., et al. Positive network assortativity of influenza vaccination at a high school: implications for outbreak risk and herd immunity. PLoS One. 9 (2), 87042(2014).
- Baluch, A., et al. Randomized controlled trial of high-dose intradermal versus standard-dose intramuscular influenza vaccine in organ transplant recipients. Am J Transplant. 13 (4), 1026-1033 (2013).
- Haralambieva, I. H., et al. The Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in Older Subjects. PLoS One. 10 (3), 0122282(2015).
- Egli, A., et al. Vaccine adjuvants--understanding molecular mechanisms to improve vaccines. Swiss Med Wkly. 144, 13940(2014).
- O'Shea, D., Widmer, L. A., Stelling, J., Egli, A. Changing face of vaccination in immunocompromised hosts. Curr Infect Dis Rep. 16 (9), 420(2014).
- Meulemans, G., Carlier, M. C., Gonze, M., Petit, P. Comparison of hemagglutination-inhibition, agar gel precipitin, and enzyme-linked immunosorbent assay for measuring antibodies against influenza viruses in chickens. Avian Dis. 31 (3), 560-563 (1987).
- Martins, T. B. Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile. Clin Diagn Lab Immunol. 9 (1), 41-45 (2002).
- Webster, R., Cox, N., Stöhr, K. WHO Animal Influenza Manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
- Mittelholzer, C. M., et al. Human cell lines used in a micro neutralization test for measuring influenza-neutralizing antibodies. Scand J Immunol. 63 (4), 257-263 (2006).
- Hamilton, R. S., Gravell, M., Major, E. O. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol. 38 (1), 105-109 (2000).
- Kumakura, S., et al. Comparison of hemagglutination inhibition assay and enzyme immunoassay for determination of mumps and rubella immune status in health care personnel. J Clin Lab Anal. 27 (5), 418-421 (2013).
- Ogundiji, O. T., Okonko, I. O., Adu, F. D. Determination of measles hemagglutination inhibiting antibody levels among school children in Ibadan, Nigeria. J Immunoassay Immunochem. 34 (2), 208-217 (2013).
- Cwach, K. T., Sandbulte, H. R., Klonoski, J. M., Huber, V. C. Contribution of murine innate serum inhibitors toward interference within influenza virus immune assay. Influenza Other Respir Viruses. 6 (2), 127-135 (2012).
- Lee, P. S., et al. Receptor mimicry by antibody F045-092 facilitates universal binding to the H3 subtype of influenza virus. Nat Commun. 5, 3614(2014).
- Blumel, B., et al. Age-related prevalence of cross-reactive antibodies against influenza A(H3N2) variant virus, Germany, 2003 to 2010. Euro Surveill. 20 (32), 16-24 (2015).
- Reber, A. J., et al. Seasonal Influenza Vaccination of Children Induces Humoral and Cell-Mediated Immunity Beyond the Current Season: Cross-reactivity with Past and Future Strains. J Infect Dis. , (2016).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon