Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Grip özgü antikor titreleri ölçmek için bir en iyi duruma getirilmiş hemaglütinasyon inhibisyon (hı) tahlil
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Sunulan iletişim kuralları nasıl grip özgü antikor titreleri serum numuneleri grip aşısı alıcıların üzerinden ölçmek için bir hemaglütinasyon inhibisyon tahlil gerçekleştirileceğini açıklar. İlk tahlil hemaglütinasyon tarafından en iyi viral antijen konsantrasyonları belirler. İkinci tahlil hemaglütinasyon inhibisyon tarafından grip özgü antikor titreleri quantifies.
Özet
Antikor titreleri grip ve diğer patojenleri serolojik korunmak için vekil işaretleri olarak yaygın olarak kullanılır. Detaylı bilgi antikor üretim öncesi ve sonrası aşı aşı indüklenen dokunulmazlık anlamak için gereklidir. Bu makalede grip özgü antikor titreleri belirlemek için güvenilir bir noktası noktası protokolü. İlk protokol için ikinci Protokolü (hemaglütinasyon tahlil, HA tahlil) sonraki kullanım konsantrasyonları standartlaştıran hemaglütinasyon için gerekli antijen miktarları belirtmek için bir yöntem açıklanır. İkinci Protokolü grip özgü antikor titreleri farklı virüs suşları karşı miktar insan serum veya hücre kültür supernatants (hemaglütinasyon inhibisyon tahlil, HI tahlil) seri bir seyreltme kullanarak açıklar.
Uygulamalı örnek olarak, biz bir değerlikli Inaktif grip aşısı alınan sağlıklı bir kohort antikor tepki göstermek. Ayrıca, farklı grip virüsleri arasında olan gösterilir ve hayvan kırmızı kan hücrelerinin (RBCs) farklı türleri kullanarak olan en aza indirmek için yöntemleri açıklanmıştır. Tartışma avantajları ve dezavantajları sunulan deneyleri ve grip özgü antikor titreleri belirlenmesi aşı ile ilgili bağışıklık anlayış nasıl geliştirebiliriz vurgulamaktadır.
Giriş
Grip virüsü ile enfeksiyon önemli morbidite, mortalite ve yüksek sağlık maliyetleri1,2,3,4ile ilişkilidir. Özellikle, yaşlı, Yenidoğan, hamile kadınlar ve kronik hastalığı olan hastalarda daha ağır klinik sonuçlar için risk altındadır. Bu nedenle, aşı grip virüs suşları dolaşan karşı bu yüksek riskli nüfus hastalığında yükünü azaltmak için birincil ölçü birimi. Sonra aşı, örneğin, grip özgü antikorların koruyucu bir eşiğin bireysel bağışıklık yanıtının artış azaltır enfeksiyon ve genel olarak bireysel risk olasılığını bir nüfus içinde viral iletim 5. aşı indüklenen humoral bağışıklık yanıtı farklı nüfus ve çeşitli yaş grupları arasında detaylı bir anlayış önemli klinik soruları6,7,8 cevap için bir unsurdur , 9, aşağıdaki gibi: Neden bazı yaşlı hastalarda enfeksiyonlar önceki aşılama rağmen mi? Bir "iyi" ve "yeterli" aşı indüklenen koruması nedir? Ne sıklıkta bir aşı koruyucu titreleri ulaşmak için bir baskılanmış hastaya uygulanması gereken? En etkili doz nedir? Bir roman adjuvan sonrası aşılama antikor titreleri üzerinde etkisi nedir? Aşı özgü antikor üretimi ölçümü bu önemli sorulara cevap ve aşı sonuçları geliştirmek yardımcı olabilir.
Virüs özgü antikor titreleri miktar çeşitli immünolojik yöntemler ile yapılabilir. Bu katı fazlı10 veya boncuk tabanlı ELISA11 deneyleri, HI tahlil12ve nötralize deneyleri13içerir. ELISA tabanlı yöntemler serum numuneleri çeşitli antijenlere karşı nispeten büyük miktarda tarama olanak sağlar. Ayrıca, patojen özgü immünglobulin (Ig) M ve IgG ayrı olarak düzenlemelidir. Antijeni, örneğin, doğrusal amino asit dizisi veya virüs gibi parçacık özelliklerini bağlama antikorların etkileyebilir rağmen potansiyel epitopları yelpazesi çok geniş ve bilgi üzerinde olup olmadığını bir antikor sağlamaz Yanıt fonksiyonel ilgisi yok.
Buna ek olarak, nötralizasyon tahlil antikorlar enfeksiyon hücreleri işlevsel olarak inhibe potansiyeline belirler ve bu nedenle potansiyel nötralize yansıtır. Ancak, bu yöntem çok emek yoğun, belirli kültür satırları hücre ve virüs yaşayan ve bu nedenle, zaman alıcı, pahalı ve özel ekipman gerektirir gerektirir.
Grip özgü antikor titreleri ölçmek için HI Dünya Sağlık Örgütü WHO tabanlı protokol12 adım adım bu makalede anlatılmaktadır. Hemaglütinasyon eritrositler Aglutinasyon için önde gelen bazı virüsler karakteristik bir etkisidir. Bu etkiyi hasta sera ile inhibisyonu nötralize etkisi yansıtan inhibitör antikor konsantrasyonları, ölçüm sağlar.
İş akışını daha verimli kullanımı birden çok örneği aynı anda ve böylece azaltmak belgili tanımlık gerekli zaman izin vermek için WHO-protokol ve değişiklik yapmış. İlk protokolünü belirli grip antijen Aglutinasyon potansiyelinin belirlenmesi açıklar. Bunu yaparken, doğru grip antijen konsantrasyon için ikinci Protokolü belirlenir. Bu bölümü her yeni viral antijen ile yanı sıra her toplu kan yinelenmelidir.
İkinci Protokolü grip özgü antikor titreleri belirlenmesi açıklar. Sunulan iletişim kuralları ancak soruşturma grip virüsü ve insan serum numuneleri için optimize edilmiş, bu aynı zamanda fare serum numuneleri veya hücre kültürü supernatants için uyarılmış bağışıklık hücrelerinden, örneğin, virüs özgü B-hücreleri uygulanabilir. Sonuçları mutlak ölçülen titreleri belirlenebilir. Birçok aşı çalışmalarda, geometrik ortalama titreleri ve % 95 güven aralığı belirli her nüfus için gösterilir. Yorumu, seroprotection veya serokonversiyonu için sık sık bir popülasyona belirli virüs duyarlılık tanımlamak için kullanılır. Daha fazla 4-fold titresi seroprotective titreleri iki saat nokta (öncesi aşı ve 30 gün sonrası aşılama kullanılan özelliklerle) arasındaki başarı ile arttıkça Seroprotection ≥1:40 ve serokonversiyonu titresi tanımlanır.
Her iki iletişim kurallarını kullanmak çok kolay ve çok çeşitli araştırma soruları adapte edilebilir. Özellikle, onlar güvenilir ve hızlı bir şekilde belirlemek için kullanılabilir kapasiteli hemaglütinasyon, kızamık, polyomaviruses, kabakulak, kızamıkçık veya14,15,16 gibi çeşitli diğer virüslere karşı antikor titreleri .
Access restricted. Please log in or start a trial to view this content.
Protokol
Çalışma protokolleri yerel etik Değerlendirme Komitesi (www.EKNZ.ch) kabul edildi ve tüm katılımcılar yazılı Onam alındı.
1. serum koleksiyonu
- İnsanlar zaman makas-in ilgi, serum numuneleri toplamak. Bu çalışma için 0 (zaman Grip aşısının), + 7 + 30 + 60 ve + 180 gün sonra aşılama, sera toplanan.
- Serum elde etmek için 1200 x g için oda sıcaklığında (20-25 ° C) 10 dk de örnek tüpler santrifüj kapasitesi.
Not: Sigara centrifuged kan örnekleri 4 ° C'de ve artık 24 saat daha için saklanmalıdır. - Aliquot serum içine farklı tüpler (cryo-tüpleri) ve donma-80 ° c kadar kullanım.
- Sonraki deneyleri batch-wise, tüm zaman-noktaları bir hasta içinde değişkenliği azaltmak için bir kişi de dahil olmak üzere gerçekleştirin.
2. antijenleri hazırlanması
Dikkat: Beş farklı antijenler kullanılır (bkz. Tablo malzeme). Bir seviye 2 (BSL-2) laboratuvar antijenleri hazırlayın.
- Üreticinin yönergelerine uygun bir grip liyofilize antijen ampül toplam içeriği 1.0 mL distile su ile yeniden oluşturmak ve çözünmüş antijen 5 dk devam etmeden önce oda sıcaklığında en az durmak izin verir.
- Aliquot antijen çözüm 1.5 ml tüpler ve-80 ° C'de daha fazla kullanılmasını kadar dondurma.
3. kolera Filtrate hazırlanması
Not: Kolera filtrate enzim (RDE) WHO protokolü12göre yok bir reseptör olarak kullanılır. Bu doğuştan gelen inhibitörleri ile tahlil17müdahale serum kaldırır.
- Üreticinin yönergelerine göre lyophilized RDE sulandırmak.
- RDE çözüm 4 ° C'de 15 mL tüp kadar daha fazla kullanılmasını saklayın.
4. HA tahlil
Not: HI deneyleri birkaç tabak arasında karşılaştırılabilir olmasını sağlamak için virüs parçacıkları aynı miktarda her plaka için kullanılması gerekir. (HA titrasyon olarak da bilinir) HA tahlil virüs parçacıkları hemaglütinasyon için gerekli ölçmek için yapılır ve HA birimleri cinsinden kaydedilir. Hemaglütinasyon bir "birim" HA titrasyon için kullanılan yöntem bağımlı operasyonel bir birimidir ve virüs mutlak bir tutar bir ölçü birimi değil. Böylece, bir HA birimi virüs standartlaştırılmış bir RBC süspansiyon eşit bir hacmi agglutinate için gerekli miktarı olarak tanımlanır. DSÖ göre HI tahlil için kullanılan standart 4 HA adet başına 25 µL tutardır. HA tahlil ilkesine bir örnek için bkz: şekil 1.

Resim 1 : Hemaglütinasyon ve hemaglütinasyon inhibisyon prensibi. Virüsler ve antikor (sol sütun) olmadan bir negatif kontrol durumda hiçbir hemaglütinasyon oluşur ve sadece grip virüsü (orta sütunda) huzurunda eritrositler hemagglutinate. Ancak, grip virüsü hemagglutinin virüs özel antikorlar sonra hiçbir hemaglütinasyon tarafından engellendiğinde (sağ sütun) oluşabilir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Not: kullanılan RBCs grip virüsü tahlil (Tablo 1) türüne bağlı. Ayrıca, 96-şey mikro titresi tabak çeşitli türleri için kuluçka süresi hem de sigara zerrelerinden hücrelerinin görünümü (Tablo 2) farklı.
| Grip antijen | A/California/7/09 (H1N1) | A/İsviçre/9715293/2013 (H3N2) | A/Texas/50/2012 (H3N2) | B/Brisbane/60/08 | B/Massachusetts/02/2012 | ||
| RBC türler | Tavuk | Eskiden şiling şimdi domuz | Eskiden şiling şimdi domuz | Türkiye | Türkiye | ||
Tablo 1: grip antijenleri ve RBCs karşılık gelen türü. Üreticinin yönergelerine göre (NIBSC).
| RBC türler | Tavuk | Türkiye | Eskiden şiling şimdi domuz | İnsan tipi O |
| Konsantrasyonu RBCs (v/v) | % 0.75 | % 0.75 | % 1 | % 1 |
| Microtiter plaka türü | V alt | V alt | U alt | U alt |
| Kuluçka süresi, RT | 30 dk | 30 dk | 1 saat | 1 saat |
| Sigara zerrelerinden hücrelerinin görünümü | Düğme * | Düğme * | Halo | Halo |
Tablo 2: tahlil RBCs farklı tür koşullarla. WHO protokole göre. (* akar hareket ettirildiğinde zaman).
-
RBC süspansiyon hazırlanması
- RBC hisse senedi süspansiyon seyreltik (%10, v/v; hariç insan tipi O) ( Tablo malzemelerigörmek) fosfat ile serum fizyolojik (PBS) %0,75 ve % 1, kuş ve memeli RBCs için uygun konsantrasyonlarda sırasıyla yapmak için arabelleğe alınmış.

Resim 2 : Plaka tasarimi HA testin. HA titrasyon çoğaltmaları gerçekleştirilir. Hiçbir antijen denetim satır eklendi. Ayrıca şekil 4 en iyi antijen konsantrasyonu tayini için bkz. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
-
96-şey mikro titresi plaka hazırlanması
Not: Resim 2 plaka tasarım genel bakış için bkz:.- PBS 25 µL kuyu kullanılan her satırın bir 96-şey mikro titresi plaka için 1 ile 12 çok kanallı pipet (Şekil 2) kullanarak ekleyin. Mikro titresi V şekilli plaka tavuk ve hindi gibi kuş RBCs ile çalışırken kullanın. Mikro titresi U şekilli plaka memeli RBCs ile eskiden şiling şimdi domuz ve insan tipi O gibi (Tablo 2) çalışırken kullanın.
- Grip antijen 25 µL antijen-satırların çoğaltmaları düzenlenmiş olan ilk şey ekleyin. Hiçbir antijen kontrolü satırlarına eklenir. Denetim satır hemaglütinasyon etkisini göstermek gerektiğini ve negatif kontrol eder (Şekil 2) hizmet vermektedir.
- Bir seri logosuna 2 kat seyreltme 25 µL antijen-satırları ilk kuyudan için art arda gelen wells bir çok kanallı pipet kullanarak transfer ederek gerçekleştirmek. Her seyreltme adım yukarı ve aşağı yavaşça 10 kez pipetting tarafından mix.
- Son 25 µL son Wells atmak.
- PBS 25 µL kullanılan her satırındaki kuyu 1-12 toplam hacmi iyi başına 50 µL ulaşmak için bir çok kanallı pipet kullanarak ekleyin.
- Her şey bir çok kanallı pipet kullanarak kullanılan RBC süspansiyon 50 µL ekleyin.
- Plaka dikkatle karıştırmak için her dört kenardan 10 kez dokunun.
- Bir kapak ile plaka kapak ve oda sıcaklığında RBC tür kullanılır (bkz. Tablo 2) bağlı olarak uygun süreyi için kuluçkaya. Plaka kuluçka iken hareket ettirmeyin.
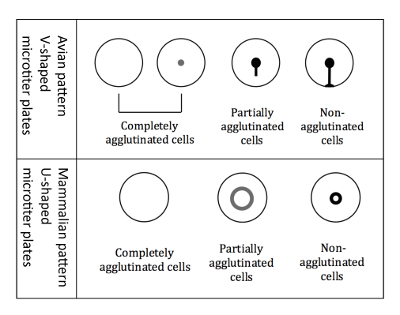
Şekil 3 : Kuş ve memeli RBCs şekillerinin Aglutinasyon. Mikro titresi V şekilli plaka kuş RBCs ile çalışırken kullanılır. Okuma bir hareket ettirildiğinde plaka konumda gerçekleştirilir ve zerrelerinden RBCs gözyaşı benzeri şekli oluşturan aşağı çalışmaya başlar. U şekilli microtiter plakaları memeli RBCs ile çalışırken kullanılır. Okuma sonra bir sigara eğik konumda gerçekleştirilir ve küçük bir hale zerrelerinden RBCs oluşturur. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
-
Plaka okuma
Not: Okuma kuş RBCs memeli RBCs için farklı şekilli mikro titresi wells (şekil 3) nedeniyle karşılaştırıldığında kullanırken biraz daha farklıdır.- Kuş RBCs okuma
- Plaka 25 90 ° eğim s.
Not: üç farklı tür Aglutinasyon desenleri (tamamen zerrelerinden, kısmen zerrelerinden ve zerrelerinden olmayan) bir düğme ne zaman değil eğik görünür çünkü plaka devirme kuş desenleri, farklılaşma için çok önemlidir. - Plakayı hala bir konumda hareket ettirildiğinde, yazdırılan bir düzeni 96-şey plaka üzerinde iken sonuçları hemen, mark. Kuş RBCs Aglutinasyon şekillerinin şekil 3' te gösterilmektedir.
- Plaka 25 90 ° eğim s.
- Memeli RBCs okuma
- Yazdırılan bir düzeni sonuçlarına 96-şey plaka, plaka (yatay konum bankta) devirme olmadan işaretleyin.
Not: hemaglütinasyon ortaya çıktığında, Kuyunun dibinde bir hale zerrelerinden olmayan hücreleri görünür, ancak zerrelerinden hücreleri yukarıdan aşağıya doğru razı değil. Halo kısmen zerrelerinden hücrelerinin daha az yoğun olduğu ve daha büyük çapı (şekil 3).
- Yazdırılan bir düzeni sonuçlarına 96-şey plaka, plaka (yatay konum bankta) devirme olmadan işaretleyin.
- 4 HA adet belirlenmesi.
Not: Tam hemaglütinasyon oluştuğu son şey HA titrasyon bitiş noktası var. Bu iyi virüs 1 HA birimi içerir. Antijen logosuna 2 kat dilutions nedeniyle, HA titrasyon bitiş noktası önde iki kuyu şey virüs (şekil 4) 4 HA birimlerini içerir yolunda.
- Kuş RBCs okuma

Şekil 4 : HA titrasyon okuma ile 4 HA adet titresi belirlemek için kuş RBCs. En iyi antijen miktarı hemaglütinasyon için gerekli hemaglütinasyon tahlil (antijen titrasyon tahlil) tarafından ölçülür. Tam hemaglütinasyon oluştuğu son iyi HA titrasyon bitiş noktasıdır ve 1 HA birimi içerir. Logosuna 2 kat dilutions antijen, HA titrasyon bitiş noktası önde iki kuyu nedeniyle 4 HA birimlerine titresi karşılık gelir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
5. HI tahlil
Not: İş akışı iletişim kuralı birden fazla örnekleri daha verimli bir işlem aynı anda izin ver, PCR kullanarak tüp çizgili ve termo cycler (aşağıya bakın) için optimize edilmiştir.
-
Serum numuneleri hazırlanması
Not: bir BSL-2 laboratuvar serum numuneleri hazırla.- Her bireyin her zaman noktasının donmuş serum numuneleri çözülme (bkz. Adım 1.2) oda sıcaklığında.
- Bir aliquot her çözdürülen serum örneği 10 µL PCR tüp şeridi (10-tek şerit tüplerde) bir tüp ekleyin.
Not: bir çok kanallı pipet HI tahlil aşağıdaki adımlarda için kullanılabilir PCR tüp şeritler kullanmanın en büyük avantajı olduğunu; Bu serum numuneleri büyük miktarda test ve performans ölçüleri aynı örnekleri için farklı virüs suşları karşı antikor titreleri tekrarlanan bir çok zaman kazandırır. - Bölünmemeli serum numuneleri kadar kullanmak PCR tüp şeritler-80 ° C'de depolayın.
- HI tahlil yapılmadan önce birgün serum örnek aliquots ilgi oda sıcaklığında erimek.
- Uygun anti-serum 10 µL boş bir PCR tüp ekleyin.
Not: olumlu bir denetim olarak hizmet için belirli bir virüs karşı anti-serumu kullanılan virüs aynı olmalıdır. Pozitif kontrol plaka performans standardizasyon üzerinde birden fazla tabak sağlar. - Kolera filtrate çözüm 30 µL her serum aliquot ve anti-serumu (Kolera filtrate 1 serum hacmiyle 3 cilt) bir çok kanallı pipet kullanarak ekleyin.
- PCR tüpleri tutmak bir PCR 96-şey raf veya bir boş ipucu-kutu ve 5 için girdap s.
- Gecede 37 ° C'de bir termo cycler kullanarak örnekleri kuluçkaya.
- Kolera filtrate termo cycler kullanarak devre dışı bırakabilirsiniz 30 dk 56 ° C'de örnekleri kuluçkaya.
Not: Termo cycler bağlı olarak bu adım daha otomatikleştirmek belgili tanımlık oluşum için programlanmış olabilir. - PCR tüpleri tutmak bir PCR 96-şey raf veya bir boş ipucu-kutu ve 5 için girdap s.
- 4 ° C'de örnekleri HI tahlil kullanıma kadar buzdolabında saklayın.

Şekil 5 : Plaka tasarım ve iş akışı HI testin. Beş saat Puan iki kişinin bir plaka üzerinde ölçülebilir. 1,024 için HI titresi aralıkları 8. Pozitif kontrol kullanılan antijen bir anti-serumu hizmet ve geri titrasyon antijen seyreltme 4 HA adet eşitse kontrol etmek için gerçekleştirildi. Serum örneği seri seyreltme 2 bireysel aşı alıcılarına gösterilir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
-
Merhaba tahlil
Not: HI tahlil ilkesine bir örnek için bkz. şekil 1. Virüs bağlı olarak farklı türler RBCs tahlil (Tablo 1) için kullanılır. RBCs farklı tür 96-şey plakaların çeşitli türlerinde kullanılır ve kuluçka süresi hem de sigara zerrelerinden hücrelerinin görünümü farklıdır (Tablo 2). HI tahlil için 4 HA adet virüs ya da antijen örnekleri logosuna 2 kat seyreltme dizisine eklenir.-
Antijen çözüm hazırlanması
- 96-şey plakalar kullanılan sayısına göre gerekli antijen çözüm hacmi hesaplamak (25 µL antijen de × 96 = 2400 µL antijen 96-şey plaka; başına başına 100 µL plaka için çok kanallı pipet; bir rezervuar kullanımı nedeniyle ilave ücret eklemek Toplam 2.5 mL antige n plaka başına).
Not: Örneğin, 100 serum numuneleri ölçme Eğer o zaman 10 tabak gerekli (plaka başına 10 örnek) vardır: 2.5 mL x 10 = 25 mL toplamda gerekli antijen çözeltisi. - 4 HA adet uygun seyreltme PBS kullanarak hesaplanan birim için hazırlayın.
Not: 4 HA adet HA tahlil için belirlenir. Antijen uygun miktarda için 4 HA adet için karşılık gelen titresi hesaplanan birim bölün. Örneğin, 4 HA adet 1/64 seyreltme için karşılık gelen ve 15.000 ihtiyacımız µL antijen çözüm ihtiyaç vardır: 15.000/64 234.4 = µL çözünmüş liyofilize grip antijen eklenir.
- 96-şey plakalar kullanılan sayısına göre gerekli antijen çözüm hacmi hesaplamak (25 µL antijen de × 96 = 2400 µL antijen 96-şey plaka; başına başına 100 µL plaka için çok kanallı pipet; bir rezervuar kullanımı nedeniyle ilave ücret eklemek Toplam 2.5 mL antige n plaka başına).
-
RBC süspansiyon hazırlanması
- 96-şey mikro titresi plakalar kullanılan sayısına göre gerekli RBC süspansiyon hacmi hesaplamak (50 µL RBC süspansiyon de × 96 = 4800 µL RBC süspansiyon 96-şey plaka; başına başına 200 µL plaka bir rezervuar için çok kanallı pipet kullanımı nedeniyle ilave ücret ekleyin) .
- RBC hisse senedi süspansiyon seyreltik (normalde %10, v/v; insan tipi O hariç) % 0.75 ve % 1, kuş ve memeli RBCs için uygun konsantrasyonlarda sırasıyla yapmak için PBS ile.
-
96-şey mikro titresi plaka hazırlanması
- 96-şey mikro titresi tabak (örnek kimliği, pozitif kontrol ve geri titrasyon) etiketleyin. Şekil 5 plaka yönde dikkatli bir şekilde gözden geçirin.
- Dışında her şey "titrasyon geri" satır (şekil 5,12 satır ) ilk de PBS 25 µL eklemek çok kanallı pipet kullanarak.
Not: Kullanılan antijen seyreltme 4 HA adet eşitse kontrol etmek için geri titrasyon gerçekleştirildi. 4 HA birimlerinin bir antijen titresi gösterilir hemaglütinasyon "titrasyon geri" satır ilk üç kuyu ama dördüncü de oluşup oluşmayacağını. - 50 µL (5.2.1 içinde açıklanan) hazırlanan antijen çözüm "titrasyon geri" satır(12 satır) ilk kuyusu ekleyin.
- RDE tedavi serum örneklerinin 25 µL satır 1-10 çok kanallı pipet kullanarak her plaka üzerinde ilk kuyu ekleyin.
- Uygun anti-serum 25 µL 11inci satır ilk kuyusu olumlu bir denetimi ekleyin.
- Seri logosuna 2 kat dilutions 25 µL (1-12) her satırın ilk kuyudan için art arda gelen wells bir çok kanallı pipet kullanarak transfer ederek gerçekleştirmek. Aşağı yukarı her seyreltme adım için 10 - 15 kez pipetting tarafından karıştırın. Aynı ipuçları her seyreltme adımı örnek başına için kullanılabilir.
- Son 25 µL son Wells atmak.
- Antijen çözüm 25 µL satır 1-11 (serum numuneleri ve anti-serumu) her şey için çok kanallı pipet kullanarak ekleyin. Kuyuları dokunmatik değil aynı ipuçları kullanılabilir.
- PBS 25 µL antijen yerine "titrasyon geri" satır(12 satır) her şey için ekleyin.
- Plaka dikkatle karıştırmak için her dört kenardan 10 kez dokunun.
- Bir kapak ile plaka kapak ve 30 dk için oda sıcaklığında kuluçkaya. Plaka kuluçka iken hareket ettirmeyin.
- RBC süspansiyon 50 µL her şey için ekleyin.
- Plaka dikkatle karıştırmak için her 4 taraftan 10 kez dokunun.
- Bir kapak ile plaka kapak ve oda sıcaklığında RBC tür kullanılır (bkz. Tablo 2) bağlı olarak uygun süreyi için kuluçkaya. Plaka kuluçka iken hareket ettirmeyin.
-
Plaka okuma
Not: HI titresi tamamen hemaglütinasyon engeller (anti-) serum son seyreltme karşılıklı olduğunu. RDE tedavi sera zaten 1:4 ve seri seyreltme adım sonra seyreltilmiş, seyreltilmiş 1:8, 8 için bir HI titresi karşılık gelen ilk Wells sera vardır dikkate almak önemlidir.- Kuş RBCs okuma
- Plaka 25 90 ° eğim s.
Not: üç farklı tür Aglutinasyon desenleri (tamamen zerrelerinden, kısmen zerrelerinden ve zerrelerinden olmayan) bir düğme ne zaman değil eğik görünür çünkü plaka devirme kuş desenleri, farklılaşma için çok önemlidir. - Plakayı hala bir konumda hareket ettirildiğinde, yazdırılan bir düzeni 96-şey plaka üzerinde iken sonuçları hemen, mark. Kuş RBCs Aglutinasyon şekillerinin şekil 3' te gösterilmektedir.
- Plaka 25 90 ° eğim s.
- Memeli RBCs okuma
- Yazdırılan bir düzeni sonuçlarına 96-şey plaka, plaka devirme olmadan işaretleyin.
Not: hemaglütinasyon ortaya çıktığında, Kuyunun dibinde bir hale zerrelerinden olmayan hücreleri görünür, ancak zerrelerinden hücreleri razı değil. Halo kısmen zerrelerinden hücrelerinin daha az yoğun olduğu ve daha büyük çapı (şekil 3). - HI her örneğinin belirlemek ve bilgisayarlı tabloya (şekil 6) transferi
- Not: Kısmen zerrelerinden kuyu alt titresi belirlenmiştir. Örneğin, bir serum örneği tamamen hemaglütinasyon (1: 64 seyreltme) kadar iyi 4 ve 5inci de engeller (1:128 seyreltme) kısmen zerrelerinden, sonra HI titresi düşük titresi 64 son tahlilde (şekil 6, için ayarlanır 4 satır).
- Yazdırılan bir düzeni sonuçlarına 96-şey plaka, plaka devirme olmadan işaretleyin.
- Kuş RBCs okuma
-
Antijen çözüm hazırlanması

Şekil 6 : HI tahlil okuma ile kuş RBCs. Öncesi ve sonrası aşı indüklenen grip spesifik antikor yanıtı HI tahlil tarafından belirlenir. Örneğin, bir kişi daha yüksek HI titreleri iki kişi daha var. Her iki kişi bir antikor yanıtı aşı sonrası gösterisi; 180 gün sonra aşılama antikor titreleri her iki kişi daha azalmıştır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Grip A H3N2 öncesi ve sonrası aşı indüklenen antikor yanıtı
Aşı indüklenen antikor yanıtı bir Inaktif trivalan alt birim grip aşısı grip A/H1N1/California/2009, A/H3N2/Texas/2012 ve B/Massachusetts/02/2012 2014 öncesinde içeren alınan 26 sağlıklı gönüllü olarak değerlendirildi / 2015 grip sezonu. Şekil 6 2 aşı alıcılarının temsil edici bir örnek göstermektedir. İlginçtir, o belirli grip sezonu boyunca A/...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Öncesi ve sonrası aşı grip virüsü spesifik antikor titreleri miktar aşı çalışmaları için gerekli önemli bir araçtır. Seroprotection gibi virüs bulaşmasına karşı koruma vekil tedbirlerinin temel (> 1:40) veya serokonversiyonu (4-fold titresi artış), aşı stratejileri-ebilmek var olmak en iyi duruma getirilmiş9. Sağlanan iletişim kurallarını kullanarak belirleyebilir: (i) hemaglütinasyon potansiyelini belli bir virüsün ve (ii) antikor titreleri ilgi bir virüs için.<...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
AE tarafından desteklenen bir araştırma (PZ00P3_154709), "SNSF Ambizione puan" programından verir "Forschungsfond, Förderung strategischer Projekte" Basel Üniversitesi, Stiftungsinfektionskrankheiten Basel ve Bangeter Rhyner Stiftung. L.K. teknik Graz Üniversitesi, Avusturya grant tarafından desteklenmiştir. JL destek sistemleri Biyoloji programında (9th çağrısı) SystemsX.ch girişim iPhD Kardeşliği tarafından kabul eder.
Teşekkürler
hiçbiri.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 25 ml Disposable Multichannel Pipette Reservoirs | Integra | 4312 | |
| 8-well PCR tubes | Brand GMBH | 781332 | For serum aliquots |
| 96-well microtiter plate, U-shaped | TPP | 92097 | For HI assay when using mammalian RBCs |
| 96-well microtiter plate, V-shaped | Corning Costar | 3897 | For HI assay when using avian RBCs |
| Aqua ad iniect. Steril | Bichsel AG | 1000004 | For preparing influenza antigen and cholera filtrate solutions |
| Chicken RBC (10%) | Cedarlane | CLC8800 | 10% suspension of chicken red blood cells in Alsever's solution |
| Cholera filtrate | Sigma-Aldrich | C8772 | Used as receptor destroying enzyme (RDE) |
| Dulbecco's PBS | Sigma-Aldrich | D8537 | For diluting the serum samples, RBCs and antigens |
| Eppendorf Multichannel pipette, 12-channel, 10-100 µl | Sigma-Aldrich | Z683949 | |
| Eppendorf Multichannel pipette, 8-channel, 10-100 µl | Sigma-Aldrich | Z683930 | |
| Guinea Pig RBC (10%) | Cedarlane | CLC1800 | 10% suspension of guinea pig red blood cells in Alsever's solution |
| Influenza Anti-A/California/7/09 HA serum | NIBSC | 14/134 | Used as positive control at the HI assay |
| Influenza Anti-A/Switzerland/9715293/2013-like HA serum | NIBSC | 14/272 | Used as positive control at the HI assay |
| Influenza Anti-A/Texas/50/2012-Like HA Serum | NIBSC | 13/178 | Used as positive control at the HI assay |
| Influenza Anti-B/Brisbane/60/2008-HA serum | NIBSC | 13/254 | Used as positive control at the HI assay |
| Influenza Anti-B/Massachusetts/02/2012 HA serum | NIBSC | 13/182 | Used as positive control at the HI assay |
| Influenza antigen A/California/7/09 (H1N1)(NYMC-X181) | NIBSC | 12/168 | Inactivated, partially purified A/California/7/09 (H1N1)(NYMC-X181) virus (ca. 46µgHA/ml) |
| Influenza antigen A/Switzerland/9715293/2013 (NIB88) | NIBSC | 14/254 | Inactivated, partially purified A/Switzerland/9715293/2013 (NIB88) virus (ca. 55µgHA/ml) |
| Influenza antigen A/Texas/50/2012 (H3N2)(NYMCX-223) | NIBSC | 13/112 | Inactivated, partially purified A/Texas/50/2012 (H3N2)(NYMCX-223) virus (ca. 74µgHA/ml) |
| Influenza antigen B/Brisbane/60/2008 | NIBSC | 13/234 | Inactivated, partially purified B/Brisbane/60/2008 virus (ca. 42µgHA/ml) |
| Influenza antigen B/Massachusetts/02/2012 | NIBSC | 13/134 | Inactivated, partially purified B/Massachusetts/02/2012 virus (ca. 35µgHA/ml) |
| Serum-Tubes | S-Monovette, Sardstedt | 01.1601.100 | For serum extraction with clotting activator |
| Single Donor Human RBC, Type 0 | Innovative Research | IPLA-WB3 | Suspension of single donor human red blood cells in Alsever's solution (ca. 26%) |
| Turkey RBC (10%) | Cedarlane | CLC1180 | 10% suspension of turkey red blood cells in Alsever's solution |
| Phosphate Buffered Saline (PBS) | Gibco |
Referanslar
- Prevention and control of seasonal influenza with vaccines. Recommendations of the Advisory Committee on Immunization Practices--United States, 2013-2014. MMWR Recomm Rep. 62, Centers for Disease, C. & Prevention. RR-07 1-43 (2013).
- Dominguez-Cherit, G., et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 302 (17), 1880-1887 (2009).
- Fox, B. D., et al. Pandemic influenza (H1N1): impact on lung transplant recipients and candidates. J Heart Lung Transplant. 29 (9), 1034-1038 (2010).
- Piercy, J., Miles, A., Krankheiten, S. B. fG. S. V., Values, M. The Economic Impact of Influenza in Switzerland: Interpandemic Situation. , Swiss Federal Office of Public Health, Division of Epidemiology and Infectious Diseases, Section of Viral Diseases and Sentinel Systems. (2003).
- Barclay, V. C., et al. Positive network assortativity of influenza vaccination at a high school: implications for outbreak risk and herd immunity. PLoS One. 9 (2), 87042(2014).
- Baluch, A., et al. Randomized controlled trial of high-dose intradermal versus standard-dose intramuscular influenza vaccine in organ transplant recipients. Am J Transplant. 13 (4), 1026-1033 (2013).
- Haralambieva, I. H., et al. The Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in Older Subjects. PLoS One. 10 (3), 0122282(2015).
- Egli, A., et al. Vaccine adjuvants--understanding molecular mechanisms to improve vaccines. Swiss Med Wkly. 144, 13940(2014).
- O'Shea, D., Widmer, L. A., Stelling, J., Egli, A. Changing face of vaccination in immunocompromised hosts. Curr Infect Dis Rep. 16 (9), 420(2014).
- Meulemans, G., Carlier, M. C., Gonze, M., Petit, P. Comparison of hemagglutination-inhibition, agar gel precipitin, and enzyme-linked immunosorbent assay for measuring antibodies against influenza viruses in chickens. Avian Dis. 31 (3), 560-563 (1987).
- Martins, T. B. Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile. Clin Diagn Lab Immunol. 9 (1), 41-45 (2002).
- Webster, R., Cox, N., Stöhr, K. WHO Animal Influenza Manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
- Mittelholzer, C. M., et al. Human cell lines used in a micro neutralization test for measuring influenza-neutralizing antibodies. Scand J Immunol. 63 (4), 257-263 (2006).
- Hamilton, R. S., Gravell, M., Major, E. O. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol. 38 (1), 105-109 (2000).
- Kumakura, S., et al. Comparison of hemagglutination inhibition assay and enzyme immunoassay for determination of mumps and rubella immune status in health care personnel. J Clin Lab Anal. 27 (5), 418-421 (2013).
- Ogundiji, O. T., Okonko, I. O., Adu, F. D. Determination of measles hemagglutination inhibiting antibody levels among school children in Ibadan, Nigeria. J Immunoassay Immunochem. 34 (2), 208-217 (2013).
- Cwach, K. T., Sandbulte, H. R., Klonoski, J. M., Huber, V. C. Contribution of murine innate serum inhibitors toward interference within influenza virus immune assay. Influenza Other Respir Viruses. 6 (2), 127-135 (2012).
- Lee, P. S., et al. Receptor mimicry by antibody F045-092 facilitates universal binding to the H3 subtype of influenza virus. Nat Commun. 5, 3614(2014).
- Blumel, B., et al. Age-related prevalence of cross-reactive antibodies against influenza A(H3N2) variant virus, Germany, 2003 to 2010. Euro Surveill. 20 (32), 16-24 (2015).
- Reber, A. J., et al. Seasonal Influenza Vaccination of Children Induces Humoral and Cell-Mediated Immunity Beyond the Current Season: Cross-reactivity with Past and Future Strains. J Infect Dis. , (2016).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır