需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种优化的血凝抑制 (HI) 测定流感特异抗体滴
* 这些作者具有相同的贡献
摘要
本协议描述了如何进行血凝抑制试验, 以量化流感疫苗接受者血清样本中的流感特异性抗体滴。第一种方法是通过血凝法确定最佳病毒抗原浓度。第二种方法通过血凝抑制来量化流感特异抗体滴。
摘要
抗体滴是常用的替代标志, 用于血清保护流感和其他病原体。对抗体产生前和后接种的详细知识需要了解疫苗诱导免疫。本文介绍了一个可靠的点对点协议来确定流感特异抗体滴。第一个协议描述了一种方法来指定血凝所需的抗原量, 它标准化了第二个协议中随后使用的浓度 (血凝试验, HA 测定)。第二个协议描述了对不同病毒株的流感特异性抗体滴的定量化, 使用人血清或细胞培养清 (血凝抑制法, HI 测定) 的序列稀释。
作为一个应用实例, 我们展示了一个健康的队列的抗体应答, 它接受了三价灭活流感疫苗。此外, 还说明了不同流感病毒之间的交叉反应性, 并解释了使用不同类型的动物红细胞 (红细胞) 减少交叉反应性的方法。讨论突出了所提出的化验的优缺点, 以及如何确定流感特异抗体滴可以提高对疫苗相关免疫的认识。
引言
感染流感病毒与相当大的发病率, 死亡率和高医疗费用相关的1,2,3,4。特别是, 老年人、新生儿、孕妇和慢性病患者面临更严重的临床后果。因此, 预防循环流感病毒株的接种是降低高危人群疾病负担的主要措施。疫苗接种后个体免疫应答的增加,例如, 高于保护性阈值的流感特异性抗体, 降低了个体感染的风险, 并在总体上减少了病毒在人群中传播的可能性5. 详细了解不同人群及各年龄组的疫苗诱导体液免疫应答是回答重要临床问题的关键因素6、7、8,9, 例如: 为什么有些老年患者尽管曾接种过疫苗, 但仍有感染?什么是 "好" 和 "足够" 疫苗诱导的保护?疫苗应多久免疫患者才能达到保护性滴?什么是最有效的剂量?新佐剂对后接种抗体滴的影响是什么?对疫苗特异抗体的测定可以帮助回答这些重要问题, 提高疫苗接种效果。
病毒特异性抗体滴的定量可以用各种免疫学方法进行。这包括固相10或基于磁珠的 ELISA11化验、HI 化验12和中和分析13。以 ELISA 为基础的方法可以筛选相对大量的血清标本对各种抗原。另外, 可以分别探讨病原体特异免疫球蛋白 (Ig) 和 IgG。虽然抗原的特征,如例如, 线性氨基酸序列或类似病毒的微粒可能影响抗体的结合, 潜在的表位的光谱是非常宽广的并且不提供信息关于是否抗体响应具有功能相关性。
与此相反, 中和试验确定了抗体在功能上抑制细胞感染的潜能, 从而反映了中和电位。然而, 这种方法是非常劳动密集型, 需要培养特定的细胞系和活病毒, 因此, 它是费时, 昂贵, 并要求特殊设备。
本文介绍了一个循序渐进的世界卫生组织 (WHO) 为基础的 HI 协议12 , 以量化流感特异性抗体滴。血凝是某些病毒导致红细胞凝集的一种特征性效应。这种效果与患者血清的抑制, 使抑制抗体浓度的测量, 这反映了中和效应。
我们修改了 WHO 协议的工作流程, 以便在同一时间更有效地处理多个样本, 从而减少所需的时间。第一个协议描述了特定流感抗原的凝集电位的测定。这样做, 确定了正确的流感抗原浓度的第二个协议。这部分应重复每一个新的病毒抗原, 以及每一批血液。
第二个协议描述了流感特异性抗体滴的测定。针对流感病毒和人血清样本的研究, 提出的协议进行了优化但是, 它也可以用于小鼠血清样本或细胞培养清的刺激免疫细胞,例如, 特定病毒 B 细胞。结果可以确定为绝对测量滴。在许多疫苗研究中, 每个特定种群都显示了几何平均滴和95% 置信区间。对于解释, seroprotection 或血清经常被用来描述人口对某种病毒的易感性。Seroprotection 被定义为≥1:40 的效价, 血清为超过4倍的效价增加与 seroprotective 滴在两个时间点之间的成就 (最常见的预接种和30天后接种使用)。
这两种协议都很容易使用, 而且可以适应范围广泛的研究问题。特别是, 他们可以用来确定可靠和快速的抗体滴对其他各种病毒的血凝能力, 如麻疹, polyomaviruses, 腮腺炎, 或风疹14,15,16.
Access restricted. Please log in or start a trial to view this content.
研究方案
研究方案通过当地道德审查委员会 (www.EKNZ.ch) 批准, 并获得了所有与会者的书面知情同意。
1. 血清采集
- 在感兴趣的时间点从人体收集血清样本。在这项研究中, 我们收集的血清在0天 (流感疫苗接种时间), + 7, + 30, + 60, 和 +180 后接种。
- 为了获得血清, 离心的样品管在 1200 x g 为10分钟室温 (20-25 ° c)。
注: 非离心血液样品应贮存在4° c, 且不超过24小时。 - 将血清分到不同的管中 (冷冻瓶), 并在-80 ° c 冷冻直至使用。
- 执行随后的化验批次-明智的, 包括一个人的所有时间点, 以减少在病人的变异性。
2. 抗原的制备
警告: 使用五种不同的抗原 (请参见材料表)。在生物安全2级 (BSL-2) 实验室制备抗原。
- 根据制造商的指示, 重建一个冻干流感抗原安瓿的总内容与1.0 毫升蒸馏水, 并允许溶解抗原在室温下至少站立5分钟, 然后再继续。
- 将抗原溶液分至1.5 毫升管, 并在-80 ° c 冷冻, 直至进一步使用。
3. 霍乱滤液的制备
注: 霍乱滤液根据 WHO 协议12被用作受体破坏酶 (RDE)。这将消除血清中的天然抑制剂, 这将干扰化验17。
- 根据制造商的说明重组冻干 RDE。
- 将 RDE 溶液储存在4° c 的15毫升管中直到进一步使用。
4. HA 测定
注意: 为了确保高含量的样品在几个板块之间是可比较的, 每个盘子必须使用相同数量的病毒颗粒。ha 检测 (也称为 ha 滴定) 是用来量化的病毒粒子的血凝必要的, 并记录在 ha 单位。血凝的 "单位" 是一个操作单位, 依赖于用于 HA 滴定的方法, 而不是测量绝对数量的病毒。因此, HA 单位被定义为凝集标准红细胞悬浮液的等量量所需的病毒数量。根据 WHO 的标准量, 用于高含量的检测是每25µL 4 公顷的单位。有关 HA 测定的原理的说明, 请参见图 1。

图 1: 血凝和血凝抑制的原理.在没有病毒和抗体 (左栏) 的阴性控制情况下, 没有血凝发生, 只有在流感病毒 (中柱) 存在的红细胞 hemagglutinate。然而, 当流感病毒的血被特定病毒抗体阻断时, 就不会发生血凝 (右栏)。请单击此处查看此图的较大版本.
注: 所使用的红细胞取决于检测中的流感病毒类型 (表 1)。此外, 对于各种类型的96井微滴板, 孵化时间以及非粘结细胞的外观不同 (表 2)。
| 流感抗原 | A/California/7/09 (H1N1) | A/Switzerland/9715293/2013 (H3N2) | A/Texas/50/2012 (H3N2) | B/Brisbane/60/08 | B/Massachusetts/02/2012 | ||
| 红细胞种类 | 鸡 | 豚鼠 | 豚鼠 | 土耳其 | 土耳其 | ||
表 1: 流感抗原及相应种类的红细胞。根据制造商的说明 (NIBSC)。
| 红细胞种类 | 鸡 | 土耳其 | 豚鼠 | 人型 O |
| 红细胞浓度 (v/v) | 0.75% | 0.75% | 1% | 1% |
| 孔板类型 | V 底 | V 底 | U 底 | U 底 |
| 孵化时间, RT | 30分钟 | 30分钟 | 1小时 | 1小时 |
| 非粘结细胞的外观 | 按钮* | 按钮* | 光环 | 光环 |
表 2: 不同种类的红细胞的测定条件.根据世卫组织的议定书。(* 倾斜时流动)。
-
红细胞悬浮液的制备
- 稀释红细胞悬浮物 (10%, v/v; 除了人类类型 O) (见材料表) 与磷酸盐缓冲盐水 (PBS), 使适当浓度的鸟类和哺乳动物红细胞的0.75% 和 1%, 分别。

图 2: HA 检测的板设计.HA 滴定是重复执行的。控制行中没有添加抗原。还请参见图 4确定最佳抗原浓度。请单击此处查看此图的较大版本.
-
96井微滴板的制备
注意: 有关板设计的概述, 请参见图 2 。- 使用多通道吸管 (图 2), 在96阱微滴板的每行使用1至12的µL 中添加25的 PBS。使用 V 型微滴板时, 与禽红细胞, 如鸡肉和土耳其工作。使用 U 型微滴板时, 与哺乳动物红细胞, 如豚鼠和人类类型 O (表 2) 工作。
- 在抗原行的第一个井中加入25µL 流感抗原, 这是以重复的方式排列的。控制行中不添加抗原。控制行不应显示血凝效果并充当负控制 (图 2)。
- 通过使用多通道吸管将25µL 从抗原行的第一口井转移到连续井, 进行连续2倍稀释。每稀释一步由移上下轻轻10次。
- 丢弃最后一口井的最后25µL。
- 使用多通道吸管将 PBS 的25µL 添加到1到12的每一个行中, 以达到每井50µL 的总体积。
- 加入50µL 的红细胞悬浮液, 每一个使用多通道吸管。
- 小心地轻敲盘子10次在所有四边混合。
- 用盖子盖住盘子, 在室温下孵育适当的时间, 这取决于所使用的红细胞种类 (参见表 2)。在孵化时不要移动盘子。
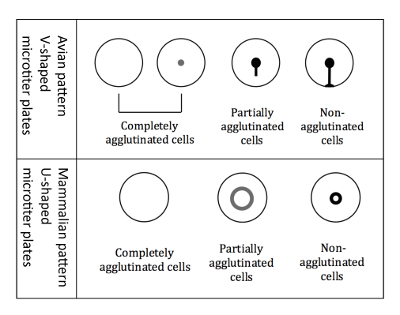
图 3: 鸟类和哺乳动物红细胞的凝集模式.在与禽红细胞工作时, 使用 V 型微滴板。读数是在倾斜的板块位置, 非粘结红细胞开始运行下来形成一个撕裂状的形状。U 形孔板使用时, 与哺乳动物红细胞。然后在非倾斜位置进行读数, 非粘结红细胞形成一个小光环。请单击此处查看此图的较大版本.
-
阅读板
注: 与哺乳动物红细胞相比, 由于不同形状的微滴度井 (图 3), 在使用禽红细胞时, 读数略有不同。- 禽红细胞的读数
- 倾斜板90°二十五年代。
注: 倾斜板对禽型的分化至关重要, 因为所有三种不同类型的凝集模式 (完全粘结、部分粘结和非粘结) 在不倾斜时显示为按钮。 - 立即标记结果, 而该板仍处于倾斜位置, 在96井板的打印方案。禽红细胞的凝集模式如图 3所示。
- 倾斜板90°二十五年代。
- 哺乳动物红细胞的读数
- 将结果标记在96井板的打印方案上, 而不倾斜板 (工作台的水平位置)。
注: 当血凝发生时, 粘结细胞不会沉淀到底部, 而非粘结细胞则会出现在井底的光环中。部分粘结的细胞的晕强度较小, 直径较大 (图 3)。
- 将结果标记在96井板的打印方案上, 而不倾斜板 (工作台的水平位置)。
- 4公顷单位的测定。
注: HA 滴定终点是完全血凝发生的最后一处井。这井包含1公顷的病毒单位。由于抗原的2倍稀释, 在 ha 滴定终点之前的两口井是包含4公顷病毒的井 (图 4)。
- 禽红细胞的读数

图 4: ha 滴定与禽红细胞的读数, 以确定 4 ha 单位的效价.用血凝试验 (抗原滴定法) 测定血凝所需的最佳抗原量。最后一井, 完全血凝发生是 ha 滴定终点和包含1公顷单位。由于抗原的2倍稀释, 在 ha 滴定终点之前有两口井, 其滴度对应于4公顷的单位。请单击此处查看此图的较大版本.
5. HI 检测
注意: 该协议的工作流程已经过优化, 可以同时使用 PCR 管条纹和热循环更有效地处理多个样品。
-
血清标本的制备
注: 在 BSL-2 实验室制备血清样品。- 在室温下解冻每个人的每个时间点的冰冻血清样本 (见步骤 1.2)。
- 将每个解冻的血清样本的分10µL 添加到 PCR 管条 (一条带10管) 的试管中。
注: 使用 PCR 管条的最大优点是多通道吸管可用于以下步骤的 HI 测定;这节省了大量的时间, 当测试大量的血清样本和执行重复的措施相同的样本抗体滴对不同的病毒株。 - 将 aliquoted 血清样本储存在-80 ° c 的 PCR 管条中直到使用。
- 在进行 HI 化验前的一天, 在室温下解冻血清样品等分。
- 在一个空的 PCR 管中加入10µL 的适当抗血清。
注意: 作为一个积极的控制, 抗血清对特定的病毒必须匹配使用的病毒。正向控制允许在多个板上对板的性能进行标准化。 - 使用多通道吸管将30µL 的霍乱滤液溶液添加到每个血清分和抗血清 (3 卷霍乱滤液到1的血清) 中。
- 将 pcr 管放在 pcr 的96井机架上, 或者是一个空的尖盒和 5 s 的涡流。
- 用热循环在37° c 的夜间孵育样品。
- 在56° c 孵育样品30分钟, 用热循环将霍乱滤液灭活。
注: 根据热循环, 此步骤可编程以进一步自动化过程。 - 将 pcr 管放在 pcr 的96井机架上, 或者是一个空的尖盒和 5 s 的涡流。
- 将样品储存在4° c 的冰箱中, 直到用于 HI 化验。

图 5: 板的设计和工作流程的 HI 检测.两个人的五时间点可以在一个板块上测量。高滴度范围从8到1024。对所用抗原的抗血清作阳性对照, 并进行反滴定检查抗原稀释是否等于 4 HA 单位。血清样本的序列稀释显示为2个人疫苗接受者。 请单击此处查看此图的较大版本.
-
HI 检测
注: 为高分析的原则的例证参见图 1。根据病毒, 不同种类的红细胞用于检测 (表 1)。不同种类的红细胞用于各种类型的 96-井板, 孵化时间以及非粘结细胞的外观不同 (表 2)。对于 HI 化验, 4 公顷的病毒或抗原的单位被添加到2倍稀释系列的样品。-
抗原溶液的制备
- 根据所使用的96井板的数量计算所需抗原溶液的体积 (25 µL 抗原每 96 = 2400 µL 抗原每 96-井板; 增加100µL 每盘由于多通道吸管的使用水库; 共2.5 毫升的 antigen 每盘)。
注: 例如, 如果测量100血清样本, 则需要10板 (每盘10样品): 2.5 毫升 x 10 = 25 毫升的抗原溶液总共需要。 - 使用 PBS 为计算出的容积准备适当稀释 4 HA 单位。
注: 4 公顷单位是确定的 ha 化验。对于适当的抗原量, 除以与 4 HA 单位对应的滴度计算的体积。例如, 4 HA 单位对应于稀释 1/64, 并且我们需要1.5万µL 抗原解答是需要的: 1.5万/64 = 234.4 µL 溶解冻干流感抗原被增加。
- 根据所使用的96井板的数量计算所需抗原溶液的体积 (25 µL 抗原每 96 = 2400 µL 抗原每 96-井板; 增加100µL 每盘由于多通道吸管的使用水库; 共2.5 毫升的 antigen 每盘)。
-
红细胞悬浮液的制备
- 根据所使用的96井微滴度板的数量计算红细胞悬浮液的体积 (50 µL 红细胞悬架每井 x 96 = 4800 µL 红细胞悬浮每 96-井板; 添加200µL 每板额外由于使用了一个水库为多通道吸管).
- 稀释红细胞悬浮液 (通常为 10%, v/v; 除了人型 O) 与 PBS, 使适当的浓度为鸟类和哺乳动物红细胞的0.75% 和1% 分别。
-
96井微滴板的制备
- 标签96井微滴板 (样品 ID, 阳性对照, 和背部滴定)。请仔细检查图 5中的板方向。
- 除了 "后滴定" 行的第一个井 (图 5, 12th行), 使用多通道吸管将 PBS 的25µL 添加到每个井。
注: 采用后滴定法检查所使用的抗原稀释是否等于4公顷的单位。如果在 "后滴定" 排的前三井中发生血凝, 而在第四井则不存在, 则表明 4 HA 单位的抗原效价。 - 在 "后滴定" 行 (12th行) 的第一个井中添加50µL 的准备抗原溶液 (在5.2.1 中描述)。
- 使用多通道吸管, 将 RDE 处理过的血清样品的25µL 添加到每片1至10排的第一口井。
- 将适当抗血清的25µL 添加到 11th行的第一个井中作为阳性对照。
- 通过使用多通道吸管将25µL 从每行 (1-12) 的第一口井转移到连续井, 执行串行2倍稀释。混合由移上下 10-15 倍为每个稀释步骤。同样的提示可以用于每一个稀释步骤的每个样品。
- 丢弃最后一口井的最后25µL。
- 增加25µL 的抗原溶液, 使用多通道吸管, 每行1至 11 (血清样本和抗血清)。如果他们不接触水井, 也可以使用同样的技巧。
- 在 "后滴定" 行 (12th行) 的每个井中添加25µL 的 PBS 而不是抗原。
- 小心地轻敲盘子10次在所有四边混合。
- 用盖子盖住盘子, 在室温下孵育30分钟。在孵化时不要移动盘子。
- 每井加50µL 的红细胞悬浮液。
- 小心地轻敲盘子10次在所有4边混合。
- 用盖子盖住盘子, 在室温下孵育适当的时间, 这取决于所使用的红细胞种类 (参见表 2)。在孵化时不要移动盘子。
-
阅读板
注: HI 滴度是最后稀释 (抗) 血清的倒数, 完全抑制血凝。重要的是要考虑到, RDE 处理的血清已经稀释 1:4, 并在连续稀释步骤后, 在第一口井的血清稀释 1:8, 这相当于一个 HI 效价8。- 禽红细胞的读数
- 倾斜板90°二十五年代。
注: 倾斜板对禽型的分化至关重要, 因为所有三种不同类型的凝集模式 (完全粘结、部分粘结和非粘结) 在不倾斜时显示为按钮。 - 立即标记结果, 而该板仍处于倾斜位置, 在96井板的打印方案。禽红细胞的凝集模式如图 3所示。
- 倾斜板90°二十五年代。
- 哺乳动物红细胞的读数
- 在不倾斜板的情况下, 将结果标记为96井板的打印方案。
注: 当血凝发生时, 粘结细胞不会沉淀下来, 而非粘结细胞则会出现在井底的光环中。部分粘结的细胞的晕强度较小, 直径较大 (图 3)。 - 确定每个示例的 HI 并将其传输到基于计算机的表 (图 6)
- 注: 部分粘结井被确定为较低滴度。例如, 如果一个血清样本完全抑制了凝血多达第四井 (1:64 稀释) 和 5th井 (1:128 稀释) 是部分粘结, 然后高滴度是设置到较低的效价64的最终分析 (图 6,4th行)。
- 在不倾斜板的情况下, 将结果标记为96井板的打印方案。
- 禽红细胞的读数
-
抗原溶液的制备

图 6: 使用禽红细胞的 HI 检测的读数.通过 HI 试验测定了接种前后的流感特异抗体应答。在这个例子中, 人一有高滴比人二。两人在接种疫苗后均表现出抗体应答;180天在疫苗接种以后两个人的抗体滴再减少。请单击此处查看此图的较大版本.
Access restricted. Please log in or start a trial to view this content.
结果
预防流感 H3N2 前和后接种诱导抗体应答
26健康志愿者接受了疫苗诱导的抗体应答, 他们在2014之前收到了含有流感 A/H1N1/California/2009、A/H3N2/Texas/2012 和 B/Massachusetts/02/2012 的灭活三价亚基流感疫苗。2015流感季节。图 6显示了2疫苗接收者的代表性示例。有趣的是, 在那个特定的流感季节, A/H3N2/Texas/2012 没有循环, 相反, 这个季节包括了一些不?...
Access restricted. Please log in or start a trial to view this content.
讨论
对疫苗接种前后流感病毒特异性抗体滴的定量是一种重要的研究手段。基于保护病毒感染的替代措施, 如 seroprotection (> 1:40) 或血清 (4 倍效价增加), 疫苗接种策略可以优化9。使用所提供的协议可以确定: (i) 特定病毒的血凝潜能, 和 (ii) 抗体滴的病毒的利益。
修改和故障排除:
此协议基于 WHO 标准12。我们用 PCR...
Access restricted. Please log in or start a trial to view this content.
披露声明
a.e 得到了 "SNSF Ambizione 评分" 计划 (PZ00P3_154709)、"Forschungsfond、Förderung strategischer Projekte" 巴塞尔大学、Stiftungsinfektionskrankheiten 巴塞尔和 Bangeter Rhyner 基金会的研究资助。力得到奥地利格拉茨技术大学的资助。. 承认, 在系统生物学计划 (9th调用) 的 SystemsX.ch 倡议的 iPhD 奖学金的支持。
致谢
没有.
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 25 ml Disposable Multichannel Pipette Reservoirs | Integra | 4312 | |
| 8-well PCR tubes | Brand GMBH | 781332 | For serum aliquots |
| 96-well microtiter plate, U-shaped | TPP | 92097 | For HI assay when using mammalian RBCs |
| 96-well microtiter plate, V-shaped | Corning Costar | 3897 | For HI assay when using avian RBCs |
| Aqua ad iniect. Steril | Bichsel AG | 1000004 | For preparing influenza antigen and cholera filtrate solutions |
| Chicken RBC (10%) | Cedarlane | CLC8800 | 10% suspension of chicken red blood cells in Alsever's solution |
| Cholera filtrate | Sigma-Aldrich | C8772 | Used as receptor destroying enzyme (RDE) |
| Dulbecco's PBS | Sigma-Aldrich | D8537 | For diluting the serum samples, RBCs and antigens |
| Eppendorf Multichannel pipette, 12-channel, 10-100 µl | Sigma-Aldrich | Z683949 | |
| Eppendorf Multichannel pipette, 8-channel, 10-100 µl | Sigma-Aldrich | Z683930 | |
| Guinea Pig RBC (10%) | Cedarlane | CLC1800 | 10% suspension of guinea pig red blood cells in Alsever's solution |
| Influenza Anti-A/California/7/09 HA serum | NIBSC | 14/134 | Used as positive control at the HI assay |
| Influenza Anti-A/Switzerland/9715293/2013-like HA serum | NIBSC | 14/272 | Used as positive control at the HI assay |
| Influenza Anti-A/Texas/50/2012-Like HA Serum | NIBSC | 13/178 | Used as positive control at the HI assay |
| Influenza Anti-B/Brisbane/60/2008-HA serum | NIBSC | 13/254 | Used as positive control at the HI assay |
| Influenza Anti-B/Massachusetts/02/2012 HA serum | NIBSC | 13/182 | Used as positive control at the HI assay |
| Influenza antigen A/California/7/09 (H1N1)(NYMC-X181) | NIBSC | 12/168 | Inactivated, partially purified A/California/7/09 (H1N1)(NYMC-X181) virus (ca. 46µgHA/ml) |
| Influenza antigen A/Switzerland/9715293/2013 (NIB88) | NIBSC | 14/254 | Inactivated, partially purified A/Switzerland/9715293/2013 (NIB88) virus (ca. 55µgHA/ml) |
| Influenza antigen A/Texas/50/2012 (H3N2)(NYMCX-223) | NIBSC | 13/112 | Inactivated, partially purified A/Texas/50/2012 (H3N2)(NYMCX-223) virus (ca. 74µgHA/ml) |
| Influenza antigen B/Brisbane/60/2008 | NIBSC | 13/234 | Inactivated, partially purified B/Brisbane/60/2008 virus (ca. 42µgHA/ml) |
| Influenza antigen B/Massachusetts/02/2012 | NIBSC | 13/134 | Inactivated, partially purified B/Massachusetts/02/2012 virus (ca. 35µgHA/ml) |
| Serum-Tubes | S-Monovette, Sardstedt | 01.1601.100 | For serum extraction with clotting activator |
| Single Donor Human RBC, Type 0 | Innovative Research | IPLA-WB3 | Suspension of single donor human red blood cells in Alsever's solution (ca. 26%) |
| Turkey RBC (10%) | Cedarlane | CLC1180 | 10% suspension of turkey red blood cells in Alsever's solution |
| Phosphate Buffered Saline (PBS) | Gibco |
参考文献
- Prevention and control of seasonal influenza with vaccines. Recommendations of the Advisory Committee on Immunization Practices--United States, 2013-2014. MMWR Recomm Rep. 62, Centers for Disease, C. & Prevention. RR-07 1-43 (2013).
- Dominguez-Cherit, G., et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 302 (17), 1880-1887 (2009).
- Fox, B. D., et al. Pandemic influenza (H1N1): impact on lung transplant recipients and candidates. J Heart Lung Transplant. 29 (9), 1034-1038 (2010).
- Piercy, J., Miles, A., Krankheiten, S. B. fG. S. V., Values, M. The Economic Impact of Influenza in Switzerland: Interpandemic Situation. , Swiss Federal Office of Public Health, Division of Epidemiology and Infectious Diseases, Section of Viral Diseases and Sentinel Systems. (2003).
- Barclay, V. C., et al. Positive network assortativity of influenza vaccination at a high school: implications for outbreak risk and herd immunity. PLoS One. 9 (2), 87042(2014).
- Baluch, A., et al. Randomized controlled trial of high-dose intradermal versus standard-dose intramuscular influenza vaccine in organ transplant recipients. Am J Transplant. 13 (4), 1026-1033 (2013).
- Haralambieva, I. H., et al. The Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in Older Subjects. PLoS One. 10 (3), 0122282(2015).
- Egli, A., et al. Vaccine adjuvants--understanding molecular mechanisms to improve vaccines. Swiss Med Wkly. 144, 13940(2014).
- O'Shea, D., Widmer, L. A., Stelling, J., Egli, A. Changing face of vaccination in immunocompromised hosts. Curr Infect Dis Rep. 16 (9), 420(2014).
- Meulemans, G., Carlier, M. C., Gonze, M., Petit, P. Comparison of hemagglutination-inhibition, agar gel precipitin, and enzyme-linked immunosorbent assay for measuring antibodies against influenza viruses in chickens. Avian Dis. 31 (3), 560-563 (1987).
- Martins, T. B. Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile. Clin Diagn Lab Immunol. 9 (1), 41-45 (2002).
- Webster, R., Cox, N., Stöhr, K. WHO Animal Influenza Manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
- Mittelholzer, C. M., et al. Human cell lines used in a micro neutralization test for measuring influenza-neutralizing antibodies. Scand J Immunol. 63 (4), 257-263 (2006).
- Hamilton, R. S., Gravell, M., Major, E. O. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol. 38 (1), 105-109 (2000).
- Kumakura, S., et al. Comparison of hemagglutination inhibition assay and enzyme immunoassay for determination of mumps and rubella immune status in health care personnel. J Clin Lab Anal. 27 (5), 418-421 (2013).
- Ogundiji, O. T., Okonko, I. O., Adu, F. D. Determination of measles hemagglutination inhibiting antibody levels among school children in Ibadan, Nigeria. J Immunoassay Immunochem. 34 (2), 208-217 (2013).
- Cwach, K. T., Sandbulte, H. R., Klonoski, J. M., Huber, V. C. Contribution of murine innate serum inhibitors toward interference within influenza virus immune assay. Influenza Other Respir Viruses. 6 (2), 127-135 (2012).
- Lee, P. S., et al. Receptor mimicry by antibody F045-092 facilitates universal binding to the H3 subtype of influenza virus. Nat Commun. 5, 3614(2014).
- Blumel, B., et al. Age-related prevalence of cross-reactive antibodies against influenza A(H3N2) variant virus, Germany, 2003 to 2010. Euro Surveill. 20 (32), 16-24 (2015).
- Reber, A. J., et al. Seasonal Influenza Vaccination of Children Induces Humoral and Cell-Mediated Immunity Beyond the Current Season: Cross-reactivity with Past and Future Strains. J Infect Dis. , (2016).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。