A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس الالتقام حويصلة متشابك في الخلايا العصبية هيبوكامبال مثقف
In This Article
Summary
تم الكشف عن الالتقام حويصلة متشابك الخفيفة الميكروسكوب من فلورين تنصهر مع البروتين حويصلة متشابك والمجهر الإلكتروني لامتصاص حويصلة.
Abstract
خلال الالتقام، يتم استرداد حويصلات متشابك تنصهر في المحطات العصبية، مما يسمح لإعادة التدوير حويصلة ومن ثم الحفاظ على انتقال متشابك أثناء إطلاق العصبية المتكررة. الالتقام البصر في الحالات المرضية ويؤدي إلى نقصان في مهام القوة والدماغ متشابك. هنا، يمكننا وصف الطرق المستخدمة لقياس الالتقام حويصلة متشابك في المشبك هيبوكامبال الثدييات في ثقافة العصبية. نحن يرصدها الالتقام البروتين حويصلة متشابك الصمامات بروتين غشائي حويصلية متشابك، بما في ذلك سينابتوفيسين و VAMP2/سينابتوبريفين، إلى جانب لومينال حويصلية، مع فلورين، حساسة لدرجة الحموضة بروتين فلورية خضراء التي تزيد عن كثافة الأسفار كما يزيد من درجة الحموضة. خلال الرقابة، يزيد الرقم الهيدروجيني التجويف حويصلية، بينما خلال التجويف حويصلية الالتقام الأس الهيدروجيني إعادة المحمضة. وهكذا، يشير إلى زيادة كثافة fluorescence فلورين الانصهار، بينما تشير إلى انخفاض الالتقام البروتين المسمى حويصلة متشابك. بالإضافة إلى استخدام أسلوب التصوير فلورين لتسجيل الالتقام، نحن يرصدها غشاء حويصلية الالتقام بقياسات الميكروسكوب الإلكتروني (م) الفجل البيروكسيديز (HRP) امتصاص حويصلات. وأخيراً، نحن رصد تشكيل الأعصاب الطرفية الغشاء حفر في أوقات مختلفة بعد depolarization المستحثة بالبوتاسيوم عالية. يشير مسار الوقت لتشكيل حفرة الامتصاص والغشاء HRP إلى مسار الوقت الالتقام.
Introduction
أجهزة الإرسال العصبية المخزنة في حويصلات متشابك وصدر عن الرقابة. غشاء حويصلة متشابك والبروتين ثم استيعابه الالتقام، وإعادة استخدامها في الجولة القادمة للرقابة. أمر مهم للحفاظ على تجمعات حويصلة متشابك الالتقام حويصلات متشابك ويزيل حويصلات بارزة من غشاء البلازما. وقد استخدمت فلورين البروتينات الفلورية الخضراء حساسة لدرجة الحموضة، وهو مروي في الظروف الحمضية وديكوينتشيد في الأس الهيدروجيني المحايدة، لقياس الوقت الالتقام دورات في العيش الخلايا1،،من23. عادة ما ترتبط البروتين فلورين الجانب لومينال حويصلة متشابك البروتينات، مثل سينابتوفيسين أو VAMP2/سينابتوبريفين. في الراحة وهي تطفئ فلورين في التجويف pH 5.5 من حويصلات متشابك. حويصلة الانصهار لغشاء البلازما يكشف التجويف حويصلية للحل خارج الخلية حيث هو الرقم الهيدروجيني ~ 7.3، أدى إلى زيادة في الأسفار فلورين. بعد الرقابة، يتعفن fluorescence المتزايدة، نظراً الالتقام بروتينات حويصلة متشابك تليها التحمض إعادة حويصلة داخل تلك الحويصلات المستردة. على الرغم من أن يعكس الانحلال الالتقام وتحمض إعادة حويصلية، أنه يعكس الالتقام، معظمها لتحميض إعادة أسرع من الالتقام في معظم الأحوال1،4. هو وقت ثابت لإعادة التحميض s 3-4 أو أقل5،6، الذي عادة أسرع من 10 s أو أكثر مطلوب لحويصلة الالتقام4،5. إذا كانت التجارب ضرورية للتمييز بين الالتقام من إعادة التحميض، حمض تجارب التبريد باستخدام الحل (MES) حمض مورفولينيثانيسولفونيك 4 (25 مم) مع الرقم الهيدروجيني 5.5 يمكن استخدامها لتحديد ما إذا كان يتم استرداد البروتينات حويصلة متشابك من غشاء البلازما عن طريق الالتقام1،،من34. وبالتالي، زيادة كثافة fluorescence فلورين يعكس توازناً أكسو-والالتقام، ويعكس الانخفاض بعد تحفيز الأعصاب على وجه التحديد الالتقام.
يمكن استخدام التصوير فلورين ليس فقط لقياس الدورة الزمنية الالتقام، ولكن أيضا حجم حويصلة متشابك برك7،8، واحتمال الإفراج عن مقولة وعفوية الإفراج عن9. العديد من العوامل والبروتينات المشاركة في تنظيم الالتقام، مثل الكالسيوم وجبهة الخلاص الوطني-مرفق قابل للذوبان بروتين مستقبلات (الفخ) البروتينات، factor(BDNF) نيوروتروفيك المستمدة من الدماغ وكالسينيورين وقد حددت استخدام التصوير فلورين1 , 2 , 10 , 11 , 12 , 13 , 14 , 15 , 16-وعلاوة على ذلك، يمكن اكتشاف الإفراج عن العصبي في الخلايا العصبية الأولية فقط لا بل في خلايا neuroblastoma مع تيرفم17. مؤخرا، تم وضع المتغيرات فلورين، دسريد، مورانج وفتوماتو لرصد تسجيلات المتزامن لعوامل متعددة في18،المشبك واحد19. على سبيل المثال، تنصهر مع سينابتوفيسين فتوماتو ويستخدم مع مؤشر كالسيوم مشفرة جينياً (GCaMP5K) لمراقبة الانصهار حويصلة presynaptic و Ca2 + تدفق في حجرة بوستسينابتيك20. ولذلك، فلورين يعلق على البروتينات متشابك يوفر وسيلة مفيدة لتحليل العلاقة بين الالتقام والرقابة.
أم هو أسلوب آخر استخداماً في دراسة الالتقام، سبب عالية الدقة المكانية التي تظهر التغييرات ultrastructural أثناء الالتقام. اثنين من مجالات عامة هي القدرة على تصور التغييرات المرضية داخل الخلايا العصبية21 وتعقب حويصلة البروتينات22. على وجه الخصوص، مراقبة امتصاص حويصلة متشابك، انحناء غشاء المغلفة كلاثرين في منطقة بيرياكتيفي، وهياكل اندوسومال ممكن مع م3،،من2324،25 26، ،،من2728. بينما م ينطوي على التحف المحتملة، مثل التشوهات الناجمة عن مثبت، التي قد تؤثر على الالتقام، وتحليل بيانات العمالة المكثفة، أن القرار يوفر فرصة جذابة لتصور البنية الخلوية. يمكن التغلب على المشاكل المحتملة مثبت والقيد في الأزمنة م بالضغط العالي تجميد، وتوفير وسيلة سريعة وغير كيميائية لاستقرار الهياكل الدقيقة الحالية أثناء الالتقام27.
Protocol
ملاحظة: البروتوكول التالي يصف أساليب التصوير فلورين وم الأساليب المستخدمة في استزراع الخلايا العصبية هيبوكامبال. فلورين شاشات حويصلة متشابك بروتين امتصاص في الخلايا الحية ويكشف م الإقبال على حويصلة متشابك و التغييرات ultrastructural.
رعاية الحيوان والإجراء المعاهد الوطنية للصحة للمبادئ التوجيهية ووافقت عليها لجنة الاستخدام والمعاهد الوطنية للصحة الحيوانية العناية.
1-فلورين التصوير
- ثقافة العصبية هيبوكامبال
- تحضير الحصين المخزن المؤقت (خضاب الدم) عن طريق الجمع بين NaHCO 3 4 و 5 ملم هيبيس وضبط على درجة الحموضة 7.3 مع 5 م هيدروكسيد الصوديوم. جعل المتوسط الثقافة بخلط نيوروباسال المتوسط، 2% B27، 0.5 مم ستربتوميسين البنسلين لام الجلوتامين و 1%. بالإضافة إلى ذلك، إعداد خليط من المخزن المؤقت غبطة مع 20% "مصل بقرى الجنين" (HB/20% FBS).
ملاحظة: يستند هذا البروتوكول تثقيف أرى, et al. 29 ووو , et al. 24 - قطع رأس الجراء الماوس بين يوم بعد الولادة 0 إلى 2 في اليوم في المتوسط الثقافة، واستخراج المخ إلى 4 درجة مئوية HB/20% FBS. إزالة الدماغ والمهاد لفضح هيبوكامبي. تشريح خارج هيبوكامبي، بعد كشف أنه بإزالة الدماغ والمهاد، ونقل إلى الطازجة 4 درجة مئوية HB/20% FBS-
ملاحظة: عادة ما يكون العائد حوالي 4 × 10 5 خلايا/مل ألجرو واحد (اثنين هيبوكامبي). نظيفة من الأغشية المنضمة باستخدام الملقط أو المقص، ثم نقل إلى الطازجة 4 درجة مئوية HB/20% FBS. إلغاء المغزلي المسنن، وعزل في سوبيكولوم بقطع بالمقص، ثم نقل إلى الطازجة 4 درجة مئوية HB/20% FBS- - تقسيم كل الحصين، بقطع من البداية إلى النهاية، إلى حوالي 10 شرائح وتحويلها إلى أنبوب 15 مل مخروطية البوليبروبيلين.
- بعد السماح للأنسجة لتسوية، يغسل مع 10 مل من HB/20% FBS، ومن ثم يغسل ثلاث مرات مع 10 مل غبطة.
- إعداد الحل الهضم من 137 كلوريد الصوديوم، 5 ملم بوكل، 7 ملم Na2HPO 4، و 25 ملم هيبيس، وضبط للرقم الهيدروجيني 7.2 مع 5 م هيدروكسيد الصوديوم. إزالة المادة طافية من هيبوكامبي. إضافة 10 مغ التربسين و 1 ملغ من الدناز إلى 2 مل من محلول الهضم، وتصفية من خلال غشاء عقيمة 0.22 ميكرومتر مباشرة على بيليه عينة-
- احتضان هيبوكامبي لمدة 5 دقائق في 37 درجة مئوية، ثم يغسل مرتين مع 10 مل من HB/20% FBS، ويغسل مرة واحدة مع 10 مل غبطة.
- تنأى بالخلايا بملغ 6 مجسو 4 ∙ 7 ح 2 س و 1 ملغ من الدناز 2 مل غبطة وتصفية العقيمة على هيبوكامبي بيليه من خلال عامل تصفية 0.22 ميكرومتر عقيمة. بلطف ننأى بالخلايا بعناية تريتوراتينج، مع الحرص على تجنب إدخال فقاعات الهواء. السماح للجسيمات الأنسجة تسوية لمدة 2 دقيقة، وبعد ذلك ببطء نقل المادة طافية إلى أنبوب آخر.
- إضافة 3 مل HB/20% FBS إلى تعليق خلية، وأجهزة الطرد المركزي أو 10 دقيقة في 4 درجات مئوية و 1,000 لفة في الدقيقة. تجاهل المادة طافية وريسوسبيند في مستنبت. الخلايا
- 60,000 لوحة علقت في 150 ميليلتر الثقافة المتوسطة في ساترة قطرها 25 ملم بولي-د-يسين المغلفة، دون انسكاب قبالة ساترة. إضافة 2 مل من قبل حرارة الثقافة المتوسطة ح 2 بعد الطلاء. تتم المحافظة على كوفيرسليبس في لوحات تثقيف 6-جيدا أو أطباق بتري معقمة.
- المحافظة على الخلايا عند 37 درجة مئوية في نسبة 5% CO 2 هوميديفيد حاضنة في الثقافة المتوسطة لمدة 14-21 يوما قبل التسجيل. وخلال نمو الثقافة، تغيير النصف الأعلى من المتوسط مرتين في أسبوع-
- تحضير الحصين المخزن المؤقت (خضاب الدم) عن طريق الجمع بين NaHCO 3 4 و 5 ملم هيبيس وضبط على درجة الحموضة 7.3 مع 5 م هيدروكسيد الصوديوم. جعل المتوسط الثقافة بخلط نيوروباسال المتوسط، 2% B27، 0.5 مم ستربتوميسين البنسلين لام الجلوتامين و 1%. بالإضافة إلى ذلك، إعداد خليط من المخزن المؤقت غبطة مع 20% "مصل بقرى الجنين" (HB/20% FBS).
- تعداء
- 6-7 أيام بعد الطلاء، ترانسفيكت سينابتوفيسين-فلورين 2 X (SpH) أو VAMP2-فلورين في الخلايا العصبية هيبوكامبال. سف، استخدم مروج "الفيروس المضخم للخلايا" (CMV)، إدراج ناقل pcDNA3 30. بالنسبة VAMP2-فلورين، استخدم مروج CMV إدراجها ناقل pCI 31- ترانسفيكت
- أما ناقل الناقل المادة الدهنية إلى خلايا الهدف، باستخدام 1 ميكروغرام من بلازميد. استخدام الثقافة المتوسطة من البروتوكول خطوة 1.1.1، الذي يفتقر إلى المصل، تعداء. تغيير المتوسطة ح 2 بعد تعداء لتقليل السمية.
ملاحظة: في حالة منخفضة من التعبير عن SpH في بتونس، زيادة تركيز الحمض النووي إلى 2 ميكروغرام أو وقت الحضانة مع الناقل الدهن، إذا لم تكن الخلايا غير صحية. نموذجياً، 4-10 خلايا (0.006-0.008%) من الخلايا العصبية تم transfected.
- الخفيفة الميكروسكوب
- تحضير المحلول الملحي العادي يتألف من 119 مم كلوريد الصوديوم، 2 مم كاكل 2، 2.5 ملم بوكل، حبيس (درجة الحموضة 7.4)، الجلوكوز 30 مم، 2 مم مجكل 2، 25 مم (0.01 مم 6-cyano-7-nitroquinoxaline-2,3-dione كنقكس)، و 0.05 ملم حمض DL-2-أمينو-5-فوسفونوفاليريك (AP5). تأخذ ساترة من صفيحة متوسطة الثقافة والمكان في دائرة لتصوير تسمح التحفيز الميدانية، واستخدام زيوت التشحيم وتسرب لتجنب تسرب. تجنب ترك الزجاج الجاف أثناء نقل ساترة من اللوحة إلى الدائرة عن طريق إضافة فورا 750 المحلول الملحي العادي ميليلتر.
ملاحظة: استخدمت كنقكس و AP5 لحظر نشاط بوستسينابتيك، الذي ينطوي على إمكانات لنشاط متكرر. قبل وضع دائرة على مجهر مقلوب الأسفار، استخدام تنظيف الأنسجة للتأكد من أن الدائرة لا تسرب. تسريب بطيء يسبب تغييرات التركيز أثناء التسجيل بخلط النفط المالحة والغمر العادي، مما يؤدي إلى تغيرات في الانكسار. - التحفيز وتسجيل
- الصورة في مجهر مقلوب ويديفيلد مع 60 X (1.4 الفتحة العددية) النفط غمر عدسة مع مصباح هاليد معدني. تصور فلورين مع عامل تصفية مجموعة لذروة إثارة 480 نانومتر، 490 نانومتر تمرير طويل مرآة، عامل تصفية انبعاث 500-550 نانومتر، ومصراع الوجه يدوي. التقاط الصور كل مرض التصلب العصبي المتعدد 100، مع 2 × 2 binning، باستخدام كاميرا إلكترون تتضاعف تهمة إلى جانب جهاز (امككد)-
ملاحظة: ينبغي النظر العديد من الميزات لتحقيق الظروف الملائمة لتجنب فوتوبليتشينج، بما في ذلك فترة التقاط الصورة، وتصفية و binning، التي تعتمد على المعدات. في حالة التصوير [كنفوكل]، ينبغي النظر في وقت الليزر السلطة والتعرض لتجنب فوتوبليتشينج. مصممة الإعداد بعد تسجيل على الأقل 3 دقائق بدون حافز، وتم إجراء التسجيل لمالا يقل عن 10 s دون حافز للتحقق من فوتوبليتشينج- - اختيار منطقة بكثافة عالية من بتونس وتيسيرا للتحليل في كل تجربة. تحديد خلايا ترانسفيكتيد بإشارة الفلورية الخضراء، مع التركيز على أنماط التعبير مستديرة أو بيضاوية بوتون والتعبير المستمر بين بتونس-
- الالتقام الحث بتنشيط الحقل استخدام 1 نبضة، 20 mA العمل المحتملة (أ فب) المقدمة من نبض مشجعا وتسليمها عن طريق قطب البلاتين ضمن وحدة عزل التحفيز. صورة النشاط الأسفار على مدى التحفيز وأثناء استرداد الخلية.
ملاحظة: في حالة الخلايا الميتة، التعبير أقوى من بوتونس الحية وأظهرت نمطاً متفاوتاً بين بوتونس-
- الصورة في مجهر مقلوب ويديفيلد مع 60 X (1.4 الفتحة العددية) النفط غمر عدسة مع مصباح هاليد معدني. تصور فلورين مع عامل تصفية مجموعة لذروة إثارة 480 نانومتر، 490 نانومتر تمرير طويل مرآة، عامل تصفية انبعاث 500-550 نانومتر، ومصراع الوجه يدوي. التقاط الصور كل مرض التصلب العصبي المتعدد 100، مع 2 × 2 binning، باستخدام كاميرا إلكترون تتضاعف تهمة إلى جانب جهاز (امككد)-
- تحضير المحلول الملحي العادي يتألف من 119 مم كلوريد الصوديوم، 2 مم كاكل 2، 2.5 ملم بوكل، حبيس (درجة الحموضة 7.4)، الجلوكوز 30 مم، 2 مم مجكل 2، 25 مم (0.01 مم 6-cyano-7-nitroquinoxaline-2,3-dione كنقكس)، و 0.05 ملم حمض DL-2-أمينو-5-فوسفونوفاليريك (AP5). تأخذ ساترة من صفيحة متوسطة الثقافة والمكان في دائرة لتصوير تسمح التحفيز الميدانية، واستخدام زيوت التشحيم وتسرب لتجنب تسرب. تجنب ترك الزجاج الجاف أثناء نقل ساترة من اللوحة إلى الدائرة عن طريق إضافة فورا 750 المحلول الملحي العادي ميليلتر.
- تحليل الصور
- لتحليل كثافة fluorescence في بوتون واحد، تعيين يصل المنطقة للفائدة (ROI) ك 1.5 x 1.5 ميكرومتر مربع؛ حجم بوتون على مسافة حوالي 1.5 ميكرومتر. استخدام آثار قبل التحفيز للتحقق من فوتوبليتشينج وطرح كخلفية. تغيير
- fluorescence تطبيع (ΔF) مع المعادلة:
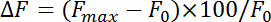
حيث و ماكس وو 0 تشير إلى الزيادة القصوى بعد التحفيز وخط الأساس الأسفار، على التوالي. قياس معدلات الالتقام كمعدل الاضمحلال خلال الأول s 4-10 بعد نقطة الحد الأقصى من الأسفار فلورين. الحصول على وقت ثابت (τ) من الالتقام باحتواء الانحلال fluorescence فلورين من الزيادة القصوى لخط الأساس مع دالة آسيه مونو-
2. المجهر الإلكتروني
- تحضير بولي-د-يسين المغلفة صفيحة 6-جيدا قبل تطبيق 1.5 مل من 0.01 ٪ العقيمة التي تمت تصفيتها بولي-د-يسين الحل لكل بئر ح 1 في درجة حرارة الغرفة، ثم الغسل ثلاث مرات بالماء المعقم. تشريح، والثقافة، والمحافظة على الخلايا العصبية هيبوكامبال كما هو الحال في الخطوات 1.1.1 و 1.1.2 و 1.1.3، على التوالي.
- تحضير حلاً تحفيز ك + عالية مع برنامج الصحة الإنجابية ملم 31.5 كلوريد الصوديوم، 2 مم كاكل 2، 90 مم بوكل، 25 مم حبيس (درجة الحموضة 7.4)، الجلوكوز 30 مم، 2 مم مجكل 2 ومم 0.01 كنقكس 0.05 مم AP5 5 ملغ/مل برنامج الصحة الإنجابية، ثم ضبط على درجة الحموضة 7.4 مع م 5 هيدروكسيد الصوديوم.
- الحث ثقافة العصبية هيبوكامبال بارتفاع 1.5 مل ك + الحل التحفيز في درجة حرارة الغرفة (يشار إلى ك +) بالإضافة إلى 1.5 مل لكل بئر ل 90 ثانية. في حالة الراحة (المشار إليها كالبحث والتطوير)، تنطبق نفس تركيز 5 ملغ/مل HRP 90 s، ولكن مع المحلول الملحي العادي. للحصول على نموذج الاسترداد، تطبيق الحل التحفيز ك + عالية كما هو الحال مع العينة ك +، ثم سرعة تغسل ويستبدل المحلول الملحي العادي واحتضانها للحد الأدنى 10
- وتثبيت وتلطيخ
- إعداد 0.1 م غ كاكوديلاتي المخزن المؤقت باستخدام 21.4 غرام/لتر كاكوديلاتي نا على درجة الحموضة 7.4. إصلاح الخلايا مع 4 ٪ glutaraldehyde في 0.1 م غ كاكوديلاتي المخزن المؤقت على الأقل 1 ساعة في درجة حرارة الغرفة. أغسل ثلاث مرات مع 0.1 م نا كاكوديلاتي المخزن المؤقت لمدة 7 دقائق.
- الحل ديامينوبينزيديني إعداد (DAB)، تتألف من 0.5 ملغ/مل من الدأب مع 0.3 ٪ ح 2 س 2 في ddH 2 س، وتصفية مع عامل تصفية 0.22 ميكرومتر. تطبيق الحل الدأب 1.5 مل لمدة 30 دقيقة في 37 درجة مئوية. يغسل ثلاث مرات مع 0.1 م نا كاكوديلاتي المخزن المؤقت لمدة 7 دقائق.
تنبيه: الدأب مادة مسرطنة سامة والمشتبه فيهم. الرجاء استخدام قفازات ومعاطف المعمل.
ملاحظة: وسم مع الدأب يحدث نتيجة للأكسدة، ح 2 س 2، كما حفزت ببرنامج الصحة الإنجابية. تؤدي الزيادات الصغيرة في المكونات إشارة زيادة في العينة. زيادة تركيز HRP يسرع تأثير المحفز. تجمعات كبيرة بما فيه الكفاية من ح 2 س 2 تسمح المنهكة ردود فعل الجانب مع برنامج الصحة الإنجابية، التي تحول دون تأثير وسم 32. في هذا العمل، وتركيزات هذا النظام وضع العلامات اختيرت استناداً إلى البحوث المتاحة حاليا 33 ، 34- - احتضان الخلايا العصبية مع 1.5 مل من 1% أوسو 4 في 0.1 م غ كاكوديلاتي المخزن المؤقت لح 1 في 4 درجات مئوية كمرحلة ما بعد التثبيت. أغسل ثلاث مرات مع 1.5 مل من 0.1 م نا كاكوديلاتي المخزن المؤقت لمدة 7 دقائق.
تنبيه: نظراً لسمية ومفاعليه أوسو 4، حفظ العينة على الجليد في غطاء كيميائية الأفضل في كثير من الحالات إلى استخدام ثلاجة للاحتضان. - تحضير م 0.1 الصوديوم خلات المخزن المؤقت مع 13.61 غرام/لتر صوديوم اسيتات و 11.43 مل/لتر الجليدية حمض الخليك على درجة الحموضة 5.0. تغسل ثلاث مرات مع 1.5 مل م 0.1 خلات المخزن المؤقت على درجة الحموضة 5.0 لكل 7 دقائق واحتضان مع خلات اليورانيل 1% 1.5 مل م 0.1 خلات المخزن المؤقت على درجة الحموضة 5.0 ح 1 في 4 ° أغسل جيم ثلاث مرات مع 1.5 مل م 0.1 خلات المخزن المؤقت لمدة 7 دقائق.
- الإيبوكسي التضمين
- يذوي ثقافة العصبية مع يغسل واحد 1.5 مل من الإيثانول 50%، 70%، و 90 في المائة، لمدة 7 دقائق في كل مجال وثم يغسل 3 من الإيثانول 100% 1.5 مل ل 7 دقيقة في غطاء دخان.
- ميكس 485 مل/لتر bisphenol-A-(epichlorhydrin) الإيبوكسي الراتنج، 160 مل/لتر دوديسينيل succinic الخل (دسا)، 340 مل/لتر الفينول 2,4,6-تريس (ديميثيلامينوميثيل) الخل (دكتور)، و 15 مل/لتر الميثيل-5-نوربورنيني-2, 3-ديكاربوكسيليك (برنامج إدارة الكوارث-30) لإنشاء في الإيبوكسي راتنج. المزيج جيدا، ثم تخزين تحت الفراغ لإزالة فقاعات الهواء-
ملاحظة: أنها حاسمة لإزالة فقاعات الهواء في الراتنج، لا سيما تلك التي أصغر من رؤيته بالعين المجردة، نظراً لأنها يمكن أن تسبب تسوس الأسنان في الراتنج خلال تمزيقها. - ارتشاح الراتنج العينة بالاستعاضة عن الإيثانول مع الإيبوكسي 50% في الإيثانول مدة 30 دقيقة في درجة حرارة الغرفة على شاكر، ثم 70% الإيبوكسي الراتنج في الإيثانول مدة 30 دقيقة في درجة حرارة الغرفة على شاكر.
- التبديل الإيبوكسي الراتنج الحل مع الراتنج الإيبوكسي 100% واحتضان لمدة 10 دقيقة في 50 درجة مئوية. تنفيذ اثنين التبادلات راتنج الإيبوكسي 100% جديدة مع إينكوباتيونس ح 1 في 50 درجة مئوية. إضافة جديدة 100% الإيبوكسي الراتنج والسماح تتصلب عند 50 درجة مئوية بين عشية وضحاها، ومن ثم في 60 آند #17 6؛ (ج) لما يزيد على 36 ح تتصلب.
- إزالة كل عينة من لوحة موتى، حسنا مع صائغ ' s المنشار. تحديد المناطق ذات الاهتمام، تجمعات كثيفة من الخلايا، باستخدام مجهر ضوء مقلوب، وثم قطع 70 إلى 80 نانومتر كتل لتمزيقها مبضع. جبل منطقة قطع في تشاك مبضع وتحميل مبضع. ضع تشاك في مبضع وجبل سكين الماس مع حافة موازيا لسطح الكتلة. جمع الفروع من 70 إلى 80 نانومتر سمك مباشرة على الشبكات الفردية-
- يذوب خلات اليورانيل في المياه لحل 1% بالوزن، ويذوب بشكل منفصل سترات الرصاص في المياه لحل 3% بالوزن. كونتيرستين المقاطع بغمر مع خلات اليورانيل مائي 1% لمدة 15 دقيقة ومن ثم سترات الرصاص مائي 3% لمدة 5 دقائق لتحسين تباين العينات.
- تصوير م
- دراسة المقاطع مع مجهر إلكترون انتقال وتسجيل الصور مع كاميرا رقمية اتفاقية مكافحة التصحر في تكبير الأولية من 10,000-20، 000 X 3.
- الإحصاءات
- أداء تي-اختبار لتحديد فوارق كبيرة بمقارنة متوسط والخطأ المعياري للقياس (s.e.m.) بين التحكم والعينات التجريبية.
النتائج
استخدام أسلوب الناقل الدهن، أعرب SpH في هيبوكامبال الخلايا العصبية، مما يسمح لتحديد بوتونس (الشكل 1a). التحفيز الكهربائي للخلايا التي يسببها الرقابة، وإلى زيادة مقابلة في كثافة الأسفار. الزيادة في الأسفار (ΔF) أوقف قبل إنهاء الحافز (الشكل 1b). ...
Discussion
هنا نظهر طريقتين لرصد الالتقام حويصلة متشابك. في الطريقة الأولى، يمكننا رصد فلورين تنصهر مع بروتين حويصلة متشابك في transfected الخلايا العصبية وحفزت كهربائياً في وقت لاحق. ثانيا، قمنا باستخدام التصوير م من الإقبال على برنامج الصحة الإنجابية كما فعل بوكل. نحن استخدام المحفزات المختلفة لسببين....
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونحن نشكر الدكتور تشو يونغ لينغ لتوفير بنية سينابتوفيسين-pHluorin2x، والدكتور جيمس روثمان هاء لتقديم VAMP2-فلورين. ونشكر الدكتورة سوزان تشنغ وفيرجينيا كروكر NINDS الميكروسكوب الإلكتروني مرفق للدعم التقني والمساعدة. هذا العمل كان يدعمها المعهد الوطني للاضطرابات العصبية والسكتة الدماغية داخلية برنامج البحوث في الولايات المتحدة الأمريكية، ومنحة من KRIBB مبادرة برنامج البحوث (الكورية الطبية الحيوية عالم برنامج زمالة)، المعهد الكوري لأبحاث العلوم الحيوية والتكنولوجيا الحيوية، وجمهورية كوريا.
Materials
| Name | Company | Catalog Number | Comments |
| Lipofectamine LTX with Plus | Thermo Fisher | 15338-100 | Transfection of plasmid DNA including synaptophysin or VAMP2-pHluorin |
| neurobasal medium | Thermo Fisher | 21103-049 | Growth medium for neuron, Warm up to 37°C before use |
| B27 | Thermo Fisher | 17504-044 | Gradient for neuronal differentiation |
| Glutamax | Thermo Fisher | 35050-061 | Gradient for neuronal culture |
| Poly-D-Lysine coated coverslip | Neuvitro | GG-25-pdl | Substrate for neuronal growth and imaging of pHluorin |
| Trypsin XI from bovine pancrease | Sigma | T1005 | Neuronal culture-digest hippocampal tissues |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025 | Neuronal culture-inhibits viscous cell suspension |
| pulse stimulator | A-M systems | model 2100 | Apply electrical stimulation |
| Slotted bath with field stimulation | Warner Instruments | RC-21BRFS | Apply electrical stimulation |
| stimulus isolation unit | Warner Instruments | SIU102 | Apply electrical stimulation |
| lubricant | Dow corning | 111 | pHluorin imaging-seal with coverslip and imaging chamber, avoid leak from chamber |
| AP5 | Tocris | 3693 | Gradient for normal saline, selective NMDA receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| CNQX | Tocris | 190 | Gradient for normal saline, competitive AMPA/kainate receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| Illuminator | Nikon | C-HGFI | Metal halide light source for pHluorin |
| EMCCD camera | Andor | iXon3 | pHluorin imaging, detect pHluorin fluorescence intensity |
| Inverted microscopy | Nikon | Ti-E | Imaging for synaptophysin or VAMP2 pHluorin transfected cells |
| NIS-Elements AR | Nikon | NIS-Elements Advanced Research | Software for imaging acquisition and analysis |
| Igor Pro | WaveMetrics | Igor pro | Software for imaging analysis and data presentation |
| imaging chamber | Warner Instruments | RC21B | pHluorin imaging, apply field stimulation on living cells |
| poly-l-lysine | Sigma | P4832 | Electron microscopy, substrate for neuronal growth, apply on multiwell plate for 1 h at room temperature then wash with sterilized water 3 times |
| Horseradish peroxidase(HRP) | Sigma | P6782 | Electron microscopy, labeling of endocytosed synaptic vesicles by catalyzing DAB in presence hydrogen peroxide, final concentration is 5 mg/mL in normal saline, make fresh before use |
| Na cacodylate | Electron Microscopy Sciences | 12300 | Electron microscopy, buffer for fixatives and washing, final concentration is 0.1 N |
| 3,3′-Diaminobenzidine(DAB) | Sigma | D8001 | Electron microscopy, labeling of endocytosed synaptic vesicles, substrate for HRP, final concentration is 0.5 mg/mL in DDW and filtered, make fresh before use |
| Hydrogen peroxide solution | Sigma | H1009 | Electron microscopy, labeling of endocytosed synaptic vesicles by inducing HRP-DAB reaction, final concentration is 0.3% in DDW, make fresh before use |
| glutaraldehyde | Electron Microscopy Sciences | 16365 | Electron microscopy, fixatives, final concentration is 4% in Na-cacodylate buffer, make fresh before use, shake well before to use |
| TEM | JEOL | 200CX | Electron microscopy, imaging of endocytosed vesicles and ultrastructural changes |
| CCD digital camera | AMT | XR-100 | Electron microscopy, capturing images |
| Lead citrate | Leica microsystems | 16707235 | Electron microscopy, grid staining |
References
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nature cell biol. 2 (4), 197-204 (2000).
- Sun, T., Wu, X. S., et al. The role of calcium/calmodulin-activated calcineurin in rapid and slow endocytosis at central synapses. J Neurosci. 30 (35), 11838-11847 (2010).
- Wu, X. -. S. S., Lee, S. H., et al. Actin Is Crucial for All Kinetically Distinguishable Forms of Endocytosis at Synapses. Neuron. 92 (5), 1020-1035 (2016).
- Granseth, B., Odermatt, B., Royle, S. J., Lagnado, L. Clathrin-mediated endocytosis is the dominant mechanism of vesicle retrieval at hippocampal synapses. Neuron. 51 (6), 773-786 (2006).
- Atluri, P. P., Ryan, T. A. The kinetics of synaptic vesicle reacidification at hippocampal nerve terminals. J Neurosci. 26 (8), 2313-2320 (2006).
- Royle, S. J., Granseth, B., Odermatt, B., Derevier, A., Lagnado, L. Imaging phluorin-based probes at hippocampal synapses. Methods Mol Biol. 457, 293-303 (2008).
- Moulder, K. L., Mennerick, S. Reluctant vesicles contribute to the total readily releasable pool in glutamatergic hippocampal neurons. J Neurosci. 25 (15), 3842-3850 (2005).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptopHluorin. Proc Natl Acad Sci U S A. 102 (17), 6131-6136 (2005).
- Morris, R. G. Elements of a neurobiological theory of hippocampal function: the role of synaptic plasticity, synaptic tagging and schemas. Eur J Neurosci. 23 (11), 2829-2846 (2006).
- Sankaranarayanan, S., Ryan, T. A. Calcium accelerates endocytosis of vSNAREs at hippocampal synapses. Nat Neurosci. 4 (2), 129-136 (2001).
- Balaji, J., Armbruster, M., Ryan, T. A. Calcium control of endocytic capacity at a CNS synapse. J Neurosci. 28 (26), 6742-6749 (2008).
- Ferguson, S. M., Brasnjo, G., et al. A selective activity-dependent requirement for dynamin 1 in synaptic vesicle endocytosis. Science. 316 (5824), 570-574 (2007).
- Baydyuk, M., Wu, X. S., He, L., Wu, L. G. Brain-derived neurotrophic factor inhibits calcium channel activation, exocytosis, and endocytosis at a central nerve terminal. J Neurosci. 35 (11), 4676-4682 (2015).
- Wu, X. S., Zhang, Z., Zhao, W. D., Wang, D., Luo, F., Wu, L. G. Calcineurin is universally involved in vesicle endocytosis at neuronal and nonneuronal secretory cells. Cell Rep. 7 (4), 982-988 (2014).
- Zhang, Z., Wang, D., et al. The SNARE proteins SNAP25 and synaptobrevin are involved in endocytosis at hippocampal synapses. J Neurosci. 33 (21), 9169-9175 (2013).
- Wu, L. -. G. G., Hamid, E., Shin, W., Chiang, H. -. C. C. Exocytosis and endocytosis: modes, functions, and coupling mechanisms. Annu Rev Physiol. 76 (1), 301-331 (2014).
- Daniele, F., Di Cairano, E. S., Moretti, S., Piccoli, G., Perego, C. TIRFM and pH-sensitive GFP-probes to evaluate neurotransmitter vesicle dynamics in SH-SY5Y neuroblastoma cells: cell imaging and data analysis. J Vis Exp. (95), e52267 (2015).
- Shaner, N. C., Lin, M. Z., et al. Improving the photostability of bright monomeric orange and red fluorescent proteins. Nat Methods. 5 (6), 545-551 (2008).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Leitz, J., Kavalali, E. T. Fast retrieval and autonomous regulation of single spontaneously recycling synaptic vesicles. Elife. 3, e03658 (2014).
- Bisht, K., El Hajj, H., Savage, J. C., Sánchez, M. G., Tremblay, M. -. &. #. 2. 0. 0. ;. Correlative Light and Electron Microscopy to Study Microglial Interactions with β-Amyloid Plaques. J Vis Exp. (112), e54060 (2016).
- Schikorski, T. Monitoring Synaptic Vesicle Protein Sorting with Enhanced Horseradish Peroxidase in the Electron Microscope. High-Resolution Imaging of Cellular Proteins: Methods and Protocols. , 327-341 (2016).
- Kononenko, N. L., Puchkov, D., et al. Clathrin/AP-2 mediate synaptic vesicle reformation from endosome-like vacuoles but are not essential for membrane retrieval at central synapses. Neuron. 82 (5), 981-988 (2014).
- Wu, Y., O'Toole, E. T., et al. A dynamin 1-, dynamin 3- and clathrin-independent pathway of synaptic vesicle recycling mediated by bulk endocytosis. eLife. 2014 (3), e01621 (2014).
- Heuser, J. E., Reese, T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J Cell Biol. 57 (2), 315-344 (1973).
- Ceccarelli, B., Hurlbut, W. P., Mauro, A. Turnover of transmitter and synaptic vesicles at the frog neuromuscular junction. J Cell Biol. 57 (2), 499-524 (1973).
- Watanabe, S., Rost, B. R., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S., Trimbuch, T., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
- Sankaranarayanan, S., Atluri, P. P., Ryan, T. A. Actin has a molecular scaffolding, not propulsive, role in presynaptic function. Nat Neurosci. 6 (2), 127-135 (2003).
- Zhu, Y., Xu, J., Heinemann, S. F. Two pathways of synaptic vesicle retrieval revealed by single-vesicle imaging. Neuron. 61 (3), 397-411 (2009).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Arnao, M. B. B., Acosta, M., del Rio, J. A. A., García-Cánovas, F. Inactivation of peroxidase by hydrogen peroxide and its protection by a reductant agent. Biochim Biophys Acta. 1038 (1), 85-89 (1990).
- Deák, F., Schoch, S., et al. Synaptobrevin is essential for fast synaptic-vesicle endocytosis. Nat Cell Biol. 6 (11), 1102-1108 (2004).
- Clayton, E. L., Evans, G. J. O., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J Neurosci. 28 (26), 6627-6632 (2008).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nat Neurosci. 17 (1), 10-16 (2014).
- Wienisch, M., Klingauf, J. Vesicular proteins exocytosed and subsequently retrieved by compensatory endocytosis are nonidentical. Nat Neurosci. 9 (8), 1019-1027 (2006).
- Fernández-Alfonso, T., Kwan, R., Ryan, T. A. Synaptic vesicles interchange their membrane proteins with a large surface reservoir during recycling. Neuron. 51 (2), 179-186 (2006).
- Gimber, N., Tadeus, G., Maritzen, T., Schmoranzer, J., Haucke, V. Diffusional spread and confinement of newly exocytosed synaptic vesicle proteins. Nat Commun. 6, 8392 (2015).
- Nicholson-Fish, J. C., Smillie, K. J., Cousin, M. A. Monitoring activity-dependent bulk endocytosis with the genetically-encoded reporter VAMP4-pHluorin. J Neurosci Methods. 266, 1-10 (2016).
- Burrone, J., Li, Z., Murthy, V. N. Studying vesicle cycling in presynaptic terminals using the genetically encoded probe synaptopHluorin. Nat Protoc. 1 (6), 2970-2978 (2006).
- Wisse, E., Braet, F., et al. Fixation methods for electron microscopy of human and other liver. World journal of gastroenterology. 16 (23), 2851-2866 (2010).
- Magidson, V., Khodjakov, A. Circumventing Photodamage in Live-Cell Microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Søndergaard, C. R., Garrett, A. E., et al. Structural artifacts in protein-ligand X-ray structures: implications for the development of docking scoring functions. J Med Chem. 52 (18), 5673-5684 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved