È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Endocitosi delle vescicole sinaptiche in colture di neuroni ippocampali di misura
In questo articolo
Riepilogo
Endocitosi delle vescicole sinaptiche sono rilevato da microscopia chiara di pHluorin fuso con proteine delle vescicole sinaptiche e da microscopia elettronica dell'assorbimento della vescicola.
Abstract
Durante endocitosi, fusione delle vescicole sinaptiche sono Estratto alle terminazioni nervose, permettendo per riciclo delle vescicole e quindi il mantenimento della trasmissione sinaptica durante la cottura ripetuto del nervo. Alterata endocitosi in condizioni patologiche conduce alle diminuzioni in funzioni sinaptiche di forza e cervello. Qui, descriviamo i metodi utilizzati per misurare la endocitosi delle vescicole sinaptiche alla sinapsi ippocampo mammifera in coltura neuronale. Abbiamo monitorato endocitosi proteine delle vescicole sinaptiche fondendo una proteina di membrana vescicolare sinaptica, compreso lo synaptophysin e VAMP2/sinaptobrevina, sul lato di lumenal vescicolare, con pHluorin, una proteina fluorescente verde di pH sensibili che aumenta la sua aumenta l'intensità di fluorescenza come il pH. Durante l'esocitosi, vescicolare lumen pH aumenta, mentre durante il lume vescicolare endocitosi pH è ri-acidificato. Così, un aumento dell'intensità di fluorescenza pHluorin indica fusione, mentre una diminuzione indica endocitosi della proteina marcata delle vescicole sinaptiche. Oltre a utilizzare il metodo di imaging pHluorin per registrare endocitosi, abbiamo monitorato endocitosi membrana vescicolare da misure di microscopia elettronica (EM) del rafano perossidasi (HRP) assorbimento dalle vescicole. Infine, abbiamo monitorato la formazione dei pozzi di membrana terminale del nervo in tempi diversi dopo la depolarizzazione indotta da potassio alta. Il corso di formazione di pozzo di assorbimento e membrana HRP tempo indica il corso di tempo dell'endocitosi.
Introduzione
Neurotrasmettitori sono memorizzati in vescicole sinaptiche e distribuiti dalla esocitosi. La membrana della vescicola sinaptica e la proteina sono quindi interiorizzati dal endocytosis e riutilizzati nel prossimo turno di esocitosi. Endocitosi delle vescicole sinaptiche sono importante per il mantenimento piscine delle vescicole sinaptiche e rimuove vescicole sporgente dalla membrana plasmatica. PHluorin la proteina fluorescente verde sensibili al pH, che è spenta in circostanze acide e dequenched a pH neutro, è stato utilizzato per misurare il tempo di endocitosi corsi in diretta le cellule1,2,3. La proteina di pHluorin è in genere associata al lato lumenal di proteine delle vescicole sinaptiche, come lo synaptophysin o VAMP2/sinaptobrevina. A riposo, pHluorin è spenta in lumen pH 5,5 delle vescicole sinaptiche. Fusione della vescicola alla membrana plasmatica espone il lume vescicolare alla soluzione extracellulare dove il pH è ~ 7.3, conseguente aumento nella fluorescenza pHluorin. Dopo l'esocitosi, l'aumento della fluorescenza decade, a causa di endocitosi delle proteine delle vescicole sinaptiche, seguita da ri-acidificazione vescicola all'interno di tali vescicole recuperate. Anche se il decadimento riflette sia endocitosi e ri-acidificazione vescicolare, essa riflette principalmente endocitosi, perché ri-acidificazione è più veloce di endocitosi nella maggior parte delle condizioni1,4. La costante di tempo di ri-acidificazione è 3-4 s o meno5,6, che è generalmente più veloce di 10 s o superiore richiesto per endocitosi delle vescicole4,5. Se sono necessari esperimenti per distinguere endocitosi da ri-acidificazione, acidi dissetante esperimenti utilizzando la soluzione di (MES) acida 4-Morpholineethanesulfonic (25 mM) con un pH di 5.5 possono essere utilizzati per determinare se vengono recuperate proteine delle vescicole sinaptiche dalla membrana del plasma tramite endocitosi1,3,4. Così, l'aumento di intensità di fluorescenza pHluorin riflette un equilibrio di exo - ed endocitosi e la diminuzione dopo stimolazione del nervo in particolare riflette endocitosi.
pHluorin formazione immagine può essere usata non solo per misurare il corso di tempo dell'endocitosi, ma anche la dimensione della vescicola sinaptica piscine7,8, e la probabilità di rilascio evocato e spontaneo versione9. Molti fattori e proteine coinvolte nella regolazione di endocitosi, quali calcio, le proteine solubili NSF-attachment proteina recettore (rullante), factor(BDNF) neurotrophic cervello-derivato e della calcineurina sono stati identificati usando pHluorin imaging1 , 2 , 10 , 11 , 12 , 13 , 14 , 15 , 16. Inoltre, il rilascio di neurotrasmettitore potrebbe essere rilevata nei neuroni non solo primari ma in cellule di neuroblastoma con TIRFM17. Recentemente, pHTomato, dsRed, mOrange e varianti di pHluorin sono stati sviluppati per il monitoraggio di registrazioni simultanee di fattori multipli in una singola sinapsi18,19. Ad esempio, pHTomato è stato fuso con lo synaptophysin e utilizzato con un indicatore di calcio codificato geneticamente (GCaMP5K) per monitorare la fusione della vescicola presinaptica e afflusso di Ca2 + nel compartimento postsinaptico20. Di conseguenza, pHluorin associata a proteine sinaptiche fornisce un metodo utile per analizzare la relazione fra endocitosi ed esocitosi.
EM è un altro metodo comunemente usato per lo studio di endocitosi, grazie all'elevata risoluzione spaziale che mostra i cambiamenti ultrastrutturali durante endocitosi. Due aree generali sono la capacità di visualizzare cambiamenti patologici all'interno di cellule neuronali21 e tenere traccia della vescicola proteine22. In particolare, l'osservazione dell'assorbimento delle vescicole sinaptiche, curvatura di membrana rivestite di clatrina nella zona periattiva ed endosomal strutture sono possibili con EM3,23,24,25 ,26,27,28. Mentre EM comporta potenziali artefatti, come fissativo-indotto malformazioni, che possono pregiudicare la endocitosi, e analisi dei dati è laboriosa, che la risoluzione fornisce un'opportunità interessante per visualizzare la struttura cellulare. Potenziali problemi di fissativo e la limitazione a risoluzione temporale EM può essere superati da alta pressione congelamento, fornendo un metodo veloce e non chimici di stabilizzare le delicate strutture presenti durante endocitosi27.
Protocollo
Nota: il seguente protocollo descrive i metodi di formazione immagine di pHluorin e metodi EM utilizzati in neuroni hippocampal coltivati. pHluorin monitor delle vescicole sinaptiche proteine l'assorbimento nelle cellule viventi ed EM rileva l'assorbimento delle vescicole sinaptiche e cambiamenti ultrastrutturali.
cura degli animali e procedura seguite linee guida NIH e sono stati approvati dal comitato di uso e cura degli animali NIH.
1. pHluorin Imaging
- cultura Neurone ippocampale
- preparare ippocampo Buffer (HB) combinando 4 NaHCO 3 e 5 mM HEPES e regolare a pH 7,3 con 5 M NaOH. Fare il terreno di coltura mescolando neurobasal medi, 2% B27, 0,5 mM L-Glutammina e 1% di penicillina-streptomicina. Inoltre, preparare una miscela di tampone HB con 20% di siero bovino fetale (FBS HB/20%).
Nota: Il presente protocollo coltura si basa su Sankaranarayanan, et al. 29 e Wu et al. 24 - decapitare i cuccioli del mouse tra postnatale giorno 0 al giorno 2 in terreno di coltura ed estrarre il cervello nella 4 ° C HB/20% FBS. Rimuovere il tronco cerebrale ed il talamo per esporre ippocampi. Sezionare ippocampi, dopo esporla tramite rimozione del tronco cerebrale e nel talamo e trasferire al fresco 4 ° C HB/20% FBS.
Nota: In genere, la resa è circa 4 x 10 5 cellule/mL per un cucciolo (due ippocampi). Pulire le membrane aderente con una pinzetta o forbici, poi il trasferimento a fresco 4 ° C HB/20% FBS. Srotolare la circonvoluzione dentata e isolare il subiculum tagliando con le forbici, poi trasferimento a fresco 4 ° C HB/20% FBS. - Dividere ogni ippocampo, dal taglio dall'inizio alla fine, a circa 10 fette e trasferirli in un tubo conico in polipropilene 15ml.
- Dopo che permette al tessuto di stabilirsi, lavare con 10 mL di HB/20% FB e poi lavare tre volte con 10ml di HB.
- Preparare la soluzione di digestione di 137 mM NaCl, 5 mM KCl, 7mm Na2HPO 4 e 25 mM HEPES e regolare il pH a 7,2 con NaOH M 5. Rimuovere il surnatante da ippocampi. Aggiungere 2 mL di soluzione di digestione 10 mg di tripsina e 1 mg di DNasi e filtrare attraverso una membrana da 0,22 µm sterile direttamente sul pellet campione.
- Incubare ippocampi per 5 min a 37 ° C, quindi lavate due volte con 10 mL di HB/20% FB e poi lavare una volta con 10 mL di HB.
- Dissociare le cellule con 6 mg di MgSO 4 ∙ 7 H 2 O e 1 mg di dnasi a 2 mL HB e filtro sterile sul ippocampi a pellet attraverso un filtro da 0,22 µm sterile. Delicatamente dissociare le cellule mediante triturazione attenzione, avendo cura di evitare di introdurre bolle d'aria. Consentire le particelle di tessuto a stabilirsi per 2 min e poi lentamente trasferire il surnatante in un'altra provetta.
- Aggiungere 3 mL HB/20% FBS alla sospensione cellulare e centrifuga o 10 min a 4 ° C e 1000 giri/min. Scartare il surnatante e risospendere in terreno di coltura.
- Piastra 60.000 cellule sospese nel 150 µ l di coltura su un vetrino coprioggetti 25 mm diametro di poli-D-lisina rivestito, senza fuoriuscita fuori il vetrino coprioggetti. Aggiungere 2 mL di terreno di coltura pre-riscaldato 2 h dopo il placcaggio. Le lamelle sono mantenute in coltura piastre da 6 pozzetti o Petri sterili.
- Cellule di mantenere a 37 ° C in un 5% CO 2 umidificati incubatore in terreno di coltura per 14-21 giorni prima della registrazione. Durante la crescita di cultura, cambiare la metà superiore del mezzo due volte a settimana.
- preparare ippocampo Buffer (HB) combinando 4 NaHCO 3 e 5 mM HEPES e regolare a pH 7,3 con 5 M NaOH. Fare il terreno di coltura mescolando neurobasal medi, 2% B27, 0,5 mM L-Glutammina e 1% di penicillina-streptomicina. Inoltre, preparare una miscela di tampone HB con 20% di siero bovino fetale (FBS HB/20%).
- Transfezione
- 6-7 giorni dopo il placcaggio, transfect synaptophysin-pHluorin 2 X (SpH) o VAMP2-pHluorin in neuroni ippocampali. Per SpH, utilizzare un promotore del citomegalovirus (CMV), inserito in un di vettore pcDNA3 30. Per VAMP2-pHluorin, utilizzare un promotore CMV inserito in un vettore di pCI 31.
- Transfect entrambi vector di elemento portante del lipido in cellule bersaglio, usando 1 µ g del plasmide. Utilizzare il terreno di coltura dal passaggio di protocollo 1.1.1, che manca del siero, per la transfezione. Modificare il mezzo 2 h dopo la trasfezione per ridurre la tossicità.
Nota: In caso di bassa espressione di SpH nel boutons, aumentare la concentrazione di DNA 2 µ g o il tempo di incubazione con il vettore del lipido, a meno che le cellule sono malsane. In genere, 4-10 celle (0,006-0,008%) dei neuroni transfected.
- Microscopia
- preparare soluzione salina normale è composto da 119 mM NaCl, 2mm CaCl 2, 2,5 mM KCl, 25mm HEPES (pH 7.4), glucosio di 30 mM, 2 mM MgCl 2, 0,01 mM (6-cyano-7-nitroquinoxaline-2,3-dione CNQX) e 0,05 mM acido DL-2-ammino-5-phosphonovaleric (AP5). Prendere un vetrino coprioggetto dalla piastra di terreno di coltura e posto su una camera di imaging che permette una stimolazione di campo, con lubrificante e sigillante per evitare perdite. Evitare di lasciare che il vetro asciutto durante il trasferimento di un vetrino coprioggetto dalla piastra alla camera immediatamente aggiungendo 750 µ l di soluzione salina normale.
Nota: CNQX e AP5 sono stati utilizzati per bloccare l'attività post-sinaptica, che ha il potenziale per attività ricorrente. Prima di mettere una camera su un microscopio a fluorescenza invertito, è possibile utilizzare tessuto di pulizia per confermare che la camera non ci siano perdite. Colatura lento causa i cambiamenti di messa a fuoco durante la registrazione dalla miscelazione di normale soluzione salina e immersione olio, che si traduce in cambiamenti nell'indice di rifrazione. - Stimolazione e registrazione d'immersione in olio (apertura numerica 1,4)
- immagine su un microscopio invertito widefield con un 60 X lente con una lampada ad alogenuri metallici. Visualizzare pHluorin con un filtro impostato per un picco di eccitazione di 480 nm, uno specchio di passaggio lungo 490 nm, un filtro di emissione di 500-550 nm e un otturatore manuale flip. Catturare immagini ogni 100 ms, con 2 x 2 binning, utilizzando una telecamera di elettrone moltiplicando Charge Coupled dispositivo (EMCCD).
Nota: Molte funzionalità dovrebbe essere considerata per raggiungere le giuste condizioni per evitare il photobleaching, compreso l'intervallo di acquisizione immagine e filtrare e binning, che sono dipendenti da attrezzature. Nel caso di imaging confocale, laser potenza e tempo di esposizione dovrebbe essere considerato per evitare photobleaching. L'installazione è stata determinata dopo aver registrato almeno 3 min senza stimolo e la registrazione è stata effettuata per almeno 10 s senza stimolo per cercare photobleaching. - Scegliere una zona con un'alta densità dei boutons per facilitare l'analisi in ogni esperimento. Identificare cellule trasfettate dal loro segnale di fluorescenza verde, con enfasi sui modelli di espressione rotonda o ovale nelle bouton ed espressione continua tra boutons.
- Induce endocitosi di stimolazione di campo utilizzando un 1 impulso ms, 20 mA potenziale d'azione (AP) fornito da uno stimolatore di impulso e trasportato attraverso un elettrodo di platino all'interno dell'unità di isolamento di stimolo. Attività fluorescenza della battuta nel corso della stimolazione e durante il recupero delle cellule.
Nota: Nel caso di cellule morte, espressione era più forte di vita boutons e ha mostrato un modello irregolare tra boutons.
- immagine su un microscopio invertito widefield con un 60 X lente con una lampada ad alogenuri metallici. Visualizzare pHluorin con un filtro impostato per un picco di eccitazione di 480 nm, uno specchio di passaggio lungo 490 nm, un filtro di emissione di 500-550 nm e un otturatore manuale flip. Catturare immagini ogni 100 ms, con 2 x 2 binning, utilizzando una telecamera di elettrone moltiplicando Charge Coupled dispositivo (EMCCD).
- preparare soluzione salina normale è composto da 119 mM NaCl, 2mm CaCl 2, 2,5 mM KCl, 25mm HEPES (pH 7.4), glucosio di 30 mM, 2 mM MgCl 2, 0,01 mM (6-cyano-7-nitroquinoxaline-2,3-dione CNQX) e 0,05 mM acido DL-2-ammino-5-phosphonovaleric (AP5). Prendere un vetrino coprioggetto dalla piastra di terreno di coltura e posto su una camera di imaging che permette una stimolazione di campo, con lubrificante e sigillante per evitare perdite. Evitare di lasciare che il vetro asciutto durante il trasferimento di un vetrino coprioggetto dalla piastra alla camera immediatamente aggiungendo 750 µ l di soluzione salina normale.
- Analisi dell'immagine
- Per analizzare l'intensità di fluorescenza in una singola bouton, impostato su una regione di interesse (ROI) come un 1,5 x 1,5 µm quadrati; la dimensione di una bouton è all'interno di circa 1,5 µm. uso le tracce prima della stimolazione per controllare photobleaching e sottrarre come sfondo.
- Normalizza fluorescenza cambiare (ΔF) con l'equazione:
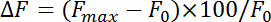
dove F max e F 0 si riferiscono al massimo incremento dopo stimolazione e fluorescenza della linea di base, rispettivamente. Misurare endocitosi tassi come il tasso di decadimento durante i primi 4-10 s dopo il punto massimo di fluorescenza di pHluorin. Ottenere la costante di tempo (τ) dell'endocitosi inserendo il deperimento di fluorescenza di pHluorin dall'aumento del picco alla linea di base con una funzione mono-esponenziale.
2. Microscopia elettronica
- preparare una poli-D-lisina 6-pozzetti piatto rivestito di applicazione 1,5 mL di soluzione di poli-D-lisina filtrato sterile 0,01% ad ogni pozzetto per 1 h a temperatura ambiente, poi lavare tre volte con acqua sterilizzata. Sezionare, cultura e mantenere i neuroni hippocampal come punti 1.1.1, 1.1.2 e 1.1.3, rispettivamente.
- Preparare una soluzione di stimolazione elevata K + con HRP come 31,5 mM NaCl, 2mm CaCl 2, 90 mM KCl, 25mm HEPES (pH 7.4), glucosio di 30 mM, 2 mM MgCl 2, 0,01 mM CNQX, 0,05 mM AP5 e 5 mg/mL HRP, quindi regolare il pH 7.4 con 5 M NaOH.
Soluzione di stimolazione K +
- stimolare la cultura del neurone ippocampale con 1,5 mL alto a temperatura ambiente (denominato K +) tramite l'aggiunta di 1,5 mL per ciascun pozzetto per 90 s. In condizione di riposa (denominata R), applicare la stessa concentrazione di 5 mg/mL HRP per 90 s, ma con normale soluzione salina. Per l'esempio di recupero, applicare la soluzione di stimolazione elevata K + come con l'esempio K +, poi rapidamente lavare e sostituire con normale soluzione salina e incubare per 10 min.
- Fissazione e colorazione
- preparare tampone cacodilato Na di 0.1 M utilizzando 21,4 g/L Na cacodylate a pH 7,4. Fissare le cellule con glutaraldeide al 4% in tampone cacodilato di 0.1 M Na per almeno 1 h a temperatura ambiente. Lavare tre volte con tampone cacodilato Na di 0.1 M per 7 minuti ciascuno,.
- Soluzione di preparare diaminobenzidina (DAB), composto da 0,5 mg/mL di tamponare con 0,3% H 2 O 2 ddH 2 O, ed il filtro con un filtro di 0,22 µm. Applicare 1,5 mL di soluzione DAB per 30 min a 37 ° C. lavare tre volte con tampone cacodilato Na di 0.1 M per 7 minuti ciascuno,.
Attenzione: DAB è un tossico e sospetto cancerogeno. Si prega di utilizzare guanti e camici da laboratorio.
Nota: Etichettatura con DAB si verifica a causa della sua ossidazione di H 2 O 2, come catalizzata da HRP. Piccoli aumenti nel risultato di componenti in un segnale aumentato nel campione. Aumento della concentrazione di HRP accelera l'effetto del catalizzatore. Sufficientemente grandi concentrazioni di H 2 O 2 consentono debilitante reazioni secondarie con HRP, inibendo l'effetto dell'etichettatura 32. In questo lavoro, le concentrazioni di questo sistema di etichettatura sono stati scelti in base alla ricerca attualmente disponibili 33 , 34. - Incubare i neuroni con 1,5 mL di 1% OsO 4 in tampone cacodilato Na di 0.1 M per 1 h a 4 ° C, come la fissazione della posta. Lavare tre volte con 1,5 mL di tampone cacodilato Na di 0.1 M per 7 minuti ciascuno,.
Attenzione: A causa della tossicità e la reattività di OsO 4, mantenendo il campione sul ghiaccio in una cappa chimica è preferibile in molti casi utilizzando un frigo per l'incubazione. - Preparare 0.1 M tampone acetato di sodio con 13,61 g/L sodio acetato e 11,43 mL/L acido acetico glaciale a pH 5.0. Lavare tre volte con tampone di acetato 1,5 mL 0,1 M a pH 5.0 per 7 minuti ciascuno e incubare con acetato di uranile 1,5 mL 1% in tampone acetato 0,1 M a pH 5.0 per 1 h a 4 ° C. Wash tre volte con tampone di acetato 0,1 M 1,5 mL per 7 minuti ciascuno,.
- Epossidica embedding
- disidratare la cultura del neurone con lavaggi di singolo 1,5 mL di etanolo 50%, 70% e 90%, 7 min in ciascuno e poi 3 lavaggi di 1,5 mL di etanolo al 100% per 7 minuti ciascuno, in una cappa aspirante.
- Mix 485 mL/L bisphenol-A-(epichlorhydrin), resina di anidride di 160 mL/L dodecenyl succinico (DDSA), 340 mL/L metil-5-Norbornene-2,3-dicarbossilico anidride acetica (NMA) e 15 mL/L 2, 4,6-tris (dimethylaminomethyl) fenolo (DMP-30) per creare la resina epossidica resina. Mix accuratamente, quindi memorizzare sotto vuoto per eliminare le bolle d'aria.
Nota: È fondamentale per rimuovere le bolle d'aria nella resina, soprattutto quelli inferiori visibili ad occhio nudo, perché possono causare cavità nella resina durante il sezionamento. - Si infiltra nell'esempio sostituendo l'etanolo con 50% resina epossidica resina in etanolo per 30 min a temperatura ambiente in un agitatore, poi 70% resina epossidica in etanolo per 30 min a temperatura ambiente in un agitatore.
- Interruttore la resina epossidica resina soluzione con resina epossidica di 100% e incubare per 10 min a 50 scambi di eseguire due ° C. dell'epossiresina 100% fresco con incubazioni per 1 h a 50 ° C. Aggiungi fresco 100% resina epossidica resina e lasciar per indurire a 50 ° C durante la notte e poi a 60 & n. 17 6; C per oltre 36 h a indurire.
- Rimuovere ogni campione da muti-pozzetti con un gioielliere ' sega a mano s. Selezionare le regioni di interesse, dense concentrazioni di cellule, utilizzando un microscopio ottico invertito e poi tagliare blocchi nm 70-80 per il sezionamento di microtomo. Montare la regione di taglio nel mandrino microtomo e caricare il microtomo. Posizionare il mandrino nel microtomo e montare una lama di diamante con il bordo parallelo alla superficie del blocco. Raccogliere le sezioni di spessore nm 70-80 direttamente sulle griglie individuali.
- Sciogliere acetato di uranile in acqua per una soluzione di 1% in peso e sciogliere separatamente citrato di piombo in acqua per una soluzione al 3% in peso. Colorante di contrasto le sezioni da immersione con acetato di uranile acquosa 1% per 15 min e poi 3% acquosa piombo citrato per 5 min migliorare il contrasto dei campioni.
- Formazione immagine EM
- esaminare le sezioni con un microscopio elettronico a trasmissione e registrare le immagini con una fotocamera digitale CCD ad un ingrandimento primario di 10.000-20, 000 X 3.
- Statistiche
- eseguire un t-test per identificare differenze significative confrontando la media e l'errore standard di misura (s.e.m.) tra il controllo e i campioni sperimentali.
Risultati
Utilizzando il metodo di elemento portante del lipido, SpH è stato espresso nei neuroni dell'ippocampo, che consenta l'identificazione dei boutons (Figura 1a). La stimolazione elettrica delle cellule indotto esocitosi e un corrispondente aumento in intensità di fluorescenza. L'aumento della fluorescenza (ΔF) è stato interrotto terminando lo stimolo (Figura 1b). L'aumento della fluorescenza è stata seguita da una lenta diminu...
Discussione
Qui dimostriamo due metodi per il monitoraggio di endocitosi delle vescicole sinaptiche. Nel primo metodo, abbiamo monitorato pHluorin fuse con una proteina della vescicola sinaptica nei neuroni trasfettati e successivamente elettricamente stimolata. In secondo luogo, abbiamo usato la formazione immagine EM dell'assorbimento HRP come indotto da KCl. Abbiamo usato diversi stimoli per due motivi. In primo luogo, applicazione di potassio induce la depolarizzazione di tutti i neuroni nella cultura. Questo facilita l'esame EM...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo il Dr. Yong-Ling Zhu per fornire lo synaptophysin-pHluorin2x costrutto e Dr. James E. Rothman per fornire VAMP2-phluorin. Ringraziamo Dr. Susan Cheng e Virginia Crocker di NINDS microscopia elettronica Facility per loro guida e supporto tecnico. Questo lavoro è stato supportato dall'Istituto nazionale dei disordini neurologici e colpo programma di ricerca intramurale in USA e una sovvenzione dal programma iniziativa ricerca KRIBB (coreano Biomedical Scientist Fellowship Program), Korea Research Institute di Bioscienze e biotecnologie, Repubblica di Corea.
Materiali
| Name | Company | Catalog Number | Comments |
| Lipofectamine LTX with Plus | Thermo Fisher | 15338-100 | Transfection of plasmid DNA including synaptophysin or VAMP2-pHluorin |
| neurobasal medium | Thermo Fisher | 21103-049 | Growth medium for neuron, Warm up to 37°C before use |
| B27 | Thermo Fisher | 17504-044 | Gradient for neuronal differentiation |
| Glutamax | Thermo Fisher | 35050-061 | Gradient for neuronal culture |
| Poly-D-Lysine coated coverslip | Neuvitro | GG-25-pdl | Substrate for neuronal growth and imaging of pHluorin |
| Trypsin XI from bovine pancrease | Sigma | T1005 | Neuronal culture-digest hippocampal tissues |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025 | Neuronal culture-inhibits viscous cell suspension |
| pulse stimulator | A-M systems | model 2100 | Apply electrical stimulation |
| Slotted bath with field stimulation | Warner Instruments | RC-21BRFS | Apply electrical stimulation |
| stimulus isolation unit | Warner Instruments | SIU102 | Apply electrical stimulation |
| lubricant | Dow corning | 111 | pHluorin imaging-seal with coverslip and imaging chamber, avoid leak from chamber |
| AP5 | Tocris | 3693 | Gradient for normal saline, selective NMDA receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| CNQX | Tocris | 190 | Gradient for normal saline, competitive AMPA/kainate receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| Illuminator | Nikon | C-HGFI | Metal halide light source for pHluorin |
| EMCCD camera | Andor | iXon3 | pHluorin imaging, detect pHluorin fluorescence intensity |
| Inverted microscopy | Nikon | Ti-E | Imaging for synaptophysin or VAMP2 pHluorin transfected cells |
| NIS-Elements AR | Nikon | NIS-Elements Advanced Research | Software for imaging acquisition and analysis |
| Igor Pro | WaveMetrics | Igor pro | Software for imaging analysis and data presentation |
| imaging chamber | Warner Instruments | RC21B | pHluorin imaging, apply field stimulation on living cells |
| poly-l-lysine | Sigma | P4832 | Electron microscopy, substrate for neuronal growth, apply on multiwell plate for 1 h at room temperature then wash with sterilized water 3 times |
| Horseradish peroxidase(HRP) | Sigma | P6782 | Electron microscopy, labeling of endocytosed synaptic vesicles by catalyzing DAB in presence hydrogen peroxide, final concentration is 5 mg/mL in normal saline, make fresh before use |
| Na cacodylate | Electron Microscopy Sciences | 12300 | Electron microscopy, buffer for fixatives and washing, final concentration is 0.1 N |
| 3,3′-Diaminobenzidine(DAB) | Sigma | D8001 | Electron microscopy, labeling of endocytosed synaptic vesicles, substrate for HRP, final concentration is 0.5 mg/mL in DDW and filtered, make fresh before use |
| Hydrogen peroxide solution | Sigma | H1009 | Electron microscopy, labeling of endocytosed synaptic vesicles by inducing HRP-DAB reaction, final concentration is 0.3% in DDW, make fresh before use |
| glutaraldehyde | Electron Microscopy Sciences | 16365 | Electron microscopy, fixatives, final concentration is 4% in Na-cacodylate buffer, make fresh before use, shake well before to use |
| TEM | JEOL | 200CX | Electron microscopy, imaging of endocytosed vesicles and ultrastructural changes |
| CCD digital camera | AMT | XR-100 | Electron microscopy, capturing images |
| Lead citrate | Leica microsystems | 16707235 | Electron microscopy, grid staining |
Riferimenti
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nature cell biol. 2 (4), 197-204 (2000).
- Sun, T., Wu, X. S., et al. The role of calcium/calmodulin-activated calcineurin in rapid and slow endocytosis at central synapses. J Neurosci. 30 (35), 11838-11847 (2010).
- Wu, X. -. S. S., Lee, S. H., et al. Actin Is Crucial for All Kinetically Distinguishable Forms of Endocytosis at Synapses. Neuron. 92 (5), 1020-1035 (2016).
- Granseth, B., Odermatt, B., Royle, S. J., Lagnado, L. Clathrin-mediated endocytosis is the dominant mechanism of vesicle retrieval at hippocampal synapses. Neuron. 51 (6), 773-786 (2006).
- Atluri, P. P., Ryan, T. A. The kinetics of synaptic vesicle reacidification at hippocampal nerve terminals. J Neurosci. 26 (8), 2313-2320 (2006).
- Royle, S. J., Granseth, B., Odermatt, B., Derevier, A., Lagnado, L. Imaging phluorin-based probes at hippocampal synapses. Methods Mol Biol. 457, 293-303 (2008).
- Moulder, K. L., Mennerick, S. Reluctant vesicles contribute to the total readily releasable pool in glutamatergic hippocampal neurons. J Neurosci. 25 (15), 3842-3850 (2005).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptopHluorin. Proc Natl Acad Sci U S A. 102 (17), 6131-6136 (2005).
- Morris, R. G. Elements of a neurobiological theory of hippocampal function: the role of synaptic plasticity, synaptic tagging and schemas. Eur J Neurosci. 23 (11), 2829-2846 (2006).
- Sankaranarayanan, S., Ryan, T. A. Calcium accelerates endocytosis of vSNAREs at hippocampal synapses. Nat Neurosci. 4 (2), 129-136 (2001).
- Balaji, J., Armbruster, M., Ryan, T. A. Calcium control of endocytic capacity at a CNS synapse. J Neurosci. 28 (26), 6742-6749 (2008).
- Ferguson, S. M., Brasnjo, G., et al. A selective activity-dependent requirement for dynamin 1 in synaptic vesicle endocytosis. Science. 316 (5824), 570-574 (2007).
- Baydyuk, M., Wu, X. S., He, L., Wu, L. G. Brain-derived neurotrophic factor inhibits calcium channel activation, exocytosis, and endocytosis at a central nerve terminal. J Neurosci. 35 (11), 4676-4682 (2015).
- Wu, X. S., Zhang, Z., Zhao, W. D., Wang, D., Luo, F., Wu, L. G. Calcineurin is universally involved in vesicle endocytosis at neuronal and nonneuronal secretory cells. Cell Rep. 7 (4), 982-988 (2014).
- Zhang, Z., Wang, D., et al. The SNARE proteins SNAP25 and synaptobrevin are involved in endocytosis at hippocampal synapses. J Neurosci. 33 (21), 9169-9175 (2013).
- Wu, L. -. G. G., Hamid, E., Shin, W., Chiang, H. -. C. C. Exocytosis and endocytosis: modes, functions, and coupling mechanisms. Annu Rev Physiol. 76 (1), 301-331 (2014).
- Daniele, F., Di Cairano, E. S., Moretti, S., Piccoli, G., Perego, C. TIRFM and pH-sensitive GFP-probes to evaluate neurotransmitter vesicle dynamics in SH-SY5Y neuroblastoma cells: cell imaging and data analysis. J Vis Exp. (95), e52267 (2015).
- Shaner, N. C., Lin, M. Z., et al. Improving the photostability of bright monomeric orange and red fluorescent proteins. Nat Methods. 5 (6), 545-551 (2008).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Leitz, J., Kavalali, E. T. Fast retrieval and autonomous regulation of single spontaneously recycling synaptic vesicles. Elife. 3, e03658 (2014).
- Bisht, K., El Hajj, H., Savage, J. C., Sánchez, M. G., Tremblay, M. -. &. #. 2. 0. 0. ;. Correlative Light and Electron Microscopy to Study Microglial Interactions with β-Amyloid Plaques. J Vis Exp. (112), e54060 (2016).
- Schikorski, T. Monitoring Synaptic Vesicle Protein Sorting with Enhanced Horseradish Peroxidase in the Electron Microscope. High-Resolution Imaging of Cellular Proteins: Methods and Protocols. , 327-341 (2016).
- Kononenko, N. L., Puchkov, D., et al. Clathrin/AP-2 mediate synaptic vesicle reformation from endosome-like vacuoles but are not essential for membrane retrieval at central synapses. Neuron. 82 (5), 981-988 (2014).
- Wu, Y., O'Toole, E. T., et al. A dynamin 1-, dynamin 3- and clathrin-independent pathway of synaptic vesicle recycling mediated by bulk endocytosis. eLife. 2014 (3), e01621 (2014).
- Heuser, J. E., Reese, T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J Cell Biol. 57 (2), 315-344 (1973).
- Ceccarelli, B., Hurlbut, W. P., Mauro, A. Turnover of transmitter and synaptic vesicles at the frog neuromuscular junction. J Cell Biol. 57 (2), 499-524 (1973).
- Watanabe, S., Rost, B. R., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S., Trimbuch, T., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
- Sankaranarayanan, S., Atluri, P. P., Ryan, T. A. Actin has a molecular scaffolding, not propulsive, role in presynaptic function. Nat Neurosci. 6 (2), 127-135 (2003).
- Zhu, Y., Xu, J., Heinemann, S. F. Two pathways of synaptic vesicle retrieval revealed by single-vesicle imaging. Neuron. 61 (3), 397-411 (2009).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Arnao, M. B. B., Acosta, M., del Rio, J. A. A., García-Cánovas, F. Inactivation of peroxidase by hydrogen peroxide and its protection by a reductant agent. Biochim Biophys Acta. 1038 (1), 85-89 (1990).
- Deák, F., Schoch, S., et al. Synaptobrevin is essential for fast synaptic-vesicle endocytosis. Nat Cell Biol. 6 (11), 1102-1108 (2004).
- Clayton, E. L., Evans, G. J. O., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J Neurosci. 28 (26), 6627-6632 (2008).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nat Neurosci. 17 (1), 10-16 (2014).
- Wienisch, M., Klingauf, J. Vesicular proteins exocytosed and subsequently retrieved by compensatory endocytosis are nonidentical. Nat Neurosci. 9 (8), 1019-1027 (2006).
- Fernández-Alfonso, T., Kwan, R., Ryan, T. A. Synaptic vesicles interchange their membrane proteins with a large surface reservoir during recycling. Neuron. 51 (2), 179-186 (2006).
- Gimber, N., Tadeus, G., Maritzen, T., Schmoranzer, J., Haucke, V. Diffusional spread and confinement of newly exocytosed synaptic vesicle proteins. Nat Commun. 6, 8392 (2015).
- Nicholson-Fish, J. C., Smillie, K. J., Cousin, M. A. Monitoring activity-dependent bulk endocytosis with the genetically-encoded reporter VAMP4-pHluorin. J Neurosci Methods. 266, 1-10 (2016).
- Burrone, J., Li, Z., Murthy, V. N. Studying vesicle cycling in presynaptic terminals using the genetically encoded probe synaptopHluorin. Nat Protoc. 1 (6), 2970-2978 (2006).
- Wisse, E., Braet, F., et al. Fixation methods for electron microscopy of human and other liver. World journal of gastroenterology. 16 (23), 2851-2866 (2010).
- Magidson, V., Khodjakov, A. Circumventing Photodamage in Live-Cell Microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Søndergaard, C. R., Garrett, A. E., et al. Structural artifacts in protein-ligand X-ray structures: implications for the development of docking scoring functions. J Med Chem. 52 (18), 5673-5684 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon