Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sinaptik vezikül endositoz kültürlü Hipokampal nöronlar içinde ölçme
Bu Makalede
Özet
Sinaptik vezikül endositoz sinaptik vezikül protein ile erimiş pHluorin ışık mikroskobu ve elektron mikroskobu vezikül Alım tarafından algılanır.
Özet
Endositoz sırasında erimiş sinaptik veziküller vezikül geri dönüşüm ve böylece sinaptik iletimi sırasında tekrarlayan sinir ateş bakım sağlayan sinir terminallerinde alınır. Patolojik durumlarda Engelli endositoz sinaptik gücü ve beyin fonksiyonları düşüşler yol açar. Burada, sinaptik vezikül endositoz memeli Hipokampal synapse nöronal kültür, ölçmek için kullanılan yöntemleri açıklar. Sinaptik vezikül protein endositoz veziküler lumenal yan pHluorin, artar bir pH duyarlı yeşil flüoresan protein ile synaptophysin ve VAMP2/synaptobrevin, dahil olmak üzere bir sinaptik veziküler membran protein eritme tarafından izlenen onun pH olarak floresan yoğunluğu artar. Ekzositozu sırasında veziküler Lümen pH artırır, veziküler endositoz Lümen sırasında pH yeniden acidified ise. Endositoz etiketli sinaptik vezikül protein bir azalma gösterir, ancak böylece, fusion, pHluorin floresan yoğunluğu bir artış gösterir. Endositoz kaydetmek için pHluorin görüntüleme yöntemi kullanmaya ek olarak, biz membran veziküler endositoz Horseradish peroksidaz (HRP) Alım elektron mikroskobu (EM) ölçümleri tarafından veziküller tarafından izlenir. Son olarak, yüksek potasyum kaynaklı depolarizasyon sonra çeşitli zamanlarda sinir terminal membran çukurlar oluşumu izlenir. HRP alımı ve membran çukur oluşumu zaman tabii endositoz zaman elbette gösterir.
Giriş
Nörotransmitter sinaptik veziküller içinde depolanan ve ekzositozu tarafından yayımlanan. Sinaptik vezikül membran ve protein o zaman endositoz tarafından içselleştirilmiş ve ekzositozu sonraki turda yeniden. Sinaptik veziküller endositoz sinaptik vezikül havuzları korumak için önemlidir ve çıkıntılı veziküller plazma zarı kaldırır. Asidik şartlar altında su ve nötr pH dequenched, pH-duyarlı yeşil flüoresan protein pHluorin derslerde hücreleri1,2,3canlı endositoz zamanı ölçmek için kullanılmaktadır. PHluorin protein genellikle sinaptik vezikül proteinler, synaptophysin veya VAMP2/synaptobrevin gibi lumenal tarafına eklenir. İstirahat, sinaptik veziküller 5,5 pH Lümen içinde pHluorin söndürülür. Plazma zarı vezikül fusion sunar veziküler Lümen ekstraselüler çözüm pH ~ 7.3, nerede bir artış pHluorin floresan kaynaklanan. Ekzositozu sonra artan Floresans bozunmaları, endositoz vezikül yeniden asitleştirme kurtarılan Bu veziküller içinde ardından sinaptik vezikül proteinlerin nedeniyle. Endositoz ve veziküler yeniden asitleştirme çürüme yansıtan rağmen yeniden asitleştirme endositoz çoğu koşulları1,4daha hızlı olduğu için çoğunlukla endositoz, yansıtır. 3-4 s veya genellikle daha hızlı 10'dan daha az5,olan6, yeniden asitleştirme zaman sabiti olan s veya daha vezikül endositoz4,5için gerekli. Deneyler endositoz yeniden asitleştirme ayırt etmek gerekiyorsa, pH 5.5 ile 4-Morpholineethanesulfonic asit (MES) çözüm (25 mM) kullanarak asit su verme deneyleri sinaptik vezikül proteinler alınır olup olmadığını belirlemek için kullanılabilir endositoz1,3,4üzerinden plazma zarı. Böylece, pHluorin floresan yoğunluk artmak exo - ve endositoz bir denge yansıtır ve sinir stimülasyonu sonra düşüş özellikle endositoz yansıtır.
pHluorin görüntüleme sadece endositoz zaman tabii, aynı zamanda sinaptik vezikül havuzları7,8boyutunu ölçmek için kullanılabilir ve olasılık uyarılmış yayın ve spontan bırakın9. Birçok faktörler ve proteinler endositoz, kalsiyum, çözünür NSF-ek protein reseptörü (tuzak) proteinler, beyin kaynaklı Nörotrofik factor(BDNF) ve kalsinörin gibi düzenlenmesinde ilgili pHluorin görüntüleme1 kullanarak belirlendi , 2 , 10 , 11 , 12 , 13 , 14 , 15 , 16. Ayrıca, nörotransmitter sürümü yalnızca birincil nöronlar ama Nöroblastom hücreleri TIRFM17ile tespit edilemedi. Son zamanlarda, pHluorin türevleri, dsRed, mOrange ve pHTomato bir tek synapse18,19Multipl faktörler eşzamanlı kayıtları izlemek için geliştirilmiştir. Örneğin, pHTomato synaptophysin ile erimiş edilmiş ve genetik olarak kodlanmış kalsiyum göstergesiyle (GCaMP5K) presynaptic vezikül fusion ve Ca2 + akını postsinaptik yuvası20izlemek için kullanılır. Bu nedenle, sinaptik proteinler için bağlı pHluorin ekzositozu endositoz arasındaki ilişkiyi analiz etmek için yararlı bir yöntem sağlar.
EM endositoz ultrastructural değişiklikleri sırasında endositoz gösterir yüksek Uzaysal çözünürlük nedeniyle çalışma için yaygın olarak kullanılan başka bir yöntemdir. İki genel patolojik değişiklikler nöronal hücre21 içinde görselleştirmek ve vezikül proteinler22takip yeteneği alanlardır. Özellikle, clathrin periactive bölgesinde tarafından gözlem sinaptik vezikül Alım, membran eğriliği kaplı ve endosomal yapıları EM3,23,24ile,25 mümkündür ,26,27,28. Bu endositoz etkileyebilir EM malformasyonlar, sabitleştirici indüklenen gibi potansiyel yapılar içerir ve veri analizidir emek yoğun, çözünürlük hücresel yapısı görselleştirmek için cazip bir fırsat sağlar. Olası sabitleştirici sorunları ve EM zamansal çözünürlük sınırlaması dondurma, hassas yapıları endositoz27sırasında mevcut sabitleme hızlı ve kimyasal olmayan bir yöntem sağlayan yüksek basınç tarafından üstesinden gelebilir.
Protokol
Not: pHluorin görüntüleme yöntemleri ve kültürlü Hipokampal nöronlar. pHluorin monitörler sinaptik vezikül protein anlamazdın canlı hücreler içinde kullanılan bir EM yöntem aşağıdaki iletişim kuralı tanımlar ve EM sinaptik vezikül alımını algılar ve ultrastructural değişiklikleri.
hayvan bakımı ve yordam NIH yönergeleri takip ve NIH hayvan bakım ve kullanım Komitesi tarafından kabul edildi.
1. pHluorin görüntüleme
- Hipokampal nöron kültür
- ile birleştirerek 4 mM NaHCO 3 ve 5 mM HEPES hazırla Hippocampus arabellek (HB) ve pH 7.3 ile 5 M NaOH için ayarlayın. Kültür orta neurobasal orta, %2 B27, 0,5 mM L-glutamin ve % 1 penisilin streptomisin karıştırılarak olun. Ayrıca, sert kapak Ciltli arabellek % 20 ile karışımı hazırlamak Fetal sığır Serum (HB/20% FBS).
Not: Bu kodlamayla Protokolü Sankaranarayanan, et al. dayanır 29 ve Wu vd. 24 - fare pups postnatal gün 0 gün 2 kültür orta içine arasında başını kesmek ve beyin 4 ° C HB/20% FBS hulâsa. Beyin sapı ve talamus hippocampi ortaya çıkarmak için kaldırın. Hippocampi çıkarılması beyin sapı ve Talamus, tarafından açığa sonra incelemek ve transfer taze 4 ° C HB/20% FBS.
Not: Genellikle, 4 x 10-5 hücre/mL bir yavru (iki hippocampi) için verimidir. Cımbız veya makas kullanılarak yapışan membranlar temizlik sonra taze 4 ° C HB/20% FBS için transfer. Dentat gyrus göz önüne sermek ve subiculum makasla kesme tarafından izole, sonra aktarmak taze 4 ° C HB/20% FBS. - Her Hipokampus uçtan uca yaklaşık 10 dilimler halinde keserek bölmek ve bir 15 mL polipropilen konik tüp için transfer.
- Doku yerleşmek izin sonra yıkayın HB/20% FBS 10 mL ile ve sonra yıkayın HB ile üç kez 10 mL.
- 137 mM NaCl, 5 mM KCl, 7 mM Na2HPO 4 ve 25 mM HEPES sindirim çözüm hazırlamak ve pH 7.2 ile 5 M NaOH için ayarlayın. Süpernatant hippocampi kaldırın. Tripsin 10 mg ve Dnaz 1 mg 2 mL sindirim çözeltisi ekleyin ve filtre aracılığıyla doğrudan örnek Pelet üzerine bir steril 0,22 µm membran.
- Hippocampi 37 ° C'de 5 min için kuluçkaya sonra yıkama HB/20% FBS iki kez 10 mL ile ve sonra bir kez yıkayın HB ile 10 mL.
- MgSO 4 6 mg hücrelerle ayırmak ∙ 7 H 2 O ve Dnaz 1 mg 2 mL HB ve hippocampi üzerine steril filtre cips steril bir 0,22 µm filtreden. Yavaşça hücreleri dikkatli triturating tarafından hava kabarcıkları tanıtımı önlemek için karşılamaya süre ayırmak. Doku parçacıklar 2 min için yerleşmek izin ve sonra yavaş yavaş süpernatant için başka bir tüp aktarın.
- Ekle 3 mL HB/20% FBS hücre süspansiyon ve santrifüj veya 10 dk 4 ° C'de ve 1000 rpm. Süpernatant atmak ve kültür ortamında resuspend.
- Plaka 60.000 hücreleri 150 µL kültür orta coverslip açıklarında sızıntısına olmadan Poli-D-lizin kaplı 25 mm çapında coverslip üzerinde askıya alındı. Önceden ısıtılmış kültür orta 2 h 2 mL kaplama sonra ekleyin. Coverslips 6-şey kodlamayla plakaları veya steril Petri yemekler sürdürülür.
- Koru hücreleri % 5 37 ° C'de CO 2 14-21 gün önce kayıt için kuluçka makinesine kültür orta nemlendirilmelidir. Kültür büyüme sırasında orta üst yarısı haftada iki kez değiştirin.
- ile birleştirerek 4 mM NaHCO 3 ve 5 mM HEPES hazırla Hippocampus arabellek (HB) ve pH 7.3 ile 5 M NaOH için ayarlayın. Kültür orta neurobasal orta, %2 B27, 0,5 mM L-glutamin ve % 1 penisilin streptomisin karıştırılarak olun. Ayrıca, sert kapak Ciltli arabellek % 20 ile karışımı hazırlamak Fetal sığır Serum (HB/20% FBS).
- Transfection
- synaptophysin-pHluorin 2 X 6-7 gün sonra kaplama, transfect (SpH) veya VAMP2-pHluorin Hipokampal nöronların içine. SpH için bir pcDNA3 vektör 30 eklenen bir Sitomegalovirüs (CMV) organizatörü kullanın. VAMP2-pHluorin için bir PCI vektör 31 eklenen bir CMV organizatörü kullanın.
- Lipid taşıyıcı tarafından her iki vektör plazmid 1 µg kullanarak hedef hücrelere transfect. Serum yoksun, kültür orta Protokolü adım 1.1.1, transfection için kullanın. Orta 2 h toksisite azaltmak için transfection sonra değiştirin.
Not: hücreleri sağlıksız olmadıkça SpH boutons içinde düşük ifade durumunda 2 µg veya KULUÇKA zaman DNA konsantrasyon lipid taşıyıcı ile artırın. Genellikle 4-10 hücreleri (0,006 %0.008) nöronlar transfected.
- Işık mikroskobu
- hazırla normal tuzlu çözüm oluşan 119 mM NaCl, 2 mM CaCl 2, 2.5 mM KCl, 25 mM HEPES (pH 7,4), 30 mM glikoz, 2 mM MgCl 2, 0.01 mM 6-cyano-7-nitroquinoxaline-2,3-dione () CNQX) ve 0.05 mM DL-2-amino-5-phosphonovaleric asit (AP5). Bir coverslip kültür orta plaka ve yer alan stimülasyon, sızıntıları önlemek için yağ ve dolgu macunu kullanarak sağlar bir görüntüleme odası üzerinde al. Hemen 750 µL normal tuzlu çözüm ekleyerek odası plaka bir coverslip transfer sırasında kuru cam izin kaçının.
Not: CNQX ve AP5 tekrarlayan etkinlik için potansiyele sahiptir postsinaptik faaliyetleri engellemek için kullanıldı. Bir oda bir ters Floresans mikroskobu yerleştirmeden önce temizlik doku odası değil kaçak onaylamak için kullanın. Yavaş sızıntı neden olan odak değişiklikleri kayıt sırasında Kırılma indisi değişimler sonucunda normal salin ve daldırma yağ karışımı ile. - Uyarım ve
- görüntü üzerinde bir ters widefield mikroskobu ile bir 60 X (1.4 sayısal diyafram) yağı daldırma kayıt lens ile bir metal halide lamba. 480 bir uyarma zirve için ayarla bir filtre ile pHluorin görselleştirmek nm, 490 nm uzun pası ayna, 500-550 nm emisyon filtre ve bir el ile fiske vurmak çekim. Esir alma imge her 100 ile 2 x 2 binning, ms, bir elektron çarparak şarj birleştiğinde aygıt (EMCCD) kamera kullanarak.
Not: Photobleaching görüntü yakalama aralığı da dahil olmak üzere, önlemek için uygun koşullar elde etmek ve filtre uygulamak için çeşitli özellikler düşünülmesi gereken ve binning, hangi ekipman üzerinde bağımlı. Confocal görüntüleme durumunda lazer güç ve pozlama zaman photobleaching önlemek için düşünülmelidir. En az 3 dk uyaran olmadan kaydettikten sonra kurulum belirlendi ve kayıt için en az 10 gerçekleştirildi s photobleaching için kontrol etmek için uyaran olmadan. - Her deneyde boutons analiz kolaylığı için yüksek yoğunluğu ile bir alanı seçin. Yeşil floresan sinyallerini bouton ve boutons arasında sürekli ifade yuvarlak veya oval ifade desen üzerinde durularak tarafından transfected hücrelerini tanımlamak.
- Yol endositoz 1 kullanarak alan stimülasyon tarafından ms darbesi, 20 mA eylem bir darbe uyarıcı sağlanan ve platin elektrot uyarıcı yalıtım birimi içinde aracılığıyla teslim potansiyel (AP). Görüntü Floresans etkinlik boyunca stimülasyon ve hücre kurtarma sırasında.
Not: Ölü hücreleri, söz konusu olduğunda ifade yaşam boutons güçlü olduğunu ve boutons arasındaki düzensiz bir desen gösterdi.
- görüntü üzerinde bir ters widefield mikroskobu ile bir 60 X (1.4 sayısal diyafram) yağı daldırma kayıt lens ile bir metal halide lamba. 480 bir uyarma zirve için ayarla bir filtre ile pHluorin görselleştirmek nm, 490 nm uzun pası ayna, 500-550 nm emisyon filtre ve bir el ile fiske vurmak çekim. Esir alma imge her 100 ile 2 x 2 binning, ms, bir elektron çarparak şarj birleştiğinde aygıt (EMCCD) kamera kullanarak.
- hazırla normal tuzlu çözüm oluşan 119 mM NaCl, 2 mM CaCl 2, 2.5 mM KCl, 25 mM HEPES (pH 7,4), 30 mM glikoz, 2 mM MgCl 2, 0.01 mM 6-cyano-7-nitroquinoxaline-2,3-dione () CNQX) ve 0.05 mM DL-2-amino-5-phosphonovaleric asit (AP5). Bir coverslip kültür orta plaka ve yer alan stimülasyon, sızıntıları önlemek için yağ ve dolgu macunu kullanarak sağlar bir görüntüleme odası üzerinde al. Hemen 750 µL normal tuzlu çözüm ekleyerek odası plaka bir coverslip transfer sırasında kuru cam izin kaçının.
- Görüntü analizi
- Bir tek bouton floresan yoğunluğu çözümlemek için bir bölge, faiz (yatırım Getirisi kadar) bir 1.5 x 1,5 µm kare olarak ayarlayın; bir bouton yaklaşık 1,5 µm. kullanım izleri photobleaching için kontrol ve arka plan olarak çıkarmak stimülasyon önce içinde boyutudur.
- Normale floresan değiştirme (ΔF) ile denklem:
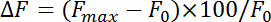
nereye F maksimum F 0 basvurunuz maksimal artış stimülasyon sonra ve taban çizgisi Floresan, anılan sıraya göre. Endositoz çürüme oranı ilk 4-10 s pHluorin floresan en yüksek noktadan sonra izleyen. Zaman sabiti (τ) temel bir mono Üstel fonksiyon ile en yüksek artış dan pHluorin floresan çürüme yaklaştırarak endositoz ile elde edilir.
2. Elektron mikroskobu
- hazırla bir Poli-D-lizin her şey oda sıcaklığında 1 h için 1,5 mL % 0,01 Poly-D-lizin çözeltisi steril filtre uygulamak, sonra üç kere steril su ile yıkama tarafından 6-şey plaka kaplı. İncelemek, kültür ve Hipokampal nöronlar olduğu gibi 1.1.1, 1.1.2 ve 1.1.3, adımları sırasıyla korumak.
- Hazırla yüksek K + stimülasyon Çözümle 31.5 mm NaCl, 2 mM CaCl 2, 90 mM KCl, 25 mM HEPES (pH 7,4), 30 mM glikoz, HRP 2 mM MgCl 2, 0.01 mM CNQX, 0.05 mM AP5 ve 5 mg/mL HRP, sonra ayarlamak için pH 7.4 ile 5 M NaOH.
- Stimulate Hipokampal nöron kültürü ile 1,5 mL yüksek K + stimülasyon çözüm (+ K olarak tarafından her şey için 1,5 mL ilavesi başvurulan) 90 için oda sıcaklığında s. 5 mg/mL HRP 90 için aynı konsantrasyonu (R adlandırılır) istirahat durumda uygulamak s, ama normal salin solüsyonu geçirin. Kurtarma örnek için K + örnek ile yüksek K + stimülasyon çözümü uygulamak sonra hızla yıkama ve normal salin ile değiştirin ve 10 dk. için kuluçkaya
- Fiksasyon ve boyama
- 0.1 M Na cacodylate arabellek 21.4 g/L Na cacodylate pH 7.4 kullanarak hazırlayın. Hücreleri 0.1 M Na cacodylate arabellek için 1S oda sıcaklığında en az % 4 oxazolidin ile düzeltmek. Üç kez ile 0.1 M Na cacodylate arabellek 7 dakika yıkayın. 0,5 mg/mL oluşan
- hazırlamak Diaminobenzidine (DAB) çözüm, H 2 O 2 GKD 2 O ve 0,22 µm filtre ile filtre %0,3 ile KURULAMAK. Üç kez ile 0.1 M Na cacodylate arabellek için 7 dk. 37 ° c yıkama 30 dk için 1,5 mL DAB çözüm uygulamak.
Dikkat: DAB şüpheli ve zehirli kanserojen olduğu. Lütfen eldiven ve laboratuvar mont kullanın.
Not: DAB ile etiketleme, oksidasyon nedeniyle tarafından H 2 O 2, HRP tarafından katalize oluşur. Örnekteki artan bir sinyal bileşenleri sonucu küçük artışlar. HRP konsantrasyonu artan katalizör etkisi kadar hızlandırır. H 2 O 2 yeterince yüksek konsantrasyonlarda HRP, yan etki zayıflatıcı için 32 etiketleme etkisini inhibe izin verir. Bu çalışmada, bu etiketleme sistemi konsantrasyonları mevcut araştırma 33 , 34 dayalı seçildi. - Nöronlar ile 1,5 mL 0.1 M Na cacodylate arabellek için 1S fiksasyon sonrası gibi 4 ° C'de % 1 OsO 4 kuluçkaya. Üç kez ile 1,5 mL 0.1 M Na cacodylate arabelleği 7 dakika yıkayın.
Dikkat: toksisite ve reaktivite OsO 4 nedeniyle örnek buz üzerinde kimyasal bir mahallede tutmak için kuluçka buzdolabı kullanılması çoğu durumda tercih. - Hazırlama 0.1 M sodyum asetat arabellek 13.61 g/L sodyum asetat ve 11,43 mL/L buzul Asetik asit pH 5.0 ile. Üç kez 1.5 mL 0.1 M asetat arabelleği pH 7 min için 5.0 ile yıkama ve 0.1 M asetat tampon pH 5,0 4 1 h için 1,5 mL % 1'uranyl asetat ile kuluçkaya ° C. yıkama üç kez ile 1,5 mL 0.1 M asetat arabellek 7 dk için.
- Epoksi gömme
- nöron kültürü tek 1,5 mL yıkar her 7 min için % 50, % 70 ve % 90 etanol ile kurutmak ve 1,5 mL % 100 etanol 7 dk her bir duman başlıklı 3 yıkar.
- Mix 485 mL/L bisphenol-A-(epichlorhydrin) epoksi reçine, 160 mL/L dodecenyl süksinik anhidrit (DDSA), 340 mL/L metil-5-Norbornene-2,3-Dikarboksilik anhidrit (NMA) ve 15 mL/L 2,4,6-tris (dimethylaminomethyl) fenol (DMP-30) epoksi oluşturmak için reçine. Karışımı iyice, sonra saklamak hava kabarcıkları kaldırmak için vakum altında.
Not: onlar kesit sırasında reçine çürükler neden olabilir çünkü bu reçine, özellikle de çıplak gözle, daha küçük hava kabarcıkları kaldırmak için önemlidir. - % 50 epoksi ile etanol değiştirerek örnek reçine etanol üzerinde bir shaker, oda sıcaklığında 30 dakika içinde % 70 epoksi reçine etanol bir shaker üzerinde oda sıcaklığında 30 dakika sonra infiltrat.
- Epoksi çözüm % 100 epoksi reçine ile reçine ve incubations için 1 h 50 ° C. Ekle taze % 100 epoksi ile için taze % 100 epoksi reçine 10 min 50 ° c gerçekleştir iki değişimleri, kuluçkaya anahtarı reçine ve 50 ° C gece ve daha sonra 60 ve #17 sertleşmesine izin 6; C sertleşmesine 36 h üzerinden için.
- Her örnek bir kuyumcu ile muti-şey plaka kaldırmak ' s el testeresi. Faiz, bölgelerinde yoğun bir ters ışık mikroskop kullanarak ve sonra microtome tarafından kesit için 70-80 nm blok kesme hücreleri, konsantrasyonları seçin. Microtome chuck kesme bölgede dağ ve microtome yük. Chuck microtome konumlandırın ve blok yüzeyine paralel kenar ile bir elmas bıçak mount. 70-80 nm kalınlığı doğrudan bireysel Izgaralar üzerine bölümlerini toplamak.
- Ağırlık olarak % 1 çözüm için suya uranyl asetat dağıtılması ve ayrı ayrı kurşun sitrat ağırlık olarak % 3 çözüm için suya geçiyoruz. %1 sulu uranyl asetat 15dk için ve sonra %3 sulu kurşun sitrat örnekleri karşıtlığı artırmak 5 min için batma tarafından bölümleri counterstain.
- EM görüntüleme
- transmisyon elektron mikroskop bölümlerle ve birincil büyütmede 10.000-20, 000 X 3 CCD dijital fotoğraf makinesi ile kayıt görüntüleri inceleyin.
- İstatistik
- gerçekleştirmek bir t-test kontrol ve deneysel örnekleri arasında ortalama ve standart hata ölçü (s.e.m.) karşılaştırarak önemli farkları belirlemek için.
Sonuçlar
Lipid taşıyıcı yöntemi kullanarak, SpH Hipokampal nöronlarda boutons (Şekil 1a) tanımlanması için izin ifade edildi. Hücrelerin elektriksel stimülasyon ekzositozu ve karşılık gelen bir artış Floresans şiddeti indüklenen. Floresan (ΔF) artış uyarıcı (Şekil 1b) bitiş tarafından durduruldu. Artan Floresans endositoz nedeniyle yavaş bir düşüş izledi. VAMP2-pHluorin durumunda VAMP2 uyarıcı
Tartışmalar
Burada biz sinaptik vezikül endositoz izlemek için iki yöntem göstermek. İlk yöntemde, bir sinaptik vezikül protein transfected nöronlar içinde erimiş ve sonradan ortaya çıkan elektriksel olarak uyarılmış pHluorin izlenir. İkinci olarak, biz EM görüntüleme HRP Alım KCl tarafından indüklenen olarak kullanılır. Biz iki nedenden dolayı farklı uyaranlara kullanılır. İlk olarak, yüksek potasyum uygulaması depolarizasyon kültür bütün nöronların neden olmaktadır. EM metodolojimiz sigara uya...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Dr. Yong-Ling Zhu synaptophysin pHluorin2x yapı ve Dr James E. Rothman VAMP2-phluorin sağlamak için verdiğiniz için teşekkür ederiz. Biz Dr Susan Cheng ve Virginia Crocker NINDS elektron mikroskobu tesisin kendi teknik destek ve yardım için teşekkür ederiz. Bu eser sinir hastalıkları Ulusal Enstitüsü ve kontur Intramural araştırma programının ABD ve bir hibe programından KRIBB araştırma girişimi (Korece biyomedikal bilim adamı Fellowship programı) Kore Araştırma Enstitüsü tarafından desteklenen Bioscience ve biyoteknoloji, Kore.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Lipofectamine LTX with Plus | Thermo Fisher | 15338-100 | Transfection of plasmid DNA including synaptophysin or VAMP2-pHluorin |
| neurobasal medium | Thermo Fisher | 21103-049 | Growth medium for neuron, Warm up to 37°C before use |
| B27 | Thermo Fisher | 17504-044 | Gradient for neuronal differentiation |
| Glutamax | Thermo Fisher | 35050-061 | Gradient for neuronal culture |
| Poly-D-Lysine coated coverslip | Neuvitro | GG-25-pdl | Substrate for neuronal growth and imaging of pHluorin |
| Trypsin XI from bovine pancrease | Sigma | T1005 | Neuronal culture-digest hippocampal tissues |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025 | Neuronal culture-inhibits viscous cell suspension |
| pulse stimulator | A-M systems | model 2100 | Apply electrical stimulation |
| Slotted bath with field stimulation | Warner Instruments | RC-21BRFS | Apply electrical stimulation |
| stimulus isolation unit | Warner Instruments | SIU102 | Apply electrical stimulation |
| lubricant | Dow corning | 111 | pHluorin imaging-seal with coverslip and imaging chamber, avoid leak from chamber |
| AP5 | Tocris | 3693 | Gradient for normal saline, selective NMDA receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| CNQX | Tocris | 190 | Gradient for normal saline, competitive AMPA/kainate receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| Illuminator | Nikon | C-HGFI | Metal halide light source for pHluorin |
| EMCCD camera | Andor | iXon3 | pHluorin imaging, detect pHluorin fluorescence intensity |
| Inverted microscopy | Nikon | Ti-E | Imaging for synaptophysin or VAMP2 pHluorin transfected cells |
| NIS-Elements AR | Nikon | NIS-Elements Advanced Research | Software for imaging acquisition and analysis |
| Igor Pro | WaveMetrics | Igor pro | Software for imaging analysis and data presentation |
| imaging chamber | Warner Instruments | RC21B | pHluorin imaging, apply field stimulation on living cells |
| poly-l-lysine | Sigma | P4832 | Electron microscopy, substrate for neuronal growth, apply on multiwell plate for 1 h at room temperature then wash with sterilized water 3 times |
| Horseradish peroxidase(HRP) | Sigma | P6782 | Electron microscopy, labeling of endocytosed synaptic vesicles by catalyzing DAB in presence hydrogen peroxide, final concentration is 5 mg/mL in normal saline, make fresh before use |
| Na cacodylate | Electron Microscopy Sciences | 12300 | Electron microscopy, buffer for fixatives and washing, final concentration is 0.1 N |
| 3,3′-Diaminobenzidine(DAB) | Sigma | D8001 | Electron microscopy, labeling of endocytosed synaptic vesicles, substrate for HRP, final concentration is 0.5 mg/mL in DDW and filtered, make fresh before use |
| Hydrogen peroxide solution | Sigma | H1009 | Electron microscopy, labeling of endocytosed synaptic vesicles by inducing HRP-DAB reaction, final concentration is 0.3% in DDW, make fresh before use |
| glutaraldehyde | Electron Microscopy Sciences | 16365 | Electron microscopy, fixatives, final concentration is 4% in Na-cacodylate buffer, make fresh before use, shake well before to use |
| TEM | JEOL | 200CX | Electron microscopy, imaging of endocytosed vesicles and ultrastructural changes |
| CCD digital camera | AMT | XR-100 | Electron microscopy, capturing images |
| Lead citrate | Leica microsystems | 16707235 | Electron microscopy, grid staining |
Referanslar
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nature cell biol. 2 (4), 197-204 (2000).
- Sun, T., Wu, X. S., et al. The role of calcium/calmodulin-activated calcineurin in rapid and slow endocytosis at central synapses. J Neurosci. 30 (35), 11838-11847 (2010).
- Wu, X. -. S. S., Lee, S. H., et al. Actin Is Crucial for All Kinetically Distinguishable Forms of Endocytosis at Synapses. Neuron. 92 (5), 1020-1035 (2016).
- Granseth, B., Odermatt, B., Royle, S. J., Lagnado, L. Clathrin-mediated endocytosis is the dominant mechanism of vesicle retrieval at hippocampal synapses. Neuron. 51 (6), 773-786 (2006).
- Atluri, P. P., Ryan, T. A. The kinetics of synaptic vesicle reacidification at hippocampal nerve terminals. J Neurosci. 26 (8), 2313-2320 (2006).
- Royle, S. J., Granseth, B., Odermatt, B., Derevier, A., Lagnado, L. Imaging phluorin-based probes at hippocampal synapses. Methods Mol Biol. 457, 293-303 (2008).
- Moulder, K. L., Mennerick, S. Reluctant vesicles contribute to the total readily releasable pool in glutamatergic hippocampal neurons. J Neurosci. 25 (15), 3842-3850 (2005).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptopHluorin. Proc Natl Acad Sci U S A. 102 (17), 6131-6136 (2005).
- Morris, R. G. Elements of a neurobiological theory of hippocampal function: the role of synaptic plasticity, synaptic tagging and schemas. Eur J Neurosci. 23 (11), 2829-2846 (2006).
- Sankaranarayanan, S., Ryan, T. A. Calcium accelerates endocytosis of vSNAREs at hippocampal synapses. Nat Neurosci. 4 (2), 129-136 (2001).
- Balaji, J., Armbruster, M., Ryan, T. A. Calcium control of endocytic capacity at a CNS synapse. J Neurosci. 28 (26), 6742-6749 (2008).
- Ferguson, S. M., Brasnjo, G., et al. A selective activity-dependent requirement for dynamin 1 in synaptic vesicle endocytosis. Science. 316 (5824), 570-574 (2007).
- Baydyuk, M., Wu, X. S., He, L., Wu, L. G. Brain-derived neurotrophic factor inhibits calcium channel activation, exocytosis, and endocytosis at a central nerve terminal. J Neurosci. 35 (11), 4676-4682 (2015).
- Wu, X. S., Zhang, Z., Zhao, W. D., Wang, D., Luo, F., Wu, L. G. Calcineurin is universally involved in vesicle endocytosis at neuronal and nonneuronal secretory cells. Cell Rep. 7 (4), 982-988 (2014).
- Zhang, Z., Wang, D., et al. The SNARE proteins SNAP25 and synaptobrevin are involved in endocytosis at hippocampal synapses. J Neurosci. 33 (21), 9169-9175 (2013).
- Wu, L. -. G. G., Hamid, E., Shin, W., Chiang, H. -. C. C. Exocytosis and endocytosis: modes, functions, and coupling mechanisms. Annu Rev Physiol. 76 (1), 301-331 (2014).
- Daniele, F., Di Cairano, E. S., Moretti, S., Piccoli, G., Perego, C. TIRFM and pH-sensitive GFP-probes to evaluate neurotransmitter vesicle dynamics in SH-SY5Y neuroblastoma cells: cell imaging and data analysis. J Vis Exp. (95), e52267 (2015).
- Shaner, N. C., Lin, M. Z., et al. Improving the photostability of bright monomeric orange and red fluorescent proteins. Nat Methods. 5 (6), 545-551 (2008).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Leitz, J., Kavalali, E. T. Fast retrieval and autonomous regulation of single spontaneously recycling synaptic vesicles. Elife. 3, e03658 (2014).
- Bisht, K., El Hajj, H., Savage, J. C., Sánchez, M. G., Tremblay, M. -. &. #. 2. 0. 0. ;. Correlative Light and Electron Microscopy to Study Microglial Interactions with β-Amyloid Plaques. J Vis Exp. (112), e54060 (2016).
- Schikorski, T. Monitoring Synaptic Vesicle Protein Sorting with Enhanced Horseradish Peroxidase in the Electron Microscope. High-Resolution Imaging of Cellular Proteins: Methods and Protocols. , 327-341 (2016).
- Kononenko, N. L., Puchkov, D., et al. Clathrin/AP-2 mediate synaptic vesicle reformation from endosome-like vacuoles but are not essential for membrane retrieval at central synapses. Neuron. 82 (5), 981-988 (2014).
- Wu, Y., O'Toole, E. T., et al. A dynamin 1-, dynamin 3- and clathrin-independent pathway of synaptic vesicle recycling mediated by bulk endocytosis. eLife. 2014 (3), e01621 (2014).
- Heuser, J. E., Reese, T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J Cell Biol. 57 (2), 315-344 (1973).
- Ceccarelli, B., Hurlbut, W. P., Mauro, A. Turnover of transmitter and synaptic vesicles at the frog neuromuscular junction. J Cell Biol. 57 (2), 499-524 (1973).
- Watanabe, S., Rost, B. R., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S., Trimbuch, T., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
- Sankaranarayanan, S., Atluri, P. P., Ryan, T. A. Actin has a molecular scaffolding, not propulsive, role in presynaptic function. Nat Neurosci. 6 (2), 127-135 (2003).
- Zhu, Y., Xu, J., Heinemann, S. F. Two pathways of synaptic vesicle retrieval revealed by single-vesicle imaging. Neuron. 61 (3), 397-411 (2009).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Arnao, M. B. B., Acosta, M., del Rio, J. A. A., García-Cánovas, F. Inactivation of peroxidase by hydrogen peroxide and its protection by a reductant agent. Biochim Biophys Acta. 1038 (1), 85-89 (1990).
- Deák, F., Schoch, S., et al. Synaptobrevin is essential for fast synaptic-vesicle endocytosis. Nat Cell Biol. 6 (11), 1102-1108 (2004).
- Clayton, E. L., Evans, G. J. O., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J Neurosci. 28 (26), 6627-6632 (2008).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nat Neurosci. 17 (1), 10-16 (2014).
- Wienisch, M., Klingauf, J. Vesicular proteins exocytosed and subsequently retrieved by compensatory endocytosis are nonidentical. Nat Neurosci. 9 (8), 1019-1027 (2006).
- Fernández-Alfonso, T., Kwan, R., Ryan, T. A. Synaptic vesicles interchange their membrane proteins with a large surface reservoir during recycling. Neuron. 51 (2), 179-186 (2006).
- Gimber, N., Tadeus, G., Maritzen, T., Schmoranzer, J., Haucke, V. Diffusional spread and confinement of newly exocytosed synaptic vesicle proteins. Nat Commun. 6, 8392 (2015).
- Nicholson-Fish, J. C., Smillie, K. J., Cousin, M. A. Monitoring activity-dependent bulk endocytosis with the genetically-encoded reporter VAMP4-pHluorin. J Neurosci Methods. 266, 1-10 (2016).
- Burrone, J., Li, Z., Murthy, V. N. Studying vesicle cycling in presynaptic terminals using the genetically encoded probe synaptopHluorin. Nat Protoc. 1 (6), 2970-2978 (2006).
- Wisse, E., Braet, F., et al. Fixation methods for electron microscopy of human and other liver. World journal of gastroenterology. 16 (23), 2851-2866 (2010).
- Magidson, V., Khodjakov, A. Circumventing Photodamage in Live-Cell Microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Søndergaard, C. R., Garrett, A. E., et al. Structural artifacts in protein-ligand X-ray structures: implications for the development of docking scoring functions. J Med Chem. 52 (18), 5673-5684 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır