Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesurer l’endocytose de la vésicule synaptique dans des neurones Hippocampal cultivés
Dans cet article
Résumé
Endocytose Vésicule synaptique est détectée par microscopie de pHluorin fusionnée avec des protéines de la vésicule synaptique et par microscopie électronique de l’absorption de la vésicule.
Résumé
Au cours de l’endocytose, fusion des vésicules synaptiques sont récupérées dans les terminaisons nerveuses, permettant de recyclage de la vésicule et donc l’entretien de la transmission synaptique au moment du tir nerf répétitives. Avec facultés affaiblies endocytose dans certaines pathologies conduit à une diminution des fonctions synaptiques de force et le cerveau. Nous décrivons ici les méthodes utilisées pour mesurer l’endocytose de la vésicule synaptique synaptique hippocampal mammifères en culture neuronale. Nous avons suivi l’endocytose de protéine Vésicule synaptique en fusionnant une protéine de la membrane de vésicules synaptiques, y compris synaptophysine et VAMP2/synaptobrévine, sur le côté lumière vésiculaire, avec pHluorin, une protéine fluorescente verte sensibles au pH qui augmente sa intensité de la fluorescence lorsque le pH augmente. Au cours de l’exocytose, pH lumen vésiculaire augmente, alors qu’au cours de la lumière vésiculaire endocytose pH est re-acidifié. Ainsi, une augmentation de l’intensité de fluorescence pHluorin indique fusion, alors qu’une diminution indique l’endocytose de la protéine marquée des vésicules synaptiques. Outre l’utilisation de la méthode d’imagerie pHluorin pour enregistrer l’endocytose, nous avons suivi endocytose de la membrane vésiculaire par microscopie électronique (me) mesures d’absorption de raifort peroxydase de raifort (HRP) par des vésicules. Enfin, nous avons suivi la formation de fosses terminal membrane nerveuse à des moments différents après forte dépolarisation induite par le potassium. L’évolution temporelle de la HRP absorption et membrane fosse formation indique l’évolution temporelle de l’endocytose.
Introduction
Neurotransmetteurs sont stockées dans des vésicules synaptiques et libérées par exocytose. La membrane des vésicules synaptiques et la protéine sont internalisés par endocytose, puis réutilisés dans la prochaine série d’exocytose. L’endocytose des vésicules synaptiques est important pour le maintien des piscines de la vésicule synaptique et supprime la saillie vésicules de la membrane plasmique. La protéine fluorescente verte sensibles au pH pHluorin, qui est trempé dans des conditions acides et dequenched à pH neutre, a été utilisé pour mesurer le temps d’endocytose cours à vivent les cellules1,2,3. La protéine pHluorin est généralement attachée au côté lumière des protéines des vésicules synaptiques, comme synaptophysine ou VAMP2/synaptobrévine. Au repos, pHluorin est trempé dans le lumen de pH 5,5 des vésicules synaptiques. La fusion des vésicules de la membrane plasmique expose la lumière vésiculaire à la solution extracellulaire où le pH est ~ 7,3, résultant en une augmentation pHluorin de fluorescence. Après exocytose, l’augmentation de la fluorescence décroît, en raison de l’endocytose des protéines Vésicule synaptique, suivie par une vésicule ré-acidification dans ces vésicules récupérés. Bien que la désintégration reflète l’endocytose et vésiculaire ré-acidification, il reflète surtout endocytose, parce que la réacidification est plus rapide que l’endocytose dans la plupart des conditions1,4. La constante de temps de ré-acidification est 3-4 s ou moins5,6, qui est généralement plus rapide que les 10 s ou plus requis pour la vésicule endocytose4,5. Si les expériences sont nécessaires pour distinguer l’endocytose de ré-acidification, les expériences trempe acides avec un pH de 5.5 à l’aide de la solution de (MES) acide 4-Morpholineethanesulfonic (25 mM) peuvent être utilisés pour déterminer si les protéines des vésicules synaptiques sont récupérés de la membrane plasmique par endocytose1,3,4. Ainsi, l’augmentation d’intensité de fluorescence pHluorin fait apparaître un solde d’exo - et l’endocytose et la diminution après une stimulation nerveuse reflète précisément l’endocytose.
pHluorin imagerie peut être utilisé non seulement pour mesurer l’évolution temporelle de l’endocytose, mais aussi la taille des vésicules synaptiques piscines7,8, et la probabilité de libération évoquée et spontanée de sortie9. Plusieurs facteurs et les protéines impliquées dans la régulation de l’endocytose, tels que le calcium, les protéines solubles NSF-attachment protein receptor (SNARE), factor(BDNF) neurotrophique dérivé du cerveau et de la calcineurine sont identifiés au moyen d’imagerie pHluorin1 , 2 , 10 , 11 , 12 , 13 , 14 , 15 , 16. en outre, la libération du neurotransmetteur pouvait être détectée dans les neurones pas primaires mais dans les cellules de neuroblastome avec TIRFM17. Récemment, pHTomato, dsRed, mOrange et variantes de pHluorin ont été développés pour le suivi des enregistrements simultanés de facteurs multiples dans une seule synapse18,19. Par exemple, pHTomato a été fusionné avec synaptophysine et utilisé avec un indicateur de calcium génétiquement encodé (GCaMP5K) pour surveiller la fusion des vésicules présynaptiques et l’influx de Ca2 + dans le compartiment post-synaptique20. Par conséquent, pHluorin attaché aux protéines synaptiques fournit une méthode utile pour analyser la relation entre l’endocytose et l’exocytose.
EM est une autre méthode couramment utilisée pour étudier l’endocytose, en raison de la haute résolution spatiale qui montre les changements ultrastructuraux au cours de l’endocytose. Deux domaines généraux sont la possibilité de visualiser des changements pathologiques dans les cellules neuronales21 et de suivre les vésicules protéines22. En particulier, l’observation d’absorption de la vésicule synaptique, courbure de membrane enduite de clathrine dans la zone de periactive, et les structures endosomale sont possibles avec EM3,23,24,25 ,26,27,28. Tandis qu’EM implique des artefacts potentiels, tels que des malformations induites par le fixateur, qui peuvent affecter l’endocytose, et analyse des données est de main-d'oeuvre, que la résolution offre la possibilité de visualiser la structure cellulaire attrayante. Les problèmes potentiels de fixateur et la limitation en résolution temporelle EM peuvent être surmontés en haute pression, congélation, fournissant une méthode rapide et non chimiques de stabiliser les structures délicates présents au cours de l’endocytose27.
Protocole
Remarque : le protocole suivant décrit les méthodes d’imagerie pHluorin et les méthodes de EM utilisés dans des neurones hippocampal cultivés. pHluorin moniteurs Vésicule synaptique protéine absorption dans les cellules vivantes et EM détecte l’absorption des vésicules synaptiques et modifications ultrastructurales.
soins aux animaux et la procédure suivie NIH guidelines et ont été approuvés par le Comité de l’utilisation et le NIH animalerie.
1. pHluorin Imaging
- Prepare hippocampe tampon (HB) en combinant 4 NaHCO 3 et 5 mM HEPES de la culture de neurones hippocampiques et ajuster le pH 7,3 avec 5 M de NaOH. Rendre le milieu de culture en mélangeant neurobasal moyenne, 2 % B27, 0,5 mM de L-glutamine et 1 % de pénicilline-streptomycine. En outre, préparer un mélange de tampon HB avec 20 % de sérum de foetus (HB/20% SVF).
Remarque : Ce protocole culture repose sur Sankaranarayanan, et al. 29 et Wu et al. 24 - décapiter les souriceaux entre postnatal jour 0 au jour 2 dans le milieu de culture et extraire le cerveau en 4 ° C HB/20% FBS. Enlevez le tronc cérébral et le thalamus pour exposer l’hippocampe. Disséquer à l’hippocampe, après avoir exposé il par le retrait du tronc cérébral et le thalamus et transfert à frais 4 ° C HB/20% BF.
Remarque : En général, le rendement est environ 4 x 10 5 cellules/mL pour un chiot (deux hippocampe). Enlever les membranes adhérentes à l’aide de la pince à épiler ou des ciseaux, puis transférez-les vers frais 4 ° C HB/20% FBS. Déroulez le gyrus denté et isoler le subiculum en coupant avec des ciseaux, puis transférez-les vers frais 4 ° C HB/20% BF. - Diviser chaque hippocampe, en coupant d’un bout à l’autre, en environ 10 tranches et de les transférer dans un tube conique polypropylène de 15 mL.
- Après avoir laissé le tissu de s’installer, laver avec 10 mL de HB/20% FBS et puis laver trois fois avec 10 mL de HB.
- Préparer la solution de digestion de 137 mM NaCl, KCl 5 mM, 7 mM Na2HPO 4 et 25 mM HEPES et ajuster le pH 7.2 avec 5 M de NaOH. Retirez le surnageant de l’hippocampe. Ajouter 10 mg de trypsine et 1 mg de DNase à 2 mL de solution de digestion et filtrer à travers une membrane stérile 0,22 µm directement sur la pastille échantillon.
- Incuber l’hippocampe pendant 5 min à 37 ° C, puis laver deux fois avec 10 mL de HB/20% FBS et puis laver une fois 10 ml d’HB.
- Se dissocient les cellules avec 6 mg de MgSO 4 ∙ 7 H 2 O et 1 mg de DNase à 2 mL HB et filtre stérile sur l’hippocampe-pellet à travers un filtre de 0,22 µm stérile. Doucement se dissocient les cellules par trituration prudent, tout en prenant soin d’éviter l’introduction de bulles d’air. Permettre aux particules de tissus se contenter de 2 min et transférer ensuite lentement le liquide surnageant dans un autre tube.
- Ajouter 3 mL HB/20% FBS à la suspension de cellules et centrifugeuse ou à 10 min à 4 ° C et 1 000 tr/min. Jeter le surnageant et remettre en suspension dans un milieu de culture.
- Plaque 60 000 cellules suspendues dans 150 µL de milieu de culture sur une lamelle de 25 mm de diamètre de Poly-D-Lysine enduite, sans déversement au large de la lamelle. Ajouter 2 mL de milieu de culture pré chauffé 2 h après l’ensemencement. Lamelles sont maintenues dans 6 puits culture assiettes ou plats de Pétri stérile.
- Cellules de maintenir à 37 ° C dans un 5 % CO 2 humidifié incubateur dans un milieu de culture pendant 14 à 21 jours avant l’enregistrement. Au cours de la croissance des cultures, changer la moitié supérieure du milieu deux fois par semaine.
- Prepare hippocampe tampon (HB) en combinant 4 NaHCO 3 et 5 mM HEPES de la culture de neurones hippocampiques et ajuster le pH 7,3 avec 5 M de NaOH. Rendre le milieu de culture en mélangeant neurobasal moyenne, 2 % B27, 0,5 mM de L-glutamine et 1 % de pénicilline-streptomycine. En outre, préparer un mélange de tampon HB avec 20 % de sérum de foetus (HB/20% SVF).
- Transfection
- 6-7 jours après l’ensemencement, transfecter synaptophysine-pHluorin 2 X (SpH) ou VAMP2-pHluorin dans les neurones de l’hippocampe. Pour SpH, utilisez un promoteur du cytomégalovirus (CMV), inséré dans un vecteur de pcDNA3 30. Pour VAMP2-pHluorin, utilisez un promoteur de CMV inséré dans un pCI vecteur 31.
- Transfecter soit vecteur de transporteur de lipides dans les cellules cibles, à l’aide de 1 µg de plasmide. Utiliser un milieu de culture de l’étape de protocole 1.1.1, qui n’a pas de sérum, pour la transfection. Changer le milieu 2 h après la transfection pour réduire la toxicité.
Remarque : En cas de faible expression de SpH dans les boutons, augmenter la concentration d’ADN à 2 µg ou le temps d’incubation avec le transporteur de lipides, à moins que les cellules sont en mauvaise santés. En général, 4-10 cellules (0,006-0,008 %) des neurones ont été transfectés.
- Microscopie
- Prepare une solution saline normale composée de 119 mM NaCl, 2 mM CaCl 2, 2,5 mM KCl, 25 mM HEPES (pH 7,4), glucose de 30 mM, 2 mM MgCl 2, (6-cyano-7-nitroquinoxaline-2,3-dione) 0,01 mM CNQX) et 0,05 mM acide DL-2-amino-5-phosphonovalérique (AP5). Prendre un lamelle couvre-objet de la plaque de milieu de culture et de la placer sur une chambre d’imagerie qui permet une stimulation de champ, à l’aide de lubrifiant et étanchéité pour éviter les fuites. Ne pas laisser le verre sécher durant le transfert d’un lamelle couvre-objet de la plaque à la chambre en ajoutant immédiatement 750 µL de solution saline normale.
NOTE : CNQX et AP5 ont été utilisés pour bloquer les activités postsynaptique, qui a le potentiel pour activité récurrente. Avant de placer une chambre sur un microscope à fluorescence inversé, utilisez nettoyage tissus pour confirmer que la chambre ne fuit pas. Une fuite lente provoque des modifications de la mise au point lors de l’enregistrement par le mélange d’huile normale de solution saline et d’immersion, qui se traduit par des variations de l’indice de réfraction. - Stimulation et enregistrement d’immersion dans l’huile (ouverture numérique 1,4)
- Image sur un microscope widefield inversé avec un 60 X lentille avec une lampe aux halogénures métalliques. Visualiser les pHluorin avec un filtre défini un pic d’excitation de 480 nm, un miroir de longue passe 490 nm, un filtre d’émission de 500 à 550 nm et une vitesse d’obturation manuelle flip. Capturer des images toutes les 100 ms, avec binning de 2 x 2, à l’aide d’une caméra électronique multipliant Charge couplé dispositif (EMCCD).
Remarque : Plusieurs fonctionnalités devraient envisager d’atteindre les conditions appropriées pour éviter le photoblanchiment, y compris l’intervalle de capture d’image et de filtrer et binning, qui sont tributaires de l’équipement. Dans le cas de l’imagerie confocale, laser de puissance et l’exposition de temps devrait considérer afin d’éviter le photoblanchiment. La configuration a été déterminée après l’enregistrement d’au moins 3 min sans stimulation et l’enregistrement a été effectué pendant au moins 10 s sans stimulation pour vérifier le photoblanchiment. - Choisir une zone à forte densité de boutons pour faciliter l’analyse à chaque expérience. Identifier les cellules transfectées par leur signal de fluorescence verte, en mettant l’accent sur les profils d’expression rond ou ovale dans le bouton et l’expression continue entre boutons.
- Induce endocytose par stimulation de champ en utilisant un 1 ms impulsion, 20 mA potentiel d’action (PA) alimentés par un stimulateur de l’impulsion et livré par une électrode de platine dans l’unité d’isolement de stimulus. Activité de fluorescence au cours de la stimulation et lors de la récupération de la cellule d’image.
Remarque : Dans le cas des cellules mortes, expression était plus forte que les boutons de la vie et a montré de façon inégale entre les boutons.
- Image sur un microscope widefield inversé avec un 60 X lentille avec une lampe aux halogénures métalliques. Visualiser les pHluorin avec un filtre défini un pic d’excitation de 480 nm, un miroir de longue passe 490 nm, un filtre d’émission de 500 à 550 nm et une vitesse d’obturation manuelle flip. Capturer des images toutes les 100 ms, avec binning de 2 x 2, à l’aide d’une caméra électronique multipliant Charge couplé dispositif (EMCCD).
- Prepare une solution saline normale composée de 119 mM NaCl, 2 mM CaCl 2, 2,5 mM KCl, 25 mM HEPES (pH 7,4), glucose de 30 mM, 2 mM MgCl 2, (6-cyano-7-nitroquinoxaline-2,3-dione) 0,01 mM CNQX) et 0,05 mM acide DL-2-amino-5-phosphonovalérique (AP5). Prendre un lamelle couvre-objet de la plaque de milieu de culture et de la placer sur une chambre d’imagerie qui permet une stimulation de champ, à l’aide de lubrifiant et étanchéité pour éviter les fuites. Ne pas laisser le verre sécher durant le transfert d’un lamelle couvre-objet de la plaque à la chambre en ajoutant immédiatement 750 µL de solution saline normale.
- Analyse d’images
- Pour analyser l’intensité de fluorescence en un seul bouton, définissez jusqu'à une région d’intérêt (ROI) comme un 1,5 x 1,5 µm carrés ; la taille d’un bouton se trouve environ 1,5 µm. utilisation des traces avant stimulation pour vérifier le photoblanchiment et soustraire comme arrière-plan.
- Normalize fluorescence change (ΔF) avec l’équation :
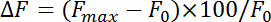
lorsque F max et F 0 font état d’une augmentation maximale après stimulation et la fluorescence de la ligne de base, respectivement. Mesurer les endocytose taux comme le taux de désintégration au cours du premier 4-10 s après le point maximum de la fluorescence de la pHluorin. Obtenir la constante de temps (τ) d’endocytose en ajustant la décroissance de la fluorescence pHluorin de l’augmentation maximale au niveau de référence avec une fonction exponentielle mono.
2. Microscopie électronique
- Prepare un Poly-D-Lysine enduit plaque 6 puits en appliquant 1,5 mL de solution de Poly-D-Lysine stérile filtré 0,01 % dans chaque puits pendant 1 h à température ambiante, puis laver trois fois avec de l’eau stérilisée. Disséquer, culture et préserver les neurones de l’hippocampe tout comme aux étapes 1.1.1 et 1.1.2 1.1.3, respectivement.
- Préparer une solution de stimulation élevée K + avec HRP que 31,5 mM NaCl, 2 mM CaCl 2, 90 mM de KCl, 25 mM HEPES (pH 7,4), glucose de 30 mM, 2 mM MgCl 2, 0,01 mM CNQX, 0,05 mM AP5 et 5 mg/mL HRP, puis ajuster le pH 7.4 avec 5 M NaOH.
- Stimuler la culture de neurones hippocampal avec 1,5 mL haute K + stimulation solution à température ambiante (dénommée K +) par addition de 1,5 mL dans chaque puits pour 90 s. Dans l’état de repos (dénommé R), appliquer la même concentration de 5 mg/mL HRP pour 90 s, mais avec une solution saline normale. Pour l’exemple de récupération, appliquer la solution de stimulation élevée K + comme dans l’exemple de K +, puis rapidement laver et remplacer avec un soluté physiologique et incuber pendant 10 min.
- Fixation et coloration
- préparer un tampon cacodylate Na 0,1 M à l’aide de Na cacodylate de 21,4 g/L à un pH de 7,4. Fixer les cellules avec le glutaraldéhyde à 4 % dans un tampon de cacodylate de 0,1 M Na pendant au moins 1 h à température ambiante. Laver trois fois avec un tampon de cacodylate de 0,1 M Na pendant 7 min chaque.
- Solution de préparer Diaminobenzidine (DAB), composé de 0,5 mg/mL de DAB avec 0,3 % H 2 O 2 ddH 2 O, et filtre avec filtre 0,22 µm. Appliquer la solution DAB 1,5 mL pendant 30 min à 37 ° C. laver trois fois avec un tampon de cacodylate de 0,1 M Na pendant 7 min de chaque.
ATTENTION : DAB est un cancérogène toxique et suspects. S’il vous plaît utiliser des gants et blouses.
NOTE : Marquage avec le DAB se produit en raison de son oxydation par H 2 O 2, comme catalysée par la HRP. Petites augmentations dans les composants se traduisent en un signal accru dans l’échantillon. Augmentation de la concentration de HRP accélère l’effet du catalyseur. Suffisamment de grandes concentrations de H 2 O 2 permettant débilitante de réactions secondaires avec HRP, inhibant l’effet de l’étiquetage 32. Dans cet ouvrage, les concentrations de ce système d’étiquetage ont été choisies en fonction recherche actuellement disponibles 33 , 34. - Incuber les neurones avec 1,5 mL de 1 % OsO 4 dans un tampon de cacodylate de 0,1 M Na pendant 1 h à 4 ° C après fixation. Laver trois fois avec 1,5 mL de tampon de cacodylate de Na de 0,1 M pendant 7 min chaque.
ATTENTION : En raison de la toxicité et la réactivité de l’OsO 4, garder l’échantillon sur la glace dans une hotte chimique est préférable, dans bien des cas, à un réfrigérateur pour l’incubation. - Prepare 0,1 M tampon d’acétate de sodium avec 13,61 g/L sodium acétate et 11,43 mL/L acide acétique glacial à pH 5,0. Laver trois fois avec le tampon d’acétate 1,5 mL 0,1 M à pH 5.0 pour 7 minutes chacun et incuber avec 1,5 mL d’acétate d’uranyle 1 % dans un tampon acétate 0,1 M à pH 5,0 pour 1 h à 4 ° C. Wash trois fois avec le tampon d’acétate 0,1 M 1,5 mL de 7 min chacun.
- Enrobage époxy
- déshydrater la culture de neurones avec lavages unique 1,5 mL d’éthanol à 50 %, 70 % et 90 %, 7 mn chacune et puis 3 lavages de 1,5 mL d’éthanol à 100 % de 7 min chacun, sous une hotte.
- Mix 485 mL/L bisphenol-A-(epichlorhydrin) époxy résine, l’anhydride succinique de 160 mL/L dodécényle (DDSA), 340 mL/L méthyl-5-norbornène-2, 3-dicarboxylique Anhydride (NMA) et 15 mL/L 2,4,6-tris (diméthylamino) phénol (DMP-30) pour créer l’époxy résine. Mélanger soigneusement, puis stocker sous vide pour éliminer les bulles d’air.
Remarque : Il est essentiel pour éliminer les bulles d’air dans la résine, en particulier ceux moins visible à le œil nu, parce qu’ils peuvent causer des caries dans la résine au cours de la section. - Infiltrez l’échantillon en remplaçant l’éthanol 50 % époxy résine-éthanol pendant 30 min à température ambiante sur un agitateur, puis 70 % époxy résine dans l’éthanol pendant 30 min à température ambiante sur un agitateur.
- Commutateur l’époxy résine solution résine époxy 100 % et incuber pendant 10 min à des échanges d’effectuer deux 50 ° C. de frais 100 % époxy avec incubation pendant 1 h à 50 ° C. Ajouter frais 100 % revêtement époxy résine et laissez pour durcir à 50 ° C durant la nuit, puis à 60 & #17 6 ; C pendant plus de 36 h à durcir.
- Retirez la plaque muti-puits chaque échantillon avec un bijoutier ' scie à main s. Sélectionnez les régions d’intérêt, des concentrations denses de cellules, à l’aide d’un microscope inversé de lumière et puis couper les blocs de 70 à 80 nm pour le sectionnement par microtome. Monter la région coupée dans le mandrin du microtome et charger le microtome. Positionner le mandrin dans le microtome et monter un couteau diamant avec le bord parallèle à la surface du bloc. Recueillir les sections d’épaisseur de 70 à 80 nm directement sur les grilles individuelles.
- Dissoudre l’acétate d’uranyle dans l’eau pour une solution à 1 % en poids et dissoudre séparément citrate de plomb dans l’eau pour une solution à 3 % en poids. Contre-coloration les sections par immersion avec l’acétate d’uranyle aqueuse 1 % pendant 15 min, puis citrate de plomb aqueux de 3 % pendant 5 min améliorer le contraste des échantillons.
- Imagerie EM
- examiner les sections avec un microscope électronique à transmission et enregistrer des images avec un appareil photo numérique avec un grossissement primaire 10 000-20, 000 X 3.
- Statistiques
- effectuer un t-test afin d’identifier des différences significatives en comparant la moyenne et l’écart-type de mesure (s.e.m.) entre les témoins et les échantillons expérimentaux.
Résultats
En utilisant la méthode de transporteur de lipides, SpH a été exprimé dans les neurones de l’hippocampe, permettant l’identification des boutons (Figure 1 a). La stimulation électrique des cellules induites par exocytose et une augmentation correspondante dans l’intensité de la fluorescence. L’augmentation de fluorescence (ΔF) a été arrêtée en mettant fin à la stimulation (Figure 1 b). L’augmentation de la f...
Discussion
Nous démontrons ici deux méthodes pour surveiller l’endocytose de la vésicule synaptique. Dans la première méthode, nous avons suivi pHluorin fondu avec une protéine de la vésicule synaptique dans les neurones transfectées et stimulé par la suite électriquement. Deuxièmement, nous avons utilisé l’imagerie EM d’absorption HRP car induite par le KCl. Nous avons utilisé différents stimuli pour deux raisons. Tout d’abord, application de potassium élevé induit une dépolarisation de tous les neurones d...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions m. Zhu Yong-Ling prévoyant la fourniture VAMP2-phluorin de construction synaptophysine-pHluorin2x et Dr. James E. Rothman. Nous remercions le Dr Susan Cheng et Virginia Crocker de NINDS Electron Microscopy Facility pour leur soutien technique et aide. Ce travail a été soutenu par le National Institute of Neurological Disorders et programme de recherche intra-muros accident vasculaire cérébral aux États-Unis et une subvention de la KRIBB Research Initiative (programme coréen biomédicale scientifique Fellowship), Korea Research Institute of Bioscience et biotechnologie, République de Corée.
matériels
| Name | Company | Catalog Number | Comments |
| Lipofectamine LTX with Plus | Thermo Fisher | 15338-100 | Transfection of plasmid DNA including synaptophysin or VAMP2-pHluorin |
| neurobasal medium | Thermo Fisher | 21103-049 | Growth medium for neuron, Warm up to 37°C before use |
| B27 | Thermo Fisher | 17504-044 | Gradient for neuronal differentiation |
| Glutamax | Thermo Fisher | 35050-061 | Gradient for neuronal culture |
| Poly-D-Lysine coated coverslip | Neuvitro | GG-25-pdl | Substrate for neuronal growth and imaging of pHluorin |
| Trypsin XI from bovine pancrease | Sigma | T1005 | Neuronal culture-digest hippocampal tissues |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025 | Neuronal culture-inhibits viscous cell suspension |
| pulse stimulator | A-M systems | model 2100 | Apply electrical stimulation |
| Slotted bath with field stimulation | Warner Instruments | RC-21BRFS | Apply electrical stimulation |
| stimulus isolation unit | Warner Instruments | SIU102 | Apply electrical stimulation |
| lubricant | Dow corning | 111 | pHluorin imaging-seal with coverslip and imaging chamber, avoid leak from chamber |
| AP5 | Tocris | 3693 | Gradient for normal saline, selective NMDA receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| CNQX | Tocris | 190 | Gradient for normal saline, competitive AMPA/kainate receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| Illuminator | Nikon | C-HGFI | Metal halide light source for pHluorin |
| EMCCD camera | Andor | iXon3 | pHluorin imaging, detect pHluorin fluorescence intensity |
| Inverted microscopy | Nikon | Ti-E | Imaging for synaptophysin or VAMP2 pHluorin transfected cells |
| NIS-Elements AR | Nikon | NIS-Elements Advanced Research | Software for imaging acquisition and analysis |
| Igor Pro | WaveMetrics | Igor pro | Software for imaging analysis and data presentation |
| imaging chamber | Warner Instruments | RC21B | pHluorin imaging, apply field stimulation on living cells |
| poly-l-lysine | Sigma | P4832 | Electron microscopy, substrate for neuronal growth, apply on multiwell plate for 1 h at room temperature then wash with sterilized water 3 times |
| Horseradish peroxidase(HRP) | Sigma | P6782 | Electron microscopy, labeling of endocytosed synaptic vesicles by catalyzing DAB in presence hydrogen peroxide, final concentration is 5 mg/mL in normal saline, make fresh before use |
| Na cacodylate | Electron Microscopy Sciences | 12300 | Electron microscopy, buffer for fixatives and washing, final concentration is 0.1 N |
| 3,3′-Diaminobenzidine(DAB) | Sigma | D8001 | Electron microscopy, labeling of endocytosed synaptic vesicles, substrate for HRP, final concentration is 0.5 mg/mL in DDW and filtered, make fresh before use |
| Hydrogen peroxide solution | Sigma | H1009 | Electron microscopy, labeling of endocytosed synaptic vesicles by inducing HRP-DAB reaction, final concentration is 0.3% in DDW, make fresh before use |
| glutaraldehyde | Electron Microscopy Sciences | 16365 | Electron microscopy, fixatives, final concentration is 4% in Na-cacodylate buffer, make fresh before use, shake well before to use |
| TEM | JEOL | 200CX | Electron microscopy, imaging of endocytosed vesicles and ultrastructural changes |
| CCD digital camera | AMT | XR-100 | Electron microscopy, capturing images |
| Lead citrate | Leica microsystems | 16707235 | Electron microscopy, grid staining |
Références
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nature cell biol. 2 (4), 197-204 (2000).
- Sun, T., Wu, X. S., et al. The role of calcium/calmodulin-activated calcineurin in rapid and slow endocytosis at central synapses. J Neurosci. 30 (35), 11838-11847 (2010).
- Wu, X. -. S. S., Lee, S. H., et al. Actin Is Crucial for All Kinetically Distinguishable Forms of Endocytosis at Synapses. Neuron. 92 (5), 1020-1035 (2016).
- Granseth, B., Odermatt, B., Royle, S. J., Lagnado, L. Clathrin-mediated endocytosis is the dominant mechanism of vesicle retrieval at hippocampal synapses. Neuron. 51 (6), 773-786 (2006).
- Atluri, P. P., Ryan, T. A. The kinetics of synaptic vesicle reacidification at hippocampal nerve terminals. J Neurosci. 26 (8), 2313-2320 (2006).
- Royle, S. J., Granseth, B., Odermatt, B., Derevier, A., Lagnado, L. Imaging phluorin-based probes at hippocampal synapses. Methods Mol Biol. 457, 293-303 (2008).
- Moulder, K. L., Mennerick, S. Reluctant vesicles contribute to the total readily releasable pool in glutamatergic hippocampal neurons. J Neurosci. 25 (15), 3842-3850 (2005).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptopHluorin. Proc Natl Acad Sci U S A. 102 (17), 6131-6136 (2005).
- Morris, R. G. Elements of a neurobiological theory of hippocampal function: the role of synaptic plasticity, synaptic tagging and schemas. Eur J Neurosci. 23 (11), 2829-2846 (2006).
- Sankaranarayanan, S., Ryan, T. A. Calcium accelerates endocytosis of vSNAREs at hippocampal synapses. Nat Neurosci. 4 (2), 129-136 (2001).
- Balaji, J., Armbruster, M., Ryan, T. A. Calcium control of endocytic capacity at a CNS synapse. J Neurosci. 28 (26), 6742-6749 (2008).
- Ferguson, S. M., Brasnjo, G., et al. A selective activity-dependent requirement for dynamin 1 in synaptic vesicle endocytosis. Science. 316 (5824), 570-574 (2007).
- Baydyuk, M., Wu, X. S., He, L., Wu, L. G. Brain-derived neurotrophic factor inhibits calcium channel activation, exocytosis, and endocytosis at a central nerve terminal. J Neurosci. 35 (11), 4676-4682 (2015).
- Wu, X. S., Zhang, Z., Zhao, W. D., Wang, D., Luo, F., Wu, L. G. Calcineurin is universally involved in vesicle endocytosis at neuronal and nonneuronal secretory cells. Cell Rep. 7 (4), 982-988 (2014).
- Zhang, Z., Wang, D., et al. The SNARE proteins SNAP25 and synaptobrevin are involved in endocytosis at hippocampal synapses. J Neurosci. 33 (21), 9169-9175 (2013).
- Wu, L. -. G. G., Hamid, E., Shin, W., Chiang, H. -. C. C. Exocytosis and endocytosis: modes, functions, and coupling mechanisms. Annu Rev Physiol. 76 (1), 301-331 (2014).
- Daniele, F., Di Cairano, E. S., Moretti, S., Piccoli, G., Perego, C. TIRFM and pH-sensitive GFP-probes to evaluate neurotransmitter vesicle dynamics in SH-SY5Y neuroblastoma cells: cell imaging and data analysis. J Vis Exp. (95), e52267 (2015).
- Shaner, N. C., Lin, M. Z., et al. Improving the photostability of bright monomeric orange and red fluorescent proteins. Nat Methods. 5 (6), 545-551 (2008).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Leitz, J., Kavalali, E. T. Fast retrieval and autonomous regulation of single spontaneously recycling synaptic vesicles. Elife. 3, e03658 (2014).
- Bisht, K., El Hajj, H., Savage, J. C., Sánchez, M. G., Tremblay, M. -. &. #. 2. 0. 0. ;. Correlative Light and Electron Microscopy to Study Microglial Interactions with β-Amyloid Plaques. J Vis Exp. (112), e54060 (2016).
- Schikorski, T. Monitoring Synaptic Vesicle Protein Sorting with Enhanced Horseradish Peroxidase in the Electron Microscope. High-Resolution Imaging of Cellular Proteins: Methods and Protocols. , 327-341 (2016).
- Kononenko, N. L., Puchkov, D., et al. Clathrin/AP-2 mediate synaptic vesicle reformation from endosome-like vacuoles but are not essential for membrane retrieval at central synapses. Neuron. 82 (5), 981-988 (2014).
- Wu, Y., O'Toole, E. T., et al. A dynamin 1-, dynamin 3- and clathrin-independent pathway of synaptic vesicle recycling mediated by bulk endocytosis. eLife. 2014 (3), e01621 (2014).
- Heuser, J. E., Reese, T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J Cell Biol. 57 (2), 315-344 (1973).
- Ceccarelli, B., Hurlbut, W. P., Mauro, A. Turnover of transmitter and synaptic vesicles at the frog neuromuscular junction. J Cell Biol. 57 (2), 499-524 (1973).
- Watanabe, S., Rost, B. R., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S., Trimbuch, T., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
- Sankaranarayanan, S., Atluri, P. P., Ryan, T. A. Actin has a molecular scaffolding, not propulsive, role in presynaptic function. Nat Neurosci. 6 (2), 127-135 (2003).
- Zhu, Y., Xu, J., Heinemann, S. F. Two pathways of synaptic vesicle retrieval revealed by single-vesicle imaging. Neuron. 61 (3), 397-411 (2009).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Arnao, M. B. B., Acosta, M., del Rio, J. A. A., García-Cánovas, F. Inactivation of peroxidase by hydrogen peroxide and its protection by a reductant agent. Biochim Biophys Acta. 1038 (1), 85-89 (1990).
- Deák, F., Schoch, S., et al. Synaptobrevin is essential for fast synaptic-vesicle endocytosis. Nat Cell Biol. 6 (11), 1102-1108 (2004).
- Clayton, E. L., Evans, G. J. O., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J Neurosci. 28 (26), 6627-6632 (2008).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nat Neurosci. 17 (1), 10-16 (2014).
- Wienisch, M., Klingauf, J. Vesicular proteins exocytosed and subsequently retrieved by compensatory endocytosis are nonidentical. Nat Neurosci. 9 (8), 1019-1027 (2006).
- Fernández-Alfonso, T., Kwan, R., Ryan, T. A. Synaptic vesicles interchange their membrane proteins with a large surface reservoir during recycling. Neuron. 51 (2), 179-186 (2006).
- Gimber, N., Tadeus, G., Maritzen, T., Schmoranzer, J., Haucke, V. Diffusional spread and confinement of newly exocytosed synaptic vesicle proteins. Nat Commun. 6, 8392 (2015).
- Nicholson-Fish, J. C., Smillie, K. J., Cousin, M. A. Monitoring activity-dependent bulk endocytosis with the genetically-encoded reporter VAMP4-pHluorin. J Neurosci Methods. 266, 1-10 (2016).
- Burrone, J., Li, Z., Murthy, V. N. Studying vesicle cycling in presynaptic terminals using the genetically encoded probe synaptopHluorin. Nat Protoc. 1 (6), 2970-2978 (2006).
- Wisse, E., Braet, F., et al. Fixation methods for electron microscopy of human and other liver. World journal of gastroenterology. 16 (23), 2851-2866 (2010).
- Magidson, V., Khodjakov, A. Circumventing Photodamage in Live-Cell Microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Søndergaard, C. R., Garrett, A. E., et al. Structural artifacts in protein-ligand X-ray structures: implications for the development of docking scoring functions. J Med Chem. 52 (18), 5673-5684 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon