A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת אנדוציטוזה שלפוחית סינפטית של נוירונים בהיפוקמפוס בתרבית
In This Article
Summary
שלפוחית סינפטית אנדוציטוזה מזוהה על ידי מיקרוסקופ אור של pHluorin התמזגו עם שלפוחית סינפטית חלבונים על ידי מיקרוסקופ אלקטרונים של ספיגת שלפוחית.
Abstract
במהלך אנדוציטוזה, מאוחה הסינפטיות מאוחזרות על קצות עצבים היקפיים, המאפשרות שלפוחית מיחזור, ובכך את התחזוקה של ההעברה הסינאפסית במהלך ירי עצב חוזרות. אנדוציטוזה לקוי בתנאים פתולוגיים מוביל ירידות סינפטית כוח, המוח מתפקד. כאן, אנו מתארים שיטות למדידת אנדוציטוזה שלפוחית סינפטית על הסינפסה בהיפוקמפוס יונקים בתרבות עצביים. אנחנו בפיקוח שלפוחית סינפטית חלבון אנדוציטוזה פיוזינג חלבון ממברנה vesicular סינפטית, כולל synaptophysin ו VAMP2/synaptobrevin, בצד lumenal vesicular, עם pHluorin, רגיש pH חלבון פלואורסצנטי ירוק זה מגביר שלה עוצמת קרינה פלואורסצנטית כמו ה-pH מעלה. במהלך אקסוציטוזה, מגביר לומן vesicular pH, ואילו במהלך אנדוציטוזה vesicular לומן pH הוא acidified מחדש. לפיכך, גידול של עוצמת קרינה פלואורסצנטית pHluorin מציין היתוך, ואילו ירידה מציין אנדוציטוזה של החלבון שלפוחית סינפטית עם תוויות ברורות. בנוסף לשימוש בשיטת הדמיה pHluorin להקליט אנדוציטוזה, אנחנו בפיקוח אנדוציטוזה ממברנה vesicular על ידי מיקרוסקופ אלקטרונים (EM) מדידות של ספיגת peroxidase (HRP) חזרת שלפוחית. בסופו של דבר, אנחנו פיקוח היווצרות של חוצפה רפידה מסוף בורות בזמנים שונים לאחר דפולריזציה הנוצרות על-ידי אשלגן גבוה. מסלול הזמן של ספיגת HRP בור היווצרות קרום מציין את מהלך הזמן של אנדוציטוזה.
Introduction
נוירוטרנסמיטרים מאוחסנים הסינפטיות, שפורסמו על ידי אקסוציטוזה. קרום שלפוחית סינפטית של חלבון לאחר מכן על ידי אנדוציטוזה הינם בשימוש חוזר לסיבוב הבא של אקסוציטוזה. אנדוציטוזה של הסינפטיות חשוב לשמירה על שלפוחית סינפטית בריכות ומסירה שלפוחית הבולטות של קרום פלזמה. PHluorin רגיש pH חלבון פלואורסצנטי ירוק, אשר הוא מתרצה בנסיבות חומצי, dequenched ב pH ניטראלי, שימש כדי למדוד זמן אנדוציטוזה קורסים לחיות תאים1,2,3. החלבון pHluorin מחובר בדרך כלל לצד lumenal של חלבונים שלפוחית סינפטית, כגון synaptophysin או VAMP2/synaptobrevin. במצב מנוחה, pHluorin הוא מתרצה ב- 5.5 pH לומן של הסינפטיות. פיוז'ן שלפוחית על קרום פלזמה חושף לומן vesicular לתמיסה חוץ-תאית איפה ה-pH ~ 7.3, וכתוצאה מכך עלייה בזריחה pHluorin. לאחר אקסוציטוזה, נרקב זריחה מוגברת, עקב אנדוציטוזה של חלבונים שלפוחית סינפטית ואחריו שלפוחית acidification מחדש בתוך שלפוחית התאושש האלה. למרות הריקבון משקף אנדוציטוזה והן vesicular acidification מחדש, הוא משקף בעיקר אנדוציטוזה, כי acidification מחדש הוא מהיר יותר מאשר אנדוציטוזה רוב התנאים1,4. קבוע הזמן של acidification מחדש הוא 3-4 s או פחות5,6, שהוא בדרך כלל מהיר יותר 10 s או יותר הדרושים עבור שלפוחית אנדוציטוזה4,5. אם הניסויים נדרשים לבידול אנדוציטוזה acidification מחדש, חומצה שכבתה ניסויים באמצעות 4-Morpholineethanesulfonic חומצה (MES) הפתרון (25 מ מ) עם pH של 5.5 יכול לשמש כדי לקבוע אם חלבונים שלפוחית סינפטית מאוחזרות של קרום פלזמה ויה אנדוציטוזה-1,-3,-4. לפיכך, העלייה עוצמת קרינה פלואורסצנטית pHluorin משקפת איזון של מסכות, אנדוציטוזה ולאחר הירידה לאחר גירוי עצבי משקף באופן ספציפי אנדוציטוזה.
הדמיה pHluorin עשוי לשמש לא רק כדי למדוד את מהלך הזמן של אנדוציטוזה, אלא גם את הגודל של שלפוחית סינפטית בריכות7,8, ולשחרר ההסתברות של שחרור עורר וספונטני9. גורמים רבים, חלבונים מעורב בוויסות אנדוציטוזה, כגון סידן, מסיסים NSF-מצורף חלבון קולטן (מוקש) חלבונים, המוח, נגזר neurotrophic factor(BDNF) calcineurin זוהו באמצעות הדמיה pHluorin1 , 2 , 10 , 11 , 12 , 13 , 14 , 15 , 16. יתר על כן, שחרור נוירוטרנסמיטר יכול להתגלות נוירונים לא רק העיקרי אלא נוירובלסטומה תאים עם TIRFM17. לאחרונה, גרסאות pHluorin, dsRed, מורנג ו pHTomato פותחו לפיקוח הסימולטניות הקלטות של גורמים רבים ב18,סינפסה בודדת19. לדוגמה, pHTomato יש כבר התמזגו עם synaptophysin, נהגה עם מחוון סידן מקודדים גנטית (GCaMP5K) לפקח על שלפוחית presynaptic fusion ו Ca2 + זרם ב ה תא postsynaptic20. לכן, pHluorin מחוברים חלבונים סינפטיים מספק שיטה שימושית כדי לנתח את הקשר בין אקסוציטוזה אנדוציטוזה.
EM הוא שיטה נוספת בשימוש נפוץ ללמוד אנדוציטוזה, בשל הרזולוציה המרחבית הגבוהה זה מציגה את השינויים ultrastructural במהלך אנדוציטוזה. בשני תחומים כלליים הן את היכולת להמחיש שינויים פתולוגיים בתוך תאים עצביים21 ולעקוב אחר שלפוחית חלבונים22. בפרט, ההתבוננות שלפוחית סינפטית תפיסה, ממברנה עקמומיות מצופה מאת clathrin באיזור periactive, endosomal מבנים אפשריים עם EM3,23,24,25 ,26,27,28. בעוד EM כרוך לכלוכים פוטנציאליים, כגון מקבע-induced מומים, זה עלול להשפיע על אנדוציטוזה ולאחר ניתוח נתונים הוא עמל רב, שהפתרון מספק הזדמנות אטרקטיבית להמחיש המבנה התאי. בעיות פוטנציאליות מקבע והגבלת ברזולוציה הטמפורלית EM ניתן להתגבר על ידי לחץ גבוה קפוא, מתן שיטה מהירה ללא כימיקלים לייצב את המבנים עדין נוכח בזמן אנדוציטוזה27.
Protocol
הערה: פרוטוקול הבאים מתאר את שיטות הדמיה pHluorin ופעולות EM בשימוש נוירונים בהיפוקמפוס בתרבית. pHluorin צגים שלפוחית סינפטית חלבון ספיגת בתאים חיים ו- EM מזהה ספיגת של שלפוחית סינפטית, השינויים ultrastructural.
טיפול בבעלי חיים, הליך עקב הנחיות NIH, אושרו על ידי NIH חיה טיפול ועל שימוש הוועדה.
1-pHluorin הדמיה
- נוירון בהיפוקמפוס תרבות
- הכן ההיפוקמפוס מאגר (HB) על ידי שילוב של 4 מ"מ NaHCO 3 ו 5 מ מ HEPES ולהתאים את ה-pH 7.3 עם 5 M NaOH. להפוך את המדיום התרבות על ידי ערבוב neurobasal בינוני, 2% B27, 0.5 מ מגלוטמין ו 1% פניצילין-סטרפטומיצין. בנוסף, להכין תערובת של המאגר על בסיס חצי פנסיון עם 20% סרום שור עוברית (HB/20% FBS).
הערה: פרוטוקול culturing זה מבוסס על Sankaranarayanan, et al. 29 ו וו ואח ' 24 - לערוף הגורים העכבר בין יום כמחנכת 0 ליום 2 לתוך תרבות בינוני, ולחלץ את המוח לתוך 4 ° C HB/20% FBS. להסיר את גזע המוח תלמוס לחשוף את hippocampi. שווייץ hippocampi, לאחר לחשוף אותה על ידי הסרה של גזע המוח, תלמוס, ולהעביר טרי 4 ° C HB/20% FBS.
הערה: בדרך כלל, התשואה הוא בסביבות 4 x 10 5 תאים/mL עבור גור אחד (שני hippocampi). תנקה הקרומים adhering באמצעות פינצטה או מספריים, ולאחר מכן להעביר את טרי 4 ° C HB/20% FBS. לפרוש הכישור משוננת, לבודד את subiculum על ידי גזירה במספריים ולאחר מכן להעביר את טרי 4 ° C HB/20% FBS. - לחלק כל ההיפוקמפוס, על ידי חיתוך מקצה לקצה, כ- 10 פרוסות ולהעביר אותם צינור חרוטי פוליפרופילן 15 מ"ל.
- לאחר המאפשר הרקמה להתיישב, לשטוף עם 10 מ"ל של HB/20% FBS, ולאחר מכן לשטוף שלוש פעמים עם 10 מ"ל של HB-
- להכין תמיסת עיכול 137 מ מ NaCl, 5 מ מ אשלגן כלורי, 7 מ מ Na2HPO 4 ו- 25 מ מ HEPES, ולהתאים את ה-pH 7.2 עם 5 M NaOH. הסר את תגובת שיקוע hippocampi. להוסיף 10 מ ג של טריפסין 1 מ ג של DNase 2 מ"ל של פתרון מערכת העיכול, לסנן דרך קרום מיקרומטר 0.22 סטרילי ישירות על גבי בגדר דגימה.
- דגירה של hippocampi עבור 5 דקות ב 37 מעלות צלזיוס, ולאחר מכן לשטוף פעמיים עם 10 מ"ל של HB/20% FBS, ולאחר מכן לשטוף פעם עם 10 מ"ל של HB-
- מביצועם התאים עם 6 מ ג של MgSO 4 ∙ 7 שעות 2 O ו- 1 מ ג של DNase 2 מ"ל על בסיס חצי פנסיון, מסנן סטרילי אל hippocampi גלולה דרך מסנן מיקרומטר 0.22 סטרילי. בעדינות מביצועם בתאים על-ידי triturating זהירה, תוך דאגה שלא להעלות בועות אוויר. לאפשר רקמות חלקיקים להתיישב למשך 2 דקות, ולאחר מכן להעביר את תגובת שיקוע צניעותו עוד לאט.
- להוסיף 3 מ"ל HB/20% FBS עד תא ההשעיה, וגם צנטריפוגה או 10 דקות ב 4 ° C ו- 1000 סל ד. למחוק את תגובת שיקוע, resuspend תרבות בינוני.
- צלחת 60,000 תאים מושעה במדיום תרבות µL 150-coverslip בקוטר 25 מ מ פולי-D-ליזין מצופה, מבלי לשפוך את coverslip. להוסיף 2 מ של תרבות מראש ומחוממת בינוני 2 h לאחר ציפוי. Coverslips מתוחזקים טוב 6 צלחות culturing או עקר פטרי.
- שמור על תאים ב- 37 מעלות צלזיוס 5% CO 2 humidified חממה במדיום תרבות עבור 14-21 יום לפני ההקלטה. במהלך הגידול תרבות, לשנות את החלק העליון של המדיום פעמיים בשבוע.
- הכן ההיפוקמפוס מאגר (HB) על ידי שילוב של 4 מ"מ NaHCO 3 ו 5 מ מ HEPES ולהתאים את ה-pH 7.3 עם 5 M NaOH. להפוך את המדיום התרבות על ידי ערבוב neurobasal בינוני, 2% B27, 0.5 מ מגלוטמין ו 1% פניצילין-סטרפטומיצין. בנוסף, להכין תערובת של המאגר על בסיס חצי פנסיון עם 20% סרום שור עוברית (HB/20% FBS).
- תרביות תאים
- 6-7 ימים לאחר ציפוי, transfect synaptophysin-pHluorin 2 X (SpH) או VAMP2-pHluorin לתוך נוירונים בהיפוקמפוס. לשימוש SpH, מקדם Cytomegalovirus (CMV), מוכנס לתוך וקטור pcDNA3 30. לשימוש VAMP2-pHluorin, מקדם CMV מוכנס לתוך וקטור pCI 31.
- Transfect או וקטור על-ידי השומנים ההובלה לתוך תאי היעד, באמצעות µg 1 של פלסמיד. השתמש בינוני תרבות משלב פרוטוקול 1.1.1, אשר חסרה סרום, עבור תרביות תאים. לשנות את המדיום 2 h לאחר תרביות תאים כדי להפחית רעילות.
הערה: במקרה של ביטוי נמוך של SpH עם העיתון ons, להגדיל את ריכוז הדנ א 2 µg או זמן הדגירה עם ההובלה השומנים, אלא אם כן התאים הם לא בריאים. בדרך כלל, 4-10 תאים (0.006-0.008%) של נוירונים היו transfected.
- מיקרוסקופ אור
- להכין תמיסת מלח רגיל מורכב 119 מ מ NaCl, 2 מ מ CaCl 2, 2.5 מ מ אשלגן כלורי, 25 מ מ HEPES (pH 7.4), גלוקוז 30 מ מ, 2 מ מ MgCl 2, (6-cyano-7-nitroquinoxaline-2,3-dione 0.01 מ מ CNQX), ו 0.05 מ"מ חומצה DL-2-אמינו-5-phosphonovaleric (AP5). קח coverslip מן צלחת בינונית תרבות המקום על חדר הדמיה המאפשרת גירוי שדה, באמצעות חומר סיכה, איטום כדי למנוע דליפות. להימנע לתת הזכוכית יבש במהלך ההעברה של coverslip מהצלחת אל התא על-ידי הוספת מיד 750 µL רגיל תמיסת.
הערה: CNQX ו- AP5 שימשו כדי לחסום פעילות postsynaptic, אשר יש הפוטנציאל לפעילות חוזרים ונשנים. לפני הצבת תא במיקרוסקופ פלורסצנטיות הפוכה, השתמש ניקוי רקמות כדי לאשר כי החדר אינה דולפת. דליפה איטית גורמת מוקד משתנה במהלך ההקלטה על-ידי ערבוב רגיל שמן תמיסת מלח ו טבילה, אשר גורמת לשינויים במדד השבירה. - התמונה במיקרוסקופ widefield הפוכה עם 60 X (מפתח נומרי 1.4) שמן טבילה גירוי והקלטה עדשה עם הליד. דמיינו pHluorin עם מסנן של עירור שיא של 480 ננומטר, מראה מעבר ארוך 490 nm, 500-550 ננומטר מסנן פליטה, תריס היפוך ידני. לכידת תמונות כל 100 ms, עם 2 x 2 binning, באמצעות מצלמת אלקטרון הכפלת חיוב מצמידים התקן (EMCCD).
הערה: מספר תכונות נחשבות כדי להשיג את תנאים נאותים כדי להימנע photobleaching, כולל את מרווח לכידת התמונה, ולסנן, binning, אשר תלויות על ציוד. במקרה של הדמיה קונאפוקלית, כוח לייזר וזמן חשיפה להתייחס כדי להימנע photobleaching. הגדרת נקבע לאחר הקלטת לפחות 3 דקות ללא גירוי, ההקלטה בוצעה במשך לפחות 10 s ללא גירוי לבדיקת photobleaching. - לבחור אזור עם צפיפות גבוהה עם העיתון ons כדי להקל על ניתוח של ניסוי. לזהות תאים transfected לפי האות שלהם פלורסצנטיות ירוק, עם דגש על דפוסי ביטוי עגולים או אליפטיים בוטון, ביטוי רציף בין עם העיתון ons-
- אנדוציטוזה Induce על ידי גירוי שדה משתמש 1 ms הדופק, 20 מא פוטנציאל הפעולה (AP) מכרטיס ממריץ את הדופק ומסר דרך אלקטרודת פלטינה בתוך יחידת בידוד הגירוי. תמונת פעילות זריחה במהלך הגירוי ובמהלך השחזור תא.
הערה: במקרה של תאים מתים, הביטוי היה חזק יותר לחיות עם העיתון ons והראה תבנית אחידה בין עם העיתון ons-
- התמונה במיקרוסקופ widefield הפוכה עם 60 X (מפתח נומרי 1.4) שמן טבילה גירוי והקלטה עדשה עם הליד. דמיינו pHluorin עם מסנן של עירור שיא של 480 ננומטר, מראה מעבר ארוך 490 nm, 500-550 ננומטר מסנן פליטה, תריס היפוך ידני. לכידת תמונות כל 100 ms, עם 2 x 2 binning, באמצעות מצלמת אלקטרון הכפלת חיוב מצמידים התקן (EMCCD).
- להכין תמיסת מלח רגיל מורכב 119 מ מ NaCl, 2 מ מ CaCl 2, 2.5 מ מ אשלגן כלורי, 25 מ מ HEPES (pH 7.4), גלוקוז 30 מ מ, 2 מ מ MgCl 2, (6-cyano-7-nitroquinoxaline-2,3-dione 0.01 מ מ CNQX), ו 0.05 מ"מ חומצה DL-2-אמינו-5-phosphonovaleric (AP5). קח coverslip מן צלחת בינונית תרבות המקום על חדר הדמיה המאפשרת גירוי שדה, באמצעות חומר סיכה, איטום כדי למנוע דליפות. להימנע לתת הזכוכית יבש במהלך ההעברה של coverslip מהצלחת אל התא על-ידי הוספת מיד 750 µL רגיל תמיסת.
- ניתוח תמונות
- לניתוח עוצמת קרינה פלואורסצנטית ב בוטון יחיד, הגדר את אזור של הריבית (ROI) 1.5 x 1.5 מיקרומטר מרובע; הגודל של בוטון הוא בתוך כ 1.5 שימוש עקבות מיקרומטר. לפני גירוי כדי לבדוק photobleaching וכדי להפחית כרקע.
- קרינה פלואורסצנטית Normalize לשנות (ΔF) עם המשוואה:
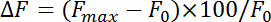
איפה F max ו- F 0 להפנות הגדלה מקסימלי לאחר גירוי ו בסיסית פלורסצנטיות, בהתאמה. למדוד אנדוציטוזה המחירים כמו שיעור הריקבון במהלך הראשון 4-10 s לאחר נקודת מקסימום של זריחה pHluorin. לקבל את קבוע הזמן (τ) של אנדוציטוזה על-ידי התאמת את העששת זריחה pHluorin מהגידול שיא לקו הבסיס עם פונקציה מעריכית-מונו-
2. מיקרוסקופ אלקטרונים
- הכן פולי-D-ליזין מצופה 6-ובכן צלחת על ידי החלת 1.5 מ של 0.01% סטרילי-מסוננים פולי-D-ליזין פתרון כל טוב של h 1 בטמפרטורת החדר, ואז כביסה שלוש פעמים עם מים מעוקר. לנתח, תרבות ולתחזק נוירונים בהיפוקמפוס כמו שלבים 1.1.1, 1.1.2 ו 1.1.3, בהתאמה.
- להכין פתרון גבוהה של גירוי K + עם HRP בתור מ מ 31.5 NaCl, 2 מ מ CaCl 2, 90 מ מ אשלגן כלורי, 25 מ מ HEPES (pH 7.4), גלוקוז 30 מ מ, 2 מ מ MgCl 2, 0.01 מ מ CNQX, מ מ 0.05 AP5 ו 5 מ"ג/מ"ל HRP, ואז להסתגל pH 7.4 עם 5 מ' NaOH.
פתרון גירוי K +
- Stimulate התרבות נוירון בהיפוקמפוס 1.5 מ ל גבוהה בטמפרטורת החדר (המכונה K +) על ידי תוספת של 1.5 מ"ל עד מכל קידוח עבור 90 s. במצב מנוחה (המכונה R), להחיל ריכוז זהה של 5 מ"ג/מ"ל HRP עבור 90 s, אבל עם תמיסת מלח רגיל. עבור המדגם השחזור, להחיל פתרון גירוי K + גבוהה כמו עם הדגימה K +, ואז במהירות לשטוף להחליף את המשאבה ואת תקופת דגירה של 10 דקות
- קיבעון, צביעת
- להכין 0.1 M-Na-cacodylate-מאגר באמצעות נמצא 21.4 g/L cacodylate נה ב- pH 7.4. לתקן תאים עם 4% גלוטראלדהיד במאגר 0.1 M נה cacodylate במשך לפחות שעה בטמפרטורת החדר. תשטוף שלוש פעמים עם 0.1 M נה cacodylate מאגר למשך 7 דקות כל אחד.
- פתרון Diaminobenzidine להכין (DAB), המורכב 0.5 מ"ג/מ"ל של כי אמחה קלות עם 0.3% 2 O H 2 ב- ddH 2 O ומסנן עם מסנן מיקרומטר 0.22. להחיל פתרון DAB 1.5 mL למשך 30 דקות בשטיפת 37 מעלות צלזיוס. שלוש פעמים עם 0.1 M נה cacodylate מאגר למשך 7 דקות כל אחד.
התראה: DAB הוא קרצינוגן רעיל, החשודות. נא להשתמש בכפפות עור חלוקי מעבדה.
הערה: תיוג עם DAB מתרחשת עקב חמצון שלו על ידי H 2 O 2, כמו על ידי HRP. עליות קטנות הרכיבים לגרום אות מוגבר במדגם. הגדלת ריכוז HRP מאיץ את ההשפעה של הזרז. ריכוז גדול מספיק של 2 O H 2 לאפשר מתישה ריאקציות צדדיות עם HRP, מעכב את השפעת תיוג 32. בעבודה זו, ריכוזי מערכת תיוג זו נבחרו בהתבסס על המחקר זמין כעת 33 , 34- - דגירה הנוירונים 1.5 מ של 1% OsO 4 במאגר 0.1 M נה cacodylate עבור h 1 ב 4 ° C כמו פוסט קיבעון. תשטוף שלוש פעמים עם 1.5 מ ל 0.1 M נה cacodylate מאגר למשך 7 דקות כל אחד.
התראה: בשל רעילות תגובתיות של OsO 4, בשמירה על המדגם על הקרח ברדס כימי עדיפה במקרים רבים על שימוש מקרר עבור הדגירה. - הכנת 0.1 M סודיום אצטט מאגר עם 13.61 g/L סודיום אצטט ו 11.43 mL/L חומצה אצטית ב- pH 5.0. שלוש פעמים עם מאגר אצטט 0.1 M 1.5 מ ב- pH 5.0 למשך 7 דקות כל וקונטה דגירה עם 1.5 מ ל 1% uranyl אצטט במאגר אצטט 0.1 M ב- pH 5.0 עבור h 1 ב-4 ° C. שטיפת שלוש פעמים עם 1.5 mL 0.1 M אצטט מאגר למשך 7 דקות כל.
- אפוקסי הטבעה
- מייבשים את התרבות נוירון עם mL 1.5 יחיד שוטף של 50%, 70% ו- 90% אתנול, במשך 7 דקות בכל אחד, ואז 3 שוטף של 1.5 מ"ל אתנול 100% למשך 7 דקות כל אחד בשכונה fume.
- מיקס 485 mL/L bisphenol-A-(epichlorhydrin) אפוקסי שרף, 160 מ ל/L dodecenyl סוקסינית אנהידריד (DDSA), 340 מ ל/L Methyl-5-Norbornene-2, 3-Dicarboxylic אנהידריד (NMA), ו- 15 מ"ל/L 2,4,6-טריס (dimethylaminomethyl) פנול (DMP-30) כדי ליצור את אפוקסי שרף. לערבב ביסודיות, מכן לאחסן תחת ואקום להסיר בועות אוויר.
הערה: זה קריטי כדי להסיר בועות אוויר שרף, במיוחד אלה קטנים יותר גלוי לעין, כי הם יכולים לגרום חללים שרף במהלך חלוקתה. - לחדור הדגימה על-ידי החלפת האתנול עם 50% אפוקסי שרף אתנול למשך 30 דקות בטמפרטורת החדר על מטרף, ולאחר מכן 70% אפוקסי שרף אתנול למשך 30 דקות בטמפרטורת החדר על מטרף.
- מתג האפוקסי שרף פתרון עם שרף אפוקסי 100%, תקופת דגירה של 10 דקות ב- 50 מעלות צלזיוס לבצע שתי החלפות של שרף אפוקסי 100% טרי עם incubations עבור h 1-50 מעלות צלזיוס. הוסף טריים 100% אפוקסי שרף ולאפשר להקשיח 50 ° C בלילה ולאחר מכן 60 & #17 6; C עבור מעל 36 h להקשיח.
- להסיר כל מדגם מהצלחת מוטי-ובכן עם צורף ' s חלול. בחר אזורים מעניינים, ריכוזים צפופים של תאים, באמצעות מיקרוסקופ אור הפוך, ולאחר מכן לחתוך 70-80 ננומטר בלוקים חלוקתה מאת מיקרוטום. הר האזור לחתוך צ'אק מיקרוטום וטען את האזמל הקטן. מקם את הצ'אק ב האזמל הקטן והר סכין יהלום עם הקצה במקביל למשטח של הרחוב. אוסף קטעים של 70-80 ננומטר בעובי ישירות על גבי רשתות נפרדות.
- לפזר uranyl אצטט למים פתרון 1% לפי משקל, בנפרד להמיס עופרת ציטראט למים פתרון 3% לפי משקל. Counterstain הסעיפים על ידי צלילה עם אצטט uranyl מימית 1% למשך 15 דקות ולאחר מכן 3% עופרת מימית ציטראט למשך 5 דקות לשפר את הניגודיות של הדגימות.
- EM הדמיה
- לבחון את הסעיפים עם מיקרוסקופ אלקטרונים הילוכים ותמונות הרשומה עם מצלמה דיגיטלית CCD בהגדלה גדולה העיקרי של 10,000-20, 000 X 3.
- סטטיסטיקה
- לבצע t-test כדי לזהות הבדלים משמעותיים על-ידי השוואת את שגיאת תקן של מדידה (s.e.m.) וב בין בקרה ניסויית דגימות.
תוצאות
שימוש בשיטת המוביל השומנים, SpH בא לידי נוירונים בהיפוקמפוס, המאפשרות הזיהוי עם העיתון ons (איור 1 א'). גירוי חשמלי של התאים הנגרמת אקסוציטוזה, וגידול מקביל בעוצמתם זריחה. העלייה ברמת קרינה פלואורסצנטית (ΔF) נעצר על ידי סיום הגירוי (איור 1b). ידי ק...
Discussion
כאן נדגים שתי שיטות לניטור אנדוציטוזה שלפוחית סינפטית. בשיטה הראשונה, אנחנו במעקב pHluorin התמזגו עם חלבון שלפוחית סינפטית בנוירונים transfected, לאחר מכן חשמלית מגורה. שנית, השתמשנו EM הדמיה של ספיגת HRP כפי שנגזרות אשלגן כלורי. השתמשנו גירויים שונים משתי סיבות. ראשית, יישום אשלגן גבוה גורם דפולריזצ?...
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים ד ר יונג-לינג ז'ו על מתן לבנות synaptophysin-pHluorin2x, ד ר ג'יימס דגלס רוטמן על מתן VAMP2-phluorin. אנו מודים ד ר סוזן נג ו וירג'יניה קרוקר NINDS מיקרוסקופ אלקטרונים מתקן על תמיכה טכנית ועזרה שלהם. עבודה זו נתמכה על ידי המכון הלאומי של הפרעות נוירולוגיות שבץ תוכנית מחקר מגזר בארה ב, מענק של KRIBB המחקר יוזמת התוכנית (קוריאנית ביו מדען תכנית העמיתים), המכון הקוריאני לחקר של Bioscience, ביוטכנולוגיה/ביולוגיה, הרפובליקה של קוריאה.
Materials
| Name | Company | Catalog Number | Comments |
| Lipofectamine LTX with Plus | Thermo Fisher | 15338-100 | Transfection of plasmid DNA including synaptophysin or VAMP2-pHluorin |
| neurobasal medium | Thermo Fisher | 21103-049 | Growth medium for neuron, Warm up to 37°C before use |
| B27 | Thermo Fisher | 17504-044 | Gradient for neuronal differentiation |
| Glutamax | Thermo Fisher | 35050-061 | Gradient for neuronal culture |
| Poly-D-Lysine coated coverslip | Neuvitro | GG-25-pdl | Substrate for neuronal growth and imaging of pHluorin |
| Trypsin XI from bovine pancrease | Sigma | T1005 | Neuronal culture-digest hippocampal tissues |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025 | Neuronal culture-inhibits viscous cell suspension |
| pulse stimulator | A-M systems | model 2100 | Apply electrical stimulation |
| Slotted bath with field stimulation | Warner Instruments | RC-21BRFS | Apply electrical stimulation |
| stimulus isolation unit | Warner Instruments | SIU102 | Apply electrical stimulation |
| lubricant | Dow corning | 111 | pHluorin imaging-seal with coverslip and imaging chamber, avoid leak from chamber |
| AP5 | Tocris | 3693 | Gradient for normal saline, selective NMDA receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| CNQX | Tocris | 190 | Gradient for normal saline, competitive AMPA/kainate receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| Illuminator | Nikon | C-HGFI | Metal halide light source for pHluorin |
| EMCCD camera | Andor | iXon3 | pHluorin imaging, detect pHluorin fluorescence intensity |
| Inverted microscopy | Nikon | Ti-E | Imaging for synaptophysin or VAMP2 pHluorin transfected cells |
| NIS-Elements AR | Nikon | NIS-Elements Advanced Research | Software for imaging acquisition and analysis |
| Igor Pro | WaveMetrics | Igor pro | Software for imaging analysis and data presentation |
| imaging chamber | Warner Instruments | RC21B | pHluorin imaging, apply field stimulation on living cells |
| poly-l-lysine | Sigma | P4832 | Electron microscopy, substrate for neuronal growth, apply on multiwell plate for 1 h at room temperature then wash with sterilized water 3 times |
| Horseradish peroxidase(HRP) | Sigma | P6782 | Electron microscopy, labeling of endocytosed synaptic vesicles by catalyzing DAB in presence hydrogen peroxide, final concentration is 5 mg/mL in normal saline, make fresh before use |
| Na cacodylate | Electron Microscopy Sciences | 12300 | Electron microscopy, buffer for fixatives and washing, final concentration is 0.1 N |
| 3,3′-Diaminobenzidine(DAB) | Sigma | D8001 | Electron microscopy, labeling of endocytosed synaptic vesicles, substrate for HRP, final concentration is 0.5 mg/mL in DDW and filtered, make fresh before use |
| Hydrogen peroxide solution | Sigma | H1009 | Electron microscopy, labeling of endocytosed synaptic vesicles by inducing HRP-DAB reaction, final concentration is 0.3% in DDW, make fresh before use |
| glutaraldehyde | Electron Microscopy Sciences | 16365 | Electron microscopy, fixatives, final concentration is 4% in Na-cacodylate buffer, make fresh before use, shake well before to use |
| TEM | JEOL | 200CX | Electron microscopy, imaging of endocytosed vesicles and ultrastructural changes |
| CCD digital camera | AMT | XR-100 | Electron microscopy, capturing images |
| Lead citrate | Leica microsystems | 16707235 | Electron microscopy, grid staining |
References
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nature cell biol. 2 (4), 197-204 (2000).
- Sun, T., Wu, X. S., et al. The role of calcium/calmodulin-activated calcineurin in rapid and slow endocytosis at central synapses. J Neurosci. 30 (35), 11838-11847 (2010).
- Wu, X. -. S. S., Lee, S. H., et al. Actin Is Crucial for All Kinetically Distinguishable Forms of Endocytosis at Synapses. Neuron. 92 (5), 1020-1035 (2016).
- Granseth, B., Odermatt, B., Royle, S. J., Lagnado, L. Clathrin-mediated endocytosis is the dominant mechanism of vesicle retrieval at hippocampal synapses. Neuron. 51 (6), 773-786 (2006).
- Atluri, P. P., Ryan, T. A. The kinetics of synaptic vesicle reacidification at hippocampal nerve terminals. J Neurosci. 26 (8), 2313-2320 (2006).
- Royle, S. J., Granseth, B., Odermatt, B., Derevier, A., Lagnado, L. Imaging phluorin-based probes at hippocampal synapses. Methods Mol Biol. 457, 293-303 (2008).
- Moulder, K. L., Mennerick, S. Reluctant vesicles contribute to the total readily releasable pool in glutamatergic hippocampal neurons. J Neurosci. 25 (15), 3842-3850 (2005).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptopHluorin. Proc Natl Acad Sci U S A. 102 (17), 6131-6136 (2005).
- Morris, R. G. Elements of a neurobiological theory of hippocampal function: the role of synaptic plasticity, synaptic tagging and schemas. Eur J Neurosci. 23 (11), 2829-2846 (2006).
- Sankaranarayanan, S., Ryan, T. A. Calcium accelerates endocytosis of vSNAREs at hippocampal synapses. Nat Neurosci. 4 (2), 129-136 (2001).
- Balaji, J., Armbruster, M., Ryan, T. A. Calcium control of endocytic capacity at a CNS synapse. J Neurosci. 28 (26), 6742-6749 (2008).
- Ferguson, S. M., Brasnjo, G., et al. A selective activity-dependent requirement for dynamin 1 in synaptic vesicle endocytosis. Science. 316 (5824), 570-574 (2007).
- Baydyuk, M., Wu, X. S., He, L., Wu, L. G. Brain-derived neurotrophic factor inhibits calcium channel activation, exocytosis, and endocytosis at a central nerve terminal. J Neurosci. 35 (11), 4676-4682 (2015).
- Wu, X. S., Zhang, Z., Zhao, W. D., Wang, D., Luo, F., Wu, L. G. Calcineurin is universally involved in vesicle endocytosis at neuronal and nonneuronal secretory cells. Cell Rep. 7 (4), 982-988 (2014).
- Zhang, Z., Wang, D., et al. The SNARE proteins SNAP25 and synaptobrevin are involved in endocytosis at hippocampal synapses. J Neurosci. 33 (21), 9169-9175 (2013).
- Wu, L. -. G. G., Hamid, E., Shin, W., Chiang, H. -. C. C. Exocytosis and endocytosis: modes, functions, and coupling mechanisms. Annu Rev Physiol. 76 (1), 301-331 (2014).
- Daniele, F., Di Cairano, E. S., Moretti, S., Piccoli, G., Perego, C. TIRFM and pH-sensitive GFP-probes to evaluate neurotransmitter vesicle dynamics in SH-SY5Y neuroblastoma cells: cell imaging and data analysis. J Vis Exp. (95), e52267 (2015).
- Shaner, N. C., Lin, M. Z., et al. Improving the photostability of bright monomeric orange and red fluorescent proteins. Nat Methods. 5 (6), 545-551 (2008).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Leitz, J., Kavalali, E. T. Fast retrieval and autonomous regulation of single spontaneously recycling synaptic vesicles. Elife. 3, e03658 (2014).
- Bisht, K., El Hajj, H., Savage, J. C., Sánchez, M. G., Tremblay, M. -. &. #. 2. 0. 0. ;. Correlative Light and Electron Microscopy to Study Microglial Interactions with β-Amyloid Plaques. J Vis Exp. (112), e54060 (2016).
- Schikorski, T. Monitoring Synaptic Vesicle Protein Sorting with Enhanced Horseradish Peroxidase in the Electron Microscope. High-Resolution Imaging of Cellular Proteins: Methods and Protocols. , 327-341 (2016).
- Kononenko, N. L., Puchkov, D., et al. Clathrin/AP-2 mediate synaptic vesicle reformation from endosome-like vacuoles but are not essential for membrane retrieval at central synapses. Neuron. 82 (5), 981-988 (2014).
- Wu, Y., O'Toole, E. T., et al. A dynamin 1-, dynamin 3- and clathrin-independent pathway of synaptic vesicle recycling mediated by bulk endocytosis. eLife. 2014 (3), e01621 (2014).
- Heuser, J. E., Reese, T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J Cell Biol. 57 (2), 315-344 (1973).
- Ceccarelli, B., Hurlbut, W. P., Mauro, A. Turnover of transmitter and synaptic vesicles at the frog neuromuscular junction. J Cell Biol. 57 (2), 499-524 (1973).
- Watanabe, S., Rost, B. R., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S., Trimbuch, T., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
- Sankaranarayanan, S., Atluri, P. P., Ryan, T. A. Actin has a molecular scaffolding, not propulsive, role in presynaptic function. Nat Neurosci. 6 (2), 127-135 (2003).
- Zhu, Y., Xu, J., Heinemann, S. F. Two pathways of synaptic vesicle retrieval revealed by single-vesicle imaging. Neuron. 61 (3), 397-411 (2009).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Arnao, M. B. B., Acosta, M., del Rio, J. A. A., García-Cánovas, F. Inactivation of peroxidase by hydrogen peroxide and its protection by a reductant agent. Biochim Biophys Acta. 1038 (1), 85-89 (1990).
- Deák, F., Schoch, S., et al. Synaptobrevin is essential for fast synaptic-vesicle endocytosis. Nat Cell Biol. 6 (11), 1102-1108 (2004).
- Clayton, E. L., Evans, G. J. O., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J Neurosci. 28 (26), 6627-6632 (2008).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nat Neurosci. 17 (1), 10-16 (2014).
- Wienisch, M., Klingauf, J. Vesicular proteins exocytosed and subsequently retrieved by compensatory endocytosis are nonidentical. Nat Neurosci. 9 (8), 1019-1027 (2006).
- Fernández-Alfonso, T., Kwan, R., Ryan, T. A. Synaptic vesicles interchange their membrane proteins with a large surface reservoir during recycling. Neuron. 51 (2), 179-186 (2006).
- Gimber, N., Tadeus, G., Maritzen, T., Schmoranzer, J., Haucke, V. Diffusional spread and confinement of newly exocytosed synaptic vesicle proteins. Nat Commun. 6, 8392 (2015).
- Nicholson-Fish, J. C., Smillie, K. J., Cousin, M. A. Monitoring activity-dependent bulk endocytosis with the genetically-encoded reporter VAMP4-pHluorin. J Neurosci Methods. 266, 1-10 (2016).
- Burrone, J., Li, Z., Murthy, V. N. Studying vesicle cycling in presynaptic terminals using the genetically encoded probe synaptopHluorin. Nat Protoc. 1 (6), 2970-2978 (2006).
- Wisse, E., Braet, F., et al. Fixation methods for electron microscopy of human and other liver. World journal of gastroenterology. 16 (23), 2851-2866 (2010).
- Magidson, V., Khodjakov, A. Circumventing Photodamage in Live-Cell Microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Søndergaard, C. R., Garrett, A. E., et al. Structural artifacts in protein-ligand X-ray structures: implications for the development of docking scoring functions. J Med Chem. 52 (18), 5673-5684 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved