Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de endocitosis vesícula sináptica en neuronas Hippocampal cultivadas
En este artículo
Resumen
Endocitosis de vesículas sinápticas se detectan por microscopia ligera de pHluorin fusionado con la proteína de la vesícula sináptica y por microscopia electrónica de la absorción de la vesícula.
Resumen
Durante la endocitosis, vesículas sinápticas fundidas se recuperan en los terminales del nervio, permitiendo para el reciclaje de la vesícula y así el mantenimiento de la transmisión sináptica durante la cocción del repetidor del nervio. Endocitosis deteriorada en condiciones patológicas conduce a disminuciones en las funciones de cerebro y fuerza sinápticas. Aquí, describimos los métodos utilizados para medir la endocitosis de vesículas sinápticas en la sinapsis hippocampal mamífera en cultivo neuronal. Supervisamos la endocitosis de la proteína de la vesícula sináptica mediante la fusión de una proteína de la membrana vesicular sináptica, incluyendo synaptophysin y VAMP2/synaptobrevin, en el lado lumenal de vesicular, con pHluorin, una proteína fluorescente verde sensibles al pH que aumenta su intensidad de fluorescencia como el pH aumenta. Durante la exocitosis, pH del lumen vesicular aumenta, mientras que durante lumen vesicular endocitosis es acidificado a pH. Así, un aumento de la intensidad de la fluorescencia pHluorin indica fusión, mientras que indica que una disminución de la endocitosis de la proteína de la vesícula sináptica con. Además de utilizar el método de proyección de imagen de pHluorin para grabar endocitosis, supervisamos endocitosis la membrana vesicular por microscopia electrónica (EM) medidas de la absorción de peroxidasa (HRP) de rábano por vesículas. Por último, controla la formación de hoyos de membrana terminal del nervio en las varias horas después de la despolarización inducida por potasio alto. El curso del tiempo de formación de HRP absorción y membrana pit indica el curso del tiempo de endocitosis.
Introducción
Neurotransmisores se almacenan en vesículas sinápticas y liberados por exocitosis. La membrana de la vesícula sináptica y proteína son internalizados por endocitosis y reutilizadas en la próxima ronda de exocitosis. Endocitosis de vesículas sinápticas es importante para el mantenimiento de piscinas de la vesícula sináptica y quitan vesículas que sobresale de la membrana plasmática. La pHluorin pH-sensible a la proteína verde fluorescente, que se apagó en condiciones ácidas y dequenched en un pH neutro, se ha utilizado para medir el tiempo de endocitosis cursos en viven las células1,2,3. La proteína pHluorin se une típicamente al lado de las proteínas de la vesícula sináptica, como la sinaptofisina o VAMP2/synaptobrevin lumenal. En el resto, pHluorin se apaga en el lumen de pH 5.5 de vesículas sinápticas. Fusión de la vesícula a la membrana plasmática expone el lumen vesicular a la solución extracelular donde el pH es ~ 7.3, resultando en un incremento en la fluorescencia pHluorin. Después de la exocitosis, la fluorescencia creciente decae, debido a la endocitosis de las proteínas de la vesícula sináptica seguido de acidificación la vesícula dentro de las vesículas recuperadas. Aunque el decaimiento refleja endocitosis y acidificación vesicular de nuevo, en su mayoría refleja endocitosis, porque la acidificación es más rápida que la endocitosis en la mayoría condiciones1,4. La constante de tiempo de la acidificación es 3-4 s o menos5,6, que es generalmente más rápido que los 10 s o más necesarios para la endocitosis de vesículas4,5. Si los experimentos son necesarios para distinguir la endocitosis de la acidificación, experimentos de amortiguamiento ácidos con la solución de (MES) ácida 4-Morpholineethanesulfonic (25 mM) con un pH de 5.5 pueden utilizarse para determinar si las proteínas de la vesícula sináptica se recuperan de la membrana plasmática vía endocitosis1,3,4. Así, el aumento de intensidad de fluorescencia de pHluorin refleja un equilibrio de exo y endocitosis, y la disminución después de la estimulación nerviosa refleja específicamente endocitosis.
pHluorin la proyección de imagen puede utilizarse no sólo para medir el curso temporal de la endocitosis, pero también el tamaño de la vesícula sináptica piscinas7,8, y la probabilidad de liberación evocada y espontánea libertad9. Muchos factores y proteínas implicadas en la regulación de endocitosis, tales como calcio, proteínas solubles de receptores (trampa) de la proteína del NSF-accesorio, factor(BDNF) neurotrófico derivado del cerebro y calcineurina han sido identificadas usando proyección de imagen de pHluorin1 , 2 , 10 , 11 , 12 , 13 , 14 , 15 , 16. por otra parte, se podría detectar liberación de neurotransmisores en las neuronas no sólo primarias, sino en las células del neuroblastoma con TIRFM17. Recientemente, pHTomato, dsRed, mOrange y variantes de pHluorin fueron desarrollados para el monitoreo de grabaciones simultáneas de múltiples factores en una sola sinapsis18,19. Por ejemplo, pHTomato ha sido fusionado con synaptophysin y utilizado con un indicador de calcio genéticamente codificados (GCaMP5K) para controlar la fusión de la vesícula presináptica y Ca2 + afluencia en el compartimiento postsináptico20. Por lo tanto, pHluorin unida a las proteínas sinápticas proporciona un método útil para analizar la relación entre endocitosis y exocitosis.
EM es otro método comúnmente utilizado para el estudio de endocitosis, debido a la alta resolución espacial que muestra cambios ultraestructurales durante la endocitosis. Dos áreas generales son la capacidad de visualizar los cambios patológicos dentro de las células neuronales21 y seguir vesícula proteínas22. En particular, la observación de la absorción de la vesícula sináptica, curvatura de la membrana recubierta por clatrina de la zona de periactive y endosomal estructuras son posibles con EM3,23,24,25 ,26,27,28. Mientras que EM comprende artefactos potenciales, tales como malformaciones inducidas por el fijador, que puede afectar la endocitosis, y análisis de datos es mano de obra, que la resolución ofrece una atractiva oportunidad para visualizar la estructura celular. Posibles problemas de fijador y la limitación en la resolución temporal de EM pueden superarse por la alta presión de congelación, proporcionando un método rápido y no químicos de estabilización de las delicadas estructuras presentes durante la endocitosis27.
Protocolo
Nota: el siguiente protocolo describe los métodos de proyección de imagen de pHluorin y métodos EM en neuronas hippocampal cultivadas. pHluorin monitores vesícula sináptica proteína asimilación en las células vivas y EM detecta la absorción de la vesícula sináptica y cambios ultraestructurales.
cuidado de los animales y procedimiento seguido las pautas de NIH y fueron aprobados por el Comité de uso y cuidado de animales de NIH.
1. pHluorin imágenes
- cultura Hippocampal neuron
- preparar Buffer de hipocampo (HB) mediante la combinación de 4 mM NaHCO 3 y 5 mM HEPES y ajustar el pH a 7.3 con 5 M NaOH. Hacer el medio de cultivo mediante la mezcla de neurobasal medio, 2% B27, 0,5 mM L-glutamina y 1% de penicilina-estreptomicina. Además, preparar una mezcla de tampón de HB con el 20% de suero bovino Fetal (FBS HB/20%).
Nota: Este protocolo de cultivo se basa en Sankaranarayanan, et al. 29 y Wu et al. 24 - decapitar a crías de ratón entre postnatal día 0 a día 2 en medio de cultivo y extraer el cerebro en 4 ° C HB/20% FBS. Quitar el tronco encefálico y el tálamo para exponer a los hipocampos. Diseccionar a los hipocampos, después de exponer por el retiro del tallo cerebral y tálamo y transferir a fresca 4 ° C HB/20% FBS.
Nota: Normalmente, el rendimiento es alrededor de 4 x 10 5 células/mL para un cachorro (dos hipocampos). Limpie las membranas adherentes utilizando unas pinzas o tijeras, luego transferir a fresca 4 ° C HB/20% FBS. Desenrolle el giro dentado y aislar el subiculum cortando con unas tijeras, luego transferir a fresca 4 ° C HB/20% FBS. - Dividir cada hipocampo, cortando de un extremo a extremo, en rodajas de unos 10 y transferirlos a un tubo cónico de polipropileno de 15 mL.
- Después de permitir que el tejido colocar, lavar con 10 mL de SBF HB/20% y luego lavar tres veces con 10 mL de HB.
- Preparar la solución de digestión de 137 mM NaCl, KCl de 5 mM, 7 mM Na2HPO 4 y 25 mM HEPES y ajustar pH a 7.2 con NaOH M 5. Retire el sobrenadante de los hipocampos. Añadir 10 mg de tripsina y 1 mg de la ADNsa a 2 mL de solución de digestión y filtrar a través de una membrana de 0,22 μm estéril directamente en el sedimento de la muestra.
- Incubar los hipocampos por 5 min a 37 ° C, luego lavar dos veces con 10 mL de SBF HB/20% y luego lavar una vez con 10 mL de HB.
- Disociar las células con 6 mg de MgSO 4 ∙ 7 H 2 O y 1 mg de la ADNsa 2 mL HB y filtro estéril en los hipocampos de pellets a través de un filtro estéril de 0,22 μm. Suavemente disociar las células por trituración cuidadosa, mientras que teniendo cuidado de no introducir burbujas de aire. Permitir que las partículas de tejido a reposar 2 min y entonces lentamente transfiera el sobrenadante a otro tubo.
- Añadir 3 mL HB/20% FBS a la suspensión de la célula y centrífuga o 10 min a 4 ° C y 1.000 rpm. Deseche el sobrenadante y resuspender en medio de cultivo.
- Placa de 60.000 células suspendidas en 150 μL de medio de cultivo en un cubreobjetos de 25 mm de diámetro recubierto de Poly-D-lisina, sin derrame de cubreobjetos. Añadir 2 mL de medio de cultivo con 2 h después de la galjanoplastia. Cubreobjetos se mantienen en placas cultivo de 6 pocillos o platos de Petri estéril.
- Mantener las células a 37 ° C en un 5% CO 2 humidificado incubadora en medio de cultivo durante 14-21 días antes de la grabación. Durante el crecimiento de la cultura, cambiar la mitad superior del medio dos veces a la semana.
- preparar Buffer de hipocampo (HB) mediante la combinación de 4 mM NaHCO 3 y 5 mM HEPES y ajustar el pH a 7.3 con 5 M NaOH. Hacer el medio de cultivo mediante la mezcla de neurobasal medio, 2% B27, 0,5 mM L-glutamina y 1% de penicilina-estreptomicina. Además, preparar una mezcla de tampón de HB con el 20% de suero bovino Fetal (FBS HB/20%).
- Transfección
- 6-7 días después de la galjanoplastia, transfectar synaptophysin-pHluorin 2 X (SpH) o VAMP2-pHluorin en neuronas hippocampal. Para SpH, utilizar un promotor de citomegalovirus (CMV), insertado en un vector pcDNA3 de 30. Para VAMP2-pHluorin, use un promotor CMV insertado en un vector de pCI 31.
- Transfectar cualquier vector por el portador del lípido en las células diana, con 1 μg de plásmido. Utilizar medio de cultivo de paso protocolo 1.1.1, que carece de suero, para la transfección. Cambiar el medio 2 h después de transfección para reducir toxicidad.
Nota: En caso de baja expresión de SpH en los botones, aumentar la concentración de ADN a 2 μg o el tiempo de incubación con el transportador lipídico, a menos que las células son poco saludables. Por lo general, de 4-10 células (0.006 0.008%) de las neuronas fueron transfectadas.
- Microscopía
- preparación de solución salina normal compuesta de 119 mM NaCl, CaCl 2, 2,5 mM de KCl, 25 mM HEPES (pH 7.4), glucosa de 30 mM, 2 mM de MgCl 2, (6-cyano-7-nitroquinoxaline-2,3-dione) 0,01 mM de 2 mM CNQX) y 0.05 m de ácido DL-2-amino-5-phosphonovaleric (AP5). Tomar un cubreobjetos de la placa de medio de cultivo y el lugar en una cámara de proyección de imagen que permite la estimulación de campo, usando lubricante y sellante para evitar fugas. Evitar que el vidrio seco durante la transferencia de un cubreobjetos de la placa de la cámara inmediatamente agregando solución salina normal de 750 μl.
Nota: CNQX y AP5 fueron utilizados para bloquear la actividad postsináptica, que tiene el potencial para la actividad recurrente. Antes de colocar una cámara en un microscopio de fluorescencia invertido, utilice limpieza tejido para confirmar que la cámara no gotear. Filtración lenta provoca cambios de enfoque durante la grabación por la mezcla de aceite salino e inmersión normal, que se traduce en cambios en el índice de refracción de. - Estimulación y registro de inmersión de aceite (apertura numérica de 1.4)
- de imagen en un microscopio invertido de campo amplio con 60 X la lente con una lámpara de haluro de metal. Visualizar la pHluorin con un filtro para un pico de excitación de 480 nm, 490 nm pase largo espejo, un filtro de emisión de 500-550 nm y un obturador de tirón manual. Capturar imágenes cada 100 ms, con 2 x 2 binning, usando una cámara de electrones multiplicando carga acoplada dispositivo (EMCCD).
Nota: Varias características deben considerarse para lograr las condiciones adecuadas para evitar el fotoblanqueo, incluyendo el intervalo de captura de imagen y filtrar y binning, que dependen de equipos. En el caso de la proyección de imagen confocal, tiempo de exposición y potencia láser debe considerarse para evitar el fotoblanqueo. La configuración se determinó después de grabar al menos 3 minutos sin estímulo y la grabación fue realizada por al menos 10 s sin estímulo para comprobar fotoblanqueo. - Elija un área con una alta densidad de botones para facilitar el análisis en cada experimento. Identificar células transfected por su señal de fluorescencia verde, con énfasis en los patrones de expresión redonda u ovalada en el bouton y expresión continua entre boutons.
- Endocitosis inducir por el estímulo de campo usando un 1 ms de pulso, 20 potencial de acción mA (AP) provee de un estimulador de impulsos y a través de un electrodo de platino dentro de la unidad de aislamiento del estímulo. Actividad de fluorescencia de imagen a lo largo de la estimulación y durante la recuperación celular.
Nota: En el caso de las células muertas, expresión era más fuerte que la vida botones y demostró un patrón desigual entre boutons.
- de imagen en un microscopio invertido de campo amplio con 60 X la lente con una lámpara de haluro de metal. Visualizar la pHluorin con un filtro para un pico de excitación de 480 nm, 490 nm pase largo espejo, un filtro de emisión de 500-550 nm y un obturador de tirón manual. Capturar imágenes cada 100 ms, con 2 x 2 binning, usando una cámara de electrones multiplicando carga acoplada dispositivo (EMCCD).
- preparación de solución salina normal compuesta de 119 mM NaCl, CaCl 2, 2,5 mM de KCl, 25 mM HEPES (pH 7.4), glucosa de 30 mM, 2 mM de MgCl 2, (6-cyano-7-nitroquinoxaline-2,3-dione) 0,01 mM de 2 mM CNQX) y 0.05 m de ácido DL-2-amino-5-phosphonovaleric (AP5). Tomar un cubreobjetos de la placa de medio de cultivo y el lugar en una cámara de proyección de imagen que permite la estimulación de campo, usando lubricante y sellante para evitar fugas. Evitar que el vidrio seco durante la transferencia de un cubreobjetos de la placa de la cámara inmediatamente agregando solución salina normal de 750 μl.
- Análisis de la imagen
- Para el análisis de la intensidad de fluorescencia en un sola bouton, establecer hasta una región de interés (ROI) como un 1.5 x 1.5 μm de cuadrados; el tamaño de un bouton está a unos 1,5 μm. uso los rastros antes de estimulación para comprobar fotoblanqueo y restar como fondo.
- Normalizar la fluorescencia cambia (ΔF) con la ecuación:
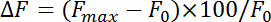
donde F max y F 0 consulte aumento máximo después de la estimulación y de la fluorescencia basal, respectivamente. Medir tipos de endocitosis como la tasa de decaimiento durante los primeros 4 10 s después del punto máximo de fluorescencia pHluorin. Obtener la constante de tiempo (τ) de endocitosis encajando el decaimiento de la fluorescencia de pHluorin el aumento de pico a la línea de base con una función exponencial mono.
2. La microscopia electrónica
- Prepare una Poly-D-lisina cubierta placa de 6 pozos por aplicar 1.5 mL de solución estéril filtrada de Poly-D-lisina de 0.01% a cada pocillo por 1 h a temperatura ambiente, luego se lava tres veces con agua esterilizada. Disecar, la cultura y mantener las neuronas hippocampal en pasos 1.1.1, 1.1.2 y 1.1.3, respectivamente.
- Prepare solución de estimulación de alta K + con HRP como 31,5 mM NaCl, CaCl 2, de 2 mM 90 mM KCl, 25 mM HEPES (pH 7.4), glucosa de 30 mM, 2 mM de MgCl 2, 0,01 mM CNQX, 0,05 mM AP5 y 5 mg/mL HRP, luego ajustan a pH 7,4 con 5 M NaOH.
Solución para estimulación K +
- estimular la cultura de neurona del hipocampo con 1,5 mL de alta temperatura (denominada K +) por la adición de 1,5 mL a cada pozo de 90 s. En la condición de reposo (denominada R), se aplica la misma concentración de 5 mg/mL HRP por 90 s, pero con solución salina normal. Para la muestra de recuperación, aplicar solución de estimulación alta K + como con la muestra de K +, entonces rápidamente lavado sustituir con solución salina normal e incubar durante 10 minutos
- Fijación y coloración
- preparar buffer de cacodilato de Na de 0.1 M con 21,4 g/L Na cacodilato a pH 7,4. Fijar las células con glutaraldehído al 4% en buffer de cacodilato de Na de 0.1 M por al menos 1 h a temperatura ambiente. Lavar tres veces con buffer de cacodilato de Na de 0.1 M por 7 min.
- Solución preparar diaminobenzidina (DAB), de 0,5 mg/mL de lenguado con 0.3% H 2 O 2 en ddH 2 O y el filtro con filtro de 0.22 μm. Aplique solución DAB 1.5 mL durante 30 min a 37 ° C. lavado tres veces con buffer de cacodilato de Na de 0.1 M por 7 min.
PRECAUCIÓN: DAB es un carcinógeno tóxico y sospecha. Utilice guantes y batas de laboratorio.
Nota: Etiquetado con el lenguado se produce debido a su oxidación por H 2 O 2, como catalizada por HRP. Pequeños incrementos en el resultado de los componentes de una señal creciente en la muestra. Aumento de la concentración de HRP acelera el efecto del catalizador. Suficientemente grandes concentraciones de H 2 O 2 permiten debilitante reacciones secundarias con HRP, inhibiendo el efecto de etiquetado 32. En este trabajo, las concentraciones de este sistema de etiquetado fueron seleccionadas en base a investigaciones actualmente disponibles 33 , 34. - Incubar las neuronas con 1,5 mL de 1% OsO 4 en buffer de cacodilato de Na de 0.1 M por 1 h a 4 ° C como fijación. Lavar tres veces con 1,5 mL de buffer de cacodilato de Na de 0.1 M por 7 min.
PRECAUCIÓN: Debido a la toxicidad y reactividad de OsO 4, manteniendo la muestra en hielo en una campana química es preferible en muchos casos a utilizar una nevera para la incubación. - Preparar 0.1 M tampón de acetato de sodio con 13,61 g/L sodio acetato y 11,43 mL/L de ácido acético glacial a pH 5,0. Lavar tres veces con tampón de acetato 1,5 mL de 0.1 M a pH 5.0 por 7 min e incubar con acetato de uranilo 1.5 mL de 1% en buffer de acetato de 0,1 M a pH 5,0 por 1 h a 4 ° C. Wash tres veces con tampón de acetato de 0,1 M 1,5 mL por 7 min.
- Epoxy incrustar
- deshidratar la cultura neurona con lavados de solo 1,5 mL de etanol 50%, 70% y 90%, durante 7 minutos en cada uno y luego 3 lavados de 1,5 mL de etanol de 100% durante 7 min en una campana de humos. Bisphenol-A-(epichlorhydrin) de 485 mL/L de mezcla de
- resina de epoxy, 160 mL/L dodecenilo succínico, anhídrido (DDSA), de 340 mL/L-metil-5-Norbornene-2, 3-Dicarboxylic fenol 2,4,6-tris (dimethylaminomethyl) anhídrido (NMA) y 15 mL/L (DMP-30) para crear el epoxi resina. Mezcla bien, luego almacenar bajo vacío para eliminar las burbujas de aire.
Nota: Es fundamental para eliminar las burbujas de aire en la resina, especialmente los inferiores visibles a simple vista, ya que pueden causar caries en la resina durante el seccionamiento. - La muestra sustituyendo el etanol con 50% de epoxy de la resina en etanol por 30 min a temperatura ambiente en un agitador, entonces el 70% de epoxy resina en etanol durante 30 min a temperatura ambiente en un agitador infiltrado.
- Interruptor el epoxi resina solución con resina de epoxy del 100% e incubar 10 min a intercambios de realizar dos de 50 ° C. de resina epoxi 100% fresco con incubaciones por 1 h a 50 ° C. agregar dulce 100% de epoxy resina y deje que se endurezca a 50 ° C durante la noche y luego en el 60 y el #17 6; C de más de 36 h a.
- Con un joyero, retire cada muestra de la placa de la pozo muti ' Serrucho s. Seleccione las regiones de interés, las concentraciones densas de células, utilizando un microscopio de luz invertido y luego cortar bloques de 70 a 80 nm de seccionamiento por micrótomo. Monte de la región de corte en el mandril para Microtomo y carga el microtomo. Coloque el portabrocas en el microtomo y Monte un cuchillo del diamante con el borde paralelo a la superficie del bloque. Recoge secciones de espesor de 70 a 80 nm directamente sobre rejillas individuales.
- Acetato de uranilo se disuelven en agua para una solución al 1% en peso y por separado disolver citrato de plomo en el agua de una solución de 3% en peso. Contratinción las secciones por sumersión con acetato de uranilo acuosa 1% por 15 min y citrato de plomo acuosa 3% durante 5 minutos mejorar el contraste de las muestras.
- Proyección de imagen de EM
- examinar las secciones con un microscopio electrónico de transmisión y grabar imágenes con una cámara digital CCD a un aumento primario de 10.000-20, 000 X 3.
- Estadísticas
- realizar un t-test para identificar diferencias significativas al comparar la media y error estándar de medición (SEM) entre el control y las muestras experimentales.
Resultados
Usando el método del portador lípido, SpH se expresó en neuronas hipocampales, lo que permite la identificación de los botones (Figura 1a). Estimulación eléctrica de las células inducido por exocitosis y un correspondiente aumento en la intensidad de la fluorescencia. El aumento de fluorescencia (ΔF) fue detenido por fin el estímulo (Figura 1b). El aumento de la fluorescencia fue seguida por un lento descenso, debido a l...
Discusión
Aquí muestran dos métodos para el monitoreo de endocitosis vesícula sináptica. En el primer método, supervisamos pHluorin fusionado con una proteína de la vesícula sináptica en neuronas transfected y posteriormente eléctricamente estimulados. En segundo lugar, utilizamos proyección de imagen de EM de la absorción HRP como inducidas por KCl. Utilizamos diversos estímulos por dos razones. En primer lugar, aplicación de alto potasio induce la despolarización de todas las neuronas en la cultura. Esto facilita e...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos Dr. Yong Ling Zhu prevén construir pHluorin2x synaptophysin y el Dr. James E. Rothman proporcionando VAMP2-phluorin. Agradecemos a Dr. Susan Cheng y Virginia Crocker de NINDS microscopia electrónica por su soporte técnico y ayuda. Este trabajo fue financiado por el Instituto Nacional de desórdenes neurológicos y movimiento programa de investigación intramuros en Estados Unidos y una beca del programa de iniciativa de KRIBB en investigación (Coreano biomédico científico programa de becas), Instituto de investigación de Corea de Biociencia y biotecnología, República de Corea.
Materiales
| Name | Company | Catalog Number | Comments |
| Lipofectamine LTX with Plus | Thermo Fisher | 15338-100 | Transfection of plasmid DNA including synaptophysin or VAMP2-pHluorin |
| neurobasal medium | Thermo Fisher | 21103-049 | Growth medium for neuron, Warm up to 37°C before use |
| B27 | Thermo Fisher | 17504-044 | Gradient for neuronal differentiation |
| Glutamax | Thermo Fisher | 35050-061 | Gradient for neuronal culture |
| Poly-D-Lysine coated coverslip | Neuvitro | GG-25-pdl | Substrate for neuronal growth and imaging of pHluorin |
| Trypsin XI from bovine pancrease | Sigma | T1005 | Neuronal culture-digest hippocampal tissues |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025 | Neuronal culture-inhibits viscous cell suspension |
| pulse stimulator | A-M systems | model 2100 | Apply electrical stimulation |
| Slotted bath with field stimulation | Warner Instruments | RC-21BRFS | Apply electrical stimulation |
| stimulus isolation unit | Warner Instruments | SIU102 | Apply electrical stimulation |
| lubricant | Dow corning | 111 | pHluorin imaging-seal with coverslip and imaging chamber, avoid leak from chamber |
| AP5 | Tocris | 3693 | Gradient for normal saline, selective NMDA receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| CNQX | Tocris | 190 | Gradient for normal saline, competitive AMPA/kainate receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| Illuminator | Nikon | C-HGFI | Metal halide light source for pHluorin |
| EMCCD camera | Andor | iXon3 | pHluorin imaging, detect pHluorin fluorescence intensity |
| Inverted microscopy | Nikon | Ti-E | Imaging for synaptophysin or VAMP2 pHluorin transfected cells |
| NIS-Elements AR | Nikon | NIS-Elements Advanced Research | Software for imaging acquisition and analysis |
| Igor Pro | WaveMetrics | Igor pro | Software for imaging analysis and data presentation |
| imaging chamber | Warner Instruments | RC21B | pHluorin imaging, apply field stimulation on living cells |
| poly-l-lysine | Sigma | P4832 | Electron microscopy, substrate for neuronal growth, apply on multiwell plate for 1 h at room temperature then wash with sterilized water 3 times |
| Horseradish peroxidase(HRP) | Sigma | P6782 | Electron microscopy, labeling of endocytosed synaptic vesicles by catalyzing DAB in presence hydrogen peroxide, final concentration is 5 mg/mL in normal saline, make fresh before use |
| Na cacodylate | Electron Microscopy Sciences | 12300 | Electron microscopy, buffer for fixatives and washing, final concentration is 0.1 N |
| 3,3′-Diaminobenzidine(DAB) | Sigma | D8001 | Electron microscopy, labeling of endocytosed synaptic vesicles, substrate for HRP, final concentration is 0.5 mg/mL in DDW and filtered, make fresh before use |
| Hydrogen peroxide solution | Sigma | H1009 | Electron microscopy, labeling of endocytosed synaptic vesicles by inducing HRP-DAB reaction, final concentration is 0.3% in DDW, make fresh before use |
| glutaraldehyde | Electron Microscopy Sciences | 16365 | Electron microscopy, fixatives, final concentration is 4% in Na-cacodylate buffer, make fresh before use, shake well before to use |
| TEM | JEOL | 200CX | Electron microscopy, imaging of endocytosed vesicles and ultrastructural changes |
| CCD digital camera | AMT | XR-100 | Electron microscopy, capturing images |
| Lead citrate | Leica microsystems | 16707235 | Electron microscopy, grid staining |
Referencias
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nature cell biol. 2 (4), 197-204 (2000).
- Sun, T., Wu, X. S., et al. The role of calcium/calmodulin-activated calcineurin in rapid and slow endocytosis at central synapses. J Neurosci. 30 (35), 11838-11847 (2010).
- Wu, X. -. S. S., Lee, S. H., et al. Actin Is Crucial for All Kinetically Distinguishable Forms of Endocytosis at Synapses. Neuron. 92 (5), 1020-1035 (2016).
- Granseth, B., Odermatt, B., Royle, S. J., Lagnado, L. Clathrin-mediated endocytosis is the dominant mechanism of vesicle retrieval at hippocampal synapses. Neuron. 51 (6), 773-786 (2006).
- Atluri, P. P., Ryan, T. A. The kinetics of synaptic vesicle reacidification at hippocampal nerve terminals. J Neurosci. 26 (8), 2313-2320 (2006).
- Royle, S. J., Granseth, B., Odermatt, B., Derevier, A., Lagnado, L. Imaging phluorin-based probes at hippocampal synapses. Methods Mol Biol. 457, 293-303 (2008).
- Moulder, K. L., Mennerick, S. Reluctant vesicles contribute to the total readily releasable pool in glutamatergic hippocampal neurons. J Neurosci. 25 (15), 3842-3850 (2005).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptopHluorin. Proc Natl Acad Sci U S A. 102 (17), 6131-6136 (2005).
- Morris, R. G. Elements of a neurobiological theory of hippocampal function: the role of synaptic plasticity, synaptic tagging and schemas. Eur J Neurosci. 23 (11), 2829-2846 (2006).
- Sankaranarayanan, S., Ryan, T. A. Calcium accelerates endocytosis of vSNAREs at hippocampal synapses. Nat Neurosci. 4 (2), 129-136 (2001).
- Balaji, J., Armbruster, M., Ryan, T. A. Calcium control of endocytic capacity at a CNS synapse. J Neurosci. 28 (26), 6742-6749 (2008).
- Ferguson, S. M., Brasnjo, G., et al. A selective activity-dependent requirement for dynamin 1 in synaptic vesicle endocytosis. Science. 316 (5824), 570-574 (2007).
- Baydyuk, M., Wu, X. S., He, L., Wu, L. G. Brain-derived neurotrophic factor inhibits calcium channel activation, exocytosis, and endocytosis at a central nerve terminal. J Neurosci. 35 (11), 4676-4682 (2015).
- Wu, X. S., Zhang, Z., Zhao, W. D., Wang, D., Luo, F., Wu, L. G. Calcineurin is universally involved in vesicle endocytosis at neuronal and nonneuronal secretory cells. Cell Rep. 7 (4), 982-988 (2014).
- Zhang, Z., Wang, D., et al. The SNARE proteins SNAP25 and synaptobrevin are involved in endocytosis at hippocampal synapses. J Neurosci. 33 (21), 9169-9175 (2013).
- Wu, L. -. G. G., Hamid, E., Shin, W., Chiang, H. -. C. C. Exocytosis and endocytosis: modes, functions, and coupling mechanisms. Annu Rev Physiol. 76 (1), 301-331 (2014).
- Daniele, F., Di Cairano, E. S., Moretti, S., Piccoli, G., Perego, C. TIRFM and pH-sensitive GFP-probes to evaluate neurotransmitter vesicle dynamics in SH-SY5Y neuroblastoma cells: cell imaging and data analysis. J Vis Exp. (95), e52267 (2015).
- Shaner, N. C., Lin, M. Z., et al. Improving the photostability of bright monomeric orange and red fluorescent proteins. Nat Methods. 5 (6), 545-551 (2008).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Leitz, J., Kavalali, E. T. Fast retrieval and autonomous regulation of single spontaneously recycling synaptic vesicles. Elife. 3, e03658 (2014).
- Bisht, K., El Hajj, H., Savage, J. C., Sánchez, M. G., Tremblay, M. -. &. #. 2. 0. 0. ;. Correlative Light and Electron Microscopy to Study Microglial Interactions with β-Amyloid Plaques. J Vis Exp. (112), e54060 (2016).
- Schikorski, T. Monitoring Synaptic Vesicle Protein Sorting with Enhanced Horseradish Peroxidase in the Electron Microscope. High-Resolution Imaging of Cellular Proteins: Methods and Protocols. , 327-341 (2016).
- Kononenko, N. L., Puchkov, D., et al. Clathrin/AP-2 mediate synaptic vesicle reformation from endosome-like vacuoles but are not essential for membrane retrieval at central synapses. Neuron. 82 (5), 981-988 (2014).
- Wu, Y., O'Toole, E. T., et al. A dynamin 1-, dynamin 3- and clathrin-independent pathway of synaptic vesicle recycling mediated by bulk endocytosis. eLife. 2014 (3), e01621 (2014).
- Heuser, J. E., Reese, T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J Cell Biol. 57 (2), 315-344 (1973).
- Ceccarelli, B., Hurlbut, W. P., Mauro, A. Turnover of transmitter and synaptic vesicles at the frog neuromuscular junction. J Cell Biol. 57 (2), 499-524 (1973).
- Watanabe, S., Rost, B. R., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S., Trimbuch, T., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
- Sankaranarayanan, S., Atluri, P. P., Ryan, T. A. Actin has a molecular scaffolding, not propulsive, role in presynaptic function. Nat Neurosci. 6 (2), 127-135 (2003).
- Zhu, Y., Xu, J., Heinemann, S. F. Two pathways of synaptic vesicle retrieval revealed by single-vesicle imaging. Neuron. 61 (3), 397-411 (2009).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Arnao, M. B. B., Acosta, M., del Rio, J. A. A., García-Cánovas, F. Inactivation of peroxidase by hydrogen peroxide and its protection by a reductant agent. Biochim Biophys Acta. 1038 (1), 85-89 (1990).
- Deák, F., Schoch, S., et al. Synaptobrevin is essential for fast synaptic-vesicle endocytosis. Nat Cell Biol. 6 (11), 1102-1108 (2004).
- Clayton, E. L., Evans, G. J. O., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J Neurosci. 28 (26), 6627-6632 (2008).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nat Neurosci. 17 (1), 10-16 (2014).
- Wienisch, M., Klingauf, J. Vesicular proteins exocytosed and subsequently retrieved by compensatory endocytosis are nonidentical. Nat Neurosci. 9 (8), 1019-1027 (2006).
- Fernández-Alfonso, T., Kwan, R., Ryan, T. A. Synaptic vesicles interchange their membrane proteins with a large surface reservoir during recycling. Neuron. 51 (2), 179-186 (2006).
- Gimber, N., Tadeus, G., Maritzen, T., Schmoranzer, J., Haucke, V. Diffusional spread and confinement of newly exocytosed synaptic vesicle proteins. Nat Commun. 6, 8392 (2015).
- Nicholson-Fish, J. C., Smillie, K. J., Cousin, M. A. Monitoring activity-dependent bulk endocytosis with the genetically-encoded reporter VAMP4-pHluorin. J Neurosci Methods. 266, 1-10 (2016).
- Burrone, J., Li, Z., Murthy, V. N. Studying vesicle cycling in presynaptic terminals using the genetically encoded probe synaptopHluorin. Nat Protoc. 1 (6), 2970-2978 (2006).
- Wisse, E., Braet, F., et al. Fixation methods for electron microscopy of human and other liver. World journal of gastroenterology. 16 (23), 2851-2866 (2010).
- Magidson, V., Khodjakov, A. Circumventing Photodamage in Live-Cell Microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Søndergaard, C. R., Garrett, A. E., et al. Structural artifacts in protein-ligand X-ray structures: implications for the development of docking scoring functions. J Med Chem. 52 (18), 5673-5684 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados