A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام رقاقة حاسة الشم تكييف موائع جزيئية لتصوير نشاط الخلايا العصبية في الرد على الفيرومونات في الذكور ايليجانس جيم رئيس الخلايا العصبية
In This Article
Summary
يتم وصف استخدام تكييف "رقاقة حاسة الشم" لتصوير الكالسيوم كفاءة الذكور C. ايليجانس هنا. وترد أيضا دراسات التعرض الذكور والغليسيرول وفرمون.
Abstract
استخدام مؤشرات الكالسيوم عزز إلى حد كبير فهمنا لديناميات العصبية والتنظيم. ديدان أسطوانية ايليجانس كاينورهابديتيس، مع الجهاز العصبي تماما المعينة والتشريح شفافة، يقدم نموذجا مثاليا لفهم ديناميات العصبية في الوقت الحقيقي باستخدام مؤشرات الكالسيوم. في تركيبة مع التكنولوجيات موائع جزيئية وتصاميم تجريبية، يتم تنفيذ دراسات الكالسيوم-التصوير باستخدام هذه المؤشرات في الحيوانات التحرك الحر والمحاصرين. بيد أن معظم الدراسات السابقة استخدام الأجهزة الملائمة، مثل رقاقة حاسة الشم الموصوفة في Chronis et al.، الأجهزة المصممة للاستخدام في خنثي أكثر شيوعاً، كما ذكر أقل شيوعاً على حد سواء شكلياً وهيكليا متباينة. رقاقة إلكترونية حاسة الشم تكييف صمم وملفقة لزيادة الكفاءة في تصوير الخلايا العصبية الذكور مع استخدام الحيوانات البالغين الشباب. قد أدرجت بدوره الدودة تحميل المنفذ لتدوير الحيوانات والسماح لفصل الخلايا العصبية الفردية داخل زوج ثنائية في 2D التصوير. الديدان تتعرض لمراقبة تدفق الرائحة داخل الجهاز موائع جزيئية، كما هو مبين في الدراسات السابقة خنثي. ويتم تحليل العابرين الكالسيوم ثم استخدام البرمجيات المفتوحة المصدر إيماجيج. يجب السماح الإجراء الموضح هنا لزيادة كمية المستندة إلى ذكر C. ايليجانس الكالسيوم التصوير الدراسات، تعميق فهمنا لآليات الإشارات العصبية الخاصة بالجنس.
Introduction
توفر أجهزة موائع جزيئية زيادة الوصول إلى البيئات التي تسيطر عليها تحديداً، حيث الحيوانات، مثل ديدان أسطوانية C. ايليجانس، يمكن أن يكون تجريبيا التلاعب1. وتشمل هذه الدراسات فحوصات السلوكية، ودراسات التصوير الكالسيوم، أو عروض حتى لتعمل محددة، أسفر عن قياسات أكثر دقة للنتائج التجريبية1،2،،من34، 5،6. ميكروفلويديكس توفير ظروف السائل صغيرة يمكن من خلالها تشغيل التجارب التفصيلية بينما تستخدم كميات ضئيلة من الكواشف. هناك إنتاج مستمر لتصميمات الجهاز موائع جزيئية جديدة، ويختلف استخدام كل من الساحات التي تسمح للحركة الجيبية الطبيعية من C. ايليجانس في فحوصات السلوكية والعصبية دراسات التصوير، إلى اعتراض الأجهزة المستخدمة في التصوير العصبية ودراسات حاسة الشم، إلى الأجهزة التي تسمح لتحليل المظهرية الفائق في الوراثية شاشات4،5،،من67. عقب تلفيق العفن الرئيسية، أجهزة موائع جزيئية غير مكلفة لبناء – نظراً لإعادة استخدام الرئيسي – وسهلة الاستخدام، مما يسمح لتوليد البيانات بسرعة عن طريق دراسات الفائق. تصنيع الأجهزة باستخدام البوليمرات مثل بولي دايمثيل سيلوكسان (PDMS) يسمح بإنشاء أجهزة جديدة في غضون ساعات.
استخدام دراسات التصوير الكالسيوم الكالسيوم وراثيا المرمزة المؤشرات (جيسيس) أعربت في الخلايا الهدف لقياس ديناميات العصبية من تلك الخلايا في الوقت الحقيقي8،9،،من1011. طبيعة شفافة C. ايليجانس يسمح لتسجيل مستويات هذه البروتينات في الحيوانات الحية الفلورسنت. تقليديا، جيسيس تعتمد على البروتينات الفلورية الخضراء (التجارة والنقل)-على أساس الاستشعار بروتينات فلورية خضراء-كالمودولين-M13 "الببتيد" (جكامب)، على الرغم من أن الدراسات الأخيرة قد تكيفت هذه المجسات للسماح لأفضل إشارة إلى الضوضاء النسب وملامح الإثارة تحول الأحمر. بعد وضع GCaMP3، قد اختلفت البروتينات بتلك المواصفات، بما في ذلك أجهزة الاستشعار مثل GCaMP6s و GCaMP6f (بطيئة وسريعة fluorescence قبالة-معدلات، على التوالي)، فضلا عن طلب تقديم العروض-كالمودولين-M13 "الببتيد" (ركامب)، التي قد تحول الأحمر تفعيل الشخصية. المزيج من هذه جيسيس مع C. ايليجانس الجينات الخاصة بخلية المروج تسلسل يمكن استهداف الخلايا ذات الاهتمام، والخلايا العصبية الحسية وبخاصة12،13،،من1415 , 16.
بينما يتضح سهولة الاستخدام C. ايليجانس في الدراسات موائع جزيئية، وتقريبا جميع الدراسات ركزت على المنحرفين. وعلى الرغم من الذكور فقط تمثل 0.01-0.02% من السكان نوع البرية، يمكن أن تنشأ نتائج لا تقدر بثمن من تكييفها. بينما تم تعيين الشبكة العصبية المادية للجهاز العصبي خنثي بالكامل لعقود17، ما زالت عصبية الذكور غير مكتملة، لا سيما في منطقة الرأس من الحيوان18. استخدام تصوير الكالسيوم في الذكور سيساعد على توليد فهم في الجهاز العصبي الذكور والخلافات التي تنشأ بين الجنسين. حجم أصغر من الذكور البالغين C. ايليجانس يمنع تعويض فعالة وموثوق بها في موانئ تحميل أجهزة الشم التقليدية مصممة للمنحرفين أكبر. لمعالجة هذا الوضع، نسخة معدلة من رقاقة حاسة الشم Chronis19 تم تطويره باستخدام منفذ تحميل أضيق، ارتفاع قناة الدنيا، ويتحول في دودة ميناء التحميل (التي تدوير الحيوان)، مما يسمح للتصور من الثنائية يسار/يمين أزواج الخلايا العصبية. يسمح هذا التصميم: (1) تعويض فعالة من الشباب الذكور البالغين، (2) اتجاه أكثر موثوقية من الحيوان للتصور من كل أعضاء الخلايا العصبية الاقتران الثنائي، و (3) التصوير الدقيق للنشاط العصبي في الخلايا العصبية الذكور.
متزايدة، تشير الدراسات إلى أن الذكور C. ايليجانس يستجيب بطريقة مختلفة عن المنحرفين لمجموعة متنوعة من أسكاروسيديس (عسكر)، أو ديدان أسطوانية الفيرومونات20،،من2122،23 ،24. ولذلك، أصبح تطوير فهم ديناميات العصبية والتمثيل داخل الشبكة العصبية الذكور حتى أكثر صلة بالموضوع. الذكور C. ايليجانس تحتوي على 87 من الخلايا العصبية الخاصة بالجنس غير موجود في خنثي25،26، تغيير الشبكة العصبية في وصفها-طرق لم يحدد حتى الآن. التمكن من صورة هذه الديناميات العصبية فريدة من نوعها سوف تسمح لنا بفهم أفضل للردود الخاصة بالجنس وتمثيلات العصبية.
يصف هذا البروتوكول استخدام شريحة حاسة الشم أنثى-تكييفها لتصوير العصبية من الذكور C. ايليجانس تشيموسينسيشن. الدراسات العصبية nociceptive الرماد يستجيب موثوق والغليسيرول 1 م في الذكور، وتتفق مع السابقة hermaphroditic27. التعرض إلى أسكاروسيديس يمكن الحصول على ردود التي متغير من الحيوان للحيوان، التي تتطلب عددا أكبر من الحيوانات لفحصها. سابقا قد تبين استجابة الخلايا العصبية جيم خاصة بالذكور، من خلال الكهربية والكالسيوم التصوير الدراسات، الاستجابة مغايرة أسكاروسيدي #323.
Access restricted. Please log in or start a trial to view this content.
Protocol
1-"تصنيع جهاز"
ملاحظة: انظر المرجع 1.
ملاحظة: قوالب السليكون الرئيسية كانت ملفقة استخدام تقنيات فوتوليثوغرفيك القياسية للزخرفة سو-8 مقاوم الضوء على سليكون رئيسي 1 ، 7. وطبعت فوتوماسكس للزخرفة ويفر على 25,000 نقطة في البوصة. تصميم الجهاز تتكيف مع ذكر ميزات شريحة حاسة الشم Chronis 19 مع تغيير في الدودة تحميل المنفذ، وتكييف تصميم التي تم الحصول عليها من م. زيمر (المراسلات الشخصية، 2016). ويرد بدوره للتحكم التناوب للحيوانات. هو تضييق عرض الدودة تحميل قناة الميناء إلى 50 ميكرومتر. جميع القنوات القامة 32 ميكرومتر. مجرد العفن رئيسي سيليكون متوفرة للمستخدم، المستخدم يمكن اتبع بعد ذلك البروتوكول، كما هو موضح سابقا 1.
- PDMS ميكس قاعدة وعلاج عامل بنسبة 10:1 بالوزن.
- مزيج دقيق مع نقل الممصات.
- ديغا المخلوط في مجفف فراغ ح 1، حتى تتم إزالة جميع فقاعات مرئية.
- صب الخليط على سيد سليكون العفن في صحن قطرها 150 مم حتى 5 مم (100 غرام). استخدام ماصة باستور لإزالة أي فقاعات أو الغبار التي أدخلت إلى الخليط.
- خبز عند 65 درجة مئوية على الأقل 3 ح، أو بين عشية وضحاها.
- قطع PDMS بعيداً عن القالب باستخدام مشرط وقطع أجهزة منفصلة عن بعضها البعض باستخدام شفرة حلاقة.
- لكمه ثقوب مدخل ومخرج لكمه الجلد 1 مم-
- استواء الثقوب مع dH 2 س، الإيثانول، ومرة أخرى مع dH 2 س لإزالة الجسيمات من اللكمات. الجهاز في نبض تيار هواء الجاف-
- تنظيف قناة الجانبين والجانب العلوي من الجهاز بشريط لاصق، إزالة أي غبار أو الحطام المتبقي على الجهاز للسماح للرابطة ناجحة.
- البلازما-بوند الجهاز، القناة-الجانب الأسفل، لزجاج غطاء رقم 1-
- فضح تغطية الزجاج والجهاز (القناة-الجانب الأعلى) للبلازما الجوية باستخدام الشروط التي تسمح للربط السليم، مثل 100 واط لمدة 30 ثانية أو 24 ث ل 60 س.
ملاحظة: يمكن ضبط الإعدادات لتحسين كفاءة الربط. ظروف البلازما-الترابط ليست ذات أهمية حاسمة كالتنظيف الصحيح عند محاولة لتحسين كفاءة الترابط. جهاز تنظيف كاف سوف لا السندات، حتى في ظل ظروف مثالية البلازما. - عكس الزجاج غطاء على جانب القناة للجهاز واضغط لأسفل مع الإبهام 5 س.
- فضح تغطية الزجاج والجهاز (القناة-الجانب الأعلى) للبلازما الجوية باستخدام الشروط التي تسمح للربط السليم، مثل 100 واط لمدة 30 ثانية أو 24 ث ل 60 س.
2. المخزن المؤقت إعداد
- ديلوتى 1 x S القاعدية (100 ملم كلوريد الصوديوم و 0.05 متر مكعب مشرف 4، pH 6.0) من أسهم x 10 عقيمة.
- تمييع 1 م تيتراميسولي الأسهم لتركيز نهائي من 1 ملم في 1 x S القاعدية لكل المخزن المؤقت الحلول.
- إضافة فلوريسسين على حد سواء " التحكم بالانسياب " و " المخزن المؤقت " الخزانات.
- إنشاء مخزون 100 مغ/مل من فلوريسسين في 1 العاشر القاعدية S-
- تمييع المخزون النهائي بتركيزات 1 ميكروغرام/مل في التحكم بالانسياب و 0.1 ميكروغرام/مل في المخزن المؤقت-
- خلق المحفزات.
- والغليسيرول مخفف بتركيز نهائي 1 م في 1 العاشر القاعدية S-
- أسكاروسيدي #3 (عسكر #3) مخفف بتركيز 1 ميكرومتر نهائي إلى 1 X S القاعدية.
3. إعداد الجهاز
ملاحظة: انظر 1-

الرقم 1. إعداد الجهاز موائع جزيئية. (أ) الخزانات والأنابيب. 30 مل المحاقن دون المكبس بمثابة " الخزان. " هذا متصل بصمام اللوير مع تدفق الخيارات الثلاثة. منفذ واحد متصل بحقنه 3 مل مع المكبس، بينما الآخر متصل بإبرة (برتقالي) التي يتم إدراجها في الأنبوب الذي يصل إلى الجهاز موائع جزيئية. (ب) الإجمالي الإعداد موائع جزيئية تصوير التجربة. يتم وضع الجهاز في مرحلة من مراحل المجهر المقلوب ابيفلوريسسينسي، فوق العدسات الهدف. " التحكم بالانسياب " المخزن المؤقت ينتقل عن طريق صمام 3-الطريقة التي يتم التحكم بواسطة وحدة على الرف فوق الإعداد. ثم يتم إدراج الأسطر التي تحتوي على مخازن في منافذ الجهاز المناسب. (ج) منافذ الجهاز موائع جزيئية. " التحكم بالانسياب " منافذ الجناح مدخل الموانئ الأخرى: " التحفيز " و " المخزن المؤقت " الموانئ. " منفذ " والمنفذ هو منفذ أقصى اليمين. ونظرا لموقع الساحة تحميل دودة، " دودة تحميل " المنفذ هو منفذ معظم الوسطى على الجهاز. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- تحضير ثلاثة خزانات السوائل عن طريق إرفاق حقنه مل 30 أو 60 3-طريقة نظام صمام، مع 3 مل حقنه وابرة تعلق على صمام اللوير كذلك (كما هو الحال في الشكل 1A). توصيل الإبرة للأنابيب التي تمتد إلى الجهاز موائع جزيئية (كما هو الحال في الشكل 1A -ب)-
- إزالة فقاعات الهواء من الخزان والأنابيب-
- ملء المحاقن 3 مل مع أنابيب المرفقة مع 1 x S القاعدية وأدخله في المنفذ منفذ
- بلطف تطبيق الضغط على المحاقن حتى المخزن المؤقت الذي يظهر في الجزء العلوي من فتحات مدخل-
- الاتصال التحكم بالانسياب والمخزن المؤقت وأنابيب التحفيز ثقوب الفتحة المناسبة (كما هو الحال في الشكل 1B -ج)، ضمان أن قطرات السائل موجودة في كل ميناء التحميل ثقب والأنابيب العازلة ترفق.
- مرة أخرى، تطبيق الضغط بلطف على المحاقن متصل بالمنفذ منفذ حتى تظهر قطرات في الدودة تحميل مدخل الميناء-
- أدخل pin حظر صلبة إلى الدودة تحميل منفذ
- إزالة المحاقن من المنفذ منفذ وإرفاق منفذ خط متصل بفراغ البيت (تور-670)-
- فحص الجهاز لأي فقاعات في التدفق القنوات، بصريا، ومن خلال تأكيد الفيديو عن طريق برنامج متوافق مع الكاميرا المستخدمة، مثل برمجيات المصدر المفتوح المهد الصغير. راجع الخطوة 6 للحصول على تلميحات حول استخدام مايكرو-مدير-
- في حالة وجود أي فقاعات، انتظر منهم إزاحة أو يتم استيعابهم في PDMS الحائط قبل تحميل أي الحيوانات؛ ووجود فقاعات سوف يزعج التدفق السليم للسوائل من خلال الجهاز-
- باستخدام عامل تصفية بروتينات فلورية خضراء، تأكيد ديناميات التدفق السليم داخل الجهاز قبل دودة تحميل تشغيل صمام ثلاثي ومراقبة التحويل من المخازن المؤقتة.
- تحديد ديناميات التدفق السليم: مراقبة fluorescein الحالية في حلول المخزن المؤقت للتحكم في تدفق ( الشكل 2D --2E) تغيير عند تغيير قيمة عنصر تحكم تدفق بالضغط على عنصر التحكم الزر المقابل لصمام ثلاثي على الارتباط صمام ( الشكل 1B).
- بعد فتح الصغيرة-إدارة، انقر فوق في " لايف " لمراقبة صورة حية للجهاز. قم بتشغيل مصدر الضوء الفلورية لمراقبة تدفق المخازن المؤقتة في الجهاز ( الشكل 2D --2E).
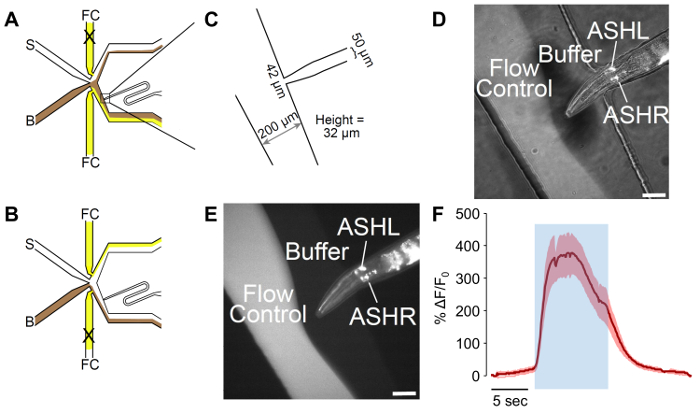
شكل 2: تكييف أنثى موائع جزيئية حاسة الشم شريحة. (أ) التدفق أنماط الجهاز عندما يتعرض الدودة إلى المخزن المؤقت. المخزن المؤقت (ب) ويرد في براون، والتحكم بالانسياب (FC) يظهر باللون الأصفر، مع الحوافز (S) بالأبيض. قد تم تكييف الدودة تحميل المنفذ ليشمل منحنى، التي تسمح بتحكم أفضل في اتجاه دودة. (ب) التدفق أنماط الجهاز عندما يتعرض الدودة للتحفيز. المخزن المؤقت (ب) ويرد في براون، والتحكم بالانسياب (FC) يظهر باللون الأصفر، مع الحوافز (S) بالأبيض. (ج) قياسات جهاز تكييف ملفقة. الدودة تحميل المنفذ ينتهي في مكم 42 فتح، مع 50 ميكرون قناة مصممة لعرض الذكور. ارتفاع يقاس من القنوات هو 32 ميكرون، رغم هدفا من 25 ميكرومتر في التصميم. (د-ه) المحاصرين بالذكور إذ تعرب عن ف sra-6:: GCaMP3. مروج sra-6 غير الخاصة بالرماد، ويمكن ملاحظة بعض التعبير في العصبية عاصي، على الرغم من أن لا العابرين الكالسيوم وقد لوحظت في وكالة الفضاء الإيطالية. الصورة هي (د) مزيج من الإضاءة المشرقة الميدانية ونيون، بينما الفلورسنت (ه) فقط. أشرطة مقياس الدلالة 42 ميكرومتر. (و) "الرماد" العصبية يستجيب للتحفيز والغليسيرول م 1 مع قوي النشاط العصبي. منطقة الأزرق يشير إلى وقت التحفيز والغليسيرول م 1. المنطقة المظللة تشير إلى الخطأ القياسي، مع n = 20 البقول من الديدان السبعة. آثار حمراء تدل على الاستجابات ديبولاريزينج. وتظهر ياكسيس ΔF/و 0. شريط مقياس ترمز إلى 5 س. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
4-"إعداد الحيوانات"
ملاحظة: انظر مرجع 23-
- الردود "التصوير الرماد" إلى والغليسيرول 1 م.
- مكان ما يقرب من 20 C. ايليجانس الذكور التي إيجابية ف sra-6:: GCaMP3 صفيف التعبير على طبق أجار (NGM) متوسط نمو السلكية المصنف مع حشيش OP50 كولاي. استخدم التعبير عن جيتشي الفلورسنت و/أو علامة حقن المشارك للتعرف على الحيوانات الإيجابية الصفيف.
ملاحظة: سوف فلوريس الصفيف الحيوانات الإيجابية وفقا جيتشي المستخدمة (أي الحيوانات معربا عن جكامب سوف فلوريس الخضراء تحت الضوء الأزرق التحفيز، بينما سوف فلوريس الحيوانات ركامب الأحمر تحت الضوء الأخضر التحفيز). يمكن أن تتراوح من البروتينات الفلورية الأخرى، مثل التجارة والنقل وطلب تقديم العروض، إلى علامات المظهرية، مثل رول-6، علامات الحقن المشارك أو يمكن إنقاذ النمط الظاهري مهيمنة، مثل الطفرة فا-1 28.- إذا كان الانتقاء مباشرة قبل الفحص، اختيار الشباب الذكور البالغين. إذا كان الانتقاء في اليوم السابق الفحص، واختيار الذكور اليرقات L4.
- مكان ما يقرب من 20 C. ايليجانس الذكور التي إيجابية ف sra-6:: GCaMP3 صفيف التعبير على طبق أجار (NGM) متوسط نمو السلكية المصنف مع حشيش OP50 كولاي. استخدم التعبير عن جيتشي الفلورسنت و/أو علامة حقن المشارك للتعرف على الحيوانات الإيجابية الصفيف.
- التصوير الردود جيم إلى 1 ميكرومتر عسكر #3-
- بيك قرابة 20 L4 C. ايليجانس الذكور (fkEx98 [ف pkd-2::GCaMP::SL2::dsRED + مقسم-1]؛ فا--1 (e2123ts)؛ 5-له (e1490)؛ لايت 1 (ce314)) إيجابية للتعبير علامة حقن المشارك دسريد.
ملاحظة: التعبير دسريد داخل الخلايا العصبية رأي حكاية الذكور أسهل لمراقبة والتأكد من التعبير جكامب داخل الخلايا العصبية جيم الأربعة- - عزل هذه الذكور من المنحرفين على صفيحة أجار NGM المصنف مع حشيش OP50 كولاي ح 5-14 قبل القيام بتجربة التصوير-
ملاحظة: الذكور غير معزولة للحد ني ح 5 لا تستجيب سلوكيا أسكر #3 وقد يحمل ذلك العابرين الكالسيوم أقل أسكاروسيدي مما لوحظ هنا.
- بيك قرابة 20 L4 C. ايليجانس الذكور (fkEx98 [ف pkd-2::GCaMP::SL2::dsRED + مقسم-1]؛ فا--1 (e2123ts)؛ 5-له (e1490)؛ لايت 1 (ce314)) إيجابية للتعبير علامة حقن المشارك دسريد.
5. تحميل الحيوان
ملاحظة: انظر ريفيفينسي 1-
- بيك دودة واحدة على صفيحة أجار NGM المصنف باستخدام تقنيات الصيانة دودة القياسية.
- بيك الديدان قبل المشتعلة اختيار (مصنوعة من سلك البلاتين مسطح)، التقاط البكتيريا على الانتقاء، و " دابينج " دودة لاستلامه. بلطف ضع الدودة على لوحة جديدة، والسماح لها بالزحف من تلقاء نفسها-
- حوالي 5 مل 1 × القاعدية S بإضافة إلى لوحة المصنف، مثل لوحة غمرت.
- رسم الدودة في تحميل محقن (أي 3 مل المحاقن مع أنابيب المرفقة) التي كانت مليئة قبل 1 العاشر القاعدية S-
- ومن المؤكد أن تمتص الدودة فقط داخل الأنبوب، وليس على طول الطريق في المحاقن.
ملاحظة: إذا كان يسافر الدودة في المحاقن، يكاد يكون من المستحيل الحصول على إعادته إلى الأنبوب.
- ومن المؤكد أن تمتص الدودة فقط داخل الأنبوب، وليس على طول الطريق في المحاقن.
- إيقاف الفراغ إيقاف التدفق طريق صمام مأخذ اللوير.
- إزالة دبوس الصلبة حجب الدودة تحميل منفذ
- تشغيل صمام نظام متصل بالمنفذ منفذ ( الشكل 1B) حيث أن ذلك هو التنفيس.
ملاحظة: استخدام فيديو حية تغذية أثناء تحميل الدودة للتأكد من الموقع والتوجه للحيوان (خطوات 5.8-5.13). - إدراج الدودة تحميل أنبوبة في الدودة تحميل منفذ
- بلطف تطبيق الضغط على المحاقن حتى تظهر الدودة في قناة التحميل.
- إذا الدودة يبدأ بدخول قناة الذيل الأول، سحب المكبس حقنه الحيلولة دون دخول القناة الدودة.
- التبديل بين تطبيق وعكس الضغط حتى يدخل الرئيس القناة الأولى-
- فتح الفراغ عن طريق تحويل صمام ثلاثي اللوير موصولة إلى منفذ مخرج لفتحه لفراغ بدلاً من الغلاف الجوي-
- يدوياً تطبيق الضغط بالاكتئاب المكبس حقنه لتوجيه ووضع رأسه دودة مثل أن يتم عرضه في قناة تدفق المخزن المؤقت، ولكن ليس حتى الآن يمكن أن تتحرك بحرية حول الرأس ( الشكل 2 د-2E).
6. التحفيز واقتناء
- استخدام لبرمجيات المصدر المفتوح مجهرية، مثل مايكرو--مدير، سجل بواسطة التقاط الصور مكدس TIFF في 10 إطارات/ثانية باستخدام الضوء الأزرق الإثارة (470 nm) 30 س.
- ضبط التعرض على القائمة الرئيسية للسيدة 100
- فتح " Acq المتعددة د. " من القائمة الرئيسية للبرنامج. تعيين " عدد " إلى " 300، " و " الفاصل الزمني " إلى " 0. " انقر فوق " اكتساب! " للحصول على شريط الفيديو.
- تطبيق نبضة ق 10 ق التحفيز 5 بعد الشروع في اقتناء. ضبط مدة تطبيق الحوافز حسب الرغبة.
- بعد الحصول على 5 s الفيديو، تغيير صمام 3-طريقة التحكم في تدفق التحكم المخزن المؤقت لتطبيق الحافز للحيوانات يجري اختبارها. انقر فوق الزر أقصى اليمين على الارتباط صمام ( الشكل 1B).
- بعد 10 ثانية من التعرض للتحفيز (ويمكن تعديل هذه المرة النحو المرغوب فيه من قبل المستخدم)، يغير تدفق المخازن المؤقتة بالضغط على زر أقصى اليسار مرة أخرى على رابط صمام.
- سجل تحت المخزن المؤقت فقط حتى يكتمل الإطار 30-s للسماح للأسفار جيتشي للعودة إلى خط الأساس- كرر
- كما هو مطلوب. الانتظار 30 ثانية بين نهاية اقتناء والشروع في المحاكمة القادمة.
7. صورة التحليل
- فتح المكدس TIFF مع برمجيات المصدر المفتوح، إيماجيج، عن طريق سحب الملف إلى إطار إيماجيج. انقر فوق استخدام المؤشر
- واسحب لتحديد المنطقة للفائدة (ROI) حول الخلايا العصبية للفائدة. تعيين المنطقة لتشمل سوما من الخلايا العصبية للفائدة (كما هو الحال في الشكل 3 ألف)-
- مؤامرة z-كومة شدة الأسفار من العائد على الاستثمار عبر مداخن بالنقر فوق فتح-> الصورة-> مداخن-> "الأرض الشخصية محور ع".
- انقر فوق " قائمة " في الإطار الذي يتم فتحه. انقر فوق تحرير-> نسخ لنسخ القيم. قم بلصق القيم إلى برنامج جدول بيانات.
- تحليل fluorescence الخلفية لكل نبضة عن طريق سحب العائد على الاستثمار إلى منطقة الدودة يحتوي على تعبير جكامب-
- تنفيذ الطرح الخلفية لكل نبض بطرح قيمة الأسفار الخلفية من قيمة الكثافة fluorescence العصبية.
- حساب ΔF/و 0 لكل إطار من كل نبضة.
- "و حساب" 0 كقيمة كثافة متوسط العائد على الاستثمار لأول 1 s لاقتناء (مثلاً، إطارات 1-10)-
- حساب ΔF/و 0 بقسمة قيمة خصم معلومات أساسية للإطار للفائدة القيمة المحسوبة 0 و.
- كرر لكل الخلايا العصبية تصويرها وكل نبض التحفيز.
- الخلايا العصبية مع ملامح استجابة متسقة، مثل الرماد، ومتوسط جميع البقول لكل الخلايا العصبية وحساب ووزارة شؤون المرأة (كما هو الحال في الشكل 2 واو)-
- الأرض ΔF متوسط/و 0 مع وزارة شؤون المرأة على مر الزمن لكل الخلايا العصبية.
ملاحظة: في هذه الحالة، ممارسة شائعة لتضمين heatmaps الردود العصبية الفردية لكل محاكمة، وكذلك. في الخلايا العصبية التي لا تظهر التغييرات متسقة في العابرين الكالسيوم عند التعرض لمحفزات عبر التحفيز المتكرر، أو في مختلف الأفراد 23، قد يكون أكثر قابلية للتطبيق لإظهار آثار نبض الفردية (كما هو الحال في الشكل 4). انظر المناقشة للحصول على تفاصيل حول تحديد كيفية عرض البيانات-
Access restricted. Please log in or start a trial to view this content.
النتائج
مثال على إعداد الجهاز عموما يتبين في الشكل 1 ألف-باء. ويصور الشكل 1A تشييد خزان السليم والإعداد. ويبين الشكل 1B اتصالات الخزانات إلى الجهاز موائع جزيئية. ويصور الشكل 1 جهاز موائع جزيئية مع المنافذ الف...
Access restricted. Please log in or start a trial to view this content.
Discussion
رقاقة حاسة الشم تتكيف مع ذكر يتضمن بدوره إلى ميناء تحميل أضيق، مما يسمح للمزيد من السيطرة التوجه وتعويض فعال للذكور C. ايليجانس. وهذا يسمح للتصور من كل من أعضاء اليسار واليمين من أزواج ثنائية الخلايا العصبية، دون الحاجة إلى التراص z. يؤدي هذا المنحنى إلى توجه بعيداً عن رأسي 100% من الوقت ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
نود أن نشكر زيمر مانويل لتزويدنا بملف التصميم الأولية التي تم تكييفها للاستخدام مع الذكور؛ فرانك شرودر للتوليف وإمدادات من عسكر #3؛ لاجوي روس للبصيرة والمساعدة مع التصوير والتحليل؛ ولورا أوريليو لتصنيع الرئيسي ومنظمة الصحة العالمية، جنبا إلى جنب مع كريستوفر المشغلة، ساهمت في استعراض هذه المخطوطة. تم توفير التمويل لهذا العمل ضمن "المعاهد الوطنية للصحة" منحة 1R01DC016058-01 (ج. س.) ومنح المؤسسة الوطنية للعلوم كبة 1605679 (D.R.A.)، و "جائزة الوظيفي ويلكوم بوروز" في واجهة العلمية (D.R.A.).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Silicon Wafer | University Wafer | 452 | |
| SU-8 2035 | MicroChem | Y111070-0500L1GL | |
| Developer | MicroChem | Y020100-4000L1PE | |
| Wafer Mask | Cad/Art Services | - | Custom order. Printed at 25,000 dpi. |
| Sylgard-184 | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| 1.0 mm Dermal Punches | Acuderm Inc. | P150 | |
| Soft Tubing | Cole-Palmer | EW-06419-01 | |
| Hard Tubing | IDEX Health & Science | 1622 | |
| Pins | New England Small Tube | NE-1027-12 | |
| Blocking Pins | New England Small Tube | 0.415/0.425" OD x .500 Long | Batch PB07027 |
| 3 mL syringes | BD | 309657 | |
| 30 mL syringes | Vitality Medical | 302832 | Used as buffer reservoirs. |
| Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer | Component Supply Company | NE-231PL-50 | |
| Stopcocks with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile | Cole-Palmer | EW-30600-07 | |
| Fisherfinest Premium Cover Glass | Fisher Scientific | 12-548-5M | |
| Mercator Control System LF-5 Plasma System | Mercator | LF-5 | |
| Scotch Tape | Scotch | BSN43575 | |
| Series 20 Chamber | Warner Instruments | P-2 | |
| Vacuum Desicator | Bel-Art Scienceware | 420250000 | 24 cm inner diameter. |
| Weigh Boats | Cole-Palmer | EW-01017-27 | |
| Classic Plus Balance | Mettler Toledo | PB1501-S/FACT | |
| Glass Pasteur Pipettes | Cole-Palmer | EW-25554-06 | |
| Transfer pipettes | Genesee Scientific | 30-202 | |
| Oven | Sheldon Manufacturing Inc | 9120993 | Model Number: 1500E. |
| 60 mm, non-vented, sharp edge Petri dishes | TriTech Research | T3308 | |
| Zeiss Axio Observer.A1 | Zeiss | - | |
| Hammamatsu Orca Flash 4.0 Digital CMOS | Hammamatsu | C11440-22CU | |
| Blue Fluorescent Light | Lumencor | SOLA SM6-LCR-SA | 24-30V/7.9A DC. |
| Illumination Adaptor | Zeiss | 423302-0000 | |
| Series 1 and 2 Miniature Inert PTFE Isolation Valve | Parker | 001-0017-900 | 3-way valve for controlling flow. |
| ValveLink8.2® | AutoMate Scientific | 01-18 | Flow Switch Controller |
| Micro Manager | Micro-Manager | - | Free software, can be downloaded at: https://www.micro-manager.org/wiki/Download_Micro-Manager_Latest_Release |
| ImageJ | ImageJ | - | Free software, can be downloaded at: https://imagej.nih.gov/ij/download.html |
| Agar, Bacteriological Grade | Apex | 9012-36-6 | |
| Peptone | Apex | 20-260 | |
| CaCl2 | VWR | BDH0224-1KG | |
| MgSO4 | Sigma-Aldrich | 230391-1kg | |
| Cholesterol | Alfa Aesar | A11470 | |
| Ethanol | Sigma-Aldrich | 270741-4L | |
| Tetramisole | Sigma-Aldrich | L9756-10(G) | Store at 4 °C. |
| Fluorescein | Sigma-Aldrich | FD2000S-250mg | Light Sensitive. Store in photoprotective vials. |
| Glycerol | Sigma-Aldrich | G6279-1L | |
| Ascaroside #3 | - | - | Synthesized in the Schroeder Lab (Cornell University). |
| NaCl | Genesee Scientific | 18-215 | |
| KH2PO4 | BDH | BDH9268.25 | |
| K2HPO4 | J.T. Baker | 3252-025 | |
| ASH GCaMP3 line | - | - | CX10979 (KyEx2865 [psra-6::GCAMP3 @ 100 ng/uL]). Developed in Bargmann lab. Provided from Albrecht Lab library. |
| CEM GCaMP6 line | - | - | JSR49 (FkEx98[ppkd-2::GCaMP::SL2::dsRED + pBX-1]; pha-1(e2123ts); him-5(e1490); lite-1(ce314)). Developed by Robyn Lints. Provided from Srinivasan Lab library. |
| E. coli (OP50) | Caenorhabditis Genetics Center | OP50 | |
| "Reservoir" | - | - | To create a Reservoir: A "30 mL syringe", is connected to a "Stopcock with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile", which is connected to a "3 mL syringe" and a "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer". The "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer" is then inserted into "Soft Tubing" approximately 1/3 of the way down the needle. |
References
- Lagoy, R. C., Albrecht, D. R. Microfluidic Devices for Behavioral Analysis, Microscopy, and Neuronal Imaging in Caenorhabditis elegans. Methods Mol Biol. 1327, 159-179 (2015).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Curr Opin Neurobiol. 19 (5), 561-567 (2009).
- Chronis, N. Worm chips: Microtools for C. elegans biology. Lab on a Chip. 10 (4), 432-437 (2010).
- Lee, H., Crane, M. M., Zhang, Y., Lu, H. Quantitative screening of genes regulating tryptophan hydroxylase transcription in Caenorhabditis elegans using microfluidics and an adaptive algorithm. Integr Biol (Camb). 5 (2), 372-380 (2013).
- Lockery, S. R., et al. A microfluidic device for whole-animal drug screening using electrophysiological measures in the nematode C. elegans. Lab Chip. 12 (12), 2211-2220 (2012).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nat Commun. 7, 13023(2016).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 110 (45), E4266-E4273 (2013).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Front Mol Neuro. 6, 2(2013).
- Badura, A., Sun, X. R., Giovannucci, A., Lynch, L. A., Wang, S. S. H. Fast calcium sensor proteins for monitoring neural activity. Neurophotonics. 1 (2), 025008(2014).
- Tatro, E. T. Brain-wide imaging of neurons in action. Front Neural Circuits. 8, 31(2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat Methods. 6 (12), 875-881 (2009).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Greene, J. S., Dobosiewicz, M., Butcher, R. A., McGrath, P. T., Bargmann, C. I. Regulatory changes in two chemoreceptor genes contribute to a Caenorhabditis elegans QTL for foraging behavior. Elife. 5, (2016).
- Kim, K., et al. Two Chemoreceptors Mediate Developmental Effects of Dauer Pheromone in C. elegans. Science. 326 (5955), 994-998 (2009).
- McGrath, P. T., et al. Parallel evolution of domesticated Caenorhabditis species targets pheromone receptor genes. Nature. 477 (7364), 321-325 (2011).
- Schmitt, C., Schultheis, C., Husson, S. J., Liewald, J. F., Gottschalk, A. Specific Expression of Channelrhodopsin-2 in Single Neurons of Caenorhabditis elegans. PLoS ONE. 7 (8), e43164(2012).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Nervous System of the Nematode Caenorhabditis elegans. Phil Trans of the Royal Soc of Lon. 314 (1165), 1(1986).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat Meth. 4 (9), 727-731 (2007).
- Chute, C. D., Srinivasan, J. Chemical mating cues in C. elegans. Semin Cell Dev Biol. 33, 18-24 (2014).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook. , 1-22 (2013).
- Narayan, A., et al. Contrasting responses within a single neuron class enable sex-specific attraction in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 113 (10), E1392-E1401 (2016).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Sammut, M., et al. Glia-derived neurons are required for sex-specific learning in C. elegans. Nature. 526 (7573), 385-390 (2015).
- Sulston, J. E., Albertson, D. G., Thomson, J. N. The Caenorhabditis elegans male: postembryonic development of nongonadal structures. Dev Biol. 78 (2), 542-576 (1980).
- Hilliard, M. A., et al. In vivo imaging of C. elegans ASH neurons: cellular response and adaptation to chemical repellents. The EMBO Journal. 24 (1), 63-72 (2005).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Cáceres, I. dC., Valmas, N., Hilliard, M. A., Lu, H. Laterally Orienting C. elegans Using Geometry at Microscale for High-Throughput Visual Screens in Neurodegeneration and Neuronal Development Studies. PLoS ONE. 7 (4), e35037(2012).
- Schrodel, T., Prevedel, R., Aumayr, K., Zimmer, M., Vaziri, A. Brain-wide 3D imaging of neuronal activity in Caenorhabditis elegans with sculpted light. Nat Methods. 10 (10), 1013-1020 (2013).
- García, L. R., Portman, D. S. Neural circuits for sexually dimorphic and sexually divergent behaviors in Caenorhabditis elegans. Curr Opin Neurobiol. 38, 46-52 (2016).
- Clokey, G. V., Jacobson, L. A. The autofluorescent "lipofuscin granules" in the intestinal cells of Caenorhabditis elegans are secondary lysosomes. Mech Ageing Dev. 35 (1), 79-94 (1986).
- Coburn, C., et al. Anthranilate Fluorescence Marks a Calcium-Propagated Necrotic Wave That Promotes Organismal Death in C. elegans. PLoS Biology. 11 (7), e1001613(2013).
- Macosko, E. Z., et al. A hub-and-spoke circuit drives pheromone attraction and social behaviour in C. elegans. Nature. 458 (7242), 1171-1175 (2009).
- Park, D., et al. Interaction of structure-specific and promiscuous G-protein-coupled receptors mediates small-molecule signaling in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 109 (25), 9917-9922 (2012).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved