Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование адаптированных Microfluidic обонятельных чип для отображения активности нейронов в ответ на феромоны в мужской C. Elegans головы нейронов
В этой статье
Резюме
Здесь описывается использование адаптированных «обонятельных чип» для эффективного кальция изображений самцы нематоды Caenorhabditis elegans . Отображаются также исследования мужской воздействия глицерина и феромонов.
Аннотация
Использование кальция показателей позволило значительно расширить наше понимание динамики нейронной и регулирования. Нематоды Caenorhabditis elegans, с его полностью сопоставленных нервной системы и прозрачной анатомии, представляет идеальная модель для понимания реального времени нейронных динамики, с использованием показателей кальция. В сочетании с microfluidic технологий и экспериментальных проектов кальций томографии исследования с использованием этих показателей выполняются бесплатно перемещение и захваченных животных. Однако большинство предыдущих исследований с использованием треппинга устройств, таких как обонятельные чип, описанные в Chronis et al., иметь устройства, предназначенные для использования в более общих гермафродита, как менее распространенные мужчины как морфологически и структурно разнородных. Адаптированный обонятельных чип был разработаны и изготовлены для повышения эффективности в мужской нейрональных изображений с использованием молодых взрослых животных. Очередь была включена в червь, Загрузка порт для поворота животных и для разделения отдельных нейронов в рамках двусторонних пара в 2D изображения. Черви подвергаются контролируемого потока одоранта в пределах microfluidic устройство, как описано в предыдущих исследованиях Гермафродит. Кальция транзиентов затем анализируются с помощью программное обеспечение open-source ImageJ. Описываемую процедуру следует предусмотреть увеличение количества на основе мужской C. elegans кальция изображений исследования, углубления нашего понимания механизмов конкретного пола нейрональных сигнализации.
Введение
Microfluidic приборы обеспечивают расширение доступа к точно контролируемой среде, которой животных, такие как нематоду C. elegans, могут быть экспериментально манипулировать1. Эти исследования включают поведенческих анализов, кальция изображений исследования или даже показы для конкретных фенотипов, что приводит к более точные измерения экспериментальных результатов1,,2,3,,4, 5,6. Микрофлюидика обеспечивают мелкие жидких условия, через которые можно запускать подробные эксперименты во время используя минимальное количество реагентов. Существует постоянное производство новых microfluidic устройство конструкций, и использования каждого колеблется от арены, которые позволяют для естественного синусоидальные движения C. elegans в поведенческих анализов и нейронных обработки изображений исследования, в ловушку устройств, используемых в нейронных изображений и обонятельные исследования, для устройств, которые позволяют для фенотипического анализа высок объём в генетических экранов4,5,6,7. После изготовления мастер плесень, microfluidic приборы стоят недорого построить — учитывая многократного использования мастера — и простой в использовании, что позволяет для создания быстрого данных через высок объём исследований. Изготовление устройств с использованием полимеров, таких как полидиметилсилоксан (PDMS) предусматривает создание новых устройств в течение часа.
Кальция изображений исследования использовать генетически закодированный кальция индикаторов (GECIs) в клетки-мишени для измерения нейронных динамику этих клеток в реальном времени8,9,10,11. Прозрачный характер C. elegans позволяет для записи флуоресцентные уровней этих белков в живых животных. Традиционно, GECIs полагаются на Зеленый флуоресцентный белок (ГПУП)-на основе датчика GFP-Кальмодулин-M13 пептида (GCaMP), хотя более недавние исследования адаптировали эти датчики для лучшего соотношения сигнал шум и красно смещается возбуждения профилей. После разработки GCaMP3, имеют различные белки с этим спецификациям, включая датчики, например GCaMP6s и GCaMP6f (медленно и быстро флуоресценции вне цены, соответственно), а также ППП-Кальмодулин-M13 пептида (RCaMP), который имеет красно перенесен Активация профиля. Сочетание этих GECIs с C. elegans клеток конкретных генов промоутер последовательности можно ориентировать клетки интереса, особенно сенсорных нейронов12,13,14,15 , 16.
Хотя простота использования C. elegans в microfluidic исследования является очевидной, почти все исследования были посвящены гермафродитки. Несмотря на мужчин приходится только 0.01-0.02% из населенности дикого типа, бесценный выводы могут возникнуть от их характеристик. Хотя физические коннектом Гермафродит нервной системы полностью сопоставлен для десятилетий17, мужской коннектом остаются неполными, особенно в регионе головы животных18. Использование кальция изображений в мужчины поможет сформировать понимание мужской нервной системы и различия, которые возникают между двумя полами. Меньший размер взрослые самцы нематоды Caenorhabditis elegans препятствует эффективной и надежной треппинга в портах погрузки традиционных обонятельных устройства, предназначенные для больших гермафродитки. Для решения этой проблемы, модифицированную версию Chronis обонятельных чип19 был разработан с более узкий порт погрузки, Нижняя высота канала и превращается в червь порту погрузки (который повернуть животное), позволяя для визуализации двусторонних влево/вправо нейрональных пар. Эта конструкция позволяет: (1 эффективное улавливание молодых взрослых мужчин, (2 более надежной ориентации животных для визуализации обоих членов двусторонних парных нейронов, и (3 точных изображений нейронной активности в мужской нейронов.
Все чаще исследования показывают, что C. elegans мужчины по-разному чем гермафродитки реагировать на целый ряд ascarosides (математический), или нематоды феромоны20,21,22,23 ,24. Таким образом развитие понимания нейронных динамики и представительств в мужской коннектом стала еще более актуальными. Мужчины C. elegans содержат 87 конкретного пола нейроны не присутствует в Гермафродит25,26, изменяя коннектом в как-пока еще неопределенного пути. Возможность изображения эти уникальные нейронных динамика позволит нам лучше понять ответы конкретного пола и нейронных представлений.
Этот протокол описывает использование мужчины адаптированных обонятельных чип нейронных образов мужчин C. elegans chemosensation. Ноцицептивных нейрон золы надежно реагирует на 1 М глицерина в мужчин, в соответствии с предыдущим гермафродиты исследований27. Воздействия на ascarosides может получить ответы, которые являются переменными от животных до животных, требующих большего количества животных, чтобы быть проверены. Ответ нейронов сем мужчины конкретных ранее было показано, через электрофизиологии и кальция изображений исследования, переменно реагировать на ascaroside #323.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Изготовление устройства
Примечание: см. ссылку 1.
Примечание: мастер формы кремния были изготовлены с использованием стандартных методов фотолитографический для структурирования Су-8 фоторезиста на кремний мастер 1 , 7. Фотошаблонов для патронирования пластины были напечатаны на 25 000 dpi. Мужчины адаптированных устройства особенности Chronis обонятельных чип дизайн 19 с изменением червь порт погрузки, адаптация дизайна, полученные от M. Zimmer (личная переписка, 2016). Поворот включен для управления вращением животных. Ширина червь загрузки порт канал сужается до 50 мкм. Все каналы являются 32 мкм высотой. После того, как мастер формы кремния доступны для пользователя, пользователь может следить за последующие протокол, как описано ранее 1.
- Mix PDMS базы и отверждения агент в соотношении 10:1 по весу.
- Тщательно перемешать с передачей пипетки.
- Дега смесь в вакуумного эксикатора за 1 ч, пока не будут удалены все видимые пузырьки.
- Залить смесь на образец формы кремния в блюдо диаметром 150 мм, до тех пор, пока это толщиной 5 мм (100 g). Используйте пипетки Пастера, чтобы удалить любые пузыри или пыль, которые были введены в смесь.
- Выпекать при температуре 65 ° C для по крайней мере 3 h, или на ночь.
- Вырезать PDMS от плесени, с помощью скальпеля и разрезать отдельные устройства с помощью лезвия бритвы.
- Удар впускных и выпускных отверстий с 1 мм дермального удар.
- Очистить отверстия с dH 2 O, этанол и снова с dH 2 O для удаления частиц от ударов. Высушите прибор в воздушный поток импульсов.
- Чистый канал стороны и в верхней части устройства с клейкой лентой, удаляя пыль или мусора, оставшихся на устройстве для успешного связывания.
- Плазмы Бонд устройства, канал стороной вниз, чтобы стекла Крышка № 1.
- Expose покровным стеклом и устройства (канал стороной вверх) воздуха в плазме с использованием условий, которые позволяют для правильного соединения, например 100 Вт для 30 s или 24 W 60 s.
Примечание: Параметры могут корректироваться для повышения эффективности сцепления. Плазма склеивание условия, не так критичен как надлежащей очистки при попытке улучшить эффективность сцепления. Недостаточно очищенных устройство не склеивает, даже в условиях идеальной плазмы. - Инвертировать покровным стеклом на стороне канала устройства и нажмите вниз с пальца для 5 s.
- Expose покровным стеклом и устройства (канал стороной вверх) воздуха в плазме с использованием условий, которые позволяют для правильного соединения, например 100 Вт для 30 s или 24 W 60 s.
2. Буфера подготовка
- развести 1 x S базальную (KPO NaCl и 0,05 М 100 мм 4, pH 6.0) из запаса стерильные 10 x.
- Развести 1 М Тэтрамизол складе в конечной концентрации 1 мм в 1 x S базальной, для всех буфера решения.
- Добавить оба флуоресцеин " управления потоком " и " буфера " водохранилищ.
- Создать запас флуоресцеин 100 мг/мл в 1 x S базальной.
- Развести запас для окончательного концентрации 1 мкг/мл в поток управления и 0,1 мкг/мл в буфере.
- Создать стимулы.
- Разбавленной глицерина до конечной концентрации 1 м в 1 X S базальной.
- Ascaroside #3 (математический #3) разбавляют до конечной концентрации 1 мкм в 1 X S базальной.
3. Настройка устройства
Примечание: см. 1.

на рисунке 1. Настройка устройства microfluidic. (A) резервуаров и труб. 30 мл шприц без поршень служит " водохранилище. " это прилагается к Луер клапан с тремя вариантами потока. Один выход подключен к шприц 3 мл с плунжером, в то время как другой подключенный к иглы (оранжевый), которая вставляется в НКТ, который подключается к устройству microfluidic. (B) Общая Настройка microfluidic изображений эксперимент. Устройство помещается на сцене Перевернутый эпифлуоресцентного микроскопа, выше цель линзы. " Управления потоком " буфера проходит через 3-ходовой клапан, который контролируется группой на полке выше установки. Строки, содержащие буферы затем вставляются в соответствующие устройства порты. (C) портов microfluidic устройства. " Управления потоком " порты фланге другие порты на входе: " стимул " и " буфера " порты. " Розетка " порт-это самый правый. Благодаря расположению червь загрузки Арена " червь загрузки " порт-это центральный большинство на устройстве. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Подготовить три жидкости водохранилищ путем присоединения 30 или 60 мл шприц Luer 3-пневмораспределитель, с 3 мл шприц и иглу, придает Luer клапана, а также (как показано на рисунке 1A). Подключите иглы для труб, которая простирается на microfluidic устройство (как показано на рисунке 1A -B).
- Удаления пузырьков воздуха из резервуара и трубопровода.
- , Заполните шприц 3 мл с прилагаемой трубки с 1 x S базальной и вставьте его в розетку порт
- Мягко надавливайте на шприц, до тех пор, пока буфер появляется в верхней части впускного отверстия.
- Подключить управления потоком, буфера и стимул труб к соответствующим впускного отверстия (как показано на рисунке 1B -C), обеспечивая что капель жидкости присутствуют на порту погрузки отверстие и буферной трубки прилагаться.
- Снова, мягко надавливайте на шприц, который подключен к порту выхода пока не появляются капли в червь загрузки впускной порт.
- Вставьте твердый блокирующий штифт в червь, Загрузка порт
- Удалите шприц из порта розетки и прикрепить линии розетки подключены к дом вакуума (-670 мм.рт.ст.).
- Проверить устройство для любой пузырьков в потоке каналы, визуально и через видео подтверждение через программное обеспечение, совместимое с камерой используется, такие как открытым исходным кодом микро-ясли. Шаг 6 для советы по использованию микро-менеджер.
- Если любые пузыри присутствуют, ждать их, чтобы выбить или быть поглощенным в PDMS стены перед загрузкой любых животных; наличие пузырьков будет беспокоить надлежащего потока жидкости через устройство.
- С помощью GFP фильтра, подтверждения надлежащего потока динамика внутри устройства до червь, загрузки, исполнительные 3-ходового клапана и наблюдая за переключения буферов.
- Определить динамику надлежащего потока: наблюдать флуоресцеин, присутствующих в решения управления и буфера потока ( Рисунок 2D -2E) меняется при изменении значение управления потоком, нажав элемент управления кнопку, соответствующую 3-ходового клапана на ссылку клапан ( рис. 1B).
- После открытия микро-менеджера, нажмите на " Live " наблюдать живой образ устройства. Включите флуоресцентный источник света для наблюдения за потоком буферов в устройстве ( рис. 2D -2E).
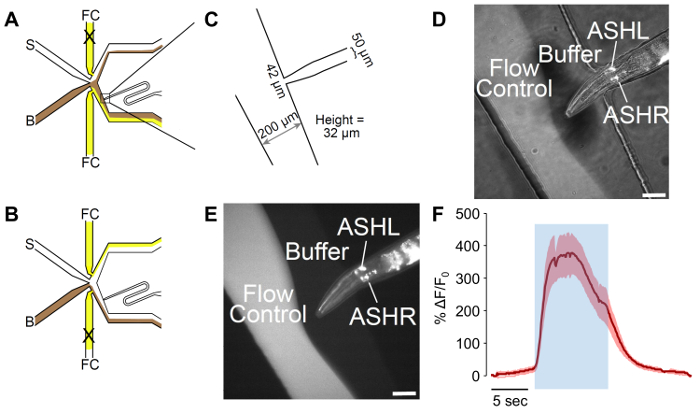
Рисунок 2: Мужчины адаптированных microfluidic обонятельных чип. (A) потока модели устройства, когда червь подвергается буфер. Буфер (B) показан в Браун, и управление потоком (FC) отображается желтым цветом, с стимул (S) в белом. Порт погрузки червь был адаптирован к включать кривую, которая позволяет для лучшего контроля ориентации червя. (B) потока модели устройства, когда червь подвергается стимул. Буфер (B) показан в Браун, и управление потоком (FC) отображается желтым цветом, с стимул (S) в белом. (C) измерения адаптировать устройство как сфабрикованы. Червь, порт погрузки заканчивается в 42 µm, открывая, с каналом 50 мкм, предназначенные для мужчин ширины. Измеренной высоты каналов — 32 мкм, несмотря на цель 25 мкм в дизайне. (D-E) A в ловушке мужчины выражая p sra-6:: GCaMP3. Sra-6 промоутер не аш конкретным, и некоторые выражения могут наблюдаться в ASI нейрон, хотя не кальция переходные процессы наблюдались в ASI. (D) сочетанием ярких поле и флуоресцентного освещения, то изображение, (E) флуоресцентных только. Масштаб баров обозначим 42 µm. (F) зола нейрон отвечает на 1 М глицерина стимуляции с надежной нейронной активности. Синий уголок обозначает время стимул глицерина 1 M. Затененные области обозначает стандартная ошибка, с n = 20 импульсов от семи червей. Красные следы обозначают деполяризующий ответы. Оси y показывают ΔF/F 0. В баре шкалы обозначает 5 s. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
4. животное подготовки
Примечание: см. ссылку 23.
- Ответы imaging золы на 1 М глицерина.
- Место около 20 C. elegans мужчины, которые являются позитивными для p sra-6:: GCaMP3 выражение массива на нематод роста средних (НГМ) агар пластину семенами с газоном ОР50 E. coli. Используйте выражение флуоресцентные ГЕЧИ и/или совместное инъекций маркер для определения массива инфицированных животных.
Примечание: Массив положительных животных будет флуоресцировать согласно ГЕЧИ используется (то есть, животных, выражая GCaMP будет флуоресцировать зеленый под голубой свет стимуляции, в то время как RCaMP животных будет флуоресцировать красный под зелёный свет стимуляции). Совместное инъекций маркеров может варьироваться от других флуоресцентных белков, таких как GFP и ППП, фенотипические маркеры, такие как rol-6, или может спасти доминирующей фенотип, например мутация pha-1 28.- Если сбор непосредственно перед assay, забрать молодых взрослых мужчин. Если сбор за день до assay, выбрать личинок мужчины L4.
- Место около 20 C. elegans мужчины, которые являются позитивными для p sra-6:: GCaMP3 выражение массива на нематод роста средних (НГМ) агар пластину семенами с газоном ОР50 E. coli. Используйте выражение флуоресцентные ГЕЧИ и/или совместное инъекций маркер для определения массива инфицированных животных.
- Imaging ответы CEM 1 мкм математический #3.
- Забрать около 20 L4 C. elegans самцов (fkEx98 [::GCaMP::SL2::dsRED pkd-2 p + АТС-1]; Пха-1 (e2123ts); ему-5 (e1490); Lite-1 (ce314)) которые являются позитивными для dsRed совместное инъекций маркер выражения.
Примечание: dsRed выражение в рамках Рэй нейронов мужской сказки проще соблюдать и подтвердить чем GCaMP выражение в рамках четырех нейронов CEM. - Изолировать эти мужчины от гермафродитки на плите агар NGM семенами с лужайки E. coli ОР50 для 5-14 h перед выполнением изображений эксперимент.
Примечание: Мужчины не изолированы как минимум 5 h поведенчески не реагировать на математический #3 и поэтому могут проявлять еще меньше кальция переходные к ascaroside, чем здесь наблюдается.
- Забрать около 20 L4 C. elegans самцов (fkEx98 [::GCaMP::SL2::dsRED pkd-2 p + АТС-1]; Пха-1 (e2123ts); ему-5 (e1490); Lite-1 (ce314)) которые являются позитивными для dsRed совместное инъекций маркер выражения.
5. Животных загрузки
Примечание: см refefence 1.
- Выбрать одного червя на unseeded NGM агар пластину с помощью методов технического обслуживания стандартных червь.
- Забрать червей, пылающий забрать (из плоского провода платины), сбор бактерий на выбор, и " вытирает " червь, чтобы забрать его. Осторожно поместите червя на новую пластину, позволяя его обход покинуть по собственной.
- Добавить около 5 мл 1 x S базальной unseeded пластины, таким образом, чтобы пластины наводнен.
- Нарисовать червь в загрузки шприц (т.е., 3 мл шприц с прилагаемой трубки), который был предварительно заполненные с 1 x S базальной.
- Будьте уверены, чтобы сосать червь только в трубы, не все пути в шприц.
Примечание: Если червь проходит в шприц, это практически невозможно получить его обратно в трубе.
- Будьте уверены, чтобы сосать червь только в трубы, не все пути в шприц.
- Выключить вакуум, чтобы остановить поток, повернув клапан Luer.
- Удалите твердые ПИН, блокирование загрузки порт червь
- Поверните клапан Luer подключен к порту розетки ( рис. 1B), таким образом, чтобы она продувки.
Примечание: Используйте живой видео-канал при загрузке червь для подтверждения местоположения и ориентации животных (шаги 5,8-5.13). - Вставить червь загрузки трубку в червь порт погрузки
- Мягко надавливайте на шприц, пока червь появится в канале загрузки.
- Если червь начинает вводить хвост первый канал, тянуть на поршень шприца, чтобы предотвратить ввод канала червь.
- Переключение между применения и обращения вспять давление до тех пор, пока глава вступает канал сначала.
- Открыть, пылесос, повернув Luer 3-пневмораспределитель, подключенного к порту розетки чтобы открыть его в вакууме вместо атмосферу.
- Вручную применить давление путем отжимать поршень шприца, чтобы ориентировать и поместите головку червь, таким образом, что он подвергается в канал буфера потока, но не так далеко, что руководитель может свободно перемещаться (D-2E Рисунок 2).
6. Стимул и приобретение
- используя программное обеспечение с открытым исходным кодом микроскопии, например микро-менеджер, запись, захват изображений TIFF стеком в 10 кадров/сек, используя синий свет возбуждения (470 Нм) для 30 s. Установка экспозиции в главном меню до 100 г-жа
- открытые
- " мульти D Acq. " в главном меню программного обеспечения. Установите " номер " на " 300, " и " интервал " к " 0. " нажмите " приобретать! " приобрести видео.
- Применить 10 s импульса стимул 5 с после начала приобретения. Отрегулируйте продолжительность стимул приложения нужным.
- После приобретения 5 s видео, изменить 3-ходовой клапан контроля потока управления буфер чтобы применить стимул к животное проходит испытания. Нажмите на левую кнопку на ссылку клапан ( рис. 1B).
- После 10 s воздействия стимула (это время может корректироваться по желанию пользователя), изменяют поток буферов, снова нажав на левую кнопку на клапан ссылку.
- Запись в буфер только до тех пор, пока 30-s окно полностью разрешить ГЕЧИ флуоресценции вернуться к базовой.
- Повторите при необходимости. Подождите 30 s между концом приобретения и начало следующего судебного процесса.
7. Анализ изображений
- Открыть TIFF стека с открытым исходным кодом, ImageJ, путем перетаскивания файлов в окно ImageJ.
- Нажмите кнопку с помощью курсора и перетащите, чтобы установить региона интерес (ROI) вокруг нейрон интерес. Установка области включить Сома нейрон интерес (как показано на рисунке 3A).
- Участок z стек интенсивности флуоресценции ROI через стеки, нажав кнопку Открыть-> изображение - > стеки - > участок профиля Z-axis.
- Нажмите " список " в окне, которое открывается. Нажмите кнопку Edit - > копировать, чтобы скопировать значения. Вставьте значения в программу электронных таблиц.
- Анализ фон флуоресценции для каждого импульса путем перетаскивания рентабельность инвестиций в регион червя, который не содержит выражение GCaMP.
- Выполнять вычитание фона для каждого импульса путем вычитания значения флуоресценции фон из значения интенсивности флуоресценции нейрон.
- Вычисления 0 ΔF/F для каждого кадра каждого импульса.
- Вычислить F 0 как значение средней интенсивности ROI для первого 1 s приобретения (например, кадры 1-10).
- Рассчитать путем деления значения вычитается фон для кадра интерес вычисленное значение F 0 ΔF/F 0.
- Повторить каждый нейрон образы и каждый стимул пульс.
- Нейроны с профилями согласованного реагирования, таких, как ясень, среднее всех импульсов для каждого нейрона и рассчитать SEM (как в рисунке 2F).
- Участок средняя ΔF/F 0 с SEM с течением времени для каждого нейрона.
Примечание: В данном случае, это обычная практика, чтобы включить карты отдельных нейронов ответов каждого разбирательства. В нейроны, которые exhibit последовательного изменения в кальция переходных процессов при воздействии раздражителей через повторяющиеся стимуляцию, или в разных лиц 23 она может быть более применимо к Показать следы отдельных импульса (как в Рисунок 4). Смотрите обсуждение для деталей на определение путей для отображения данных.
Access restricted. Please log in or start a trial to view this content.
Результаты
Пример общей установки устройства можно увидеть на рисунке 1A-B. Рисунок 1A изображает строительство надлежащего водохранилище и установки. Рисунок 1B показывает соединения водохранилищ на microfluidic устройство.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Мужчины адаптированных обонятельных чип включает в себя поворот в узкий порт погрузки, который позволяет для большего контроля ориентации и для эффективного улавливания мужской C. elegans. Это позволяет для визуализации левой и правой членов нейрональных двусторонних пар, без необхо...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы хотели бы поблагодарить Мануэль Zimmer за предоставленную нам с файлом первоначальный дизайн был адаптирован для использования с мужчины; Франк Шредер для синтеза и поставку математический #3; Росс Lagoy за понимание и помощь с визуализации и анализа; и Лаура Aurilio для мастер изготовления и которые, наряду с Кристофер желоба, способствовали рассмотрению этой рукописи. Рамках национальных институтов здравоохранения грант 1R01DC016058-01 (ю.с.), Национальный фонд науки Грант CBET 1605679 (D.R.A.) и Берроуз Уэллком Career Award в научной интерфейс (D.R.A.) было обеспечено финансирование для этой работы.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Silicon Wafer | University Wafer | 452 | |
| SU-8 2035 | MicroChem | Y111070-0500L1GL | |
| Developer | MicroChem | Y020100-4000L1PE | |
| Wafer Mask | Cad/Art Services | - | Custom order. Printed at 25,000 dpi. |
| Sylgard-184 | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| 1.0 mm Dermal Punches | Acuderm Inc. | P150 | |
| Soft Tubing | Cole-Palmer | EW-06419-01 | |
| Hard Tubing | IDEX Health & Science | 1622 | |
| Pins | New England Small Tube | NE-1027-12 | |
| Blocking Pins | New England Small Tube | 0.415/0.425" OD x .500 Long | Batch PB07027 |
| 3 mL syringes | BD | 309657 | |
| 30 mL syringes | Vitality Medical | 302832 | Used as buffer reservoirs. |
| Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer | Component Supply Company | NE-231PL-50 | |
| Stopcocks with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile | Cole-Palmer | EW-30600-07 | |
| Fisherfinest Premium Cover Glass | Fisher Scientific | 12-548-5M | |
| Mercator Control System LF-5 Plasma System | Mercator | LF-5 | |
| Scotch Tape | Scotch | BSN43575 | |
| Series 20 Chamber | Warner Instruments | P-2 | |
| Vacuum Desicator | Bel-Art Scienceware | 420250000 | 24 cm inner diameter. |
| Weigh Boats | Cole-Palmer | EW-01017-27 | |
| Classic Plus Balance | Mettler Toledo | PB1501-S/FACT | |
| Glass Pasteur Pipettes | Cole-Palmer | EW-25554-06 | |
| Transfer pipettes | Genesee Scientific | 30-202 | |
| Oven | Sheldon Manufacturing Inc | 9120993 | Model Number: 1500E. |
| 60 mm, non-vented, sharp edge Petri dishes | TriTech Research | T3308 | |
| Zeiss Axio Observer.A1 | Zeiss | - | |
| Hammamatsu Orca Flash 4.0 Digital CMOS | Hammamatsu | C11440-22CU | |
| Blue Fluorescent Light | Lumencor | SOLA SM6-LCR-SA | 24-30V/7.9A DC. |
| Illumination Adaptor | Zeiss | 423302-0000 | |
| Series 1 and 2 Miniature Inert PTFE Isolation Valve | Parker | 001-0017-900 | 3-way valve for controlling flow. |
| ValveLink8.2® | AutoMate Scientific | 01-18 | Flow Switch Controller |
| Micro Manager | Micro-Manager | - | Free software, can be downloaded at: https://www.micro-manager.org/wiki/Download_Micro-Manager_Latest_Release |
| ImageJ | ImageJ | - | Free software, can be downloaded at: https://imagej.nih.gov/ij/download.html |
| Agar, Bacteriological Grade | Apex | 9012-36-6 | |
| Peptone | Apex | 20-260 | |
| CaCl2 | VWR | BDH0224-1KG | |
| MgSO4 | Sigma-Aldrich | 230391-1kg | |
| Cholesterol | Alfa Aesar | A11470 | |
| Ethanol | Sigma-Aldrich | 270741-4L | |
| Tetramisole | Sigma-Aldrich | L9756-10(G) | Store at 4 °C. |
| Fluorescein | Sigma-Aldrich | FD2000S-250mg | Light Sensitive. Store in photoprotective vials. |
| Glycerol | Sigma-Aldrich | G6279-1L | |
| Ascaroside #3 | - | - | Synthesized in the Schroeder Lab (Cornell University). |
| NaCl | Genesee Scientific | 18-215 | |
| KH2PO4 | BDH | BDH9268.25 | |
| K2HPO4 | J.T. Baker | 3252-025 | |
| ASH GCaMP3 line | - | - | CX10979 (KyEx2865 [psra-6::GCAMP3 @ 100 ng/uL]). Developed in Bargmann lab. Provided from Albrecht Lab library. |
| CEM GCaMP6 line | - | - | JSR49 (FkEx98[ppkd-2::GCaMP::SL2::dsRED + pBX-1]; pha-1(e2123ts); him-5(e1490); lite-1(ce314)). Developed by Robyn Lints. Provided from Srinivasan Lab library. |
| E. coli (OP50) | Caenorhabditis Genetics Center | OP50 | |
| "Reservoir" | - | - | To create a Reservoir: A "30 mL syringe", is connected to a "Stopcock with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile", which is connected to a "3 mL syringe" and a "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer". The "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer" is then inserted into "Soft Tubing" approximately 1/3 of the way down the needle. |
Ссылки
- Lagoy, R. C., Albrecht, D. R. Microfluidic Devices for Behavioral Analysis, Microscopy, and Neuronal Imaging in Caenorhabditis elegans. Methods Mol Biol. 1327, 159-179 (2015).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Curr Opin Neurobiol. 19 (5), 561-567 (2009).
- Chronis, N. Worm chips: Microtools for C. elegans biology. Lab on a Chip. 10 (4), 432-437 (2010).
- Lee, H., Crane, M. M., Zhang, Y., Lu, H. Quantitative screening of genes regulating tryptophan hydroxylase transcription in Caenorhabditis elegans using microfluidics and an adaptive algorithm. Integr Biol (Camb). 5 (2), 372-380 (2013).
- Lockery, S. R., et al. A microfluidic device for whole-animal drug screening using electrophysiological measures in the nematode C. elegans. Lab Chip. 12 (12), 2211-2220 (2012).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nat Commun. 7, 13023(2016).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 110 (45), E4266-E4273 (2013).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Front Mol Neuro. 6, 2(2013).
- Badura, A., Sun, X. R., Giovannucci, A., Lynch, L. A., Wang, S. S. H. Fast calcium sensor proteins for monitoring neural activity. Neurophotonics. 1 (2), 025008(2014).
- Tatro, E. T. Brain-wide imaging of neurons in action. Front Neural Circuits. 8, 31(2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat Methods. 6 (12), 875-881 (2009).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Greene, J. S., Dobosiewicz, M., Butcher, R. A., McGrath, P. T., Bargmann, C. I. Regulatory changes in two chemoreceptor genes contribute to a Caenorhabditis elegans QTL for foraging behavior. Elife. 5, (2016).
- Kim, K., et al. Two Chemoreceptors Mediate Developmental Effects of Dauer Pheromone in C. elegans. Science. 326 (5955), 994-998 (2009).
- McGrath, P. T., et al. Parallel evolution of domesticated Caenorhabditis species targets pheromone receptor genes. Nature. 477 (7364), 321-325 (2011).
- Schmitt, C., Schultheis, C., Husson, S. J., Liewald, J. F., Gottschalk, A. Specific Expression of Channelrhodopsin-2 in Single Neurons of Caenorhabditis elegans. PLoS ONE. 7 (8), e43164(2012).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Nervous System of the Nematode Caenorhabditis elegans. Phil Trans of the Royal Soc of Lon. 314 (1165), 1(1986).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat Meth. 4 (9), 727-731 (2007).
- Chute, C. D., Srinivasan, J. Chemical mating cues in C. elegans. Semin Cell Dev Biol. 33, 18-24 (2014).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook. , 1-22 (2013).
- Narayan, A., et al. Contrasting responses within a single neuron class enable sex-specific attraction in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 113 (10), E1392-E1401 (2016).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Sammut, M., et al. Glia-derived neurons are required for sex-specific learning in C. elegans. Nature. 526 (7573), 385-390 (2015).
- Sulston, J. E., Albertson, D. G., Thomson, J. N. The Caenorhabditis elegans male: postembryonic development of nongonadal structures. Dev Biol. 78 (2), 542-576 (1980).
- Hilliard, M. A., et al. In vivo imaging of C. elegans ASH neurons: cellular response and adaptation to chemical repellents. The EMBO Journal. 24 (1), 63-72 (2005).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Cáceres, I. dC., Valmas, N., Hilliard, M. A., Lu, H. Laterally Orienting C. elegans Using Geometry at Microscale for High-Throughput Visual Screens in Neurodegeneration and Neuronal Development Studies. PLoS ONE. 7 (4), e35037(2012).
- Schrodel, T., Prevedel, R., Aumayr, K., Zimmer, M., Vaziri, A. Brain-wide 3D imaging of neuronal activity in Caenorhabditis elegans with sculpted light. Nat Methods. 10 (10), 1013-1020 (2013).
- García, L. R., Portman, D. S. Neural circuits for sexually dimorphic and sexually divergent behaviors in Caenorhabditis elegans. Curr Opin Neurobiol. 38, 46-52 (2016).
- Clokey, G. V., Jacobson, L. A. The autofluorescent "lipofuscin granules" in the intestinal cells of Caenorhabditis elegans are secondary lysosomes. Mech Ageing Dev. 35 (1), 79-94 (1986).
- Coburn, C., et al. Anthranilate Fluorescence Marks a Calcium-Propagated Necrotic Wave That Promotes Organismal Death in C. elegans. PLoS Biology. 11 (7), e1001613(2013).
- Macosko, E. Z., et al. A hub-and-spoke circuit drives pheromone attraction and social behaviour in C. elegans. Nature. 458 (7242), 1171-1175 (2009).
- Park, D., et al. Interaction of structure-specific and promiscuous G-protein-coupled receptors mediates small-molecule signaling in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 109 (25), 9917-9922 (2012).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены