É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Usando um Chip olfativo Microfluidic adaptado para a imagem da atividade Neuronal em resposta aos Pheromones em neurônios de cabeça masculino C. Elegans
Neste Artigo
Resumo
O uso de um chip adaptado"olfativo" para a imagem de cálcio eficiente de machos de c. elegans é descrito aqui. Estudos de exposição masculino glicerol e um pheromone também são mostrados.
Resumo
A utilização de indicadores de cálcio tem bastante reforçada a nossa compreensão da dinâmica neural e regulamento. O nemátodo Caenorhabditis elegans, com sua anatomia transparente e completamente mapeado sistema nervoso apresenta um modelo ideal para a compreensão dinâmica neural em tempo real, usando indicadores de cálcio. Em combinação com tecnologias microfluídicos e projetos experimentais, estudos de geração de imagens de cálcio usando estes indicadores são realizados em animais em movimento livre e presos. No entanto, a maioria dos estudos anteriores utilizando dispositivos de captura, como o chip olfativo descrito no Chronis et al., têm dispositivos projetados para uso no hermafrodita mais comuns, como o macho menos comum é que ambos morfologicamente e estruturalmente dissimilares. Um chip adaptado olfativo foi projetado e fabricado para aumentar a eficiência no masculina imagem neuronal com o uso de animais jovens e adultos. Uma vez foi incorporada a minhoca porto para girar os animais e para permitir a separação dos neurônios individuais dentro de um par bilateral em 2D imagem de carregamento. Vermes são expostos a um fluxo controlado de odorante dentro do dispositivo microfluidic, conforme descrito em estudos anteriores de hermafrodita. Transientes de cálcio são então analisados utilizando o software open-source ImageJ. O procedimento descrito neste documento deverá permitir uma maior quantidade de macho com base em c. elegans cálcio estudos, aprofundar a nossa compreensão dos mecanismos de sinalização neuronal do sexo-específico de imagem.
Introdução
Dispositivos microfluídicos fornecem maior acesso a precisamente ambientes controlados, onde animais, tais como o nemátodo c. elegans, pode ser manipulado experimentalmente1. Estes estudos incluem ensaios comportamentais, estudos de imagiologia de cálcio ou mesmo sessões de fenótipos específicos, resultando em medidas mais exatas de resultados experimentais1,2,3,4, 5,6. Microfluídica proporcionar condições líquidas em pequena escala, através do qual as experiências detalhadas podem ser executadas utilizando quantidades mínimas de reagentes. Há uma produção constante de novos designs de dispositivo microfluidic, e o uso de cada um varia, de arenas que permitem o movimento natural sinusoidal de c. elegans em ensaios comportamentais e estudos de imagiologia neurais, capturar dispositivos utilizados em imagiologia neural e estudos olfativos, dispositivos que permitem alta produtividade análise fenotípica em genética telas4,5,6,7. Após a fabricação de um molde mestre, dispositivos microfluídicos são baratos construir — dada a capacidade de reutilização do mestre — e fácil de usar, permitindo a geração de dados rápida, através de estudos de alto rendimento. Fabricação de dispositivos usando polímeros tais como polydimethylsiloxane (PDMS) permite a criação de novos dispositivos dentro de horas.
Estudos de imagiologia de cálcio usam indicadores de cálcio geneticamente codificado (GECIs) expressados em células-alvo para medir a dinâmica neural essas células em tempo real8,9,10,11. A natureza transparente da c. elegans permite a gravação dos níveis fluorescentes destas proteínas em animais vivos. Tradicionalmente, GECIs dependem da proteína verde fluorescente (GFP)-baseado sensor peptídeo GFP-calmodulina-M13 (GCaMP), embora estudos mais recentes adaptaram estes sensores para permitir melhor relação sinal-ruído e perfis de excitação avermelhado. Após o desenvolvimento de GCaMP3, proteínas com estas especificações têm variado, incluindo sensores tais como GCaMP6s e GCaMP6f (lento e rápido fluorescência fora-taxas, respectivamente), bem como de peptídeo de RFP-calmodulina-M13 (RCaMP), que tem um avermelhado Perfil de ativação. A combinação destes GECIs com sequências de promotor de genes célula específica de c. elegans pode atingir células de interesse, neurônios sensoriais particularmente12,13,14,15 , 16.
Enquanto a facilidade de uso de c. elegans em estudos microfluídicos é aparente, quase todos os estudos têm incidido sobre hermafroditas. Apesar dos machos apenas contabilização de 0,01-0,02% da população de tipo selvagem, inestimáveis conclusões podem surgir de sua caracterização. Enquanto a conectoma física do sistema nervoso hermafrodita foi totalmente mapeada por décadas17, a conectoma masculina permanece incompleta, especialmente na região da cabeça do animal18. O uso de imagens de cálcio em machos vai ajudar a gerar uma compreensão do sistema nervoso masculino e as diferenças que surgem entre os dois sexos. O menor tamanho de c. elegans machos adultos evita armadilhas eficaz e confiável nos portos de carregamento dos tradicionais dispositivos olfativos projetados para maiores hermafroditas. Para resolver isso, uma versão modificada do Chip Olfactory Chronis19 foi desenvolvida com um porto de carregamento mais estreito, uma altura inferior do canal e se transforma no worm Porto de carregamento (que giram o animal), permitindo a visualização de esquerda/direita bilateral neuronais pares. Este projeto permite: (1) a captura efetiva de jovens adultos do sexo masculino, (2) uma orientação mais confiável do animal para a visualização de ambos os membros de neurônios emparelhados bilaterais e (3) a imagem precisa de atividade neural em neurônios masculinos.
Cada vez mais, estudos mostram que os machos de c. elegans respondem de forma diferente do que hermafroditas para uma variedade de ascarosides (ascr), ou o nematódeo pheromones20,21,22,23 ,24. Portanto, desenvolver uma compreensão da dinâmica neural e representações dentro a conectoma masculina tornou-se ainda mais pertinente. Masculino c. elegans contêm 87 neurônios específicos do sexo não está presentes no hermafrodita25,26, alterando a conectoma em como-maneiras ainda indeterminados. Sendo capaz de imagem essas dinâmicas neurais exclusivas nos permitirá compreender melhor respostas específicas do sexo e representações neurais.
Este protocolo descreve o uso de um chip olfativo macho-adaptado para a imagem neural de masculino c. elegans chemosensation. O neurônio nociceptivo que Ash responde confiantemente ao glicerol 1m em machos, consistentes com as anteriores hermafrodita estuda27. Exposição de ascarosides pode eliciar respostas que são variável de animal para animal, que requerem um maior número de animais a ser testado. A resposta dos neurônios CEM macho-específico anteriormente mostrou, através de eletrofisiologia e cálcio de imagem estudos, reagir variàvel ascaroside #323.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. fabricação de dispositivo
Nota: ver referência 1.
Nota: mestre moldes de silicone foram fabricados usando técnicas padrão fotolitográfica para padronização fotorresiste SU-8 em um silício mestre 1 , 7. Máscaras de patrocínio de bolacha foram impressos em 25.000 dpi. Os recursos do dispositivo de homem-adaptado um Chip Olfactory Chronis desenha 19 com uma mudança no worm Porto de carregamento, adaptando um design obtido de M. Zimmer (correspondência pessoal, 2016). Uma vez é incluída para controlar a rotação dos animais. A largura do canal do porto de carregamento worm é reduzida para 50 μm. Todos os canais são 32 μm de altura. Uma vez que um molde mestre do silicone está disponível para o usuário, o usuário pode acompanhar o subsequente protocolo, conforme descrito anteriormente, 1.
- Agente de cura e base Mix PDMS na proporção de 10:1 em peso.
- Homogeneizar com pipetas de transferência.
- Desgaseificar a mistura num exsicador de vácuo para 1 h, até que sejam removidas todas as bolhas visíveis.
- Despeje a mistura em um mestre de molde de silicone em um prato de diâmetro de 150 mm até 5 mm de espessura (100 g). Usar uma pipeta Pasteur para remover quaisquer bolhas ou poeira que foram introduzidos à mistura.
- Asse a 65 ° C, durante pelo menos 3 h, ou durante a noite.
- Corte o PDMS longe o molde usando um bisturi e corte os dispositivos separados separados usando uma lâmina de barbear.
- Buracos de entrada e saída com um soco dérmica de 1 mm.
- Limpar os orifícios com dH 2 O, etanol e novamente com dH 2 O para remover partículas dos socos. Secar o dispositivo em um pulso de fluxo de ar.
- Limpar ambos os lados do canal e o lado superior do dispositivo com fita adesiva, removendo toda a sujeira ou detritos remanescentes no dispositivo para permitir a ligação de sucesso.
- Plasma-lig o dispositivo, canal-lado para baixo, para um vidro de tampa no. 1.
- Expor vidro de tampa e dispositivo (canal-cima) para ar plasma usando as condições que permitem a ligação adequada, tais como 100 W por 30 s ou 24 W em 60 s.
Nota: As configurações podem ser ajustadas para melhorar a eficiência da colagem. As condições de ligação-plasma não são tão críticas como a limpeza apropriada ao tentar melhorar a eficiência da colagem. Um dispositivo insuficientemente limpo não ligarão, mesmo sob condições ideais plasma. - Inverter o vidro de tampa para o lado de canal do dispositivo e pressione para baixo com o polegar para 5 s.
- Expor vidro de tampa e dispositivo (canal-cima) para ar plasma usando as condições que permitem a ligação adequada, tais como 100 W por 30 s ou 24 W em 60 s.
2. Preparação de buffer
- dilua 1 x S Basal (100 mM NaCl e 0,05 M KPO 4, pH 6.0) de um estoque de estéril 10 x.
- Diluir 1 M tetramisole estoque para uma concentração final de 1 mM em 1 x S Basal para todos do buffer soluções.
- Adicionar fluoresceína para ambos o " controle de fluxo " e " buffer " reservatórios.
- Criar um estoque de 100 mg/mL de fluoresceína em 1 x Basal de S.
- Diluir o estoque para concentrações finais de 1 µ g/mL no controle de fluxo e 0,1 µ g/mL no buffer.
- Criar estímulos.
- Glicerol diluído a uma concentração final de 1 M em 1 X Basal de S.
- Diluído ascaroside #3 (ascr #3) a uma concentração final de 1 µM em 1 X Basal de S.
3. Instalação de dispositivo
Nota: ver 1.

Figura 1. Instalação do dispositivo microfluidic. (A) reservatórios e tubos. Um 30 mL seringa sem um êmbolo serve como o " reservatório. " isto é anexado a uma válvula Luer com três opções de fluxo. Uma tomada é ligada a uma seringa de 3 mL com um êmbolo, enquanto o outro é conectado a uma agulha (laranja) que é inserida o tubo que conecta o dispositivo microfluidic. (B) o total configuração da microfluidic experiência de imagem. O dispositivo é colocado em um palco de um microscópio de epifluorescência invertido, acima as lentes objetivas. O " controle de fluxo " tampão viaja através de uma válvula de 3 vias, que é controlada por uma unidade na prateleira acima da instalação. Linhas que contêm buffers de então são inseridas os portos de dispositivo apropriado. (C) as portas do dispositivo microfluidic. O " controle de fluxo " portas flanqueiam as outras portas de entrada: o " estímulo " e " buffer " portas. A " tomada " porta é a porta da direita. Devido à localização da arena de carregamento do worm, o " worm carregando " porta é a porta central-maioria no dispositivo. clique aqui para ver uma versão maior desta figura.
- Preparar três reservatórios de fluido, anexando uma seringa de 30 ou 60 mL com válvula de 3 vias Luer, com uma seringa de 3 mL e agulha anexada à válvula Luer também (como na figura 1A). Conecte a agulha a tubulação que se estende até o dispositivo microfluidic (como na figura 1A -B).
- Remover as bolhas de ar do reservatório e tubulação.
- Encher a seringa de 3 mL com tubo anexado com 1 x S Basal e inseri-lo na saída do Porto
- Suavemente aplique pressão na seringa até que o buffer aparece na parte superior dos orifícios de entrada.
- Conectar o controle de fluxo, tampão e tubulação de estímulo aos orifícios de entrada apropriado (como na figura 1B -C), garantindo que gotas de líquido estão presentes em ambos o porto de carregamento orifício e o tubo de buffer a ser anexado.
- Novo, suavemente aplique pressão na seringa que é conectado à porta de saída até que as gotas aparecem no worm da entrada do porto de carregamento.
- Inserir um pino de bloqueio sólido para o worm Porto de carregamento
- Remover a seringa da porta de saída e conecte o tubo de descarga ligado ao vácuo casa (-670 Torr).
- Inspecione o dispositivo para quaisquer bolhas no fluxo de canais, visualmente e através de confirmação através de um software compatível com a câmera de vídeo utilizados, tais como o software open-source Micro-Manger. Consulte a etapa 6 para obter dicas sobre como usar o Microgestor.
- Se as bolhas estiverem presentes, esperar por eles para desalojar ou ser absorvido o PDMS de parede antes de carregar qualquer animais; a presença de bolhas irá perturbar o fluxo adequado de fluidos através do dispositivo.
- Usando um filtro GFP, confirmar a dinâmica do fluxo adequado dentro do dispositivo antes da minhoca carregando a válvula de 3 vias de actuação e observando o switching de buffers.
- Determinar a dinâmica do fluxo adequado: observar a fluoresceína presente nas soluções de controle e buffer de fluxo ( Figura 2D -2E) alterar quando o valor do controle de fluxo é alterado pressionando o controle botão correspondente à válvula de 3 vias no link da válvula ( figura 1B).
- Depois de abrir o Microgestor, clique no " Live " para observar uma imagem ao vivo do dispositivo. Ligue a fonte de luz fluorescente para observar o fluxo de buffers no dispositivo ( Figura 2D -2E).
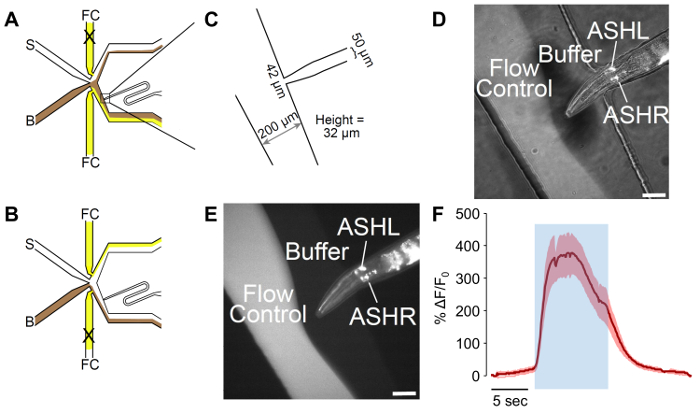
Figura 2: Um macho-adaptado microfluidic olfativo chip. (A), o fluxo de padrões do dispositivo quando o worm é exposto para reserva. Tampão (B) é mostrado na cor marrom, e controle de fluxo (FC) é mostrado em amarelo, com estímulo (S) em branco. O worm Porto de carregamento foi adaptado para incluir uma curva, o que permite o melhor controle da orientação do worm. (B) o fluxo de padrões do dispositivo quando o worm é exposto ao estímulo. Tampão (B) é mostrado na cor marrom, e controle de fluxo (FC) é mostrado em amarelo, com estímulo (S) em branco. (C) as medições do dispositivo adaptado como fabricada. O worm Porto de carregamento termina em uma 42 µm de abertura, com um canal de µm 50 projetado para a largura masculina. A altura medida dos canais é 32 µm, apesar de um alvo de 25 µm no design. (D-E) A presa masculino expressando p sra-6:: GCaMP3. O promotor sra-6 não é específico do ASH, e alguma expressão pode ser observada no neurônio ASI, embora não transientes de cálcio foram observadas na ASI. A imagem é (D), uma combinação de iluminação de campo claro e fluorescente, enquanto (E) só é fluorescente. As barras de escala denotam 42 µm. (F) o ASH neurônio responde à estimulação de glicerol 1m com atividade neural robusta. A área azul denota o tempo de estímulo de glicerol a 1 M. A região sombreada indica o erro-padrão, com n = 20 pulsos de sete vermes. Os traços vermelhos indicam respostas despolarizante. Os y-Axes mostram ΔF/F 0. Barra de escala denota 5 s. , por favor clique aqui para ver uma versão maior desta figura.
4. preparação de animal
Nota: ver referência 23.
- Respostas de ASH imaging para glicerol 1 M.
- Lugar aproximadamente 20 c. elegans machos que são positivos para p sra-6:: expressão de matriz GCaMP3 em uma placa de ágar nematoide crescimento média (NGM) inoculado com um gramado de OP50 Escherichia coli. Usar a expressão de Lino fluorescente e/ou um marcador de injeção de co para a identificação dos animais positivos matriz.
Nota: Animais positivos matriz serão fluorescem de acordo com o Lino usado (i.e., animais expressando GCaMP serão fluorescência verde sob luz azul estimulação, enquanto RCaMP animais serão fluorescem vermelho sob estimulação verde). Marcadores de co injeção podem variar de outras proteínas fluorescentes, tais como a GFP e RFP, a marcadores fenotípicos, como o rol-6, ou podem resgatar um fenótipo dominante, como a mutação de pha-1 28.- Se mexendo imediatamente antes do ensaio, escolher jovens adultos do sexo masculino. Se escolher o dia antes do ensaio, escolher machos larvas L4.
- Lugar aproximadamente 20 c. elegans machos que são positivos para p sra-6:: expressão de matriz GCaMP3 em uma placa de ágar nematoide crescimento média (NGM) inoculado com um gramado de OP50 Escherichia coli. Usar a expressão de Lino fluorescente e/ou um marcador de injeção de co para a identificação dos animais positivos matriz.
- Imaging as respostas CEM a 1 µM ascr #3.
- Pick aproximadamente 20 L4 c. elegans machos (fkEx98 [p pkd-2::GCaMP::SL2::dsRED + pBX-1]; Pha-1 (e2123ts); -o-5 (e1490); Lite-1 (ce314)) que são positivos para expressão de marcador dsRed injeção co.
Nota: dsRed expressão dentro os neurônios do raio do conto masculino é mais fácil de observar e confirmar que GCaMP expressão dentro os quatro neurônios CEM. - Isolar esses machos de hermafroditas em uma placa de ágar NGM semeado com um gramado de OP50 Escherichia coli para 5-14 h antes de realizar o experimento de imagem.
Nota: Os machos não isolados por um período mínimo de 5 h não respondem comportamentalmente a ascr #3 e, portanto, podem apresentar ainda menos transientes de cálcio para o ascaroside do que o observado aqui.
- Pick aproximadamente 20 L4 c. elegans machos (fkEx98 [p pkd-2::GCaMP::SL2::dsRED + pBX-1]; Pha-1 (e2123ts); -o-5 (e1490); Lite-1 (ce314)) que são positivos para expressão de marcador dsRed injeção co.
5. Carga animal
Nota: ver refefence 1.
- Escolher um verme em uma placa de ágar não-semeada NGM usando técnicas de manutenção padrão worm.
- Picareta vermes por em chamas uma picareta (feita de fio de platina achatado), escolhendo as bactérias para a escolha, e " enxugando " um verme para buscá-lo. Coloque delicadamente o verme na chapa de novo, permitindo-lhe sair por conta própria.
- Adicionar aproximadamente 5 mL de 1x S Basal para a placa não-semeada, tal que a placa está inundada.
- Desenhar a minhoca em uma seringa de carregamento (ou seja, seringa de 3 mL com tubo anexado) que tenha sido previamente enchida com 1 x Basal de S.
- Não se esqueça de chupar o worm só para o tubo, não todo o caminho para a seringa.
Nota: Se o worm viaja para a seringa, é quase impossível de recuperá-lo para o tubo.
- Não se esqueça de chupar o worm só para o tubo, não todo o caminho para a seringa.
- Desligar o vácuo para parar o fluxo girando a válvula de saída Luer.
- Retire o pino sólido bloqueando o worm Porto de carregamento
- Girar a válvula Luer conectada à porta de saída ( figura 1B), para que ele está descarregando.
Nota: Use um vídeo ao vivo alimentar ao carregar o worm para confirmar a localização e orientação do animal (etapas 5.8-5.13). - Inserir o sem-fim do tubo para o worm Porto de carregamento de carga
- Suavemente aplique pressão na seringa até que o verme aparece no canal de carregamento.
- Se o worm começa a entrar no canal posição invertida, puxar o êmbolo da seringa para impedir a entrada do canal de worm.
- Interruptor entre aplicação e invertendo a pressão até que a cabeça entre o canal primeiro.
- Abrir o vácuo, girando a válvula de 3 vias Luer conectado à porta de saída para abri-lo a vácuo em vez de atmosfera.
- Pressionar manualmente, pressionando o êmbolo da seringa para orientar e coloque a cabeça de minhoca, tal que ele é exposto para o canal do fluxo de reserva, mas não tão longe que a cabeça pode circular livremente ( Figura 2 D-2E).
6. Estímulo e aquisição
- usando um software de código-fonte aberto microscopia, como Gerenciador de Micro, gravar, capturando imagens como uma pilha TIFF em 10 quadros/s usando a excitação de luz azul (470 nm) por 30 s.
- Definir a exposição no menu principal para 100 ms.
- aberto " Acq multi D. " no menu principal do software. Definir o " número " para " 300, " e o " intervalo de " para " 0. " clique " adquirir! " para adquirir o vídeo.
- Aplicar um pulso de s 10 do estímulo 5 s após iniciar a aquisição. Ajustar a duração da aplicação de estímulos como desejado.
- Depois de adquirir 5 s de vídeo, altere a válvula de 3 vias, controlando o buffer de controle de fluxo para aplicar o estímulo para o animal que está sendo testado. Clique no botão mais à esquerda no link da válvula ( figura 1B).
- Após 10 s de exposição de estímulo (este tempo pode ser ajustado como desejado pelo usuário), alterar o fluxo de buffers pressionando novamente o botão mais à esquerda no link válvula.
- Registro sob reserva somente até a janela de 30-s está completa para permitir que a fluorescência de Lino retornar à linha de base.
- Repetir como desejado. Espere 30 s entre o fim de aquisição e o início do próximo julgamento.
7. Análise de imagem
- abrir a pilha TIFF com o software open-source, ImageJ, arrastando o arquivo para a janela do ImageJ.
- Clique usando o cursor e arraste para definir a região de interesse (ROI) em torno do neurônio de interesse. Definir a região para incluir o soma do neurônio de interesse (como na Figura 3A).
- Plot z-pilha da intensidade da fluorescência do ROI através de pilhas clicando em Open-> imagem - > pilhas - > traçar perfil do eixo z.
- Clique " lista " na janela que se abre. Clique em Editar - > copiar para copiar os valores. Cole os valores em um programa de planilha.
- Analisar a fluorescência de fundo para cada pulso arrastando o ROI para uma região do verme que não contenha a expressão GCaMP.
- Realizar a subtração de fundo para cada pulso subtraindo o valor de fluorescência do fundo do valor de intensidade de fluorescência neurônio.
- ΔF/F 0 para cada quadro de cada pulso de calcular.
- F calcular 0 como o valor de intensidade média do ROI para primeiro 1 s da aquisição (por exemplo, quadros 1-10).
- Calcular ΔF/F 0 dividindo o valor subtraído de fundo para o quadro de interesse pelo valor calculado F 0.
- Repita para cada neurônio fotografada e cada pulso de estímulo.
- Dos neurônios com perfis de resposta consistente, como ASH, média de todos os pulsos para cada neurônio e calcular o SEM (como na Figura 2F).
- Plotar a média ΔF/F 0 com SEM ao longo do tempo para cada neurônio.
Nota: Neste caso, é prática comum incluir heatmaps das respostas neuronais individuais de cada julgamento também. Em neurônios que não exibem alterações consistentes em transientes de cálcio após a exposição a estímulos através de estimulações repetidas, ou em indivíduos diferentes 23, pode ser mais aplicável para mostrar traços de pulso individuais (como em a Figura 4). Consulte a discussão para obter detalhes sobre como determinar como exibir os dados.
Access restricted. Please log in or start a trial to view this content.
Resultados
Um exemplo de configuração do dispositivo global pode ser visto na figura 1A-B. Figura 1A mostra a construção do reservatório apropriado e instalação. A figura 1B mostra as conexões dos reservatórios para o dispositivo microfluidic. Figura 1 mostra um dispositivo microfluidic com portas individuais para maior clareza.
Access restricted. Please log in or start a trial to view this content.
Discussão
O chip olfativo macho-adaptado incorpora uma vez em um porto de carregamento mais estreito, o que permite maior controle da orientação e para a captura eficiente de masculino c. elegans. Isto permite a visualização de ambos os membros direito e esquerdos da neuronais pares bilaterais, sem a necessidade de empilhamento z. Esta curva leva a uma orientação longe vertical 100% do tempo em worms, onde destina-se apenas um par bilateral com um marcador fluorescente, como o ASH (Figura 2D
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Gostaríamos de agradecer a Manuel Zimmer nos fornecendo o arquivo de projeto inicial que foi adaptado para uso com machos; Frank Schroeder para a síntese e o fornecimento da ascr #3; Ross Lagoy para o insight e assistência de imagem e análise; e Laura Aurilio para a fabricação de mestre e que, ao lado de Christopher Chute, contribuiu para a revisão deste manuscrito. Financiamento para este trabalho foi fornecido sob concessão do National Institutes of Health 1R01DC016058-01 (J.S.), a concessão do National Science Foundation CBET 1605679 (D.R.A.) e o prémio de carreira Burroughs Wellcome em Interface científica (D.R.A.).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Silicon Wafer | University Wafer | 452 | |
| SU-8 2035 | MicroChem | Y111070-0500L1GL | |
| Developer | MicroChem | Y020100-4000L1PE | |
| Wafer Mask | Cad/Art Services | - | Custom order. Printed at 25,000 dpi. |
| Sylgard-184 | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| 1.0 mm Dermal Punches | Acuderm Inc. | P150 | |
| Soft Tubing | Cole-Palmer | EW-06419-01 | |
| Hard Tubing | IDEX Health & Science | 1622 | |
| Pins | New England Small Tube | NE-1027-12 | |
| Blocking Pins | New England Small Tube | 0.415/0.425" OD x .500 Long | Batch PB07027 |
| 3 mL syringes | BD | 309657 | |
| 30 mL syringes | Vitality Medical | 302832 | Used as buffer reservoirs. |
| Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer | Component Supply Company | NE-231PL-50 | |
| Stopcocks with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile | Cole-Palmer | EW-30600-07 | |
| Fisherfinest Premium Cover Glass | Fisher Scientific | 12-548-5M | |
| Mercator Control System LF-5 Plasma System | Mercator | LF-5 | |
| Scotch Tape | Scotch | BSN43575 | |
| Series 20 Chamber | Warner Instruments | P-2 | |
| Vacuum Desicator | Bel-Art Scienceware | 420250000 | 24 cm inner diameter. |
| Weigh Boats | Cole-Palmer | EW-01017-27 | |
| Classic Plus Balance | Mettler Toledo | PB1501-S/FACT | |
| Glass Pasteur Pipettes | Cole-Palmer | EW-25554-06 | |
| Transfer pipettes | Genesee Scientific | 30-202 | |
| Oven | Sheldon Manufacturing Inc | 9120993 | Model Number: 1500E. |
| 60 mm, non-vented, sharp edge Petri dishes | TriTech Research | T3308 | |
| Zeiss Axio Observer.A1 | Zeiss | - | |
| Hammamatsu Orca Flash 4.0 Digital CMOS | Hammamatsu | C11440-22CU | |
| Blue Fluorescent Light | Lumencor | SOLA SM6-LCR-SA | 24-30V/7.9A DC. |
| Illumination Adaptor | Zeiss | 423302-0000 | |
| Series 1 and 2 Miniature Inert PTFE Isolation Valve | Parker | 001-0017-900 | 3-way valve for controlling flow. |
| ValveLink8.2® | AutoMate Scientific | 01-18 | Flow Switch Controller |
| Micro Manager | Micro-Manager | - | Free software, can be downloaded at: https://www.micro-manager.org/wiki/Download_Micro-Manager_Latest_Release |
| ImageJ | ImageJ | - | Free software, can be downloaded at: https://imagej.nih.gov/ij/download.html |
| Agar, Bacteriological Grade | Apex | 9012-36-6 | |
| Peptone | Apex | 20-260 | |
| CaCl2 | VWR | BDH0224-1KG | |
| MgSO4 | Sigma-Aldrich | 230391-1kg | |
| Cholesterol | Alfa Aesar | A11470 | |
| Ethanol | Sigma-Aldrich | 270741-4L | |
| Tetramisole | Sigma-Aldrich | L9756-10(G) | Store at 4 °C. |
| Fluorescein | Sigma-Aldrich | FD2000S-250mg | Light Sensitive. Store in photoprotective vials. |
| Glycerol | Sigma-Aldrich | G6279-1L | |
| Ascaroside #3 | - | - | Synthesized in the Schroeder Lab (Cornell University). |
| NaCl | Genesee Scientific | 18-215 | |
| KH2PO4 | BDH | BDH9268.25 | |
| K2HPO4 | J.T. Baker | 3252-025 | |
| ASH GCaMP3 line | - | - | CX10979 (KyEx2865 [psra-6::GCAMP3 @ 100 ng/uL]). Developed in Bargmann lab. Provided from Albrecht Lab library. |
| CEM GCaMP6 line | - | - | JSR49 (FkEx98[ppkd-2::GCaMP::SL2::dsRED + pBX-1]; pha-1(e2123ts); him-5(e1490); lite-1(ce314)). Developed by Robyn Lints. Provided from Srinivasan Lab library. |
| E. coli (OP50) | Caenorhabditis Genetics Center | OP50 | |
| "Reservoir" | - | - | To create a Reservoir: A "30 mL syringe", is connected to a "Stopcock with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile", which is connected to a "3 mL syringe" and a "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer". The "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer" is then inserted into "Soft Tubing" approximately 1/3 of the way down the needle. |
Referências
- Lagoy, R. C., Albrecht, D. R. Microfluidic Devices for Behavioral Analysis, Microscopy, and Neuronal Imaging in Caenorhabditis elegans. Methods Mol Biol. 1327, 159-179 (2015).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Curr Opin Neurobiol. 19 (5), 561-567 (2009).
- Chronis, N. Worm chips: Microtools for C. elegans biology. Lab on a Chip. 10 (4), 432-437 (2010).
- Lee, H., Crane, M. M., Zhang, Y., Lu, H. Quantitative screening of genes regulating tryptophan hydroxylase transcription in Caenorhabditis elegans using microfluidics and an adaptive algorithm. Integr Biol (Camb). 5 (2), 372-380 (2013).
- Lockery, S. R., et al. A microfluidic device for whole-animal drug screening using electrophysiological measures in the nematode C. elegans. Lab Chip. 12 (12), 2211-2220 (2012).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nat Commun. 7, 13023(2016).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 110 (45), E4266-E4273 (2013).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Front Mol Neuro. 6, 2(2013).
- Badura, A., Sun, X. R., Giovannucci, A., Lynch, L. A., Wang, S. S. H. Fast calcium sensor proteins for monitoring neural activity. Neurophotonics. 1 (2), 025008(2014).
- Tatro, E. T. Brain-wide imaging of neurons in action. Front Neural Circuits. 8, 31(2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat Methods. 6 (12), 875-881 (2009).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Greene, J. S., Dobosiewicz, M., Butcher, R. A., McGrath, P. T., Bargmann, C. I. Regulatory changes in two chemoreceptor genes contribute to a Caenorhabditis elegans QTL for foraging behavior. Elife. 5, (2016).
- Kim, K., et al. Two Chemoreceptors Mediate Developmental Effects of Dauer Pheromone in C. elegans. Science. 326 (5955), 994-998 (2009).
- McGrath, P. T., et al. Parallel evolution of domesticated Caenorhabditis species targets pheromone receptor genes. Nature. 477 (7364), 321-325 (2011).
- Schmitt, C., Schultheis, C., Husson, S. J., Liewald, J. F., Gottschalk, A. Specific Expression of Channelrhodopsin-2 in Single Neurons of Caenorhabditis elegans. PLoS ONE. 7 (8), e43164(2012).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Nervous System of the Nematode Caenorhabditis elegans. Phil Trans of the Royal Soc of Lon. 314 (1165), 1(1986).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat Meth. 4 (9), 727-731 (2007).
- Chute, C. D., Srinivasan, J. Chemical mating cues in C. elegans. Semin Cell Dev Biol. 33, 18-24 (2014).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook. , 1-22 (2013).
- Narayan, A., et al. Contrasting responses within a single neuron class enable sex-specific attraction in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 113 (10), E1392-E1401 (2016).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Sammut, M., et al. Glia-derived neurons are required for sex-specific learning in C. elegans. Nature. 526 (7573), 385-390 (2015).
- Sulston, J. E., Albertson, D. G., Thomson, J. N. The Caenorhabditis elegans male: postembryonic development of nongonadal structures. Dev Biol. 78 (2), 542-576 (1980).
- Hilliard, M. A., et al. In vivo imaging of C. elegans ASH neurons: cellular response and adaptation to chemical repellents. The EMBO Journal. 24 (1), 63-72 (2005).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Cáceres, I. dC., Valmas, N., Hilliard, M. A., Lu, H. Laterally Orienting C. elegans Using Geometry at Microscale for High-Throughput Visual Screens in Neurodegeneration and Neuronal Development Studies. PLoS ONE. 7 (4), e35037(2012).
- Schrodel, T., Prevedel, R., Aumayr, K., Zimmer, M., Vaziri, A. Brain-wide 3D imaging of neuronal activity in Caenorhabditis elegans with sculpted light. Nat Methods. 10 (10), 1013-1020 (2013).
- García, L. R., Portman, D. S. Neural circuits for sexually dimorphic and sexually divergent behaviors in Caenorhabditis elegans. Curr Opin Neurobiol. 38, 46-52 (2016).
- Clokey, G. V., Jacobson, L. A. The autofluorescent "lipofuscin granules" in the intestinal cells of Caenorhabditis elegans are secondary lysosomes. Mech Ageing Dev. 35 (1), 79-94 (1986).
- Coburn, C., et al. Anthranilate Fluorescence Marks a Calcium-Propagated Necrotic Wave That Promotes Organismal Death in C. elegans. PLoS Biology. 11 (7), e1001613(2013).
- Macosko, E. Z., et al. A hub-and-spoke circuit drives pheromone attraction and social behaviour in C. elegans. Nature. 458 (7242), 1171-1175 (2009).
- Park, D., et al. Interaction of structure-specific and promiscuous G-protein-coupled receptors mediates small-molecule signaling in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 109 (25), 9917-9922 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados