Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verwenden einen angepasste mikrofluidischen olfaktorische Chip für die Bildgebung neuronaler Aktivität als Reaktion auf Pheromone in männlichen C. Elegans Kopf Neuronen
In diesem Artikel
Zusammenfassung
Die Verwendung eines angepassten "olfaktorischen Chips" für die effiziente Kalzium Imaging von C. Elegans Männchen ist hier beschrieben. Studien über männliche Einwirkung von Glycerin und ein Pheromon werden ebenfalls angezeigt.
Zusammenfassung
Die Verwendung von Kalzium Indikatoren wurde unser Verständnis der neuronalen Dynamik und Regulierung erheblich verbessert. Der Fadenwurm Caenorhabditis Elegans, mit seiner völlig zugeordneten Nervensystem und transparente Anatomie, stellt ein ideales Modell für Echtzeit-neural Dynamics mit Kalzium Indikatoren zu verstehen. In Kombination mit mikrofluidischen Technologien und experimentellen Designs sind Kalzium-Bildgebungsstudien mit Hilfe dieser Indikatoren in frei bewegliche und eingeschlossene Tiere durchgeführt. Allerdings haben die meisten frühere Studien unter Verwendung Trapping-Geräte, wie den olfaktorischen Chip beschrieben in Chronis Et Al., Geräte für den Einsatz in der häufiger Zwitter, wie das seltenere Männchen sowohl morphologisch und strukturell ist unähnlich. Ein angepasster olfaktorischer Chip wurde konstruiert und gefertigt für mehr Effizienz in der männlichen neuronale Bildgebung mit jungen Erwachsenen Tieren. Eine Wende wurde der Wurm Verladehafen, die Tiere zu drehen und ermöglicht die Trennung der einzelnen Neuronen innerhalb eines bilateralen Paares in 2D Bildgebung eingegliedert. Würmer sind ein kontrollierter Informationsfluss Geruchsstoff innerhalb des Gerätes mikrofluidischen ausgesetzt wie in den vorhergehenden Zwitter Studien beschrieben. Kalzium-Transienten sind dann mit der Open-Source-Software ImageJ analysiert. Die hier beschriebene Verfahren ermöglichen eine erhöhte Menge an männlich-basierte C. Elegans Kalzium Bildgebungsstudien vertiefen unser Verständnis der Mechanismen der Geschlecht-spezifische neuronale Signale.
Einleitung
Mikrofluidischen Geräte bieten verstärkten Zugang zu genau kontrollierten Umgebungen, wobei Tiere, wie z. B. der Fadenwurm C. Elegans, kann experimentell manipulierte1sein. Diese Studien umfassen Verhaltens Assays, Kalzium bildgebenden oder sogar Vorführungen für bestimmte Phänotypen, wodurch genauere Messungen von experimentellen Ergebnissen1,2,3,4, 5,6. Mikrofluidik bieten kleinen flüssigen Bedingungen durch die ausführliche Experimente ausgeführt werden können, während die Nutzung minimaler Mengen von Reagenzien. Gibt es eine konstante Produktion von neuen mikrofluidischen Gerätedesigns und die Verwendung der einzelnen variiert von Arenen, die für die natürliche sinusförmige Bewegung von C. Elegans in behavioral Assays und neuronale bildgebende Geräte in neuronale Bildgebung auffangen ermöglichen und olfaktorischen Studien, die Geräte, die für Hochdurchsatz-phänotypische Analyse in genetischen4,5,6,7Bildschirme ermöglichen. Im Anschluss an die Herstellung von einem master-Form, mikrofluidischen Geräte sind preisgünstig zu konstruieren – angesichts die Wiederverwendbarkeit des Meisters — und einfach zu bedienen, so dass für schnelle Datengenerierung über Hochdurchsatz-Studien. Die Herstellung von Geräten, die Verwendung von Polymeren wie z. B. Polydimethylsiloxan (PDMS) ermöglicht die Erstellung von neuen Geräten innerhalb von Stunden.
Calcium bildgebenden mithilfe genetisch codierte Kalzium Indikatoren (GECIs) ausgedrückt in Zielzellen der neuronalen Dynamik dieser Zellen in Echtzeit8,9,10,11messen. Die transparentere Natur von C. Elegans ermöglicht die Aufzeichnung der fluoreszierenden Ebenen dieser Proteine in lebenden Tieren. Traditionell, GECIs verlassen sich auf das grün fluoreszierende Protein (GFP)-basierte Sensor GFP-Calmodulin-M13 Peptid (GCaMP), obwohl neuere Studien diese Sensoren für besseres Signal-Rausch-Verhältnis und rot-verschoben Erregung Profile angepasst haben. Im Anschluss an die Entwicklung der GCaMP3 Proteine mit diesen Spezifikationen haben unterschiedliche, einschließlich Sensoren wie GCaMP6s und GCaMP6f (langsame und schnelle Fluoreszenz ab-Preise, bzw.), sowie RFP-Calmodulin-M13-Peptid (RCaMP), die hat einen rot-verschoben Aktivierung-Profil. Die Kombination aus diesen GECIs mit C. Elegans zellspezifische gen Promotorsequenzen kann gezielt Zellen von Interesse, besonders sensorischen Neuronen12,13,14,15 , 16.
Während die Benutzerfreundlichkeit C. Elegans in mikrofluidischen Studien hervorgeht, haben fast alle Studien auf Hermaphroditen konzentriert. Trotz Männchen entfallen nur 0,01-0,02 % der Bevölkerung Wildtyp, können wertvolle Erkenntnisse ergeben sich aus der Charakterisierung. Während der physischen Connectome Zwitter Nervensystem vollständig für Jahrzehnte17zugeordnet wurde, bleibt das männliche Connectome unvollständig, vor allem im Kopfbereich der Tiere18. Die Verwendung von Kalzium Bildgebung bei Männern wird mithelfen, schaffen ein Verständnis für die männlichen Nervensystems und die Unterschiede, die zwischen den beiden Geschlechtern auftreten. Die geringere Größe der Männchen C. Elegans verhindert effektiv und zuverlässig Fallenjagd in der Ladehäfen des traditionellen olfaktorischen Geräte für größere Hermaphroditen. Um dieses Problem anzugehen, eine modifizierte Version des olfaktorischen Chip Chronis19 wurde mit ein schmaler Verladehafen, eine niedrigere Kanalhöhe entwickelt und stellt sich in der Wurm Ladeöffnung (die das Tier zu drehen), ermöglicht die Visualisierung von bilateralen links/rechts neuronale Paare. Dieses Design erlaubt: (1) die effektive Trapping von jungen Erwachsenen Männern, (2) ein zuverlässiger Ausrichtung des Tieres für die Visualisierung von beide Mitglieder des bilateralen verbundenen Neuronen und (3) die präzise Abbildung der neuronalen Aktivität im männlichen Neuronen.
Immer mehr zeigen Studien, dass C. Elegans Männer anders als Hermaphroditen zu einer Vielzahl von Ascarosides (Ascr) oder Nematoden Pheromone20,21,22,23 reagieren ,24. Daher entwickeln ein Verständnis der neuronalen Dynamik und Darstellungen innerhalb der männlichen Connectome noch relevant geworden. Männliche C. Elegans enthalten 87 geschlechtsspezifische Neuronen nicht vorhanden in der Zwitter25,26, verändern das Connectome in als-noch unbestimmten Arten. In der Lage, diese einzigartige neuronale Dynamik Bild erlaubt uns, besser zu verstehen, geschlechtsspezifische Reaktionen und Neuronale Repräsentationen.
Dieses Protokoll beschreibt die Verwendung eines männlichen angepasst olfaktorische Chips für die neuronale Bildgebung von männlichen C. Elegans Chemosensation. Die nozizeptiven Neuron Asche reagiert zuverlässig auf 1 M Glycerin bei Männern, konsistent mit früheren hermaphroditischen Studien27. Exposition gegenüber Ascarosides kann Reaktionen hervorrufen, die Variable von Tier zu Tier sind, erfordern eine größere Anzahl von Tieren getestet werden. Die Antwort der männlich-spezifische CEM Neuronen zuvor, durch Elektrophysiologie und Kalzium, die bildgebenden Verfahren, nachweislich zu Ascaroside #323variabel reagieren.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Gerät Herstellung
Hinweis: siehe Hinweis 1.
Hinweis: master Silikonformen wurden hergestellt mit photolithographische Standardtechniken für Musterung SU-8 Photoresist auf einem Silizium-master 1 ,- 7. Fotomasken für Wafer Musterung wurden bei 25.000 dpi gedruckt. Männlich-angepasst Gerätefunktionen Chronis olfaktorische Chip design 19 mit einer Änderung in der Wurm Verladehafen, Anpassung eine Design von M. Zimmer (persönliche Korrespondenz, 2016) erhalten. Eine Wende ist enthalten, um die Rotation der Tiere zu kontrollieren. Die Breite des Wurms laden Hafen-Kanal ist auf 50 μm verengt. Alle Kanäle sind 32 μm groß. Sobald ein Silizium-master-Form für den Benutzer verfügbar ist, kann der Benutzer die nachfolgenden folgen Protokoll, wie zuvor beschrieben 1.
- Mix PDMS Basis und Aushärtung Agent im Verhältnis 10:1 Gew.
- Mischen mit Transfer Pipetten.
- Die Mischung in ein Vakuum Exsikkator für 1 h, Entgasen, bis alle sichtbare Luftblasen entfernt werden.
- Den Teig auf ein Silikon Form Meister in einem 150 mm Durchmesser Teller bis 5 mm dick (100 g) ist. Entfernen alle Luftblasen oder Staub, die zu der Mischung eingeführt wurden mithilfe einer Pasteurpipette.
- Bei 65 ° C für mindestens 3 Stunden oder über Nacht backen.
- Die PDMS aus der Form mit einem Skalpell schneiden und schneiden die separate Geräte auseinander mit einer Rasierklinge.
- Einlass und Auslass Löcher mit einem 1 mm dermal Punch Stanzen.
- Spülen die Löcher mit dH 2 O, Ethanol, und wieder mit dH 2 O Partikel aus dem Stempel entfernen. Trocknen Sie das Gerät in einen Stream Luftimpuls.
- Reinigen, Kanal-Seiten und der Oberseite des Gerätes mit Klebeband, entfernen von Staub und Schmutz bleiben auf dem Gerät, um erfolgreiche Verklebung zu ermöglichen.
- Plasma-Band Gerät, Kanal-Seite nach unten, zu einem Deckglas Nr. 1.
- Expose Deckglas und Gerät (Kanal-Seite nach oben), Luft-Plasma mit Hilfe von Bedingungen, mit denen für die korrekte Verklebung, z. B. 100 W für 30 s oder 24 W 60 s.
Hinweis: Einstellungen können angepasst werden, um die Verklebung Effizienz zu verbessern. Die Plasma-Bonding-Bedingungen sind nicht so wichtig wie die richtige Reinigung beim Versuch zur Verbesserung der Effizienz der Verklebung. Eine nicht ausreichend gereinigte Gerät wird nicht verkleben, auch unter Bedingungen ideal Plasma. - Invertieren das Deckglas auf der Kanal-Seite für das Gerät und drücken Sie nach unten mit dem Daumen für 5 s.
- Expose Deckglas und Gerät (Kanal-Seite nach oben), Luft-Plasma mit Hilfe von Bedingungen, mit denen für die korrekte Verklebung, z. B. 100 W für 30 s oder 24 W 60 s.
2. Vorbereitung-Puffer
- verdünnt 1 x S Basal (100 mM NaCl und 0,05 M KPO 4, pH 6.0) ab Lager eine sterile 10 X.
- 1 M Tetramisole Lager, eine Endkonzentration von 1 mM 1 x S Basal zu verdünnen, denn alle Lösungen Puffer.
- Beide Fluorescein hinzufügen der " fließen Kontrolle " und " Puffer " Reservoire.
- Erstellen eine 100 mg/mL-Aktie von Fluorescein in 1 x S basale.
- Der Börse zu Endkonzentrationen von 1 µg/mL in die Flusssteuerung und 0,1 µg/mL im Puffer verdünnen.
- Die Reize zu schaffen.
- Verdünntem Glycerin, eine Endkonzentration von 1 M 1 X S basale.
- Verdünnte Ascaroside #3 (Ascr #3) um eine Endkonzentration von 1 µM in 1 X S basale.
3. Geräte-Setup
Hinweis: siehe 1.

Abbildung 1. Mikrofluidische Geräteinstallation. (A) Behälter und Rohre. 30 mL Spritze ohne ein Kolben dient als die " Reservoir. " diese zu einem Luer-Ventil mit drei Flow Optionen angebracht ist. Ein Auslass ist verbunden mit einer 3 mL Spritze mit einem Kolben, während die andere mit einer Nadel (Orange) verbunden ist, die in den Schlauch eingefügt werden, die eine zu dem Gerät mikrofluidischen Verbindung. (B) die gesamte Einrichtung von der mikrofluidischen imaging Experiment. Das Gerät befindet sich auf einer Bühne von einem umgekehrten Epifluoreszenz Mikroskop über die Objektive. Die " fließen Kontrolle " Puffer reist durch ein 3-Wege-Ventil, das von einer Einheit auf dem Regal über das Setup gesteuert wird. Zeilen, die Puffer werden dann in die entsprechenden Geräteports eingefügt. (C) die Häfen von mikrofluidischen Gerät. Die " fließen Kontrolle " Häfen flankieren die anderen Einlass-Ports: die " Anregung " und " Puffer " Häfen. Die " Auslauf " Port ist die am weitesten rechts. Aufgrund der Lage der Wurm laden Arena die " Wurm laden " Port ist der Zentrale-die meisten Port auf dem Gerät. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Bereiten drei Flüssigkeitsbehälter durch das Anbringen einer 30 oder 60 mL Spritze auf 3-Wegeventil Luer mit 3 mL Spritze und Nadel das Luer-Ventil als auch (wie in Abbildung 1A). Verbinden Sie die Nadel mit Schlauch, der an das Gerät mikrofluidischen erstreckt (wie in Abbildung 1A -B).
- Entfernen der Luftblasen aus dem Reservoir und Schlauch.
- Füllen Sie die 3 mL Spritze mit angeschlossenen Schlauch mit 1 x S Basal und stecken Sie ihn in die Steckdose Port
- Sanft üben Sie Druck auf die Spritze, bis der Puffer am oberen Rand der Saugbohrungen erscheint.
- Schließen Sie die Steuerung des Datenflusses, Puffer und Reiz Schläuche an entsprechende Saugbohrungen (wie in Abbildung 1 b -C), um sicherzustellen, dass Flüssigkeitstropfen auf beide die Ladeöffnung vorhanden sind Loch und der Puffer-Schlauch befestigt werden.
- Wieder sanft üben Druck auf die Spritze, die an der Auslassöffnung angeschlossen ist, bis Tröpfchen im Laden Hafen Einlass Wurm erscheinen.
- Eine solide blockierende Bolzen in die Wurm laden Port
- Ziehen Sie die Spritze aus der Auslassöffnung und befestigen Sie die Ablaufleitung angeschlossen um das Haus Vakuum (-670 Torr).
- Inspizieren das Gerät für Bläschen in den Fluss-Kanäle, optisch und durch video Bestätigung über eine Software mit der Kamera kompatibel verwendet, wie die Open-Source-Software Micro-Manger. Finden Sie in Schritt 6 Tipps zur Verwendung von Micro-Manager.
- Wenn alle Bläschen vorhanden sind, warten Sie, sie zu vertreiben oder in der PDMS aufgesogen werden Wand vor dem Laden alle Tiere; Bläschen wird die richtige Strömung von Flüssigkeiten durch das Gerät stören.
- Richtige Strömungsdynamik innerhalb des Gerätes bestätigen mit einem GLP-Filter vor dem Wurm durch Betätigung der 3-Wege-Ventil und beobachten den Wechsel der Puffer laden.
- Bestimmen Sie die richtige Strömungsdynamik: beobachten die Fluorescein in die Strömung Kontrolle und Puffer-Lösungen vorhanden ( Abb. 2D -2E) ändern, wenn der Fluss Steuerelementwert geändert wird, durch Drücken der Schaltfläche für das 3-Wege-Ventil auf den Ventil-Link ( Abbildung 1 b).
- Nach dem Micro-Manager zu öffnen, klicken Sie auf " Live ", ein live-Bild des Geräts zu beobachten. Die fluoreszierende Lichtquelle zu beobachten, den Fluss der Puffer in das Gerät einschalten ( Abb. 2D -2E).
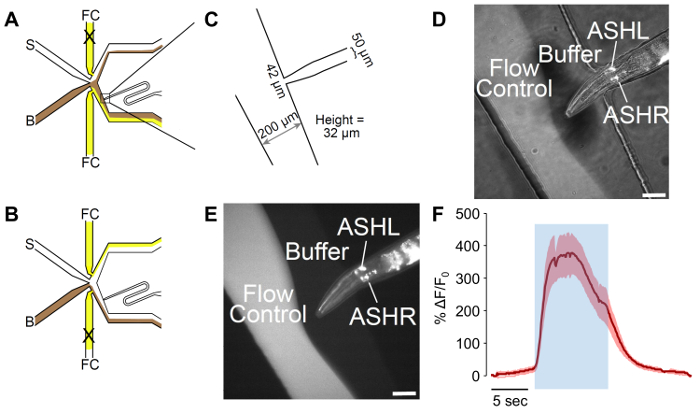
Abbildung 2: Ein Mann angepasst mikrofluidischen olfaktorische Chip. (A) den Fluss Muster des Gerätes bei der Wurm ausgesetzt ist auf Puffer. Puffer (B) ist in braun, und Flusssteuerung (FC) ist in gelb, mit Stimulus (S) in weiß angezeigt. Der Wurm Verladehafen wurde angepasst, um eine Kurve enthalten, die für eine bessere Kontrolle der Wurm Orientierung ermöglicht. (B) den Fluss Muster des Gerätes bei der Wurm auf Reiz ausgesetzt ist. Puffer (B) ist in braun, und Flusssteuerung (FC) ist in gelb, mit Stimulus (S) in weiß angezeigt. (C) Messungen des Gerätes als vorgefertigte angepasst. Der Wurm Verladehafen endet in einem 42 µm öffnen, mit einem 50 µm-Kanal für die männlichen breite ausgelegt. Die gemessene Höhe der Kanäle ist 32 µm, trotz ein Ziel von 25 µm im Design. (D-E) A gefangen männlichen Ausdruck p Sra-6:: GCaMP3. Der Sra-6-Promoter ist nicht Asche-spezifisch, und einige Ausdruck in der ASI-Nervenzelle beobachtet werden kann, obwohl kein Kalzium Transienten ASI beobachtet wurden. Das Bild ist (D) eine Kombination von Hellfeld und fluoreszierende Beleuchtung (E) Leuchtstofflampen nur. Der Maßstabsbalken bezeichnen 42 µm. (F) die Asche Neuron reagiert auf 1 M Glycerin Stimulation mit robuste neuronale Aktivität. Der blaue Bereich kennzeichnet die Zeit des 1 M Glycerin Stimulus. Die schattigen Bereich kennzeichnet den Standardfehler mit n = 20 Impulse aus sieben Würmer. Die roten Spuren bezeichnen depolarisierende Antworten. Die Y-Achsen zeigen ΔF/F 0. Die Maßstabsleiste bezeichnet 5 s. Klicken Sie bitte hier, um eine größere Version dieser Figur.
4. Tier Vorbereitung
Hinweis: siehe Referenz 23.
- Imaging Asche Antworten auf 1 M Glycerin.
- Platz ca. 20 C. Elegans-Männchen, die positiv für p Sra-6 sind:: GCaMP3-Array-Ausdruck auf Nematoden Wachstum Mittel-(NGM) Nährbodenplatte ausgesät mit einem Rasen von OP50 E. Coli. Verwenden Sie den Ausdruck von fluoreszierenden GECI und/oder ein Co-Injektion-Marker zur Identifizierung von Array-positiven Tieren.
Hinweis: Array positive Tiere fluoreszieren nach der GECI verwendet (z. B. Tiere, die mit dem Ausdruck GCaMP fluoreszieren grün unter Blaulicht-Stimulation, während RCaMP Tiere rot unter Stimulation grünes Licht fluoreszieren werden). Co-Injektion Marker können zwischen anderen fluoreszierende Proteine, wie GFP und RFP, und phänotypische Markierungen, wie Rol-6, oder einen dominanten Phänotyp, wie z. B. der pha-1 Mutation 28 retten können.- , Wenn unmittelbar vor dem Test, junge Männchen Pick picking. Wenn am Tag vor dem Test Kommissionierung, pick L4 Larven Männchen.
- Platz ca. 20 C. Elegans-Männchen, die positiv für p Sra-6 sind:: GCaMP3-Array-Ausdruck auf Nematoden Wachstum Mittel-(NGM) Nährbodenplatte ausgesät mit einem Rasen von OP50 E. Coli. Verwenden Sie den Ausdruck von fluoreszierenden GECI und/oder ein Co-Injektion-Marker zur Identifizierung von Array-positiven Tieren.
- Imaging der CEM Antworten auf 1 µM Ascr #3.
- Pick ca. 20 L4 C. Elegans Männchen (fkEx98 [p Pkd-2::GCaMP::SL2::dsRED + pBX-1]; Pha-1 (e2123ts); ihn-5 (e1490); Lite-1 (ce314)) sind positiv für DsRed Co-Injektion Marker Ausdruck.
Hinweis: DsRed Ausdruck innerhalb der Ray-Neuronen der männlichen Erzählung ist einfacher zu beobachten und zu bestätigen, als GCaMP Ausdruck innerhalb der vier CEM Neuronen. - Isolieren diese Männer von Hermaphroditen auf einer NGM Nährbodenplatte ausgesät mit einem Rasen von OP50 E. Coli für 5-14 h vor der Durchführung der bildgebenden Experiments.
Hinweis: Männchen nicht isoliert für ein Minimum von 5 h reagieren nicht behaviorally Ascr #3 und kann daher noch weniger Kalzium Transienten, die Ascaroside als hier beobachtet aufweisen.
- Pick ca. 20 L4 C. Elegans Männchen (fkEx98 [p Pkd-2::GCaMP::SL2::dsRED + pBX-1]; Pha-1 (e2123ts); ihn-5 (e1490); Lite-1 (ce314)) sind positiv für DsRed Co-Injektion Marker Ausdruck.
5. Tierische be-
Hinweis: siehe Refefence 1.
- Wählen Sie einen Wurm auf einer ungesetzte NGM Nährbodenplatte mit standard Wurm Wartung Techniken.
- Pick Würmer durch Abflammen eine Kommissionierung (gemacht von abgeflachten Platindraht), Bakterien auf der Kommissionierung Kommissionierung und " Tupfen " ein Wurm um ihn abzuholen. Sanft lege den Wurm auf die neue Platte ermöglicht es, aus eigener kriechen.
- Die ungesetzte Platte ca. 5 mL 1 x S basale hinzufügen, so dass Platte überflutet wird.
- Zeichnen den Wurm in eine laden-Spritze (d. h. 3 mL Spritze mit angeschlossenen Schläuchen), die mit 1 x S basale vorausgefüllt wurde.
- Achten Sie darauf, den Wurm nur in den Schlauch, nicht den ganzen Weg in die Spritze zu saugen.
Hinweis: Wenn der Wurm in die Spritze reist, es ist fast unmöglich, es wieder in den Schlauch.
- Achten Sie darauf, den Wurm nur in den Schlauch, nicht den ganzen Weg in die Spritze zu saugen.
- Schalten Sie das Vakuum, den Fluss zu stoppen, durch drehen das Auslaßventil Luer.
- Entfernen Sie den festen Stift blockieren des Wurms laden Port
- Drehen Sie das Luer-Anschluss an die Auslassöffnung ( Abbildung 1 b) angeschlossen, so dass es Entlüftung ist.
Hinweis: Verwenden Sie eine live-Video-feed beim Laden des Wurms, bestätigen die Position und Ausrichtung des Tieres (Stufen 5,8-5.13). - Fügen Sie den Wurm Rohr in die Wurm Port laden laden
- Sanft üben Sie Druck auf die Spritze, bis der Wurm in den Laden-Kanal angezeigt wird.
- Wenn der Wurm anfängt, den Channel Tail-erste zu betreten, ziehen Sie den Spritzenkolben zu verhindern, dass den Wurm in den Kanal.
- Schalter zwischen dem Auftragen und Rückwärtsfahren Druck, bis der Kopf zuerst den Kanal eindringt.
- Öffnen das Vakuum durch das 3-Wegeventil Luer drehen an der Auslassöffnung zu öffnen, anstatt Atmosphäre Vakuum angeschlossen.
- Manuell Druck durch Niederdrücken des Spritzenkolbens zu orientieren und den Wurm Kopf zu platzieren, so dass es, um den Puffer-Strömungskanal, aber nicht so weit ausgesetzt ist, dass der Kopf frei bewegen können ( Abbildung 2-D-2E).
6. Reiz und Erwerb
- mit einem Open-Source-Mikroskopie-Software, wie Micro-Manager aufnehmen durch die Erfassung der Bilder als TIFF-Stack auf 10 Bilder/s mit Blaulicht-Anregung (470 nm) für 30 s. Stellen Sie die Belichtung auf dem Hauptmenü auf 100 Ms.
- Open
- " Multi-D Acq. " im Hauptmenü der Software. Festlegen der " Anzahl ", " 300, " und die " Intervall " zu " 0. " klicken Sie " erwerben! ", das Video zu erwerben.
- Übernehmen eine 10 s Puls der Impuls 5 s nach dem Start der Akquisition. Die Dauer des Reizes Anwendung wie gewünscht anpassen,.
- Nach der Übernahme von 5 s Video, ändern Sie die 3-Wege-Ventil kontrolliert den Durchfluss Kontrolle Puffer, um den Reiz für das Tier getestet gelten. Klicken Sie links auf den Ventil-Link ( Abbildung 1 b).
- Nach 10 s Stimulus ausgesetzt (diese Zeit kann eingestellt werden wie gewünscht durch den Benutzer), den Fluss von Puffern durch erneutes Drücken der linken Taste auf den Ventil-Link ändern.
- Rekord unter Puffer nur bis 30 s Fenster erlauben die GECI Fluoreszenz zum Ausgangswert zurück abgeschlossen ist.
- Wiederholen, wie gewünscht. S zwischen dem Ende des Erwerbs und die Einleitung der nächsten Prüfung warten 30.
7. Bildanalyse
- den TIFF-Stapel mit Open-Source-Software, ImageJ, öffnen, indem Sie die Datei in das ImageJ-Fenster ziehen.
- Klicken Sie mit der Maus und ziehen Sie, um die Region of Interest (ROI) um das Neuron von Interesse. Legen Sie die Region auf der Soma des Neurons von Interesse (wie in Abbildung 3A).
- Plotten den Z-Stack für die Fluoreszenzintensität der ROI über Stapel durch Klicken öffnen-> Bild - > Stapel - > Plot z-Profil.
- Klicken Sie " Liste " in dem sich öffnenden Fenster. Klicken Sie auf Bearbeiten - > kopieren, kopieren Sie die Werte. Fügen Sie die Werte in einem Tabellenkalkulationsprogramm.
- Analysieren die Hintergrundfluoreszenz für jedem Impuls durch ziehen den ROI zu einer Region des Wurms, die nicht GCaMP Ausdruck enthalten.
- Führen Hintergrundabzug für jedem Impuls durch Subtraktion den Fluoreszenz Hintergrundwert vom Neuron Fluoreszenz Intensitätswert.
- ΔF/F 0 für jeden Frame von jedem Impuls zu berechnen.
- Berechnen F 0 als die durchschnittlichen Intensitätswert des ROI für die ersten 1 s des Erwerbs (z. B. Bilder 1-10).
- ΔF/F 0 zu berechnen, indem man den Hintergrund subtrahiert Wert für den Rahmen des Interesses durch den berechneten Wert der F-0.
- Wiederholen Sie für jedes Neuron abgebildet und jeder Impuls Impuls.
- Für Neuronen mit konsequente Antwort Profile, wie Asche, alle Pulse für jedes Neuron durchschnittlich und die SEM (wie in Abbildung 2F berechnen).
- Zeichnen die durchschnittliche ΔF/F 0 mit SEM im Laufe der Zeit für jedes Neuron.
Hinweis: In diesem Fall ist es gängige Praxis, Heatmaps der individuellen neuronalen Antworten jede Prüfung sowie gehören. In Neuronen, die nicht konsistentere Änderungen in Kalzium Transienten bei Einwirkung auf Reize über wiederholte Stimulationen ausstellen, oder in verschiedenen Individuen 23 kann es auf individuelle Puls Spuren (wie in zeigen mehr angewendet werden. ( Abbildung 4). Siehe die Diskussion für Details auf die Festlegung, wie die Daten angezeigt werden sollen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Ein Beispiel für den Gesamtaufbau Gerät sehen in Abbildung 1A-B. Abbildung 1A zeigt den richtigen Behälter Bau und Einrichtung. Abbildung 1 b zeigt die Verbindungen der Stauseen am mikrofluidischen Gerät. Abbildung 1 zeigt ein mikrofluidischen Gerät mit einzelnen Ports für Klarheit beschriftet.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die männlichen angepasst olfaktorische Chip integriert eine Wendung in ein schmaler Verladehafen, wodurch für mehr Kontrolle über die Ausrichtung und das effiziente Abfangen von männlichen C. Elegans. Dies ermöglicht die Visualisierung der linken und rechten Mitglieder des neuronalen bilaterale Paare, ohne die Notwendigkeit für Z-Stapeln. Diese Kurve führt zu eine Orientierung Weg von vertikalen 100 % der Zeit in Worms, wo richtet sich nur eine bilaterale paar mit einem fluoreszierenden Marker, z. B. Asch...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir möchten danken Manuel Zimmer für die Bereitstellung von uns mit der ersten Entwurf-Datei, die für Gebrauch mit Männchen angepasst wurde; Frank Schroeder für die Synthese und die Lieferung von Ascr #3; Ross Lagoy für die Einsicht und Unterstützung bei der Bildverarbeitung und Analyse; und Laura Aurilio für die Meister Fertigung und, neben Christopher Chute, dazu beigetragen, den Beitrag dieser Handschrift. Diese Arbeit wurde unter der National Institutes of Health Grant 1R01DC016058-01 (j.s.), die National Science Foundation Stipendium CBET 1605679 (D.R.A) und die Burroughs Wellcome Career Award an wissenschaftlichen Schnittstelle (D.R.A) finanziert.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Silicon Wafer | University Wafer | 452 | |
| SU-8 2035 | MicroChem | Y111070-0500L1GL | |
| Developer | MicroChem | Y020100-4000L1PE | |
| Wafer Mask | Cad/Art Services | - | Custom order. Printed at 25,000 dpi. |
| Sylgard-184 | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| 1.0 mm Dermal Punches | Acuderm Inc. | P150 | |
| Soft Tubing | Cole-Palmer | EW-06419-01 | |
| Hard Tubing | IDEX Health & Science | 1622 | |
| Pins | New England Small Tube | NE-1027-12 | |
| Blocking Pins | New England Small Tube | 0.415/0.425" OD x .500 Long | Batch PB07027 |
| 3 mL syringes | BD | 309657 | |
| 30 mL syringes | Vitality Medical | 302832 | Used as buffer reservoirs. |
| Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer | Component Supply Company | NE-231PL-50 | |
| Stopcocks with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile | Cole-Palmer | EW-30600-07 | |
| Fisherfinest Premium Cover Glass | Fisher Scientific | 12-548-5M | |
| Mercator Control System LF-5 Plasma System | Mercator | LF-5 | |
| Scotch Tape | Scotch | BSN43575 | |
| Series 20 Chamber | Warner Instruments | P-2 | |
| Vacuum Desicator | Bel-Art Scienceware | 420250000 | 24 cm inner diameter. |
| Weigh Boats | Cole-Palmer | EW-01017-27 | |
| Classic Plus Balance | Mettler Toledo | PB1501-S/FACT | |
| Glass Pasteur Pipettes | Cole-Palmer | EW-25554-06 | |
| Transfer pipettes | Genesee Scientific | 30-202 | |
| Oven | Sheldon Manufacturing Inc | 9120993 | Model Number: 1500E. |
| 60 mm, non-vented, sharp edge Petri dishes | TriTech Research | T3308 | |
| Zeiss Axio Observer.A1 | Zeiss | - | |
| Hammamatsu Orca Flash 4.0 Digital CMOS | Hammamatsu | C11440-22CU | |
| Blue Fluorescent Light | Lumencor | SOLA SM6-LCR-SA | 24-30V/7.9A DC. |
| Illumination Adaptor | Zeiss | 423302-0000 | |
| Series 1 and 2 Miniature Inert PTFE Isolation Valve | Parker | 001-0017-900 | 3-way valve for controlling flow. |
| ValveLink8.2® | AutoMate Scientific | 01-18 | Flow Switch Controller |
| Micro Manager | Micro-Manager | - | Free software, can be downloaded at: https://www.micro-manager.org/wiki/Download_Micro-Manager_Latest_Release |
| ImageJ | ImageJ | - | Free software, can be downloaded at: https://imagej.nih.gov/ij/download.html |
| Agar, Bacteriological Grade | Apex | 9012-36-6 | |
| Peptone | Apex | 20-260 | |
| CaCl2 | VWR | BDH0224-1KG | |
| MgSO4 | Sigma-Aldrich | 230391-1kg | |
| Cholesterol | Alfa Aesar | A11470 | |
| Ethanol | Sigma-Aldrich | 270741-4L | |
| Tetramisole | Sigma-Aldrich | L9756-10(G) | Store at 4 °C. |
| Fluorescein | Sigma-Aldrich | FD2000S-250mg | Light Sensitive. Store in photoprotective vials. |
| Glycerol | Sigma-Aldrich | G6279-1L | |
| Ascaroside #3 | - | - | Synthesized in the Schroeder Lab (Cornell University). |
| NaCl | Genesee Scientific | 18-215 | |
| KH2PO4 | BDH | BDH9268.25 | |
| K2HPO4 | J.T. Baker | 3252-025 | |
| ASH GCaMP3 line | - | - | CX10979 (KyEx2865 [psra-6::GCAMP3 @ 100 ng/uL]). Developed in Bargmann lab. Provided from Albrecht Lab library. |
| CEM GCaMP6 line | - | - | JSR49 (FkEx98[ppkd-2::GCaMP::SL2::dsRED + pBX-1]; pha-1(e2123ts); him-5(e1490); lite-1(ce314)). Developed by Robyn Lints. Provided from Srinivasan Lab library. |
| E. coli (OP50) | Caenorhabditis Genetics Center | OP50 | |
| "Reservoir" | - | - | To create a Reservoir: A "30 mL syringe", is connected to a "Stopcock with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile", which is connected to a "3 mL syringe" and a "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer". The "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer" is then inserted into "Soft Tubing" approximately 1/3 of the way down the needle. |
Referenzen
- Lagoy, R. C., Albrecht, D. R. Microfluidic Devices for Behavioral Analysis, Microscopy, and Neuronal Imaging in Caenorhabditis elegans. Methods Mol Biol. 1327, 159-179 (2015).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Curr Opin Neurobiol. 19 (5), 561-567 (2009).
- Chronis, N. Worm chips: Microtools for C. elegans biology. Lab on a Chip. 10 (4), 432-437 (2010).
- Lee, H., Crane, M. M., Zhang, Y., Lu, H. Quantitative screening of genes regulating tryptophan hydroxylase transcription in Caenorhabditis elegans using microfluidics and an adaptive algorithm. Integr Biol (Camb). 5 (2), 372-380 (2013).
- Lockery, S. R., et al. A microfluidic device for whole-animal drug screening using electrophysiological measures in the nematode C. elegans. Lab Chip. 12 (12), 2211-2220 (2012).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nat Commun. 7, 13023(2016).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 110 (45), E4266-E4273 (2013).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Front Mol Neuro. 6, 2(2013).
- Badura, A., Sun, X. R., Giovannucci, A., Lynch, L. A., Wang, S. S. H. Fast calcium sensor proteins for monitoring neural activity. Neurophotonics. 1 (2), 025008(2014).
- Tatro, E. T. Brain-wide imaging of neurons in action. Front Neural Circuits. 8, 31(2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat Methods. 6 (12), 875-881 (2009).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Greene, J. S., Dobosiewicz, M., Butcher, R. A., McGrath, P. T., Bargmann, C. I. Regulatory changes in two chemoreceptor genes contribute to a Caenorhabditis elegans QTL for foraging behavior. Elife. 5, (2016).
- Kim, K., et al. Two Chemoreceptors Mediate Developmental Effects of Dauer Pheromone in C. elegans. Science. 326 (5955), 994-998 (2009).
- McGrath, P. T., et al. Parallel evolution of domesticated Caenorhabditis species targets pheromone receptor genes. Nature. 477 (7364), 321-325 (2011).
- Schmitt, C., Schultheis, C., Husson, S. J., Liewald, J. F., Gottschalk, A. Specific Expression of Channelrhodopsin-2 in Single Neurons of Caenorhabditis elegans. PLoS ONE. 7 (8), e43164(2012).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Nervous System of the Nematode Caenorhabditis elegans. Phil Trans of the Royal Soc of Lon. 314 (1165), 1(1986).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat Meth. 4 (9), 727-731 (2007).
- Chute, C. D., Srinivasan, J. Chemical mating cues in C. elegans. Semin Cell Dev Biol. 33, 18-24 (2014).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook. , 1-22 (2013).
- Narayan, A., et al. Contrasting responses within a single neuron class enable sex-specific attraction in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 113 (10), E1392-E1401 (2016).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Sammut, M., et al. Glia-derived neurons are required for sex-specific learning in C. elegans. Nature. 526 (7573), 385-390 (2015).
- Sulston, J. E., Albertson, D. G., Thomson, J. N. The Caenorhabditis elegans male: postembryonic development of nongonadal structures. Dev Biol. 78 (2), 542-576 (1980).
- Hilliard, M. A., et al. In vivo imaging of C. elegans ASH neurons: cellular response and adaptation to chemical repellents. The EMBO Journal. 24 (1), 63-72 (2005).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Cáceres, I. dC., Valmas, N., Hilliard, M. A., Lu, H. Laterally Orienting C. elegans Using Geometry at Microscale for High-Throughput Visual Screens in Neurodegeneration and Neuronal Development Studies. PLoS ONE. 7 (4), e35037(2012).
- Schrodel, T., Prevedel, R., Aumayr, K., Zimmer, M., Vaziri, A. Brain-wide 3D imaging of neuronal activity in Caenorhabditis elegans with sculpted light. Nat Methods. 10 (10), 1013-1020 (2013).
- García, L. R., Portman, D. S. Neural circuits for sexually dimorphic and sexually divergent behaviors in Caenorhabditis elegans. Curr Opin Neurobiol. 38, 46-52 (2016).
- Clokey, G. V., Jacobson, L. A. The autofluorescent "lipofuscin granules" in the intestinal cells of Caenorhabditis elegans are secondary lysosomes. Mech Ageing Dev. 35 (1), 79-94 (1986).
- Coburn, C., et al. Anthranilate Fluorescence Marks a Calcium-Propagated Necrotic Wave That Promotes Organismal Death in C. elegans. PLoS Biology. 11 (7), e1001613(2013).
- Macosko, E. Z., et al. A hub-and-spoke circuit drives pheromone attraction and social behaviour in C. elegans. Nature. 458 (7242), 1171-1175 (2009).
- Park, D., et al. Interaction of structure-specific and promiscuous G-protein-coupled receptors mediates small-molecule signaling in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 109 (25), 9917-9922 (2012).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten