Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yanıt olarak erkek C. Elegans baş nöronlar Feromonlar nöronal aktivite görüntüleme için adapte mikrosıvısal koku kozu kullanımı
Bu Makalede
Özet
C. elegans erkeklerin verimli kalsiyum görüntüleme için bir adapte "koku çip" kullanımı burada açıklanmıştır. Gliserol ve bir feromon erkek maruz çalışmaların da gösterilir.
Özet
Kalsiyum göstergeleri kullanımını büyük ölçüde sinirsel dinamikleri ve yönetmelik anlayışımızı geliştirmiştir. Yuvarlak solucanlar Caenorhabditis elegans, tamamen eşleştirilmiş sinir sistemi ve şeffaf anatomi, kalsiyum göstergeler kullanarak gerçek zamanlı sinirsel dynamics anlamak için ideal bir model sunar. Mikrosıvısal teknolojileri ve deneysel tasarımlar ile birlikte, hem ücretsiz taşıma ve kapana kısılmış hayvanlarda kalsiyum görüntüleme çalışmaları bu göstergeler kullanılarak gerçekleştirilir. Ancak, içinde Chronis ve ark., açıklanan koku çip gibi yakalama aygıtları kullanan en önceki çalışmaları olarak daha az yaygın erkek hem morfolojik ve yapısal olarak daha yaygın hermafrodit olarak kullanılmak üzere tasarlanan aygıt var birbirine benzemeyen. Adapte bir koku çip tasarlanmıştır ve genç yetişkin hayvanlar kullanarak erkek nöronal görüntülemede verimlilik artışı için fabrikasyon. Bir dönüş hayvanlar döndürmek için ve 2D görüntülemede ikili bir çift bireysel nöronlar ayrılması için izin vermek için bağlantı noktası yükleme solucan içine dahil oldu. Solucanlar propil mikrosıvısal aygıt içinde kontrollü bir akış önceki hermafrodit çalışmalarda açıklandığı gibi maruz kalır. Kalsiyum geçişler sonra açık kaynak yazılım ImageJ kullanarak analiz edilir. Burada açıklanan yordamı erkek tabanlı C. elegans artan miktarda için izin vermelidir çalışmalar seks özgü nöronal sinyal verme mekanizmaları bizim anlayış derinleştirilmesi, Imaging kalsiyum.
Giriş
Yuvarlak solucanlar C. elegans,-ebilmek var olmak deneysel olarak işlenmiş1gibi mikrosıvısal aygıtları tam kontrollü ortamlarda, artan erişim hayvanlar, neyin sağlar. Bu çalışmalar davranış deneyleri, kalsiyum görüntüleme çalışmaları veya hatta gösterimleri deneysel sonuçlar1,2,3,4daha kesin ölçümler sonucu belirli fenotipleri için dahil, 5,6. Havacilik hangi aracılığıyla detaylı deneyler reaktifler en az miktarda gerçekleştirirken çalıştırılabilir küçük ölçekli sıvı koşulları sağlamak. Yeni mikrosıvısal cihaz tasarımları sürekli üretim ve her kullanımı, sinirsel görüntülemede kullanılan aygıtları yakalamak doğal sinüsoidal hareketi C. elegans davranış deneyleri ve sinirsel görüntüleme çalışmaları için izin arenalar gelen değişir ve yüksek üretilen iş fenotipik analizde genetik4,5,6,7ekranlar için izin aygıtlara koku çalışmaları. Ana kalıp imalatı mikrosıvısal aygıt oluşturmak ucuzdur — efendi kullanılırlığı verilen — ve kullanımı kolay, bırakmak için hızlı veri üretimi ile yüksek-den geçerek çalışmalar. Fabrikasyon polimerler polydimethylsiloxane (PDMS) gibi kullanan aygıtların saat içinde yeni cihazlar yaratılması için izin verir.
Kalsiyum görüntüleme çalışmaları ifade hedef hücrelerde genetik olarak kodlanmış kalsiyum göstergeleri (Turk) gerçek zamanlı8,9,10,11bu hücrelere sinirsel dinamikleri ölçmek için kullanın. C. elegans şeffaf doğası bu proteinler Canlı hayvanlarda floresan düzeyde kayıt sağlar. Geleneksel olarak, Turk yeşil flüoresan protein (GFP) üzerinde itimat-sensör GFP-Calmodulin-M13 peptid (GCaMP), her ne kadar daha yeni çalışmalar daha iyi sinyal-gürültü oranı ve kırmızı kaymıştır uyarma profiller için izin vermek için bu sensörler adapte olması dayalı. GCaMP3 gelişimini, bu özellikleriyle proteinler çeşitli, GCaMP6s ve GCaMP6f gibi sensörler dahil olmak üzere (yavaş ve floresan kapalı-fiyatlar, sırasıyla hızlı), RFP-Calmodulin-M13 peptid (lebomm) yanı sıra, sahip olduğu kırmızı kaymıştır harekete geçirmek profil. Bu Turk C. elegans hücre özel gen organizatörü dizileri ile kombinasyonu ilgi, özellikle duyusal sinir hücreleri12,13,14,15 hücreleri hedef alabilirsiniz , 16.
Mikrosıvısal çalışmalarda C. elegans kullanım kolaylığı belirgin olsa da, hemen hemen tüm çalışmalar hünsa üzerinde odaklanmıştır. Erkekler sadece 0,01-0,02 için muhasebe rağmen vahşi türü nüfusunun %, çok değerli bulgular--dan onların karakterizasyonu çıkabilir. Hermafrodit sinir sisteminin fiziksel connectome tam on yıl17için eşlenen süre erkek connectome özellikle hayvan18kafa bölgesinde eksik, kalır. Kalsiyum görüntüleme erkeklerde kullanımı erkek sinir sistemi ve iki cinsiyetler arasında ortaya çıkan farklılıklar bir anlayış oluşturmak için yardımcı olacaktır. C. elegans Yetişkin erkekler daha küçük boyutu daha büyük hermoafroditler için tasarlanan geleneksel koku aygıt yükleme noktalarından etkili ve güvenilir yakalama engeller. Bu sorunu çözmek için Chronis koku çip19 değiştirilmiş bir versiyonu daha dar bir yükleme limanı ile alt kanal yüksekliği, geliştirilmiş ve ikili sol/sağ görselleştirme için izin (hangi hayvan döndürmek) solucan yükleme limanı, döner nöronal çiftleri. Bu tasarım izin verir: genç yetişkin erkekler (1 etkili bindirme, ikili eşleştirilmiş sinir hücreleri iki üye ve (3) erkek nöronlar sinirsel aktivite hassas görüntüleme görselleştirme için hayvan daha güvenilir (2) bir yönünü.
C. elegans erkek farklı hünsa daha için a değişiklik-in ascarosides (ascr) veya Yuvarlak solucanlar Feromonlar20,21,22,23 yanıt çalışmalar giderek, göstermek ,24. Bu nedenle, sinirsel dynamics ve temsilcilikleri erkek connectome içinde bir anlayış geliştirmek bile daha uygun oldu. Erkek C. elegans içeren 87 seks özgü nöronlar hermafrodit25,26' da yok içinde connectome olarak değiştirme-henüz belirlenmemiş yolları. Bu benzersiz sinirsel dinamikler resim edememek bizi daha iyi seks özel yanıt ve sinirsel ifadeleri anlamak izin verir.
Bu iletişim kuralı bir erkek adapte koku çip erkek C. elegans sinirsel görüntüleme için açıklar chemosensation. ASH, güvenilir bir şekilde 1 M gliserol için erkeklerde, önceki ile tutarlı hermaphroditic yanıt nosiseptif nöron27çalışmalar. Ascarosides maruz gerektiren test edilecek hayvanlar daha çok sayıda hayvan hayvan, değişken olan yanıt-e doğru çıkarmak. Erkek özel CEM nöronların yanıt daha önce Elektrofizyoloji ve çalışmalar, Imaging kalsiyum degisken ascaroside #323için yanıt vermek için gösterilmiştir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. cihaz imalat
Not: bkz: başvuru 1.
Not: silikon ana kalıpları fabrikasyon SU-8 fotorezist silikon ana 1 , 7 desenlendirme için standart photolithographic teknikleri kullanarak. Photomasks gofret desenlendirme için 25.000 dpi çözünürlükte basıldı. 19 bağlantı noktası yükleme, M. Zimmer (özel yazışmaları, 2016) elde edilen bir tasarım adapte solucan bir değişiklik ile tasarım erkek adapte aygıt özellikleri Chronis koku çip. Bir dönüş hayvanlar dönüşü kontrol için bulunur. Bağlantı noktası Kanal yükleme solucan genişliğini için 50 mikron daralmış. Tüm kanallar 32 mikron uzun boylu vardır. Silikon ana kalıp kullanıcı için kullanıma hazır olduğunda, kullanıcı sonraki takip edebilirsiniz, protokol 1 daha önce açıklandığı gibi.
- Mix PDMS temel ve kür Ajan ağırlık tarafından 10:1 oranında.
- Karıştırın iyice transfer Pipetler ile.
- Tüm görünür kabarcıklar kaldırılana kadar 1s için bir vakum desiccator karışımı degas. 5 mm kalınlığında (100 gr) kadar
- bir silikon kalıp yöneticisinde bir 150 mm çapında çanak üzerine karışımı dökün. Herhangi bir kabarcıklar veya karışıma ortaya konan toz kaldırmak için bir Pasteur pipet kullanın.
- İçin en az 3 h ya da bir gecede 65 ° C'de pişirin.
- PDMS neşter kullanarak kalıp uzak kesmek ve ayrı aygıtlar ayrı bir jilet kullanarak kesti.
- 1 mm dermal yumruk ile giriş ve çıkış delikleri yumruk.
- Sifonu dH ile delik 2 O, etanol ve parçacıklar yumruk kaldırmak için tekrar dH 2 O ile. Bir hava akışı darbe cihazda kuru.
- Temiz kanal taraf ve yapışkan bant, toz ve başarılı bağ için izin vermek için cihaz üzerinde kalan enkaz kaldırma cihazın üst kısmında.
- Plazma-bond cihazın bir No 1 kapak cam kanal tarafı aşağı,.
- Maruz kapak cam ve aygıt (kanal-tarafına kadar) 100 W 30 gibi uygun bağ için izin koşulları kullanarak hava plazma s veya 24 W 60 s.
Not: Ayarları bağ etkinliğini artırmak için ayarlanabilir. Plazma-bağ koşullar bağ etkinliğini artırmak çalışırken uygun temizlik olarak kritik değildir. Yeterince temizlenmiş bir aygıt, hatta ideal plazma koşullar altında bağ değil. - İle 5 için başparmak aşağı cam kanal yan aygıt ve basın üzerine ters çevir s.
- Maruz kapak cam ve aygıt (kanal-tarafına kadar) 100 W 30 gibi uygun bağ için izin koşulları kullanarak hava plazma s veya 24 W 60 s.
2. Arabellek hazırlık
- Dilute 1 x S Bazal (100 mM NaCl ve 0,05 M KPO 4, pH 6.0) steril 10 x stoktan.
- Tüm çözümleri arabellek için 1 M tetramisole hisse senedi 1 S Bazal x 1 mM son bir konsantrasyon için oranında seyreltin.
- Fluoresein için her iki ekleyin " akış denetimi " ve " tampon " rezervuarlar.
- Fluoresein 100-mg/mL stokunun 1 x S Bazal oluşturun.
- Hisse senedi için akış denetimi 1 µg/mL ve 0.1 µg/mL arabellek son konsantrasyonları sulandırmak.
- Uyaranlara oluşturmak.
- Son konsantrasyonu 1 m 1 X S Bazal seyreltik gliserol.
- Seyreltik ascaroside #3 (ascr 3) 1 µM son bir konsantrasyon 1 X S Bazal içine için.
3. Aygıt Kurulumu
Not: bkz: 1.

şekil 1. Mikrosıvısal aygıt ayarları. (A) rezervuar ve boru. 30 mL şırınga olmadan bir dalgıç olarak hizmet veren " rezervuar. " bu üç akış seçenekleri ile bir radarı Vana bağlı olduğu. Diğer mikrosıvısal cihaza baðlanýr tüp takılı olduğundan bir iğne (turuncu) için bağlı olduğu sırada bir çıkış pompası, 3 mL şırınga bağlıdır. (B) genel deneme Imaging mikrosıvısal kuruluşu. Cihazın objektif lensler üzerinde bir ters epifluorescence mikroskop bir sahnede yer alıyor. " Akış denetimi " arabellek seyahatleri ile belgili tanımlık tertibat üstünde rafta bir birimi tarafından kontrol edilir bir 3-yollu vana. Arabellek içeren satırların sonra uygun aygıt bağlantı noktaları eklenir. (C) mikrosıvısal aygıtının bağlantı noktalarını. " Akış denetimi " bağlantı noktaları diğer giriş bağlantı noktalarını yan: " uyarıcı " ve " tampon " bağlantı noktaları. " Çıkış " en sağdaki port limanıdır. Solucan yükleme arena, konumu nedeniyle " yükleme solucan " Merkez-çoğu bağlantı noktası aygıt üzerindeki bağlantı noktasıdır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
- hazırla üç sıvı su depoları. İğne mikrosıvısal aygıta uzanan boru bağlanmak ( şekil 1A olduğu gibi -B).
- Hava kabarcıkları rezervuar ve boru çıkarın.
- 1 S Bazal x ile ekli boru ile 3 mL şırıngaya doldur ve prize takın limanda
- Arabellek giriş delikleri üst kısmında görünene kadar yavaşça uygulamak basınç-şırıngaya.
- Akış denetimi, arabellek ve uyarıcı boru uygun giriş delik bağlantısı ( şekil 1B olduğu gibi -C), her iki yükleme noktasındaki sıvı damla mevcut sağlama delik ve bağlanmak tampon tüp.
- Yine yavaşça damlacıkları bağlantı noktası giriş yükleme solucan görününceye kadar çıkış bağlantı noktasına bağlıysa şırınga basınç uygulamak.
- Limanda yükleme solucan içine sağlam bir engelleme çiviyi yerleştirmeden
- Şırınga çıkış bağlantı noktasından çıkarın ve ev vakum (-670 Torr) bağlı çıkış satırına ekleyebilir.
- Kontrol aygıtı akışında herhangi bir kabarcık açısından kanalları, görsel ve fotoğraf makinesi ile uyumlu bir yazılım yoluyla video onay aracılığıyla, kullanılan açık kaynak yazılım Mikro-yemlik gibi. Adım 6 mikro-Yöneticisi'ni kullanma hakkında ipuçları için bkz:.
- Herhangi bir kabarcıklar varsa beklemek onları çıkarmak veya PDMS absorbe duvar herhangi bir hayvan önce yükleme; kabarcıklar varlığı sıvıların uygun akış aygıtı aracılığıyla rahatsız edemeyecek.
- GFP filtreyi kullanarak onaylamak uygun akış dinamiği içinde belgili tanımlık aygıt yükleme 3-yollu vana aktüatör ve arabellek geçiş gözlemleyerek solucan önce.
- Belirleme uygun akış dinamikleri: akış denetimi ve tampon çözümlerinde mevcut floresein gözlemlemek ( şekil 2B -2E) denetim basarak akış denetimi değeri değiştiğinde değiştirme 3-yollu vana Vana bağlantısını ( şekil 1B) karşılık gelen düğmeyi.
- Mikro-Yöneticisi'ni açtıktan sonra tıklayın " Live " cihazın canlı bir görüntü gözlemlemek için. Cihazın arabellekleri akışını Floresan ışık kaynağı açın ( şekil 2B -2E).
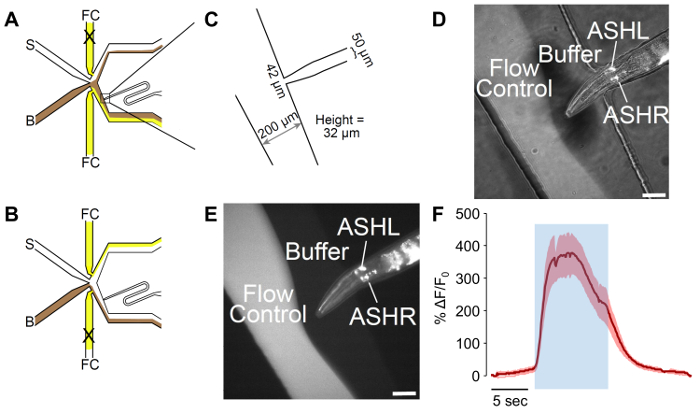
Resim 2: Bir erkek adapte mikrosıvısal koku çip. (A) akışını desenleri solucan maruz kaldığında cihazın tampon. Arabellek (B) kahverengi gösterilir ve akış denetimi (FC) beyaz sarı, uyarıcı (S) ile gösterilir. Bağlantı noktası yükleme solucan solucan yönlendirme daha iyi kontrol için sağlar bir eğri eklemek için uyarlanmıştır. (B) akışını desenleri solucan için uyarıcı maruz kaldığında cihazın. Arabellek (B) kahverengi gösterilir ve akış denetimi (FC) beyaz sarı, uyarıcı (S) ile gösterilir. (C) ölçümleri fabrikasyon olarak adapte cihazın. Bağlantı noktası yükleme solucan, erkek genişliği için tasarlanmış bir 50 µm kanal açılarak bir 42 µm biter. Ölçülen Kanallar tasarımı 25 µm hedef rağmen 32 µm yüksekliğidir. (D-E) A tuzak erkek ifade p sra-6:: GCaMP3. Sra-6 organizatörü kül özgü değildir ve hiçbir kalsiyum geçişler ASI tespit edildi, ancak bazı ifade ASI nöron gözlenen. (E) sadece floresan ise (D) alan parlak ve floresan aydınlatma, bir arada görüntüdür. Ölçek çubukları 42 µm. (F) ASH nöron tepki 1 M gliserol stimülasyon ile sağlam sinirsel aktivite gösterir. Mavi alanı 1 M gliserol uyarıcı zamanı gösterir. Gölgeli bölge n ile standart hatasını gösterir yedi solucanlar dan 20 bakliyat =. Kırmızı izler depolarize yanıt-e doğru göstermek. Axes ΔF/F 0 göster. 5 ölçek çubuğu gösterir s. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
4. hayvan hazırlık
Not: bkz: başvuru 23.
- 1 M gliserol yanıtlarını görüntüleme kül.
P sra-6 için olumlu
- yer yaklaşık 20 C. elegans erkek:: GCaMP3 dizi ifade nematodunun büyüme orta (NGM) agar plaka üzerine numaralı seribaşı OP50 E. coli çim ile. Floresan GECI ifade ve/veya bir ortak enjeksiyon marker dizi pozitif hayvanların tanımlanması için kullanın.
Not: Dizi olumlu hayvanlar kullanılan GECI göre belli (Yani, hayvanlar GCaMP ifade bulabilsem yeşil mavi ışık stimülasyon altında lebomm hayvanlar kırmızı yeşil ışık stimülasyon altında belli iken). Ortak enjeksiyon işaretçileri GFP ve RFP, gibi floresan diğer proteinler gibi rol-6, fenotipik işaretleri alanı kullanılabilir veya pha-1 mutasyon 28 gibi baskın bir fenotip kurtarabilirsiniz.- Eğer hemen tahlil önce çekme genç yetişkin erkekler toplama
- . Gün önce tahlil, L4 larva erkekler cevap.
- yer yaklaşık 20 C. elegans erkek:: GCaMP3 dizi ifade nematodunun büyüme orta (NGM) agar plaka üzerine numaralı seribaşı OP50 E. coli çim ile. Floresan GECI ifade ve/veya bir ortak enjeksiyon marker dizi pozitif hayvanların tanımlanması için kullanın.
- 1 µM ascr 3 CEM yanıtlarını görüntüleme.
- Çekme yaklaşık 20 L4 C. elegans erkekler (fkEx98 [p pkd-2::GCaMP::SL2::dsRED + pBX-1]; PHA-1 (e2123ts); onu-5 (e1490); Lite-1 (ce314)) dsRed ortak enjeksiyon marker ifade için olumlu.
Not: dsRed ray nöronlar içinde erkek masalı gözlemlemek ve GCaMP ifade dört CEM nöronlar içinde daha onaylamak daha kolay ifadesidir. - İzole hünsa görüntüleme deneme yapmadan önce bir çim OP50 E. coli için 5-14 h seribaşı NGM agar tabakta gelen bu erkek.
Not: en az 5 h için izole değil erkek davranışsal ascr 3 yanıt vermeyen ve bu nedenle ascaroside için burada görülmektedir daha bile az kalsiyum geçişler sergileyebilirler.
- Çekme yaklaşık 20 L4 C. elegans erkekler (fkEx98 [p pkd-2::GCaMP::SL2::dsRED + pBX-1]; PHA-1 (e2123ts); onu-5 (e1490); Lite-1 (ce314)) dsRed ortak enjeksiyon marker ifade için olumlu.
5. Hayvan yükleme
Not: bkz: refefence 1.
- Standart solucan bakım teknikleri kullanarak bir seribaşı NGM agar plaka üzerine bir solucan seçin.
- Çekme solucanlar bakteri çekme üzerine toplama (düzleştirilmiş Platin tel yapılmış) bir çekme, alev ve " dabbing " almak için bir solucan. Yavaşça solucan kapalı, kendi tarama izin yeni plaka üzerine yerleştirin.
- Plaka sular altında olacak yaklaşık 5 mL 1 x S Bazal seribaşı plakasına eklemek.
- 1 x S Bazal ile önceden doldurulmuş oldu bir yükleme şırınga (Yani, 3 mL şırınga ile ekli boru) içine belgili tanımlık kurt çizin.
- Solucan değil sonuna kadar içine şırınga, sadece tüp içine emmek için emin olun.
Not: solucan şırınga geçerse, yakın olduğunu onu geri içine tüp imkansız.
- Solucan değil sonuna kadar içine şırınga, sadece tüp içine emmek için emin olun.
- Çıkış radarı kapak kapatarak akışını durdurmak için vakum kapatmak.
- Sağlam iğneyi limanda yükleme solucan engelleme kaldırma
- Açmak böylece bu havalandırma ( şekil 1B) çıkış bağlantı noktasına bağlı radarı Vana.
Not: bir canlı video solucan yüklenirken konumunu ve yönünü hayvan (Adım 5.8-5.13) onaylamak için kullanın. - Limanda yükleme solucan tüpüne yükleme solucan Ekle
- Solucan yükleme kanalda görünene kadar yavaşça uygulamak basınç-şırıngaya.
- Solucan kuyruk-ilk kanal başlanır, solucan kanal girmesini önlemek için şırınga pistonu üzerinde çekin.
- Uygulama ve baş kanal ilk girene kadar basınç ters arasındaki geçiş.
- 3'lü radarı kapak kapatarak vakum atmosfer yerine vakum açmak için çıkış noktasına bağlı açık.
- El ile yönlendirmek ve arabellek akışı kanal, ama henüz maruz öyle ki solucan kafa yerleştirmek için şırınga dalgıç tarafından iç karartıcı baş serbestçe taşıyabilirsiniz basınç uygulayın ( Şekil 2 D-2E).
6. Uyarıcı ve satın alma
- bir açık kaynak mikroskobu yazılımını kullanarak, mikro-Yöneticisi gibi tarafından esir alma imge: 10 kare/s Mavi ışıklı uyarma kullanarak TIFF yığını olarak kaydetmek (470 nm) 30 s.
- Açık 100 Bayan için ana menüsünde pozu ayarlamak " çok D alma. " yazılım ana menüden. Ayarla " numarası " için " 300, " ve " Aralık " için " 0. "'ı tıklatın " edinme! " video kazanmaları.
- Uygula 10 s nabzı satın alma başlatılıyor sonra uyarıcı 5 s. İstediğiniz gibi uyarıcı uygulama süresi ayarlamak.
- 5 edinme sonra s video, değiştirme uyarıcı test edilen hayvan uygulamak için akış denetimi arabellek kontrol 3-yollu vana. Vana bağlantı ( şekil 1B) en sol düğmesini.
- Sonra 10 s uyarana maruz kalma (Bu sefer ayarlanabilir kullanıcı tarafından istediğiniz gibi), yine Vana linke en soldaki düğmeye basarak akışı arabellekleri alter.
- Kayıt sadece 30-s pencere temele dönmek GECI Floresans izin vermek için tamamlanana kadar tampon altında.
- İstediğiniz şekilde yineleyin. Bekle 30 s edinme sonu ve sonraki deneme inisiyasyon arasında.
7. Görüntü analizi
- dosya ImageJ penceresine sürükleyerek açık kaynak yazılım ile ImageJ, TIFF yığın açın.
- İmleç kullanarak tıklatın ve faiz (ROI) faiz nöron çevresinde bölge ayarlamak için sürükleyin. Faiz (olduğu gibi şekil 3A) nöron soma içerecek şekilde bölgesi ayarlayın.
- Aç'ı tıklatarak yığınları arasında yatırım Getirisi floresan yoğunluğu z yığını arsa-> görüntü - > yığınları - > z ekseni profil çiz.
- Tıklama " listesi " açılır penceresinde. Düzenle-'yi > değerleri kopyalamak için Kopyala. Değerleri Yapıştır bir elektronik tablo programına.
- GCaMP ifade içermeyen solucan bir bölgeye yatırım Getirisi sürükleyerek her darbe için arka plan Floresans analiz.
- Arka plan Floresans nöron floresan yoğunluğu değerinden çıkararak her darbe için arka plan çıkarma gerçekleştirmek.
- ΔF/F 0 her darbe her çerçeve için hesaplamak.
- Olarak yatırım Getirisi için ilk 1 ortalama yoğunluk değerini hesaplamak F 0 s satın alma (Örneğin, çerçeve 1-10).
- ΔF/F 0 faiz çerçeve arka plan düşülen değeri hesaplanan F 0 değerine göre bölerek hesaplamak.
- Görüntüsü her nöron ve her uyarıcı darbe için yineleyin.
- Nöronlar ile tutarlı yanıt profilleri, ASH gibi tüm darbeleri her neuron için ortalama ve SEM (olduğu gibi şekil 2F) hesaplamak için.
- Her neuron için zaman içinde SEM ile ortalama ΔF/F 0 arsa.
Not: Bu durumda, bu heatmaps her deneme de bireysel nöronal tepkilerin dahil etmek yaygın uygulamadır. Kalsiyum geçişler tekrarlanan elektrodlar arasında uyarıcılara maruz üzerine tutarlı değişiklikler sergi değil nöronlar, veya farklı kişiler 23, bireysel darbe izlemeler (olarak göstermek için daha uygun olabilir şekil 4). Ayrıntılar için tartışma verilerin nasıl görüntüleneceğini belirleme bkz.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Genel aygıt kurulum örneği şekil 1A-Bgörülebilir. Şekil 1A uygun rezervuar inşaat ve kurulum gösteriyor. Şekil 1B mikrosıvısal aygıt depolar bağlantılarını gösterir. Şekil 1 c ile netlik için etiketli bağlantı noktalarını ayrı ayrı bir mikrosıvısal aygıtı gösteriyor.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Erkek adapte koku çip bir dönüş yönünün daha fazla denetim ve erkek C. elegansverimli yakalama sağlar daha dar bir yükleme limanı içine içermektedir. Bu z-istifleme için gerek kalmadan nöronal ikili çift sol ve sağ üyeleri görselleştirme sağlar. Bu eğri bir solucan zamanında yönünü dikey %100 uzak nerede sadece bir ikili çift kül (şekil 2B-E)29,30gibi floresan bir marker ile hedef...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Manuel Zimmer erkekler ile kullanmak için adapte oldu ilk tasarım dosya ile bize verdiğiniz için teşekkür ederiz istiyorum; Frank Schroeder sentezi ve ascr 3 temini için; Ross Lagoy için fikir ve görüntüleme ve çözümleme ile ilgili yardım için; ve bu el yazması gözden geçirme için ana imalat ve kim, Laura Aurilio Christopher Chute, yanında bulunmuştur. Ulusal Sağlık Enstitüleri grant 1R01DC016058-01 (js), Ulusal Bilim Vakfı Hibe CBET 1605679 (D.R.A.) ve Burroughs Wellcome kariyer Ödülü, bilimsel arabirimi (D.R.A.) altında bu iş için fon sağlanmıştır.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Silicon Wafer | University Wafer | 452 | |
| SU-8 2035 | MicroChem | Y111070-0500L1GL | |
| Developer | MicroChem | Y020100-4000L1PE | |
| Wafer Mask | Cad/Art Services | - | Custom order. Printed at 25,000 dpi. |
| Sylgard-184 | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| 1.0 mm Dermal Punches | Acuderm Inc. | P150 | |
| Soft Tubing | Cole-Palmer | EW-06419-01 | |
| Hard Tubing | IDEX Health & Science | 1622 | |
| Pins | New England Small Tube | NE-1027-12 | |
| Blocking Pins | New England Small Tube | 0.415/0.425" OD x .500 Long | Batch PB07027 |
| 3 mL syringes | BD | 309657 | |
| 30 mL syringes | Vitality Medical | 302832 | Used as buffer reservoirs. |
| Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer | Component Supply Company | NE-231PL-50 | |
| Stopcocks with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile | Cole-Palmer | EW-30600-07 | |
| Fisherfinest Premium Cover Glass | Fisher Scientific | 12-548-5M | |
| Mercator Control System LF-5 Plasma System | Mercator | LF-5 | |
| Scotch Tape | Scotch | BSN43575 | |
| Series 20 Chamber | Warner Instruments | P-2 | |
| Vacuum Desicator | Bel-Art Scienceware | 420250000 | 24 cm inner diameter. |
| Weigh Boats | Cole-Palmer | EW-01017-27 | |
| Classic Plus Balance | Mettler Toledo | PB1501-S/FACT | |
| Glass Pasteur Pipettes | Cole-Palmer | EW-25554-06 | |
| Transfer pipettes | Genesee Scientific | 30-202 | |
| Oven | Sheldon Manufacturing Inc | 9120993 | Model Number: 1500E. |
| 60 mm, non-vented, sharp edge Petri dishes | TriTech Research | T3308 | |
| Zeiss Axio Observer.A1 | Zeiss | - | |
| Hammamatsu Orca Flash 4.0 Digital CMOS | Hammamatsu | C11440-22CU | |
| Blue Fluorescent Light | Lumencor | SOLA SM6-LCR-SA | 24-30V/7.9A DC. |
| Illumination Adaptor | Zeiss | 423302-0000 | |
| Series 1 and 2 Miniature Inert PTFE Isolation Valve | Parker | 001-0017-900 | 3-way valve for controlling flow. |
| ValveLink8.2® | AutoMate Scientific | 01-18 | Flow Switch Controller |
| Micro Manager | Micro-Manager | - | Free software, can be downloaded at: https://www.micro-manager.org/wiki/Download_Micro-Manager_Latest_Release |
| ImageJ | ImageJ | - | Free software, can be downloaded at: https://imagej.nih.gov/ij/download.html |
| Agar, Bacteriological Grade | Apex | 9012-36-6 | |
| Peptone | Apex | 20-260 | |
| CaCl2 | VWR | BDH0224-1KG | |
| MgSO4 | Sigma-Aldrich | 230391-1kg | |
| Cholesterol | Alfa Aesar | A11470 | |
| Ethanol | Sigma-Aldrich | 270741-4L | |
| Tetramisole | Sigma-Aldrich | L9756-10(G) | Store at 4 °C. |
| Fluorescein | Sigma-Aldrich | FD2000S-250mg | Light Sensitive. Store in photoprotective vials. |
| Glycerol | Sigma-Aldrich | G6279-1L | |
| Ascaroside #3 | - | - | Synthesized in the Schroeder Lab (Cornell University). |
| NaCl | Genesee Scientific | 18-215 | |
| KH2PO4 | BDH | BDH9268.25 | |
| K2HPO4 | J.T. Baker | 3252-025 | |
| ASH GCaMP3 line | - | - | CX10979 (KyEx2865 [psra-6::GCAMP3 @ 100 ng/uL]). Developed in Bargmann lab. Provided from Albrecht Lab library. |
| CEM GCaMP6 line | - | - | JSR49 (FkEx98[ppkd-2::GCaMP::SL2::dsRED + pBX-1]; pha-1(e2123ts); him-5(e1490); lite-1(ce314)). Developed by Robyn Lints. Provided from Srinivasan Lab library. |
| E. coli (OP50) | Caenorhabditis Genetics Center | OP50 | |
| "Reservoir" | - | - | To create a Reservoir: A "30 mL syringe", is connected to a "Stopcock with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile", which is connected to a "3 mL syringe" and a "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer". The "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer" is then inserted into "Soft Tubing" approximately 1/3 of the way down the needle. |
Referanslar
- Lagoy, R. C., Albrecht, D. R. Microfluidic Devices for Behavioral Analysis, Microscopy, and Neuronal Imaging in Caenorhabditis elegans. Methods Mol Biol. 1327, 159-179 (2015).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Curr Opin Neurobiol. 19 (5), 561-567 (2009).
- Chronis, N. Worm chips: Microtools for C. elegans biology. Lab on a Chip. 10 (4), 432-437 (2010).
- Lee, H., Crane, M. M., Zhang, Y., Lu, H. Quantitative screening of genes regulating tryptophan hydroxylase transcription in Caenorhabditis elegans using microfluidics and an adaptive algorithm. Integr Biol (Camb). 5 (2), 372-380 (2013).
- Lockery, S. R., et al. A microfluidic device for whole-animal drug screening using electrophysiological measures in the nematode C. elegans. Lab Chip. 12 (12), 2211-2220 (2012).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nat Commun. 7, 13023(2016).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 110 (45), E4266-E4273 (2013).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Front Mol Neuro. 6, 2(2013).
- Badura, A., Sun, X. R., Giovannucci, A., Lynch, L. A., Wang, S. S. H. Fast calcium sensor proteins for monitoring neural activity. Neurophotonics. 1 (2), 025008(2014).
- Tatro, E. T. Brain-wide imaging of neurons in action. Front Neural Circuits. 8, 31(2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat Methods. 6 (12), 875-881 (2009).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Greene, J. S., Dobosiewicz, M., Butcher, R. A., McGrath, P. T., Bargmann, C. I. Regulatory changes in two chemoreceptor genes contribute to a Caenorhabditis elegans QTL for foraging behavior. Elife. 5, (2016).
- Kim, K., et al. Two Chemoreceptors Mediate Developmental Effects of Dauer Pheromone in C. elegans. Science. 326 (5955), 994-998 (2009).
- McGrath, P. T., et al. Parallel evolution of domesticated Caenorhabditis species targets pheromone receptor genes. Nature. 477 (7364), 321-325 (2011).
- Schmitt, C., Schultheis, C., Husson, S. J., Liewald, J. F., Gottschalk, A. Specific Expression of Channelrhodopsin-2 in Single Neurons of Caenorhabditis elegans. PLoS ONE. 7 (8), e43164(2012).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Nervous System of the Nematode Caenorhabditis elegans. Phil Trans of the Royal Soc of Lon. 314 (1165), 1(1986).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat Meth. 4 (9), 727-731 (2007).
- Chute, C. D., Srinivasan, J. Chemical mating cues in C. elegans. Semin Cell Dev Biol. 33, 18-24 (2014).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook. , 1-22 (2013).
- Narayan, A., et al. Contrasting responses within a single neuron class enable sex-specific attraction in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 113 (10), E1392-E1401 (2016).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Sammut, M., et al. Glia-derived neurons are required for sex-specific learning in C. elegans. Nature. 526 (7573), 385-390 (2015).
- Sulston, J. E., Albertson, D. G., Thomson, J. N. The Caenorhabditis elegans male: postembryonic development of nongonadal structures. Dev Biol. 78 (2), 542-576 (1980).
- Hilliard, M. A., et al. In vivo imaging of C. elegans ASH neurons: cellular response and adaptation to chemical repellents. The EMBO Journal. 24 (1), 63-72 (2005).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Cáceres, I. dC., Valmas, N., Hilliard, M. A., Lu, H. Laterally Orienting C. elegans Using Geometry at Microscale for High-Throughput Visual Screens in Neurodegeneration and Neuronal Development Studies. PLoS ONE. 7 (4), e35037(2012).
- Schrodel, T., Prevedel, R., Aumayr, K., Zimmer, M., Vaziri, A. Brain-wide 3D imaging of neuronal activity in Caenorhabditis elegans with sculpted light. Nat Methods. 10 (10), 1013-1020 (2013).
- García, L. R., Portman, D. S. Neural circuits for sexually dimorphic and sexually divergent behaviors in Caenorhabditis elegans. Curr Opin Neurobiol. 38, 46-52 (2016).
- Clokey, G. V., Jacobson, L. A. The autofluorescent "lipofuscin granules" in the intestinal cells of Caenorhabditis elegans are secondary lysosomes. Mech Ageing Dev. 35 (1), 79-94 (1986).
- Coburn, C., et al. Anthranilate Fluorescence Marks a Calcium-Propagated Necrotic Wave That Promotes Organismal Death in C. elegans. PLoS Biology. 11 (7), e1001613(2013).
- Macosko, E. Z., et al. A hub-and-spoke circuit drives pheromone attraction and social behaviour in C. elegans. Nature. 458 (7242), 1171-1175 (2009).
- Park, D., et al. Interaction of structure-specific and promiscuous G-protein-coupled receptors mediates small-molecule signaling in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 109 (25), 9917-9922 (2012).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır