JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
남성 선 충 C. 머리 신경에 있는 페로몬에 대 한 응답에서 신경 활동의 이미징에 대 한 적응된 미세 후 각 칩을 사용 하 여
요약
C. 선 충 수 컷의 효율적인 칼슘 이미징에 대 한 적응된 "후 각 칩"를 사용 하 여 여기에 설명 되어 있습니다. 글리세롤과 페로몬에 남성 노출의 연구도 표시 됩니다.
초록
칼슘 지표의 사용은 크게 신경 역학 및 규칙의 우리의 이해를 강화 했다. 완전히 매핑된 신 경계와 투명 한 해부학, 선 충 류 꼬마 선 충, 칼슘 표시기를 사용 하 여 실시간 신경 역학을 이해 하기 위한 이상적인 모델을 제공 합니다. 미세 기술 및 실험 설계와 함께, 자유로운 이동 및 덫을 놓은 동물 칼슘 이미징 연구가이 표시기를 사용 하 여 수행 됩니다. 그러나, Chronis 그 외 여러분에서 설명한 후 각 칩 등의 트랩 장치를 이용 하 여 대부분 이전 연구는 보다 적게 일반적인 남성은 둘 다 형태학 상으로 그리고 구조적으로 더 일반적인 자웅 동체에 사용 하기 위해 설계 된 장치 비슷하지. 적응된 후 각 칩 설계와 젊은 성인 동물을 사용 하 여 남성 신경 이미징에서 증가 효율성에 대 한 조작. 차례는 웜 포트 동물 회전 하 고 2D 영상에서 양측 쌍 개별 뉴런의 분리에 대 한 로드로 통합 되었다. 벌레는 자웅 동체 연구 이전에 설명 된 대로 odorant 미세 소자 내에서 제어 흐름에 노출 됩니다. 칼슘 과도 다음 ImageJ의 오픈 소스 소프트웨어를 사용 하 여 분석 된다. 여기에 설명 된 절차는 남성 기반 C. 선 충 의 증가 금액에 대 한 허용 해야 칼슘 이미징 연구, 섹스 관련 신경 신호 전달의 메커니즘에 대 한 우리의 이해를 심화.
서문
미세 장치 증가에 액세스할 정확 하 게 제어 환경의 점에서 동물, C. 선 충, 선 충 류 실험적 조작된1수와 같은. 이러한 연구는 행동 분석, 칼슘 이미징 연구, 또는 특정 고기, 실험 결과1,2,3,4,의 더 정확한 측정 결과 대 한도 검 진 5,6. 마이크로 소규모 액체 상태는 상세한 실험 시 약의 최소한의 금액을 이용 하는 동안 실행 될 수 있습니다 제공 합니다. 거기는 새로운 미세 장치 디자인의 지속적인 생산 다르며 각각의 사용, 자연 정현파 모션 C. 선 충 의 행동 분석 및 신경 영상 연구, 신경 이미징에 사용 되는 장치를 함정을 허용 하는 경기장에서 그리고 후 각 연구, 유전자에서 높은 처리량 phenotypic 분석 화면4,5,,67대 한 허용 하는 장치. 마스터 몰드의 제작, 다음 미세 장치는 건설 비용이-마스터의 재사용성을 제공-사용 하기 쉬운, 높은 처리량 연구를 통해 빠른 데이터 생성에 대 한 허용. 등입니다 (PDMS) 폴리머를 사용 하 여 장치의 제조 시간 이내 신제품의 창조에 대 한 수 있습니다.
칼슘 이미징 연구 대상 세포에 표현 된 유전자 인코딩된 칼슘 지표 (GECIs)를 사용 하 여 실시간으로8,9,,1011에 그 세포의 신경 역학 측정. C. 선 충 의 투명 한 자연 동물에이 단백질의 형광 레벨의 기록에 대 한 수 있습니다. GECIs 녹색 형광 단백질 (GFP)을 의존 하는 전통적으로,-하지만 더 최근의 연구 더 나은 신호 대 잡음 비율 및 레드 이동 여기 프로필 있도록 이러한 센서 적응 센서 GFP Calmodulin M13 펩 티 드 (GCaMP)를 기반으로. GCaMP3의 개발에 따라 단백질이 규격 다양, GCaMP6s 및 GCaMP6f 같은 센서를 포함 하 여 (느린 빠르고 형광 오프 비율, 각각), RFP Calmodulin M13 펩 티 드 (RCaMP), 뿐만 아니라 빨간색 이동 있다 활성화 프로필입니다. C. 선 충 세포 관련 유전자 발기인 시퀀스와 이러한 GECIs 조합의 관심사, 특히 감각 신경12,13,,1415 의 세포를 타겟팅 할 수 있습니다. , 16.
미세 연구에 선 충 C. 사용의 용이성 명백한 동안, 거의 모든 연구는 광고에 나온 것에 집중 했다. 남성만 0.01-0.02에 대 한 회계에 불구 하 고 야생 형식 인구의 %, 귀중 한 발견 그들의 특성에서 발생할 수 있습니다. 자웅 동체 신경 시스템의 물리적 텀 수십 년17완벽 하 게 매핑 되었습니다, 반면 남성 텀 동물18의 머리 지역에서 특히 불완전, 남아 있습니다. 칼슘 이미징 남성에서의 사용은 남성 신 경계와 두 남녀 사이 발생 하는 차이 대 한 이해를 생성 하는 데 도움이 됩니다. 선 충 C. 성인 남성의 더 작은 크기는 큰 광고에 나온 것을 위한 전통적인 후 각 장치의 로드 포트에 효과적이 고 신뢰할 수 있는 트래핑 방지할 수 있습니다. 이 해결 하기 위해 Chronis 후 각 칩19 의 수정된 된 버전 좁은 로드 포트, 낮은 채널 높이, 개발 되었다 고 웜 로드 포트 (이 동물 회전), 양자 왼쪽/오른쪽의 시각화에 대 한 허용에 신경 쌍입니다. 이 디자인 허용: 젊은 성인 남성 (1) 효과적인 트랩핑, 양자 쌍된 뉴런의 두 멤버와 남성 뉴런에서 신경 활동의 정확한 영상 (3)의 시각화에 대 한 동물의 보다 안정적인 방향 (2).
점점, 연구 선 충 C. 남성 ascarosides (ascr), 또는 선 충 류 페로몬20,,2122,23의 다양 한 광고에 나온 것 보다 다르게 응답 표시 ,24. 따라서, 신경 역학과 남성 텀 내 표현에 대 한 이해를 개발 훨씬 더 관련 되고있다. 남성 선 충 C. 포함 자웅 동체25,26에 없음 87 섹스 관련 신경으로에 텀을 변경-아직 불확 실한 방법. 이러한 독특한 신경 역학 이미지를 수 있는 더 나은 섹스 관련 응답 및 신경 표현 이해 하 고 우리 수 있습니다.
이 프로토콜은 남성 C. 선 충 의 신경 영상에 대 한 남성 적응 후 각 칩의 사용을 설명 합니다 chemosensation. 재 1 M 글리세롤 남성, 이전 일치에 자웅 동체에 안정적으로 응답 nociceptive 신경 연구27. Ascarosides에 노출은 변수 동물 동물에서 시험 될 동물의 많은 수를 요구 하는 응답을 유도 수 있습니다. 남성 전용 CEM 뉴런의 응답 이전 표시 되었습니다, 전기 생리학 및 칼슘 이미징 연구를 통해 변함없이 ascaroside #323응답.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 장치 제조
참고: 참조 참조 1.
참고: 실리콘 마스터 금형 실리콘 마스터 1 , 7 수 8 포토 레지스트 패터 닝에 대 한 표준 photolithographic 기법을 사용 하 여 날조 했다. 웨이퍼 패턴에 대 한 포토 25000 dpi에서 인쇄 되었다. 남성 적응 장치 기능 Chronis 후 각 칩 디자인 변화는 웜 포트 로드, M. 짐머 (개인 통신, 2016)에서 얻은 디자인을 적응에 19. 차례 동물의 회전을 제어 하는 포함 되어 있습니다. 포트 채널을 로드 하는 벌레의 폭은 50 μ m로 좁혀 졌다. 모든 채널은 32 μ m 높이 이다. 실리콘 마스터 몰드는 사용자에 게 제공 되 면 사용자는 후속 따를 수 프로토콜, 앞에서 설명한 1.
- 무게에 의해 10:1 비율로 믹스 PDMS 기본 및 경화 에이전트.
- 전송 펫으로 철저 하 게 혼합.
- 모든 보이는 거품 제거 될 때까지 1 시간에 대 한 진공 desiccator에 섞어 드.
- 두께 5 mm (100 g) 때까지 150 m m 직경 접시에 실리콘 몰드 마스터에 혼합물을 부 어. 파스퇴르 피 펫을 사용 하 여 모든 거품 또는 혼합물에 도입 된 먼지 제거.
- 적어도 3 h, 또는 하룻밤 65 ° C에서 구워.
- 메스를 사용 하 여 금형에서 PDMS를 잘라내어 별도 장치를 떨어져 면도날을 사용 하 여 잘라.
- 1mm 피부 펀치와 인 레트와 출구 구멍을 펀치.
- 플러시 dH 구멍 2 O, 에탄올, 그리고 다시 dH 2 O는 펀치에서 입자를 제거 하. 에 어 스트림 펄스에서 장치 건조.
- 채널 측 및 어떤 먼지 또는 성공적인 접합 수 있도록 장치에 남아 있는 파편 제거 접착 테이프로 장치의 위쪽 청소.
- 플라즈마-본드 장치, 제 1 덮개 유리, 채널 사이드.
- 노출 커버 유리 및 장치 (채널-쪽) 공기 플라즈마 100 W 30 같은 적절 한 결합을 허용 하는 조건을 사용 하 여 s 또는 24 W 60에 대 한 s.
참고: 설정은 결합 효율을 향상 시키기 위해 조정할 수 있습니다. 플라즈마-결합 조건이 결합 효율을 개선 하려고 할 때 적절 한 청소 만큼 중요있지 않습니다. 이상적인 플라즈마 조건 에서도 충분 청소 장치 채권 하지 것입니다. - 5 손가락으로 아래로 장치 및 보도 채널 쪽으로 커버 유리를 반전 미
- 노출 커버 유리 및 장치 (채널-쪽) 공기 플라즈마 100 W 30 같은 적절 한 결합을 허용 하는 조건을 사용 하 여 s 또는 24 W 60에 대 한 s.
2. 준비를 버퍼
- Dilute 1 살 균 10 배 재고에서 S 기초 (100 m m NaCl 및 0.05 M KPO 4, pH 6.0) x.
- 모든 버퍼 솔루션에 대 한 1 M 1 m m S 기초 x 1에서의 최종 농도 tetramisole 재고 희석.
- Fluorescein 둘 다 추가 " 흐름 제어 "와 " 버퍼 " 저수지.
- S 기초 x 1에 100 mg/mL 재고 fluorescein 만들기.
- 흐름 제어에 1 µ g/mL 및 버퍼에서 0.1 µ g/mL의 최종 농도에 재고 희석.
- 자극을 만듭니다.
- 1 M S 기초 X 1에서의 최종 농도에 희석 글리세롤.
- S 기초 X 1으로 1 µ M의 최종 농도를 희석 ascaroside #3 (ascr #3).
3. 장치 설치
참고: 1 참조.

그림 1. 미세 장치 설치. (A) 저수지 및 튜브 30 mL 주사기 플런저 역할 수 없이 " 저수지. "이 세 가지 흐름 옵션 Luer 밸브에 연결. 다른 미세 장치에 연결 하는 튜브에 삽입 된 바늘 (오렌지)에 연결 하는 동안 1 개의 출구 3 mL 주사기 플런저와 연결 된다. (B) 전체 이미징 실험 미세의 설정. 소자 대물 렌즈 위에 거꾸로 epifluorescence 현미경의 단계에 배치 됩니다. " 흐름 제어 " 버퍼 설정 위의 선반에 장치에 의해 제어 되는 3 방향 밸브를 통해 여행. 라인 버퍼를 포함 하는 다음 적절 한 장치 포트에 삽입 됩니다. (C) 미세 소자의 포트. " 흐름 제어 " 포트 측면 다른 입구 포트:는 " 자극 " 및 " 버퍼 " 포트. " 콘센트 "는 가장 오른쪽 포트. 웜 로드 경기장의 위치는 " 웜 로드 " 포트는 장치에서 중앙 대부분 포트입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 준비 3 3 mL 주사기 및 바늘 ( 그림 1A)에서 뿐만 아니라 루어 밸브에 연결 된 3 방향 Luer 밸브, 30 또는 60 mL 주사기를 연결 하 여 유체 저수지. 미세 장치 확장 튜브에 바늘을 연결 ( 그림 1A에서 -B).
- 저수지와 배관에서 공기 방울을 제거.
- S 기초 x 1과 연결 된 튜빙 3 mL 주사기를 콘센트에 삽입 포트
- 버퍼 입구 구멍의 상단에 표시 될 때까지 부드럽게 주사기에 압력을 적용.
- 적절 한 입구 구멍에 흐름 제어, 버퍼 및 자극 튜브를 연결 ( 그림 1B에서 -C), 액체 방울 로드 포트에 있는 지를 확인 구멍과 첨부 버퍼 튜브.
- 방울 벌레 로드 포트 입구에에서 나타날 때까지 출구 포트에 연결 된 주사기를 다시 부드럽게 압력을 적용.
- 포트 로드 벌레에 단단한 차단 핀을 삽입
- 출구 포트에서 주사기를 제거 하 고 집 진공 (-670 Torr)에 연결 하는 콘센트 라인 연결.
- 검사 흐름에 어떤 거품에 대 한 장치 채널, 시각 및 카메라와 호환 하는 소프트웨어를 통해 비디오 확인을 통해 사용, 오픈-소스 소프트웨어 마이크로 유 등. 마이크로-Manager를 사용 하 여에 대 한 도움말 6 단계를 참조 하십시오.
- 어떤 거품이 있으면 기다리는 그들을 꺼내 려 하는 PDMS에 흡수 될 어떤 동물을 로드 하기 전에 벽, 거품의 존재는 장치를 통해 체액의 적절 한 흐름을 방해 합니다.
- 장치 내에서 적절 한 흐름 역학 확인 GFP 필터를 사용 하 여 웜 3-방향 밸브를 움직이는 버퍼의 관찰을 로드 하기 전에.
- 결정 적절 한 흐름 역학: 흐름 제어 및 버퍼 솔루션에 fluorescein 관찰 ( 그림 2D -2E) 컨트롤을 눌러 흐름 제어 값이 변경 될 때 변경 3-방향 밸브 밸브 링크 ( 그림 1B)에 해당 하는 버튼.
- 마이크로 관리자를 연 후에 클릭 " 라이브 " 소자의 라이브 이미지를 관찰 하는 것. 장치에서 버퍼의 흐름을 관찰 하는 형광 광원 설정 ( 그림 2D -2E).
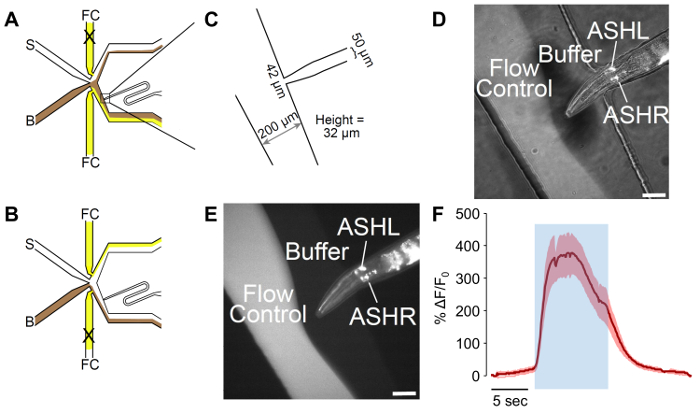
그림 2: 한 남자 적응 미세 후 각 칩 했다. 장치는 벌레는 노출 될 경우의 (A) 흐름 패턴 버퍼를. 버퍼 (B)는 브라운에 나와 고 흐름 제어 (FC) 흰색에서 노란색, 자극 (S)에 표시 됩니다. 포트 로드 웜 웜 오리엔테이션의 더 나은 제어 곡선을 포함 적응 되었습니다. (B) 흐름 벌레 자극에 노출 되 면 소자의 패턴. 버퍼 (B)는 브라운에 나와 고 흐름 제어 (FC) 흰색에서 노란색, 자극 (S)에 표시 됩니다. (C) 조작으로 적응된 장치의 측량. 포트 로드 웜 남성 폭을 위한 50 µ m 채널 여 42 µ m에 끝납니다. 채널의 측정된 높이 디자인 25 µ m의 목표에도 불구 하 고 32 µ m입니다. (D-E) A 갇혀 남성 표현 p sra-6:: GCaMP3. Sra 6 발기인 재 관련, 그리고 비록 아무 칼슘 과도 ASI에 관찰 했다 일부 식 ASI 신경에서 관찰 될 수 있습니다. 반면 (E) 형광 이미지 (D) 밝은 분야 및 형광 조명의 조합입니다. 스케일 바는 강력한 신경 활동 42 µ m. (F)는 재 신경 응답을 1 M 글리세롤 자극을 나타냅니다. 파란색 영역 1 M 글리세롤 자극의 시간을 나타냅니다. 음영 처리 된 영역 나타냅니다 표준 오차, n = 7 벌레에서 20 펄스. 붉은 흔적이 depolarizing 응답을 나타냅니다. y 축의 δ/F 0을 표시합니다. 눈금 막대를 5 나타냅니다 s. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
4. 동물 준비
참고: 참조 참조 23.
- 이미징 재 응답 1 M 글리세롤. P sra-6에 대 한 긍정적인
- 장소 약 20 C. 선 충
- 남성:: 선 충 류 성장 매체 (NGM) 한 접시에 GCaMP3 배열 식 OP50 대장균의 잔디와 시드. 형광 GECI의 표현 및 공동 주입 마커를 사용 하 여 배열-긍정적인 동물의 식별에 대 한.
- 따기 직전 분석 결과, 젊은 성인 남성을 선택 하는 경우
- . 만약 전날 분석 결과, L4 애벌레 남성 선택.
참고: 배열 긍정적인 동물 사용 GECI에 따르면 형광 것입니다 (즉, 동물을 표현 하는 GCaMP 것입니다 형광 블루 빛 자극, 아래 녹색 RCaMP 동물 그린 빛 자극 아래에 빨간색 형광 것입니다 하는 동안). 공동 주입 마커 phenotypic 마커, rol-6, 같은 다른 형광 단백질, GFP와 RFP, 등에서 배열할 수 있다 또는 pha-1 돌연변이 28 같은 지배적인 표현 형을 구출 하실 수 있습니다. - 따기 직전 분석 결과, 젊은 성인 남성을 선택 하는 경우
- 이미징 CEM 응답 1 µ M ascr #3.
- 선택 약 20 L4 C. 선 충 수 컷 (fkEx98 [p pkd-2::GCaMP::SL2::dsRED + pBX-1]; pha-1 (e2123ts); 그-5 (e1490); 라이트-1 (ce314)) 그는 dsRed 공동 주입 식 표식에 대 한 긍정적.
참고: 남자 이야기의 광선 신경 내 dsRed 식을 관찰 하 고 4 개의 CEM 뉴런 내에서 GCaMP 식 보다 확인 쉽습니다. - 이미징 실험을 수행 하기 전에 5-14 h OP50 대장균의 잔디와 시드 NGM agar 접시에 광고에 나온 것에서이 남성 분리.
참고: 남성 5 h의 최소 절연 하지 행동 ascr # 3에 응답 하지 않는 및 따라서 여기 관찰 보다는 ascaroside에도 적은 칼슘 과도 전시 수 있습니다.
- 선택 약 20 L4 C. 선 충 수 컷 (fkEx98 [p pkd-2::GCaMP::SL2::dsRED + pBX-1]; pha-1 (e2123ts); 그-5 (e1490); 라이트-1 (ce314)) 그는 dsRed 공동 주입 식 표식에 대 한 긍정적.
5. 동물 로드
참고: refefence 1.
- 표준 웜 유지 관리 기술을 사용 하 여 한 unseeded NGM 천 배지 위에 한 웜 선택.
- 선택
- 벌레는 (병합 된 백 금 철사로 만든), 선택, 선택에 박테리아를 따기 불타는 여 고 " dabbing " 그것을 데리 러 벌레. 부드럽게 장소 자체에서 크롤링할 수 있도록 하는 새로운 접시에 웜.
- 접시가 홍수 같은 unseeded 접시에 S 기초 x 1의 약 5 mL을 추가.
- S 기초 x 1 미리 채워진 된 로드 주사기 (즉, 연결 된 튜빙 3 mL 주사기)에 벌레를 그립니다.
- 웜 튜브로 서만, 아니라 모든 방법으로 주사기를 빨 아 해야.
참고: 경우 벌레 주사기에 여행, 그것은 가까이 튜브에 그것을 다시 얻을 불가능.
- 웜 튜브로 서만, 아니라 모든 방법으로 주사기를 빨 아 해야.
- 콘센트 Luer 밸브 선회 하 여 흐름을 중지 하려면 진공 해제.
- 포트 로드 웜 차단 고체 핀 제거
- 설정 Luer 밸브 배기는 출구 포트 ( 그림 1B)에 연결.
참고: 사용 하 여 라이브 비디오 피드는 벌레를 로드 하는 동안 위치와 동물 (단계 5.8-5.13)의 방향을 확인. - 삽입 튜브 웜 포트 로드에 로드 하는 웜
- 웜 로드 채널에 나타날 때까지 부드럽게 주사기에 압력을 적용.
- 벌레 꼬리 1 채널 입력을 시작, 경우 입력 채널에서 벌레를 방지 하기 위해 주사기 플런저 당겨.
- 적용 하 고 머리 먼저 채널 입력 될 때까지 압력을 반전 전환.
- 3 방향 Luer 밸브 선회 하 여 진공 분위기 대신 진공 하 여 출구 포트에 연결 하는 오픈.
- 수동으로 머리 자유롭게 이동할 수 우울을 동양 벌레 머리 버퍼 흐름 채널, 하지만 지금까지 노출 되는 주사기 플런저에 의해 압력을 적용 ( 그림 2 D-2E).
6. 자극 및 수집
- 마이크로 매니저 등 10 프레임/s 블루 빛 여기를 사용 하 여 TIFF 스택으로 이미지를 캡처하여 기록 소프트웨어를 오픈-소스 현미경을 사용 하 여, (470 nm) 30 미
- 오픈 100 양 메인 메뉴에서 노출 설정 " 멀티 D Acq. " 소프트웨어의 메인 메뉴에서. 설정는 " 번호 "를 " 300, " 및 " 간격 "을 " 0. " 클릭 " 취득! " 비디오를 얻으려고.
- 적용 수집을 시작한 후 자극 5 s의 10 s 펄스. 원하는 대로 응용 프로그램 자극의 기간 조정.
- 5 인수 후 s 비디오의 변경 제어 흐름 제어 버퍼 테스트 중인 동물을 자극을 적용 하는 3 방향 밸브. 밸브 연결 ( 그림 1B)에 가장 왼쪽 단추를 클릭 하십시오.
- 자극 노출 후 10 s (이 시간을 조정할 수 있습니다 사용자가 원하는대로), 다시 밸브 링크 맨 왼쪽 버튼을 누르면 버퍼의 흐름을 변경.
- 버퍼 30의 창 GECI 형광 기준선으로 돌아갑니다 있도록 완료 될 때까지 아래 기록.
- 원하는 대로 반복합니다. 수집의 끝과 다음 재판의 개시 사이 대기 30 s.
7. 분석 이미지
- ImageJ 창에 파일을 드래그 하 여 TIFF 스택 ImageJ, 오픈 소스 소프트웨어와 함께 엽니다.
- 커서를 사용 하 여 클릭 하 고 끌어 관심 (ROI)의 신경 주변 영역을 설정. ( 그림 3A)와 같이 관심의 신경의 soma를 포함 하도록 영역 설정.
- 열기 클릭 하 여 투자 수익의 형광 강도의 z 스택 스택 전체 플롯-> 이미지-> 스택-> z 축 프로필 플롯.
- 클릭 " 목록 " 열리는 창에서. 편집-> 값을 복사 하려면 복사. 값을 붙여 스프레드시트 프로그램으로.
- 웜 GCaMP 식을 포함 하지 않는 영역에 투자 수익을 드래그 하 여 각 펄스에 대 한 배경 형광 분석.
- 신경 형광 강도 값에서 배경 형광 값을 빼서 각 펄스에 대 한 배경 빼기 수행.
- 계산 각 펄스의 각 프레임에 대 한 δ/F 0.
- 첫 번째 1 대 한 투자 수익의 평균 휘도 값으로 계산 F 0 수집 (예: 프레임 1-10)의 s.
- 계산된 F 0 값으로 관심의 프레임에 대 한 배경 뺀 값을 분할 하 여 δ/F 0를 계산.
- 군데 모든 신경 및 모든 자극 펄스 반복.
- 일관 된 응답 프로필, 화산재, 등 신경 각 뉴런에 대 한 모든 펄스를 평균 하 고 ( 그림 2F)에서 SEM을 계산.
- 각 뉴런에 대 한 시간이 지남에 SEM와 평균 δ/F 0 플롯.
참고:이 경우에, 그것은 뿐만 아니라 각 재판의 개별 신경 응답의 heatmaps를 포함 하 일반적인 관행입니다. 그것은 개별 펄스 트레이스 (로 표시에 더 적용 수 반복된 stimulations 걸쳐 자극에 노출 되 면 칼슘 과도 일관 된 변화를 전시 하지 않는 신경 또는 다른 개인 23 그림 4)입니다. 결정 하는 데이터를 표시 하는 방법에 대 한 자세한 내용은 토론을 참조 하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
그림 1A-B에서 전체 장치 설치의 예를 볼 수 있습니다. 그림 1A 는 적절 한 저수지 건설 및 설치를 보여 줍니다. 그림 1B 미세 장치에 저수지의 연결을 보여 줍니다. 그림 1C 는 개별 포트 선명도 대 한 분류와 미세 장치를 묘사 한다.
Access restricted. Please log in or start a trial to view this content.
토론
남성 적응 후 각 칩 좁은 로드 포트 방향 제어 및 남성 C. 선 충의 효율적인 트래핑 수 있는 회전을 채택 하고있다. Z-스태킹에 대 한 필요 없이 신경 양자 쌍의 왼쪽 및 오른쪽 회원의 시각화에 대 한 수 있습니다. 이 곡선 벌레에 시간의 수직 100% 떨어져 방향을 하나의 양자 쌍 재 (그림 2D-E)29,30같은 형광 표시와 ?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 없다.
감사의 말
우리는 마누엘 짐머 남성;와 사용을 위해 적응 시켰다 초기 디자인 파일 제공 하는 것을 감사 하 고 싶습니다. 합성 및 ascr #3;의 공급에 대 한 프랭크 슈뢰더 로스 Lagoy 통찰력 및 영상 및 분석; 그리고 크리스토퍼 낙하산, 함께 마스터 제작 및,로 라 Aurilio이이 원고 검토에 기여. 이 작품에 대 한 자금 국립 보건원 그랜트 1R01DC016058-01 (제), 국립 과학 재단 부여 CBET 1605679 (D.R.A.), 및 버로우즈 Wellcome 경력 수상 과학 인터페이스 (D.R.A.)에서 제공 했다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Silicon Wafer | University Wafer | 452 | |
| SU-8 2035 | MicroChem | Y111070-0500L1GL | |
| Developer | MicroChem | Y020100-4000L1PE | |
| Wafer Mask | Cad/Art Services | - | Custom order. Printed at 25,000 dpi. |
| Sylgard-184 | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| 1.0 mm Dermal Punches | Acuderm Inc. | P150 | |
| Soft Tubing | Cole-Palmer | EW-06419-01 | |
| Hard Tubing | IDEX Health & Science | 1622 | |
| Pins | New England Small Tube | NE-1027-12 | |
| Blocking Pins | New England Small Tube | 0.415/0.425" OD x .500 Long | Batch PB07027 |
| 3 mL syringes | BD | 309657 | |
| 30 mL syringes | Vitality Medical | 302832 | Used as buffer reservoirs. |
| Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer | Component Supply Company | NE-231PL-50 | |
| Stopcocks with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile | Cole-Palmer | EW-30600-07 | |
| Fisherfinest Premium Cover Glass | Fisher Scientific | 12-548-5M | |
| Mercator Control System LF-5 Plasma System | Mercator | LF-5 | |
| Scotch Tape | Scotch | BSN43575 | |
| Series 20 Chamber | Warner Instruments | P-2 | |
| Vacuum Desicator | Bel-Art Scienceware | 420250000 | 24 cm inner diameter. |
| Weigh Boats | Cole-Palmer | EW-01017-27 | |
| Classic Plus Balance | Mettler Toledo | PB1501-S/FACT | |
| Glass Pasteur Pipettes | Cole-Palmer | EW-25554-06 | |
| Transfer pipettes | Genesee Scientific | 30-202 | |
| Oven | Sheldon Manufacturing Inc | 9120993 | Model Number: 1500E. |
| 60 mm, non-vented, sharp edge Petri dishes | TriTech Research | T3308 | |
| Zeiss Axio Observer.A1 | Zeiss | - | |
| Hammamatsu Orca Flash 4.0 Digital CMOS | Hammamatsu | C11440-22CU | |
| Blue Fluorescent Light | Lumencor | SOLA SM6-LCR-SA | 24-30V/7.9A DC. |
| Illumination Adaptor | Zeiss | 423302-0000 | |
| Series 1 and 2 Miniature Inert PTFE Isolation Valve | Parker | 001-0017-900 | 3-way valve for controlling flow. |
| ValveLink8.2® | AutoMate Scientific | 01-18 | Flow Switch Controller |
| Micro Manager | Micro-Manager | - | Free software, can be downloaded at: https://www.micro-manager.org/wiki/Download_Micro-Manager_Latest_Release |
| ImageJ | ImageJ | - | Free software, can be downloaded at: https://imagej.nih.gov/ij/download.html |
| Agar, Bacteriological Grade | Apex | 9012-36-6 | |
| Peptone | Apex | 20-260 | |
| CaCl2 | VWR | BDH0224-1KG | |
| MgSO4 | Sigma-Aldrich | 230391-1kg | |
| Cholesterol | Alfa Aesar | A11470 | |
| Ethanol | Sigma-Aldrich | 270741-4L | |
| Tetramisole | Sigma-Aldrich | L9756-10(G) | Store at 4 °C. |
| Fluorescein | Sigma-Aldrich | FD2000S-250mg | Light Sensitive. Store in photoprotective vials. |
| Glycerol | Sigma-Aldrich | G6279-1L | |
| Ascaroside #3 | - | - | Synthesized in the Schroeder Lab (Cornell University). |
| NaCl | Genesee Scientific | 18-215 | |
| KH2PO4 | BDH | BDH9268.25 | |
| K2HPO4 | J.T. Baker | 3252-025 | |
| ASH GCaMP3 line | - | - | CX10979 (KyEx2865 [psra-6::GCAMP3 @ 100 ng/uL]). Developed in Bargmann lab. Provided from Albrecht Lab library. |
| CEM GCaMP6 line | - | - | JSR49 (FkEx98[ppkd-2::GCaMP::SL2::dsRED + pBX-1]; pha-1(e2123ts); him-5(e1490); lite-1(ce314)). Developed by Robyn Lints. Provided from Srinivasan Lab library. |
| E. coli (OP50) | Caenorhabditis Genetics Center | OP50 | |
| "Reservoir" | - | - | To create a Reservoir: A "30 mL syringe", is connected to a "Stopcock with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile", which is connected to a "3 mL syringe" and a "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer". The "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer" is then inserted into "Soft Tubing" approximately 1/3 of the way down the needle. |
참고문헌
- Lagoy, R. C., Albrecht, D. R. Microfluidic Devices for Behavioral Analysis, Microscopy, and Neuronal Imaging in Caenorhabditis elegans. Methods Mol Biol. 1327, 159-179 (2015).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Curr Opin Neurobiol. 19 (5), 561-567 (2009).
- Chronis, N. Worm chips: Microtools for C. elegans biology. Lab on a Chip. 10 (4), 432-437 (2010).
- Lee, H., Crane, M. M., Zhang, Y., Lu, H. Quantitative screening of genes regulating tryptophan hydroxylase transcription in Caenorhabditis elegans using microfluidics and an adaptive algorithm. Integr Biol (Camb). 5 (2), 372-380 (2013).
- Lockery, S. R., et al. A microfluidic device for whole-animal drug screening using electrophysiological measures in the nematode C. elegans. Lab Chip. 12 (12), 2211-2220 (2012).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nat Commun. 7, 13023(2016).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 110 (45), E4266-E4273 (2013).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Front Mol Neuro. 6, 2(2013).
- Badura, A., Sun, X. R., Giovannucci, A., Lynch, L. A., Wang, S. S. H. Fast calcium sensor proteins for monitoring neural activity. Neurophotonics. 1 (2), 025008(2014).
- Tatro, E. T. Brain-wide imaging of neurons in action. Front Neural Circuits. 8, 31(2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat Methods. 6 (12), 875-881 (2009).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Greene, J. S., Dobosiewicz, M., Butcher, R. A., McGrath, P. T., Bargmann, C. I. Regulatory changes in two chemoreceptor genes contribute to a Caenorhabditis elegans QTL for foraging behavior. Elife. 5, (2016).
- Kim, K., et al. Two Chemoreceptors Mediate Developmental Effects of Dauer Pheromone in C. elegans. Science. 326 (5955), 994-998 (2009).
- McGrath, P. T., et al. Parallel evolution of domesticated Caenorhabditis species targets pheromone receptor genes. Nature. 477 (7364), 321-325 (2011).
- Schmitt, C., Schultheis, C., Husson, S. J., Liewald, J. F., Gottschalk, A. Specific Expression of Channelrhodopsin-2 in Single Neurons of Caenorhabditis elegans. PLoS ONE. 7 (8), e43164(2012).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Nervous System of the Nematode Caenorhabditis elegans. Phil Trans of the Royal Soc of Lon. 314 (1165), 1(1986).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat Meth. 4 (9), 727-731 (2007).
- Chute, C. D., Srinivasan, J. Chemical mating cues in C. elegans. Semin Cell Dev Biol. 33, 18-24 (2014).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook. , 1-22 (2013).
- Narayan, A., et al. Contrasting responses within a single neuron class enable sex-specific attraction in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 113 (10), E1392-E1401 (2016).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Sammut, M., et al. Glia-derived neurons are required for sex-specific learning in C. elegans. Nature. 526 (7573), 385-390 (2015).
- Sulston, J. E., Albertson, D. G., Thomson, J. N. The Caenorhabditis elegans male: postembryonic development of nongonadal structures. Dev Biol. 78 (2), 542-576 (1980).
- Hilliard, M. A., et al. In vivo imaging of C. elegans ASH neurons: cellular response and adaptation to chemical repellents. The EMBO Journal. 24 (1), 63-72 (2005).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Cáceres, I. dC., Valmas, N., Hilliard, M. A., Lu, H. Laterally Orienting C. elegans Using Geometry at Microscale for High-Throughput Visual Screens in Neurodegeneration and Neuronal Development Studies. PLoS ONE. 7 (4), e35037(2012).
- Schrodel, T., Prevedel, R., Aumayr, K., Zimmer, M., Vaziri, A. Brain-wide 3D imaging of neuronal activity in Caenorhabditis elegans with sculpted light. Nat Methods. 10 (10), 1013-1020 (2013).
- García, L. R., Portman, D. S. Neural circuits for sexually dimorphic and sexually divergent behaviors in Caenorhabditis elegans. Curr Opin Neurobiol. 38, 46-52 (2016).
- Clokey, G. V., Jacobson, L. A. The autofluorescent "lipofuscin granules" in the intestinal cells of Caenorhabditis elegans are secondary lysosomes. Mech Ageing Dev. 35 (1), 79-94 (1986).
- Coburn, C., et al. Anthranilate Fluorescence Marks a Calcium-Propagated Necrotic Wave That Promotes Organismal Death in C. elegans. PLoS Biology. 11 (7), e1001613(2013).
- Macosko, E. Z., et al. A hub-and-spoke circuit drives pheromone attraction and social behaviour in C. elegans. Nature. 458 (7242), 1171-1175 (2009).
- Park, D., et al. Interaction of structure-specific and promiscuous G-protein-coupled receptors mediates small-molecule signaling in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 109 (25), 9917-9922 (2012).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유