Method Article
صمام عزل وتوصيف للفئران الابتدائي الخلايا الخلالي: نموذج جديد لدراسة تكلس الصمام الابهري
In This Article
Summary
ويصف هذا البروتوكول العزلة والثقافة وتكلس الخلايا فراغي صمام المستمدة من الفئران، نموذجا عاليا فسيولوجية في المختبر لمرض الصمام الابهري calcific (كافد). ويسهل استغلال هذا نموذج الفئران كافد البحوث في استكشاف الخلية والآليات الجزيئية التي تكمن وراء هذه العملية المرضية المعقدة.
Abstract
أمراض الصمام الابهري calcific (كافد) تتميز بسماكة التدريجي من منشورات صمام الابهر. وهو شرط كثيرا ما وجدت في نهاية المرحلة والمسنين (المسببات) مرضى الفشل الكلوي، الذين يعانون عادة من هايبرفوسفاتيميا والدهون. وفي الوقت الحاضر، هناك لا العلاجات الأدوية التي يمكن أن تتوقف عن التقدم. الآليات التي تكمن وراء هذه العملية المرضية لا تزال غير واضحة. النشرة الصمام الابهري يتألف من طبقة رقيقة من الخلايا صمام غشائي (تقدم) على الأسطح الخارجية لمنحنيات الابهري، مع صمام الخلايا الخلالي (VICs) بين تقدم. يمكن استخدام نموذج الفئران الدراسة في المختبر لحمل خارج الرحم تكلس على أساس في فيفو فوسفات فيسيوباثولوجيكال المصل (Pi) ومستويات الكالسيوم (Ca) للمرضى الذين يعانون من هايبرفوسفاتيميا والدهون. البروتوكول وصف تفاصيل عزل فأر نقية فيك السكان كما هو موضح بالتعبير عن علامات فيك: العضلات الملساء ألفا (α-SMA) أكتين فيمنتين والأنسجة عامل النمو بيتا (TGFβ) 1 و 2، وغياب الكتلة التمايز (CD) 31، مركزنا علامة. بتوسيع هذه VICs، يمكن إجراء الدراسات البيوكيميائية والوراثية، والتصوير لدراسة وكشف الوسطاء الرئيسية التي تدعم كافد.
Introduction
الصمام الابهري صحية تتكون من ثلاثة منشورات، التي تقسم أيضا توزيع الإجهاد الميكانيكي أثناء فتح وإغلاق الصمام. النشرة صمام لها بنية محددة من ثلاث طبقات متميزة: فيبروسا، سبونجيوسا، وفينتريكولاريس، الذي دار صمام الخلايا الخلالي (VICs) كنوع الخلية السائدة. هذه الطبقات الثلاثة هي تقع بين سريرين صمام خلايا بطانية (تقدم)1.
VICs تلعب دوراً حاسما في التقدم من Calcific الابهر صمام تكلس (كافد)، أمراض صمام القلب الأكثر شيوعاً في العالم الغربي. كافد يوصف بأنه شرط تدريجي الذي ينظم نشاط أنسجة صمامات القلب والمكرويه المحيطة به. في البداية تسبب التغيرات الخلوية سماكة fibrotic، وفي نهاية المطاف تكلس واسعة من منشورات صمام الابهر. هذا ثم يؤدي إلى تضيق الصمام الابهري كبيرة، وفي نهاية المطاف، ترك تدفق البطين عرقلة2، تاركاً استبدال صمام الجراحي العلاج الوحيد.
الفسيولوجيا المرضية كافد معقدة، ولكن أسهم آليات مماثلة ل تمعدن العظام الفسيولوجية3. بينما عدد من الدراسات أظهرت قدرة VICs للخضوع للتمايز عبر أوستيوجينيك وتكلس4،5، الآليات التي تدعم هذه العملية لم تكون أكثر وضوحاً كاملا، تسليط الضوء على شرط حاسم لنموذج مجدية وذات الصلة في المختبر كافد.
العمل السابق بعدد من المختبرات بنجاح المعزولة VICs من نماذج الخنزير والأبقار، ومثقف هذه الخلايا تحت التكلس الظروف6،،من78. بسبب الحجم الكبير للصمام الابهري في هذه النماذج، تم عزل الخلايا عن طريق الهضم الأنزيمي فعالة جداً في توليد السكان نقية من الخلايا. ومع ذلك، يمكن أن تكون هذه النماذج مقيدة بسبب محدودية توافر الأدوات الجزيئية للأنواع الحيوانية الكبيرة. وفي المقابل، نماذج القوارض تظل مفيدة بسبب التكاليف المنخفضة نسبيا، وإمكانية التلاعب بالجينات، ومجموعة واسعة من الأدوات الجزيئية التي تتوافر بسهولة. ومع ذلك، عزل VICs من النماذج الحيوانية الصغيرة هو لا تستخدم على نطاق واسع، التي من المحتمل نتيجة للصعوبات التي تواجهها عند العمل مع عينات الأنسجة الصغيرة.
هذا البروتوكول مفصلاً تقارير أسلوب شامل لعزله مباشرة من الفئران VICs. بتشريح دقيق للصمام، متبوعاً بسلسلة من ديجيسشنز الانزيمية، يمكن عزل VICs ويعملون في مجموعة متنوعة من التقنيات التجريبية، بما في ذلك التعبير الثقافة وتكلس والجينات في الخلية. ولا شك أن سيجعل هذا النموذج أهمية بالغة في المختبر من كافد إسهاما أساسيا في زيادة معرفتنا بهذه العملية المرضية.
Protocol
جميع التجارب على الحيوانات قد وافقت "لجنة المستخدمين الحيوان" في معهد "روزلين"، والحيوانات وفقا للمبادئ التوجيهية "وزارة الداخلية" (المملكة المتحدة) لرعاية واستخدام الحيوانات. واستخدمت للبروتوكول هو موضح أدناه، 5-الأسبوع القديمة، والذكور من الفئران "سبراغ داولي".
1-كاشف وصفات
- تعد الثقافة المتوسطة باستخدام دولبيكو لتعديل النسر المتوسطة (دميم) والمغذيات خليط F-12 (DMEM/F12). إضافة 10% للتعقيم معطل الحرارة الجنيني البقري المصل (FBS) والجنتاميسين 1%.
- إعداد متوسطة تكلس استخدام الثقافة المتوسطة و 2.7 مم Ca/2.5 Pi.
- يعد كلوريد الكالسيوم 1 م (كاكل2) حسب وزنها بملغ 555 كاكل2 وحلها في الماء 5 مل المقطر لجعل 5 مل من كاكل 1 م2. تصفية الحل من خلال عامل تصفية حقنه 0.22 ميكرومتر في تعقيم الحل.
- تحضير فوسفات الصوديوم 1 م حسب وزنها بملغ 710 اللامائى مائي فوسفات الصوديوم (Na2هبو4) و 600 ملغ من اللامائى صوديوم فوسفات (نة2بو4)، حل كل على حدة في 5 مل المقطر المياه. الجمع بين ميليلتر 3,870 نا2هبو4 وميليلتر 1,130 نة2ص4، والتصفية من خلال مرشح حقنه ميكرومتر 0.22 في تعقيم الحل.
- إعداد يغسل المخزن المؤقت يتضمن الجنتاميسين هانك لحل متوازن الملح (حبس) و 1%.
2-إعداد هود تشريح
- القيام بتشريح جميع بغطاء التهوية، سبق تطهيرها مع الإيثانول 70% لضمان العقم العينات والمواد الكاشفة.
- تعقيم أدوات التشريح بالتعقيم منهم تليها غمر تلميحات الأدوات في كوب يحتوي على 70% إيثانول قبل الاستخدام.
- إعداد قنينة تحتوي على المخزن المؤقت للمياه والصرف الصحي، ونقع أدوات التشريح في المخزن المؤقت للمياه والصرف الصحي قبل اتصالهم الحيوانات أو الأنسجة. الحفاظ على الجليد المخزن المؤقت يغسل في جميع الأوقات.
3-استخراج الفئران الابتدائي VICs
ملاحظة: استخدمت للبروتوكول هو موضح أدناه، 5-الأسبوع القديمة، والذكور من الفئران "سبراغ داولي".
- إعدام الفئران (~ 100 غرام) بخلع عنق الرحم وفقا للمبادئ التوجيهية "وزارة الداخلية في المملكة المتحدة".
- تشريح من قلب كل الفئران، ضع الحيوان ضعيف على لوحة تشريح زجاج، وتطهير الجلد بالرش مع الإيثانول 70%.
- جعل شق 4 سم في خط الوسط للفئران مع معونة مقص التشريح، فضح تجويف البطن، وإزالة بعناية في القفص الصدري والرئتين، لفضح القلب.
- إزالة القلب مع زوج من شارب والربيع مقص منحنى، وتخزين تشريح القلب في المخزن المؤقت للغسيل البارد الجليد حتى يكتمل تشريح الإجمالي كل من الفئران.
- الصغير-تشريح كل قلب، شملت نقل الأخير إلى طبق بتري في المخزن المؤقت للمياه والصرف الصحي. تقليم عضلة القلب مع زوج من مقص مستقيم الربيع (بليد 6 مم) أن تترك مساحة صغيرة المحيطة بجذر الاورطي والشريان الاورطي تصاعدي.
- استخدام نفس الربيع مقص مستقيم (بليد 6 مم)، بعناية قطع فتح الشريان الاورطي تصاعدي نحو البطين الأيسر وفضح منشورات صمام الابهر.
- نقل فتح الشريان الاورطي إلى طبق بتري معقمة، طازجة مليئة بحبس. تشريح منشورات الصمام الابهري، تميزت بشكلها 'U' فريدة من نوعها في قاعدة الشريان الاورطي، مع فاناس من نوع كابسولوتومي الصغرى-مقص (بليد 3 مم).
- تخزين جميع المنشورات في 1 مل من المخزن المؤقت للغسيل البارد الجليد، في أنبوب ميكروسينتريفوجي 1.5 مل حتى يكتمل تشريح كافة.
- بمجرد قد تم حصادها جميع المنشورات، الطرد المركزي لهم في 100 غ س ل 1 دقيقة عند 4 درجة مئوية لإزالة المخزن المؤقت الغسيل.
- الخطوات اللاحقة في غطاء ثقافة خلية لضمان التعقيم. لإزالة تقدم، هضم هذه المنشورات في 100 ميليلتر 425 يو/مليلتر كولاجيناز الثاني لمدة 5 دقائق عند 37 درجة مئوية. تعطيل الهضم عن طريق بيبيتينج بلطف إلى أعلى وأسفل باستخدام تلميح ماصة 200 ميليلتر.
- أجهزة الطرد المركزي في 100 x ز 30 s لبيليه المنشورات، وتجاهل المادة طافية بعناية. تغسل مرتين مع 500 ميليلتر يغسل العازلة وإعادة بيليه الخلايا باستخدام الطرد المركزي في ز 100 x لمدة 30 ثانية.
- حصاد VICs من المنشورات، هضم مع 100 ميليلتر من 425 يو/مليلتر كولاجيناز الثاني ح 2، ومن ثم حرر VICs طريق بيبيتينج بلطف إلى أعلى وأسفل باستخدام تلميح ماصة 200 ميليلتر.
- تمييع كولاجيناز الثاني في 19 مل الثقافة المتوسطة وأجهزة الطرد المركزي في 670 x ز لمدة 5 دقائق بيليه VICs والحطام النشرة صمام المتبقية. تجاهل المادة طافية، ونقل منشورات و VICs للثقافة لوحات/قوارير تبعاً لذلك (الجدول 1).
- الثقافة VICs لمدة 5-7 أيام في الثقافة المتوسطة، حتى يتم التوصل إلى كونفلوينسي في 37 درجة مئوية، وحضور 5% (ثاني أكسيد الكربون) CO2، تغيير في المتوسط بعد 72 ساعة. للاستخدام اللاحق في تجارب في المختبر ، مرور تصل إلى 5 مرات بمجرد كونفلوينسي يصل إلى 100%.
4-تنظيم دورات تعريفية تكلس VICs الفئران
ملاحظة: لجميع التجارب، عد الخلايا التي تحتوي هيموسيتوميتير.
- أداء كل خلية الابتدائية البذر وباساجينج في أغطية معقمة لمنع التلوث. لإعداد الفئران الأولية VICs للتجارب في المختبر تكلس، بذور الخلايا في كثافة قدرها 000 150 خلايا/بئر في لوحات 6-جيدا. الحفاظ على المديين المتوسط والثقافة حتى ≥ 90% كونفلوينسي (عادة ح 72).
- علاج VICs مع تكلس مقابل التحكم المتوسطة واحتضان في 37 درجة مئوية، وحضور 5% CO2، ح 72 إضافية.
- دراسة الفئران الابتدائي متكلسة VICs لتحليلات المصب اللاحقة وإزالة المتوسطة تكلس/مراقبة واغسل مونولاييرس مع المخزن المؤقت للغسيل لإزالة أيونات Ca وبي غير منضم.
5-فأر توصيف مركز فيينا الدولي
- إيمونوستينينج لرصد للعلامات المظهرية مثل البذور فيمنتين و α-SMA، VICs الفئران في كثافة قدرها 000 150 خلايا/بئر في البئر 6-لوحات تتضمن كشوف الغطاء (الخلايا سوف تنمو على سطح كشوف الغطاء)، وإجازة تنمو حتى كونفلوينسي 50%.
- نضح المتوسطة الثقافة وإصلاح مونولاييرس الخلية مع بارافورمالدهيد 4% (PFA) لمدة 10 دقائق قبل غسلها 3 مرات مع الفوسفات مخزنة المالحة (PBS)، لمدة 5 دقائق في كل مرة.
تنبيه: منهاج عمل بيجين سامة ويجب أن تعالج بعناية. - احتضان المونولاير الخلية مع المخزن المؤقت لعرقلة وبيرميبيليزيشن (برنامج تلفزيوني 1 x، 5% مصل العادي من نفس النوع كجسم الثانوية، 0.3% Triton X-100) ح 1 في درجة حرارة الغرفة.
- احتضان مونولاييرس الخلية مع الماوس فيمنتين المضادة وارنب المضادة-α-SMA الأجسام المضادة المخفف في المخزن المؤقت لتمييع جسم (ألبومين المصل البقري 1% + 0.3% X-100 تريتون في برنامج تلفزيوني) بين عشية وضحاها في 4 درجة مئوية، برفق الهز على الروك.
ملاحظة: عناصر سلبية تمثلت الماوس غير مترافق مفتش وارنب مفتش، استخدام تخفيف نفسه كعينات الاختبار. - في اليوم التالي، يغسل الأجسام المضادة الأولية 3 مرات مع برنامج تلفزيوني، لمدة 5 دقائق في كل مرة.
- احتضان مونولاييرس الخلية مع الأجسام المضادة الثانوية مترافق fluorophore ح 1 في درجة حرارة الغرفة، تهتز برفق في الروك.
- أغسل 3 مرات مع برنامج تلفزيوني، ولطف تويز خارج كوفيرسليبس (التي تحتوي على الفئران VICs) مع زوج من الملقط ومكان على ساترة التي تحتوي على 4 ', 6-دياميدينو-2-فينيليندولي (DAPI). اترك الشرائح لعلاج لمالا يقل عن 24 ساعة عند 4 درجة مئوية قبل تصور مع مجهر الأسفار.
- لتحليل لطخة غربية، والبذور الفئران خلايا/بئر في البئر 6-لوحات VICs في كثافة قدرها 000 150، وترك لينمو في المتوسط الثقافة حتى 100% المتلاقية.
- استخدم 8 ميكروغرام من البروتين لتشغيل غربية وصمة عار لقياس التعبير عن CD31 ويستبعد أي تلوث مركزنا.
ملاحظة: بروتوكول قياسي لطخة غربية وأعقب كما هو موضح سابقا9. - لدراسات الجينات، واستخراج حمض النووي الريبي (الرنا) باستخدام مجموعة أدوات تجارية اتباع إرشادات الشركة المصنعة.
- الحصول على كدنا استخدام النسخ العكسي لقياس التعبير الجينات المستهدفة باستخدام تفاعل البوليميراز المتسلسل (PCR)، وفي الوقت الحقيقي بكر (RT-PCR؛ ويعرف أيضا باسم قبكر) مع الكشف عن فلوروفوري الأخضر، استخدام جابده كالجين الإشارة، كما سبق ووصف10.
- استخدم البرنامج التالي لتحليل PCR: دورة 1 94 درجة مئوية لمدة 3 دقائق، دورات 30 من 94 درجة مئوية لمدة 30 ق، 63 درجة مئوية لمدة 30 ق، 72 درجة مئوية مقابل 35 s، وأخيراً 1 دورة 72 درجة مئوية لمدة 5 دقائق.
- استخدم البرنامج التالي لتحليل قبكر: دورة 1 من 95 درجة مئوية لمدة 10 دقائق، دورات 40 من 95 درجة مئوية عن 15 ثانية، 60 درجة مئوية 1 دقيقة ودورة إضافية من 95 درجة مئوية لمدة 1 دقيقة، 55 درجة مئوية عن 30 ثانية، و 95 درجة مئوية لمدة 30 ثانية.
- تشغيل التفريد جل لتحليل منتجات PCR باستخدام 2% [اغروس] هلام في المخزن المؤقت تريس/بورات/يدتا (TBE).
6-فأر فيك تكلس الدراسات
- الدراسات البيوكيميائية تكلس والاليزارين الأحمر S، الرجاء اتباع البذر وتكلس المبادئ التوجيهية المبينة في المادة 4.
- وصمة عار مونولاييرس الخلية مع الحل 5% S الأليزارين الأحمر، تعصف بلطف على شاكر، لمدة 20 دقيقة. بعد ذلك يغسل 3 مرات بماء مقطر، لمدة 5 دقائق في كل مرة. الحصول على صور لكل بئر.
- للتحديد الكمي لترسيب Ca، استخدام أدوات تحليل Ca بيوكيميائية. ليتش Ca2 + أيونات استخدام 0.6 M حمض الهيدروكلوريك (HCl) عن 24 ساعة عند 4 درجة مئوية، مع التحريض لطيف.
- حصاد المادة طافية وقياس تركيز Ca باستخدام مقايسة Ca كيت (انظر الجدول للمواد) اتباع إرشادات الشركة المصنعة.
- حساب تركيز الكالسيوم كجزء من مجموع البروتين الخلوي. تؤذي البروتينات الخلوية من مونولاييرس الخلية مع هيدروكسيد الصوديوم 0.1 M (هيدروكسيد الصوديوم) + 0.1% الصوديوم دوديسيل كبريتات (الحزب الديمقراطي الصربي). تحديد تركيز البروتين الكلي باستخدام مقايسة بروتين (DC) منظفات متوافق مع اتباع إرشادات الشركة المصنعة.
النتائج
وكان الهدف من هذا البروتوكول لوصف عزلة الفئران الابتدائي VICs والثقافة منهم لإجراء تجارب في المختبر تكلس. باستخدام الطريقة الموصوفة أعلاه، يمكن بنجاح معزولة الفئران VICs وتوسيعها لدراسة الآليات المسؤولة عن كافد.
فأر تعريب VICs الابتدائي المشترك مع علامات فيك المنشأة:
أكد النمط الظاهري فيك الخلايا المعزولة من خلال الفلورة التدقيق في علامات فيك: فيمنتين و α-SMA (أحمر، وأخضر، على التوالي، الشكل 1A)، وهو ما يتفق مع التقارير السابقة11،12. عناصر سلبية الممثل باستخدام الماوس غير مترافق وارنب مفتش مبينة في الشكل 1 باء. بالإضافة إلى ذلك، تم تأكيد التعبير عن مركز فيينا الدولي-نمو منظم TGFβ-1 و TGFβ-2 استخدام تحليل PCR (الشكل 1). من أجل تأكيد أن الفئران المعزولة VICs الأولية كانت خالية من التلوث بطانية، أجرى تحليل لطخة غربية للتحقق من أن الفئران كانت VICs السلبية لعلامة الخلية البطانية، CD31، استخدام الكلاب تقدم التاجي كعنصر إيجابي ( الشكل 1).
كاليفورنيا وبي حمل تكلس فيك الفئران:
عادة محرك تركيزات مرتفعة من Ca و/أو Pi الجهازية تكلس VICs في المختبر. لتقدير إمكانات تكلس الفئران المعزولة VICs، تعرض الخلايا لمستويات مرتفعة من Ca و Pi، التي تحاكي ظروف hypercalcemia وهايبرفوسفاتيميا المرضية في المرضى المسببات. علاج VICs مع 2.7 مم Ca/2.5 Pi الناجم عن تكلس، كما يحددها الأليزارين الأحمر S تلطيخ لترسيب Ca (الشكل 2A) وتحديد مستويات Ca عقب HCl النض (81 حظيرة؛ قياس الألوان ف < 0.05 استخدام الطالب t-اختبار؛ الشكل 2).
التغيرات تعبير الجينات المرتبطة تكلس مركز فيينا الدولي:
تكلس في خلايا الأوعية الدموية في المختبر المقترن مع ملف تعريف جزيئية متميزة. في هذه الدراسة، معاملة VICs مع 2.7 مم Ca/2.5 Pi الناجم عن زيادة كبيرة في التعبير مرناً من علامات أوستيوجينيك: مش هوميوبوكس 2، Msx2 (تجليد 2.04 التغيير؛ ف < 0.01؛ الشكل 3 ألف)، الفوسفاتيز القلوية، البل (1.49 إضعاف التغيير؛ ف < 0.001؛ الشكل 3)، وفوسفوثانولاميني/phosphocholine الفوسفاتيز، Phospho1 (4.7 إضعاف التغيير؛ ف < 0.01 استخدام ANOVA في اتجاه واحد؛ الشكل 3). بيد أن التعبير عن علامة أوستيوجينيك، Runx2، وتكلس مثبط اكتونوكليوتيدي بيروفاسفاتاسي، Enpp1، ظلت دون تغيير (3D الرقم–ه).
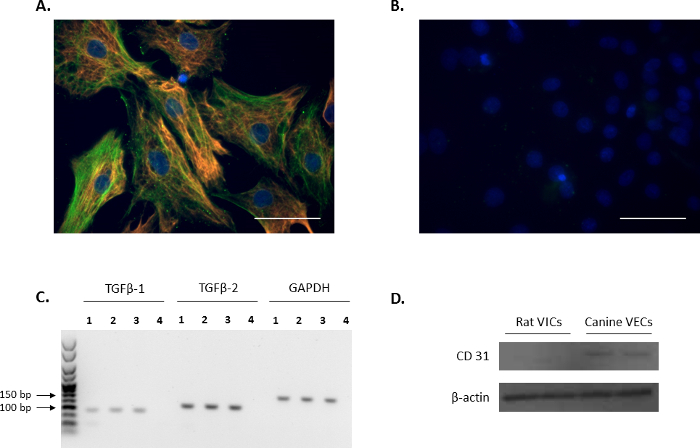
رقم 1. التعبير عن علامات فيك. (أ) الفلورة لائحة تلطيخ مزدوجة وكولوكاليزيشن من أكتين العضلات الملساء ألفا (α-SMA؛ الأخضر) وفيمنتين في صمام الخلايا الخلالي (VICs). (ب) صورة تمثيلية من عناصر سلبية باستخدام الماوس والارنب مفتش. أنوية ملطخة باللون الأزرق باستخدام 4 ', 6-دياميدينو-2-فينيليندولي (DAPI). شريط المقياس = 50 ميكرومتر. (ج) وجود تحويل عامل النمو بيتا 1 (TGFβ-1) و TGFβ 2 في VICs (الممرات 1-3) كما هو موضح بتحليل PCR. 4 لين هو التحكم بالمياه. وكان مرجع الجينات المستخدمة جابده. (د) تحليل لطخة غربية عرض التعبير وفيرة من CD31 في خلايا بطانية الكلاب الصمام التاجي (تقدم) بالمقارنة بأي تعبير في VICs. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
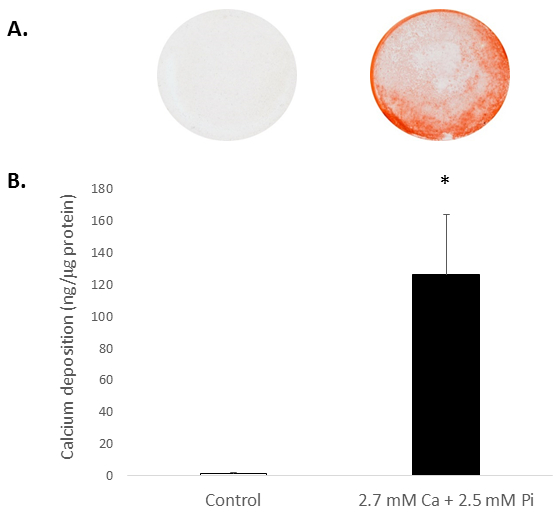
الرقم 2. تكلس في المختبر من الفئران VICs. ترسيب Ca في VICs تعامل مع 2.7 مم Ca/2.5 Pi حسبما يقرره: (ألف) صورة فوتوغرافية تبين صبغة الأليزارين الأحمر S من خلية كاملة مونولاييرس في البئر، وتحديد مستويات كاليفورنيا بعد النض HCl اللونية (ب). الطالب t-وأجرى اختبار لتحليل أهمية بين المجموعات اثنين من البيانات. وترد نتائج يعني ± S.E.M. *p < 0.5 بالمقارنة مع التحكم؛ (n = 4).
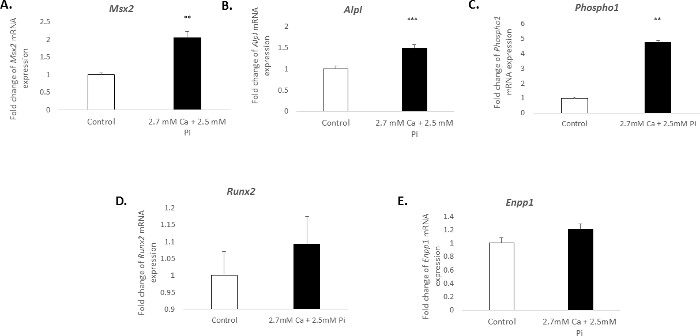
الشكل 3. التغييرات تعبير الجينات المرتبطة تكلس فيك. حظيرة تغيير في التعبير مرناً من علامات أوستيوجينيك (A) Msx2، (ج) Phospho1(د) Runx2، (ب) البلو (E) Enpp1 في VICs تعامل مع 2.7 مم Pi Ca/2.5 مم حاء – 48 مرناً التعبير يظهر كتغيير إضعاف مقارنة بالجينات المرجعية الذاتية جادف- وأجرى ANOVA أحادي الاتجاه باستخدام النموذج الخطي العام تتضمن مقارنات لبير لتحليل الأهمية بين مجموعات متعددة. وترد نتائج يعني ± S.E.M. * *ف < 0.01؛ ف < 0.001 مقارنة للرقابة؛ (n = 6). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| عدد من منشورات صمام | الثقافة لوحة/قارورة |
| 9 إلى 15 | 1 جيدا في لوحة 12-جيدا |
| 15 إلى 30 | 1 جيدا في لوحة 6-جيدا |
| 30 + | T25 |
الجدول 1- مبادئ توجيهية عامة لعدد المنشورات اللازمة للبذر الأولية.
Discussion
هذا البروتوكول مفصلة توضح طريقة عملية للحصول على الفئران الابتدائي VICs، تمكين عزل هذه الخلايا من صمامات القلب الجرذان عن طريق الهضم الأنزيمي. كذلك لدينا أسلوب يدعم ويمتد استخدام فأر ذكر سابقا في المختبر النموذجي لدراسة تكلس الصمام الابهري13. ويدخل عزلة VICs من الصمام الابهري احتمال التلوث الناجم عن تقدم المجاورة. بيد أن البيانات الفلورة لدينا تأكيد أن الخطوة الأولى الهضم كافية لإزالة تقدم، مما يجعل الخلايا المعزولة سلبية بالنسبة لعلامة الخلية البطانية، CD31. وعلاوة على ذلك، تلطيخ α-SMA يؤكد النمط الظاهري المنشط من VICs، مما مطلوب تكلس12.
وأبلغ فيك العزلة المفروضة سابقا في النماذج الحيوانية الكبيرة6،،من78. ومع ذلك، هذه الأنواع مقيدة بالأدوات الجينية والجزيئية المحدودة المتاحة لدراسة المصب، فضلا عن إمكانية الوصول المقيد في المختبرات حول العالم. وفي المقابل، هذه الأدوات راسخة في القوارض متاحة بسهولة، ومن ثم القدرة على عزل المستمدة من الفئران تمكن VICs قدرة تصميم تجريبي أكبر. كما يعني استخدام VICs من الفئران الصغار أن الخلايا نسبيا التكاثري أكثر من الفئران الأكبر سنا، ولذلك تتطلب أقل الحيوانات لإنتاج المزيد من الخلايا. على الرغم من أن الفئران بسهولة، ولكن بسبب الفئران بعد لا سيما أصغر القلوب، العزل من الماوس الأساسي سيكون VICs أكثر استهلاكاً للوقت وسيكون أكبر بكثير من الحيوانات المطلوبة لعزل محصول نفس الخلايا كنموذج الفئران.
ميزة كبيرة لهذا النهج المبين أن VICs يمكن أن تكون معزولة وقتيا من نوع البرية والفئران المحورة وراثيا، فضلا عن نماذج الفئران من إصابة المرض وصمام القلب والأوعية الدموية. باستخدام نموذج الفئران سيتطلب عدد أكبر من الحيوانات لإجراء التجارب على نطاق واسع، وبالتالي الحد من استخدام الحيوانات، يمكن أن تتحول الفئران الأولية VICs لإنتاج خط خلية مرة واحدة فقد اتسم أيضا.
بينما السريرية الشديدة المترتبة على كافد معروفة على نطاق واسع، والآليات السببية الكامنة لم يتحدد. وباﻹضافة إلى ذلك، دواء فعال العلاجات التي قد منع وعلاج تكلس الصمام الابهري يحتمل أن تكون غير متوفرة في الوقت الحاضر. ولذلك توفر ثقافة VICs تحت ظروف التكلس نموذج وثيقة صلة في المختبر من كافد. ونحن تبين أن مستويات مرتفعة من كاليفورنيا وبي حمل تكلس في المختبر من الفئران المعزولة VICs مع زيادة مصاحبة في التعبير عن علامات الجينات osteogenic Msx2و البل Phospho1. ثبت على نطاق واسع أن هذه العلامات المرتبطة بعملية تكلس الأوعية الدموية14،،من1516المرضية. ولذلك تظهر البيانات لدينا أن ثقافة الفئران VICs في التكلس المتوسطة نموذجا مناسباً لدراسة تكلس الصمام الابهري في المختبر. في الواقع، استخدمت الدراسات التي أجريت مؤخرا من مختبرنا هذا النموذج لإثبات أن يعزز Ca تكلس الصمام الابهري عن طريق إثراء السادس Annexin المستمدة من مركز فيينا الدولي مصفوفة حويصلات17.
على الرغم من فوائد استخدام الفئران VICs وتكييفها تتسم بالكفاءة، لا تزال هناك بعض القيود. أولاً، حجم السكان فيك داخل الصمامات الفئران الصغيرة جداً، ولذلك هناك حاجة إلى العديد من الحيوانات من أجل توليد أرقام الخلية كافية لدراسات مستفيضة في المختبر . ومع ذلك، من الممكن للتغلب على هذا القيد بإجراء دراسات أولية في خطوط الخلايا الخلالي صمام مخلدة، كما ذكرت مؤخرا من قبلنا18، وبعد ذلك توظيف الثقافات الأولية للتحقق من وتمتد هذه النتائج.
وباختصار، يشرح الأسلوب وصف عزلة الناجحة، والثقافة، وتكلس من الفئران الابتدائي VICs، التي يمكن بعد ذلك تقييم باستخدام مجموعة متنوعة من التحليلات بما في ذلك فحوصات الكيمياء الحيوية، فضلا عن البروتين وتحاليل الحمض النووي الريبي. هذا الطراز يوفر نظام موثوق ومريحة للتحقيق كافد في المختبر، ويوفر أداة قيمة للتحقيق في الآليات الجزيئية المسؤولة عن هذا المرض المدمر.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وكان CD31 الأجسام المضادة المستخدمة هدية سخية من الدكتور كارين تان، جامعة أدنبرة. هذه الدراسة كانت مدعومة بتمويل من التكنولوجيا الأحيائية والبيولوجية العلوم بحوث المجلس (BBSRC) في شكل "منحة البرنامج الاستراتيجي المعهد" (BB/J004316/1؛ BBS/E/D/20221657) (VEM) و (CF المعهد المهني مسار الزمالة BB/F023928/1 (VEM)، ومنحة التمويل عبر القضية BBSRC سنهم BB/K011618/1 (LC).
Materials
| Name | Company | Catalog Number | Comments |
| Dissection scissors | World Precision Instruments | 14393 | Autoclave before use. |
| Spring straight (8 mm blade) | World Precision Instruments | 15905 | Autoclave before use. |
| SuperFine Vannas scissors (5 mm blade, 8 cm) | World Precision Instruments | 14003 | Autoclave before use. |
| Dumont #5 tweezers (11 cm) | World Precision Instruments | 500342 | Autoclave before use. |
| DMEM-F12 | Thermo Fisher Scientific | 11320074 | |
| Foetal bovine serum | Thermo Fisher Scientific | 10500064 | Filter before adding to culture medium. |
| Gentamicin | Thermo Fisher Scientific | 15710049 | |
| Absolute ethanol | Thermo Fisher Scientific | E/0650DF/17 | Dilute to 70% v/v in distilled water. |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | H1150PB17 | Dilute to 0.6M with distilled water. |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | UN1823 | Dilute to 0.1M with distilled water. |
| DAPI | Thermo Fisher Scientific | P36931 | |
| Alexa Fluor 594 goat anti-mouse antibody | Thermo Fisher Scientific | A11005 | 1/250 dilution in antibody dilution buffer. |
| Alexa Fluor 488 donkey anti-rabbit antibody | Thermo Fisher Scientific | A21206 | 1/250 dilution in antibody dilution buffer. |
| Superscript II kit | Thermo Fisher Scientific | 18064014 | |
| dNTP | Thermo Fisher Scientific | 18427013 | |
| Random primers | Thermo Fisher Scientific | P/N58875 | |
| Taq Polymerase kit | Thermo Fisher Scientific | 18038026 | |
| Tris/Borate/EDTA (TBE) | Thermo Fisher Scientific | AM9863 | Dilute to 1x with distlled water, before use. |
| Agarose | Thermo Fisher Scientific | 16500 | 2% in 1x Tris/Borate/EDTA(TBE). |
| Lysis buffer (RIPA) | Thermo Fisher Scientific | 89900 | |
| T75 flask | Thermo Fisher Scientific | 156472 | |
| T175 flask | Thermo Fisher Scientific | 159920 | |
| qPCR plates | Thermo Fisher Scientific | AB0990 | |
| Rat Msx2 primer | Qiagen | QT01084090 | |
| Rat Alpl primer | Qiagen | QT00190680 | |
| Rat Enpp1 primer | Qiagen | QT00181426 | |
| RNeasy minikit | Qiagen | 74104 | |
| 6-well plates | Sigma | CLS3516 | |
| T25 flask | Sigma | CLS430639 | |
| Monobasic phosphate | Sigma | S5011 | |
| Dibasic phosphate | Sigma | S5136 | |
| Calcium chloride | Sigma | C1016 | |
| Sodium dodecyl sulphate (SDS) | Sigma | 5030 | Dilute to 0.1% with 0.1M NaOH. |
| Paraformaldehyde | Sigma | P6148 | Dilute to 4% with PBS. |
| Triton X100 | Sigma | X100 | |
| Bovine serum albumin (BSA) | Sigma | A3059 | |
| Alizarin red S | Sigma | A5533 | Make up to 2% with distilled water, and adjust to pH 4.2. |
| TGFβ-1 primer pair: f: GCTACCATGCCAACTTCTGT r: TGTGTTGGTTGTAGAGGGCA | Sigma | Concentration used: 10 μM | |
| TGFβ-2 primer pair: f: GAAGGCAGAGTTCAGGGTCT r: CGCTGGGTTGGAGATGTTAG | Sigma | Concentration used: 10 μM | |
| Monoclonal Anti-β-Actin−Peroxidase antibody produced in mouse | Sigma | A3854 | 1/50000 dilution in 5% BSA in tris-buffered saline + 0.1% Tween (TBS/T). |
| Mouse anti-vimentin antibody | Sigma | v6389 | 1/900 dilution in antibody dilution buffer (1x phosphate buffered saline (PBS), 1% bovine serum albumin (BSA), 0.3% Triton X-100). |
| Mouse IgG | Sigma | I5381 | Diluted to the same stock concentration as mouse anti-vimentin antibody prior to dilution in antibody dilution buffer. |
| Rabbit IgG | GeneTex | GTX35035 | Diluted to the same stock concentration as rabbit anti-α-smooth muscle actin antibody prior to dilution in antibody dilution buffer. |
| Rabbit anti-α-smooth muscle actin antibody | Abcam | ab5694 | 1/200 dilution in antibody dilution buffer. |
| Rabbit anti-CD31 | Abcam | ab28364 | 1/50 dilution in 5% BSA inTBS/T. |
| HRP-conjugated goat anti-rabbit antibody | Dako | P0448 | 1/3000 dilution in in 5% BSA in TBS/T. |
| Collagenase II | Worthington | 41512862 | Adjust to 425 U/mL with distilled water, and then filter. |
| SYBR green mastermix | Primerdesign | PrecisionPLUS-MX-SY | |
| Calcium assay kit | Randox | CA590 | |
| DC protein assay kit | Bio-Rad | 5000111 | |
| ECL reagent | GE Healthcare | RPN2109 | |
| Hyperfilm ECL | GE Healthcare | 28906837 | |
| Nitrocellulose membrane | GE Healthcare | 10600007 | |
| PCR ladder | Bioline | BIO-33057 | |
| Loading dye for gel electrophoresis | New England Biolabs | B7025S | |
| Syringe filters (0.22 μm) | Merck Millipore | SLGP033RS | |
| Coverslips | Scientific Laboratory Supplies LTD | MIC3100 | |
| Hematocytometer | Marienfeld Superior | 640030 | |
| Name | Company | Catalog Number | Comments |
| Camera set up for Alizarin red images: | |||
| Camera | Nikon D800 | ||
| Lens | Nikon AF_s Micro, Nikko 105 mm, 1:2.8 GED | ||
| Dissection forceps 10 cm, curved ends | World Precision Instruments | 15915 | Autoclave before use. |
References
- Dweck, M. R., Boon, N. a, Newby, D. E. Calcific aortic stenosis: a disease of the valve and the myocardium. J Am Coll Cardiol. 60 (19), 1854-1863 (2012).
- Freeman, R. V., Otto, C. M. Spectrum of calcific aortic valve disease: Pathogenesis, disease progression, and treatment strategies. Circulation. 111, 3316-3326 (2005).
- Mohler, E. R., Gannon, F., Reynolds, C., Zimmerman, R., Keane, M. G., Kaplan, F. S. Bone formation and inflammation in cardiac valves. Circulation. 103 (11), 1522-1528 (2001).
- Monzack, E. L., Masters, K. S. Can valvular interstitial cells become true osteoblasts? A side-by-side comparison. J Heart Valve Dis. 20 (4), 449-463 (2011).
- Osman, L., Yacoub, M. H., Latif, N., Amrani, M., Chester, A. H. Role of human valve interstitial cells in valve calcification and their response to atorvastatin. Circulation. 114 (Suppl 1), (2006).
- Gu, X., Masters, K. S. Role of the Rho pathway in regulating valvular interstitial cell phenotype and nodule formation. Am J Physiol Heart Circ Physiol. 300 (2), H448-H458 (2011).
- Rodriguez, K. J., Masters, K. S. Regulation of valvular interstitial cell calcification by components of the extracellular matrix. J Biomed Mater Res A. 90 (4), 1043-1053 (2009).
- Rattazzi, M., Iop, L., et al. Clones of interstitial cells from bovine aortic valve exhibit different calcifying potential when exposed to endotoxin and phosphate. Arterioscler Thromb Vasc Biol. 28 (12), 2165-2172 (2008).
- Zhu, D., Hadoke, P. W. F., et al. Ablation of the androgen receptor from vascular smooth muscle cells demonstrates a role for testosterone in vascular calcification. Sci Rep. 6 (April), 24807(2016).
- Zhu, D., Mackenzie, N. C. W., Millan, J. L., Farquharson, C., Macrae, V. E. Upregulation of IGF2 expression during vascular calcification. J Mol Endocrinol. 52 (2), 77-85 (2014).
- Latif, N., Quillon, A., et al. Modulation of human valve interstitial cell phenotype and function using a fibroblast growth factor 2 formulation. PLoS ONE. 10 (6), (2015).
- Liu, A. C., Joag, V. R., Gotlieb, A. I. The emerging role of valve interstitial cell phenotypes in regulating heart valve pathobiology. Am J Pathol. 171 (5), 1407-1418 (2007).
- Katwa, L. C., Ratajska, A., et al. Angiotensin converting enzyme and kininase-II-like activities in cultured valvular interstitial cells of the rat heart. Cardiovasc Res. 29 (1), 57-64 (1995).
- Shao, J. S., Cheng, S. L., Pingsterhaus, J. M., Charlton-Kachigian, N., Loewy, A. P., Towler, D. A. Msx2 promotes cardiovascular calcification by activating paracrine Wnt signals. J Clin Invest. 115, 1210-1220 (2005).
- Mackenzie, N. C. W., Zhu, D., Longley, L., Patterson, C. S., Kommareddy, S., MacRae, V. E. MOVAS-1 cell line: a new in vitro model of vascular calcification. Int J Mol Med. 27, 663-668 (2011).
- Kiffer-Moreira, T., Yadav, M. C., et al. Pharmacological inhibition of PHOSPHO1 suppresses vascular smooth muscle cell calcification. J Bone Miner Res. 28, 81-91 (2013).
- Cui, L., Rashdan, N. A., et al. End stage renal disease-induced hypercalcemia may promote aortic valve calcification via Annexin VI enrichment of valve interstitial cell derived-matrix vesicles. J Cell Physio. , (2017).
- Tsang, H., et al. Exploiting novel valve interstitial cell lines to study calcific aortic valve disease. Mol Med Rep. , In press (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved