Method Article
Isolierung und Charakterisierung von primären Ratte Ventil interstitielle Zellen: ein neues Modell zur Verkalkung der Aortenklappe
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Isolierung, die Kultur und die Verkalkung der Ratte abgeleitet Ventil interstitiellen Zellen, ein höchst physiologischen in Vitro Modell der Schulterarthrose Aortenklappe Krankheit (CAVD). Ausbeutung von diesem Rattenmodell erleichtert die CAVD Forschung in der Erforschung der Zelle und der molekularen Mechanismen, die diese komplexen Krankheitsgeschehen zugrunde liegen.
Zusammenfassung
Schulterarthrose Aortenklappe Krankheit (CAVD) zeichnet sich durch die fortschreitende Verdickung der Aortenklappe Flugblätter. Es ist eine Bedingung, die häufig bei den älteren und terminaler Niereninsuffizienz (ESRD) Patienten, leiden häufig unter Hyperphosphatämie und Hyperkalzämie gefunden. Derzeit gibt es keine Medikamente-Therapien, die ihr Fortschreiten aufhalten kann. Die Mechanismen, die diesen pathologischen Prozess zugrunde liegen bleiben unklar. Die Aortenklappe Broschüre besteht aus eine dünne Schicht aus Endothelzellen Ventil (VECs) an den Außenflächen der aortalen Höckern, mit Ventil interstitiellen Zellen (VICs) eingeklemmt zwischen den VECs. Die Verwendung von einem Rattenmodell ermöglicht die in-vitro- Studie ektopische Verkalkungen auf Basis der in Vivo pathophysiologischen Serum-Phosphat (Pi) und Kalzium (Ca) der Patienten, die leiden Hyperphosphatämie und Hyperkalzämie. Das beschriebene Protokoll beschreibt die Isolation einer reinen Ratte VIC Bevölkerung dargestellt durch die Expression von VIC Marker: Alpha-Glattmuskel Aktin (α-SMA) Vimentin und Gewebe Wachstumsfaktor Beta (TGFβ) 1 und 2 und das Fehlen des Clusters der Differenzierung (CD) 31, eine VEC Marker. Durch den Ausbau dieser VICs, können biochemische, genetische und bildgebende Untersuchungen durchgeführt werden, um zu studieren und die wichtigsten Vermittler zugrunde liegenden CAVD zu entwirren.
Einleitung
Die gesunde Aortenklappe besteht aus drei Broschüren, die die Verteilung der mechanischen Beanspruchung beim Öffnen und Schließen des Ventils gleichmäßig aufgeteilt wird. Die Ventil-Broschüre hat eine definierte Struktur aus drei unterschiedlichen Schichten: die Fibrosa, Spongiosa und Ventricularis, welches Haus Ventil interstitielle Zellen (VICs) als die vorherrschenden Zelltyp. Diese drei Schichten sind eingeklemmt zwischen zwei Betten von Valve Endothelzellen (VECs)1.
VICs spielen eine entscheidende Rolle bei der Progression von Schulterarthrose Aortic Valve Verkalkung (CAVD), in der westlichen Welt die häufigste Herzklappenerkrankung. CAVD bezeichnet man als eine fortschreitende Erkrankung, die durch das Herzklappenfehler Gewebe und seine umliegenden Mikroumgebung aktiv geregelt ist. Zellveränderungen verursachen zunächst fibrotische Verdickung und schließlich eine umfangreiche Verkalkung der Aortenklappe Flugblätter. Dies führt dann zu erheblichen Aortenklappe Stenose und letztlich left ventricular Abfluß Obstruktion2, chirurgische Klappenersatz als die einzig mögliche Behandlung verlassen.
Die Pathophysiologie der CAVD ist komplex, aber ähnliche Mechanismen zur physiologischen Knochen Mineralisierung3teilt. Während eine Reihe von Studien die von VICs osteogene Trans-Differenzierung und Verkalkung4,5unterziehen bewiesen haben, die Mechanismen für diesen Prozess müssen erst noch vollständig aufgeklärt werden, Hervorhebung der entscheidende Voraussetzung für ein machbar und relevanten in-vitro- Modell der CAVD.
Frühere Arbeiten von verschiedenen Labors hat erfolgreich VICs von Schweinen und Rindern Modelle isoliert und kultiviert diese Zellen unter Bedingungen6,7,8Kalkseife. Aufgrund der Größe der Aortenklappe in diesen Modellen wurde Isolation von Zellen durch enzymatische Verdauung hochwirksame reine Bevölkerungen der Zellen zu generieren. Jedoch können diese Modelle aufgrund der begrenzten Verfügbarkeit von molekulare Werkzeuge für große Tierarten restriktiv sein. Im Gegensatz dazu bleiben die Nager-Modelle vorteilhaft aufgrund der relativ geringeren Kosten, Potenzial für Genmanipulation und die umfangreiche Palette von molekulare Werkzeuge, die zur Verfügung stehen. Jedoch ist die Isolierung von VICs von kleiner Tiermodelle nicht weit verbreitet eingesetzt ist eine wahrscheinliche Folge der Schwierigkeiten bei der Arbeit mit kleinen Gewebeproben.
Dieses ausführliche Protokoll meldet eine umfassende Methode für die direkte Lokalisierung der Ratte VICs. Durch sorgfältige Präparation des Ventils, gefolgt von einer Reihe von enzymatischen Verdauung können VICs isoliert und in einer Vielzahl von experimentellen Techniken, einschließlich der Zelle Kultur, Verkalkung und gen Ausdruck eingesetzt werden. Dieses hochaktuellen in Vitro Modell der CAVD wird zweifellos einen wesentlichen Beitrag zur Erhöhung der unser Wissen über diesen pathologischen Prozess machen.
Protokoll
Alle Tierversuche wurden das Roslin-Institut Tier Benutzer Ausschuss angenommene, und die Tiere waren im Einklang mit Home Office (UK) Leitlinien für die Pflege und Verwendung von Tieren gepflegt. Für das Protokoll beschrieben wurden 5 - Woche alte, männlichen Sprague-Dawley Ratten verwendet.
(1) Reagenz Rezepte
- Bereiten Sie das Kulturmedium mit Dulbeccos geändert Eagle Medium (DMEM) und nahrhafte Mischung f-12 (DMEM/F12). Fügen Sie 10 % sterilisiert Hitze-inaktivierten fetalen bovine Serum (FBS) und 1 % Gentamicin.
- Bereiten Sie die Verkalkung Medium mit Nährmedium und 2,7 mM Ca/2.5 mM Pi.
- Bereiten Sie 1 M-Kalzium-Chlorid (CaCl2) durch wiegen, 555 mg CaCl2 und in 5 mL destilliertem Wasser 5 mL 1 M CaCl2zu lösen. Filtern Sie die Lösung durch einen 0,22 µm Spritze Filter um die Lösung zu sterilisieren.
- Bereiten Sie 1 M Natriumphosphat durch Wiegen 710 mg wasserfreiem Diabas-Natriumphosphat (Na2HPO4) und 600 mg wasserfreiem monobasic Natriumphosphat (NaH2PO4) Auflösung jeweils separat in 5 mL destilliertem Wasser. Kombinieren Sie 3.870 µL Na2HPO4 und 1.130 µL NaH2PO4und Filter durch einen 0,22 µm Spritze Filter Lösung zu sterilisieren.
- Bereiten Sie den Puffer zu waschen mit Hank es ausgewogen Salz-Lösung (HBSS) und 1 % Gentamicin.
2. Vorbereitung der Dissektion Haube
- Führen Sie alle Sektionen in einem belüfteten Haube, vorher desinfiziert mit 70 % Ethanol zur Sterilität der Proben und Reagenzien zu gewährleisten.
- Sterilisieren Sie Dissektion Werkzeuge durch Autoklavieren, die ihnen folgten durch Eintauchen der Tipps der Werkzeuge in einem Becher mit 70 % Ethanol vor dem Gebrauch.
- Bereiten Sie Becher mit Waschpuffer vor, und genießen Sie die Dissektion Werkzeuge Waschpuffer vor Kontakt mit dem Tier oder Gewebe. Behalten Sie stets den Waschpuffer auf Eis.
3. Gewinnung von primären Ratte VICs
Hinweis: Für das Protokoll beschrieben, wurden 5 - Woche alte, männlichen Sprague-Dawley Ratten verwendet.
- Die Ratten zu Keulen (~ 100 g) durch zervikale Dislokation nach UK Home Office-Richtlinien.
- Um das Herz der jede Ratte zu sezieren, legen Sie das Tier auf eine Dissektion Glastafel Rückenlage und desinfizieren der Haut durch Besprühen mit 70 % Ethanol.
- Machen Sie einen Schnitt von 4 cm in der Mittellinie der Ratte mit Hilfe der Dissektion Schere zu entlarven die Bauchhöhle, und entfernen vorsichtig den Brustkorb und die Lungen, das Herz aussetzen.
- Entfernen Sie das Herz mit einem Paar von Sharp, Frühling gebogene Schere und seziert Herzen im Eis Kaltwäsche Puffer speichern, bis alle Brutto Sezierungen der Ratten abgeschlossen sind.
- Um Mikro-jedes Herz sezieren, Letzteres Transfer in eine Petrischale in Waschpuffer abgedeckt. Trimmen des Herzmuskels mit der Frühling gerade Schere (6 mm Klinge) mit einer kleinen Umgebung der Aorta ascendens und die Aortenwurzel gelassen werden.
- Mit den gleichen Frühling gerade Schere (6 mm Klinge), vorsichtig aufschneiden der Aorta ascendens in Richtung des linken Ventrikels und entlarven die Aortenklappe Flugblätter.
- Übertragung der eröffneten Aorta in eine frische, sterile Petrischale gefüllt mit HBSS. Sezieren Sie Flugblättern der Aortenklappe, gekennzeichnet durch ihre einzigartige 'U'-Form an der Basis der Aorta mit einer Vannas-Typ Kapsulotomie Mikro-Schere (3 mm Klinge).
- Speichern Sie alle Merkblätter in 1 mL Eis kalt Waschpuffer in einem 1,5 mL Microcentrifuge Schlauch bis alle Sezierungen abgeschlossen sind.
- Sobald alle Merkblätter geerntet worden sind, Zentrifugieren sie 100 X g für 1 min bei 4 ° C, die Waschpuffer zu entfernen.
- Nachfolgende Schritte in eine Zelle Kultur Kapuze Sterilisation sicherzustellen. Entfernen Sie die VECs verdauen Sie die Flugblätter in 100 µL 425 U/mL Kollagenase II für 5 min bei 37 ° C. Stören Sie die Verdauung, indem es sanft nach oben und unten mit einer Spitze 200 µL Pipette pipettieren.
- Zentrifuge bei 100 X g für 30 s, pellet-Flugblätter und entsorgen Sie den Überstand sorgfältig. Zweimal mit 500 µL Waschpuffer waschen und neu pellet der Zellen durch Zentrifugation bei 100 X g für 30 s.
- Um die VICs aus Flugblätter zu ernten, mit 100 µL 425 U/mL Kollagenase II für 2 h zu verdauen Sie, und lassen Sie die VICs durch sanft nach oben und unten mit einer Spitze 200 µL Pipette pipettieren.
- Verdünnen Sie die Kollagenase II in 19 mL Kulturmedium und Zentrifuge bei 670 X g für 5 min um die VICs und restlichen Ventil Broschüre Schutt pellet. Überstand verwerfen, und übertragen Sie Flugblätter und VICs auf Platten/Kulturflaschen entsprechend (Tabelle 1).
- Kultur der VICs für 5-7 Tage in Kulturmedium, bis Konfluenz bei 37 ° C in Anwesenheit von 5 % (Kohlendioxid) CO2, ändern des Mediums nach 72 h erreicht ist. Für eine spätere Verwendung in in-vitro- Experimenten Passage bis zu 5 Mal nach confluency 100 % erreicht.
(4) Induktion von Verkalkung der Ratte VICs
Hinweis: Für alle Experimente zählen Sie Zellen mit einem Hemocytometer.
- Führen Sie alle Primärzelle seeding und Passagierung in sterilisierten Hauben um Kontaminationen zu vermeiden. Um primäre Ratte VICs für in-vitro- Verkalkung Experimente vorzubereiten, Samen der Zellen bei einer Dichte von 150.000 Zellen/Brunnen in 6-Well Platten. Pflegen Sie im Kulturmedium bis ≥ 90 % Konfluenz (in der Regel 72 h).
- Behandeln Sie die VICs mit Verkalkung versus Steuermedium und Inkubation bei 37 ° C in Anwesenheit von 5 % CO2, für weitere 72 h.
- Um die verkalkten primären Ratte VICs für spätere nachgelagerte Analysen zu untersuchen, entfernen Sie die Verkalkung/Steuermedium zu und waschen Sie Monolagen mit Waschpuffer, nicht gebundenen Ca und Pi-Ionen zu entfernen.
(5) Ratte VIC Charakterisierung
- Immunostaining für phänotypische Markierungen zu überwachen, wie z. B. Vimentin und α-SMA, Samen die Ratte VICs bei einer Dichte von 150.000 Zellen/Brunnen in 6 Well-Platten, enthalten in Deckel rutscht (Zellen wachsen auf der Oberfläche der Abdeckung), und bis zu 50 % Konfluenz wachsen lassen.
- Aspirieren das Kulturmedium und fixieren der Zelle Monolagen mit 4 % Paraformaldehyd (PFA) für 10 min vor dem Waschen sie 3 Mal mit Phosphat gepufferte Kochsalzlösung (PBS), für 5 min jedes Mal.
Achtung: PFA ist giftig und muss sorgfältig behandelt werden. - Inkubieren Sie die Zelle Monolage mit Blockierung und Permeabilisierung Puffer (1 X PBS, 5 % des normalen Serum aus der gleichen Art wie der Sekundärantikörper, 0,3 % Triton x-100) für 1 h bei Raumtemperatur.
- Inkubieren Sie die Zelle Monolagen mit Maus Anti-Vimentin und Kaninchen Anti-α-SMA-Antikörper Antikörper Verdünnungspuffer verdünnt (1 % Rinderserumalbumin + 0,3 % Triton x-100 mit PBS-Puffer) über Nacht bei 4 ° C, sanft schütteln auf einer Wippe.
Hinweis: Negative Kontrollen bestand aus nicht konjugiert Maus IgG und Kaninchen IgG, unter Verwendung der gleichen Verdünnungen als der Prüflinge. - Am nächsten Tag die primären Antikörper 3 Mal mit PBS für 5 min jedes Mal abwaschen.
- Inkubieren Sie die Zelle Monolagen mit Fluorophor-konjugierten Sekundärantikörper für 1 h bei Raumtemperatur, sanft schütteln auf einer Wippe.
- 3 Mal mit PBS waschen und vorsichtig tweeze, Deckgläsern (die Ratte VICs enthalten) mit ein paar Zangen und Platz auf einem Deckgläschen mit 4', 6-Diamidino-2-Phenylindole (DAPI). Lassen Sie die Folien für mindestens 24 Stunden bei 4 ° C zu heilen, bevor die Visualisierung mit einem Fluoreszenzmikroskop.
- Für Western-Blot Analyse Samen der Ratte, die Vics bei einer Dichte von 150.000 Zellen/Brunnen in 6 Well-Platten und in Kulturmedium bis 100 % konfluierende wachsen lassen.
- Verwenden Sie 8 µg Protein zum Ausführen ein Western-Blot zur Messung des Ausdrucks der CD31 und Verunreinigungen VEC ausschließen.
Hinweis: Ein standard-Western-Blot-Protokoll folgte bereits9beschrieben. - Gen Studien extrahieren Sie Ribonukleinsäure (RNA) mithilfe eines kommerziellen Kits nach den Richtlinien des Herstellers.
- Erhalten cDNA mit reversen Transkription um zu messen, Zielgene Ausdruck mit Hilfe der Polymerase-Kettenreaktion (PCR) und Real-Time PCR (RT-PCR; auch bekannt als qPCR) mit grünen Fluorophor-Erkennung, mit Gapdh als Referenz gen, als zuvor 10beschrieben.
- Verwenden Sie das folgende Programm für PCR-Analysen: 1 Zyklus von 94 ° C für 3 min 30 Zyklen von 94 ° C für 30 s, 63 ° C für 30 s, 72 ° C für 35 s und schließlich 1 Zyklus von 72 ° C für 5 Minuten.
- Verwenden Sie das folgende Programm für qPCR-Analyse: 1 Zyklus von 95 ° C für 10 min, 40 Zyklen von 95 ° C für 15 s, 60 ° C für 1 min und einen zusätzlichen Kreislauf von 95 ° C für 1 min, 55 ° C für 30 s und 95 ° C für 30 s.
- Führen Sie eine Gelelektrophorese PCR-Produkte mit einem 2 % Agarose-Gel in Tris/Borat/EDTA (TBE) Puffer zu analysieren.
(6) Ratte VIC Verkalkung Studien
- Alizarin Rot S und biochemische Verkalkung Studien folgen Sie bitte säen und Verkalkung Richtlinien in Abschnitt 4 beschrieben.
- Die Zelle Monolagen mit 5 % rote Alizarin S-Lösung auf einem Shaker, 20 min sanft schaukelnden Fleck. Anschließend waschen Sie 3 Mal mit destilliertem Wasser für 5 min jedes Mal. Bilder von jedem Bohrloch zu erwerben.
- Um Ca Ablagerung zu quantifizieren, verwenden Sie eine biochemische Ca Assay Kit. Lauge Ca2 + -Ionen mit 0,6 M Salzsäure (HCl) für 24 h bei 4 ° C, mit sanften Agitation.
- Ernte der Überstand und messen die Ca-Konzentration über einen Ca-Assay kit (siehe Tabelle der Materialien) nach den Richtlinien des Herstellers.
- Berechnen Sie die Calcium-Konzentration als Bruchteil der zellulären Gesamtprotein. Denaturieren Sie zelluläre Proteine aus der Zelle Monolagen mit 0,1 M Natronlauge (NaOH) + 0,1 % Sodium Dodecyl Sulfat (SDS). Bestimmen Sie die Gesamt-Protein-Konzentration mit einem Waschmittel kompatibel (DC) Protein Assay nach den Richtlinien des Herstellers.
Ergebnisse
Das Ziel dieses Protokolls war zu beschreiben, die Isolation der primären Ratte VICs und Kultur sie für in-vitro- Experimente der Verkalkung. Durch den Einsatz der oben beschriebenen Methode, Ratte VICs erfolgreich isoliert und für die Erforschung der Mechanismen verantwortlich für CAVD erweitert.
Ratte primäre VICs gemeinsam mit etablierten VIC Marker zu lokalisieren:
Der VIC-Phänotyp der isolierten Zellen wurde bestätigt durch Immunfluoreszenz durch Sondierung für den VIC-Marker: Vimentin und α-SMA (rot und grün, bzw. Abbildung 1A), und ist in Übereinstimmung mit früheren Berichte11,12. Die repräsentative Negativkontrollen mit nicht konjugiert Maus und Kaninchen IgG sind in Abbildung 1 bdargestellt. Darüber hinaus wurde der Ausdruck des VIC-Wachstumsregulator TGFβ-1 und TGFβ-2 bestätigt mittels PCR-Analyse (Abbildung 1). Um zu bestätigen, dass die isolierte Ratte primäre VICs waren frei von endothelialen Verunreinigungen, Western-Blot Analyse wurde durchgeführt, um zu überprüfen, diese Ratte waren VICs negativ für die Endothelzellen Marker, CD31, Eckzahn mitral VECs als Positivkontrolle ( mit Abbildung 1).
Ca und Pi induzieren Ratte VIC Verkalkung:
Erhöhte systemischen Ca und/oder Pi Konzentrationen fahren in der Regel die Verkalkung der VICs in Vitro. Um das Potenzial der Verkalkung der isolierten Ratte VICs zu schätzen, waren die Zellen ausgesetzt erhöhten Ca und Pi, die pathologische Bedingungen Hyperkalzämie und Hyperphosphatämie ESRD-Patienten zu imitieren. Behandlung von VICs mit 2,7 mM Ca/2.5 mM Pi induzierte Verkalkung, wie bestimmt durch Alizarin Rot S Färbung für Ca Ablagerung (Abbildung 2A) und farbmetrische Bestimmung der Ca nach HCl Auswaschung (81 Falte; p < 0,05 mit der Student t-Test; Abbildung 2 b).
Veränderungen der Genexpression VIC Verkalkung zugeordnet:
Die Verkalkung der vaskulären Zellen in Vitro ist eine deutliche molekulare Profil zugeordnet. In der vorliegenden Studie, die Behandlung von VICs mit 2,7 mM Ca/2.5 mM Pi induziert eine deutliche Zunahme der mRNA Ausdruck der knochenbildenden Marker: Msh Homeobox 2, Msx2 (2,04 Falte ändern; p < 0,01; ( Abbildung 3A), alkalische Phosphatase, Alpl (1,49 Falte ändern; p < 0,001; Abb. 3 b), und Phosphoethanolamine/Phosphocholin Phosphatase, Phospho1 (4.7 Falte ändern; mit One-Way ANOVA p < 0,01; Abbildung 3). Der Ausdruck der knochenbildenden Marker, Runx2und Verkalkung Inhibitor Ectonucleotide Pyrophasphatase, Enpp1, blieb jedoch unverändert (Abbildung 3D–E).
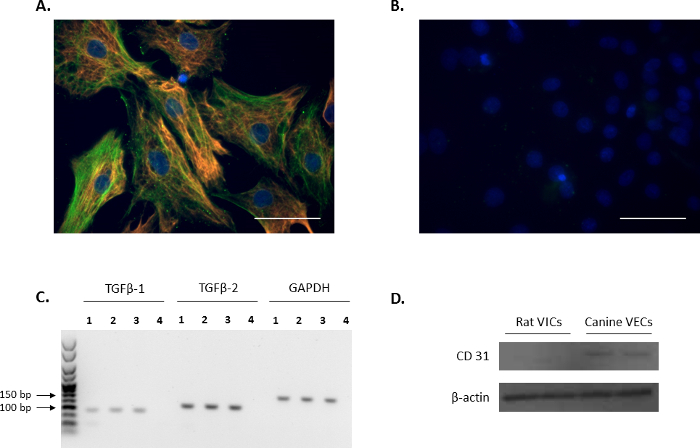
Abbildung 1: Ausdruck von VIC Markern. (A) Immunfluoreszenz zeigt doppelte Färbung und NS1 der Alpha-Glattmuskel Aktin (α-SMA; grün) und Vimentin im Ventil interstitiellen Zellen (VICs). (B) repräsentatives Bild der Negativkontrollen mit Maus und Kaninchen IgG. Kerne sind in blau mit 4', 6-Diamidino-2-Phenylindole (DAPI) gefärbt. Maßstabsleiste = 50 µm. (C) das Vorhandensein der Umwandlung Wachstumsfaktor Beta 1 (TGFβ-1) und TGFβ-2 in VICs (Bahnen 1 - 3) Dargestellt durch PCR-Analyse. Bahn 4 ist das Wasser-Steuerelement. Referenz-gen verwendet wurde Gapdh. (D) Western-Blot Analyse zeigt den reichlichen Ausdruck von CD31 in Eckzahn Mitralklappe Endothelzellen (VECs) im Vergleich zu keinen Ausdruck in VICs. Bitte klicken Sie hier für eine größere Version dieser Figur.
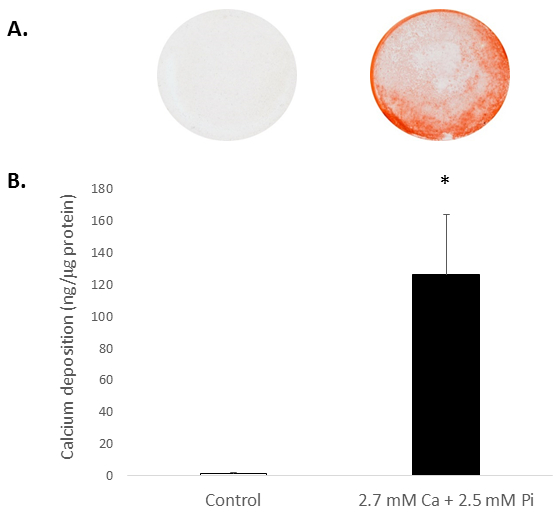
Abbildung 2. In-vitro- Verkalkung der Ratte VICs. Ca-Ablagerung in VICs behandelt mit 2,7 mM Ca/2.5 mM Pi bestimmt: (A) Foto zeigt Alizarin Rot S ganze Zelle Monoschichten in den Brunnen und (B) farbmetrische Bestimmung der Ca nach HCl Auslaugung Färbung. Der Student t-Test wurde durchgeführt, um die Bedeutung zwischen den beiden Gruppen zu analysieren. Ergebnisse werden wie meine ± S.E.M *p < 0,5 verglichen mit Kontrolle; (n = 4).
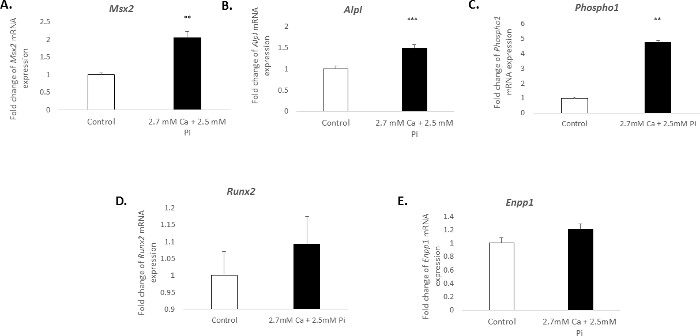
Abbildung 3. Veränderungen der Genexpression mit VIC Verkalkung verbunden. Falte in der mRNA Expression von knochenbildenden Marker zu ändern, (A) Msx2, (B) Alpl, (C) Phospho1, (D) Runx2und (E) Enpp1 in VICs behandelt mit 2,7 mM Ca/2.5 mM für Pi 48 h. mRNA Ausdruck erscheint als Falte Änderung im Vergleich zu den endogenen Referenz-gen Gadph. Einfache ANOVA mit allgemeines lineares Modell mit paarweisen Vergleiche wurde durchgeführt, um die Bedeutung zwischen mehreren Gruppen zu analysieren. Ergebnisse werden wie meine ± S.E.M **p < 0,01; p < 0,001 im Vergleich zur Kontrolle; (n = 6). Bitte klicken Sie hier für eine größere Version dieser Figur.
| Anzahl der Klappensegel | Kultur-Platte/Kolben |
| 9 bis 15 | 1 in 12-Well-Platte |
| 15 bis 30 | 1 in 6-Well-Platte |
| 30 + | T25 |
Tabelle 1. Allgemeine Richtlinien für die Anzahl der Prospekte für die erste Aussaat erforderlich.
Diskussion
Dieses ausführliche Protokoll beschreibt eine praktische Methode zur Erfassung von primären Ratte VICs, wodurch die Isolation dieser Zellen von Ratte Herzklappen durch enzymatische Verdauung. Unsere Methode weiter unterstützt und erweitert die Nutzung eines zuvor gemeldeten Ratte in Vitro Modell Aortenklappe Verkalkung13zu studieren. Die Isolierung von VICs von der Aortenklappe stellt das Potential für Verunreinigung von benachbarten VECs. Unsere Immunfluoreszenz Daten bestätigen jedoch, dass der erste Verdauung Schritt um die VECs Rendern die isolierten Zellen negativ für die Endothelzellen Marker, CD31 zu entfernen. Darüber hinaus bestätigt α-SMA Färbung den aktivierten Phänotyp VICs, was für Verkalkung12erforderlich ist.
VIC Isolationen zuvor gemeldet wurden großen Tiermodelle6,7,8. Diese Arten sind jedoch durch die genetischen und molekularbiologischen Werkzeugen für nachgeschaltete Studie sowie deren eingeschränkte Zugänglichkeit in den Labors auf der ganzen Welt zur Verfügung eingeschränkt. Im Gegensatz dazu sind solche Tools etabliert in leicht zugänglich Nagetiere und daher die Fähigkeit, Ratte abgeleitet VICs ermöglicht eine größere Kapazität der Versuchsplanung isolieren. Die Benutzung von VICs aus jungen Ratten bedeutet auch, dass die Zellen relativ mehr proliferative als ältere Ratten, erfordert daher weniger Tiere mehr Zellen zu liefern. Obwohl Mäuse ohne weiteres zugänglich sind, aber aufgrund von Mäusen vor allem kleinere Herzen, die Isolation der primäre Maustaste VICs wäre mehr Zeit in Anspruch und wesentlich mehr Tiere wäre erforderlich, um die gleiche Ausbeute an Zellen als die Rattenmodell zu isolieren.
Ein wesentlicher Vorteil dieser beschriebene Vorgehensweise ist, dass VICs zeitlich vom Wildtyp und transgene Ratten sowie Ratte Modelle von Herz-Kreislauf-Krankheiten und Ventil Verletzungen isoliert werden können. Mit der Rattenmodell würde erfordern eine größere Anzahl von Tieren für groß angelegte Versuche daher, um Tierversuche zu reduzieren, primäre Ratte VICs umgewandelt werden kann, um eine Zelllinie zu produzieren, sobald es gut charakterisiert worden ist.
Während die schweren klinischen Implikationen der CAVD allgemein anerkannt sind, müssen die zugrunde liegenden ursächlichen Mechanismen noch bestimmt werden. Darüber hinaus präsentieren wirksame Medikamente, die Therapien, die verhindern, dass potenziell heilen Verkalkung der Aortenklappe können nicht verfügbar sind. Die Kultur von VICs unter kalzifizierende Bedingungen bietet daher eine hochrelevante in Vitro Modell der CAVD. Wir zeigen, dass erhöhte Ca und Pi-Werte der in-vitro- Verkalkung der isolierten Ratte VICs mit einem gleichzeitigen Anstieg der Ausdruck der knochenbildenden Gen Marker Msx2, Alplund Phospho1induzieren. Weit feststeht, dass diese Marker des pathologischen Prozesses Gefäßverkalkung14,15,16zugeordnet sind. Unsere Daten zeigen also, dass die Kultur der Ratte VICs in Kalkschalen Medium ein geeignetes Modell zur Aortenklappe Verkalkung in-vitro-Studie. Aktuelle Studien aus unserem Labor verwendet in der Tat, haben dieses Modell zu zeigen, dass Ca Verkalkung der Aortenklappe durch Annexin VI Anreicherung von VIC abgeleitet Matrix Vesikel17fördert.
Trotz der Vorteile der Verwendung von Ratte VICs und deren effiziente Charakterisierung gibt es noch einige Einschränkungen. Zuerst, VIC Einwohnerzahl innerhalb Ratte Ventile ist sehr klein, und daher viele Tiere sind notwendig, um ausreichende Zellzahlen für umfangreiche in-vitro- Studien zu generieren. Es ist jedoch möglich, diese Beschränkung zu überwinden, indem Unternehmen Vorstudien in verewigt Ventil interstitielle Zelllinien, wie vor kurzem von uns18 berichtet, und anschließend mit Primärkulturen zu überprüfen und diese Erkenntnisse zu erweitern.
Zusammenfassend lässt sich sagen erklärt die beschriebene Methode erfolgreich isoliert, Kultur und Verkalkung der primären Ratte VICs, die anschließend bewertet werden kann, mit einer Vielzahl von Analysen sowie biochemischen Assays, Protein und RNA. Dieses Modell bietet eine zuverlässige und komfortable System, in dem CAVD in Vitrountersucht und stellt ein wertvolles Instrument für die Untersuchung der molekularen Mechanismen für diese zerstörerische Krankheit verantwortlich.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
CD31 Antikörper verwendet wurde ein großzügiges Geschenk von Dr. Karen Tan, University of Edinburgh. Diese Studie wurde unterstützt durch Mittel aus der Biotechnologie und biologische Wissenschaften Research Council (BBSRC) in Form von einem Institut strategische Programm Grant (BB/J004316/1; BBS/E/D/20221657) (VEM und CF), ein Institut Karriere Pfad Fellowship BB/F023928/1 (VEM) und Zugehörigkeit Finanzierung über eine BBSRC Fall Zugehörigkeit BB/K011618/1 (LC).
Materialien
| Name | Company | Catalog Number | Comments |
| Dissection scissors | World Precision Instruments | 14393 | Autoclave before use. |
| Spring straight (8 mm blade) | World Precision Instruments | 15905 | Autoclave before use. |
| SuperFine Vannas scissors (5 mm blade, 8 cm) | World Precision Instruments | 14003 | Autoclave before use. |
| Dumont #5 tweezers (11 cm) | World Precision Instruments | 500342 | Autoclave before use. |
| DMEM-F12 | Thermo Fisher Scientific | 11320074 | |
| Foetal bovine serum | Thermo Fisher Scientific | 10500064 | Filter before adding to culture medium. |
| Gentamicin | Thermo Fisher Scientific | 15710049 | |
| Absolute ethanol | Thermo Fisher Scientific | E/0650DF/17 | Dilute to 70% v/v in distilled water. |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | H1150PB17 | Dilute to 0.6M with distilled water. |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | UN1823 | Dilute to 0.1M with distilled water. |
| DAPI | Thermo Fisher Scientific | P36931 | |
| Alexa Fluor 594 goat anti-mouse antibody | Thermo Fisher Scientific | A11005 | 1/250 dilution in antibody dilution buffer. |
| Alexa Fluor 488 donkey anti-rabbit antibody | Thermo Fisher Scientific | A21206 | 1/250 dilution in antibody dilution buffer. |
| Superscript II kit | Thermo Fisher Scientific | 18064014 | |
| dNTP | Thermo Fisher Scientific | 18427013 | |
| Random primers | Thermo Fisher Scientific | P/N58875 | |
| Taq Polymerase kit | Thermo Fisher Scientific | 18038026 | |
| Tris/Borate/EDTA (TBE) | Thermo Fisher Scientific | AM9863 | Dilute to 1x with distlled water, before use. |
| Agarose | Thermo Fisher Scientific | 16500 | 2% in 1x Tris/Borate/EDTA(TBE). |
| Lysis buffer (RIPA) | Thermo Fisher Scientific | 89900 | |
| T75 flask | Thermo Fisher Scientific | 156472 | |
| T175 flask | Thermo Fisher Scientific | 159920 | |
| qPCR plates | Thermo Fisher Scientific | AB0990 | |
| Rat Msx2 primer | Qiagen | QT01084090 | |
| Rat Alpl primer | Qiagen | QT00190680 | |
| Rat Enpp1 primer | Qiagen | QT00181426 | |
| RNeasy minikit | Qiagen | 74104 | |
| 6-well plates | Sigma | CLS3516 | |
| T25 flask | Sigma | CLS430639 | |
| Monobasic phosphate | Sigma | S5011 | |
| Dibasic phosphate | Sigma | S5136 | |
| Calcium chloride | Sigma | C1016 | |
| Sodium dodecyl sulphate (SDS) | Sigma | 5030 | Dilute to 0.1% with 0.1M NaOH. |
| Paraformaldehyde | Sigma | P6148 | Dilute to 4% with PBS. |
| Triton X100 | Sigma | X100 | |
| Bovine serum albumin (BSA) | Sigma | A3059 | |
| Alizarin red S | Sigma | A5533 | Make up to 2% with distilled water, and adjust to pH 4.2. |
| TGFβ-1 primer pair: f: GCTACCATGCCAACTTCTGT r: TGTGTTGGTTGTAGAGGGCA | Sigma | Concentration used: 10 μM | |
| TGFβ-2 primer pair: f: GAAGGCAGAGTTCAGGGTCT r: CGCTGGGTTGGAGATGTTAG | Sigma | Concentration used: 10 μM | |
| Monoclonal Anti-β-Actin−Peroxidase antibody produced in mouse | Sigma | A3854 | 1/50000 dilution in 5% BSA in tris-buffered saline + 0.1% Tween (TBS/T). |
| Mouse anti-vimentin antibody | Sigma | v6389 | 1/900 dilution in antibody dilution buffer (1x phosphate buffered saline (PBS), 1% bovine serum albumin (BSA), 0.3% Triton X-100). |
| Mouse IgG | Sigma | I5381 | Diluted to the same stock concentration as mouse anti-vimentin antibody prior to dilution in antibody dilution buffer. |
| Rabbit IgG | GeneTex | GTX35035 | Diluted to the same stock concentration as rabbit anti-α-smooth muscle actin antibody prior to dilution in antibody dilution buffer. |
| Rabbit anti-α-smooth muscle actin antibody | Abcam | ab5694 | 1/200 dilution in antibody dilution buffer. |
| Rabbit anti-CD31 | Abcam | ab28364 | 1/50 dilution in 5% BSA inTBS/T. |
| HRP-conjugated goat anti-rabbit antibody | Dako | P0448 | 1/3000 dilution in in 5% BSA in TBS/T. |
| Collagenase II | Worthington | 41512862 | Adjust to 425 U/mL with distilled water, and then filter. |
| SYBR green mastermix | Primerdesign | PrecisionPLUS-MX-SY | |
| Calcium assay kit | Randox | CA590 | |
| DC protein assay kit | Bio-Rad | 5000111 | |
| ECL reagent | GE Healthcare | RPN2109 | |
| Hyperfilm ECL | GE Healthcare | 28906837 | |
| Nitrocellulose membrane | GE Healthcare | 10600007 | |
| PCR ladder | Bioline | BIO-33057 | |
| Loading dye for gel electrophoresis | New England Biolabs | B7025S | |
| Syringe filters (0.22 μm) | Merck Millipore | SLGP033RS | |
| Coverslips | Scientific Laboratory Supplies LTD | MIC3100 | |
| Hematocytometer | Marienfeld Superior | 640030 | |
| Name | Company | Catalog Number | Comments |
| Camera set up for Alizarin red images: | |||
| Camera | Nikon D800 | ||
| Lens | Nikon AF_s Micro, Nikko 105 mm, 1:2.8 GED | ||
| Dissection forceps 10 cm, curved ends | World Precision Instruments | 15915 | Autoclave before use. |
Referenzen
- Dweck, M. R., Boon, N. a., Newby, D. E. Calcific aortic stenosis: a disease of the valve and the myocardium. J Am Coll Cardiol. 60 (19), 1854-1863 (2012).
- Freeman, R. V., Otto, C. M. Spectrum of calcific aortic valve disease: Pathogenesis, disease progression, and treatment strategies. Circulation. 111, 3316-3326 (2005).
- Mohler, E. R., Gannon, F., Reynolds, C., Zimmerman, R., Keane, M. G., Kaplan, F. S. Bone formation and inflammation in cardiac valves. Circulation. 103 (11), 1522-1528 (2001).
- Monzack, E. L., Masters, K. S. Can valvular interstitial cells become true osteoblasts? A side-by-side comparison. J Heart Valve Dis. 20 (4), 449-463 (2011).
- Osman, L., Yacoub, M. H., Latif, N., Amrani, M., Chester, A. H. Role of human valve interstitial cells in valve calcification and their response to atorvastatin. Circulation. 114 (Suppl 1), (2006).
- Gu, X., Masters, K. S. Role of the Rho pathway in regulating valvular interstitial cell phenotype and nodule formation. Am J Physiol Heart Circ Physiol. 300 (2), H448-H458 (2011).
- Rodriguez, K. J., Masters, K. S. Regulation of valvular interstitial cell calcification by components of the extracellular matrix. J Biomed Mater Res A. 90 (4), 1043-1053 (2009).
- Rattazzi, M., Iop, L., et al. Clones of interstitial cells from bovine aortic valve exhibit different calcifying potential when exposed to endotoxin and phosphate. Arterioscler Thromb Vasc Biol. 28 (12), 2165-2172 (2008).
- Zhu, D., Hadoke, P. W. F., et al. Ablation of the androgen receptor from vascular smooth muscle cells demonstrates a role for testosterone in vascular calcification. Sci Rep. 6 (April), 24807 (2016).
- Zhu, D., Mackenzie, N. C. W., Millan, J. L., Farquharson, C., Macrae, V. E. Upregulation of IGF2 expression during vascular calcification. J Mol Endocrinol. 52 (2), 77-85 (2014).
- Latif, N., Quillon, A., et al. Modulation of human valve interstitial cell phenotype and function using a fibroblast growth factor 2 formulation. PLoS ONE. 10 (6), (2015).
- Liu, A. C., Joag, V. R., Gotlieb, A. I. The emerging role of valve interstitial cell phenotypes in regulating heart valve pathobiology. Am J Pathol. 171 (5), 1407-1418 (2007).
- Katwa, L. C., Ratajska, A., et al. Angiotensin converting enzyme and kininase-II-like activities in cultured valvular interstitial cells of the rat heart. Cardiovasc Res. 29 (1), 57-64 (1995).
- Shao, J. S., Cheng, S. L., Pingsterhaus, J. M., Charlton-Kachigian, N., Loewy, A. P., Towler, D. A. Msx2 promotes cardiovascular calcification by activating paracrine Wnt signals. J Clin Invest. 115, 1210-1220 (2005).
- Mackenzie, N. C. W., Zhu, D., Longley, L., Patterson, C. S., Kommareddy, S., MacRae, V. E. MOVAS-1 cell line: a new in vitro model of vascular calcification. Int J Mol Med. 27, 663-668 (2011).
- Kiffer-Moreira, T., Yadav, M. C., et al. Pharmacological inhibition of PHOSPHO1 suppresses vascular smooth muscle cell calcification. J Bone Miner Res. 28, 81-91 (2013).
- Cui, L., Rashdan, N. A., et al. End stage renal disease-induced hypercalcemia may promote aortic valve calcification via Annexin VI enrichment of valve interstitial cell derived-matrix vesicles. J Cell Physio. , (2017).
- Tsang, H., et al. Exploiting novel valve interstitial cell lines to study calcific aortic valve disease. Mol Med Rep. , (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten