Method Article
절연 및 기본 쥐의 밸브 중간 세포: 관상동맥 밸브 석 회화를 공부 하는 새로운 모델
요약
이 프로토콜 절연, 문화, 및 석 회화의 쥐 파생 밸브 중간 셀의 calcific 대동맥 밸브 질환 (CAVD)의 높은 생리 적 체 외에서 모델에 설명합니다. 이 쥐 모델의 착취 셀 및 분자 메커니즘이 복잡 한 병 적인 과정을 기초에 CAVD 연구를 촉진 한다.
초록
Calcific 대동맥 밸브 질환 (CAVD) 대동맥 밸브 전단의 진보적인 두껍게 특징 이다. 그것은 노인 및 끝 단계 신장 질병 (ESRD) 환자, 일반적으로 hyperphosphatemia와 아 고통에서 자주 발견 하는 조건이 다. 현재,의 진행을 막을 수 없습니다 약물 요법이 있다. 이 병 적인 과정의 기반이 되는 메커니즘은 불분명 남아 있다. 대동맥 밸브 전단 밸브 중간 셀 (피해자)는 VECs 사이 대동맥 cusps의 외부 표면에 얇은 층의 밸브 내 피 세포 (VECs)로 구성 된다. 쥐 모델의 사용에는 vivo에서 physiopathological 혈 청 인산 (Pi) 및 hyperphosphatemia와 아에서 고통 받는 환자의 칼슘 (Ca) 수준에 따라 소성 석 회화의 생체 외에서 연구를 수 있습니다. 설명된 프로토콜 세부 순수한 쥐 빅 인구의 빅 표시자의 식에 의해 표시 된 대로: 알파-부드러운 근육 걸 (α-SMA) vimentin 및 조직 성장 인자 베타 (TGFβ) 1과 2, 그리고 차별화 (CD) 31, 한 VEC의 클러스터의 부재 표식입니다. 이러한 피해자를 확대 하 여 연구 하 고 해명 CAVD underpinning 키 중재자 생화학, 유전, 및 이미징 연구를 수행할 수 있습니다.
서문
건강 한 관상동맥 밸브는 밸브의 개폐 중 기계적 스트레스의 분포는 똑같이 apportioned 세 전단지의 구성 됩니다. 밸브 전단은 3 개의 명료한 층의 정의 구조: fibrosa, spongiosa, 및 ventricularis, 어떤 집 우위 한 세포 유형으로 중간 셀 (피해 자들은) 밸브. 이러한 3 개의 계층 밸브 내 피 세포 (VECs)1의 두 침대 사이 끼워 넣으면 됩니다.
피해자의 Calcific 대동맥 밸브 석 회화 (CAVD), 서방 세계에서 가장 일반적인 심장 밸브 질병 진행에서 중요 한 역할을 한다. CAVD은 적극적으로 판 막 병 조직과 그 주변 microenvironment에 의해 규제 진보적인 조건으로 설명 되어 있습니다. 세포질 변화는 처음 거리 두껍게, 그리고 결국 대동맥 밸브 전단의 광범위 한 석 회화 발생할. 이 다음 중요 한 관상동맥 밸브 협 착 증에 지도 하 고 궁극적으로, 왼쪽 심 실 유출 방해2, 떠나는 유일한 치료로 수술 밸브 교체.
CAVD의 이상 복잡 하지만 생리 뼈 강화 작용3비슷한 메커니즘을 공유 합니다. 연구의 숫자 osteogenic 트랜스-차별화 및 석 회화4,5을 피해자의 능력을 보여 준, 하는 동안이 과정을 underpinning 메커니즘은 아직 완전히 해명 될 강조는 모델을 실현 하 고 관련 생체 외에서 CAVD의 중요 한 요구 사항입니다.
실험실 수로 이전 작업, 돼지와 소 모델에서 피해자를 고립 된 성공적으로 있으며 조건6,,78석 회화에서이 세포 배양. 이러한 모델에 관상동맥 밸브의 큰 크기로 인해 효소 소화를 통해 세포의 고립 세포의 순수한 인구 생성에 매우 효과적인 되었습니다. 그러나,이 모델은 대형 동물 종에 대 한 분자 도구의 한정 된 가용성으로 인해 제한 수 있습니다. 대조적으로, 설치류 모델 상대적으로 낮은 비용, 유전자 조작에 대 한 잠재력 및 분자 도구를 쉽게 사용할 수의 광범위 한 배열 유리한 유지. 그러나, 작은 동물 모델에서 피해자의 격리 하지 널리 채택 된다, 작은 조직 샘플을 작업할 때 발생 하는 어려움의 가능성이 결과입니다.
이 상세한 프로토콜 쥐 피해자의 직접 격리에 대 한 포괄적인 방법을 보고합니다. 밸브, 일련의 효소 소화 다음의 주의 해 부에 의해 피해자는 절연 고 실험 기법, 셀 문화, 석 회화, 및 진 식 등의 다양 한 고용 될 수 있습니다. CAVD의 모델 관련성이 높은 생체 외에서 이 의심할 여 지 없이이 병 적인 과정의 우리의 지식을 증가에 필수적인 기여를 하게된다.
프로토콜
모든 동물 실험 위원회 사용자는로 슬 린 연구소의 동물에 의해 승인 했다 및 동물 치료 동물의 사용에 대 한 홈 오피스 (영국) 지침에 따라 유지 되었다. 아래에 설명 된 프로토콜에 대 한 5 주 오래 된, 남성 Sprague Dawley 쥐 사용 되었다.
1. 시 약 조리법
- Dulbecco의 수정이 글 중간 (DMEM)과 영양소 혼합 F-12 (DMEM/F12)를 사용 하 여 문화 매체 를 준비 합니다. 10% 소독 열 비활성화 태아 둔감 한 혈 청 (FBS)와 1 %gentamicin 추가 합니다.
- 석 회화 매체 문화 매체와 2.7 m m Ca/2.5 m m 파이 사용 하 여 준비 합니다.
- 555 mg CaCl2 개 무게와 1m CaCl2의 5 mL을 증류수 5 mL 물에 용 해 하 여 1 M 칼슘 염화 물 (CaCl2)를 준비 합니다. 솔루션 솔루션 소독 0.22 μ m 주사기 필터를 통해 필터링.
- 710 mg 무수 염기 나트륨 인산 염 (Na2HPO4)과 각각 별도로 증류수 5 mL에 용 해의 무수 이수소 나트륨 인산 염 (NaH2포4), 600 밀리 그램 무게 1 M 나트륨 인산 염 을 준비합니다 물입니다. 솔루션을 소독 하는 0.22 μ m 주사기 필터를 통해 나2HPO4 의 3,870 µ L와 1130 µ L NaH2포4, 및 필터를 결합 합니다.
- 버퍼를 세척 포함 하는 행 크의 균형 소금 솔루션 (HBSS) 및 1 %gentamicin 준비.
2입니다. 절 개 후드의 준비
- 모든 해 통풍 후드, 이전 샘플 및 시 약의 무 균을 보장 하기 위해 70% 에탄올으로 소독을 실시 합니다.
- 압력가 마로 소독 그들 뒤에 70% 에탄올 이전 사용에 들어 있는 비 커에 도구 팁을 immersing에 의해 해 부 도구를 소독.
- 워시 버퍼를 포함 하는 비 커를 준비 하 고 해 부 도구 동물 또는 조직 접촉으로 오기 전에 워시 버퍼에 담근 다. 모든 시간에 얼음에 워시 버퍼를 유지.
3입니다. 기본 쥐 피해자의 추출
참고: 아래에서 설명 하는 프로토콜에 대 한 5 주 오래 된, 남성 Sprague Dawley 쥐 사용 되었다.
- 쥐를 추려 (~ 100 g) 영국 본사 지침에 따라 자 궁 경부 전위에 의해.
- 각 쥐의 심장 밖으로 해 부하는 동물 부정사 유리 해 부 보드에 놓고 70% 에탄올을 분사 하 여 피부를 소독 합니다.
- 해 부가 위, 복 부 구멍을 노출 하 고 흉 곽과 폐, 심장 폭로 조심 스럽게 제거의 도움으로 쥐의 중간에 4 cm 절 개를 확인 합니다.
- 샤 프의 쌍을 가진 심 혼을 제거 하 고 곡선된가 위, 봄은 쥐의 모든 총 해 완료 될 때까지 해 부 심장 얼음 차가운 워시 버퍼에 저장.
- 마이크로 해 부 각 심장, 페 트리 접시에 후자 전송 워시 버퍼에 덮여. 오름차순 대동맥 및 대동맥 루트 작은 지역으로 남아 있을 봄 연속가 위 (6 m m 블레이드)와 심장 근육을 잘라.
- 동일을 사용 하 여 직선 위 (6 m m 블레이드) 봄, 신중 하 게 자르면 오름차순 대동맥 좌 심 실 쪽으로 고 노출 대동맥 밸브 전단지.
- 신선 하 고, 멸 균 페 트리 접시에 전송 열린된 대동맥 HBSS 가득합니다. 대동맥 밸브 전단지, 욕실이 형 capsulotomy 마이크로-가 위 (3 m m 블레이드)와 대동맥의 기지에서 그들의 독특한 'U' 모양으로 표시를 해 부.
- 1.5 mL microcentrifuge 튜브 모든 해 완료 될 때까지 얼음 차가운 워시 버퍼의 1 mL에 모든 전단지를 저장 합니다.
- 일단 모든 전단지 수확 되어, 워시 버퍼를 제거 하 4 ° C에서 1 분 x 100g에 그들을 원심.
- 살 균을 위해 셀 문화 후드에서 다음 단계를 수행 합니다. 100 µ L 425 U/mL 콜라 II 37 ° c.에 5 분에 전단지 소화에 VECs를 제거 하려면 부드럽게 200 µ L 피 펫 팁을 사용 하 여 위아래로 pipetting으로 소화를 방해.
- 30 100 x g에서 원심 분리기 전단지, 펠 렛은 상쾌한을 신중 하 게 삭제 하는 s. 500 µ L 워시 버퍼와 두 번 세척 하 고 다시 30 100 x g에서 원심 분리 하 여 세포를 작은 s.
- 전단지에서 피해자를 수확, 2 h, 425 U/mL 콜라 II의 100 µ L를 소화 하 고 200 µ L 피 펫 팁을 사용 하 여 위아래로 부드럽게 pipetting으로 피해자를 놓습니다.
- 문화 매체 및 작은 피해 자들은 고 나머지 밸브 전단지 파편을 5 분 동안 670 x g에서 원심 분리기의 19 ml에서 콜라 II 희석. 상쾌한, 취소 및 전단지 피해 자들은 문화 접시/플라스 크에 따라 전송 (표 1).
- 문화 문화 매체, confluency 37 ° C, 5% (이산화탄소) CO2, 존재에 도달할 때까지 5-7 일에 대 한 피해 자들은 후 72 h 매체를 변경. 생체 외에서 실험에 사용에 대 한 통행 최대 5 배까지 일단 confluency에 도달 100% 합니다.
4입니다. 쥐 피해자의 석 회화의 유도
참고: 모든 실험, 세포는 hemocytometer 포함.
- 시드 및 오염을 방지 하기 위해 소독된 후드에 뿌리고 모든 1 차 셀을 수행 합니다. 기본 쥐 피해 자들은 실험 체 외에 석 회화를 준비 하려면 셀 150, 000 셀/잘 6-잘 접시의 조밀도에 씨. ≥ 90 %confluency (일반적으로 72 h)까지 문화 매체에 유지 합니다.
- 제어 매체 대 석 회화와 피해자를 취급 하 고 37 ° C, 5% CO2, 추가 72 h에 대 한 존재에서 품 어.
- 석 회화 기본 쥐 피해 자들은 후속 다운스트림 분석에 대 한 연구, 석 회화/제어 매체를 제거 하 고 세척 비 바운드 Ca 및 Pi 이온 제거에 워시 버퍼와 monolayers.
5. 쥐 빅 특성화
- Immunostaining vimentin와 α-SMA, 씨앗 150, 000 셀/잘 6 잘 플레이트의 밀도에 쥐 피해 자들은 같은 phenotypic 표식에 대 한 모니터링에 대 한 커버 전표 (셀 커버 전표의 표면에 성장할 것입니다)를 포함 하 고 50 %confluency 성장.
- 문화 매체를 발음 하 고 수정 셀 monolayers 4 %paraformaldehyde (PFA)와 10 분 동안 그들 버퍼링 하는 인산 염 (PBS), 3 시간을 세척 하기 전에 5 분 각 시간에 대 한.
주의: PFA 독성 이며 신중 하 게 처리 해야 합니다. - 차단 하 고 permeabilization 버퍼와 셀 단층을 품 어 (1 x PBS, 2 차 항 체로 동일한 종에서 정상적인 혈 청의 5%, 0.3% 트라이 톤 X-100) 실 온에서 1 h.
- 마우스 안티 vimentin 및 토끼 안티-α-SMA 항 체 항 체 희석 버퍼에 희석 된 셀 monolayers를 품 어 (1% 소 혈 청 알 부 민 + 0.3 %PBS Triton X-100) 하룻밤 4 ° C에서 부드럽게 흔들어 로커에.
주: 부정적인 컨트롤 비 활용 된 마우스 IgG와 토끼 IgG, 같은 희석을 사용 하 여 테스트 샘플으로 구성 되어 있습니다. - 다음 날, 3 번 5 분 때마다 PBS로 1 차 항 체를 씻어.
- 부드럽게 로커에 떨고 실 온에서 1 h에 대 한 2 차 항 체 fluorophore 활용으로 셀 monolayers를 품 어.
- PBS, 3 번 세척 하 고 부드럽게 핀셋 (쥐 피해 자들은 포함)는 coverslips에 밖으로 한 쌍의 집게와 coverslip 포함 4', 6-diamidino-2-phenylindole (DAPI)에와. 4 ° C에서 24 시간 이상 형광 현미경으로 시각화 하기 전에 치료 하는 슬라이드를 둡니다.
- 서쪽 오 점 분석에 대 한 150, 000의 밀도에서 피해 자들은 셀/6 잘 플레이트에 잘하고 confluent 100%까지 문화 매체에 성장에 두고 쥐 씨.
- 단백질의 8 µ g를 사용 하 여 실행 CD31 표현을 측정 하 여 VEC 오염을 배제 서쪽 오 점.
참고: 앞에서 설명한9표준 서쪽 오 점 프로토콜 미행 했다. - 유전자 연구에 대 한 제조업체의 지침에 따라 상업 키트를 사용 하 여 ribonucleic 산 (RNA)을 추출 합니다.
- 반전 녹음 방송을 사용 하 여 대상 유전자 식 연쇄 반응 (PCR)를 사용 하 여 측정 하는 cDNA를 취득 및 실시간 PCR (RT-PCR; 일컬어 정량) 녹색 fluorophore 감지 Gapdh 이전 참조 유전자로 사용 하 여 설명된10.
- 다음 프로그램을 사용 하 여 PCR 분석: 30 94 ° C의 30 주기 3 분, 94 ° C의 1 주기 s, 63 ° C 30에 대 한 s, 72 ° C 35 s, 그리고 5 분 동안 72 ° C의 마지막으로 1 사이클.
- 다음 프로그램을 사용 하 여 정량 분석: 95의 40 주기 10 분 동안 95 ° C의 1 주기 30 s, 및 95 ° C 30에 대 한 15 초, 1 분, 1 분, 55 ° C 95 ° C의 추가 주기 위한 60 ° C에 ° C s.
- 트리 스/Borate/EDTA (TBE) 버퍼에는 2 %agarose 젤을 사용 하 여 PCR 제품 분석을 젤 전기 이동 법을 실행 합니다.
6. 쥐 빅 석 회화 연구
- 알리자린 레드 S 및 생 화 확 적인 석 회화 연구, 4 섹션에 설명 된 시드 및 석 회화 지침을 따르시기 바랍니다.
- 5% 붉은 알리자린 S 솔루션, 부드럽게 20 분 통에 락 셀 monolayers 얼룩. 이후 5 분 때마다 증류수 3 번 씻어. 각 잘의 이미지를 취득 합니다.
- 생화학 Ca 분석 결과 키트를 사용 하 여 계량 Ca 증 착. 캘리포니아2 + 이온 0.6 M 염 산 (HCl)를 사용 하 여 부드러운 동요와 4 ° C에서 24 h에 대 한 거.
- 수확은 상쾌한 측정 분석 결과 Ca를 사용 하 여 Ca 농도 키트 ( 재료의 표참조) 제조 업체의 지침에 따라.
- 총 세포질 단백질의 일부분으로 칼슘 농도 계산 합니다. 0.1 M 수산화 나트륨 (NaOH) + 0.1% 나트륨 라우릴 황산 염 (SDS) 세포 monolayers에서 세포질 단백질 변성 제조업체의 지침에 따라 세제 호환 (DC) 단백질 분석을 사용 하 여 총 단백질 농도 결정 합니다.
결과
이 프로토콜의 목표 기본 쥐 피해자의 격리를 설명 하 고 석 회화 실험 체 외에 문화를 했다. 위에서 설명한 방법을 사용 하 여 쥐 피해 자들은 성공적으로 고립 되 고 CAVD에 대 한 책임 메커니즘의 연구에 대 한 확장.
쥐 주 피해자 공동 설립된 빅 마커 지역화:
격리 된 셀 빅 형 빅 표식에 대 한 면역 형광 검사를 통해 확인 했다: vimentin와 α-SMA (빨간색과 녹색, 각각 그림 1A), 이전 보고서11,12계약입니다. 비 활용 된 마우스와 토끼 IgG 사용 하 여 대표 부정적인 컨트롤 그림 1B에서 표시 됩니다. 또한, 빅-성장 레 귤 레이 터 TGFβ-1 TGFβ-2의 식 PCR 분석 (그림 1C)을 사용 하 여 확인 되었다. 서쪽 오 점 분석 그 쥐를 확인 하기 위해 수행 되었다, 고립 된 쥐 주 피해자 했다 내 피 오염에서 무료로 확인 피해 자들은 부정 했다 CD31, 내 피 세포 표식에 대 한 긍정적인 제어 ( 로 개 mitral VECs를 사용 하 여 그림 1D).
Ca와 Pi 쥐 빅 석 회화 유도:
높은 조직의 Ca 또는 Pi 농도 일반적으로 피해자 체 외의 석 회화를 드라이브. 피해 자들은 격리 된 쥐의 석 회화 가능성, 감사 셀 ESRD 환자에서 병 적인 아 및 hyperphosphatemia 조건 모방 Ca와 Pi의 높은 수준에 노출 되었다. 2.7 m m Ca/2.5 m m 파이와 피해자의 치료 유도 석 회화, 알리자린 레드 S Ca 증 착 (그림 2A)와 HCl (81 배; leaching 다음 Ca 레벨의 색도계 결정에 대 한 얼룩에 의해 결정 되 학생의 t를 사용 하 여 p < 0.05-테스트; 그림 2B)입니다.
진 식 변경 빅 석 회화와 관련 된:
생체 외에서 혈관 세포의 석 회화 별개 분자 프로 파일에 연결 됩니다. 현재 연구에서 2.7 m m Ca/2.5 m m 파이와 피해자의 치료 osteogenic 마커의 mRNA 식에 상당한 증가 유발: Msh homeobox 2, Msx2 (2.04 배 변화; p < 0.01; 그림 3A), 알칼리 성 인산 가수분해 효소, Alpl (1.49 배 변화; p < 0.001; 그림 3B), 및 phosphoethanolamine/phosphocholine 인산 가수분해 효소, Phospho1 (4.7 배 변화; p < 0.01 일방통행 ANOVA;를 사용 하 여 그림 3C)입니다. 그러나, osteogenic 표식, Runx2및 석 회화 억제 물 ectonucleotide pyrophasphatase, Enpp1의 식을 그대로 (그림 3D-E) 남아 있었다.
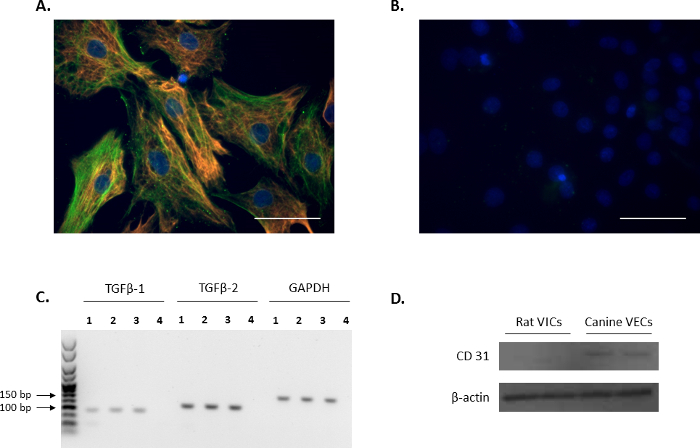
그림 1입니다. 빅 마커의 식. (A) 면역 형광 밸브 중간 셀 (피해자)에 더블 얼룩, 알파-부드러운 근육 말라 (α-SMA; 녹색)와 vimentin의 colocalization를 보여주는. (B) 마우스와 토끼 IgG 사용 하 여 부정적인 컨트롤의 대표 이미지. 핵은 블루 4', 6-diamidino-2-phenylindole를 사용 하 여 (DAPI)에 물 들 다. 눈금 막대 = 50 µ m. (C) 변형 시키는 성장 인자 beta 1 (TGFβ-1)의 존재와 피해자에 TGFβ-2 (차선 1-3) PCR 분석에 의해 표시 된 대로. 레인 4 물 컨트롤입니다. 사용 하는 참조 유전자 Gapdh이었다입니다. (D) 서쪽 오 점 분석 CD31의 풍부한 식 식이 없는 피해자에 비해 개 승 모 판 내 피 세포 (VECs)에서 보여주는. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
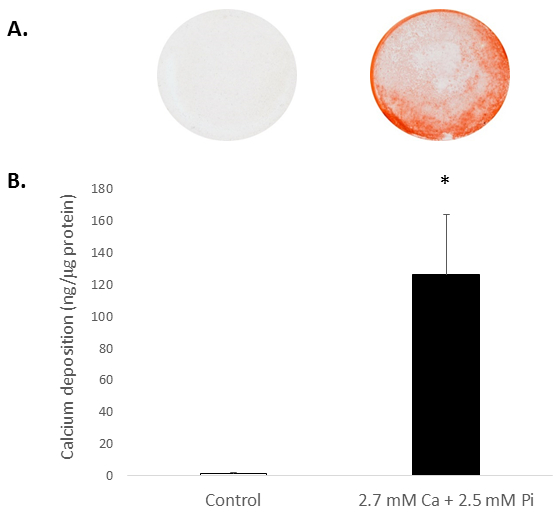
그림 2입니다. 쥐 피해 자들은의 석 회화 생체 외에서 . 피해 자들은 증 착 Ca 치료 2.7 m m Ca/2.5 m m Pi에 따라: (A) 사진 보여주는 알리자린 레드 S 잘, 그리고 (B) HCl leaching 다음 Ca 레벨의 색도계 결정에 전체 셀 monolayers의 얼룩. 학생의 t-테스트 두 데이터 그룹 간의 의미 분석을 수행 했다. 결과 ± S.E.M.를 의미 하는 대로 표시 됩니다 *p < 0.5 제어;와 비교 (n = 4).
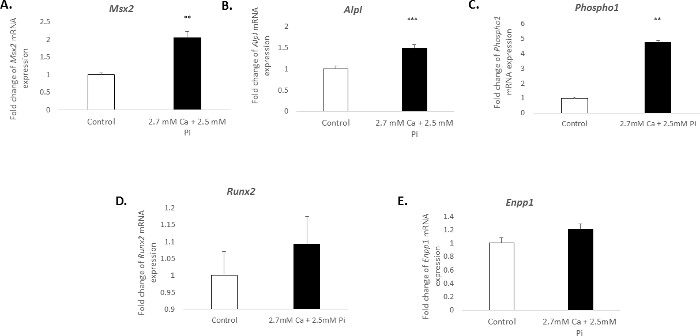
그림 3입니다. 빅 석 회화와 관련 된 유전자 표현 변경. Msx2(A), (B) Alpl, (C) Phospho1, (D) Runx2, 배 osteogenic 마커의 mRNA 식에서 변경 하 고 (E) Enpp1 피해자에서 Ca/2.5 m m에 대 한 Pi 2.7 m m로 치료 48 h. mRNA 식 생 참조 유전자에 비해 배 변화로 표시 됩니다 Gadph. 쌍 단위 비교를 통합 하는 일반 선형 모델을 사용 하 여 단방향 ANOVA 여러 그룹 간의 의미 분석을 수행 했습니다. 결과 ± S.E.M.를 의미 하는 대로 표시 됩니다 * *p < 0.01; p < 0.001 제어;에 비해 (n = 6). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 밸브 전단의 수 | 문화 접시/플라스 크 |
| 9 ~ 15 | 1 12-잘 접시에 잘 |
| 15 ~ 30 | 6 잘 플레이트에서 1 |
| 30 + | T25 |
표 1. 초기 시드에 필요한 전단지의 번호에 대 한 일반적인 지침.
토론
이 상세한 프로토콜 기본 쥐 피해 자들은, 효소 소화를 통해 쥐 심장 밸브에서 이러한 셀의 사용의 수집에 대 한 실제적인 방법을 설명 합니다. 우리의 방법은 더 지원 하 고 관상동맥 밸브 석 회화13연구 모델 생체 외에서 이전에 보고 된 쥐의 사용을 확장 합니다. 대동맥 밸브에서 피해자의 격리 이웃 VECs에서 오염에 대 한 가능성을 소개합니다. 그러나, 우리의 면역 형광 검사 데이터 초기 소화 단계 고립 된 세포를 내 피 세포 마커, CD31 부정적인 렌더링 VECs 제거 충분 한지 확인 합니다. 또한, α-SMA 얼룩 확인는 피해자의 활성화 형은 석 회화12필요 합니다.
빅 격리 이전에 보고 된 큰 동물 모델6,,78. 그러나, 이러한 종 다운스트림 연구로 전 세계 실험실에서 그들의 제한 된 액세스에 사용할 수 있는 제한 된 유전 및 분자 도구에 의해 제약 됩니다. 반면, 이러한 도구를 쉽게 사용할 수 있는 설치류에 따라서 능력을 분리 쥐 파생 된 피해자 수는 큰 실험 설계 용량 잘 설립 있습니다. 젊은 쥐에서 피해자의 사용 또한 세포는 상대적으로 더 오래 된 쥐, 따라서 더 많은 세포를 더 적은 동물이 요구 보다 증식을 의미 합니다. 마우스는 쉽게 액세스할 수, 하지만 쥐 때문 특히 작은 마음, 격리 하는 데 기본 마우스의 피해자 더 많은 시간이 소요 될 것 이라고 하 고 상당히 많은 동물 쥐 모델 셀의 동일한 수익률을 격리 하는 데 필요한 것입니다.
이 기술된 접근의 중요 한 이점은 피해 자들은 야생 종류와 유전자 변형 쥐 뿐만 아니라 심혈 관 질환과 밸브 상해의 쥐 모델에서 일시적으로 고립 될 수 있다 이다. 쥐 모델을 사용 하 여 필요 동물의 더 큰 수 대규모 실험, 따라서 동물 사용을 줄이기 위해, 그것을 잘 특징은 일단 셀 라인 생산 주 쥐 피해 자들은 변형 될 수 있다.
CAVD의 심각한 임상 의미 널리 인식 하 고, 하는 동안 근본적인 원인이 메커니즘은 아직 확인할 수 있다. 또한, 효과적인 약물 치료를 방지 하 고 잠재적으로 관상동맥 밸브 석 회화 치료 수 있습니다에서 사용할 수 있습니다 선물. 석 회화 조건 아래 피해자의 문화는 그러므로 CAVD의 관련성이 높은 생체 외에서 모델을 제공 합니다. 우리는 높은 Ca 및 Pi 수준 osteogenic 유전자 마커 Msx2, Alpl및 Phospho1의 표현에 수 반하는 증가 가진 고립 된 쥐 피해자의 체 외에 석 회화 유도 보여. 그것은 널리 이러한 마커 혈관 석 회화14,,1516의 병 적인 프로세스와 관련 된 설립. 우리의 데이터는 따라서 쥐 피해 자들은 중간 석 회화에 문화는 관상동맥 밸브 석 회화 시험관을 공부 하는 적절 한 모델을 보여준다. 실제로, 우리의 실험실에서 최근 연구는 캘리포니아 빅 파생 매트릭스 소포17의 Annexin VI 농축을 통해 관상동맥 밸브 석 회화 촉진 입증이 모델을 활용 하 고 있다.
쥐 피해 자들은 그들의 효율적인 특성을 사용 하 여의 혜택에도 불구 하 고 몇 가지 제한이 여전히 존재 한다. 첫째, 쥐 밸브 내 빅 인구의 크기는 매우 작습니다, 그리고 따라서 많은 동물 광범위 한 생체 외에서 연구에 대 한 충분 한 셀 번호를 생성 하기 위해 필요. 그러나, 그것은 불멸 하 게 밸브 중간 셀 라인, 최근에18, 우리가 보고 하 고 이후 주 문화를 고용 확인 하 고 이러한 연구 결과 확장 사업 예비 연구 하 여이 제한을 극복 하기 위해 가능 하다.
요약, 설명된 방법 성공적인 절연, 문화, 및 기본 쥐 수 있습니다 이후에 평가 분석을 포함 한 생 화 확 적인 분석 실험 단백질 및 RNA 분석의 다양 한을 사용 하 여 피해자의 석 회화를 설명 합니다. 이 모델 CAVD에서 생체 외에서조사 하는 안정적이 고 편리한 시스템 고이 파괴적인 질병에 대 한 책임 분자 메커니즘을 조사에 대 한 유용한 도구를 제공 합니다.
공개
저자는 공개 없다.
감사의 말
CD31 항 체 사용 박사 카 렌 탄, 에든버러 대학에서에서 관대 한 선물 했다. 이 연구는 생명 공학 및 생물 과학 연구 위원회 (BBSRC)는 연구소 전략적 프로그램 그랜트 (BB/J004316/1;의 형태로 자금에 의해 지원 되었다 BBS/E/D/20221657) (누구와 CF)는 연구소 경력 경로 친목 BB/F023928/1 (누구), 그리고 재학 BBSRC 경우 재학 BB/K011618/1 (LC)를 통해 자금.
자료
| Name | Company | Catalog Number | Comments |
| Dissection scissors | World Precision Instruments | 14393 | Autoclave before use. |
| Spring straight (8 mm blade) | World Precision Instruments | 15905 | Autoclave before use. |
| SuperFine Vannas scissors (5 mm blade, 8 cm) | World Precision Instruments | 14003 | Autoclave before use. |
| Dumont #5 tweezers (11 cm) | World Precision Instruments | 500342 | Autoclave before use. |
| DMEM-F12 | Thermo Fisher Scientific | 11320074 | |
| Foetal bovine serum | Thermo Fisher Scientific | 10500064 | Filter before adding to culture medium. |
| Gentamicin | Thermo Fisher Scientific | 15710049 | |
| Absolute ethanol | Thermo Fisher Scientific | E/0650DF/17 | Dilute to 70% v/v in distilled water. |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | H1150PB17 | Dilute to 0.6M with distilled water. |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | UN1823 | Dilute to 0.1M with distilled water. |
| DAPI | Thermo Fisher Scientific | P36931 | |
| Alexa Fluor 594 goat anti-mouse antibody | Thermo Fisher Scientific | A11005 | 1/250 dilution in antibody dilution buffer. |
| Alexa Fluor 488 donkey anti-rabbit antibody | Thermo Fisher Scientific | A21206 | 1/250 dilution in antibody dilution buffer. |
| Superscript II kit | Thermo Fisher Scientific | 18064014 | |
| dNTP | Thermo Fisher Scientific | 18427013 | |
| Random primers | Thermo Fisher Scientific | P/N58875 | |
| Taq Polymerase kit | Thermo Fisher Scientific | 18038026 | |
| Tris/Borate/EDTA (TBE) | Thermo Fisher Scientific | AM9863 | Dilute to 1x with distlled water, before use. |
| Agarose | Thermo Fisher Scientific | 16500 | 2% in 1x Tris/Borate/EDTA(TBE). |
| Lysis buffer (RIPA) | Thermo Fisher Scientific | 89900 | |
| T75 flask | Thermo Fisher Scientific | 156472 | |
| T175 flask | Thermo Fisher Scientific | 159920 | |
| qPCR plates | Thermo Fisher Scientific | AB0990 | |
| Rat Msx2 primer | Qiagen | QT01084090 | |
| Rat Alpl primer | Qiagen | QT00190680 | |
| Rat Enpp1 primer | Qiagen | QT00181426 | |
| RNeasy minikit | Qiagen | 74104 | |
| 6-well plates | Sigma | CLS3516 | |
| T25 flask | Sigma | CLS430639 | |
| Monobasic phosphate | Sigma | S5011 | |
| Dibasic phosphate | Sigma | S5136 | |
| Calcium chloride | Sigma | C1016 | |
| Sodium dodecyl sulphate (SDS) | Sigma | 5030 | Dilute to 0.1% with 0.1M NaOH. |
| Paraformaldehyde | Sigma | P6148 | Dilute to 4% with PBS. |
| Triton X100 | Sigma | X100 | |
| Bovine serum albumin (BSA) | Sigma | A3059 | |
| Alizarin red S | Sigma | A5533 | Make up to 2% with distilled water, and adjust to pH 4.2. |
| TGFβ-1 primer pair: f: GCTACCATGCCAACTTCTGT r: TGTGTTGGTTGTAGAGGGCA | Sigma | Concentration used: 10 μM | |
| TGFβ-2 primer pair: f: GAAGGCAGAGTTCAGGGTCT r: CGCTGGGTTGGAGATGTTAG | Sigma | Concentration used: 10 μM | |
| Monoclonal Anti-β-Actin−Peroxidase antibody produced in mouse | Sigma | A3854 | 1/50000 dilution in 5% BSA in tris-buffered saline + 0.1% Tween (TBS/T). |
| Mouse anti-vimentin antibody | Sigma | v6389 | 1/900 dilution in antibody dilution buffer (1x phosphate buffered saline (PBS), 1% bovine serum albumin (BSA), 0.3% Triton X-100). |
| Mouse IgG | Sigma | I5381 | Diluted to the same stock concentration as mouse anti-vimentin antibody prior to dilution in antibody dilution buffer. |
| Rabbit IgG | GeneTex | GTX35035 | Diluted to the same stock concentration as rabbit anti-α-smooth muscle actin antibody prior to dilution in antibody dilution buffer. |
| Rabbit anti-α-smooth muscle actin antibody | Abcam | ab5694 | 1/200 dilution in antibody dilution buffer. |
| Rabbit anti-CD31 | Abcam | ab28364 | 1/50 dilution in 5% BSA inTBS/T. |
| HRP-conjugated goat anti-rabbit antibody | Dako | P0448 | 1/3000 dilution in in 5% BSA in TBS/T. |
| Collagenase II | Worthington | 41512862 | Adjust to 425 U/mL with distilled water, and then filter. |
| SYBR green mastermix | Primerdesign | PrecisionPLUS-MX-SY | |
| Calcium assay kit | Randox | CA590 | |
| DC protein assay kit | Bio-Rad | 5000111 | |
| ECL reagent | GE Healthcare | RPN2109 | |
| Hyperfilm ECL | GE Healthcare | 28906837 | |
| Nitrocellulose membrane | GE Healthcare | 10600007 | |
| PCR ladder | Bioline | BIO-33057 | |
| Loading dye for gel electrophoresis | New England Biolabs | B7025S | |
| Syringe filters (0.22 μm) | Merck Millipore | SLGP033RS | |
| Coverslips | Scientific Laboratory Supplies LTD | MIC3100 | |
| Hematocytometer | Marienfeld Superior | 640030 | |
| Name | Company | Catalog Number | Comments |
| Camera set up for Alizarin red images: | |||
| Camera | Nikon D800 | ||
| Lens | Nikon AF_s Micro, Nikko 105 mm, 1:2.8 GED | ||
| Dissection forceps 10 cm, curved ends | World Precision Instruments | 15915 | Autoclave before use. |
참고문헌
- Dweck, M. R., Boon, N. a, Newby, D. E. Calcific aortic stenosis: a disease of the valve and the myocardium. J Am Coll Cardiol. 60 (19), 1854-1863 (2012).
- Freeman, R. V., Otto, C. M. Spectrum of calcific aortic valve disease: Pathogenesis, disease progression, and treatment strategies. Circulation. 111, 3316-3326 (2005).
- Mohler, E. R., Gannon, F., Reynolds, C., Zimmerman, R., Keane, M. G., Kaplan, F. S. Bone formation and inflammation in cardiac valves. Circulation. 103 (11), 1522-1528 (2001).
- Monzack, E. L., Masters, K. S. Can valvular interstitial cells become true osteoblasts? A side-by-side comparison. J Heart Valve Dis. 20 (4), 449-463 (2011).
- Osman, L., Yacoub, M. H., Latif, N., Amrani, M., Chester, A. H. Role of human valve interstitial cells in valve calcification and their response to atorvastatin. Circulation. 114 (Suppl 1), (2006).
- Gu, X., Masters, K. S. Role of the Rho pathway in regulating valvular interstitial cell phenotype and nodule formation. Am J Physiol Heart Circ Physiol. 300 (2), H448-H458 (2011).
- Rodriguez, K. J., Masters, K. S. Regulation of valvular interstitial cell calcification by components of the extracellular matrix. J Biomed Mater Res A. 90 (4), 1043-1053 (2009).
- Rattazzi, M., Iop, L., et al. Clones of interstitial cells from bovine aortic valve exhibit different calcifying potential when exposed to endotoxin and phosphate. Arterioscler Thromb Vasc Biol. 28 (12), 2165-2172 (2008).
- Zhu, D., Hadoke, P. W. F., et al. Ablation of the androgen receptor from vascular smooth muscle cells demonstrates a role for testosterone in vascular calcification. Sci Rep. 6 (April), 24807(2016).
- Zhu, D., Mackenzie, N. C. W., Millan, J. L., Farquharson, C., Macrae, V. E. Upregulation of IGF2 expression during vascular calcification. J Mol Endocrinol. 52 (2), 77-85 (2014).
- Latif, N., Quillon, A., et al. Modulation of human valve interstitial cell phenotype and function using a fibroblast growth factor 2 formulation. PLoS ONE. 10 (6), (2015).
- Liu, A. C., Joag, V. R., Gotlieb, A. I. The emerging role of valve interstitial cell phenotypes in regulating heart valve pathobiology. Am J Pathol. 171 (5), 1407-1418 (2007).
- Katwa, L. C., Ratajska, A., et al. Angiotensin converting enzyme and kininase-II-like activities in cultured valvular interstitial cells of the rat heart. Cardiovasc Res. 29 (1), 57-64 (1995).
- Shao, J. S., Cheng, S. L., Pingsterhaus, J. M., Charlton-Kachigian, N., Loewy, A. P., Towler, D. A. Msx2 promotes cardiovascular calcification by activating paracrine Wnt signals. J Clin Invest. 115, 1210-1220 (2005).
- Mackenzie, N. C. W., Zhu, D., Longley, L., Patterson, C. S., Kommareddy, S., MacRae, V. E. MOVAS-1 cell line: a new in vitro model of vascular calcification. Int J Mol Med. 27, 663-668 (2011).
- Kiffer-Moreira, T., Yadav, M. C., et al. Pharmacological inhibition of PHOSPHO1 suppresses vascular smooth muscle cell calcification. J Bone Miner Res. 28, 81-91 (2013).
- Cui, L., Rashdan, N. A., et al. End stage renal disease-induced hypercalcemia may promote aortic valve calcification via Annexin VI enrichment of valve interstitial cell derived-matrix vesicles. J Cell Physio. , (2017).
- Tsang, H., et al. Exploiting novel valve interstitial cell lines to study calcific aortic valve disease. Mol Med Rep. , In press (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유