Method Article
בידוד ואפיון של החולדה הראשית שסתום תאים ביניים: מודל חדש ללמוד הסתיידות שסתום אבי העורקים
In This Article
Summary
פרוטוקול זה מתאר את הבידוד, תרבות, הסתיידות של עכברוש-derived שסתום תאים ביניים, דגם מאוד פיזיולוגיים במבחנה של מחלת שסתום אבי העורקים calcific (CAVD). ניצול של מודל זה עכברוש מקלה על מחקר CAVD לחקור את התא ואת המנגנונים המולקולריים העומדים בבסיס תהליך פתולוגי מורכב זה.
Abstract
מחלת שסתום אבי העורקים calcific (CAVD) מאופיין על ידי עיבוי הדרגתי של העלעלים שסתום אבי העורקים. . זה מצב לעתים קרובות נמצאו בחולי מחלת כליות (ESRD) קשישים, בשלב הסופי, הסובלים בדרך כלל היפרפוספטמיה שמוביל. כיום, ישנם טיפולים ללא טיפול תרופתי שיכול לעצור את התפתחותו. המנגנונים העומדים בבסיס תהליך פתולוגי זה אינן ברורות. העלעל שסתום אבי העורקים מורכב משכבה דקה של תאי אנדותל שסתום (VECs) על פני השטח החיצוני של cusps אבי העורקים, עם שסתום תאים ביניים (הקורבנות) דחוקה בין VECs. השימוש מודל עכברוש מאפשר המחקר במבחנה של הסתיידות חוץ רחמי בהתבסס על ויוו סרום physiopathological פוספט (Pi) רמות סידן (Ca) של חולים הסובלים היפרפוספטמיה שמוביל. הפרוטוקול המתואר פרטים הבידוד של חולדה טהור ויק האוכלוסייה כפי שמוצג על-ידי הביטוי של ויק סמני: שריר חלק-אלפא אקטין (α-SMA) vimentin ורקמות גורם הגדילה בטא (TGFβ) 1 ו-2, ואת העדר אשכול של בידול (CD) 31, VEC סמן. על ידי הרחבת הקורבנות, ניתן לבצע מחקרים ביוכימיים גנטיים, הדמיה כדי לחקור ולפצח המתווכים מפתח לגורם המרכזי עליו מושתתת CAVD.
Introduction
שסתום אבי העורקים בריא מורכבת שלוש עלונים, שאליו חלוקת מכאניים במהלך פתיחת וסגירת המסתם במידה שווה לצפות. העלעל שסתום יש מבנה מוגדר של שלוש שכבות נפרדות: fibrosa, spongiosa, ventricularis, איזה בית שסתום תאים ביניים (הקורבנות) כסוג התא השולט. אלה שלוש שכבות הן דחוקה בין שתי מיטות של שסתום תאי אנדותל (VECs)1.
הקורבנות תפקיד קריטי בהתקדמות של Calcific אבי העורקים שסתום הסתיידות (CAVD), המחלה שסתום הלב הנפוצה ביותר בעולם המערבי. CAVD מתואר מצב מתקדם זה מוסדר באופן פעיל על ידי הרקמה valvular שלה microenvironment שמסביב. שינויים סלולריים לגרום בתחילה עיבוי שהותירה, ובסופו של הסתיידות נרחבת של העלעלים שסתום אבי העורקים. זה מוביל ואז היצרות מסתם אבי העורקים משמעותי ועזב בסופו של דבר, יצוא חדרית חסימה2, עוזב החלפת שסתום כירורגיים כמו הטיפול העתידי.
הפתופיזיולוגיה של CAVD הוא מורכב, אבל חולק מנגנונים דומים מינרליזציה עצם פיזיולוגיים3. בזמן, מספר מחקרים הדגימו את היכולת של הקורבנות לעבור osteogenic טרנס-בידול, הסתיידות4,5, המנגנונים לגורם המרכזי עליו מושתתת תהליך זה שעדיין לא להיות הובהר במלואו, המדגיש דרישה חיונית עבור מודל ריאלי ורלוונטי במבחנה של CAVD.
העבודות הקודמות על ידי מספר מעבדות יש בהצלחה מבודד הקורבנות חזירי דגמים שור, והוא תרבותי תאים אלה תחת calcifying תנאים-6,-7,-8. בשל גודלו של שסתום אבי העורקים במודלים אלה, בידוד של תאים דרך מערכת העיכול אנזימטי כבר יעילים ביצירת אוכלוסיות טהור של תאים. עם זאת, מודלים אלה יכולות להיות מגבילות עקב המוגבל של כלים עבור מיני בעלי חיים גדולים. לעומת זאת, מודלים מכרסמים נשארים יתרון עלויות נמוכות יחסית, פוטנציאל מניפולציה גנטית וכתוצאה את מערך נרחב של כלים הזמינים בקלות. עם זאת, בידודו של הקורבנות של מודלים בעלי חיים קטנים לא נרחב מועסק, וזו תוצאה סביר של הקשיים בעבודה עם דגימות רקמה קטנה.
פרוטוקול מפורט זה מדווח שיטה מקיפה הבידוד ישירה של חולדה ממין. על ידי ניתוח זהיר של השסתום, ואחריו סדרה של digestions אנזימטיות, הקורבנות יכולים להיות מבודדת, מועסקים במגוון רחב של טכניקות ניסיוני, כולל ביטוי לתרבות, הסתיידות, ג'ין תא. מודל זה מאוד רלוונטי במבחנה של CAVD יהפכו ללא ספק תרומה חיונית להגדלת הידע שלנו של תהליך פתולוגי.
Protocol
ניסויים בבעלי חיים כל אושרו על ידי הוועדה משתמשים בעלי חיים של רוזאלין המכון, ומתוחזק החיות היו על פי הנחיות משרד הפנים (בריטניה) הטיפול ואת השימוש בבעלי חיים. עבור פרוטוקול המתואר להלן, שימשו חולדות ספראג Dawley 5 - בן שבועיים, זכר.
1. מגיב מתכונים
- הכינו את תרבות בינוני באמצעות מדיום נשר שונה (DMEM) של Dulbecco מזין תערובת F-12 (DMEM/F12). להוסיף 10% לעקר להשבית חום העובר שור סרום (FBS) ו גנטמיצין 1%.
- הכן של הסתיידות בינוני באמצעות תרבות בינוני ו- 2.7 מ"מ Ca/2.5 מ"מ Pi.
- הכן 1 מ' סידן כלורי (2CaCl) על ידי שוקל 555 מ"ג CaCl2 את זה במים מזוקקים מ ל לעשות 5 מ של 1 מ' CaCl2. לסנן את הפתרון דרך מסנן מזרק מיקרומטר 0.22 לחטא את הפתרון.
- להכין 1 מ' סודיום פוספט על ידי שקילה החוצה 710 מ ג נטול מים dibasic סודיום פוספט (נה2HPO4), 600 מ"ג של נטול מים monobasic סודיום פוספט (NaH2PO4), המסת כל אחד בנפרד בכתב מ ל מזוקקים . מים. לשלב 3,870 µL של נה2HPO4 µL 1,130 NaH2PO4, מסנן דרך מסנן מזרק מיקרומטר 0.22 לחטא פתרון.
- הכינו את לשטוף את מאגר המכיל גנטמיצין מאוזנת פתרון מלח (HBSS) ו- 1% של האנק.
2. הכנת למכסה לנתיחה
- לבצע ניתוח כל בשכונה מאוורר, חיטוי בעבר עם 70% אתנול כדי להבטיח עקרות של ריאגנטים ודוגמאות.
- לחטא כלי ניתוח מאת autoclaving שאותם ואחריו הטבעית את תיאורי הכלים בתוך המכיל 70% אתנול לפני השימוש.
- להכין בקבוקונים המכילים שטיפת מאגר, ומשרים בכלי ניתוח במאגר לשטוף לפני בא במגע עם בעל חיים או רקמות. לשמור על המאגר שטיפת על קרח בכל עת.
3. מיצוי של עכברוש ראשי הקורבנות
הערה: עבור פרוטוקול המתואר להלן, חולדות ספראג Dawley 5 - בן שבועיים, זכר שימשו.
- ללקט את החולדות (~ 100 גרם) על ידי נקע בצוואר הרחם לפי הנחיות משרד הפנים בבריטניה.
- שווייץ בלב כל עכברוש, במקום החיה פרקדן על קרש חיתוך זכוכית, לחטא את העור ע י ריסוס עם 70% אתנול.
- עושים חתך 4 ס מ בהאמצע של העכברוש בעזרת מספריים לנתיחה, כדי לחשוף את חלל הבטן, הסר בזהירות את הצלעות והריאות, לחשוף את הלב.
- להסיר את הלב עם זוג של שארפ, מעיין מספריים מעוגלים, ולאחסן בלב ביתור במאגר כביסה קרה קרח עד והניתוחים דוחה כל העכברושים הושלמו.
- לנתח מיקרו-כל לב, ההעברה האחרון לתוך צלחת פטרי מכוסה במאגר לשטוף. חתוך את שריר הלב עם זוג מספריים ישר האביב (6 מ מ להבים) להישאר עם אזור קטן המקיפים של אבי העורקים, את בסיס אב העורקים.
- באמצעות אותו מעיין מספריים ישר (6 מ מ להבים), בזהירות לחתוך של אבי העורקים לכיוון החדר השמאלי ולחשוף העלעלים שסתום אבי העורקים.
- העברת העורקים שנפתח לתוך צלחת פטרי טריים, סטרילי מלא HBSS. שווייץ העלעלים שסתום אבי העורקים, מסומן על ידי הצורה 'U' הייחודית שלהם בבסיס של אבי העורקים, עם Vannas-סוג capsulotomy מיקרו-מספריים (להב 3 מ מ).
- אחסן כל העלעלים 1 מ"ל מאגר כביסה קרה קרח, צינור microcentrifuge 1.5 mL עד והניתוחים כל הושלמו.
- לאחר כל העלעלים נקצצו, centrifuge אותם ב- g x 100 עבור 1 דקות ב 4 ° C כדי להסיר את המאגר לשטוף.
- בצע את השלבים הבאים בשכונה התרבות התא כדי להבטיח עיקור. כדי להסיר את VECs, לעכל את כרוזים 100 µL 425 U/mL collagenase II עבור 5 דקות ב 37 º C. לשבש את תהליך העיכול על ידי בעדינות pipetting למעלה ולמטה באמצעות טיפ פיפטה 200 µL.
- צנטריפוגה ב 100 x g ל 30 s כדי הצניפה העלעלים, ולמחוק את תגובת שיקוע בקפידה. לשטוף פעמיים עם מאגר לשטוף µL 500 ו הצניפה מחדש את התאים על ידי צנטריפוגה-g 100 x עבור 30 s.
- הקציר הקורבנות של העלעלים, לעכל עם 100 µL של collagenase U/mL 425 השני כבר שעתיים ולאחר מכן שחרר הקורבנות על ידי בעדינות pipetting למעלה ולמטה באמצעות טיפ פיפטה 200 µL.
- לדלל את collagenase השני ב 19 מ"ל של תרבות בינונית, צנטריפוגה-g x 670 עבור 5 דקות כדי הצניפה את הקורבנות ופסולת הנותרים שסתום העלעל. למחוק את תגובת שיקוע, ולהעביר פליירים הקורבנות כדי תרבות צלחות/צלוחיות בהתאם (טבלה 1).
- תרבות הקורבנות במשך 5-7 ימים תרבות בינוני, עד confluency ב 37 מעלות צלזיוס, בנוכחות 5% (פחמן דו-חמצני) CO2, שינוי המדיום לאחר 72 h. לשימוש לאחר מכן ניסויים במבחנה , המעבר עד 5 פעמים ברגע confluency מגיע ל 100%.
4. אינדוקציה של הסתיידות של חולדה ממין
הערה: עבור כל הניסויים, לספור תאים עם hemocytometer.
- לבצע כל התא הראשי seeding, passaging בברדסים סטיריליים למניעת זיהום. כדי להתכונן עכברוש ראשי הקורבנות במבחנה הסתיידות ניסויים, זרע את התאים על צפיפות של 150,000 תאים/טוב ב- 6-ובכן צלחות. לשמור על תרבות בינוני עד 90% ≥ confluency (בדרך כלל 72 h).
- לטיפול הקורבנות עם הסתיידות לעומת שליטה בינונית, דגירה ב 37 מעלות צלזיוס, בנוכחות 5% CO2, עבור h 72 נוספים.
- ללמוד החולדה הראשית מסויד הקורבנות עבור ניתוחים במורד הזרם עוקבות, להסיר את המדיום הסתיידות/בקרה ולשטוף את monolayers עם מאגר לשטוף כדי להסיר יונים שאינו מאוגד Ca ו- Pi.
5. עכברוש ויק אפיון
- עבור immunostaining לפקח על סמנים פנוטיפי כגון vimentin וα-SMA, זרע העכברוש הקורבנות-צפיפות של 150,000 תאים/טוב בובכן 6-פלטות המכילות שער גולשת (תאים יגדל על פני פתקי כיסוי), ולהשאיר לגדול עד 50% confluency.
- האחות המדיום תרבות ולתקן את monolayers תא עם 4% paraformaldehyde (PFA) 10 דקות לפני נטילת אותם 3 פעמים בתמיסת פוספט buffered (PBS), למשך 5 דקות בכל פעם.
התראה: PFA הוא רעיל, יש לטפל בזהירות. - דגירה של טפט תא עם מאגר חסימה ו permeabilization (PBS 1 x, 5% של סרום נורמלי מן מאותו המין כמו הנוגדן המשני, 0.3% טריטון X-100) לשעה בטמפרטורת החדר.
- דגירה של monolayers תא עם העכבר anti-vimentin וארנבת נוגדנים anti-α-SMA מדולל במאגר דילול נוגדנים (אלבומין פרה 1% + 0.3% טריטון X-100 ב- PBS) בן לילה 4 ° C, בעדינות רועד על כיסא נדנדה.
הערה: פקדי שלילי כללה עכבר שאינו מצומדת IgG וארנבת IgG, באמצעות של דילולים אותו כמו הבדיקה דוגמאות. - ביום הבא, לשטוף את הנוגדנים ראשי 3 פעמים עם PBS, למשך 5 דקות בכל פעם.
- דגירה של תאים monolayers עם fluorophore מצומדת נוגדנים משניים לשעה בטמפרטורת החדר, מנענע בעדינות על כיסא נדנדה.
- לשטוף 3 פעמים עם PBS, בעדינות tweeze החוצה coverslips (אשר מכילים חולדה ממין) עם זוג מלקחיים ומקום על coverslip המכיל 4', 6-diamidino-2-phenylindole (דאפי). להשאיר את השקופיות כדי לרפא לפחות 24 שעות ב 4 ° C לפני להמחיש עם מיקרוסקופ זריחה.
- לניתוח תספיג, זרע העכברוש הקורבנות-צפיפות של 150,000 תאים/באר היטב 6-פלטות ולהשאיר לצמוח התרבות בינוני עד 100% confluent.
- השתמש µg 8 של חלבון כדי להפעיל תספיג למדוד את הביטוי של CD31, לשלול כל זיהום VEC.
הערה: פרוטוקול סטנדרטי תספיג יושם כפי שתואר לעיל9. - ללימודים ג'ין, לחלץ חומצה ריבונוקלאית (RNA) באמצעות ערכת מסחרי בעקבות הנחיות היצרן.
- להשיג cDNA באמצעות שעתוק במהופך כדי למדוד את הביטוי של גנים היעד באמצעות תגובת שרשרת פולימראזית (PCR), בזמן אמת PCR (RT-PCR; ידוע גם בשם qPCR) עם זיהוי fluorophore ירוק, באמצעות Gapdh כמו הגן הפניה, כמו בעבר תיאר10.
- השתמש התוכנית הבאה לניתוח ה-PCR: 1 מחזור 94 ° C למשך 3 דקות, מחזורים של 94 ° C ל 30 s, 63 ° C ל 30 s, 72 ° C עבור 35 s, ו 1 סוף סוף מחזור 72 מעלות צלזיוס במשך 5 דקות.
- השתמש התוכנית הבאה לניתוח qPCR: 1 מחזור 95 מעלות צלזיוס למשך 10 דקות, 40 מחזורי 95 ° C 15 s, 60 ° C 1 דקות, מחזור נוסף של 95 מעלות צלזיוס במשך 1 דקה, 55 ° C s 30, ו 95 ° C ל 30 s.
- הפעל בג'ל לנתח PCR מוצרים באמצעות ג'ל agarose 2% במאגר טריס/בוראט/EDTA (TBE).
6. עכברוש ויק הסתיידות מחקרים
- עבור Alizarin אדום S ומחקרים ביוכימיים הסתיידות, אנא עקוב אחר ההנחיות seeding, הסתיידות המתוארות בסעיף 4.
- כתם על monolayers תא עם פתרון 5% S Alizarin אדום, נדנדה בעדינות על מטרף, כעשרים דקות. לאחר מכן לשטוף 3 פעמים עם מים מזוקקים, למשך 5 דקות בכל פעם. לרכוש תמונות של כל טוב.
- כדי לכמת את התצהיר Ca, להשתמש ערכת assay Ca הביוכימי. ליץ Ca2 + יונים באמצעות 0.6 מטר חומצת מימן כלורי (HCl) במשך 24 שעות ביממה ב 4 ° C, עם עצבנות עדין.
- לקצור את תגובת שיקוע ולמדוד הריכוז Ca שימוש assay Ca של קיט (ראה טבלה של חומרים) בעקבות הנחיות היצרן.
- חשב את ריכוז הסידן כשבר של חלבון תאית הכולל. Denature הסלולר מהחלבונים monolayers התא עם 0.1 M הידרוקסיד הנתרן (NaOH) + 0.1% נתרן dodecyl סולפט (מרחביות). לקבוע ריכוז החלבון הכולל שימוש של דטרגנט תואם (DC) חלבון assay בעקבות הנחיות היצרן.
תוצאות
המטרה של פרוטוקול זה היה לתאר את ניתוקה של עכברוש ראשי הקורבנות תרבות אותם לניסויים הסתיידות ' במבחנה . על-ידי הפעלת השיטה המתוארת לעיל, חולדה ממין יכול להיות בהצלחה מבודד והתרחבה לצורך המחקר של המנגנונים האחראי על CAVD.
עכברוש ראשי הקורבנות לשפה משותפת עם ויק הוקמה סמנים:
ויק פנוטיפ של תאים מבודדים אושרה דרך immunofluorescence על-ידי בודק סמני ויק: vimentin וα-SMA (אדום וירוק, בהתאמה, איור 1A), הוא מסכים עם דוחות קודמים11,12. הפקדים שלילי נציג באמצעות העכבר שאינם מצומדת וארנבת IgG מוצגים איור 1B. בנוסף, הביטוי של ויק-צמיחה וסת TGFβ-1 ו- TGFβ-2 אושר באמצעות ניתוח ה-PCR (איור 1C). על מנת לאשר כי החולדה מבודד ראשי הקורבנות היו חינם מפני זיהום אנדותל, תספיג ניתוח בוצע כדי לאמת את העכברוש הזה הקורבנות היו שליליות דה מרקר תא אנדותל, CD31, באמצעות כלבים VECs המסתם הדו-צניפי כפקד חיובי ( איור 1D).
Ca ו- Pi זירוז הסתיידות ויק חולדה:
ריכוזים מערכתית Ca ו/או פאי לנהוג בדרך כלל הסתיידות של הקורבנות בתוך חוץ גופית. להעריך את הפוטנציאל הסתיידות של העכברוש מבודד הקורבנות, התאים נחשפו לרמות גבוהות של Ca ו- Pi, המחקות שמוביל פתולוגיים ותנאי היפרפוספטמיה חולי ESRD. טיפול ממין עם 2.7 מ"מ Ca/2.5 מ"מ Pi המושרה הסתיידות, כפי שנקבע על ידי S אדום Alizarin מכתים עבור התצהיר Ca (איור 2 א) וקביעת ערכי צבע מוחלטים של רמות Ca בעקבות HCl שטיפת (קיפול 81; באמצעות הסטודנט t p < 0.05-מבחן; איור 2B).
שינויים ביטוי גנים הקשורים עם הסתיידות ויק:
הסתיידות של כלי דם תאים במבחנה מזוהה עם פרופיל מולקולרית ברורים. במחקר הנוכחי, הטיפול של הקורבנות עם 2.7 מ"מ Ca/2.5 מ"מ Pi המושרה עלייה משמעותית בביטוי mRNA סמנים osteogenic: Msh גנים homeobox 2, Msx2 (קיפול 2.04 השינוי; p < 0.01; איור 3 א), אלקליין פוספטאז, Alpl (קיפול 1.49 השינוי; p < 0.001; איור 3B), ו phosphoethanolamine/phosphocholine פוספטאז, Phospho1 (קיפול 4.7 השינוי; p < 0.01 באמצעות חד-כיווני אנובה; איור 3C). עם זאת, הביטוי של סמן osteogenic, Runx2, הסתיידות מעכב ectonucleotide pyrophasphatase, Enpp1, נותרה ללא שינוי (איור 3D–E).
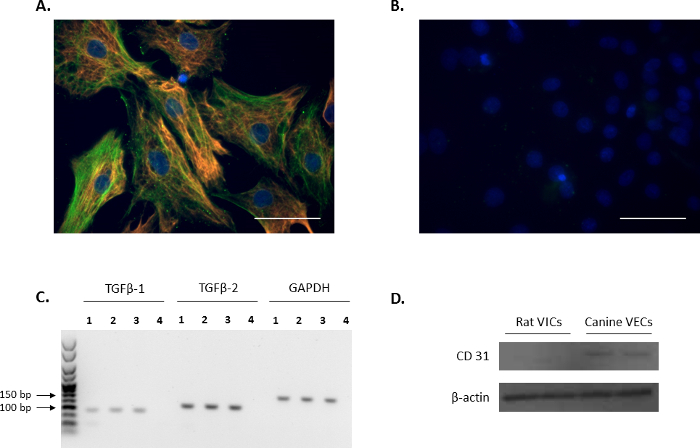
איור 1. הביטוי של סמני ויק. Immunofluorescence (א) מציג מכתים זוגי, colocalization של אקטין שריר חלק-אלפא (α-SMA; ירוק), vimentin בתאים interstitial שסתום (הקורבנות). (B) תמונה ייצוגית של פקדים שליליים באמצעות העכבר וארנב IgG. הגרעינים מוכתמים בצבע כחול באמצעות 4', 6-diamidino-2-phenylindole (דאפי). סרגל קנה מידה = 50 מיקרומטר. (ג) הנוכחות של הפיכת גורם הגדילה בטא 1 (TGFβ-1) ו- TGFβ-2 הקורבנות (מסלולים 1 - 3) כפי שמוצג על ידי ניתוח ה-PCR. ליין 4 היא הפקד מים. ג'ין הפניה בשימוש היה Gapdh. (ד) ניתוח תספיג מראה הביטוי בשפע של CD31 תאי אנדותל הכלבי הדו-צניפי (VECs) בהשוואה אין ביטוי הקורבנות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
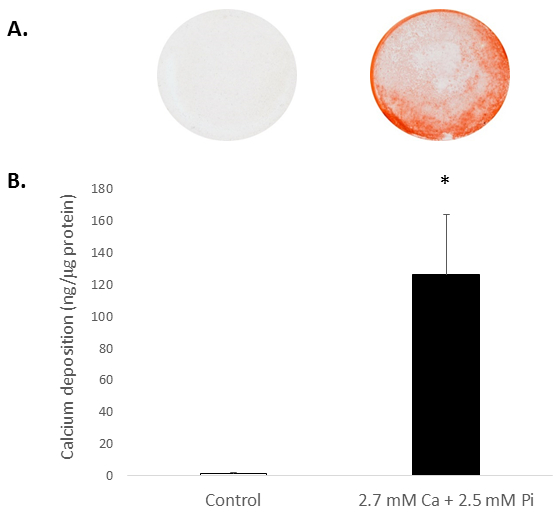
באיור 2. במבחנה הסתיידות של עכברוש הקורבנות. התצהיר Ca בהקורבנות שטופלו 2.7 מ"מ Ca/2.5 מ"מ Pi כפי שנקבע על ידי: צילום (A) מציג S אדום Alizarin מכתים של כל התא monolayers טוב ולאחר קביעת ערכי צבע מוחלטים (B) רמות Ca בעקבות שטיפת HCl. הסטודנט t-הבדיקה בוצעה כדי לנתח את המשמעות בין הקבוצות שני הנתונים. התוצאות מוצגות אומר ± S.E.M. *p < 0.5 לעומת שליטה; (n = 4).
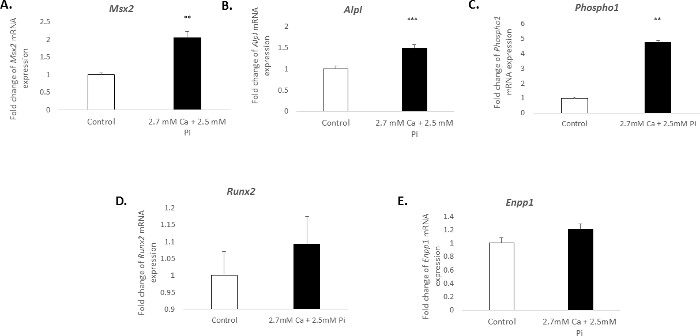
איור 3. שינויים ביטוי גנים הקשורים עם הסתיידות ויק. קיפול שינוי בביטוי ה-mRNA של סמנים osteogenic (א) Msx2(B) Alpl, (ג) Phospho1, (ד) Runx2, (E) Enpp1 של הקורבנות שטופלו 2.7 מ מ Ca/2.5 מ"מ Pi עבור 48 ה mRNA ביטוי מוצג כשינוי קיפול לעומת הגן הפניה אנדוגני Gadph. חד-כיווני אנובה באמצעות כללי מודל ליניארי שילוב השוואות pair-wise בוצעה כדי לנתח את המשמעות בין קבוצות מרובות. התוצאות מוצגות אומר ± S.E.M. * *p < 0.01; p < 0.001 לעומת שליטה; (n = 6). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| מספר העלעלים שסתום | תרבות צלחת/הבקבוק. |
| 9-15 | 1 טוב בצלחת 12-ובכן |
| 15 עד 30 | 1 טוב בצלחת 6-ובכן |
| 30 + | T25 |
טבלה 1- הנחיות כלליות עבור מספר עלונים הדרושות זריעה הראשונית.
Discussion
פרוטוקול מפורט זה מתאר שיטה מעשית עבור הרכישה של עכברוש ראשי הקורבנות, המאפשר את ניתוקה של תאים אלה מן החולדה שסתומי הלב דרך מערכת העיכול אנזימטי. השיטה שלנו נוספת תומכת, מרחיב את השימוש שדווחה בעבר. החולדה במבחנה מודל ללמוד שסתום אבי העורקים הסתיידות13. בידודו של הקורבנות מן שסתום אבי העורקים מציג את פוטנציאל זיהום של VECs השכנה. עם זאת, הנתונים immunofluorescence שלנו מאשרים כי השלב הראשוני עיכול מספיקה להסיר את VECs, עיבוד תאים בודדים שלילי עבור דה מרקר תא אנדותל, CD31. יתר על כן, α-SMA מכתים מאשרת את פנוטיפ מופעל הקורבנות, אשר נדרש עבור הסתיידות12.
ויק ומשום בעבר דווח בחיה גדולה מודלים6,7,8. עם זאת, המינים הללו הם מוגבל על ידי מוגבל גנטית ומולקולרית הכלים הזמינים עבור המחקר במורד הזרם, כמו גם נגישות מוגבלת שלהם במעבדות ברחבי העולם. לעומת זאת, כלים כאלה מבוססים היטב מכרסמים זמינים, ולכן היכולת לבודד חולדה-derived הקורבנות מאפשר תכנון ניסויים קיבולת גדולה יותר. השימוש של הקורבנות של חולדות צעירות גם אומר כי התאים נמצאים יחסית proliferative יותר מאשר עכברים בוגרים, לכן הדורשים פחות חיות להניב יותר תאים. למרות עכברים נגישים בקלות, אבל בגלל עכברים שיש לבבות קטנים במיוחד, הבידוד של העכבר הראשי הקורבנות יהיה אורכת זמן רב ו בעלי חיים הרבה יותר יידרשו כדי לבודד את התשואה זהה של תאים כמודל חולדה.
יתרון משמעותי של גישה זו המתוארת היא כי הקורבנות ניתן לבודד חנותם של פראי סוג העכברים הטרנסגניים, כמו גם חולדה מודלים של מחלות לב וכלי דם ופציעות שסתום. שימוש במודל חולדה ידרוש מספר גדול יותר של בעלי חיים לניסויים בקנה מידה גדול, לכן כדי להפחית את השימוש בבעלי חיים, עכברוש ראשי הקורבנות יכול להיהפך כדי לייצר קו תא ברגע זה גם מאפיין.
בעוד ההשלכות קלינית חמורה של CAVD מזוהים באופן נרחב המנגנונים סיבתי כבסיס טרם להיקבע. בנוסף, מציגים תרופה יעילה טיפולים זה עשוי למנוע ולרפא פוטנציאל הסתיידות שסתום אבי העורקים אינם זמינים. התרבות של הקורבנות תחת calcifying תנאים ולכן מספק מודל מאוד רלוונטי במבחנה של CAVD. אנו מראים כי רמות גבוהות של Ca ו- Pi זירוז הסתיידות במבחנה של מבודדים חולדה ממין עם עלייה והמצוות בביטוי של סמנים ג'ין osteogenic Msx2, Alplו- Phospho1. זה נרחב נוסדה סמנים אלה קשורים עם תהליך פתולוגי של הסתיידות כלי הדם14,15,16. הנתונים שלנו להציג ולכן זו התרבות של החולדה הקורבנות calcifying בינוני דגם המתאים שבו ללמוד שסתום אבי העורקים הסתיידות חוץ גופית בתוך. ואכן, מחקרים שנעשו לאחרונה מן המעבדה שלנו נעזרו מודל זה להפגין Ca מקדמת את שסתום אבי העורקים הסתיידות דרך העשרת Annexin השישי של מטריקס ויק-derived שלפוחית17.
למרות היתרונות של שימוש חולדה ממין ואיפיונן יעיל, כמה מגבלות עדיין קיים. ראשית, גודל האוכלוסייה ויק בתוך חולדה שסתומים הוא קטן מאוד, ולכן בעלי חיים רבים נדרשים על מנת ליצור תא מספיקים ללימודים נרחב במבחנה . עם זאת, ניתן להתגבר על מגבלה זו על-ידי התחייבות מחקרים ראשוניים בקווים תא interstitial מונצחים שסתום, כפי שדווח על ידי אותנו לאחרונה18, לאחר מכן העסקת תרבויות הראשי כדי לוודא ולהרחיב את הממצאים הללו.
לסיכום, השיטה המתוארת מסביר את הבידוד מוצלח, תרבות, הסתיידות של עכברוש ראשי הקורבנות, אשר עשוי להיות לאחר מכן בדקו באמצעות מגוון של ניתוחים כולל מבחני הביוכימי, כמו גם חלבון וניתוחים RNA. מודל זה מציע מערכת אמינה ונוחה בהם לחקור CAVD במבחנה, ומספק כלי רב ערך עבור חוקרים המנגנון המולקולרי האחראי על המחלה ההרסנית הזאת.
Disclosures
המחברים אין לחשוף.
Acknowledgements
נוגדנים CD31 פעם היה מתנה נדיבה של ד ר קארן טאן, באוניברסיטת אדינבורו. מחקר זה נתמך על ידי מימון ביוטכנולוגיה ו ביולוגי מדעי מחקר המועצה (BBSRC), בדמות המכון אסטרטגי תוכנית גרנט (BB/J004316/1; BBS/E/D/20221657) (VEM ו- CF), BB/F023928/1 מלגת נתיב (VEM) של המכון הקריירה, ומימון studentship ויה BBSRC במקרה Studentship BB/K011618/1 (LC).
Materials
| Name | Company | Catalog Number | Comments |
| Dissection scissors | World Precision Instruments | 14393 | Autoclave before use. |
| Spring straight (8 mm blade) | World Precision Instruments | 15905 | Autoclave before use. |
| SuperFine Vannas scissors (5 mm blade, 8 cm) | World Precision Instruments | 14003 | Autoclave before use. |
| Dumont #5 tweezers (11 cm) | World Precision Instruments | 500342 | Autoclave before use. |
| DMEM-F12 | Thermo Fisher Scientific | 11320074 | |
| Foetal bovine serum | Thermo Fisher Scientific | 10500064 | Filter before adding to culture medium. |
| Gentamicin | Thermo Fisher Scientific | 15710049 | |
| Absolute ethanol | Thermo Fisher Scientific | E/0650DF/17 | Dilute to 70% v/v in distilled water. |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | H1150PB17 | Dilute to 0.6M with distilled water. |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | UN1823 | Dilute to 0.1M with distilled water. |
| DAPI | Thermo Fisher Scientific | P36931 | |
| Alexa Fluor 594 goat anti-mouse antibody | Thermo Fisher Scientific | A11005 | 1/250 dilution in antibody dilution buffer. |
| Alexa Fluor 488 donkey anti-rabbit antibody | Thermo Fisher Scientific | A21206 | 1/250 dilution in antibody dilution buffer. |
| Superscript II kit | Thermo Fisher Scientific | 18064014 | |
| dNTP | Thermo Fisher Scientific | 18427013 | |
| Random primers | Thermo Fisher Scientific | P/N58875 | |
| Taq Polymerase kit | Thermo Fisher Scientific | 18038026 | |
| Tris/Borate/EDTA (TBE) | Thermo Fisher Scientific | AM9863 | Dilute to 1x with distlled water, before use. |
| Agarose | Thermo Fisher Scientific | 16500 | 2% in 1x Tris/Borate/EDTA(TBE). |
| Lysis buffer (RIPA) | Thermo Fisher Scientific | 89900 | |
| T75 flask | Thermo Fisher Scientific | 156472 | |
| T175 flask | Thermo Fisher Scientific | 159920 | |
| qPCR plates | Thermo Fisher Scientific | AB0990 | |
| Rat Msx2 primer | Qiagen | QT01084090 | |
| Rat Alpl primer | Qiagen | QT00190680 | |
| Rat Enpp1 primer | Qiagen | QT00181426 | |
| RNeasy minikit | Qiagen | 74104 | |
| 6-well plates | Sigma | CLS3516 | |
| T25 flask | Sigma | CLS430639 | |
| Monobasic phosphate | Sigma | S5011 | |
| Dibasic phosphate | Sigma | S5136 | |
| Calcium chloride | Sigma | C1016 | |
| Sodium dodecyl sulphate (SDS) | Sigma | 5030 | Dilute to 0.1% with 0.1M NaOH. |
| Paraformaldehyde | Sigma | P6148 | Dilute to 4% with PBS. |
| Triton X100 | Sigma | X100 | |
| Bovine serum albumin (BSA) | Sigma | A3059 | |
| Alizarin red S | Sigma | A5533 | Make up to 2% with distilled water, and adjust to pH 4.2. |
| TGFβ-1 primer pair: f: GCTACCATGCCAACTTCTGT r: TGTGTTGGTTGTAGAGGGCA | Sigma | Concentration used: 10 μM | |
| TGFβ-2 primer pair: f: GAAGGCAGAGTTCAGGGTCT r: CGCTGGGTTGGAGATGTTAG | Sigma | Concentration used: 10 μM | |
| Monoclonal Anti-β-Actin−Peroxidase antibody produced in mouse | Sigma | A3854 | 1/50000 dilution in 5% BSA in tris-buffered saline + 0.1% Tween (TBS/T). |
| Mouse anti-vimentin antibody | Sigma | v6389 | 1/900 dilution in antibody dilution buffer (1x phosphate buffered saline (PBS), 1% bovine serum albumin (BSA), 0.3% Triton X-100). |
| Mouse IgG | Sigma | I5381 | Diluted to the same stock concentration as mouse anti-vimentin antibody prior to dilution in antibody dilution buffer. |
| Rabbit IgG | GeneTex | GTX35035 | Diluted to the same stock concentration as rabbit anti-α-smooth muscle actin antibody prior to dilution in antibody dilution buffer. |
| Rabbit anti-α-smooth muscle actin antibody | Abcam | ab5694 | 1/200 dilution in antibody dilution buffer. |
| Rabbit anti-CD31 | Abcam | ab28364 | 1/50 dilution in 5% BSA inTBS/T. |
| HRP-conjugated goat anti-rabbit antibody | Dako | P0448 | 1/3000 dilution in in 5% BSA in TBS/T. |
| Collagenase II | Worthington | 41512862 | Adjust to 425 U/mL with distilled water, and then filter. |
| SYBR green mastermix | Primerdesign | PrecisionPLUS-MX-SY | |
| Calcium assay kit | Randox | CA590 | |
| DC protein assay kit | Bio-Rad | 5000111 | |
| ECL reagent | GE Healthcare | RPN2109 | |
| Hyperfilm ECL | GE Healthcare | 28906837 | |
| Nitrocellulose membrane | GE Healthcare | 10600007 | |
| PCR ladder | Bioline | BIO-33057 | |
| Loading dye for gel electrophoresis | New England Biolabs | B7025S | |
| Syringe filters (0.22 μm) | Merck Millipore | SLGP033RS | |
| Coverslips | Scientific Laboratory Supplies LTD | MIC3100 | |
| Hematocytometer | Marienfeld Superior | 640030 | |
| Name | Company | Catalog Number | Comments |
| Camera set up for Alizarin red images: | |||
| Camera | Nikon D800 | ||
| Lens | Nikon AF_s Micro, Nikko 105 mm, 1:2.8 GED | ||
| Dissection forceps 10 cm, curved ends | World Precision Instruments | 15915 | Autoclave before use. |
References
- Dweck, M. R., Boon, N. a., Newby, D. E. Calcific aortic stenosis: a disease of the valve and the myocardium. J Am Coll Cardiol. 60 (19), 1854-1863 (2012).
- Freeman, R. V., Otto, C. M. Spectrum of calcific aortic valve disease: Pathogenesis, disease progression, and treatment strategies. Circulation. 111, 3316-3326 (2005).
- Mohler, E. R., Gannon, F., Reynolds, C., Zimmerman, R., Keane, M. G., Kaplan, F. S. Bone formation and inflammation in cardiac valves. Circulation. 103 (11), 1522-1528 (2001).
- Monzack, E. L., Masters, K. S. Can valvular interstitial cells become true osteoblasts? A side-by-side comparison. J Heart Valve Dis. 20 (4), 449-463 (2011).
- Osman, L., Yacoub, M. H., Latif, N., Amrani, M., Chester, A. H. Role of human valve interstitial cells in valve calcification and their response to atorvastatin. Circulation. 114 (Suppl 1), (2006).
- Gu, X., Masters, K. S. Role of the Rho pathway in regulating valvular interstitial cell phenotype and nodule formation. Am J Physiol Heart Circ Physiol. 300 (2), H448-H458 (2011).
- Rodriguez, K. J., Masters, K. S. Regulation of valvular interstitial cell calcification by components of the extracellular matrix. J Biomed Mater Res A. 90 (4), 1043-1053 (2009).
- Rattazzi, M., Iop, L., et al. Clones of interstitial cells from bovine aortic valve exhibit different calcifying potential when exposed to endotoxin and phosphate. Arterioscler Thromb Vasc Biol. 28 (12), 2165-2172 (2008).
- Zhu, D., Hadoke, P. W. F., et al. Ablation of the androgen receptor from vascular smooth muscle cells demonstrates a role for testosterone in vascular calcification. Sci Rep. 6 (April), 24807 (2016).
- Zhu, D., Mackenzie, N. C. W., Millan, J. L., Farquharson, C., Macrae, V. E. Upregulation of IGF2 expression during vascular calcification. J Mol Endocrinol. 52 (2), 77-85 (2014).
- Latif, N., Quillon, A., et al. Modulation of human valve interstitial cell phenotype and function using a fibroblast growth factor 2 formulation. PLoS ONE. 10 (6), (2015).
- Liu, A. C., Joag, V. R., Gotlieb, A. I. The emerging role of valve interstitial cell phenotypes in regulating heart valve pathobiology. Am J Pathol. 171 (5), 1407-1418 (2007).
- Katwa, L. C., Ratajska, A., et al. Angiotensin converting enzyme and kininase-II-like activities in cultured valvular interstitial cells of the rat heart. Cardiovasc Res. 29 (1), 57-64 (1995).
- Shao, J. S., Cheng, S. L., Pingsterhaus, J. M., Charlton-Kachigian, N., Loewy, A. P., Towler, D. A. Msx2 promotes cardiovascular calcification by activating paracrine Wnt signals. J Clin Invest. 115, 1210-1220 (2005).
- Mackenzie, N. C. W., Zhu, D., Longley, L., Patterson, C. S., Kommareddy, S., MacRae, V. E. MOVAS-1 cell line: a new in vitro model of vascular calcification. Int J Mol Med. 27, 663-668 (2011).
- Kiffer-Moreira, T., Yadav, M. C., et al. Pharmacological inhibition of PHOSPHO1 suppresses vascular smooth muscle cell calcification. J Bone Miner Res. 28, 81-91 (2013).
- Cui, L., Rashdan, N. A., et al. End stage renal disease-induced hypercalcemia may promote aortic valve calcification via Annexin VI enrichment of valve interstitial cell derived-matrix vesicles. J Cell Physio. , (2017).
- Tsang, H., et al. Exploiting novel valve interstitial cell lines to study calcific aortic valve disease. Mol Med Rep. , (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved