Method Article
原发性大鼠瓣膜间质细胞的分离与鉴定: 主动脉瓣钙化的新模型研究
摘要
该协议描述了大鼠源性瓣膜间质细胞的分离、培养和钙化, 这是一种高度生理学的钙化主动脉瓣病变 (CAVD) 的体外模型。这种大鼠模型的开发有助于 CAVD 研究的细胞和分子机制的基础, 这一复杂的病理过程。
摘要
钙化主动脉瓣疾病 (CAVD) 的特点是逐渐增厚的主动脉瓣小叶。这是一个常见的情况下, 老年人和终末期肾病 (末期) 患者, 谁通常患有高和钙。目前, 没有药物治疗可以阻止其进展。这种病理过程的机制仍然不清楚。主动脉瓣小叶是由一薄层的瓣膜内皮细胞 (内皮) 在外表面的主动脉尖, 与阀间细胞 (受害者) 夹在内皮。使用大鼠模型可以使体外研究的异位钙化的基础上的体内生理血清磷酸盐 (Pi) 和钙 (Ca) 水平的病人谁患有高和钙。所描述的协议详述了一个纯鼠 vic 种群的分离, 表现为 vic 标志物: α-平滑肌肌动蛋白 (α-SMA) 波形和组织生长因子β (TGFβ) 1 和 2, 并没有分化 (CD) 31, VEC标记.通过扩大这些受害者, 生物化学, 遗传学和成像研究可以进行研究和解开的关键调解人托 CAVD。
引言
健康的主动脉瓣由三张小叶组成, 在阀门开闭的过程中, 机械应力的分布是相等的。该阀的小叶有一个定义的结构三不同的层: 丽, 质, 和 ventricularis, 其中房子阀间质细胞 (受害者) 的主要细胞类型。这三层是夹在两个床的瓣膜内皮细胞 (内皮)1。
在钙化主动脉瓣钙化 (CAVD) 的进展中, 受害者在西方世界最常见的心脏瓣膜疾病中起着至关重要的作用。CAVD 被描述为一个渐进的条件, 积极调节的心脏瓣膜组织及其周围微环境。细胞改变最初导致纤维化增厚, 并最终广泛钙化的主动脉瓣小叶。这就导致了严重的主动脉瓣狭窄和最终, 左心室流出梗阻2, 使手术瓣膜置换术成为唯一可行的治疗方法。
CAVD 的病理生理学是复杂的, 但与生理骨矿化的相似机制3。虽然, 一些研究表明, 受害者的能力进行成骨分化和钙化4,5, 支持此过程的机制尚未完全阐明, 突出显示CAVD 的一个可行的和相关的体外模型的关键要求。
以前的工作由许多实验室成功地隔绝了猪和牛模型的受害者, 并且培养了这些细胞在钙化情况下6,7,8。由于主动脉瓣在这些模型中的大尺寸, 通过酶消化分离细胞是非常有效的产生纯细胞群体。然而, 由于大型动物种类的分子工具有限, 这些模型可能会受到限制。相比之下, 啮齿动物模型仍然是有利的, 因为相对较低的成本, 潜在的遗传操作, 以及广泛的分子工具, 是现成的。然而, 从小动物模型中分离出的受害者并没有被广泛使用, 这很可能是在使用小组织标本时遇到的困难的结果。
这份详细的协议报告了一个全面的方法直接隔离大鼠受害者。通过仔细解剖的阀门, 其次是一系列的酶消解, 受害者可以孤立和就业的各种实验技术, 包括细胞培养, 钙化, 和基因表达。这种高度相关的体外模型 CAVD 无疑将对提高我们对这个病理过程的认识做出重要贡献。
研究方案
所有动物实验均经罗斯罗斯研究所动物使用委员会批准, 并按照内政部 (联合王国) 关于动物保育和使用的指导原则予以维持。对于下面所述的协议, 使用了5周大的雄性大大鼠。
1. 试剂配方
- 使用 Dulbecco 的改良鹰培养基 (DMEM) 和营养混合物 F-12 (DMEM/F12) 准备培养基。添加10% 无菌热灭活胎牛血清 (FBS) 和1% 庆大霉素。
- 使用培养基和2.7 毫米钙/2.5 mm Pi 准备钙化培养基。
- 准备1 米氯化钙(CaCl2) 通过称量555毫克的 CaCl2 , 并溶解在5毫升蒸馏水, 使5毫升 1 M CaCl2。通过0.22 µm 注射器过滤器过滤解决方案。
- 通过称量710毫克无水磷酸二钠 (Na2HPO4) 和600毫克无水二磷酸钠 (NaH2PO4), 分别在5毫升蒸馏中溶解, 准备1 米磷酸钠。水.结合3870µL 的 Na2HPO4和1130µL NaH2PO4, 并通过0.22 µm 注射器过滤器进行过滤以杀菌解决方案。
- 准备洗涤缓冲, 其中包含汉克的平衡盐溶液 (HBSS) 和1% 庆大霉素。
2. 解剖罩的准备
- 在通风罩内进行所有夹层, 以前用70% 乙醇消毒, 以确保样品和试剂不育。
- 消毒解剖工具, 灭菌, 然后浸泡在一个烧杯含有70% 乙醇之前使用的工具提示。
- 准备烧杯含洗涤缓冲液, 并在接触到动物或组织之前, 在洗涤缓冲液中浸泡解剖工具。时刻保持洗涤缓冲在冰上。
3. 原发大鼠受害者的提取
注意: 对于下面所述的协议, 使用了5周大的雄性大大鼠。
- 根据英国内政部的指导方针, 将大鼠 (约100克) 按颈椎脱位剔除。
- 要解剖每只老鼠的心脏, 将动物仰卧在玻璃解剖板上, 用70% 乙醇喷洒消毒皮肤。
- 在大鼠中线上做一个4厘米的切口, 借助解剖剪刀, 露出腹腔, 小心地取出胸腔和肺部, 露出心脏。
- 用一双锋利的弯曲的剪刀把心脏移开, 将解剖过的心脏储存在冰冷的洗涤液中, 直到所有大鼠的大体解剖完成。
- 对每颗心脏进行显微解剖, 将后者转化为覆盖在洗涤缓冲液中的培养皿。用一对弹簧直剪刀 (6 mm 刀片) 将心脏肌肉修剪, 将其留在提升主动脉和主动脉根部周围的小区域。
- 使用相同的弹簧直剪刀 (6 毫米刀片), 小心地切开向上主动脉向左心室和暴露主动脉瓣小叶。
- 将开启的主动脉转移到一个充满 HBSS 的新鲜的、无菌的培养皿中。解剖出主动脉瓣小叶, 其独特的 "U" 形在主动脉的基础, 与一对 Vannas 型囊微剪刀 (3 毫米刀片)。
- 将所有的传单存放在1毫升的冰冷洗涤缓冲液中, 在1.5 毫升的离心管中, 直到所有的解剖都完成。
- 一旦所有的小叶都已收获, 离心他们在 100 x g 1 分钟, 在4° c, 以消除洗涤缓冲区。
- 在细胞培养罩中执行后续步骤以确保灭菌。要去除内皮, 消化100µL 425 U/毫升胶原酶 II 的小叶在37° c 5 分钟。用200µL 吸管尖端轻轻移, 扰乱消化。
- 离心机在 100 x g 的三十年代, 以颗粒的传单, 并丢弃上清仔细。洗涤两次与500µL 洗涤缓冲和 re-pellet 细胞由离心在 100 x g 为三十年代。
- 为了从传单中获取受害者, 用100µL 425 U/毫升胶原酶 II 进行2小时的消化, 然后用200µL 吸管尖端轻轻移, 释放受害者。
- 稀释19毫升培养基中的胶原酶 II, 在 670 x g 的离心机上5分钟, 将受害者和剩余的阀门小叶碎片颗粒化。丢弃上清, 并相应地将小叶和受害者转移到培养皿/烧瓶 (表 1)。
- 培养受害者5-7 天在培养基中, 直到70-100 到达在37° c, 在存在 5% (二氧化碳) CO2, 改变媒介在 72 h 以后。为随后在体外实验中使用, 一次高达5次的70-100 达到100%。
4. 诱导大鼠被害人的钙化
注意: 对于所有的实验, 用例计数细胞。
- 在灭菌罩中进行所有原细胞播种和传代, 防止污染。为体外钙化实验准备原发鼠的细胞, 在15万细胞的密度下, 在6井板上播种。保持在培养基中直到≥ 90% 70-100 (通常为72小时)。
- 治疗的受害者与控制介质和孵化在37° c, 在 5% CO2的存在, 额外的72小时。
- 研究钙化的原发大鼠对后续的下游分析, 去除钙化/控制介质, 用洗涤缓冲液冲洗单分子膜, 去除 non-bound 钙和 Pi 离子。
5. 大鼠 VIC 的特征
- 对于免疫监测表型标记, 如波形和α-SMA, 种子的大鼠受害者在密度为15万细胞/井在 6 well-plates 含有盖卡瓦 (细胞将增长的表面上的封面), 并留下来增长, 直到 50% 70-100。
- 吸入培养基, 用4% 甲醛 (粉煤灰) 固定细胞单分子10分钟, 用磷酸缓冲盐 (PBS) 洗涤3次, 每次5分钟。
注意: 粉煤灰是有毒的, 必须小心处理。 - 用阻断和性缓冲液孵育细胞单层 (1x PBS, 5% 的正常血清与第二抗体, 0.3% X-100) 在室温下1小时。
- 用小鼠 anti-vimentin 和兔抗α-SMA 抗体在抗体稀释缓冲液中稀释 (1% 牛血清白蛋白 + 0.3% X-100 在 PBS 中) 过夜, 在4° c 时轻轻摇动摇杆。
注: 阴性对照组包括 non-conjugated 小鼠 igg 和兔 igg, 使用相同的稀释作为测试样本。 - 第二天, 用 PBS 洗掉主抗体3次, 每次5分钟。
- 在室温下, 用荧光共轭的二次抗体孵育细胞单分子, 在摇杆上轻轻摇动1小时。
- 用 PBS 洗涤3次, 并轻轻镊子出片 (其中包含鼠的受害者) 与一对镊子和地方的片包含 4 ", 6-diamidino-2-吲 (DAPI)。在用荧光显微镜进行可视化之前, 在4° c 的时候让幻灯片至少固化24小时。
- 对于西方的印迹分析, 种子的动物在15万细胞的密度/井在 6 well-plates 和离开生长在培养基直到100% 汇合。
- 使用8µg 的蛋白质来运行一个西方的印迹, 以测量 CD31 的表达和排除任何 VEC 污染。
注意: 标准的西方印迹协议遵循了前面描述的9。 - 为基因研究, 提取核糖核酸 (RNA) 使用一个商业套件按照制造商的指南。
- 利用逆转录聚合酶链反应 (pcr) 和 real-time pcr (rt-pcr; 也称为 qPCR) 进行绿色荧光检测, 利用反向转录技术获得 cDNA, 使用Gapdh作为参考基因, 如前所述描述了10。
- 使用以下程序进行 PCR 分析: 1 循环94° c 3 分钟, 30 循环94° c 为三十年代, 63 ° c 为三十年代, 72 ° c 为三十五年代, 和最后1个周期72° c 为 5 min。
- 使用以下程序进行 qPCR 分析: 1 周期95° c 为10分钟, 40 个周期95° c 为十五年代, 60 ° c 为 1 min 和一个另外的周期95° c 为 1 min, 55 ° c 为三十年代和95° c 为三十年代。
- 运行凝胶电泳分析 PCR 产品使用2% 琼脂糖凝胶在三/硼酸盐/EDTA (无) 缓冲。
6. 大鼠 VIC 钙化研究
- 对于茜素红 S 和生物化学钙化研究, 请遵循4节中描述的播种和钙化指南。
- 用5% 茜素红 S 溶液将细胞单分子染色, 轻轻摇动振动筛, 20 分钟。随后用蒸馏水冲洗3次, 每次5分钟。获取每个井的图像。
- 为了量化钙沉积, 使用生化钙化验试剂盒。浸出钙2 +离子使用0.6 米盐酸 (HCl) 为24小时在4° c, 以柔和的鼓动。
- 根据制造商的指导原则, 使用 ca 检测试剂盒 (请参阅材料表) 获取上清液并测量钙浓度。
- 计算钙浓度为总细胞蛋白的一小部分。用0.1 米氢氧化钠 (氢氧化钠) + 0.1% 十二烷基硫酸钠 (SDS) 从细胞膜上变性细胞蛋白。根据制造商的指导方针, 使用洗涤剂相容 (DC) 蛋白质测定法测定总蛋白浓度。
结果
本议定书的目的是描述的原发大鼠的分离和培养他们的体外钙化实验。通过采用上述方法, 可以成功地分离和扩展大鼠受害者, 以便对 CAVD 的机制进行研究。
大鼠主要受害者与已建立的 VIC 标志物进行本地化:
通过对 vic 标记: 波形和α-SMA (分别为红色和绿色,图 1A) 进行检测, 证实了孤立细胞的 vic 表型, 并与以前的报告11,12一致。使用 non-conjugated 小鼠和兔 IgG 的典型阴性对照显示在图 1B中。此外, 使用 PCR 分析 (图 1C) 确认了 VIC 生长调节剂 TGFβ-1 和 TGFβ-2 的表达。为了证实离体大鼠原发患者不受内皮污染, 进行了免疫印迹分析, 以证实大鼠的内皮细胞标记为阴性, CD31, 使用犬二尖瓣内皮作为阳性对照 (图 1D)。
钙和 Pi 诱导大鼠 VIC 钙化:
升高的系统性 Ca 和/或 Pi 浓度通常会促使受害者的钙化体外。为了了解离体大鼠的钙化潜能, 在末期患者中, 细胞暴露于高浓度的 Ca 和 Pi, 模拟病理钙和高条件。以茜素红 S 染色为钙沉积 (图 2A) 和比色法测定盐酸浸出后的钙水平 (81 倍;p < 0.05 使用学生的t测试;图 2B)。
与 VIC 钙化有关的基因表达变化:
血管细胞的钙化在体外与一个独特的分子剖面有关。在本研究中, 对2.7 毫米/2.5 毫米 Pi 的受害者的治疗诱导成骨标记的 mRNA 表达显著增加: Msh 同源 2, Msx2 (2.04 倍变化;p < 0.01;图 3A), 碱性磷酸酶, Alpl (1.49 倍变化;p < 0.001;图 3B) 和乙醇/卵磷脂磷酸酶, Phospho1 (4.7 倍变化;p < 0.01 使用 one-way 方差分析;图 3C)。然而, 成骨标记的表达, Runx2, 和钙化抑制剂 ectonucleotide pyrophasphatase, Enpp1, 保持不变 (图 3D-E)。
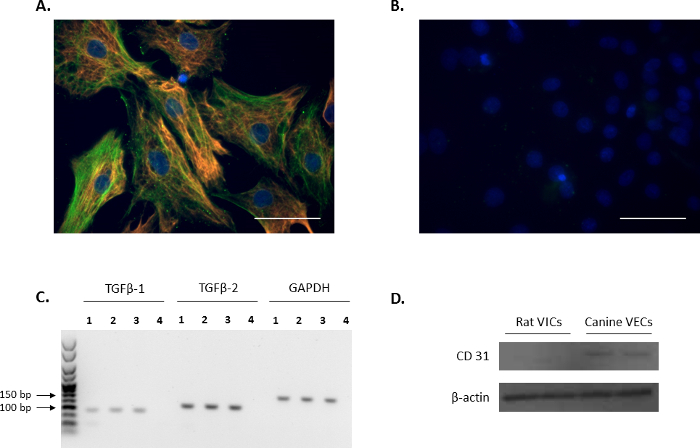
图1。VIC 标记的表达式.(A) 免疫荧光显示双染色和定位的α-平滑肌肌动蛋白 (α-SMA; 绿色) 和波形在瓣膜间质细胞 (受害者)。(B) 使用小鼠和兔 IgG 进行阴性对照的代表性图像。细胞核用蓝色染色, 使用 4 ", 6-diamidino-2-吲 (DAPI)。缩放条 = 50 µm. (C) 有转化生长因子 beta 1 (TGFβ-1) 和TGFβ-2的受害者 (车道 1-3), 如 PCR 分析所示。车道4是水控制。使用的参考基因是Gapdh。(D) 免疫印迹分析显示 CD31 在犬二尖瓣内皮细胞 (内皮) 中的表达非常丰富, 与被害人的表达无差异。请单击此处查看此图的较大版本.
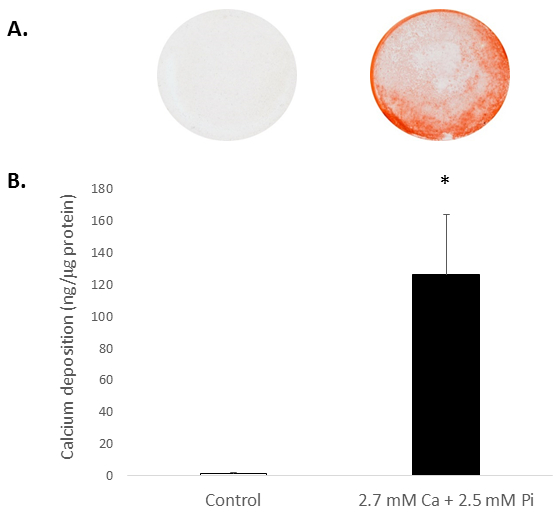
图2。体外大鼠受害者的钙化.用2.7 毫米的钙/2.5 毫米 Pi 进行治疗的受害者的钙沉积, 由: (A) 照片显示在井中的整个细胞膜的茜素红 S 染色, 和 (B) 比盐酸浸出后的钙含量的比色测定。学生的t测试是为了分析两个数据组之间的重要性而进行的。结果显示为平均± S.E.M. *p < 0.5 与控制相比;(n = 4)。
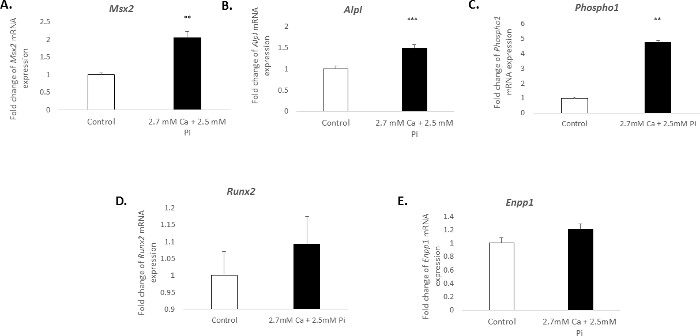
图3。与 VIC 钙化有关的基因表达变化.在成骨标记 (A) Msx2的 mRNA 表达中折叠变化, (B) Alpl, (C) Phospho1, (D) Runx2, 和 (E) Enpp1在使用 2.7 mm Ca/2.5 mm Pi 处理的受害者中48 h. mRNA 表达与内源性参考基因Gadph.采用对比较的一般线性模型进行单向方差分析, 对多组间的意义进行研究。结果显示为平均± S.E.M. **p < 0.01;与控件相比, p < 0.001;(n = 6)。请单击此处查看此图的较大版本.
| 阀门单张数 | 培养板/烧瓶 |
| 9到15 | 1井在12井板 |
| 15到30 | 1井在6井板 |
| 30 + | T25 |
表 1.初步播种所需传单数量的一般准则。
讨论
这一详细的协议描述了一个实际的方法, 以获取主要的大鼠受害者, 使这些细胞从大鼠心脏瓣膜分离酶消化。我们的方法进一步支持和扩大了使用以前报道的大鼠体外模型研究主动脉瓣钙化13。从主动脉瓣膜中分离出的受害者会带来邻近内皮的潜在污染。然而, 我们的免疫荧光数据证实, 初步消化步骤足以消除内皮, 呈现孤立细胞阴性的内皮细胞标记, CD31。此外, α-SMA 染色证实了受害者的活化表型, 这是钙化12所必需的。
维克隔离以前曾在大型动物模型中报告过6,7,8。然而, 这些物种受到有限的遗传和分子工具的限制, 可用于下游研究, 以及它们在世界各地的实验室限制可及性。相比之下, 这种工具在现成的啮齿类动物中得到了很好的建立, 因此, 分离鼠源性受害者的能力使得实验设计能力更强。使用幼鼠的受害者也意味着细胞相对较年长的老鼠更具增殖性, 因此需要较少的动物来产生更多的细胞。虽然小鼠容易接近, 但由于小鼠有明显较小的心脏, 原鼠受害者的隔离将是更费时和相当多的动物将需要隔离相同的细胞产量作为大鼠模型。
这种方法的一个显著优点是, 可以从野外和转基因大鼠, 以及心血管疾病和瓣膜损伤的大鼠模型中分离出受害者。使用大鼠模型将需要大量的动物进行大规模的实验, 因此为了减少动物的使用, 原鼠的受害者可以转化成一个细胞系, 一旦它的特征。
虽然 CAVD 的严重临床影响被广泛承认, 但潜在的致病机制尚未确定。此外, 目前还没有有效的药物治疗方法, 可以预防和潜在治疗主动脉瓣钙化。因此, 在钙化条件下的受害者的文化提供了一个高度相关的体外模型的 CAVD。我们表明, 升高的钙和 Pi 水平诱导的体外孤立大鼠的钙化与相应增加的表达成骨基因标记Msx2, Alpl, 和Phospho1。广泛证实这些标记物与血管钙化的病理过程有关14,15,16。因此, 我们的数据表明, 钙化培养基中大鼠的培养是研究主动脉瓣钙化的合适模型。事实上, 我们的实验室最近的研究已经利用这个模型来证明, 钙促进主动脉瓣钙化通过蛋白 VI 丰富的 VIC 衍生基质囊泡17。
尽管使用大鼠受害者的好处和他们的有效表征, 仍然存在一些局限性。首先, 在大鼠瓣膜中, VIC 的数量是非常小的, 因此需要许多动物来产生足够的细胞数, 以供广泛的体外研究。然而, 有可能克服这一限制, 对永生化阀间质细胞系进行初步研究, 如最近美国的18报告, 并随后使用主要的文化来验证和扩展这些发现。
总之, 所描述的方法解释了成功的分离, 培养, 和钙化的原发大鼠, 可随后评估使用各种分析, 包括生物化学的化验, 以及蛋白质和 RNA 分析。该模型提供了一个可靠和方便的系统, 以调查 CAVD 的在体外, 并提供了一个有价值的工具, 调查的分子机制, 负责这种破坏性疾病。
披露声明
作者没有什么可透露的。
致谢
CD31 抗体是一个慷慨的礼物从 Dr., 爱丁堡大学卡伦谭。这项研究得到了生物技术和生物科学研究理事会 (BBSRC) 以研究所战略方案赠款 (BB/J004316/1) 的形式提供的资助;BBS/E/D/20221657) (VEM 和 CF), 学院职业道路奖学金 BB/F023928/1 (VEM) 和李兆基的资金通过 BBSRC 案例李兆基 BB/K011618/1 (LC)。
材料
| Name | Company | Catalog Number | Comments |
| Dissection scissors | World Precision Instruments | 14393 | Autoclave before use. |
| Spring straight (8 mm blade) | World Precision Instruments | 15905 | Autoclave before use. |
| SuperFine Vannas scissors (5 mm blade, 8 cm) | World Precision Instruments | 14003 | Autoclave before use. |
| Dumont #5 tweezers (11 cm) | World Precision Instruments | 500342 | Autoclave before use. |
| DMEM-F12 | Thermo Fisher Scientific | 11320074 | |
| Foetal bovine serum | Thermo Fisher Scientific | 10500064 | Filter before adding to culture medium. |
| Gentamicin | Thermo Fisher Scientific | 15710049 | |
| Absolute ethanol | Thermo Fisher Scientific | E/0650DF/17 | Dilute to 70% v/v in distilled water. |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | H1150PB17 | Dilute to 0.6M with distilled water. |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | UN1823 | Dilute to 0.1M with distilled water. |
| DAPI | Thermo Fisher Scientific | P36931 | |
| Alexa Fluor 594 goat anti-mouse antibody | Thermo Fisher Scientific | A11005 | 1/250 dilution in antibody dilution buffer. |
| Alexa Fluor 488 donkey anti-rabbit antibody | Thermo Fisher Scientific | A21206 | 1/250 dilution in antibody dilution buffer. |
| Superscript II kit | Thermo Fisher Scientific | 18064014 | |
| dNTP | Thermo Fisher Scientific | 18427013 | |
| Random primers | Thermo Fisher Scientific | P/N58875 | |
| Taq Polymerase kit | Thermo Fisher Scientific | 18038026 | |
| Tris/Borate/EDTA (TBE) | Thermo Fisher Scientific | AM9863 | Dilute to 1x with distlled water, before use. |
| Agarose | Thermo Fisher Scientific | 16500 | 2% in 1x Tris/Borate/EDTA(TBE). |
| Lysis buffer (RIPA) | Thermo Fisher Scientific | 89900 | |
| T75 flask | Thermo Fisher Scientific | 156472 | |
| T175 flask | Thermo Fisher Scientific | 159920 | |
| qPCR plates | Thermo Fisher Scientific | AB0990 | |
| Rat Msx2 primer | Qiagen | QT01084090 | |
| Rat Alpl primer | Qiagen | QT00190680 | |
| Rat Enpp1 primer | Qiagen | QT00181426 | |
| RNeasy minikit | Qiagen | 74104 | |
| 6-well plates | Sigma | CLS3516 | |
| T25 flask | Sigma | CLS430639 | |
| Monobasic phosphate | Sigma | S5011 | |
| Dibasic phosphate | Sigma | S5136 | |
| Calcium chloride | Sigma | C1016 | |
| Sodium dodecyl sulphate (SDS) | Sigma | 5030 | Dilute to 0.1% with 0.1M NaOH. |
| Paraformaldehyde | Sigma | P6148 | Dilute to 4% with PBS. |
| Triton X100 | Sigma | X100 | |
| Bovine serum albumin (BSA) | Sigma | A3059 | |
| Alizarin red S | Sigma | A5533 | Make up to 2% with distilled water, and adjust to pH 4.2. |
| TGFβ-1 primer pair: f: GCTACCATGCCAACTTCTGT r: TGTGTTGGTTGTAGAGGGCA | Sigma | Concentration used: 10 μM | |
| TGFβ-2 primer pair: f: GAAGGCAGAGTTCAGGGTCT r: CGCTGGGTTGGAGATGTTAG | Sigma | Concentration used: 10 μM | |
| Monoclonal Anti-β-Actin−Peroxidase antibody produced in mouse | Sigma | A3854 | 1/50000 dilution in 5% BSA in tris-buffered saline + 0.1% Tween (TBS/T). |
| Mouse anti-vimentin antibody | Sigma | v6389 | 1/900 dilution in antibody dilution buffer (1x phosphate buffered saline (PBS), 1% bovine serum albumin (BSA), 0.3% Triton X-100). |
| Mouse IgG | Sigma | I5381 | Diluted to the same stock concentration as mouse anti-vimentin antibody prior to dilution in antibody dilution buffer. |
| Rabbit IgG | GeneTex | GTX35035 | Diluted to the same stock concentration as rabbit anti-α-smooth muscle actin antibody prior to dilution in antibody dilution buffer. |
| Rabbit anti-α-smooth muscle actin antibody | Abcam | ab5694 | 1/200 dilution in antibody dilution buffer. |
| Rabbit anti-CD31 | Abcam | ab28364 | 1/50 dilution in 5% BSA inTBS/T. |
| HRP-conjugated goat anti-rabbit antibody | Dako | P0448 | 1/3000 dilution in in 5% BSA in TBS/T. |
| Collagenase II | Worthington | 41512862 | Adjust to 425 U/mL with distilled water, and then filter. |
| SYBR green mastermix | Primerdesign | PrecisionPLUS-MX-SY | |
| Calcium assay kit | Randox | CA590 | |
| DC protein assay kit | Bio-Rad | 5000111 | |
| ECL reagent | GE Healthcare | RPN2109 | |
| Hyperfilm ECL | GE Healthcare | 28906837 | |
| Nitrocellulose membrane | GE Healthcare | 10600007 | |
| PCR ladder | Bioline | BIO-33057 | |
| Loading dye for gel electrophoresis | New England Biolabs | B7025S | |
| Syringe filters (0.22 μm) | Merck Millipore | SLGP033RS | |
| Coverslips | Scientific Laboratory Supplies LTD | MIC3100 | |
| Hematocytometer | Marienfeld Superior | 640030 | |
| Name | Company | Catalog Number | Comments |
| Camera set up for Alizarin red images: | |||
| Camera | Nikon D800 | ||
| Lens | Nikon AF_s Micro, Nikko 105 mm, 1:2.8 GED | ||
| Dissection forceps 10 cm, curved ends | World Precision Instruments | 15915 | Autoclave before use. |
参考文献
- Dweck, M. R., Boon, N. a., Newby, D. E. Calcific aortic stenosis: a disease of the valve and the myocardium. J Am Coll Cardiol. 60 (19), 1854-1863 (2012).
- Freeman, R. V., Otto, C. M. Spectrum of calcific aortic valve disease: Pathogenesis, disease progression, and treatment strategies. Circulation. 111, 3316-3326 (2005).
- Mohler, E. R., Gannon, F., Reynolds, C., Zimmerman, R., Keane, M. G., Kaplan, F. S. Bone formation and inflammation in cardiac valves. Circulation. 103 (11), 1522-1528 (2001).
- Monzack, E. L., Masters, K. S. Can valvular interstitial cells become true osteoblasts? A side-by-side comparison. J Heart Valve Dis. 20 (4), 449-463 (2011).
- Osman, L., Yacoub, M. H., Latif, N., Amrani, M., Chester, A. H. Role of human valve interstitial cells in valve calcification and their response to atorvastatin. Circulation. 114 (Suppl 1), (2006).
- Gu, X., Masters, K. S. Role of the Rho pathway in regulating valvular interstitial cell phenotype and nodule formation. Am J Physiol Heart Circ Physiol. 300 (2), H448-H458 (2011).
- Rodriguez, K. J., Masters, K. S. Regulation of valvular interstitial cell calcification by components of the extracellular matrix. J Biomed Mater Res A. 90 (4), 1043-1053 (2009).
- Rattazzi, M., Iop, L., et al. Clones of interstitial cells from bovine aortic valve exhibit different calcifying potential when exposed to endotoxin and phosphate. Arterioscler Thromb Vasc Biol. 28 (12), 2165-2172 (2008).
- Zhu, D., Hadoke, P. W. F., et al. Ablation of the androgen receptor from vascular smooth muscle cells demonstrates a role for testosterone in vascular calcification. Sci Rep. 6 (April), 24807 (2016).
- Zhu, D., Mackenzie, N. C. W., Millan, J. L., Farquharson, C., Macrae, V. E. Upregulation of IGF2 expression during vascular calcification. J Mol Endocrinol. 52 (2), 77-85 (2014).
- Latif, N., Quillon, A., et al. Modulation of human valve interstitial cell phenotype and function using a fibroblast growth factor 2 formulation. PLoS ONE. 10 (6), (2015).
- Liu, A. C., Joag, V. R., Gotlieb, A. I. The emerging role of valve interstitial cell phenotypes in regulating heart valve pathobiology. Am J Pathol. 171 (5), 1407-1418 (2007).
- Katwa, L. C., Ratajska, A., et al. Angiotensin converting enzyme and kininase-II-like activities in cultured valvular interstitial cells of the rat heart. Cardiovasc Res. 29 (1), 57-64 (1995).
- Shao, J. S., Cheng, S. L., Pingsterhaus, J. M., Charlton-Kachigian, N., Loewy, A. P., Towler, D. A. Msx2 promotes cardiovascular calcification by activating paracrine Wnt signals. J Clin Invest. 115, 1210-1220 (2005).
- Mackenzie, N. C. W., Zhu, D., Longley, L., Patterson, C. S., Kommareddy, S., MacRae, V. E. MOVAS-1 cell line: a new in vitro model of vascular calcification. Int J Mol Med. 27, 663-668 (2011).
- Kiffer-Moreira, T., Yadav, M. C., et al. Pharmacological inhibition of PHOSPHO1 suppresses vascular smooth muscle cell calcification. J Bone Miner Res. 28, 81-91 (2013).
- Cui, L., Rashdan, N. A., et al. End stage renal disease-induced hypercalcemia may promote aortic valve calcification via Annexin VI enrichment of valve interstitial cell derived-matrix vesicles. J Cell Physio. , (2017).
- Tsang, H., et al. Exploiting novel valve interstitial cell lines to study calcific aortic valve disease. Mol Med Rep. , (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。