Method Article
Valvola di isolamento e caratterizzazione del ratto primario cellule interstiziali: un nuovo modello per studiare la calcificazione della valvola aortica
In questo articolo
Riepilogo
Questo protocollo descrive l'isolamento, la cultura e la calcificazione delle cellule interstiziali di ratto-derivato valvola, un modello altamente fisiologico in vitro della malattia della valvola aortica calcificante (CAVD). Lo sfruttamento di questo modello di ratto facilita la ricerca di MCVA ad esplorare le cellule e i meccanismi molecolari che sono alla base di questo complesso processo patologico.
Abstract
Malattia della valvola aortica calcifica (CAVD) è caratterizzata dall'ispessimento progressivo degli opuscoli della valvola aortica. È una condizione frequente nei pazienti di malattia renale (ESRD) stadio finale e anziani, che soffrono comunemente l'iperfosfatemia e il hypercalcemia. Allo stato attuale, non esistono farmaci terapie che possono fermare la sua progressione. I meccanismi che sono alla base di questo processo patologico rimangono poco chiari. L'opuscolo della valvola aortica è composto da un sottile strato di cellule endoteliali valvola (VECs) sulle superfici esterne delle cuspidi aortiche, con cellule interstiziali di valvola (VICs) inserite tra la VECs. L'utilizzo di un modello del ratto consente lo Studio in vitro della calcificazione ectopica basato sui livelli di calcio (Ca) dei pazienti che soffrono di iperfosfatemia e il hypercalcemia ed in vivo fosfato sierico fisiopatologici (Pi). Il protocollo descritto dettagli l'isolamento di un ratto puro popolazione VIC, come indicato dall'espressione di marcatori di VIC: alfa-liscia del muscolo actina (α-SMA) il vimentin e tessuto fattore di crescita beta (TGFβ) 1 e 2 e l'assenza di cluster di differenziazione (CD) 31, un VEC marcatore. Espandendo le vittime, gli studi biochimici, genetici e di formazione immagini possono essere eseguiti per studiare e svelare i mediatori chiavi alla base della MCVA.
Introduzione
La valvola aortica sana è composto da tre foglioline, a cui la distribuzione delle sollecitazioni meccaniche durante l'apertura e la chiusura della valvola è equamente ripartita. L'opuscolo della valvola ha una struttura definita di tre strati distinti: il fibrosa e la spongiosa ventricularis, quale casa valvola cellule interstiziali (VICs) come il tipo predominante delle cellule. Questi tre strati sono intramezzati fra due letti di valvola cellule endoteliali (VECs)1.
VICs gioca un ruolo critico nella progressione di calcificante aortica valvola calcificazione (CAVD), la malattia di valvola cardiaca più comune nel mondo occidentale. CAVD è descritto come una condizione progressiva è regolata attivamente il tessuto valvolare e suo microambiente circostante. Cambiamenti cellulari inizialmente causano ispessimento fibrotico e alla fine una vasta calcificazione degli opuscoli della valvola aortica. Questo porta poi a stenosi valvolare aortica significativa e in ultima analisi, lasciato ventricolare di uscita ostruzione2, lasciando la sostituzione chirurgica della valvola come il solo possibile di trattamento.
La fisiopatologia della MCVA è complessa, ma condivide simili meccanismi fisiologici dell'osso mineralizzazione3. Mentre, una serie di studi hanno dimostrato la capacità delle vittime di subire trans-differenziazione osteogenica e calcificazione4,5, i meccanismi alla base di questo processo hanno ancora completamente essere delucidata, evidenziando il requisito fondamentale per un modello fattibile e pertinenti in vitro della MCVA.
Lavoro precedente da un numero di laboratori ha con successo isolato VICs da modelli suini e bovina e coltivato queste cellule sotto condizioni6,7,8di calcificazione. A causa delle grandi dimensioni della valvola aortica in questi modelli, l'isolamento delle cellule tramite digestione enzimatica è stato altamente efficace nel generare puri popolazioni delle cellule. Tuttavia, questi modelli possono essere restrittivi a causa della limitata disponibilità di strumenti molecolari per specie animale di grandi dimensioni. Al contrario, modelli di roditori rimangono vantaggiosi a causa dei costi relativamente ridotti, potenziale per la manipolazione genetica e la vasta gamma di strumenti molecolari che sono prontamente disponibili. Tuttavia, l'isolamento di VICs dai piccoli modelli animali non è ampiamente impiegato, che è una probabile conseguenza delle difficoltà incontrate quando si lavora con piccoli campioni di tessuto.
Questo protocollo dettagliato report un metodo completo per l'isolamento diretto del ratto VICs. Di dissezione accurata della valvola, seguita da una serie di digestioni enzimatiche, VICs può essere isolato e utilizzato in un'ampia varietà di tecniche sperimentali, tra cui l'espressione genica, la calcificazione e la cultura delle cellule. Questo modello altamente pertinenti in vitro della MCVA farà senza dubbio un contributo essenziale per aumentare la nostra conoscenza di questo processo patologico.
Protocollo
Tutti gli esperimenti sugli animali sono stati approvati dal Comitato degli utenti di The Roslin Institute animale, e gli animali sono stati mantenuti conformemente agli orientamenti di Home Office (UK) per la cura e l'uso di animali. Per il protocollo descritto di seguito, sono stati utilizzati 5 - settimana-vecchi, maschi ratti Sprague Dawley.
1. reagente ricette
- Preparare il terreno di coltura utilizzando di Dulbecco per volta Eagle Medium (DMEM) e miscela nutriente F-12 (DMEM/F12). Aggiungere 10% sterilizzata inattivati siero bovino fetale (FBS) e 1% gentamicina.
- Preparare il mezzo di calcificazione utilizzando il terreno di coltura e 2,7 mM Ca/2.5 mM Pi.
- Preparare 1 M di cloruro di calcio (CaCl2) pesando fuori 555 mg di CaCl2 e scioglierlo in 5 mL di acqua distillata per fare 5 mL di 1 M CaCl2. Filtrare la soluzione attraverso un filtro per siringa da 0,22 µm per sterilizzare la soluzione.
- Preparare 1 M di fosfato di sodio pesando 710 mg fosfato di sodio bibasico anidro (Na2HPO4) e 600 mg di sodio fosfato monobasico anidro (NaH2PO4), sciogliendo ciascuno separatamente in 5 mL di acqua distillata acqua. È possibile combinare 3.870 µ l di Na2HPO4 e 1.130 µ l di NaH2PO4e filtro attraverso un filtro per siringa 0,22 µm per sterilizzare la soluzione.
- Preparare il tampone di lavaggio contenente gentamicina soluzione salina bilanciata (HBSS) e 1% di Hank.
2. preparazione della dissezione cappa
- Svolgere tutte le dissezioni in un cappuccio ventilato, precedentemente disinfettate con etanolo al 70% per garantire la sterilità dei campioni e dei reagenti.
- Sterilizzare gli strumenti di dissezione in autoclave che loro seguito immergendo le punte degli strumenti in un becher contenente prima dell'etanolo 70% uso.
- Preparare becher contenente il tampone di lavaggio e immergere gli strumenti di dissezione in tampone di lavaggio prima di venire a contatto con l'animale o tessuti. Tenere il tampone di lavaggio sul ghiaccio in ogni momento.
3. estrazione di VICs primari di ratto
Nota: Per il protocollo descritto di seguito, sono stati utilizzati 5 - settimana-vecchi, maschi ratti Sprague Dawley.
- Abbattere i ratti (~ 100 g) di dislocazione cervicale conformemente alle linee guida UK Home Office.
- Per sezionare il cuore di ogni ratto, posizionare l'animale supina su una tavola di dissezione di vetro e disinfettare la pelle spruzzando con etanolo al 70%.
- Fare un'incisione di 4 cm nel midline del ratto con l'ausilio di forbici per dissezione, per esporre la cavità addominale e rimuovere delicatamente la gabbia toracica e i polmoni, per esporre il cuore.
- Togliere il cuore con un paio di sharp, primavera forbici curve e memorizzare il cuore dissecato nel tampone di lavaggio freddo ghiaccio fino al completamento di tutte le dissezioni lorda dei ratti.
- Per micro-sezionare ogni cuore, trasferimento a quest'ultimo in una capsula Petri coperto nel tampone di lavaggio. Tagliare il muscolo cardiaco con un paio di Forbici rette primavera (lama di 6 mm) per essere lasciato con una piccola area che circonda l'aorta ascendente e la radice aortica.
- Utilizzando lo stesso primavera Forbici rette (lama di 6 mm), accuratamente tagliati aorta ascendente verso il ventricolo sinistro ed esporre gli opuscoli della valvola aortica.
- Trasferire l'aorta aperta in una capsula di Petri fresco, sterile riempito con HBSS. Sezionare gli opuscoli della valvola aortica, contrassegnati dalla loro unica forma di 'U' alla base dell'aorta, con un paio di Allerød-tipo capsulotomy micro-forbici (lama di 3mm).
- Memorizzare tutti i volantini in 1 mL di tampone di lavaggio freddo di ghiaccio, in una provetta da microcentrifuga da 1,5 mL fino al completamento di tutte le dissezioni.
- Una volta che sono state raccolte tutte le foglioline, li Centrifugare a 100 x g per 1 min a 4 ° C per rimuovere il tampone di lavaggio.
- Eseguire i passaggi successivi in una cappa di coltura cellulare per garantire una sterilizzazione. Per rimuovere la VECs, digerire i volantini in 100 µ l 425 U/mL della collagenosi II per 5 min a 37 ° C. Disturbare la digestione pipettando delicatamente su e giù per usare una pipetta 200 µ l.
- Centrifuga a 100 x g per 30 s a pellet gli opuscoli e scartare il surnatante con attenzione. Lavare due volte con 500 µ l di tampone di lavaggio e ri-agglomerare le cellule mediante centrifugazione a 100 x g per 30 s.
- Per raccogliere le vittime da opuscoli, digerire con 100 µ l di collagenasi U/mL 425 II per 2 h e quindi rilasciare il VICs pipettando delicatamente su e giù per usare una pipetta 200 µ l.
- Diluire la collagenosi II in 19 mL di terreno di coltura e centrifugare a 670 x g per 5 min a pellet il VICs e il restante valvola volantino detriti. Eliminare il surnatante e trasferire volantini e VICs a piastre/matracci di cultura di conseguenza (tabella 1).
- Cultura il VICs per 5-7 giorni in terreno di coltura, sino al confluency a 37 ° C, in presenza di 5% (anidride carbonica) CO2, cambiando il mezzo dopo 72 h. Per un utilizzo successivo in esperimenti in vitro , passaggio fino a 5 volte una volta confluenza raggiunge il 100%.
4. induzione di calcificazione del ratto VICs
Nota: Per tutti gli esperimenti, contare le celle con un emocitometro.
- Eseguire tutti i cellulari primarie seeding e passaggio in cappe sterilizzati per evitare la contaminazione. Per preparare VICs primari di ratto in vitro esperimenti di calcificazione, seme le cellule ad una densità di 150.000 cellule/pozzetto in piastre da 6 pozzetti. Mantenere nel terreno di coltura fino al confluency di ≥ 90% (in genere 72 h).
- Trattare le vittime con la calcificazione contro medie di controllo e incubare a 37 ° C, in presenza di 5% CO2, per 72 h.
- Per studiare il ratto primario calcificato VICs per successive analisi successive, rimuovere il mezzo di calcificazione/controllo e lavare i monostrati con tampone di lavaggio per rimuovere gli ioni Ca e Pi non associati.
5. ratto VIC caratterizzazione
- Per immunostaining monitorare per marcatori fenotipici come il vimentin e α-SMA, seme di ratto VICs ad una densità di 150.000 cellule/pozzetto in piastre da 6 pozzetti-contenenti vetrini coprioggetto (cellule crescerà sulla superficie dei vetrini coprioggetto) e lasciate crescere fino al 50% confluency.
- Aspirare il terreno di coltura e fissare i monostrati di cellule umane con paraformaldeide al 4% (PFA) per 10 min prima di lavarli 3 volte con tamponato fosfato salino (PBS), per 5 minuti ogni volta.
Attenzione: PFA è tossico e deve essere maneggiato con cura. - Incubare il monostrato cellulare con blocco e permeabilization buffer (PBS 1X, 5% di siero normale dalla stessa specie come l'anticorpo secondario, 0,3% Triton X-100) per 1 h a temperatura ambiente.
- Incubare i monostrati di cellule con anticorpi anti-vimentin e coniglio topo anti-α-SMA diluiti in tampone di diluizione dell'anticorpo (albumina di siero bovino 1% + 0,3% Triton X-100 in PBS) durante la notte a 4 ° C, agitando delicatamente su un agitatore meccanico.
Nota: Controlli negativi consistevano non coniugato IgG di topo e coniglio IgG, utilizzando le stesse diluizioni dei campioni di prova. - Il giorno successivo, lavare gli anticorpi primari 3 volte con PBS, per 5 minuti ogni volta.
- Incubare i monostrati di cellule con anticorpi secondari coniugati fluoroforo per 1 h a temperatura ambiente, agitando delicatamente su un agitatore meccanico.
- Lavare 3 volte con PBS e tweeze delicatamente fuori i coprioggetti (che contengono ratto VICs) con un paio di pinze e posto su un vetrino coprioggetti contenente 4', 6-diamidino-2-phenylindole (DAPI). Lasciare i vetrini per curare per almeno 24 h a 4 ° C prima di visualizzare con un microscopio a fluorescenza.
- Per l'analisi Western blot, seme il ratto VICs ad una densità di 150.000 cellule/pozzetto in piastre da 6 pozzetti- e lasciare crescere in terreno di coltura fino al 100% confluenti.
- Utilizzare 8 µ g di proteina per eseguire un Western blot per misurare l'espressione di CD31 ed escludere qualsiasi contaminazione di VEC.
Nota: Un protocollo standard Western blot è stato seguito come descritto in precedenza9. - Per gli studi di gene, estrarre l'acido ribonucleico (RNA) utilizzando un kit commerciale seguendo le linee guida del produttore.
- Ottenere cDNA mediante retrotrascrizione a misurare l'espressione dei geni bersaglio usando reazione a catena della polimerasi (PCR) e Real-Time PCR (RT-PCR; anche conosciuto come qPCR) con rilevamento del fluoroforo verde, utilizzando Gapdh come gene di riferimento, come in precedenza descritto10.
- Utilizzare il seguente programma per l'analisi di PCR: 1 ciclo di 94 ° C per 3 min, 30 cicli di 94 ° C per 30 s, 63 ° C per 30 s, 72 ° C per 35 s e infine 1 ciclo di 72 ° C per 5 min.
- Utilizzare il seguente programma per analisi qPCR: 1 ciclo di 95 ° C per 10 min, 40 cicli di 95 ° C per 15 s, 60 ° C per 1 min e un ulteriore ciclo di 95 ° C per 1 min, 55 ° C per 30 s e 95 ° C per 30 s.
- Eseguire un'elettroforesi del gel per analizzare i prodotti di PCR utilizzando un gel di agarosio al 2% in tampone Tris/Borato/EDTA (TBE).
6. ratto VIC calcificazione studi
- Per Alizarin Red S e gli studi biochimici calcificazione, segui le istruzioni di semina e la calcificazione descritte nella sezione 4.
- Macchiare i monostrati di cellule umane con soluzione al 5%, colore rosso di alizarina S, delicatamente a dondolo su un agitatore, per 20 min. Successivamente lavare 3 volte con acqua distillata, per 5 minuti ogni volta. Acquisire immagini di ciascun pozzetto.
- Per quantificare la deposizione di Ca, utilizzare un kit di test biochimici di Ca. Leach ioni di Ca2 + 0,6 M acido cloridrico (HCl) per 24 h a 4 ° C, con agitazione delicata.
- Raccogliere il surnatante e misura la concentrazione di Ca usando un'analisi Ca kit (Vedi Tabella materiali) seguendo le linee guida del produttore.
- Calcolare la concentrazione di calcio come una frazione delle proteine cellulari totali. Denaturare le proteine cellulari da monostrati di cellule umane con 0,1 M di idrossido di sodio (NaOH) + 0,1% di sodio dodecil solfato (SDS). Determinare la concentrazione di proteine totali utilizzando un detergente compatibile saggio delle proteine (DC) seguendo le linee guida del produttore.
Risultati
L'obiettivo di questo protocollo era di descrivere l'isolamento del ratto primario VICs e loro cultura per gli esperimenti in vitro di calcificazione. Impiegando il metodo sopra descritto, ratto VICs possa essere correttamente isolato e ampliato per lo studio dei meccanismi responsabili della MCVA.
Ratto primario VICs colocalizzano con gli indicatori stabiliti VIC:
Il fenotipo di VIC di cellule isolate è stato confermato mediante immunofluorescenza tramite sondaggio per i marcatori di VIC: vimentin e α-SMA (rosso e verde, rispettivamente, Figura 1A) ed è in accordo con precedenti rapporti11,12. I controlli negativi rappresentante utilizzando il mouse non coniugato e coniglio IgG sono mostrati in Figura 1B. Inoltre, l'espressione del regolatore di VIC-crescita TGFβ-1 e del TGFβ-2 è stata confermata usando l'analisi di PCR (Figura 1). Al fine di confermare che il ratto isolato primario VICs erano esenti da contaminazione endoteliale, l'analisi Western blot è stato effettuato per verificare quel ratto VICs erano negativi per il marcatore delle cellule endoteliali, CD31, utilizzando canini VECs mitrale come controllo positivo ( Figura 1).
CA e Pi indurre calcificazione VIC Rat:
Elevate concentrazioni di Ca e/o Pi sistemiche in genere l'unità la calcificazione di VICs in vitro. Per apprezzare il potenziale di calcificazione del ratto isolato VICs, le cellule sono state esposte a livelli elevati di Ca e Pi, che mimano condizioni patologiche di ipercalcemia ed iperfosfatemia nei pazienti con ESRD. Trattamento di VICs con 2,7 mM Ca/2.5 mM Pi ha indotto la calcificazione, come determinato da Alizarin Red S macchiatura per deposizione di Ca (Figura 2A) e la determinazione colorimetrica dei livelli di Ca seguendo HCl lisciviazione (81 ovile; p < 0,05 utilizzando di Student t-Test; Figura 2B).
Cambiamenti di espressione del gene connessi con la calcificazione di VIC:
La calcificazione delle cellule vascolari in vitro è associata un profilo molecolare distinto. Nello studio presente, il trattamento di VICs con 2,7 mM Ca/2.5 mM Pi ha indotto un significativo aumento dell'espressione di mRNA dei marcatori osteogenici: Msh homeobox 2, Msx2 (2,04 piega cambia; p < 0.01; Figura 3A), fosfatasi alcalina, Alpl (1,49 piega cambia; p < 0,001; Figura 3B) e phosphoethanolamine/fosfocolina fosfatasi, Phospho1 (4,7 piega cambia; p < 0.01 usando il One-way ANOVA; Figura 3). Tuttavia, l'espressione del marcatore osteogenica, Runx2e calcificazione inibitore ectonucleotide pyrophasphatase, Enpp1, è rimasto invariato (Figura 3D–E).
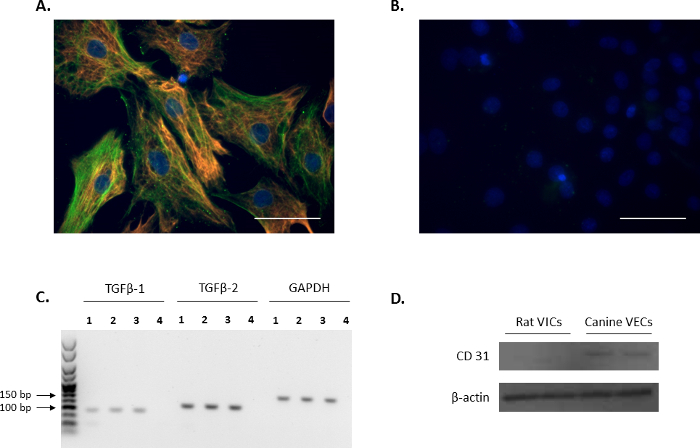
Figura 1. Espressione di marcatori di VIC. (A) immunofluorescenza mostrando doppia colorazione e colocalizzazione di actina alfa-liscia del muscolo (α-SMA; verde) e il vimentin in cellule interstiziali valvola (VICs). (B) immagine rappresentativa di controlli negativi utilizzando il mouse e coniglio IgG. Nuclei sono colorati in blu utilizzando 4', 6-diamidino-2-phenylindole (DAPI). Barra della scala = 50 µm. (C) la presenza di trasformare growth factor beta 1 (TGFβ-1) e TGFβ-2 in VICs (corsie 1 - 3) Come indicato dall'analisi PCR. 4 Lane è il controllo dell'acqua. Gene di riferimento utilizzato è stato Gapdh. (D) analisi di Western blot mostrando l'espressione abbondante di CD31 in cellule endoteliali canini della valvola mitrale (VECs) rispetto ad alcuna espressione in VICs. Clicca qui per visualizzare una versione più grande di questa figura.
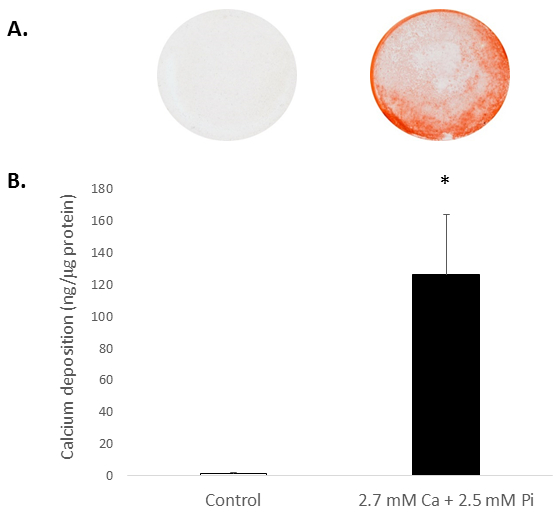
Nella figura 2. In vitro la calcificazione del ratto VICs. Deposizione di CA in VICs trattati con 2,7 mM Ca/2.5 mM Pi come determinato da: (A) una fotografia che mostra Alizarin Red S macchiatura di monostrati di cellule intere nel pozzo e (B) determinazione colorimetrica dei livelli di Ca seguendo HCl lisciviazione. Di Student t-test è stato eseguito per analizzare il significato tra i gruppi di due dati. I risultati sono presentati come media ± s.e.m. *p < 0,5 rispetto a controllo; (n = 4).
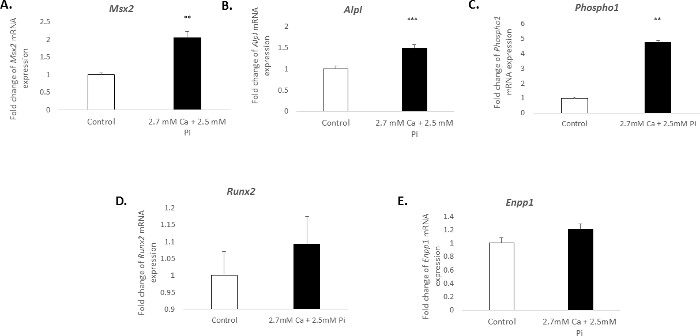
Figura 3. Cambiamenti di espressione genica associati con la calcificazione VIC. Fold cambiare nell'espressione di mRNA di marcatori osteogenici (A) Msx2, (B) Alpl, (C) Phospho1, (D) Runx2, e (E) Enpp1 in VICs trattati con 2,7 mM Ca/2.5 mM Pi per espressione di mRNA di 48 h. è indicato come un cambiamento di piega rispetto al gene endogeno riferimento Gadph. One-way ANOVA utilizzando il modello generale lineare, incorporando i confronti Pair-Wise è stato effettuato per analizzare il significato tra più gruppi. I risultati sono presentati come media ± s.e.m. * *p < 0.01; p < 0,001 rispetto al controllo; (n = 6). Clicca qui per visualizzare una versione più grande di questa figura.
| Numero degli opuscoli della valvola | Piastra/matraccio di cultura |
| da 9 a 15 | 1 bene in 12 pozzetti |
| 15-30 | 1 bene in piastra a 6 pozzetti |
| 30 + | T25 |
Tabella 1. Linee guida generali per il numero di volantini obbligatorio per il seeding iniziale.
Discussione
Questo protocollo dettagliato descrive un metodo pratico per l'acquisizione del ratto primario VICs, consentendo l'isolamento di queste cellule da valvole cardiache ratto tramite digestione enzimatica. Il nostro metodo ulteriormente supporta ed estende l'utilizzo di un modello in vitro di ratto precedentemente segnalati per lo studio della valvola aortica calcificazione13. L'isolamento di VICs dalla valvola aortica introduce il potenziale per contaminazione da vicini VECs. Tuttavia, i nostri dati di immunofluorescenza confermano che la fase di digestione iniziale è sufficiente rimuovere la VECs, rendendo le cellule isolate negativo per il marcatore delle cellule endoteliali, CD31. Inoltre, α-SMA macchiatura conferma il fenotipo attivato le vittime, che è richiesto per calcificazione12.
Gli isolamenti VIC precedentemente sono stati segnalati modelli animali grandi6,7,8. Tuttavia, queste specie sono vincolate dagli strumenti genetici e molecolari limitati disponibili per studio a valle, come pure la loro limitata accessibilità nei laboratori di tutto il mondo. Al contrario, tali strumenti sono ben stabiliti nei roditori prontamente disponibili e di conseguenza, la capacità di isolare ratto-derivato consente di VICs una maggiore capacità di disegno sperimentale. L'uso di VICs dai giovani ratti significa anche che le cellule sono relativamente più proliferative rispetto più vecchi ratti, richiedendo quindi meno animali per produrre più cellule. Anche se i topi sono facilmente accessibili, ma a causa di topi avendo in particolare piccoli cuori, l'isolamento del mouse primario VICs sarebbe più che richiede tempo e notevolmente più animali sarebbero tenuti a isolare la stessa resa delle cellule come modello del ratto.
Un notevole vantaggio di questo approccio è che VICs può essere isolato temporaneamente da wild-type e ratti transgenici, nonché modelli del ratto di lesioni valvola e malattia cardiovascolare. Utilizzando il modello di ratto richiederebbe un numero maggiore di animali per esperimenti su larga scala, quindi di ridurre l'uso di animali, del ratto primario VICs possa essere trasformato per produrre una linea cellulare una volta che è stato caratterizzato bene.
Mentre le gravi implicazioni cliniche della MCVA sono ampiamente riconosciute, i sottostanti meccanismi causativi sono ancora essere determinati. Inoltre, farmaci efficaci terapie che possono prevenire e curare potenzialmente calcificazione della valvola aortica non sono disponibili a presentare. La cultura di VICs sotto condizioni di calcificazione pertanto fornisce un modello altamente pertinenti in vitro del MCVA. Ci indicano che i livelli elevati di Ca e Pi inducono la calcificazione in vitro di VICs isolati del ratto con un concomitante aumento dell'espressione di marcatori osteogenica gene Msx2, Alple Phospho1. È ampiamente stabilito che questi indicatori sono associati con il processo patologico di calcificazione vascolare14,15,16. I nostri dati indicano pertanto che la cultura del ratto VICs nel mezzo di calcificazione è un modello appropriato con cui studiare di calcificazione della valvola aortica in vitro. Infatti, studi recenti dal nostro laboratorio hanno utilizzato questo modello per dimostrare che Ca promuove la calcificazione della valvola aortica con arricchimento di Annexin VI di VIC-derivato matrice vescicole17.
Nonostante i vantaggi dell'utilizzo del ratto VICs e loro caratterizzazione efficiente, esistono ancora alcune limitazioni. In primo luogo, la dimensione della popolazione di VIC entro valvole di ratto è molto piccola, e di conseguenza molti animali sono necessari al fine di generare sufficiente numeri di cell per esteso in vitro studi. Tuttavia, è possibile superare questa limitazione di studi preliminari di impresa nelle linee interstiziale delle cellule immortalizzate valvola, come recentemente segnalato da noi18e successivamente impiegando colture primarie per verificare ed estendono questi risultati.
In sintesi, il metodo descritto spiega il successo isolamento, la cultura e la calcificazione del ratto primario VICs, che può essere successivamente valutati usando una varietà di analisi compreso analisi biochimiche, come pure della proteina e analisi di RNA. Questo modello offre un sistema affidabile e conveniente in cui investigare MCVA in vitroe fornisce un valido strumento per indagare i meccanismi molecolari responsabili di questa malattia distruttiva.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
CD31 anticorpo utilizzato era un dono generoso da Dr. Karen Tan, Università di Edimburgo. Questo studio è stato sostenuto da finanziamenti dalla biotecnologia e Biological Sciences Research Council (BBSRC) sotto forma di una sovvenzione di programma strategico Institute (BB/J004316/1; BBS/E/D/20221657) (VEM e CF), un Istituto carriera percorso Fellowship BB/F023928/1 (VEM) e studentship finanziamenti tramite un caso BBSRC Studentship BB/K011618/1 (LC).
Materiali
| Name | Company | Catalog Number | Comments |
| Dissection scissors | World Precision Instruments | 14393 | Autoclave before use. |
| Spring straight (8 mm blade) | World Precision Instruments | 15905 | Autoclave before use. |
| SuperFine Vannas scissors (5 mm blade, 8 cm) | World Precision Instruments | 14003 | Autoclave before use. |
| Dumont #5 tweezers (11 cm) | World Precision Instruments | 500342 | Autoclave before use. |
| DMEM-F12 | Thermo Fisher Scientific | 11320074 | |
| Foetal bovine serum | Thermo Fisher Scientific | 10500064 | Filter before adding to culture medium. |
| Gentamicin | Thermo Fisher Scientific | 15710049 | |
| Absolute ethanol | Thermo Fisher Scientific | E/0650DF/17 | Dilute to 70% v/v in distilled water. |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | H1150PB17 | Dilute to 0.6M with distilled water. |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | UN1823 | Dilute to 0.1M with distilled water. |
| DAPI | Thermo Fisher Scientific | P36931 | |
| Alexa Fluor 594 goat anti-mouse antibody | Thermo Fisher Scientific | A11005 | 1/250 dilution in antibody dilution buffer. |
| Alexa Fluor 488 donkey anti-rabbit antibody | Thermo Fisher Scientific | A21206 | 1/250 dilution in antibody dilution buffer. |
| Superscript II kit | Thermo Fisher Scientific | 18064014 | |
| dNTP | Thermo Fisher Scientific | 18427013 | |
| Random primers | Thermo Fisher Scientific | P/N58875 | |
| Taq Polymerase kit | Thermo Fisher Scientific | 18038026 | |
| Tris/Borate/EDTA (TBE) | Thermo Fisher Scientific | AM9863 | Dilute to 1x with distlled water, before use. |
| Agarose | Thermo Fisher Scientific | 16500 | 2% in 1x Tris/Borate/EDTA(TBE). |
| Lysis buffer (RIPA) | Thermo Fisher Scientific | 89900 | |
| T75 flask | Thermo Fisher Scientific | 156472 | |
| T175 flask | Thermo Fisher Scientific | 159920 | |
| qPCR plates | Thermo Fisher Scientific | AB0990 | |
| Rat Msx2 primer | Qiagen | QT01084090 | |
| Rat Alpl primer | Qiagen | QT00190680 | |
| Rat Enpp1 primer | Qiagen | QT00181426 | |
| RNeasy minikit | Qiagen | 74104 | |
| 6-well plates | Sigma | CLS3516 | |
| T25 flask | Sigma | CLS430639 | |
| Monobasic phosphate | Sigma | S5011 | |
| Dibasic phosphate | Sigma | S5136 | |
| Calcium chloride | Sigma | C1016 | |
| Sodium dodecyl sulphate (SDS) | Sigma | 5030 | Dilute to 0.1% with 0.1M NaOH. |
| Paraformaldehyde | Sigma | P6148 | Dilute to 4% with PBS. |
| Triton X100 | Sigma | X100 | |
| Bovine serum albumin (BSA) | Sigma | A3059 | |
| Alizarin red S | Sigma | A5533 | Make up to 2% with distilled water, and adjust to pH 4.2. |
| TGFβ-1 primer pair: f: GCTACCATGCCAACTTCTGT r: TGTGTTGGTTGTAGAGGGCA | Sigma | Concentration used: 10 μM | |
| TGFβ-2 primer pair: f: GAAGGCAGAGTTCAGGGTCT r: CGCTGGGTTGGAGATGTTAG | Sigma | Concentration used: 10 μM | |
| Monoclonal Anti-β-Actin−Peroxidase antibody produced in mouse | Sigma | A3854 | 1/50000 dilution in 5% BSA in tris-buffered saline + 0.1% Tween (TBS/T). |
| Mouse anti-vimentin antibody | Sigma | v6389 | 1/900 dilution in antibody dilution buffer (1x phosphate buffered saline (PBS), 1% bovine serum albumin (BSA), 0.3% Triton X-100). |
| Mouse IgG | Sigma | I5381 | Diluted to the same stock concentration as mouse anti-vimentin antibody prior to dilution in antibody dilution buffer. |
| Rabbit IgG | GeneTex | GTX35035 | Diluted to the same stock concentration as rabbit anti-α-smooth muscle actin antibody prior to dilution in antibody dilution buffer. |
| Rabbit anti-α-smooth muscle actin antibody | Abcam | ab5694 | 1/200 dilution in antibody dilution buffer. |
| Rabbit anti-CD31 | Abcam | ab28364 | 1/50 dilution in 5% BSA inTBS/T. |
| HRP-conjugated goat anti-rabbit antibody | Dako | P0448 | 1/3000 dilution in in 5% BSA in TBS/T. |
| Collagenase II | Worthington | 41512862 | Adjust to 425 U/mL with distilled water, and then filter. |
| SYBR green mastermix | Primerdesign | PrecisionPLUS-MX-SY | |
| Calcium assay kit | Randox | CA590 | |
| DC protein assay kit | Bio-Rad | 5000111 | |
| ECL reagent | GE Healthcare | RPN2109 | |
| Hyperfilm ECL | GE Healthcare | 28906837 | |
| Nitrocellulose membrane | GE Healthcare | 10600007 | |
| PCR ladder | Bioline | BIO-33057 | |
| Loading dye for gel electrophoresis | New England Biolabs | B7025S | |
| Syringe filters (0.22 μm) | Merck Millipore | SLGP033RS | |
| Coverslips | Scientific Laboratory Supplies LTD | MIC3100 | |
| Hematocytometer | Marienfeld Superior | 640030 | |
| Name | Company | Catalog Number | Comments |
| Camera set up for Alizarin red images: | |||
| Camera | Nikon D800 | ||
| Lens | Nikon AF_s Micro, Nikko 105 mm, 1:2.8 GED | ||
| Dissection forceps 10 cm, curved ends | World Precision Instruments | 15915 | Autoclave before use. |
Riferimenti
- Dweck, M. R., Boon, N. a, Newby, D. E. Calcific aortic stenosis: a disease of the valve and the myocardium. J Am Coll Cardiol. 60 (19), 1854-1863 (2012).
- Freeman, R. V., Otto, C. M. Spectrum of calcific aortic valve disease: Pathogenesis, disease progression, and treatment strategies. Circulation. 111, 3316-3326 (2005).
- Mohler, E. R., Gannon, F., Reynolds, C., Zimmerman, R., Keane, M. G., Kaplan, F. S. Bone formation and inflammation in cardiac valves. Circulation. 103 (11), 1522-1528 (2001).
- Monzack, E. L., Masters, K. S. Can valvular interstitial cells become true osteoblasts? A side-by-side comparison. J Heart Valve Dis. 20 (4), 449-463 (2011).
- Osman, L., Yacoub, M. H., Latif, N., Amrani, M., Chester, A. H. Role of human valve interstitial cells in valve calcification and their response to atorvastatin. Circulation. 114 (Suppl 1), (2006).
- Gu, X., Masters, K. S. Role of the Rho pathway in regulating valvular interstitial cell phenotype and nodule formation. Am J Physiol Heart Circ Physiol. 300 (2), H448-H458 (2011).
- Rodriguez, K. J., Masters, K. S. Regulation of valvular interstitial cell calcification by components of the extracellular matrix. J Biomed Mater Res A. 90 (4), 1043-1053 (2009).
- Rattazzi, M., Iop, L., et al. Clones of interstitial cells from bovine aortic valve exhibit different calcifying potential when exposed to endotoxin and phosphate. Arterioscler Thromb Vasc Biol. 28 (12), 2165-2172 (2008).
- Zhu, D., Hadoke, P. W. F., et al. Ablation of the androgen receptor from vascular smooth muscle cells demonstrates a role for testosterone in vascular calcification. Sci Rep. 6 (April), 24807(2016).
- Zhu, D., Mackenzie, N. C. W., Millan, J. L., Farquharson, C., Macrae, V. E. Upregulation of IGF2 expression during vascular calcification. J Mol Endocrinol. 52 (2), 77-85 (2014).
- Latif, N., Quillon, A., et al. Modulation of human valve interstitial cell phenotype and function using a fibroblast growth factor 2 formulation. PLoS ONE. 10 (6), (2015).
- Liu, A. C., Joag, V. R., Gotlieb, A. I. The emerging role of valve interstitial cell phenotypes in regulating heart valve pathobiology. Am J Pathol. 171 (5), 1407-1418 (2007).
- Katwa, L. C., Ratajska, A., et al. Angiotensin converting enzyme and kininase-II-like activities in cultured valvular interstitial cells of the rat heart. Cardiovasc Res. 29 (1), 57-64 (1995).
- Shao, J. S., Cheng, S. L., Pingsterhaus, J. M., Charlton-Kachigian, N., Loewy, A. P., Towler, D. A. Msx2 promotes cardiovascular calcification by activating paracrine Wnt signals. J Clin Invest. 115, 1210-1220 (2005).
- Mackenzie, N. C. W., Zhu, D., Longley, L., Patterson, C. S., Kommareddy, S., MacRae, V. E. MOVAS-1 cell line: a new in vitro model of vascular calcification. Int J Mol Med. 27, 663-668 (2011).
- Kiffer-Moreira, T., Yadav, M. C., et al. Pharmacological inhibition of PHOSPHO1 suppresses vascular smooth muscle cell calcification. J Bone Miner Res. 28, 81-91 (2013).
- Cui, L., Rashdan, N. A., et al. End stage renal disease-induced hypercalcemia may promote aortic valve calcification via Annexin VI enrichment of valve interstitial cell derived-matrix vesicles. J Cell Physio. , (2017).
- Tsang, H., et al. Exploiting novel valve interstitial cell lines to study calcific aortic valve disease. Mol Med Rep. , In press (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon