A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
باستخدام تصوير الشبكية لدراسة الخرف
In This Article
Summary
أبرز أوجه التشابه مع الدماغ الشبكية وهكذا يمثل نافذة فريدة لدراسة المفرج وهيكل الخلايا العصبية في الدماغ غير إينفاسيفيلي. ويصف هذا البروتوكول وسيلة لدراسة استخدام تقنيات التصوير الشبكية الخرف. يحتمل أن يمكن أن تساعد هذه الطريقة في تشخيص وتقييم المخاطر للعته.
Abstract
يقدم الشبكية "نافذة" فريدة من نوعها دراسة العمليات الفيزيولوجية المرضية الخرف في الدماغ، كما أنها تعد امتداداً للجهاز العصبي المركزي (CNS) وأبرز أوجه التشابه مع الدماغ من حيث المنشأ الجنينية، الخصائص التشريحية و الخصائص الفسيولوجية. ويمكن الآن هيكل الخلايا العصبية والأوعية الدموية في شبكية العين الشبكية تصور بسهولة وغير إينفاسيفيلي استخدام تقنيات التصوير، بما في ذلك التصوير الفوتوغرافي النظارة والتصوير المقطعي التماسك الضوئية (أكتوبر)، وكمياً شبه تلقائياً باستخدام برامج الحاسوب تحليل. دراسة الاقترانات بين تغيرات الأوعية الدموية والخلايا العصبية في الشبكية والخرف يمكن تحسين فهمنا للعته، ويحتمل أن المعونة في تشخيص وتقييم المخاطر. ويهدف هذا البروتوكول لوصف أسلوب القياس الكمي وتحليل المفرج الشبكية وهيكل الخلايا العصبية، التي يحتمل أن تكون مرتبطة بالعته. هذا البروتوكول كما يوفر أمثلة على التغيرات الشبكية في المواضيع مع الخرف، ويناقش القضايا التقنية والقيود الحالية لتصوير الشبكية.
Introduction
ونظرا للزيادات في متوسط العمر المتوقع، الخرف قد أصبح مشكلة طبية الرئيسية، والمساهمة الاجتماعية الهامة والصحة الاقتصادية عبء عالمياً1،2،3،،من45. اليوم، أي شخص في الولايات المتحدة تطور مرض الزهايمر (AD)، الشكل الأكثر شيوعاً للعته، كل s 666. ويقدر أن 115 مليون شخص بحلول عام 2050، سوف تتأثر بإعلان7.
ويقدم الشبكية "نافذة" فريدة من نوعها لدراسة الخرف بسبب خصائصه التشريحية والفسيولوجية مماثلة مع الدماغ. فيما يتعلق بالمفرج والشرايين الشبكية والاوردة، قياس 100 إلى 300 ميكرون في القطر، وسمات مماثلة مع الأوعية الدماغية الصغيرة، مثل نهاية الشرايين دون أناستوموسيس، ووظيفة الحاجز، والسيارات-البند8، 9-فيما يتعلق بهيكل الخلايا العصبية، الخلايا ganglionic الشبكية (رجكس) مشاركة الخصائص النموذجية مع الخلايا العصبية في الجهاز العصبي المركزي (CNS) 10. رجكس مكانة بارزة ترتبط بالدماغ كما أنها تشكل الإشارات المرئية العصب البصري والمشروع من الشبكية إلى نويات يتناول الأفقي ووالاكيميه متفوقة. العصب البصري، مماثلة للعديد من الألياف العصبية في الجهاز العصبي المركزي، ميليناتيد من أوليجوديندروسيتيس وهو انشيثيد في طبقات سحائي. وبخاصة، يمكن أن يؤدي إلى إهانة للعصب البصري في استجابات مشابهة لوحظت في محاور عصبية الجهاز العصبي المركزي الأخرى، مثل رجعي وانحطاط anterograde إكسون وتشكيل ندبة، وتدمير المايلين، تنكس الثانوية وعلى مستوى طبيعي من نيوروتروفيك عوامل وأجهزة الإرسال العصبية11،12،،من1314. كما يمكن تفسير ظهور الأعراض البصرية في بعض المرضى الإعلانية بروابط قوية بين الشبكية و الدماغ15،16. كنتيجة لذلك، اقترح أن الشبكية قد تعكس العمليات المرضية الخرف في الدماغ وتصوير الشبكية ويمكن استخدامها لدراسة الخرف.
المفرج الشبكية وهيكل الخلايا العصبية يمكن الآن تصور غير إينفاسيفيلي باستخدام تقنيات التصوير الشبكية. على سبيل المثال، يمكن التقاط الصور الفوتوغرافية النظارة الشبكية باستخدام كاميرات النظارة، وخصائص المفرج الشبكية (مثلاً، سفينة العيار وتورتوسيتي والنمطي هندسي متكرر البعد) يمكن أن يكون كمياً ثم استخدام تحليل الحاسوب البرامج. وبالإضافة إلى ذلك، يمكن أيضا قياس استخدام التصوير المقطعي التماسك الألياف البصرية (OCT) معلمات لهيكل الخلايا العصبية الشبكية (مثل سمك العقدة الداخلية خلية بليكسيفورم [GC-الشعيرات] وطبقة الألياف العصبية الشبكية [رنفل]) وكمياً باستخدام المدمج تحليل الخوارزميات.
نظراً لأهمية تصوير الشبكية لدراسة الخرف، يهدف هذا البروتوكول إلى وصف أسلوب التصوير وتحليل المفرج الشبكية وهيكل الخلايا العصبية في فيفو باستخدام تقنيات التصوير الشبكية. هذا البروتوكول كما يوفر أمثلة على التغيرات الشبكية في المواضيع مع الخرف، ويناقش القضايا التقنية والقيود الحالية لتصوير الشبكية.
Protocol
جميع الأساليب الموصوفة هنا أقرتها لجنة أخلاقيات بحوث سريرية محلية في هونج كونج-
ملاحظة: للبساطة، يتم استخدام المعدات المدرجة في الجدول للمواد لتوضيح إجراءات تصوير الشبكية والتحليل اللاحق. ويتضح قياس البارامترات الأوعية الدموية الشبكية باستخدام برنامج (سيفا) تقييم السفينة سنغافورة I 17 (الإصدار 4.0، وجامعة سنغافورة الوطنية، سنغافورة). ومع ذلك، تجدر الإشارة إلى أن مجموعة مختلفة من المعدات يمكن أن يعتمد المبادئ الأساسية لا تزال مشابهة.
1-إعداد المواضيع "تصوير الشبكية"
- تمدد المواضيع ’ التلاميذ باستخدام عميل ميدرياتيك. الانتظار لمدة 15 دقيقة على الأقل إنشاء كافية التلميذ تمدد.
2. قياس "بارامترات الأوعية الدموية الشبكية" من "النظارة الصور الفوتوغرافية باستخدام" برنامج تحليل الحاسوب
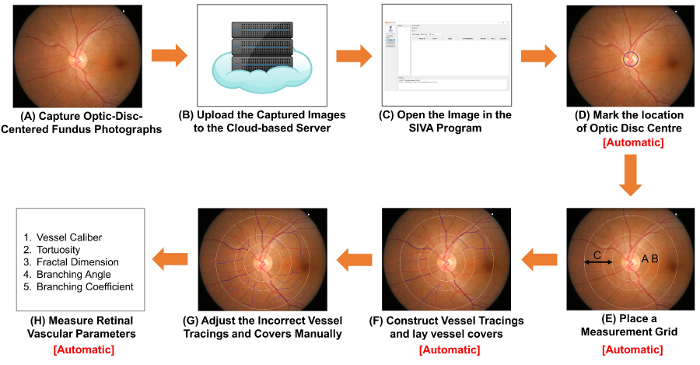
رقم 1: رسم تخطيطي عرض إجراءات قياس البارامترات الأوعية الدموية الشبكية. الحصول على (أ) تركز على القرص البصري النظارة الصور باستخدام كاميرا النظارة. الشكل 1A و 2A الشكل صورتين النظارة مع الجودة المثلى. (ب) تحميل الصور النظارة على الملقم المستندة إلى مجموعة النظراء، وأدخل تفاصيل الدراسة ذات الصلة، بما في ذلك معامل التحويل الصورة (ICF). قد تستخدم برامج الحاسوب تحليل أخرى أساليب غير المستندة إلى مجموعة النظراء لتنظيم وتخزين الصور. (ج) فتح الصورة النظارة في برنامج تحليل الحاسوب. مارك (د) موقع مركز القرص البصري، و (ه) مطالبة البرنامج للكشف عن حافة القرص البصري ووضع شبكة قياس تلقائياً. (و) بناء السفينة وسم استناداً إلى مسارات السفن، وإرساء السفن يغطي تقدير أقطار الأوعية. (ز) ضبط تغطي وسم السفن غير صحيحة والسفينة يدوياً. (ح) التدبير الطيف من المعلمات الشبكية والأوعية الدموية، بما في ذلك الكوادر السفينة، تورتوسيتي، والبعد كسورية والتشعب. يمكن تنفيذها خطوة (د) الخطوة (F)، والخطوة (ح) تلقائياً بواسطة بعض برامج الحاسوب تحليل. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- التقاط الصور الفوتوغرافية النظارة باستخدام كاميرا النظارة.
برنامج
- بدوره على الكاميرا النظارة وبدء التقاط الصور على الكمبيوتر. ضع الذقن لهذا الموضوع بشكل صحيح على تشينريست مع جبهته ضد حزام الرأس. حرك ذراع التحكم محاذاة شعاع الضوء بشكل صحيح على هذا الموضوع ’ التلميذ s-
- محاذاة النقاط الإضاءة حتى على حد سواء تظهر أصغر على كلا الجانبين في عدسة الكاميرا. نقل الهدف التثبيت الخارجي لتوجيه هذا الموضوع ’ العيون s حتى يتم القرص البصري في وسط المشاهد ومناطق الاهتمام (ROI) ضمن الحدود. ضبط مقبض التركيز على التركيز على شبكية العين-
- هذا الموضوع إيمانا راسخا إلقاء نظرة على الهدف التثبيت الخارجي والتأكد من هذا الموضوع وقد ’ العيون s لم تمتلئ بالدموع.
- كساد على زر مصراع الإفراج لالتقاط صورة ( الشكل 1A).
- التحقق من جودة الصورة النظارة التقاطها، باستخدام الشكل 2A كمعيار. تجاهل الصورة وكرر عملية اقتناء الصورة (أي خطوة 2.1.1 إلى 2.1.4) إذا كان التلميذ ضعيف المتوسعة ( الشكل 2)، القرص البصري ليس في مركز الصورة ( الشكل 2)، أو الصورة خارج التركيز ( الشكل 2D).
- حفظ الصورة في تنسيق TIFF مع تصحيح القرار (أي، تقريبا بكسل بكسل 3,000 x 2,000، في أكثر من 150 نقطة في البوصة).
ملاحظة: يمكن إيقاف البروتوكول هنا. - "كرر الخطوات" 2.1.1 ل 2.1.6 للحصول على صور فوتوغرافية النظارة لمواضيع أخرى.
- تحديد عينة 10% من الصور عشوائياً، وقياس ارتفاع الأقراص البصرية في هذه الصور ( الشكل 3). حساب معامل تحويل الصورة (ICF) باستخدام الصيغة:
ICF = 1,800 ميكرومتر/(متوسط الارتفاع بكسل للأقراص البصرية للصور عينات). - تحميل الصور الفوتوغرافية الملتقطة النظارة على الملقم المستندة إلى مجموعة النظراء، والدخول في تفاصيل الدراسة ذات الصلة، بما في ذلك معامل التحويل الصورة (ICF) ( الشكل 1B).
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا. برامج الحاسوب تحليل أخرى قد تستخدم أساليب أخرى غير المستندة إلى مجموعة النظراء لتنظيم الصور وتسجيل ICF.
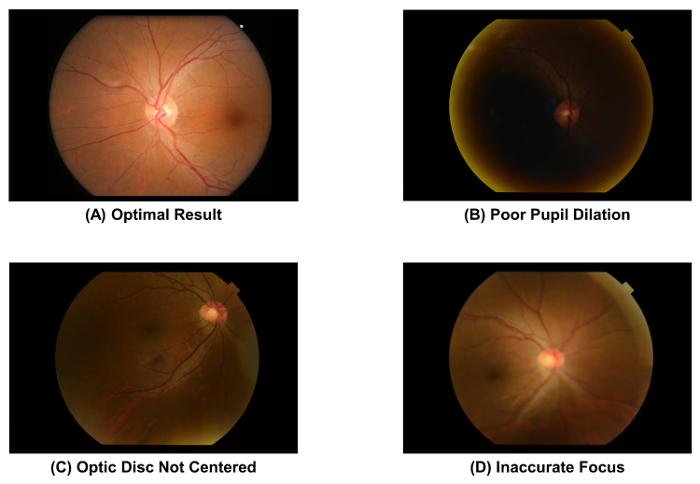
رقم 2: صور النظارة مع الجودة الأمثل والأمثل- يجب فحص جودة الصورة من صورة النظارة فورا بعد الحصول على الصور، كما أن جودة الصورة يؤثر تأثيراً مباشرا على قياس بارامترات الأوعية الدموية الشبكية اللاحقة. يجب أن يتم تجاهل الصورة إذا كان واحداً من هذه المصنوعات اليدوية ويلاحظ. هذه الصور تم التقاطها باستخدام كاميرا النظارة 50°. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
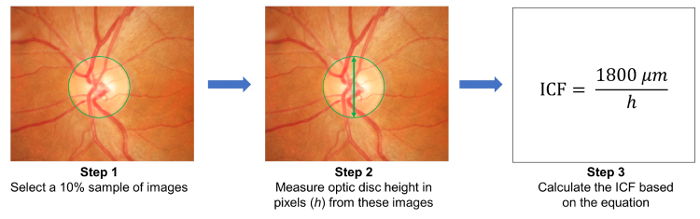
رقم 3: حساب معامل تحويل الصورة (ICF)- لحساب ICF، حدد عشوائياً عينة 10 ٪ من الصور من الدراسة (الخطوة 1). ثم، عينات قياس الارتفاع من أقراص ضوئية (بكسل) من الصور (الخطوة 2). حساب ICF استخدام الصيغة: ICF = 1800 ميكرومتر/(متوسط الارتفاع بكسل للأقراص البصرية للصور عينات)، حيث يكون مكم 1800 تقريبا ارتفاع القرص البصري العادي (الخطوة 3). كما التكبير تأثير ودقة وضوح الصورة تختلف من كاميرا لكاميرا، من الضروري لحساب ICF دقيقة لكل كاميرا المستخدمة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- بفتح الصورة النظارة في برنامج تحليل الحاسوب. بناء السفينة وسم وإرساء السفينة ليغطي المفرج الشبكية.
ملاحظة: في هذا القسم، يتم استخدام البرنامج سيفا لتوضيح الإجراءات. ومع ذلك، يمكن أن يكون محل البرنامج سيفا ببرامج تحليل الحاسوب المتوفرة الأخرى. وبالإضافة إلى ذلك، يتم تنفيذ الخطوات 2.2.2 إلى 2.2.3 تلقائياً بتحليل بعض الحاسوب فتح البرامج عندما تكون صورة النظارة (أي خطوة 2.2.1).- بفتح الصورة النظارة مع برنامج تحليل الحاسوب ( الشكل 1).
- وضع علامة على موقع مركز القرص البصري ( الشكل 1).
- فوق “ مركز OD ” الزر على لوحة الدالة left؛ وسوف يحل محله رأس مؤشر الماوس إلى دائرة خضراء.
- نقل دائرة خضراء إلى مركز القرص البصري (OD)، والأيسر لإصلاح الدائرة.
- موجه البرامج إلى وضع شبكة قياس تلقائياً، وبناء السفينة وسم ولوس أنجليسيغطي السفينة y ( الشكل 1E و 1F).
ملاحظة: تغطي السفينة هي خطوط القياس تقدير تقريبي عرض لومن الداخلية للسفن.- فوق “ OD العثور على ” زر لمطالبة البرنامج للكشف عن حافة OD ومكان أربع دوائر متحدة المركز كشبكة قياس، استناداً إلى موقف وسط OD.
- انقر فوق “ عملية ” زر لبدء عملية تتبع السفينة التلقائي.
- ضبط السفينة غير صحيحة وسم يدوياً. تبدأ عملية التفتيش من 12 س ’ ساعة الموقف بطريقة اتجاه عقارب الساعة التأكد من أن يتم التحقق من كل سفينة وسم.
- تحقق من أن دقة الكشف عن القرص الألياف البصرية وشبكة القياس يتم وضعها بشكل صحيح. ضبط قياس الشبكة يدوياً بعد الخطوات 2.2.2 إلى 2.2.3، إذا كانت دائرة الأعمق لا تحدد بدقة حافة القرص البصري ( الشكل 4 أ)-
- غادر انقر لتحديد tracing(s) السفينة المسمى مع نوع السفينة غير صحيحة (الشرايين مقابل الأوردة) وانقر “ السفينة (تب) ” الزر لتغيير نوع السفينة.
ملاحظة: يتم المسمى الشرايين بالأحمر والاوردة هي المسمى باللون الأزرق. ويمكن تمييز الشرايين عن الأوردة استناداً إلى الاختلافات الفسيولوجية. على سبيل المثال، الأوردة بشكل عام أكثر قتامة في اللون وأوسع من الشرايين. سفن مع نفس نوع السفينة عادة لا عبور بعضها البعض. - توسيع السفينة غير مكتملة وسم اتباع الخطوات 2.3.3.1 إلى 2.3.3.2 ( الشكل 4 باء).
- استخدام رأس المؤشر انقر فوق نهاية البعيدة لتعقب سفينة غير مكتملة. غادر انقر فوق نقاط على طول مسار السفينة تمديد تعقب السفينة.
- إيقاف عملية تتبع عند الوصول إلى نهاية القاصي من السفينة. إيقاف التتبع في الدائرة البيضاء الأبعد إذا كان الجزء الأعلى من السفينة يقع خارج الشبكة القياس (انظر الشكل 4B).
- ضبط السفينة وسم إذا لم يتم تتبع مسارات السفن بشكل صحيح في الموقع كروس ( الشكل 4).
- انقر “ تحديد ” الزر ومن ثم انقر فوق عند النقطة غير صحيحة لتعقب السفينة. انقر فوق “ Brea(k) Seg ” زر قطع الاتصال تتبع السفينة في نقطة محددة. حدد الجزء المتعلق بقطع الاتصال ثم انقر فوق “ Seg (Del) ” زر حذف عليه.
- إعادة بناء تتبع سفينة جديدة باستخدام الخطوات 2.3.3.1 و 2.3.3.2-
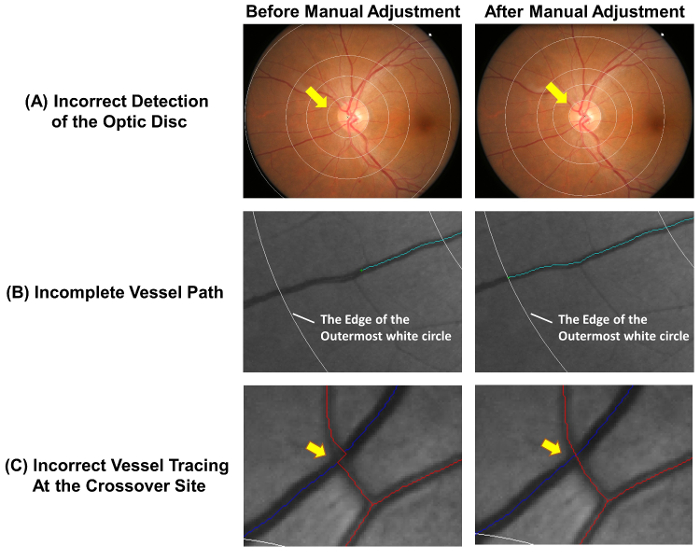
الرقم 4: الأخطاء الشائعة للسيارات-التتبع- تتبع السفينة التلقائية ليست دقيقة تماما، والتعديلات اليدوية المطلوبة لضمان دقة القياس. وهذا الرقم يبين الأخطاء الشائعة للسيارات-اقتفاء أثر ويوضح النتائج المثلى بعد التعديلات اليدوية. (أ) مركز القرص البصري تم وضع علامة بشكل غير صحيح، وهذا يؤدي إلى انحراف في شبكة القياس، التي قد تؤثر على القياسات اللاحقة. ومن الناحية المثالية، ينبغي أن تحدد دائرة الأعمق في شبكة القياس حافة القرص البصري. تتبع السفينة غير مكتملة (ب) يمكن أن يؤدي إلى قياس البعد كسورية، تورتوسيتي، و ما ينبغي أن تتبع مسار السفينة حتى نهاية السفينة غير صحيحة. إذا كان الجزء الأعلى من السفينة يقع خارج الشبكة القياس، يمكن إيقاف التتبع في الدائرة البيضاء الأبعد. (ج) السفينة وسم في مواقع كروس تخضع ميل أعلى للخطأ ومن ثم تتطلب اهتماما خاصا. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- تكمن يغطي السفينة في جميع أجزاء السفينة والأغطية غير صحيحة بإلغاء تنشيط يدوياً.
- فوق “ "تجد يغطي" ” الزر إلى إرساء السفينة ويغطي على كل سفينة شرائح تلقائياً.
- الاختيار إذا كان يغطي جميع السفن يتم وضعها بشكل صحيح. الأيسر واسحب ويغطي المؤشر لإلغاء تنشيط السفينة إذا لم يغطي وضع عمودي على جدران السفينة ( الشكل 5A)، وحجب مسار السفينة بواسطة سفينة أخرى ( الشكل 5 (ب))، أو يغطي المبالغة أو نقلل من شأن عرض التجويف السفينة ( الشكل 5).
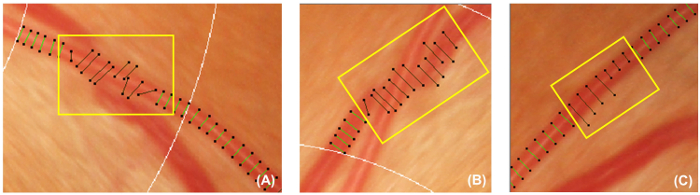
الرقم 5: يغطي السفينة غير صحيحة. يعرض الشكل التالي أمثلة ليغطي السفينة غير صحيحة ينبغي إبطال مفعولها واستبعادها من قياس اللاحقة. ينبغي إلغاء تنشيط يغطي السفينة إذا لم تكن عمودي على السفن (A). وبالإضافة إلى ذلك، ينبغي أيضا المعطلة يغطي السفينة إذا كانت السفينة يتم تتبعه تحجب تحت سفينة أخرى (ب)، أو يغطي السفينة لا يمكن أن تمثل عرض تقريبي للسفينة (ج). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- قياس المعلمات الأوعية الدموية الشبكية من وسم السفينة ويغطي السفينة
ملاحظة: 2.5 خطوة تتم تلقائياً باستخدام برنامج تحليل الحاسوب. أقطار- تسمية القرص مساحة 0.5-1.0 بعيداً عن الهامش القرص البصري كمنطقة ب، وأقطار القرص مساحة 0.5-2.0 بعيداً عن الهامش القرص البصري كمنطقة ج 18 ( الشكل 6A)، استناداً إلى البروتوكول المعدل "خطر تصلب الشرايين" في "المجتمعات المحلية" (يدرون) دراسة 19-
- قياس عيار الأوعية الدموية الشبكية من منطقة ب ومنطقة ج، استخدام أسلوب المعتمد على نطاق واسع أن يتم تعديل من يدرون دراسة 19 ، ، من 20 21 ، 22 ، 23 ، 24 ، 25 ، 26 ( الشكل 6B).
- قياس أطوال يغطي السفينة في الشرايين أكبر ستة والاوردة أكبر ستة لتقدير الكوادر السفينة الشبكية. تلخيص
- الشبكية أرتيريولار والكوادر فينولار كشريان الشبكية المركزي ما يعادل (كراي) والشبكية المركزية الوريد ما يعادل (كرف) على التوالي 17، استخدام كنودتسون المنقحة – صيغة بار--هوبارد 18 ، 19-
- تحديد جميع السفن في المنطقة ج مع عرض > 40 ميكرومتر. حساب تورتوسيتي أرتيريولار وفينولار الشبكية من المتكاملة من مجموع انحناء التربيعية على طول وسم السفينة وتطبيع قيمة بطول القوس المجموع والركوع، ونقاط الانعطاف 27 ، 28-
- حساب المجموع، أرتيريولار، والأبعاد كسورية فينولار من المنطقة جيم، أنشئت باستخدام “ أسلوب العد مربع ” 29 ، ، من 30 31.
- تقسيم الصورة إلى سلسلة من المربعات الحجم على قدم المساواة-
- حساب عدد المربعات التي تحتوي على قسم من وسم السفينة.
- كرر العملية باستخدام سلسلة من مربعات متساوية الحجم بأحجام مختلفة-
- مؤامرة لوغاريتم عدد المربعات التي تحتوي على وسم سفينة ضد لوغاريتم حجم المربعات، وحساب الميل لخط الناتجة عن ذلك؛ وهذا البعد كسورية-
- تحديد السفن مع التشعب الأولى في المنطقة ج وحساب الزوايا (θ) سوبتينديد بين أول ابنه اثنان سفن 32 ( الشكل 6). حساب قيمة المتوسط للحصول على متوسط زاوية المتفرعة.
- حساب معامل المتفرعة من المنطقة ج باستخدام الصيغة:
(د 1 2 + د 2 2) &/d 0 2، د 0 هو عيار يعني الجذع، حيث د 1 و د 2 هي الكوادر الوسطية فرع ( الشكل 6).
- قم بإغلاق إطار الدرجات. انقر فوق “ إرسال ” في مربع حوار منبثق لتحميل صورة متدرجة إلى الملقم المستندة إلى مجموعة النظراء وتسجيل المعلمات الأوعية الدموية الشبكية المقاسة تلقائياً.
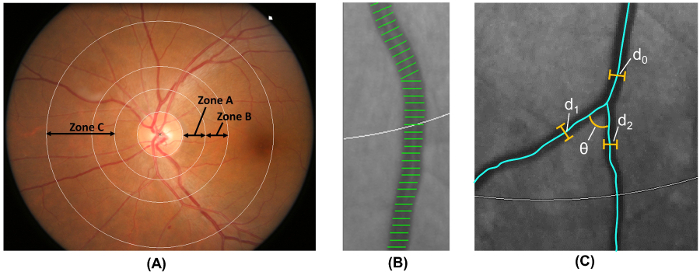
الرقم 6: القياس الكمي للمفرج الشبكية. (أ) "المنطقة ب" (يعرف 0.5-1.0 القرص أقطار بعيداً عن الهامش القرص) يستخدم لقياس الكوادر السفينة من منطقة ب وفقا "خطر تصلب الشرايين" في "دراسة المجتمعات المحلية". المنطقة ج (يعرف 0.5-2.0 القرص أقطار بعيداً عن الهامش القرص) يستخدم لقياس الكوادر السفينة من المنطقة ج ومجموعة من معلمات شبكة الأوعية الدموية الشبكية (مثل تورتوسيتي، والبعد كسورية، والتشعب). (ب) تغطي السفينة خطوط القياس المستخدمة لتقدير الكوادر السفينة الشبكية (أو الأقطار). يغطي السفينة غير صحيحة ينبغي أن تستبعد يدوياً من القياس. (ج) تدابير لجميع السفن التي تحتوي على التشعب الأولى داخل المنطقة ج، البرنامج تلقائياً (θ) الزوايا المتفرعة من التشعب الأولى. وباﻹضافة إلى ذلك، يحسب معامل التفريع أيضا باستخدام الصيغة: معامل التفريع = (د 1 2 + د 2 2) &/d 0 2، حيث هو د 0 الجذع العيار، و د 1 ود 2 هي كوادر فرع. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
3-تقييم سمك الشعيرات GC ورنفل
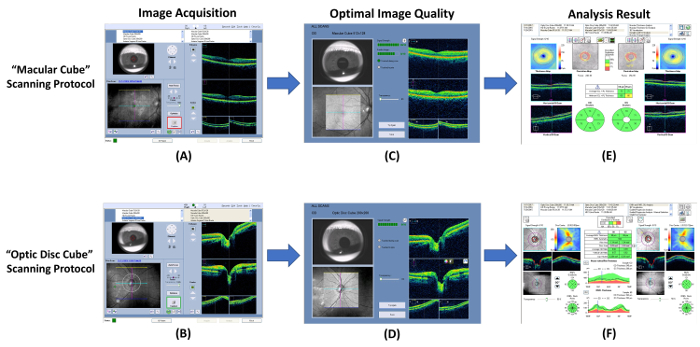
رقم 7: رسم تخطيطي عرض إجراءات قياس سمك رنفل و GC-الشعيرات- يمكن استخدام التصوير المقطعي التماسك الضوئية (OCT) لقياس سمك طبقة بليكسيفورم الخلية الداخلية العقدة (GC-الشعيرات) وطبقة الألياف العصبية الشبكية (رنفل). (أ وب) قياس سمك الشعيرات GC ورنفل استخدام المدمج في “ مكعب بقعي ” و “ مكعب القرص البصري ” المسح البروتوكولات على التوالي. (ج، د) التحقق من جودة الصورة مباشرة بعد الحصول على الصور. تجاهل الصورة وتكرار الفحص إذا كانت قوة إشارة أصغر من 6، أو يتم الكشف عن التحف الحركة. (ه، و) ثم، موجه البرنامج التحليل المدمج لتحليل نتيجة المسح تلقائياً وإنشاء تقرير للتفسير. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- إجراء الحصول على الصور باستخدام التصوير المقطعي التماسك الضوئية (OCT).
- فتح البرنامج أكتوبر وحدد “ "مكعب بقعي" ” مسح بروتوكول بدء تفحص جديد القرنية ( الشكل 7 أ).
- تحديد موقع التلميذ في إطار العرض آيريس بضبط في تشينريست. تخفيض الإضاءة إذا كان حجم تلميذ صغير جداً-
- انقر فوق “ "التركيز التلقائي" ” زر، ثم “ أمثلية ” زر لتحسين نوعية الصورة.
- الإيعاز إلى موضوع وميض بضع مرات فورا قبل بدء تشغيل التفحص.
- انقر “ التقاط ” زر لبدء تشغيل التفحص عندما تصبح الحدود المحيطة الزر الأخضر. الإيعاز إلى هذا الموضوع للتركيز على الهدف التثبيت المرئي أثناء الحصول على الصور لتجنب القطع الأثرية الحركة.
- استعراض نوعية المسح الضوئي باستخدام الرقم 7 كمعيار. تجاهل نتيجة المسح وتكرار الفحص إذا قوة إشارة أصغر من 6 ( الشكل 8 أ)، أو يتم الكشف عن التحف الحركة (يشار إليها بانقطاع الأوعية الدموية) ( الشكل 8B).
- حفظ نتيجة المسح.
- "كرر الخطوات" 3.1.1 ل 3.1.7 لعين آخر.
- إجراء فحص عصب البصري الرئيسي مع “ "الألياف الضوئية القرص مكعب" ” المسح البروتوكول التالية خطوات 3.1.2 إلى 3.1.9 ( 7B الأرقام ود 7).

الرقم 8: نتائج دون المستوى الأمثل للتصوير المقطعي التماسك الضوئية- المشتركة نتائج دون المستوى الأمثل للتصوير المقطعي التماسك الضوئية (OCT) تشمل قوة إشارة سيئة (A) (قيمة قوة < 6)، و (ب) الحركة المصنوعات اليدوية. ينبغي استعراض نوعية المسح الضوئي مباشرة بعد الحصول على الصور، ويجب أن يكون الفحص يتكرر إذا تصادف هذه المصنوعات اليدوية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- تولد النسخة مطبوعة تحليل GC-الشعيرات سمك القرنية.
- حدد “ "مكعب بقعي" ” مسح السجلات من كلتا العينين في واجهة التحليل.
- فوق “ العقدة خلية تحليل OU ” الشروع في خوارزمية تحليل التلقائي لتقييم سمك الشعيرات GC للمسح الضوئي ( الشكل 7E).
ملاحظة: يتم تلقائياً إكمال الخطوة 3.2.2 قبل خوارزمية تحليل.- تولد
- مم 14.13 2 منتظمة محورها اهليلجية الحلقة التي قد راديوسيس الداخلي والخارجي أفقي من 0.6 و 2.4 ملم، على التوالي، والرأسية راديوسيس الداخلي والخارجي من 0.5 و 2.0 ملم، على التوالي.
ملاحظة: حجم وشكل بيضاوي الحلقة مطابقة عن كثب لجسم القرنية وهكذا تتوافق مع المنطقة التي فيها سمكا في عيون طبيعية 33 ، 34 رجكس. لا تقاس المساحة ضمن الحلقة الداخلية للحلقة، كما GC-الشعيرات في هذه المنطقة رقيقة جداً- - الجزء من خط الحدود الخارجي رنفل وخط الحدود الخارجي للطبقة بليكسيفورم الداخلية (الشعيرات) لتحديد موقع GC-الشعيرات ( الشكل 9)-
- قياس المتوسط والحد الأدنى، وستة القطاعية (سوبيروتيمبورال، متفوقة، سوبيروناسال، إينفيروناسال، أقل شأنا، التحت) سمك الشعيرات GC القرنية داخل منتظمة-الشبكةتريد الحلقة اهليلجية.
- مقارنة سمك الشعيرات GC المقاسة إلى الجهاز ’ s الداخلية مطابقة العمر المعياري قاعدة البيانات وإنشاء خارطة انحراف وخريطة أهمية
- تقريرا عن نتائج القياس النسخة مطبوعة تحليل.
- مم 14.13 2 منتظمة محورها اهليلجية الحلقة التي قد راديوسيس الداخلي والخارجي أفقي من 0.6 و 2.4 ملم، على التوالي، والرأسية راديوسيس الداخلي والخارجي من 0.5 و 2.0 ملم، على التوالي.
- حفظ النسخة المطبوعة التحليل في تنسيق.pdf.
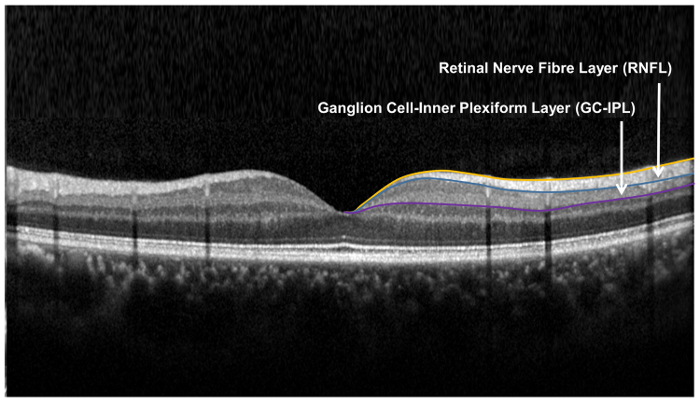
الرقم 9: طبقات الشبكية تستخدم تقييم لهيكل الخلايا العصبية الشبكية. يتم قياس طبقة الألياف العصبية الشبكية (رنفل) باستخدام الخوارزمية (ONH) رأس العصب البصري، بينما العقدة الداخلية خلية طبقة بليكسيفورم يقاس باستخدام خوارزمية تحليل (الائتلاف) خلية العقدة. خوارزمية أنه قطاعات الحدود الداخلية والخارجية رنفل لقياس سمك رنفل. خوارزمية الائتلاف بالكشف عن خط الحدود الخارجي طبقة الألياف العصبية الشبكية (رنفل)، والطبقة بليكسيفورم الداخلية (IPL) أن تسفر عن سمك طبقة خلايا العقدة (جكل) مجتمعة والشعيرات. يتم قياس سمك جكل والشعيرات معا، كما الحد الفاصل بين جكل والشعيرات تشريحيا غيرواضح. غير أن سمك مجتمعة جكل والشعيرات (أي الشعيرات GC) ما زال يدل على صحة رجكس. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- إنشاء تحليل النسخة المطبوعة من سمك رنفل ( الشكل 7F)-
- حدد “ "الألياف الضوئية القرص مكعب" ” مسح السجلات من كلتا العينين في واجهة التحليل.
- انقر فوق “ أونه وتحليل OU رنفل ” الشروع في خوارزمية تحليل التلقائي لتقييم سمك رنفل التفحص.
ملاحظة: يمكن إكمال الخطوات 3.3.2.1 إلى 3.3.2.6 تلقائياً بواسطة خوارزمية إعادة التحليل.- قياس سمك رنفل عند كل نقطة من نقاط الفحص وتوليد مخطط سمك رنفل.
- تحديد القرص البصري عن طريق الكشف عن بقعة مظلمة قرب مركز المسح الضوئي الذي يحتوي حجم وشكل يتسق مع المجموعة من disc. الألياف البصرية
- بوضع شبكة قياس مم 3.46 في قطر حول القرص البصري على خريطة سمك رنفل.
- قياس وحساب العالمية، الأربعة-الأرباع (الزمانية ومتفوقة والأنف وأدنى)، وسمك رنفل بارابابيلاري اثنتي عشرة ساعة على مدار الساعة من شبكة قياس.
- مقارنة سمك رنفل المقاسة إلى الجهاز ’ s الداخلية مطابقة العمر المعياري قاعدة البيانات وإنشاء خارطة انحراف وخريطة أهمية.
- تقريرا عن نتائج القياس النسخة مطبوعة تحليل.
- حفظ النسخة المطبوعة التحليل في تنسيق.pdf.
النتائج
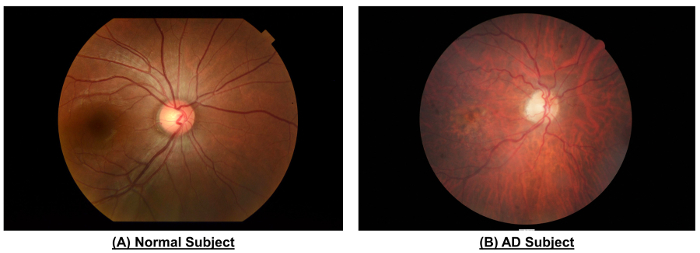
10 الرقم: مثال لإظهار الاختلافات في المفرج الشبكية بين موضوع عادي وموضوع إعلان. عند مقارنة هذا الموضوع العادي، أظهرت صورة النظارة الموضوع الإعلانية أضيق السفينة الكوادر (كراي المنطقة ب، ميكرومتر 116....
Discussion
ويصف هذا البروتوكول إجراءات قياس التغيرات العصبية والأوعية الدموية في الشبكية في فيفو. الشبكية سهم أصول الجنينية مشابهة والميزات التشريحية والخصائص الفسيولوجية مع المخ، وقد تعكس هذه التغييرات الشبكية تغييرات مماثلة للمفرج وهيكل الخلايا العصبية في الدماغ.
كما هو مبي...
Disclosures
ونود أن نعرب عن تقديرنا لمدرسة الحوسبة، "جامعة سنغافورة الوطنية،" لتقديم الدعم التقني.
Acknowledgements
فيما يتعلق بالعلاقات المالية المحتملة، هو صاحب البلاغ وونغ يوسف تيان مخترع المشارك من البرنامج سنغافورة I السفينة التقييم (سيفا) المستخدمة في هذه المقالة.
Materials
| Name | Company | Catalog Number | Comments |
| Non-mydriatic Retinal Camera | Topcon, Inc, Tokyo, Japan | TRC 50DX | N/A |
| Singapore I Vessel Assessment Program | National University of Singapore | Version 4.0 | N/A |
| CIRRUS HD-OCT | Carl Zeiss Meditec, Inc, Dublin, CA | Model 4000 | N/A |
| Mydriatic Agents | N/A | N/A | Prepared from 1% tropicamide and 2.5% phenylephrine hydrochloride |
References
- Alzheimer's Disease International. The prevalence of dementia worldwide. Alzheimer's Dis. Int. (December), 1-2 (2008).
- Wimo, A., Winblad, B., &Jönsson, L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimer's Dement. 6 (2), 98-103 (2010).
- Comas-Herrera, A., Northey, S., Wittenberg, R., Knapp, M., Bhattacharyya, S., Burns, A. Future costs of dementia-related long-term care: exploring future scenarios. Int. Psychogeriatr. 23 (1), 20-30 (2011).
- Alzheimer's Association. Alzheimer's disease facts and figures. Alzheimer's Dement. 10 (2), e47-e92 (2014).
- Prince, M., Bryce, R., Albanese, E., Wimo, A., Ribeiro, W., Ferri, C. P. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers. Dement. 9 (1), 63-75 (2013).
- Alzheimer's Association. 2016 Alzheimer's disease facts and figures. Alzheimer's Dement. 12 (4), 459-509 (2016).
- Asih, P. R., Chatterjee, P., Verdile, G., Gupta, V. B., Trengove, R. D., Martins, R. N. Clearing the amyloid in Alzheimer's: progress towards earlier diagnosis and effective treatments - an update for clinicians. Neurodegener. Dis. Manag. 4 (5), 363-378 (2014).
- Cheung, C. Y., Ikram, M. K., Chen, C., Wong, T. Y. Imaging retina to study dementia and stroke. Prog. Retin. Eye Res. , (2017).
- Patton, N., Aslam, T., Macgillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: a rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nat. Rev. Neurol. 9 (1), 44-53 (2013).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Levkovitch-Verbin, H., Quigley, H. A., Kerrigan-Baumrind, L. A., D'Anna, S. A., Kerrigan, D., Pease, M. E. Optic nerve transection in monkeys may result in secondary degeneration of retinal ganglion cells. Investig. Ophthalmol. Vis. Sci. 42 (5), 975-982 (2001).
- Levkovitch-Verbin, H., Quigley, H. A., Martin, K. R., Zack, D. J., Pease, M. E., Valenta, D. F. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Sadun, A. A., Borchert, M., DeVita, E., Hinton, D. R., Bassi, C. J. Assessment of Visual Impairment in Patients With Alzheimer's Disease. Am. J. Ophthalmol. 104 (2), 113-120 (1987).
- Schlotterer, G., Moscovitch, M., Crapper-Mclachlan, D. Visual processing deficits as assessed by spatial frequency contrast sensitivity and backward masking in normal ageing and alzheimer's. Brain. 107 (1), 309-324 (1984).
- Cheung, C. Y. L., et al. A new method to measure peripheral retinal vascular caliber over an extended area. Microcirculation. 17 (7), 495-503 (2010).
- Knudtson, M. D., Lee, K. E., Hubbard, L. D., Wong, T. Y., Klein, R., Klein, B. E. K. Revised formulas for summarizing retinal vessel diameters. Curr. Eye Res. 27 (3), 143-149 (2003).
- Hubbard, L. D., et al. Methods for evaluation of retinal microvascular abnormalities associated with hypertension/sclerosis in the Atherosclerosis Risk in Communities Study. Ophthalmology. 106 (12), 2269-2280 (1999).
- Patton, N., et al. The association between retinal vascular network geometry and cognitive ability in an elderly population. Investig. Ophthalmol. Vis. Sci. 48 (5), 1995-2000 (2007).
- VanHecke, M. V., et al. Are retinal microvascular abnormalities associated with large artery endothelial dysfunction and intima-media thickness? The Hoorn Study. Clin. Sci. London Engl. 110 (5), 597-604 (2006).
- Tien, Y. W., et al. Retinal vascular caliber, cardiovascular risk factors, and inflammation: The Multi-Ethnic Study of Atherosclerosis (MESA). Investig. Ophthalmol. Vis. Sci. 47 (6), 2341-2350 (2006).
- Leung, H., et al. Relationships between age, blood pressure, and retinal vessel diameters in an older population. Investig. Ophthalmol. Vis. Sci. 44 (7), 2900-2904 (2003).
- Wong, T. Y., et al. The prevalence and risk factors of retinal microvascular abnormalities in older persons: The cardiovascular health study. Ophthalmology. 110 (4), 658-666 (2003).
- Ikram, M. K., et al. Retinal vessel diameters and risk of stroke: The Rotterdam Study. Neurology. 66 (9), 1339-1343 (2006).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: Methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Sasongko, M. B., et al. Alterations in retinal microvascular geometry in young type 1 diabetes. Diabetes Care. 33 (6), 1331-1336 (2010).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Mainster, M. a The fractal properties of retinal vessels: embryological and clinical implications. Eye. 4 ( Pt 1) (1), 235-241 (1990).
- Liew, G., et al. The Retinal Vasculature as a Fractal: Methodology, Reliability, and Relationship to Blood Pressure. Ophthalmology. 115 (11), (2008).
- Stosic, T., Stosic, B. D. Multifractal analysis of human retinal vessels. IEEE Trans. Med. Imaging. 25 (8), 1101-1107 (2006).
- Zamir, M., Medeiros, J. A., Cunningham, T. K. &. a. m. p. ;. M., Zamir, J. A., Medeiros, T. K. C. Arterial bifurcations in the human retina. J. Gen. Physiol. 74 (4), 537-548 (1979).
- Mwanza, J. C., Oakley, J. D., Budenz, D. L., Chang, R. T., Knight, O. J., Feuer, W. J. Macular ganglion cell-inner plexiform layer: Automated detection and thickness reproducibility with spectral domain-optical coherence tomography in glaucoma. Investig. Ophthalmol. Vis. Sci. 52 (11), 8323-8329 (2011).
- Bendschneider, D., et al. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J. Glaucoma. 19 (7), 475-482 (2010).
- Cheung, C. Y., Ong, Y. T., Ikram, M. K., Chen, C., Wong, T. Y. Retinal Microvasculature in Alzheimer's Disease. J. Alzheimer's Dis. 42 (s4), S339-S352 (2014).
- Murray, C. D. THE PHYSIOLOGICAL PRINCIPLE OF MINIMUM WORK APPLIED TO THE ANGLE OF BRANCHING OF ARTERIES. J. Gen. Physiol. (4), 835-841 (1926).
- Ding, J., et al. Early retinal arteriolar changes and peripheral neuropathy in diabetes. Diabetes Care. 35 (5), 1098-1104 (2012).
- Yim, C., et al. Retinal Ganglion Cell Analysis Using High-Definition Optical Coherence Tomography in Patients with Mild Cognitive Impairment and Alzheimer's Disease. J. Alzheimer's Dis. Retin. Ganglion Cell Anal. MCI AD. 45 (1), 45-56 (2015).
- Stein, D. M., Wollstein, G., Ishikawa, H., Hertzmark, E., Noecker, R. J., Schuman, J. S. Effect of Corneal Drying on Optical Coherence Tomography. Ophthalmology. 113 (6), 985-991 (2006).
- Mwanza, J. C., et al. Effect of Cataract and its Removal on Signal Strength and Peripapillary Retinal Nerve Fiber Layer Optical Coherence Tomography Measurements. J. Glaucoma. 20 (1), 37-43 (2011).
- Garcia-Martin, E., et al. Influence of cataract surgery on optical coherence tomography and neurophysiology measurements in patients with retinitis pigmentosa. Am. J. Ophthalmol. 156 (2), (2013).
- Kok, P. H. B., et al. The relationship between the optical density of cataract and its influence on retinal nerve fibre layer thickness measured with spectral domain optical coherence tomography. Acta Ophthalmol. , (2012).
- Kim, N. R., et al. Influence of cataract on time domain and spectral domain optical coherence tomography retinal nerve fiber layer measurements. J. Glaucoma. 21 (2), 116-122 (2012).
- Hwang, Y. H., Kim, Y. Y. Effect of Peripapillary Vitreous Opacity on Retinal Nerve Fiber Layer Thickness Measurement Using Optical Coherence Tomography. Arch. Ophthalmol. 130 (6), 789-792 (2012).
- Schwartz, S. G., Flynn, H. W., Fisher, Y. L. "Floater scotoma" demonstrated on spectral-domain optical coherence tomography and caused by vitreous opacification. Ophthalmic Surg. Lasers Imaging Retina. 44 (4), 415-418 (2013).
- Frost, S., et al. Retinal vascular biomarkers for early detection and monitoring of Alzheimer's disease. Transl. Psychiatry. 3 (2), e233 (2013).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- DeJong, F. J., et al. Retinal vascular caliber and risk of dementia: The Rotterdam Study. Neurology. 76 (9), 816-821 (2011).
- Cheung, C. Y., et al. Quantitative and qualitative retinal microvascular characteristics and blood pressure. J. Hypertens. 29 (7), 1380-1391 (2011).
- Cheung, C. Y., et al. Retinal vascular fractal dimension and its relationship with cardiovascular and ocular risk factors. Am. J. Ophthalmol. 154 (4), 663-674 (2012).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Grinton, M. E., et al. The association between retinal vessel morphology and retinal nerve fiber layer thickness in an elderly population. Ophthalmic Surg. Lasers Imaging. 43 (6 Suppl), S61-S66 (2012).
- Hughes, A. D., et al. Quantification of topological changes in retinal vascular architecture in essential and malignant hypertension. J. Hypertens. 24 (5), 889-894 (2006).
- Hughes, A. D., et al. Determinants of retinal microvascular architecture in normal subjects. Microcirculation. 16 (2), 159-166 (2009).
- Lau, Q. P., Lee, M. L., Hsu, W., Wong, T. Y. The Singapore Eye Vessel Assessment System. Image Anal. Model. Ophthalmol. , 143-160 (2014).
- Thomas, G. N., et al. Measurement of Macular Fractal Dimension Using a Computer-Assisted Program. Investig. Opthalmology Vis. Sci. 55 (4), 2237 (2014).
- Murray, C. D. The physiological principle of minimal work. I. The vascular system and the cost of blood volume. Proc. Natl. Acad. Sci. 12, 207-214 (1926).
- Cheung, C., Chen, C., Wong, T. Ocular Fundus Photography as a Tool to Study Stroke and Dementia. Semin. Neurol. 35 (5), 481-490 (2015).
- Williams, M. A., et al. Retinal microvascular network attenuation in Alzheimer's disease. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 1 (2), 229-235 (2015).
- Cheung, C. Y., et al. Retinal Vascular Fractal Dimension Is Associated with Cognitive Dysfunction. J. Stroke Cerebrovasc. Dis. 23 (1), 43-50 (2014).
- Hammes, H. P., et al. Diabetic retinopathy: targeting vasoregression. Diabetes. 60 (1), 9-16 (2011).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- Frame, M. D., Sarelius, I. H. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc Res. 46 (2), 190-205 (1993).
- Djonov, V., Baum, O., Burri, P. H. Vascular remodeling by intussusceptive angiogenesis. Cell Tissue Res. 314 (1), 107-117 (2003).
- Griffith, T. M., Edwards, D. H. Basal EDRF activity helps to keep the geometrical configuration of arterial bifurcations close to the Murray optimum. J. Theor. Biol. 146 (4), 545-573 (1990).
- Griffith, T. M., Edwards, D. H., Randall, M. D. Blood flow and optimal vascular topography: role of the endothelium. Basic Res. Cardiol. 86 Suppl 2, 89-96 (1991).
- Chapman, N., Haimes, G., Stanton, A. V., Thom, S. A. M., Hughes, A. D. Acute effects of oxygen and carbon dioxide on retinal vascular network geometry in hypertensive and normotensive subjects. Clin. Sci. 99 (6), 483-488 (2000).
- Heringa, S. M., Bouvy, W. H., van denBerg, E., Moll, A. C., Jaap Kappelle, L., Jan Biessels, G. Associations between retinal microvascular changes and dementia, cognitive functioning, and brain imaging abnormalities: a systematic review. J. Cereb. blood flow Metab. 33 (7), 983-995 (2013).
- Ding, J., et al. Diabetic retinopathy and cognitive decline in older people with type 2 diabetes: The Edinburgh type 2 diabetes study. Diabetes. 59 (11), 2883-2889 (2010).
- Parisi, V., Restuccia, R., Fattapposta, F., Mina, C., Bucci, M. G., Pierelli, F. Morphological and functional retinal impairment in Alzheimer's disease patients. Clin. Neurophysiol. 112 (10), 1860-1867 (2001).
- Paquet, C., Boissonnot, M., Roger, F., Dighiero, P., Gil, R., Hugon, J. Abnormal retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Neurosci. Lett. 420 (2), 97-99 (2007).
- Moschos, M. M., et al. Structural and functional impairment of the retina and optic nerve in Alzheimer's disease. Curr. Alzheimer Res. 9 (7), 782-788 (2012).
- Lu, Y., et al. Retinal nerve fiber layer structure abnormalities in early Alzheimer's disease: Evidence in optical coherence tomography. Neurosci. Lett. 480 (1), 69-72 (2010).
- Kesler, A., Vakhapova, V., Korczyn, A. D., Naftaliev, E., Neudorfer, M. Retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Clin. Neurol. Neurosurg. 113 (7), 523-526 (2011).
- Ascaso, F. J., et al. Retinal alterations in mild cognitive impairment and Alzheimer's disease: An optical coherence tomography study. J. Neurol. 261 (8), 1522-1530 (2014).
- Berisha, F., Feke, G. T., Trempe, C. L., McMeel, J. W., Schepens, C. L. Retinal abnormalities in early Alzheimer's disease. Investig. Ophthalmol. Vis. Sci. 48 (5), 2285-2289 (2007).
- Iseri, P. K., Altinaş, O., Tokay, T., Yüksel, N. Relationship between Cognitive Impairment and Retinal Morphological and Visual Functional Abnormalities in Alzheimer Disease. J. Neuro-Ophthalmology. 26 (1), 18-24 (2006).
- Garcia-Martin, E. S., et al. Macular thickness as a potential biomarker of mild Alzheimer's disease. Ophthalmology. 121 (5), 1149-1151 (2014).
- Ko, F., et al. Retinal Nerve Fiber Layer Thinning Associated With Poor Cognitive Function Among A Large Cohort, The Uk Biobank. Alzheimer's Dement. 12 (7), P317-P318 (2016).
- Moreno-Ramos, T., Benito-Leon, J., Villarejo, A., Bermejo-Pareja, F. Retinal nerve fiber layer thinning in dementia associated with Parkinson's disease, dementia with Lewy bodies, and Alzheimer's disease. J. Alzheimers. Dis. 34 (3), 659-664 (2013).
- Moschos, M. M., et al. Morphologic changes and functional retinal impairment in patients with Parkinson disease without visual loss. Eur. J. Ophthalmol. 21 (1), 24-29 (2011).
- Garcia-Martin, E., et al. Ability and reproducibility of Fourier-domain optical coherence tomography to detect retinal nerve fiber layer atrophy in Parkinson's disease. Ophthalmology. 119 (10), 2161-2167 (2012).
- Yip, W., et al. Comparison of Common Retinal Vessel Caliber Measurement Software and a Conversion Algorithm. Transl. Vis. Sci. Technol. 5 (5), 11 (2016).
- Gorelick, P. B., et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association. Stroke. 42 (9), 2672-2713 (2011).
- Brown, W. R., Thore, C. R. Review: Cerebral microvascular pathology in ageing and neurodegeneration. Neuropathol. Appl. Neurobiol. 37 (1), 56-74 (2011).
- DeSilva, T. M., Faraci, F. M. Microvascular Dysfunction and Cognitive Impairment. Cell. Mol. Neurobiol. 36 (2), 241-258 (2016).
- Kalaria, R. N., Akinyemi, R., Ihara, M. Does vascular pathology contribute to Alzheimer changes?. J. Neurol. Sci. 322 (1-2), 141-147 (2012).
- Kling, M. A., Trojanowski, J. Q., Wolk, D. A., Lee, V. M. Y., Arnold, S. E. Vascular disease and dementias: paradigm shifts to drive research in new directions. Alzheimers. Dement. 9 (1), 76-92 (2013).
- O'Brien, J. T., et al. Vascular cognitive impairment. Lancet Neurol. 2 (2), 89-98 (2003).
- Chen, C., et al. Alzheimer's disease with cerebrovascular disease: current status in the Asia-Pacific region. J. Intern. Med. 280 (4), 359-374 (2016).
- Pérez, M. A., Bruce, B. B., Newman, N. J., Biousse, V. The use of retinal photography in nonophthalmic settings and its potential for neurology. Neurologist. 18 (6), 350-355 (2012).
- Boppart, S. A. Optical coherence tomography: Technology and applications for neuroimaging. Psychophysiology. 40 (4), 529-541 (2003).
- Hee, M. R., et al. Optical coherence tomography of the human retina. Arch. Ophthalmol. 113 (3), 325-332 (1995).
- Huang, D., et al. Optical coherence tomography. Science (80-.). 254 (5035), 1178-1181 (1991).
- vanVelthoven, M. E. J., Verbraak, F. D., Yannuzzi, L., Rosen, R. B., Podoleanu, A. G. H., deSmet, M. D. Imaging the retina by en face optical coherence tomography. Retina. 26 (2), 129-136 (2006).
- Costa, R. A., et al. Retinal assessment using optical coherence tomography. Prog. Retin. Eye Res. 25 (3), 325-353 (2006).
- DeBuc, D. C., Somfai, G. M., Ranganathan, S., Tátrai, E., Ferencz, M., Puliafito, C. A. Reliability and reproducibility of macular segmentation using a custom-built optical coherence tomography retinal image analysis software. J. Biomed. Opt. 14 (6), 64023 (2009).
- Budenz, D. L., et al. Determinants of Normal Retinal Nerve Fiber Layer Thickness Measured by Stratus OCT. Ophthalmology. 114 (6), 1046-1052 (2007).
- Leung, C. K. S., et al. Retinal Nerve Fiber Layer Imaging with Spectral-Domain Optical Coherence Tomography: A Prospective Analysis of Age-Related Loss. Ophthalmology. 119 (4), 731-737 (2012).
- Cettomai, D., et al. Reproducibility of optical coherence tomography in multiple sclerosis. Arch. Neurol. 65 (9), 1218-1222 (2008).
- Garcia-Martin, E., Pinilla, I., Idoipe, M., Fuertes, I., Pueyo, V. Intra and interoperator reproducibility of retinal nerve fibre and macular thickness measurements using Cirrus Fourier-domain OCT. Acta Ophthalmol. 89 (1), (2011).
- Garcia-Martin, E., Pueyo, V., Pinilla, I., Ara, J. R., Martin, J., Fernandez, J. Fourier-domain OCT in multiple sclerosis patients: reproducibility and ability to detect retinal nerve fiber layer atrophy. Invest. Ophthalmol. Vis. Sci. 52 (7), 4124-4131 (2011).
- Menke, M. N., Knecht, P., Sturm, V., Dabov, S., Funk, J. Reproducibility of nerve fiber layer thickness measurements using 3D fourier-domain OCT. Invest. Ophthalmol. Vis. Sci. 49 (12), 5386-5391 (2008).
- Mwanza, J. C., et al. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Investig. Ophthalmol. Vis. Sci. 51 (11), 5724-5730 (2010).
- Syc, S. B., et al. Reproducibility of high-resolution optical coherence tomography in multiple sclerosis. Mult Scler. 16 (7), 829-839 (2010).
- Ikram, M. K., Cheung, C. Y., Wong, T. Y., Chen, C. P. L. H. Retinal pathology as biomarker for cognitive impairment and Alzheimer's disease. J. Neurol. Neurosurg. Psychiatry. 83 (9), 917-922 (2012).
- MacGillivray, T. J., Trucco, E., Cameron, J. R., Dhillon, B., Houston, J. G., vanBeek, E. J. R. Retinal imaging as a source of biomarkers for diagnosis, characterization and prognosis of chronic illness or long-term conditions. Br. J. Radiol. 87 (1040), 20130832 (2014).
- Patton, N., et al. Retinal image analysis: Concepts, applications and potential. Prog. Retin. Eye Res. 25 (1), 99-127 (2006).
- McGrory, S., et al. The application of retinal fundus camera imaging in dementia: A systematic review. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 6, 91-107 (2017).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Hardin, J. S., Taibbi, G., Nelson, S. C., Chao, D., Vizzeri, G. Factors Affecting Cirrus-HD OCT Optic Disc Scan Quality: A Review with Case Examples. J. Ophthalmol. 2015, 1-16 (2015).
- Kim, N. R., et al. Influence of Cataract on Time Domain and Spectral Domain Optical Coherence Tomography Retinal Nerve Fiber Layer Measurements. J. Glaucoma. 1, (2010).
- Li, H., et al. Lens opacity and refractive influences on the measurement of retinal vascular fractal dimension. Acta Ophthalmol. 88 (6), e234-e240 (2010).
- Maberley, D., Morris, A., Hay, D., Chang, A., Hall, L., Mandava, N. A comparison of digital retinal image quality among photographers with different levels of training using a non-mydriatic fundus camera. Ophthalmic Epidemiol. 11 (3), 191-197 (2004).
- Rochtchina, E., Wang, J. J., Taylor, B., Wong, T. Y., Mitchell, P. Ethnic variability in retinal vessel caliber: A potential source of measurement error from ocular pigmentation?-The Sydney childhood eye study. Investig. Ophthalmol. Vis. Sci. 49 (4), 1362-1366 (2008).
- Wainwright, A., et al. Effect of image quality, color, and format on the measurement of retinal vascular fractal dimension. Investig. Ophthalmol. Vis. Sci. 51 (11), 5525-5529 (2010).
- Nguyen, T. T., Wong, T. Y. Retinal vascular manifestations of metabolic disorders. Trends Endocrinol. Metab. 17 (7), 262-268 (2006).
- Ding, J., et al. Retinal vascular caliber and the development of hypertension: a meta-analysis of individual participant data. J. Hypertens. 32 (2), 207-215 (2014).
- Nguyen, T. T., Wong, T. Y. Retinal vascular changes and diabetic retinopathy. Curr. Diab. Rep. 9 (4), 277-283 (2009).
- Leung, C. K. S., Ye, C., Weinreb, R. N., Yu, M., Lai, G., Lam, D. S. Impact of Age-related Change of Retinal Nerve Fiber Layer and Macular Thicknesses on Evaluation of Glaucoma Progression. Ophthalmology. 120 (12), 2485-2492 (2013).
- Sherry, L. M., et al. Reliability of computer-assisted retinal vessel measurement in a population. Clin. Experiment. Ophthalmol. 30 (3), 179-182 (2002).
- Wardlaw, J. M., et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 12 (8), 822-838 (2013).
- Patton, N., Aslam, T., MacGillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: A rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- Ferri, C. P., et al. Global prevalence of dementia: A Delphi consensus study. Lancet. 366 (9503), 2112-2117 (2005).
- Sahadevan, S., et al. Ethnic differences in Singapore's dementia prevalence: The stroke, Parkinson's disease, epilepsy, and dementia in Singapore study. J. Am. Geriatr. Soc. 56 (11), 2061-2068 (2008).
- Kernt, M., et al. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy (Optomap) compared with ETDRS 7-field stereo photography. Diabetes Care. 35 (12), 2459-2463 (2012).
- Manivannan, A., Plskova, J., Farrow, A., Mckay, S., Sharp, P. F., Forrester, J. V. Ultra-wide-field fluorescein angiography of the ocular fundus. Am. J. Ophthalmol. 140 (3), 525-527 (2005).
- Pellegrini, E., et al. Blood vessel segmentation and width estimation in ultra-wide field scanning laser ophthalmoscopy. Biomed. Opt. Express. 5 (12), 4329 (2014).
- Estrada, R., Tomasi, C., Schmidler, S. C., Farsiu, S. Tree topology estimation. IEEE Trans. Pattern Anal. Mach. Intell. 37 (8), 1688-1701 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved