JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
망막 화상 진 찰을 사용 하 여 치 매 공부 하기
요약
망막 뇌와 눈에 띄는 유사성을 공유 하 고 따라서 비 접촉 맥 관 구조와 뇌의 신경 구조를 공부 하는 독특한 창을 나타냅니다. 이 프로토콜에는 망막 이미징 기술을 사용 하 여 치 매를 공부 하는 방법을 설명 합니다. 이 방법은 잠재적으로 치 매 진단 및 위험 평가에 도움이 됩니다.
초록
망막은 독특한 "창" 중앙 신경 조직 (CNS)의 확장 이며 embryological 기원, 해 부 특징의 관점에서 뇌와 눈에 띄는 유사성을 공유로 치 매는 뇌에서의 병 태 생리 과정을 공부 하 고 생리 적 속성입니다. 망막의 혈관과 신경 구조 비 접촉 사용 하 여 쉽게 시각 망막 이미징 기술, 저 사진 등 광학 일관성 단층 촬영 (OCT), 그리고 반자동으로 사용 하 여 측정할 수 있습니다. 컴퓨터 기반 분석 프로그램입니다. 망막의 혈관과 신경 변화 및 치 매 사이 연결 공부 수 치 매에 대 한 우리의 이해를 향상 하 고, 잠재적으로, 진단 및 위험 평가에. 이 프로토콜 측정 하 고 잠재적으로 치 매와 관련 된 망막 맥 관 구조 및 신경 구조를 분석 하는 방법을 설명 하는 것을 목표로. 이 프로토콜도 치 매, 망막 과목 변경의 예를 제공 하 고 기술 문제 및 망막 화상의 현재 제한 사항에 설명 합니다.
서문
때문에 평균 수명 증가, 치 매 주요 의료 문제, 중요 한 사회에 기여 하 고 경제 건강 부담 세계적으로1,2,3,,45. 오늘, 미국에서 사람이 Alzheimer의 질병 (광고), 치 매, 모든 66 s6의 가장 일반적인 형태는 발전 한다. 그것은 2050 년까지 115 백만 사람들 것 이다 영향을 받을 광고7추정 되었다.
망막 뇌와 비슷한 해 부 및 생리 적 속성으로 인해 치 매 연구에 독특한 "창"을 제공 합니다. 맥 관 구조, 망막 arterioles 및 venules, 100 ~ 300 µ m 직경, 측정 끝 arterioles anastomoses, 장벽 기능 및 자동 제어8, 등 대뇌 작은 혈관과 비슷한 기능을 공유 9. 신경 구조, 망막 절 셀 (RGCs) 중앙 신경 시스템 (CNS) 10에에서 신경을 가진 일반적인 속성을 공유. 그들이 형성 측면 geniculate 핵을 우량한 colliculus 망막에서 시 신경 및 프로젝트 시각적 신호는 RGCs 눈에 띄게 두뇌와 연결 됩니다. 시 신경, CNS에 많은 신경 섬유와 유사한 oligodendrocytes에 의해 myelinated 이며 ensheathed meningeal 계층에 있습니다. 특히, 시 신경에 대 한 모욕이 될 수 있습니다 유사한 응답 다른 CNS 축 삭에서 관찰와 같은 역행 및 축 삭, 흉터 형성, myelin 파괴, 2 차 변성 및 科의 비정상적인 수준 참가자 변성 요인과 신경 전달 물질11,12,,1314. 일부 광고 환자에 시각적인 증 후의 외관 또한 망막 및 두뇌15,16간의 강력한 연결에 의해 설명 수 있습니다. 결과적으로, 그것은 제안 되었습니다 망막 치 매는 뇌에서의 병 적인 프로세스를 반영 수 있습니다 및 망막 화상 치 매 연구에 사용할 수 있습니다.
망막 맥 관 구조 및 신경 구조 지금 비 접촉 망막 이미징 기술을 사용 하 여 구상 될 수 있다. 예를 들어, 망막 저 사진 저 카메라를 사용 하 여 캡처할 수 있습니다 및 망막 맥 관 구조 (예: 선박 구경, tortuosity, 그리고 프랙탈 차원)의 특성 수 다음 측정할 수 컴퓨터 기반 분석을 사용 하 여 프로그램입니다. 또한, 매개 변수 (예: 신경 절의 세포 내 plexiform 레이어 [GC-IPL] 및 망막 신경 섬유 층 [RNFL]의 두께) 망막 신경 구조 또한 광학 일관성 단층 촬영 (OCT)를 사용 하 여 측정 될 수 있다 및 내장을 사용 하 여 정량 분석 알고리즘입니다.
치 매를 공부 하 고 망막 화상의 중요성에 비추어이 프로토콜 이미징 및 망막 맥 관 구조 및 신경 구조에 vivo에서 망막 이미징 기술을 사용 하 여 분석 하는 방법을 설명 하는 것을 목표로. 이 프로토콜도 치 매, 망막 과목 변경의 예를 제공 하 고 기술 문제 및 망막 화상의 현재 제한 사항에 설명 합니다.
프로토콜
여기에서 설명한 모든 방법을 홍콩에서 지역 임상 연구 윤리 위원회에 의해 승인 되었습니다.
참고: 단순, 장비 재료의 테이블에에서 나열 된 망막 이미징 및 후속 분석의 절차를 설명 하기 위해 사용 됩니다. 망막 혈관 매개 변수 측정 싱가포르 I 선박 평가 프로그램 (시바) 17 (버전 4.0, 국립 싱가포르 대학교, 싱가포르)를 사용 하 여 보여 줍니다. 그러나, 주목 해야 한다 기본 원칙 남아 비슷한 다른 장비 세트를 채택 될 수.
1. 망막 이미징에 대 한 주제를 준비
- 같은데요 과목 ’ mydriatic 에이전트를 사용 하 여 학생. 충분 한 눈동자 팽창 설정 하 15 분 이상 기다립니다.
2. 저 사진 사용 하 여 컴퓨터 기반 분석 프로그램에서 망막 혈관 매개 변수 측정
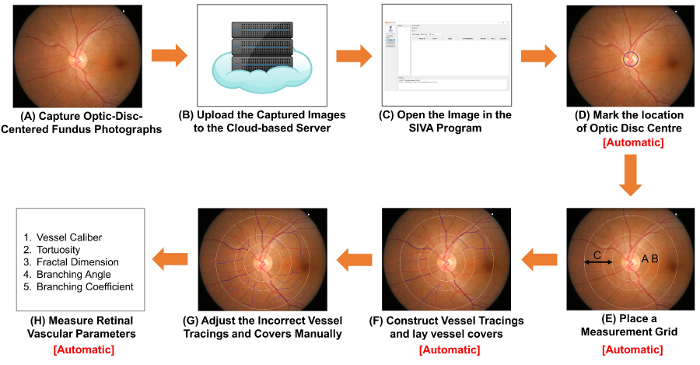
그림 1: 망막 혈관 파라미터 측정의 절차를 보여주는 회로도. (A) 받기 광학 디스크 중심 저 사진 저 카메라를 사용 하 여. 그림 1A와 그림 2A는 최적의 품질로 두 저 사진입니다. (B)는 클라우드 기반 서버에 저 사진을 업로드 하 고 이미지 변환 계수 (ICF)을 포함 하 여 관련 연구 정보를 입력. 다른 컴퓨터 기반 분석 프로그램 구성 하 고 이미지 저장 클라우드 기반 메서드를 사용할 수 있습니다. (C) 컴퓨터 기반 분석 프로그램에서 저 사진 엽니다. (D) 마크 광학 디스크 센터의 위치 및 (E) 소프트웨어를 자동으로 광학 디스크의 가장자리를 감지 하 고 측정 눈금을 배치 하 라는 메시지가. (F) 구조 선박 경시 선박 경로에 기반 하 고 배를 누워 추정 혈관의 직경을 다루고 있습니다. (G) 조정 잘못 된 선박 경시와 배 수동으로 커버. (H) 측정 스펙트럼을 망막 혈관 매개 변수, 선박 개조, tortuosity, 프랙탈 차원 및 분기를 포함 합니다. (D) 단계 단계 (F), 그리고 (H) 단계를 일부 컴퓨터 기반 분석 프로그램에 의해 자동으로 수행할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 저 사진 저 카메라를 사용 하 여 캡처.
컴퓨터에서
- 차례 저 카메라 및 이미지 캡처 시작 프로그램. 머리 끈에 대 한이 마와 chinrest에 피사체의 턱을 제대로 휴식. 주제에 제대로 광선을 정렬 하려면 컨트롤 레버를 이동 ’ s 학생.
- 둘 다 작은 뷰파인더에서 양쪽에 나타날 때까지 조명 포인트를 맞춥니다. 외부 고정 목표 주제 가이드를 이동 ’ s 눈 광학 디스크는 뷰파인더를의 중심에 있으며 관심 (ROI) 영역 경계 내에서 잘 때까지. 망막에 초점을 초점 손잡이 조정.
- 단단히 외부 고정 대상 봐 고 주제 제목이 ’ s 눈 가득 눈물.
- 이미지 ( 그림 1A) 캡처-셔터 버튼을 눌러.
- 캡처한 그림 2A를 사용 하 여 표준으로 저 사진의 품질을 확인 합니다. 이미지를 삭제 하 고 눈동자는 제대로 하는 경우 이미지 수집 프로세스 (즉, 단계 2.1.1 2.1.4)을 반복 확대 ( 그림 2B), 광학 디스크 이미지 ( 그림 2C)의 중심에 되지 않습니다 또는 이미지는 초점 ( 그림 2D).
- Gradable 해상도 (즉, 약 3000 픽셀 x 2,000 픽셀, 150 dpi 이상) TIFF 형식 이미지를 저장.
참고: 프로토콜 일시 중지할 수 있습니다 여기. - 다른 과목에 대 한 저 사진 얻으려고 반복 단계 2.1.1 2.1.6.
- 무작위로 10% 샘플 이미지를 선택 하 고 이러한 이미지 ( 그림 3)에 광학 디스크의 높이 측정. 계산 하는 수식을 사용 하 여 이미지 변환 계수 (ICF):
ICF = 1800 µ m (평균 광학 디스크의 샘플 이미지의 픽셀 높이) /. - 클라우드 기반 서버에 캡처된 저 사진을 업로드 하 고 관련 연구 정보, 이미지 변환 계수 (ICF) ( 그림 1B)를 포함 하 여.
참고: 프로토콜 수 수 일시 중지 여기. 다른 컴퓨터 기반 분석 프로그램 이미지를 구성 하 고 ICF를 기록 다른 클라우드 기반 메서드를 사용할 수 있습니다.
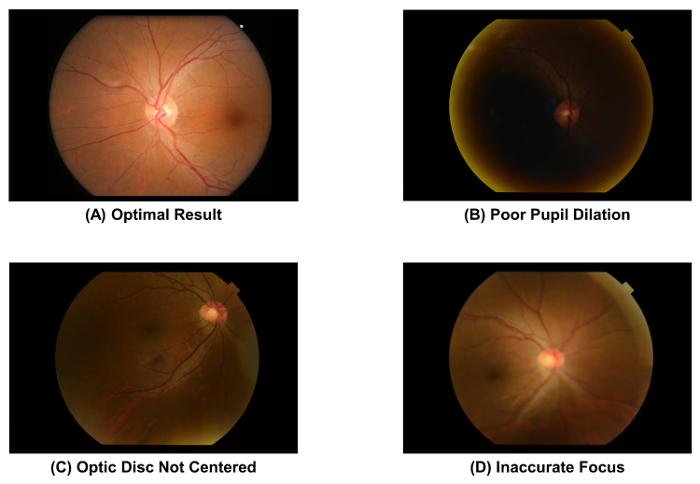
그림 2: 최적의 품질과 차선 저 사진. 이미지 품질은 망막 혈관 매개 변수의 후속 측정에 직접 영향을 저 사진의 이미지 품질 이미지 수집 후 즉시 확인 해야 합니다. 이러한 유물 중 관찰 되는 경우 이미지를 폐기 해야한다. 이러한 이미지는 50 ° 저 카메라를 사용 하 여 점령 했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
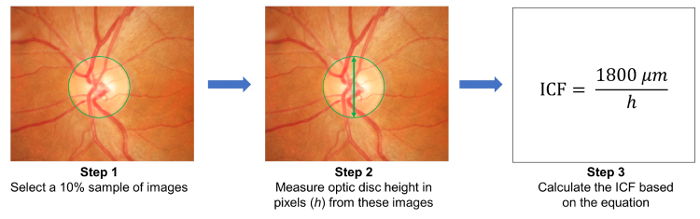
그림 3: 이미지 변환 계수 (ICF)의 계산. ICF를 계산 하려면 임의로 연구 (1 단계)에서 10% 샘플 이미지를 선택 합니다. 그런 다음 이미지에서 픽셀 단위로 광학 디스크의 높이 측정 샘플링 (2 단계). 수식을 사용 하 여 ICF를 계산: ICF = 1800 µ m / (샘플된 이미지의 광학 디스크의 픽셀 높이 평균), 1800 µ m가 정상 광학 디스크 (3 단계)의 높이 약. 확대 효과 이미지 해상도 카메라 카메라 다, 그것은 사용 하는 각 카메라에 대 한 정확한 ICF를 계산 하는 데 필요한. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 는 컴퓨터 기반 분석 프로그램에서 저 사진을 엽니다. 선박 경시를 구성 하 고 망막 맥 관 구조에 대 한 선박 커버 하다.
참고:이 섹션에 시바 프로그램 절차를 설명 하기 위해 사용 됩니다. 그러나, SIVA 프로그램은 다른 사용 가능한 컴퓨터 기반 분석 프로그램으로 교체하실 수 있습니다. 또한, 단계 2.2.2 2.2.3 자동으로 수행 하는 일부 컴퓨터 기반 분석 프로그램 때 저 사진을 열 (즉, 단계 2.2.1).- 컴퓨터 기반 분석 프로그램 ( 그림 1C) 저 사진 열.
- 광학 디스크 센터 ( 그림 1D)의 위치를 표시합니다.
- 클릭는 “ OD 센터 ” left 함수 패널에 버튼, 마우스 커서는 녹색 원에 의해 대체 될 것 이다.
- (OD), 광학 디스크의 센터에 녹색 동그라미를 이동 하 고 원을 해결 하기 위해 클릭.
- 표시 소프트웨어를 자동으로 측정 눈금, 선박 경시와 라y 선박 커버 ( 그림 1E, 1F).
참고: 선박 커버는 측정 선 혈관의 내부 루멘의 대략적인 너비를 추정입니다.- 클릭에 “ 찾을 OD ” OD 센터의 위치에 따라 측정 눈금으로 4 개의 동심원을 OD 가장자리 감지 소프트웨어를 버튼.
- 클릭은 “ 프로세스 ” 자동 선박 추적 과정을 시작 하려면 버튼.
- 조정 잘못 된 선박 경시 수동으로. 12에서 검사 시작 o ’ 모든 선박 경시는 확인 되도록 시계 방향으로 방식으로 위치를 시계.
- 광학 디스크 정확 하 게 감지 하 고 측정 눈금 올바르게 배치 확인
- . 수동으로 다음 단계 2.2.2 2.2.3, 측정 눈금을 조정 하는 경우 안쪽 원형 광학 디스크 림 ( 그림 4A)를 정확 하 게 설명 하지 않습니다.
- 선박 tracing(s) 잘못 된 선박 유형 (venules 대 arterioles) 표시를 선택 하 고 클릭 클릭 왼쪽에 “ 배 (T) 형식 ” 선박 종류를 변경 하려면 단추.
참고: Arterioles 빨간색으로 표시 되 고 venules는 파란색으로 표시 됩니다. Arterioles 그들의 생리 적인 차이에 따라 venules에서 구별 될 수 있다. 예를 들어 venules은 일반적으로 색깔에서 어둡고 arterioles 보다 넓은. 동일한 선박 유형 일반적으로 선박 서로 교차 하지 않는다. - 확장 불완전 한 선박 경시 단계 2.3.3.1 2.3.3.2 ( 그림 4B).
- 커서를 사용 하 여 불완전 한 선박 추적의 원심 끝에 클릭 하 여. 선박 추적을 확장 하는 선박 경로 따라 지점에서 클릭 왼쪽.
- 그릇의 원심 끝에 도달 하면 추적 프로세스를 중지 합니다. 그릇의 원심 부분 측정 그리드 밖에 서 떨어지는 경우 바깥쪽 흰 원에 추적 중지 ( 그림 4B 참조).
- 선박 경로 크로스 오버 사이트 ( 그림 4C)에서 제대로 추적 하지는 경우 선박 경시를 조정.
- 클릭에 “ 선택 ” 단추 및 선박 추적의 잘못 된 시점에서 다음을 클릭 합니다. 클릭은 “ Brea(k) Seg ” 버튼을 선택 하는 시점에서 선박 추적 분리. 연결 되지 않은 세그먼트를 선택 하 고 클릭는 “ (델) Seg ” 단추를 삭제 합니다.
- 다시 2.3.3.1 및 2.3.3.2 단계를 사용 하 여 새로운 선박 추적 생성.
- 선박 tracing(s) 잘못 된 선박 유형 (venules 대 arterioles) 표시를 선택 하 고 클릭 클릭 왼쪽에 “ 배 (T) 형식 ” 선박 종류를 변경 하려면 단추.
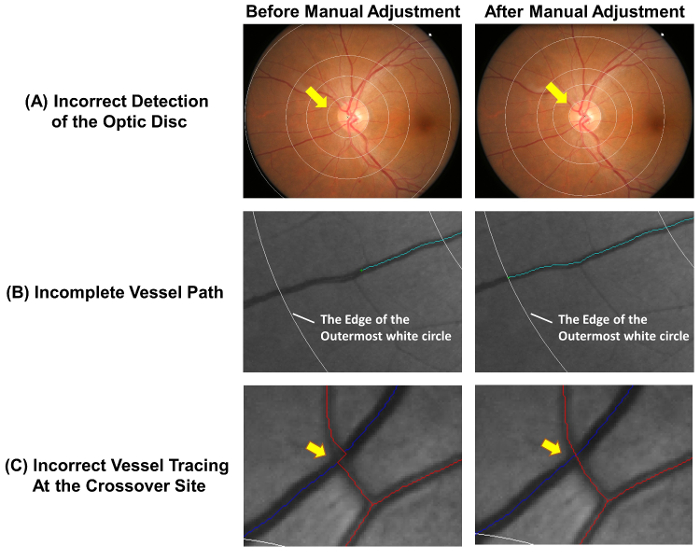
그림 4: 일반적인 오류 자동 추적의. 자동 선박 추적 완전히 정확 이며 수동 조정 측정의 정확성을 보장 하는 데 필요한. 이 그림을 자동 추적의 일반적인 오류 수동 조정 후 최적의 결과 보여 줍니다. (A) 광학 디스크 센터 잘못 표시 및 후속 측정에 영향을 미칠 수 있습니다 측정 눈금의 편차를이 리드. 이상적으로, 측정 눈금의 안쪽 원 광학 디스크 림을 설명 해야 합니다. (B) 불완전 한 선박 추적 프랙탈 차원, tortuosity, 등 선박 경로 선박 끝까지 추적 해야 잘못 측정 될 수 있습니다. 그릇의 원심 부분 측정 그리드 밖에 서 떨어지면, 바깥쪽 흰 원에 추적을 중지 수 있습니다. (C) 선박 크로스 오버 사이트에서 경시 오류의 높은 추세는 고 따라서 특별 한 주의가 필요. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 모든 선박에 선박 커버를 놓고 잘못 된 커버를 수동으로 비활성화.
- 클릭는 “ 커버 찾을 ” 버튼을 자동으로 모든 선박에 선박 커버 하다.
- 모든 선박 커버 올바르게 배치 됩니다 확인 하십시오. 선박을 비활성화 하려면 커서 커버는 커버 하지 않은 경우 끌어서 왼쪽 혈관 벽 ( 그림 5A)에 수직 누워, 선박 경로 다른 선박 ( 그림 5B)에 의해 가려진 또는 커버과 대 평가 또는 과소 평가 배 루멘 ( 그림 5C)의 폭.
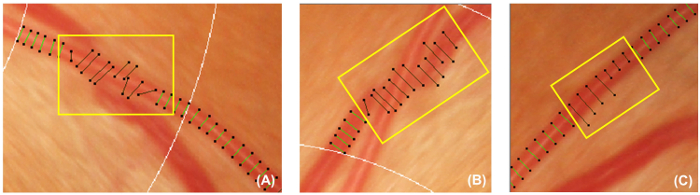
그림 5: 잘못 된 선박 커버. 이 그림은 비활성화 하 고 후속 측정에서 제외 해야 하는 잘못 된 그릇 덮개의 예를 보여줍니다. 혈관 (A)에 수직인 경우 선박 커버를 비활성화 한다. 또한, 선박 추적 중인 다른 선박 (B), 아래 가려진 선박 커버 비활성화도 한다 또는 선박 커버 선박 (C)의 대략적인 너비를 나타낼 수 없습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 선박 경시 및 선박 표지에서 망막 혈관 매개 변수 측정
참고: 단계 2.5 컴퓨터 기반 분석 프로그램에 의해 자동으로 수행 됩니다. 광학 디스크 여백 영역 B, 그리고 광학 디스크 여백 영역 C 18 ( 그림 6A)으로 떨어져 지역 0.5-2.0 디스크 직경에서- 레이블 영역 0.5-1.0 디스크 직경에 따라는 동맥 경화 위험 공동체 (ARIC)의 수정된 프로토콜 연구 19.
- B 영역과 영역 모두는 ARIC에서 수정 된 널리 채택 된 방법을 사용 하 여 C에서 망막 혈관 구경 측정 연구 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 ( 그림 6B).
- 선박 커버 6 큰 arterioles에 망막 혈관 구경 추정 6 가장 큰 venules의 길이 측정.
- 요약 arteriolar 망막 및 해당 중앙 망막 동맥으로 venular 구경 (CRAE) 및 중앙 망막 정 맥 (CRVE)에 해당 각각 17, 수정 된 Knudtson를 사용 하 여 – 파 허바드 수식 18 , 19.
- 식별 영역 C에 있는 모든 배는 너비 > 40 µ m. 선박 경시 따라 총 제곱된 곡률의 적분에서 망막 arteriolar 및 venular tortuosity 계산 그리고 전체 아크 길이, 굴복, 및 굴절의 포인트 값을 정규화 27 , 28.
- 계산 총, arteriolar, 및 venular 프랙탈 차원 C 사용 하 여 기존 영역에서 “ 상자 계산 방법 ” 29 , , 30 31.
- 일련의 동등 하 게 크기의 사각형으로 이미지를 분할.
- 선박 경시의 섹션을 포함 하는 상자 개수.
- 다른 크기와 동일 하 게 크기의 사각형의 시리즈를 사용 하 여 프로세스를 반복.
- 상자 포함 하는 상자의 크기의 로그에 대 한 선박 경시의 숫자의 로그를 플롯 결과 선의 기울기를 계산; 이것은 프랙탈 차원 이다.
- 영역 C에서에서 첫 분기와 선박을 식별 하 고 첫 번째 두 딸 배 32 ( 그림 6 c) 사이 subtended 각도 (θ)을 계산. 평균 분기 각도를 평균 값을 계산.
- 영역에서 수식을 사용 하 여 C에서 분기 계수를 계산:
(d 1 2 + 2 d 2) /d 0 2, d 0은 평균 트렁크 구경 및 d 1과 d 2는 평균 지점 구경 ( 그림 6 c).
- 등급 창을 닫습니다. 클릭 “ 보낼 ” 등급된 이미지 클라우드 기반 서버를 업로드 하 고 자동으로 측정 된 망막 혈관 매개 변수를 기록 하는 팝업 대화 상자에서.
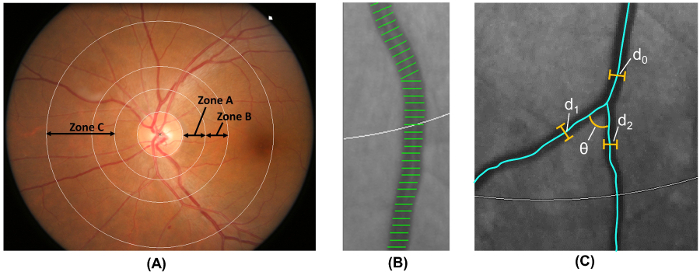
그림 6: 망막 맥 관 구조의 정량화. (A) 영역 B (0.5-1.0으로 정의 디스크 디스크 여백에서 직경) 지역 사회 연구에서 동맥 경화 위험에 따라 영역 B의 그릇 구경 측정 하는 데 사용. 영역 C (0.5-2.0으로 정의 디스크 디스크 여백에서 직경) 영역 C의 선박 개조와 망막 혈관 네트워크 매개 변수 (예: tortuosity, 프랙탈 차원, 및 분기)의 스펙트럼을 측정 하는 데 사용 됩니다. (B) 배 덮개는 측정 라인은 망막 혈관 구경 (직경)를 추정 하는 데 사용. 잘못 된 용기 커버는 수동으로 측정에서 제외 한다. (C) 모든 선박 내에서 그들의 첫 번째 분기는 자동으로 C, 프로그램 영역에 대 한 첫 번째 분기의 분기 각도 (θ)를 측정 합니다. 또한, 분기 계수는 또한 사용 하 여 계산 수식: 분기 계수 = (d 1 2 + 2 d 2) /d 0 2, 트렁크 구경 하 고 d 1 및 d d 0가 2 분기 구경 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
3. GC IPL와 RNFL의 두께 평가
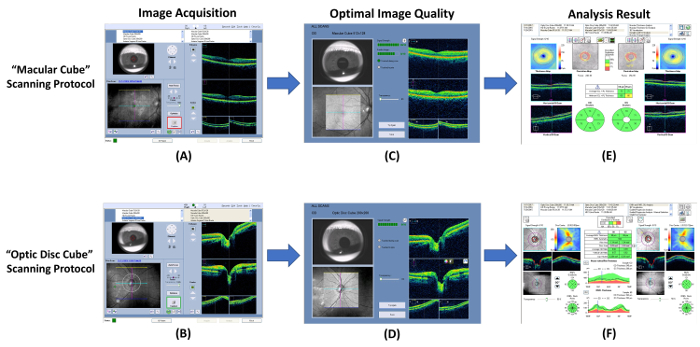
그림 7: RNFL 및 GC IPL 두께 측정의 절차를 보여주는 회로도. 광학 일관성 단층 촬영 (OCT) 신경 절 세포 안 plexiform 층 (GC-IPL) 및 망막 신경 섬유 층 (RNFL)의 두께 측정 하기 위해 사용할 수 있습니다. (A, B) 내장을 사용 하 여 GC-IPL 및 RNFL 두께 측정 “ 황 반 큐브 ” 및 “ 광학 디스크 큐브 ” 프로토콜을 각각 검색. (C, D) 이미지 수집 후 즉시 이미지 품질을 확인 합니다. 이미지를 삭제 하 고 신호 강도 6 보다 작은 경우 모션 유물 검색 검사를 반복 합니다. (E, F) 다음, 내장 된 분석 프로그램 자동으로 검사 결과 분석 하 고 해석에 대 한 보고서를 생성 하 라는 메시지가. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 광학 일관성 단층 촬영 (OCT)를 사용 하 여 이미지 수집 수행.
- OCT 프로그램을 열고 선택 합니다 “ 황 반 큐브 ” 새로운 황 반 검사 ( 그림 7A)를 시작 하는 프로토콜을 검색.
- 는 아이리스 뷰포트는 chinrest 조정 하 여 학생을 찾습니다. 낮은 조명 눈동자 크기가 너무 작은 경우.
- 클릭는 “ 자동 초점 ” 버튼 그리고는 “ 최적화 ” 버튼 이미지 품질 향상.
- 즉시 스캔을 시작 하기 전에 몇 번 깜박 주제 지시.
- 클릭 합니다 “ 캡처 ” 버튼을 둘러싼 테두리 녹색 때 검사를 시작 하는 버튼. 이미지 수집을 피하기 위해 모션 아티팩트 중 시각 고정 대상에 초점 주제 지시.
- 그림 ℃를 표준으로 사용 하 여 스캔 품질을 검토 합니다. 검사 결과 무시 하 고 신호 강도 6 ( 그림 8A) 보다 작은 경우 모션 유물 (혈관의 불연속으로 표시) 검색 스캔을 반복 ( 그림 8B).
- 검색 결과 저장.
- 반복 단계 다른 눈 3.1.7에 3.1.1.
- 와 시 신경 머리 검사 수행는 “ 광학 디스크 큐브 ” 3.1.2에 3.1.9 ( 그림 7B 및 7 D) 단계 프로토콜 다음 스캔.

그림 8: 광학 일관성 단층 촬영의 최적의 결과. 광학 일관성 단층 촬영 (OCT)의 일반적인 최적의 결과 포함 (A) 가난한 신호 강도 (강도 값 < 6), 그리고 (B) 모션 유물. 스캔 품질 이미지 수집 후 즉시 검토 해야 하 고 스캔 해야 이러한 유물 발생 경우 반복. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 황 반 GC IPL 두께의 분석 출력 생성.
- 선택은 “ 황 반 큐브 ” 분석 인터페이스에 양쪽 눈의 레코드를 스캔.
- 클릭 합니다 “ 신경 절 세포 OU 분석 ” 스캔 ( 그림 7E)의 GC IPL 두께 평가 자동 분석 알고리즘을 시작 하.
참고: 단계 3.2.2 분석 알고리즘에 의해 자동으로 완료 됩니다.- 는 14.13 m m 2 fovea 중심으로 타원형 고리는 0.6 m m 및 2.4 m m, 가로 내부 및 외부 반경을 각각, 그리고 0.5 m m와 2.0 m m, 세로 내부 및 외부 반경을 각각 생성.
참고: 크기와 모양이 타원형 환대의 황 반 해부학에 밀접 하 게 부합 하 고 따라서 고 RGCs 정상적인 눈 33 , 34에서 두꺼운 지역에 해당. 환대의 안 반지 내의 영역 측정 되지 않습니다,이 분야에서 GC IPL은 매우 얇은. - 세그먼트는 RNFL의 외부 경계와 내부 plexiform 레이어를 GC-IPL ( 그림 9)를 찾습니다 (IPL)의 바깥 경계.
- 측정 평균, 최소, 및 6 sectorial (superotemporal, 우수한, superonasal, inferonasal, 열 등 한, inferotemporal) fovea cen 내의 황 반 GC IPL의 두께입력 타원형 고리.
- 장치에 측정 된 GC IPL 두께 비교 ’ s 규범적인 나이 일치 내부 데이터베이스 및 편차 지도 및 중요성 지도 생성
- 분석 인쇄물에 측정 결과 보고.
- 는 14.13 m m 2 fovea 중심으로 타원형 고리는 0.6 m m 및 2.4 m m, 가로 내부 및 외부 반경을 각각, 그리고 0.5 m m와 2.0 m m, 세로 내부 및 외부 반경을 각각 생성.
- 분석 인쇄물.pdf 형식으로 저장.
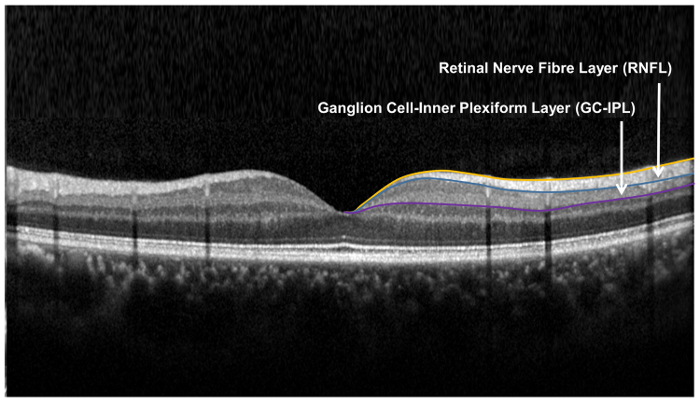
그림 9: 망막 층에 사용 되는 망막 신경 구조의 평가. 망막 신경 섬유 층 (RNFL) 신경 절 세포 안 plexiform 층 신경 절의 세포 분석 (GCA) 알고리즘을 사용 하 여 측정 하는 동안 시 신경 머리 (ONH) 알고리즘을 사용 하 여 측정 됩니다. ONH 알고리즘 RNFL의 두께 측정 하는 RNFL의 내부 및 외부 경계를 세그먼트화 합니다. GCA 알고리즘 검색 망막 신경 섬유 층 (RNFL)와 내부 plexiform 레이어 (IPL) 신경 절 세포 층 (GCL)의 결합된 두께 얻을 수의 외부 경계와 IPL. GCL과 IPL 사이의 경계는 해부학 별개 GCL 및 IPL의 두께, 측정 됩니다. 그러나, GCL과 IPL (즉, GC-IPL)의 결합 된 두께 여전히 RGCs. 건강의 지표는 의 더 큰 버전을 보려면 여기를 클릭 하십시오 그림.
- RNFL 두께 ( 그림 7 층)의 분석 출력 생성.
- 선택은 “ 광학 디스크 큐브 ” 분석 인터페이스에 양쪽 눈의 레코드를 스캔.
- 클릭 합니다 “ ONH 및 RNFL OU 분석 ” 스캔의 RNFL 두께 평가 자동 분석 알고리즘을 시작 하.
참고: 단계 3.3.2.1 3.3.2.6 분석 알고리즘에 의해 자동으로 완료 될 수 있다.- 각 검색 시점에서 RNFL 두께 측정 하 고 생성 하는 RNFL 두께 지도.
- 식별 하는 크기와 형태는 광학 디스크의 범위와 일치 하는 검색 센터 근처 어두운 장소를 감지 하 여 광학 디스크
- RNFL 두께에 광학 디스크 주위 직경에서 3.46 m m의 측정 눈금 위치.
- 측정 글로벌, 4-사분면 (시간적, 우수한, 비 강 및 열 등), 계산 하 고 측정 눈금의 12 시간 parapapillary RNFL 두께.
- 장치 측정된 RNFL 두께 비교 ’ s 규범적인 나이 일치 내부 데이터베이스 및 편차 지도 및 중요성 지도 생성.
- 분석 인쇄물에 측정 결과 보고.
- 분석 인쇄물.pdf 형식으로 저장.
결과
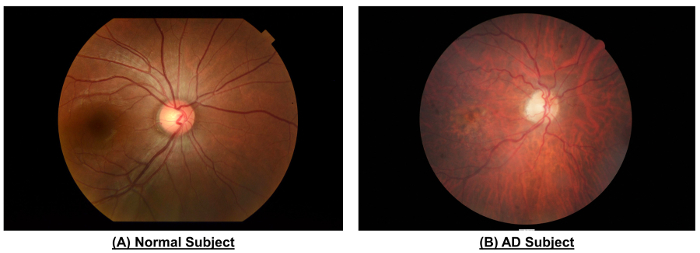
그림 10: 일반 주제와 광고 주제 망막 맥 관 구조에 차이 보여 예. 일반적인 주제에 비교 될 때 광고 주제의 저 사진 보여 좁은 그릇 구경 (CRAE 영역 B의, 116.4 µ m 대 156.4 µ m; 영역 B, 186.9 µ m 대 207.5 µ m; CRVE CRAE 영역 C, 138.5 µ m 대 165.8 µ m; 영역 C, 206.6 µ m <...
토론
이 프로토콜 비보에망막에 있는 신경 및 혈관 변화 측정의 절차를 설명 합니다. 망막은 뇌와 비슷한 embryological 기원, 기능 해 부 및 생리 속성 공유로이 망막 변화 맥 관 구조와 뇌의 신경 구조와 유사한 변화를 반영 수 있습니다.
그림 10 및 표 1에 표시 된 것 처럼 광고 주제 감소 선박 개조 건강 한 주제에 비교 될 때 보였다. 그것은 알...
공개
우리 학교 컴퓨팅, 기술 지원에 대 한 싱가포르의 국가 대학에 우리의 감사를 표현 하 고 싶습니다.
감사의 말
잠재적인 금융 관계에 관한 저자 티 엔 영 웡이이 문서에서 사용 되는 싱가포르 I 선박 평가 (시바) 프로그램의 공동 발명자 이다.
자료
| Name | Company | Catalog Number | Comments |
| Non-mydriatic Retinal Camera | Topcon, Inc, Tokyo, Japan | TRC 50DX | N/A |
| Singapore I Vessel Assessment Program | National University of Singapore | Version 4.0 | N/A |
| CIRRUS HD-OCT | Carl Zeiss Meditec, Inc, Dublin, CA | Model 4000 | N/A |
| Mydriatic Agents | N/A | N/A | Prepared from 1% tropicamide and 2.5% phenylephrine hydrochloride |
참고문헌
- Alzheimer's Disease International. The prevalence of dementia worldwide. Alzheimer's Dis. Int. (December), 1-2 (2008).
- Wimo, A., Winblad, B., &Jönsson, L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimer's Dement. 6 (2), 98-103 (2010).
- Comas-Herrera, A., Northey, S., Wittenberg, R., Knapp, M., Bhattacharyya, S., Burns, A. Future costs of dementia-related long-term care: exploring future scenarios. Int. Psychogeriatr. 23 (1), 20-30 (2011).
- Alzheimer's Association. Alzheimer's disease facts and figures. Alzheimer's Dement. 10 (2), e47-e92 (2014).
- Prince, M., Bryce, R., Albanese, E., Wimo, A., Ribeiro, W., Ferri, C. P. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers. Dement. 9 (1), 63-75 (2013).
- Alzheimer's Association. 2016 Alzheimer's disease facts and figures. Alzheimer's Dement. 12 (4), 459-509 (2016).
- Asih, P. R., Chatterjee, P., Verdile, G., Gupta, V. B., Trengove, R. D., Martins, R. N. Clearing the amyloid in Alzheimer's: progress towards earlier diagnosis and effective treatments - an update for clinicians. Neurodegener. Dis. Manag. 4 (5), 363-378 (2014).
- Cheung, C. Y., Ikram, M. K., Chen, C., Wong, T. Y. Imaging retina to study dementia and stroke. Prog. Retin. Eye Res. , (2017).
- Patton, N., Aslam, T., Macgillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: a rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nat. Rev. Neurol. 9 (1), 44-53 (2013).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Levkovitch-Verbin, H., Quigley, H. A., Kerrigan-Baumrind, L. A., D'Anna, S. A., Kerrigan, D., Pease, M. E. Optic nerve transection in monkeys may result in secondary degeneration of retinal ganglion cells. Investig. Ophthalmol. Vis. Sci. 42 (5), 975-982 (2001).
- Levkovitch-Verbin, H., Quigley, H. A., Martin, K. R., Zack, D. J., Pease, M. E., Valenta, D. F. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Sadun, A. A., Borchert, M., DeVita, E., Hinton, D. R., Bassi, C. J. Assessment of Visual Impairment in Patients With Alzheimer's Disease. Am. J. Ophthalmol. 104 (2), 113-120 (1987).
- Schlotterer, G., Moscovitch, M., Crapper-Mclachlan, D. Visual processing deficits as assessed by spatial frequency contrast sensitivity and backward masking in normal ageing and alzheimer's. Brain. 107 (1), 309-324 (1984).
- Cheung, C. Y. L., et al. A new method to measure peripheral retinal vascular caliber over an extended area. Microcirculation. 17 (7), 495-503 (2010).
- Knudtson, M. D., Lee, K. E., Hubbard, L. D., Wong, T. Y., Klein, R., Klein, B. E. K. Revised formulas for summarizing retinal vessel diameters. Curr. Eye Res. 27 (3), 143-149 (2003).
- Hubbard, L. D., et al. Methods for evaluation of retinal microvascular abnormalities associated with hypertension/sclerosis in the Atherosclerosis Risk in Communities Study. Ophthalmology. 106 (12), 2269-2280 (1999).
- Patton, N., et al. The association between retinal vascular network geometry and cognitive ability in an elderly population. Investig. Ophthalmol. Vis. Sci. 48 (5), 1995-2000 (2007).
- VanHecke, M. V., et al. Are retinal microvascular abnormalities associated with large artery endothelial dysfunction and intima-media thickness? The Hoorn Study. Clin. Sci. London Engl. 110 (5), 597-604 (2006).
- Tien, Y. W., et al. Retinal vascular caliber, cardiovascular risk factors, and inflammation: The Multi-Ethnic Study of Atherosclerosis (MESA). Investig. Ophthalmol. Vis. Sci. 47 (6), 2341-2350 (2006).
- Leung, H., et al. Relationships between age, blood pressure, and retinal vessel diameters in an older population. Investig. Ophthalmol. Vis. Sci. 44 (7), 2900-2904 (2003).
- Wong, T. Y., et al. The prevalence and risk factors of retinal microvascular abnormalities in older persons: The cardiovascular health study. Ophthalmology. 110 (4), 658-666 (2003).
- Ikram, M. K., et al. Retinal vessel diameters and risk of stroke: The Rotterdam Study. Neurology. 66 (9), 1339-1343 (2006).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: Methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Sasongko, M. B., et al. Alterations in retinal microvascular geometry in young type 1 diabetes. Diabetes Care. 33 (6), 1331-1336 (2010).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Mainster, M. a The fractal properties of retinal vessels: embryological and clinical implications. Eye. 4 ( Pt 1) (1), 235-241 (1990).
- Liew, G., et al. The Retinal Vasculature as a Fractal: Methodology, Reliability, and Relationship to Blood Pressure. Ophthalmology. 115 (11), (2008).
- Stosic, T., Stosic, B. D. Multifractal analysis of human retinal vessels. IEEE Trans. Med. Imaging. 25 (8), 1101-1107 (2006).
- Zamir, M., Medeiros, J. A., Cunningham, T. K. &. a. m. p. ;. M., Zamir, J. A., Medeiros, T. K. C. Arterial bifurcations in the human retina. J. Gen. Physiol. 74 (4), 537-548 (1979).
- Mwanza, J. C., Oakley, J. D., Budenz, D. L., Chang, R. T., Knight, O. J., Feuer, W. J. Macular ganglion cell-inner plexiform layer: Automated detection and thickness reproducibility with spectral domain-optical coherence tomography in glaucoma. Investig. Ophthalmol. Vis. Sci. 52 (11), 8323-8329 (2011).
- Bendschneider, D., et al. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J. Glaucoma. 19 (7), 475-482 (2010).
- Cheung, C. Y., Ong, Y. T., Ikram, M. K., Chen, C., Wong, T. Y. Retinal Microvasculature in Alzheimer's Disease. J. Alzheimer's Dis. 42 (s4), S339-S352 (2014).
- Murray, C. D. THE PHYSIOLOGICAL PRINCIPLE OF MINIMUM WORK APPLIED TO THE ANGLE OF BRANCHING OF ARTERIES. J. Gen. Physiol. (4), 835-841 (1926).
- Ding, J., et al. Early retinal arteriolar changes and peripheral neuropathy in diabetes. Diabetes Care. 35 (5), 1098-1104 (2012).
- Yim, C., et al. Retinal Ganglion Cell Analysis Using High-Definition Optical Coherence Tomography in Patients with Mild Cognitive Impairment and Alzheimer's Disease. J. Alzheimer's Dis. Retin. Ganglion Cell Anal. MCI AD. 45 (1), 45-56 (2015).
- Stein, D. M., Wollstein, G., Ishikawa, H., Hertzmark, E., Noecker, R. J., Schuman, J. S. Effect of Corneal Drying on Optical Coherence Tomography. Ophthalmology. 113 (6), 985-991 (2006).
- Mwanza, J. C., et al. Effect of Cataract and its Removal on Signal Strength and Peripapillary Retinal Nerve Fiber Layer Optical Coherence Tomography Measurements. J. Glaucoma. 20 (1), 37-43 (2011).
- Garcia-Martin, E., et al. Influence of cataract surgery on optical coherence tomography and neurophysiology measurements in patients with retinitis pigmentosa. Am. J. Ophthalmol. 156 (2), (2013).
- Kok, P. H. B., et al. The relationship between the optical density of cataract and its influence on retinal nerve fibre layer thickness measured with spectral domain optical coherence tomography. Acta Ophthalmol. , (2012).
- Kim, N. R., et al. Influence of cataract on time domain and spectral domain optical coherence tomography retinal nerve fiber layer measurements. J. Glaucoma. 21 (2), 116-122 (2012).
- Hwang, Y. H., Kim, Y. Y. Effect of Peripapillary Vitreous Opacity on Retinal Nerve Fiber Layer Thickness Measurement Using Optical Coherence Tomography. Arch. Ophthalmol. 130 (6), 789-792 (2012).
- Schwartz, S. G., Flynn, H. W., Fisher, Y. L. "Floater scotoma" demonstrated on spectral-domain optical coherence tomography and caused by vitreous opacification. Ophthalmic Surg. Lasers Imaging Retina. 44 (4), 415-418 (2013).
- Frost, S., et al. Retinal vascular biomarkers for early detection and monitoring of Alzheimer's disease. Transl. Psychiatry. 3 (2), e233 (2013).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- DeJong, F. J., et al. Retinal vascular caliber and risk of dementia: The Rotterdam Study. Neurology. 76 (9), 816-821 (2011).
- Cheung, C. Y., et al. Quantitative and qualitative retinal microvascular characteristics and blood pressure. J. Hypertens. 29 (7), 1380-1391 (2011).
- Cheung, C. Y., et al. Retinal vascular fractal dimension and its relationship with cardiovascular and ocular risk factors. Am. J. Ophthalmol. 154 (4), 663-674 (2012).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Grinton, M. E., et al. The association between retinal vessel morphology and retinal nerve fiber layer thickness in an elderly population. Ophthalmic Surg. Lasers Imaging. 43 (6 Suppl), S61-S66 (2012).
- Hughes, A. D., et al. Quantification of topological changes in retinal vascular architecture in essential and malignant hypertension. J. Hypertens. 24 (5), 889-894 (2006).
- Hughes, A. D., et al. Determinants of retinal microvascular architecture in normal subjects. Microcirculation. 16 (2), 159-166 (2009).
- Lau, Q. P., Lee, M. L., Hsu, W., Wong, T. Y. The Singapore Eye Vessel Assessment System. Image Anal. Model. Ophthalmol. , 143-160 (2014).
- Thomas, G. N., et al. Measurement of Macular Fractal Dimension Using a Computer-Assisted Program. Investig. Opthalmology Vis. Sci. 55 (4), 2237 (2014).
- Murray, C. D. The physiological principle of minimal work. I. The vascular system and the cost of blood volume. Proc. Natl. Acad. Sci. 12, 207-214 (1926).
- Cheung, C., Chen, C., Wong, T. Ocular Fundus Photography as a Tool to Study Stroke and Dementia. Semin. Neurol. 35 (5), 481-490 (2015).
- Williams, M. A., et al. Retinal microvascular network attenuation in Alzheimer's disease. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 1 (2), 229-235 (2015).
- Cheung, C. Y., et al. Retinal Vascular Fractal Dimension Is Associated with Cognitive Dysfunction. J. Stroke Cerebrovasc. Dis. 23 (1), 43-50 (2014).
- Hammes, H. P., et al. Diabetic retinopathy: targeting vasoregression. Diabetes. 60 (1), 9-16 (2011).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- Frame, M. D., Sarelius, I. H. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc Res. 46 (2), 190-205 (1993).
- Djonov, V., Baum, O., Burri, P. H. Vascular remodeling by intussusceptive angiogenesis. Cell Tissue Res. 314 (1), 107-117 (2003).
- Griffith, T. M., Edwards, D. H. Basal EDRF activity helps to keep the geometrical configuration of arterial bifurcations close to the Murray optimum. J. Theor. Biol. 146 (4), 545-573 (1990).
- Griffith, T. M., Edwards, D. H., Randall, M. D. Blood flow and optimal vascular topography: role of the endothelium. Basic Res. Cardiol. 86 Suppl 2, 89-96 (1991).
- Chapman, N., Haimes, G., Stanton, A. V., Thom, S. A. M., Hughes, A. D. Acute effects of oxygen and carbon dioxide on retinal vascular network geometry in hypertensive and normotensive subjects. Clin. Sci. 99 (6), 483-488 (2000).
- Heringa, S. M., Bouvy, W. H., van denBerg, E., Moll, A. C., Jaap Kappelle, L., Jan Biessels, G. Associations between retinal microvascular changes and dementia, cognitive functioning, and brain imaging abnormalities: a systematic review. J. Cereb. blood flow Metab. 33 (7), 983-995 (2013).
- Ding, J., et al. Diabetic retinopathy and cognitive decline in older people with type 2 diabetes: The Edinburgh type 2 diabetes study. Diabetes. 59 (11), 2883-2889 (2010).
- Parisi, V., Restuccia, R., Fattapposta, F., Mina, C., Bucci, M. G., Pierelli, F. Morphological and functional retinal impairment in Alzheimer's disease patients. Clin. Neurophysiol. 112 (10), 1860-1867 (2001).
- Paquet, C., Boissonnot, M., Roger, F., Dighiero, P., Gil, R., Hugon, J. Abnormal retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Neurosci. Lett. 420 (2), 97-99 (2007).
- Moschos, M. M., et al. Structural and functional impairment of the retina and optic nerve in Alzheimer's disease. Curr. Alzheimer Res. 9 (7), 782-788 (2012).
- Lu, Y., et al. Retinal nerve fiber layer structure abnormalities in early Alzheimer's disease: Evidence in optical coherence tomography. Neurosci. Lett. 480 (1), 69-72 (2010).
- Kesler, A., Vakhapova, V., Korczyn, A. D., Naftaliev, E., Neudorfer, M. Retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Clin. Neurol. Neurosurg. 113 (7), 523-526 (2011).
- Ascaso, F. J., et al. Retinal alterations in mild cognitive impairment and Alzheimer's disease: An optical coherence tomography study. J. Neurol. 261 (8), 1522-1530 (2014).
- Berisha, F., Feke, G. T., Trempe, C. L., McMeel, J. W., Schepens, C. L. Retinal abnormalities in early Alzheimer's disease. Investig. Ophthalmol. Vis. Sci. 48 (5), 2285-2289 (2007).
- Iseri, P. K., Altinaş, O., Tokay, T., Yüksel, N. Relationship between Cognitive Impairment and Retinal Morphological and Visual Functional Abnormalities in Alzheimer Disease. J. Neuro-Ophthalmology. 26 (1), 18-24 (2006).
- Garcia-Martin, E. S., et al. Macular thickness as a potential biomarker of mild Alzheimer's disease. Ophthalmology. 121 (5), 1149-1151 (2014).
- Ko, F., et al. Retinal Nerve Fiber Layer Thinning Associated With Poor Cognitive Function Among A Large Cohort, The Uk Biobank. Alzheimer's Dement. 12 (7), P317-P318 (2016).
- Moreno-Ramos, T., Benito-Leon, J., Villarejo, A., Bermejo-Pareja, F. Retinal nerve fiber layer thinning in dementia associated with Parkinson's disease, dementia with Lewy bodies, and Alzheimer's disease. J. Alzheimers. Dis. 34 (3), 659-664 (2013).
- Moschos, M. M., et al. Morphologic changes and functional retinal impairment in patients with Parkinson disease without visual loss. Eur. J. Ophthalmol. 21 (1), 24-29 (2011).
- Garcia-Martin, E., et al. Ability and reproducibility of Fourier-domain optical coherence tomography to detect retinal nerve fiber layer atrophy in Parkinson's disease. Ophthalmology. 119 (10), 2161-2167 (2012).
- Yip, W., et al. Comparison of Common Retinal Vessel Caliber Measurement Software and a Conversion Algorithm. Transl. Vis. Sci. Technol. 5 (5), 11 (2016).
- Gorelick, P. B., et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association. Stroke. 42 (9), 2672-2713 (2011).
- Brown, W. R., Thore, C. R. Review: Cerebral microvascular pathology in ageing and neurodegeneration. Neuropathol. Appl. Neurobiol. 37 (1), 56-74 (2011).
- DeSilva, T. M., Faraci, F. M. Microvascular Dysfunction and Cognitive Impairment. Cell. Mol. Neurobiol. 36 (2), 241-258 (2016).
- Kalaria, R. N., Akinyemi, R., Ihara, M. Does vascular pathology contribute to Alzheimer changes?. J. Neurol. Sci. 322 (1-2), 141-147 (2012).
- Kling, M. A., Trojanowski, J. Q., Wolk, D. A., Lee, V. M. Y., Arnold, S. E. Vascular disease and dementias: paradigm shifts to drive research in new directions. Alzheimers. Dement. 9 (1), 76-92 (2013).
- O'Brien, J. T., et al. Vascular cognitive impairment. Lancet Neurol. 2 (2), 89-98 (2003).
- Chen, C., et al. Alzheimer's disease with cerebrovascular disease: current status in the Asia-Pacific region. J. Intern. Med. 280 (4), 359-374 (2016).
- Pérez, M. A., Bruce, B. B., Newman, N. J., Biousse, V. The use of retinal photography in nonophthalmic settings and its potential for neurology. Neurologist. 18 (6), 350-355 (2012).
- Boppart, S. A. Optical coherence tomography: Technology and applications for neuroimaging. Psychophysiology. 40 (4), 529-541 (2003).
- Hee, M. R., et al. Optical coherence tomography of the human retina. Arch. Ophthalmol. 113 (3), 325-332 (1995).
- Huang, D., et al. Optical coherence tomography. Science (80-.). 254 (5035), 1178-1181 (1991).
- vanVelthoven, M. E. J., Verbraak, F. D., Yannuzzi, L., Rosen, R. B., Podoleanu, A. G. H., deSmet, M. D. Imaging the retina by en face optical coherence tomography. Retina. 26 (2), 129-136 (2006).
- Costa, R. A., et al. Retinal assessment using optical coherence tomography. Prog. Retin. Eye Res. 25 (3), 325-353 (2006).
- DeBuc, D. C., Somfai, G. M., Ranganathan, S., Tátrai, E., Ferencz, M., Puliafito, C. A. Reliability and reproducibility of macular segmentation using a custom-built optical coherence tomography retinal image analysis software. J. Biomed. Opt. 14 (6), 64023 (2009).
- Budenz, D. L., et al. Determinants of Normal Retinal Nerve Fiber Layer Thickness Measured by Stratus OCT. Ophthalmology. 114 (6), 1046-1052 (2007).
- Leung, C. K. S., et al. Retinal Nerve Fiber Layer Imaging with Spectral-Domain Optical Coherence Tomography: A Prospective Analysis of Age-Related Loss. Ophthalmology. 119 (4), 731-737 (2012).
- Cettomai, D., et al. Reproducibility of optical coherence tomography in multiple sclerosis. Arch. Neurol. 65 (9), 1218-1222 (2008).
- Garcia-Martin, E., Pinilla, I., Idoipe, M., Fuertes, I., Pueyo, V. Intra and interoperator reproducibility of retinal nerve fibre and macular thickness measurements using Cirrus Fourier-domain OCT. Acta Ophthalmol. 89 (1), (2011).
- Garcia-Martin, E., Pueyo, V., Pinilla, I., Ara, J. R., Martin, J., Fernandez, J. Fourier-domain OCT in multiple sclerosis patients: reproducibility and ability to detect retinal nerve fiber layer atrophy. Invest. Ophthalmol. Vis. Sci. 52 (7), 4124-4131 (2011).
- Menke, M. N., Knecht, P., Sturm, V., Dabov, S., Funk, J. Reproducibility of nerve fiber layer thickness measurements using 3D fourier-domain OCT. Invest. Ophthalmol. Vis. Sci. 49 (12), 5386-5391 (2008).
- Mwanza, J. C., et al. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Investig. Ophthalmol. Vis. Sci. 51 (11), 5724-5730 (2010).
- Syc, S. B., et al. Reproducibility of high-resolution optical coherence tomography in multiple sclerosis. Mult Scler. 16 (7), 829-839 (2010).
- Ikram, M. K., Cheung, C. Y., Wong, T. Y., Chen, C. P. L. H. Retinal pathology as biomarker for cognitive impairment and Alzheimer's disease. J. Neurol. Neurosurg. Psychiatry. 83 (9), 917-922 (2012).
- MacGillivray, T. J., Trucco, E., Cameron, J. R., Dhillon, B., Houston, J. G., vanBeek, E. J. R. Retinal imaging as a source of biomarkers for diagnosis, characterization and prognosis of chronic illness or long-term conditions. Br. J. Radiol. 87 (1040), 20130832 (2014).
- Patton, N., et al. Retinal image analysis: Concepts, applications and potential. Prog. Retin. Eye Res. 25 (1), 99-127 (2006).
- McGrory, S., et al. The application of retinal fundus camera imaging in dementia: A systematic review. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 6, 91-107 (2017).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Hardin, J. S., Taibbi, G., Nelson, S. C., Chao, D., Vizzeri, G. Factors Affecting Cirrus-HD OCT Optic Disc Scan Quality: A Review with Case Examples. J. Ophthalmol. 2015, 1-16 (2015).
- Kim, N. R., et al. Influence of Cataract on Time Domain and Spectral Domain Optical Coherence Tomography Retinal Nerve Fiber Layer Measurements. J. Glaucoma. 1, (2010).
- Li, H., et al. Lens opacity and refractive influences on the measurement of retinal vascular fractal dimension. Acta Ophthalmol. 88 (6), e234-e240 (2010).
- Maberley, D., Morris, A., Hay, D., Chang, A., Hall, L., Mandava, N. A comparison of digital retinal image quality among photographers with different levels of training using a non-mydriatic fundus camera. Ophthalmic Epidemiol. 11 (3), 191-197 (2004).
- Rochtchina, E., Wang, J. J., Taylor, B., Wong, T. Y., Mitchell, P. Ethnic variability in retinal vessel caliber: A potential source of measurement error from ocular pigmentation?-The Sydney childhood eye study. Investig. Ophthalmol. Vis. Sci. 49 (4), 1362-1366 (2008).
- Wainwright, A., et al. Effect of image quality, color, and format on the measurement of retinal vascular fractal dimension. Investig. Ophthalmol. Vis. Sci. 51 (11), 5525-5529 (2010).
- Nguyen, T. T., Wong, T. Y. Retinal vascular manifestations of metabolic disorders. Trends Endocrinol. Metab. 17 (7), 262-268 (2006).
- Ding, J., et al. Retinal vascular caliber and the development of hypertension: a meta-analysis of individual participant data. J. Hypertens. 32 (2), 207-215 (2014).
- Nguyen, T. T., Wong, T. Y. Retinal vascular changes and diabetic retinopathy. Curr. Diab. Rep. 9 (4), 277-283 (2009).
- Leung, C. K. S., Ye, C., Weinreb, R. N., Yu, M., Lai, G., Lam, D. S. Impact of Age-related Change of Retinal Nerve Fiber Layer and Macular Thicknesses on Evaluation of Glaucoma Progression. Ophthalmology. 120 (12), 2485-2492 (2013).
- Sherry, L. M., et al. Reliability of computer-assisted retinal vessel measurement in a population. Clin. Experiment. Ophthalmol. 30 (3), 179-182 (2002).
- Wardlaw, J. M., et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 12 (8), 822-838 (2013).
- Patton, N., Aslam, T., MacGillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: A rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- Ferri, C. P., et al. Global prevalence of dementia: A Delphi consensus study. Lancet. 366 (9503), 2112-2117 (2005).
- Sahadevan, S., et al. Ethnic differences in Singapore's dementia prevalence: The stroke, Parkinson's disease, epilepsy, and dementia in Singapore study. J. Am. Geriatr. Soc. 56 (11), 2061-2068 (2008).
- Kernt, M., et al. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy (Optomap) compared with ETDRS 7-field stereo photography. Diabetes Care. 35 (12), 2459-2463 (2012).
- Manivannan, A., Plskova, J., Farrow, A., Mckay, S., Sharp, P. F., Forrester, J. V. Ultra-wide-field fluorescein angiography of the ocular fundus. Am. J. Ophthalmol. 140 (3), 525-527 (2005).
- Pellegrini, E., et al. Blood vessel segmentation and width estimation in ultra-wide field scanning laser ophthalmoscopy. Biomed. Opt. Express. 5 (12), 4329 (2014).
- Estrada, R., Tomasi, C., Schmidler, S. C., Farsiu, S. Tree topology estimation. IEEE Trans. Pattern Anal. Mach. Intell. 37 (8), 1688-1701 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유