A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
באמצעות הדמיה ברשתית ללמוד דמנציה
In This Article
Summary
הרשתית מניות דמיון בולט עם המוח, ובכך מייצג חלון ייחודי ללמוד להערכת ומבנה עצביים במוח לא פולשני. פרוטוקול זה מתאר שיטה ללמוד דמנציה באמצעות טכניקות הדמיה ברשתית. שיטה זו יכולה לסייע פוטנציאל הערכת הסיכון ואבחון של דמנציה.
Abstract
הרשתית מציע ייחודי "חלון" ללמוד תהליכים הקשורים pathophysiological של דמנציה במוח, כמו זה הוא הרחבה של מערכת העצבים המרכזית (CNS) מניות דמיון בולט עם המוח מבחינת מוצאו embryological, תכונות אנטומיות, מאפיינים פיזיולוגיים. מבנה כלי הדם ו עצביים ברשתית כעת ניתן רשתית מטמיעים בקלות ושימוש לא פולשני טכניקות הדמיה, לרבות טומוגרפיה אופטית קוהרנטית (אוקטובר) וצילום הפונדוס, לכמת באופן אוטומטי למחצה באמצעות תוכניות המחשב בסיוע ניתוח. לומד את השיוכים בין דמנציה וסקולרית שינויים עצביים ברשתית יכולה לשפר את ההבנה שלנו של דמנציה וסיוע, באופן פוטנציאלי, על הערכת הסיכון ואבחון. פרוטוקול זה שמטרתו לתאר שיטה לכימות וניתוח להערכת רשתית מבנה עצביים, אשר קשורים באופן פוטנציאלי עם דמנציה. פרוטוקול זה גם מספק דוגמאות של שינויים ברשתית במקצועות עם דמנציה ודן בנושאים טכניים ומגבלות הנוכחי של הדמיה ברשתית.
Introduction
בשל עליות בתוחלת החיים, דמנציה הפך לבעיה רפואית גדולה, לתרום חברתית משמעותית, הבריאות הכלכלית להכביד באופן גלובלי1,2,3,4,5. היום, אדם בארצות הברית מתפתחת מחלת אלצהיימר (AD), הצורה הנפוצה ביותר של דמנציה, כל s 666. ההערכה היא כי עד שנת 2050, 115 מיליון אנשים יושפעו לספירה7.
הרשתית מציע ייחודי "חלון" ללמוד דמנציה עקב תכונותיו אנטומית, פיזיולוגית דומה עם המוח. מבחינת להערכת, רבים ברשתית venules, מדידה מיקרומטר 100 עד 300 בקוטר חולקים תכונות דומות עם מוחי כלי שיט קטנים, כגון סיום רבים בלי חיבור, מחסום פונקציה ו- auto-תקנה8, 9. במונחים של מבנה עצביים, תאים ברשתית ganglionic (RGCs) חולק מאפיינים טיפוסיים עם נוירונים במערכת העצבים המרכזית (CNS) 10. RGCs מחוברים באופן בולט עם המוח כפי שהם מעצבים את עצב הראייה ופרוייקט חזותי אותות מן הרשתית של גרעין הברך הצדי לרוחב, רקתי עליון. עצב הראייה, הדומה סיבים עצביים רבים של מערכת העצבים, הוא סיבי העצב על ידי oligodendrocytes להפוך והוא ensheathed בשכבות של קרום המוח. ראוי לציין, עלבון עצב הראייה עלולה לגרום בתגובות דומות נצפו אקסונים CNS אחרים, כגון ייסוג anterograde ניוון של הפעולה באקסון, היווצרות צלקת, הרס המיאלין, ניוון משני ברמות חריגות של neurotrophic נוירוטרנסמיטורים וגורמי11,12,13,14. הופעת הסימפטומים חזותיים אצל חלק מהחולים לספירה עשוי גם להיות מוסברת על ידי השיוכים חזקים בין הרשתית לבין המוח ה-15,16. כתוצאה מכך, הוצע כי הרשתית עשוי לשקף את התהליכים הפתולוגיים של דמנציה במוח, הדמיה ברשתית ניתן ללמוד דמנציה.
להערכת ברשתית ומבנה עצביים עכשיו להיות visualized לא-פולשנית באמצעות טכניקות הדמיה ברשתית. למשל, צילומים הפונדוס ברשתית יכולה להילכד באמצעות מצלמות הפונדוס, מאפייני להערכת ברשתית (למשל, כלי קליבר, tortuosity ופרקטל ממד) ואז ניתן לכמת באמצעות ניתוח בסיוע מחשב תוכניות. בנוסף, פרמטרים של המבנה עצביים ברשתית (כגון עובי גנגליון תא-הפנימית plexiform שכבה [GC-IPL] ושכבת סיבי עצב ברשתית [RNFL]) ניתן גם למדוד באמצעות טומוגרפיה אופטית קוהרנטית (אוקטובר), לכמת באמצעות אנרגיה ניתוח אלגוריתמים.
לאור החשיבות של הדמיה ברשתית ללמוד דמנציה, פרוטוקול זה שואפת לתאר את שיטת הדמיה וניתוח להערכת רשתית מבנה עצביים ויוו באמצעות טכניקות הדמיה ברשתית. פרוטוקול זה גם מספק דוגמאות של שינויים ברשתית במקצועות עם דמנציה ודן בנושאים טכניים ומגבלות הנוכחי של הדמיה ברשתית.
Protocol
כל השיטות המתוארות כאן אושרו על ידי ועדת האתיקה מחקר קליני מקומי בהונג קונג-
הערה: פשטות, הציוד המפורטים בטבלה של חומרים משמש להמחשת ההליכים של הרשתית הדמיה וניתוח עוקבות. מדידה של פרמטרים של כלי הדם ברשתית מומחש באמצעות סינגפור I כלי הערכת התוכנית (שיבה) 17 (גירסה 4.0, אוניברסיטת סינגפור הלאומית). עם זאת, יצוין כי יכול להיות מאומץ קבוצה שונה של ציוד כמו עקרונות היסוד נשאר דומה.
1. להכין את הנושאים רשתית הדמיה
- מתרחבים הנושאים ’ תלמידים באמצעות סוכן mydriatic. לחכות לפחות 15 דקות להקים מספיק נורמאליות.
2. למדוד את הפרמטרים כלי דם רשתית הפונדוס תמונות באמצעות תוכנת המחשב בסיוע ניתוח
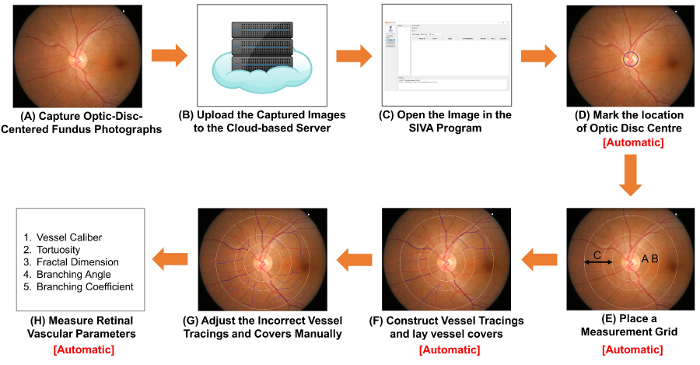
איור 1: תרשים סכמטי מציג את תהליכי מדידת פרמטרים של כלי הדם ברשתית. (א) קבל הפונדוס אופטיים-דיסק-ממורכז תצלומים באמצעות מצלמה הפונדוס. איור 1A איור 2A שתי תמונות הפונדוס עם איכות מיטבית בקרב אנשי עסקים ותיירים כאחד. (B) להעלות את התמונות הפונדוס לשרת המבוסס על ענן צמתים והזן פרטי הלימוד הרלוונטיים, כולל את פקטור המרה של תמונה (ICF). תוכניות אחרות המחשב בסיוע ניתוח עשויים להשתמש בשיטות שאינן מבוססות על ענן כדי לארגן ולאחסן את התמונות. (ג) פתח התצלום הפונדוס בתוכנית המחשב בסיוע ניתוח. מארק (D) המיקום של סיב אופטי ב"דיסק סנטר ו- (E) מנחה את התוכנה באופן אוטומטי לזהות את השפה של דיסקים אופטיים, להציב רשת מדידה. (F) לבנות כלי לשרטוטים בהתבסס על השבילים כלי השיט, ולהניח כלי מכסה כדי להעריך על הקוטר של כלי. (G) התאם הכלי שגוי לשרטוטים ואת כלי מכסה באופן ידני. (H) מדד ספקטרום של פרמטרים כלי הדם ברשתית, כולל קליברים כלי, tortuosity, ממד פרקטל, נגע הסתעפות. צעד (D) שלב (F), ועל שלב (H) ניתן לבצע באופן אוטומטי על-ידי תוכניות מסוימות ניתוח בסיוע מחשב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- לכידת תמונות הפונדוס בעזרת מצלמה הפונדוס.
תוכנית
- התור על המצלמה הפונדוס ועל ההשקה לכידת התמונה במחשב. הנח את הסנטר של הנושא כראוי על chinrest עם המצח נגד הרצועה ראש. העבר את ידית שליטה ליישור אלומת האור כראוי לנושא ’ תלמידו s.
- יישר את נקודות תאורה עד שניהם מופיעים הקטן משני הצדדים את הכוונת. להזיז את המטרה קיבוע חיצוני כדי להנחות את הנושא ’ s עיניים עד התקליטור האופטי הוא במרכז בעינית האזורים של הריבית (ROI) הם בתוך הגבולות. להתאים את הידית התמקדות להתמקד על פני הרשתית.
- יש נושא בחוזקה מסתכל למטרה קיבוע חיצוני ולהבטיח את הנושא ’ s עיניים לא יהיו מלאים דמעות.
- נלחצים לחצן שחרור תריס כדי ללכוד את התמונה ( איור 1 א').
- לבדוק את טיב התצלום הפונדוס בשבי, באמצעות איור 2A כסטנדרט. למחוק את התמונה וחזור על התהליך רכישה של התמונה (קרי, שלב 2.1.1 כדי 2.1.4) אם התלמיד לקוי מורחבים ( איור 2B), הדיסק האופטי אינו במרכז התמונה ( איור 2C), או התמונה לא בפוקוס ( איור דו-ממדי).
- לשמור את התמונה בתבנית TIFF עם רזולוציה ניתן לבדיקה (כלומר, כ 3000 פיקסלים x 2,000 פיקסלים, ב יותר מ 150 dpi).
הערה: הפרוטוקול אפשר לעצור כאן. - חזור על צעדים 2.1.1 כדי 2.1.6 לרכוש תמונות הפונדוס לנושאים אחרים.
- בחר מדגם 10% של תמונות באופן אקראי, למדוד את גובהם של דיסקים אופטיים בתמונות האלה ( איור 3). לחשב את פקטור המרת תמונה (ICF) תוך שימוש בנוסחה:
ICF = 1,800 מיקרומטר / (ממוצע פיקסל גובה של דיסקים אופטיים של תמונות שנדגמו). - להעלות את התמונות שנתפסו הפונדוס לשרת המבוסס על ענן צמתים ולהזין את פרטי המחקר הרלוונטי, כולל את פקטור המרה של תמונה (ICF) ( איור 1B).
הערה: הפרוטוקול אפשר לעצור כאן. תוכניות אחרות המחשב בסיוע ניתוח עשויים להשתמש בשיטות אחרות שאינן מבוססות על ענן כדי לארגן את התמונות ולהקליט ICF.
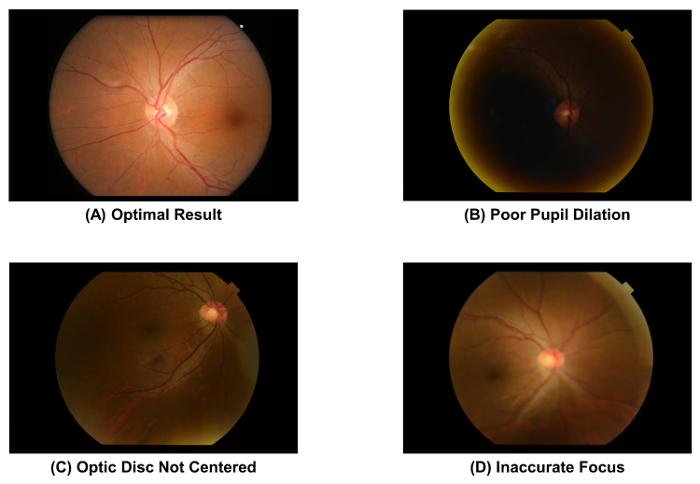
איור 2: הפונדוס תצלומים באיכות אופטימלית, שיוצרת. יש לבדוק את איכות התמונה של תצלום הפונדוס מיד לאחר ייבוא תמונות, כמו איכות התמונה משפיע ישירות על המידה עוקבות של פרמטרים של כלי הדם ברשתית. צריך להיות מושלך התמונה אם נצפית אחת לפריטים אלו. תמונות אלה נלכדו באמצעות מצלמה הפונדוס של 50°. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
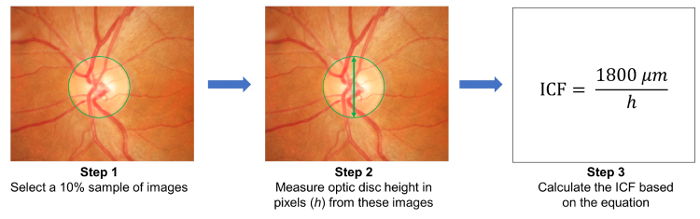
איור 3: חישוב של הגורם המרת תמונה (ICF). כדי לחשב את ICF, לבחור באקראי מדגם 10% של תמונות מן המחקר (שלב 1). לאחר מכן, למדוד הגובה של דיסקים אופטיים (בפיקסלים) מן התמונות לטעום (שלב 2). לחשב את ICF תוך שימוש בנוסחה: ICF = מיקרומטר 1800 / (פיקסל גובה של דיסקים אופטיים של תמונות שנדגמו ממוצע), איפה מיקרומטר 1800 בקירוב את הגובה של דיסק אופטי רגיל (שלב 3). כמו אפקט ההגדלה רזולוציית תמונה שונים מצלמה מצלמה, זה הכרחי לחשב של ICF מדויק לכל מצלמה בשימוש. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- תפתח את התמונה הפונדוס בתוכנית ניתוח בסיוע מחשב. לבנות כלי לשרטוטים ולהניח כלי מכסה להערכת ברשתית.
הערה: בחלק זה, התוכנית SIVA משמש כדי להמחיש את ההליכים. עם זאת, התוכנית שיבה יכול להיות מוחלף על ידי תוכניות אחרות ניתוח בסיוע מחשב זמין. בנוסף, צעדים 2.2.2 כדי 2.2.3 מתבצעות באופן אוטומטי על-ידי ניתוח המחשב בסיוע כמה תוכניות כאשר תצלום הפונדוס הוא נפתח (קרי שלב 2.2.1).- לפתוח את התמונה הפונדוס עם התוכנית ניתוח בסיוע מחשב ( איור 1C).
- סמן את המיקום של המרכז דיסקים אופטיים ( איור 1D).
- לחץ “ מרכז OD ” כפתור בלוח הפונקציה left; סמן העכבר יוחלפו על ידי עיגול ירוק.
- להעביר את העיגול הירוק למרכז התקליטור האופטי (OD) ולאחר שמאל לחץ כדי לתקן את המעגל.
- להנחות את התוכנה באופן אוטומטי להציב רשת מדידה, לבנות כלי לשרטוטים צביעy כלי מכסה ( איור 1E ו- 1F).
הערה: כלי כריכות הם קווי מדידה מעריכים מפושקות ברוחב לומן הפנימי של כלי.- לחץ “ למצוא OD ” כפתור תציג את התוכנה כדי לזהות את שפת יתר ובאותו מקום 4 עיגולים קונצנטריים ברשת מדידה, בהתבסס על המיקום של המרכז OD.
- לחץ “ תהליך ” כפתור כדי להתחיל את תהליך המעקב אחר כלי אוטומטי.
- הכוונון שגויה כלי לשרטוטים באופן ידני. התחל את הבדיקה של ה-12 o ’ שעון עמדה בצורה עם כיוון השעון כדי להבטיח כי כל כלי לשרטוטים מאומתים.
- בדוק כי סיב אופטי מדויק התקליטור, הרשת מדידה ממוקם כהלכה. להוספת רשת מדידה ידנית ביצוע השלבים 2.2.2 כדי 2.2.3, אם המעגל הפנימי לא מדויק המתאר השפה דיסקים אופטיים ( איור 4A).
- עזב לחץ כדי לבחור כלי tracing(s) עם סוג אניה שגוי (רבים לעומת venules) ולחץ “ לסוג כלי (T) ” כפתור כדי לשנות את סוג כלי.
הערה: רבים מצורפים לסחורות המסומנות באדום, לוחיות ההסבר venules בכחול. רבים ניתן להבדיל בין venules בהתבסס על הבדלים פיזיולוגיים שלהם. לדוגמה, venules הם בדרך כלל כהה בצבעו רחב יותר רבים. כלי עם אותו סוג כלי בדרך כלל לא לחצות אחד את השני. - הרחב כלי לא שלם לשרטוטים שלבים 2.3.3.1 כדי 2.3.3.2 ( איור 4B).
- השימוש הסמן כדי ללחוץ בקצה הדיסטלי של העקיבה כלי לא שלם. שמאל לחץ בנקודות לאורך השביל כלי כדי להרחיב את העקיבה הקיבול.
- לעצור את תהליך המעקב אחר כאשר בקצה הדיסטלי של הספינה מתמלאת. לעצור את העקיבה במלון העיגול הלבן החיצוני ביותר, אם החלק הדיסטלי של כלי השיט נמצא מחוץ לרשת מדידה (ראה איור 4B).
- להתאים את כלי השיט לשרטוטים אם הם השבילים כלי השיט לא איתרו כראוי באתר מוצלב ( איור 4C).
- לחץ “ בחר ” הלחצן ולאחר מכן לחץ על נקודת שגוי של העקיבה כלי השיט. לחץ “ Brea(k) Seg ” כפתור כדי לנתק את העקיבה הקיבול על הנקודה שנבחרה. בחר את המקטע המנותקת ולחץ “ (דל) Seg ” כפתור כדי למחוק את זה
- מחדש לבנות עקיבה כלי חדש באמצעות שלבים 2.3.3.1 ו 2.3.3.2.
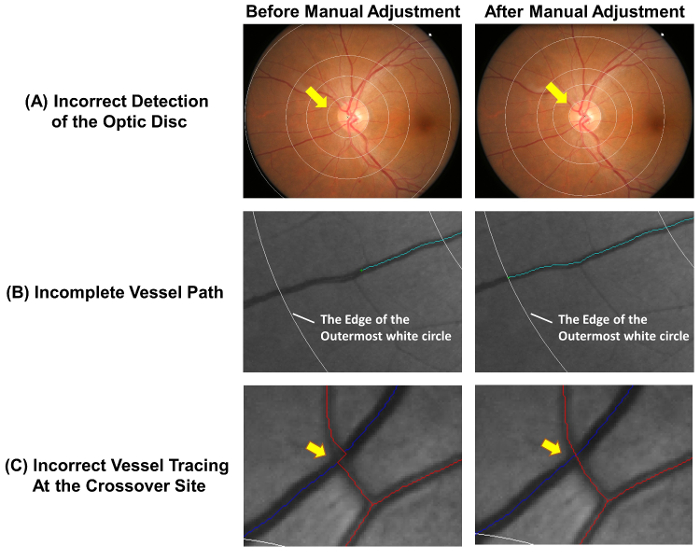
איור 4: שגיאות נפוצות של auto-העקיבה. העקיבה כלי אוטומטי לא לגמרי מדויק, שינויים ידניים נדרשים כדי להבטיח את הדיוק מדידה. איור זה מציג את השגיאות הנפוצות של auto-העקיבה ומדגים תוצאות אופטימליות לאחר שינויים ידניים. (א) מרכז תקליטורים אופטיים של שגוי מסומן, הפניה זו כדי סטייה של הרשת מדידה, העשויים להשפיע על המדידות עוקבות. באופן אידיאלי, העיגול הפנימי ביותר של הרשת מדידה צריכה חלוקה לרמות השפה דיסקים אופטיים. עקיבה כלי לא שלם (B) עלול להוביל המדידה שגוי של ממד פרקטל, tortuosity, וכו שהשביל הקיבול צריך ניתן לייחס עד הסוף של כלי השיט. כאשר החלק הדיסטלי של כלי השיט נמצא מחוץ לרשת מדידה, ניתן לעצור העקיבה במלון העיגול הלבן החיצוני ביותר. (ג) כלי לשרטוטים באתרי מוצלב כפופים נטייה גבוהה יותר של טעות, הם דורשים תשומת לב מיוחדת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- להניח כלי מכסה על כל כלי מקטעי ולבטל את השמיכה שגוי באופן ידני.
- לחץ “ למצוא מכסה ” לחצן להניח כלי מכסה על כל כלי מקטעי אוטומטית.
- לבדוק אם כל כלי מכסה ממוקמים בצורה נכונה. שמאל לחץ וגרור הסמן לנטרל את כלי השיט מכסה אם הכיסויים אינם זיון מאונך כלי הדם ( איור 5A), הנתיב כלי זה יוסתר על-ידי כלי אחר ( איור 5B), או מכסה מגזים או להמעיט את רוחב הכלי לומן ( איור 5C).
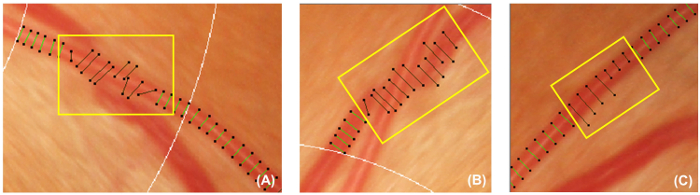
איור 5: כלי שגוי מכסה. איור זה מציג דוגמאות של כיסויים כלי שגוי זה צריך להיות פעיל ולא נכללו המדידה עוקבות. מכסה הקיבול צריך יופעלו אם הם אינם בניצב בכלי הדם (A). בנוסף, כריכות הקיבול צריך גם לנטרל התקפות הספינה שמאתרים מעורפל תחת עוד כלי-קיבול (B), או השמיכה כלי לא יכול לייצג מפושקות ברוחב של כלי השיט (C). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- למדוד פרמטרים כלי הדם ברשתית לשרטוטים את הכלי, את השמיכה כלי
הערה: 2.5 שלב מתבצע באופן אוטומטי על-ידי תוכנית המחשב בסיוע ניתוח.- תווית הדיסק אזור 0.5-1.0 קטרים מן השוליים דיסקים אופטיים אזור ב', וכן על הקוטר דיסק באזור 0.5-2.0 מן השוליים דיסקים אופטיים אזור C 18 ( איור 6A), על פי פרוטוקול שונה של טרשת עורקים סיכון קהילות (ARIC) ללמוד 19.
- מידה קוטר כלי הדם ברשתית של אזור ב' והן אזור C, באמצעות שיטה אימצו אותו באופן נרחב ששונתה מ ARIC לימוד 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 ( איור 6B).
- למדוד אורך הכלי כיסויים רבים הגדול שש, את שש venules הגדול ביותר להערכת כלי ברשתית קליברים.
- לסכם את רשתית arteriolar ו venular קליברים כמו עורק רשתית מרכזי שווה ערך (CRAE) ואת הרשתית המרכזי הוריד שווה ערך (CRVE) בהתאמה 17 באמצעות Knudtson המתוקן את – פר-האברד נוסחה 18 , 19.
- לזהות כל כלי באזור C עם רוחב > 40 µm. לחשב את tortuosity arteriolar, venular ברשתית של האינטגרל עקמומיות בריבוע הכולל לאורך לשרטוטים כלי השיט, לנרמל את הערך עם קשת סה כ אורך, בואינג, נקודות של גוון 27 , 28.
- לחשב את הסכום הכולל, arteriolar, ו venular פרקטל מידות מאזור C, באמצעות הוקמה “ שיטת ספירת תיבת ” 29 , 30 , 31.
- לחלק את התמונה סדרת ריבועים בגודל שווה.
- לספור את מספר התיבות המכיל מקטע של תצלומי מעקב כלי הקיבול.
- חזור על התהליך באמצעות סדרה של ריבועים בגודל שווה עם גדלים שונים-
- להתוות את הלוגריתם של מספר תיבות המכילות את כלי השיט לשרטוטים נגד הלוגריתם של הגודל של התיבות, לחשב את השיפוע של קו שנוצר; זה הממד פרקטל.
- לזהות כלי עם נגע הסתעפות הראשון באזור C ולחשב את הזוויות (θ באמצעות) subtended בין הראשונה בת שתי ספינות 32 ( איור 6C). לחשב את הערך הממוצע להשיג זווית מסעף הממוצע.
- לחשב את המקדם מסעף מאזור C באמצעות הנוסחה:
(ד 1 2 + d 2 2) /d 0 2, שבו d 0 הוא שהאיכות המטען מרושע, d 1 ו- d 2 האם הקליעים סניף רשע ( איור 6C).
- לסגור את החלון לדירוג. לחץ על “ שלח ” בתיבת הדו-שיח מוקפצים כדי להעלות את התמונה מדורגת בשרת המבוסס על ענן צמתים ולהקליט את הפרמטרים נמדד באופן אוטומטי כלי הדם ברשתית.
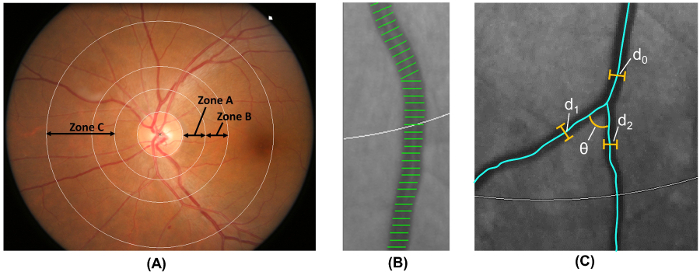
איור 6: כימות להערכת ברשתית. (א) אזור B (כהגדרתו 0.5-1.0 דיסק קטרים מן השוליים דיסק) משמש למדידת קיבול קליברים של אזור ב' על פי הסיכון טרשת עורקים במחקר קהילות. אזור C (כהגדרתו 0.5-2.0 דיסק קטרים מן השוליים דיסק) משמש למדידת קיבול קליברים של אזור C וקשת של רשת כלי הדם ברשתית הפרמטרים (כגון tortuosity, פרקטל ממד נגע הסתעפות). (B) כלי סיפורי כיסוי הם קווי המדידה המשמש להערכת כלי ברשתית קליברים (או קטרים). כלי שגוי מכסה צריך באופן ידני לא ייכללו המדידה. (ג) עבור כל כלי שיש נגע הסתעפות הראשון שלהם בתוך אזור C, התוכנית באופן אוטומטי מודד את הזוויות מסעף (θ באמצעות) של ההסתעפות הראשון. בנוסף, המקדם מסעף גם מחושבת באמצעות הנוסחה: מקדם מסעף = (ד 1 2 + d 2 2) /d 0 2, כאשר d 0 הוא המטען קליבר, ו d 1 ו- d 2 הם הקליעים סניף. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
3. להעריך את עובי GC-IPL ו RNFL
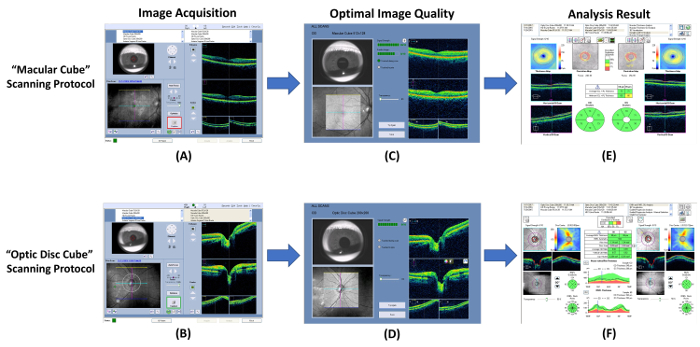
איור 7: תרשים סכמטי מציג את ההליכים של מדידת עובי RNFL ו- GC-IPL- טומוגרפיה אופטית קוהרנטית (אוקטובר) יכול לשמש למדידת עוביים של גנגליון תא-הפנימית plexiform בשכבה (GC-IPL), השכבה סיבי עצב ברשתית (RNFL). (A, B) למדוד את עוביים GC-IPL ו RNFL באמצעות אנרגיה “ קוביית מקולרי ” ו “ דיסקים אופטיים קוביה ” פרוטוקולים סריקה בהתאמה. (C, D) בדוק את איכות התמונה מיד לאחר ייבוא תמונות. למחוק את התמונה ' וחזור על הסריקה, אם עוצמת האות הוא קטן יותר מאשר 6, או חפצי אמנות תנועה מזוהים. (E, F) לאחר מכן, מנחה את התוכנית ניתוח מובנה באופן אוטומטי לנתח את התוצאה ולהפיק דוח לפרשנויות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- לבצע ייבוא תמונות באמצעות טומוגרפיה אופטית קוהרנטית (OCT).
- פתח את התוכנית OCT ובחר “ קוביית מקולרי ” סריקה בפרוטוקול כדי להפעיל סריקה חדשה מקולרי ( איור 7 א).
- אתר התלמיד האשנב איריס על-ידי התאמת את chinrest. הורד את התאורה אם גודל האישון קטן מדי.
- לחץ “ פוקוס אוטומטי ” לחצן ולאחר מכן “ מטב ” כפתור כדי לשפר את איכות התמונה.
- להורות את הנושא למצמץ כמה פעמים מיד לפני תחילת הסריקה.
- לחץ “ לכידת ” כפתור כדי להתחיל את הסריקה כאשר הגבול המקיף את הלחצן הופך ירוק. להנחות את הנושא כדי להתמקד המטרה קיבוע חזותי במהלך ייבוא תמונות כדי למנוע תנועה חפצים.
- לבחון את איכות הסריקה באמצעות איור 7C כסטנדרט. למחוק את התוצאה וחזור על הסריקה אם עוצמת האות הוא קטן יותר מאשר 6 ( איור 8A), או חפצי אמנות תנועה מזוהים (שצוין על-ידי רציפות של כלי דם) ( איור 8 ב').
- לשמור את התוצאה סריקה.
- חזור על צעדים 3.1.1 כדי 3.1.7 בעין אחרת.
- לבצע בסריקה ראש עצב הראייה עם “ קוביית דיסקים אופטיים ” סריקה להלן פרוטוקול צעדים 3.1.2 ל 3.1.9 ( איורים 7 ב וד 7).

איור 8: תת אופטימלית תוצאות טומוגרפיה אופטית קוהרנטית. תוצאות תת אופטימלית נפוצות טומוגרפיה אופטית קוהרנטית (אוקטובר) לכלול עוצמת אות נמוכה (A) (ערך כוח < 6), וחפצי תנועה (B). איכות הסריקה להותירה מיד לאחר ייבוא תמונות, הסריקה צריכה להיות חוזרת אם לפריטים אלו הם נתקלו. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- להפיק תדפיס של ניתוח של עובי GC-IPL מקולרי.
- בחר “ קוביית מקולרי ” סרוק רשומות של שתי העיניים בממשק ניתוח.
- לחץ “ גנגליון תא OU ניתוח ” ליזום האלגוריתם ניתוח אוטומטי כדי להעריך את עובי GC-IPL של הסריקה ( איור 7-אי).
הערה: שלב 3.2.2 הושלמה באופן אוטומטי על-ידי האלגוריתם ניתוח.- צור של 14.13 מ מ 2 ממורכז fovea אליפטית טבעת בעלת אופקי רדיוסים הפנימיים והחיצוניים של 0.6 מ"מ ו- 2.4 מ"מ, בהתאמה, אנכי רדיוסים הפנימיים והחיצוניים של 0.5 מ מ ו- 2.0 מ מ, בהתאמה.
הערה: הגודל והצורה של טבעת אליפטית לציית מקרוב האנטומיה מקולרי, ובכך להתאים לאזור איפה RGCs העבה ביותר ב- 33 , עיניים רגיל 34. שטחה של הטבעת הפנימית של טבעת שאינו נמדד, GC-IPL באזור זה הוא דק מאוד. - קטע הגבול החיצוני של RNFL ואת הגבול החיצוני של השכבה הפנימית plexiform (IPL) כדי לאתר את GC-IPL ( איור 9).
- למדוד את הממוצע, מינימום 6 וסינרגיה (עליון, superotemporal, superonasal, inferonasal, inferotemporal נחות,) בעוביים של GC-IPL מקולרי בתוך fovea-cenטבעת אליפטית tered.
- להשוות את עוביים GC-IPL נמדד למכשיר ’ s פנימי תואם גיל נורמטיביים מסד נתונים וליצור סטיית מפה ומפה חשיבות
- הדו ח את תוצאות המדידה התדפיס ניתוח.
- צור של 14.13 מ מ 2 ממורכז fovea אליפטית טבעת בעלת אופקי רדיוסים הפנימיים והחיצוניים של 0.6 מ"מ ו- 2.4 מ"מ, בהתאמה, אנכי רדיוסים הפנימיים והחיצוניים של 0.5 מ מ ו- 2.0 מ מ, בהתאמה.
- לשמור את התדפיס ניתוח בתבנית .pdf.
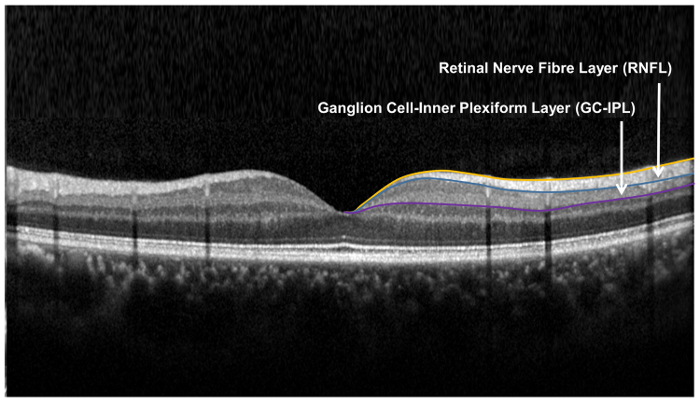
איור 9: שכבות הרשתית משמש הערכה של מבנה עצביים ברשתית. השכבה סיבי עצב ברשתית (RNFL) נמדד באמצעות עצב הראייה ראש אלגוריתם (ONH), ואילו השכבה plexiform של התא-הפנימית גנגליון נמדד באמצעות האלגוריתם ניתוח (GCA) תא גנגליון. האלגוריתם ONH מקטעים לגבולות הפנימיים והחיצוניים RNFL כדי למדוד את עובי RNFL. האלגוריתם GCA מזהה את הגבול החיצוני של השכבה סיבי עצב ברשתית (RNFL), השכבה הפנימית plexiform (IPL) להניב משולב עובי השכבה תא גנגליון (שזכתה), את IPL. עוביים של שזכתה ו IPL את נמדדים יחד, כמו גם הגבול בין שזכתה IPL אנטומית לא ברור. עובי משולב שזכתה ו- IPL (קרי GC-IPL) עם זאת, עדיין מעיד על הבריאות של RGCs. אנא לחץ כאן כדי להציג גירסה גדולה יותר מזה איור.
- ליצור את התדפיס ניתוח של עובי RNFL ( איור 7F).
- בחר “ קוביית דיסקים אופטיים ” סרוק רשומות של שתי העיניים בממשק ניתוח.
- לחץ “ ONH וניתוח OU RNFL ” ליזום האלגוריתם ניתוח אוטומטי כדי להעריך את עובי RNFL הסריקה.
הערה: צעדים 3.3.2.1 כדי 3.3.2.6 יכול להתבצע באופן אוטומטי על ידי האלגוריתם ניתוח.- למדוד את עובי RNFL בכל נקודה סרוק וצור במפת עובי RNFL.
- זיהוי התקליטור האופטי על ידי גילוי נקודה שחורה ליד המרכז של הסריקה בעל גודל וצורה בקנה אחד עם טווח disc. סיב אופטי
- למקם רשת מדידה של 3.46 מ מ קוטר סביב התקליטור האופטי על המפה עובי RNFL.
- למדוד ולחשב את גלובל, ארבע-הגזרות (הזמני, האף לכוחו של), ו- 12 שעות שעון parapapillary RNFL עוביים של רשת מדידה.
- להשוות את עוביים RNFL שנמדד למכשיר ’ s פנימי תואם גיל נורמטיביים מסד נתונים וליצור סטיית מפה ומפה חשיבות.
- הדו ח את תוצאות המדידה התדפיס ניתוח.
- לשמור את התדפיס ניתוח בתבנית .pdf.
תוצאות
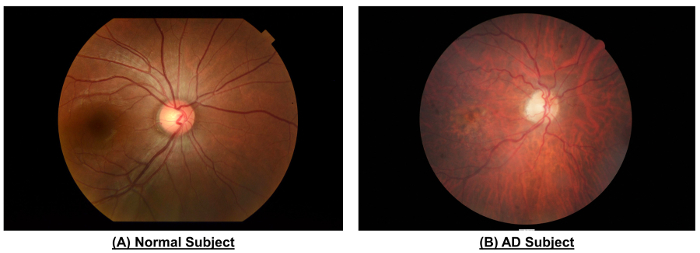
איור 10: דוגמה כדי להראות את ההבדלים להערכת רשתית בין נושא רגיל נושא המודעה. בהשוואה לנושא. נורמאלי, צילום הפונדוס של הנושא לספירה הופיע כלי צר יותר קליברים (CRAE של אזור B, מיקרומטר 116.4 לעומת 156.4 מיק...
Discussion
פרוטוקול זה מתאר את ההליכים לכמת שינויים עצביים ואת כלי הדם הרשתית ויוו. כפי הרשתית מניות מקורות embryological דומה, תכונות אנטומיות, מאפיינים פיזיולוגיים עם המוח, השינויים ברשתית אלה עשוי לשקף שינויים דומים של להערכת ומבנה עצביים במוח.
כפי שמוצג באיור 10 ...
Disclosures
ברצוננו להביע הערכה בבית הספר של מחשוב, באוניברסיטה הלאומית של סינגפור לקבלת תמיכה טכנית.
Acknowledgements
לגבי קשרים כספיים פוטנציאליים, הסופר טיין י' וונג הוא ממציא שיתוף של התוכנית סינגפור I כלי הערכה (שיבה) להשתמש במאמר זה.
Materials
| Name | Company | Catalog Number | Comments |
| Non-mydriatic Retinal Camera | Topcon, Inc, Tokyo, Japan | TRC 50DX | N/A |
| Singapore I Vessel Assessment Program | National University of Singapore | Version 4.0 | N/A |
| CIRRUS HD-OCT | Carl Zeiss Meditec, Inc, Dublin, CA | Model 4000 | N/A |
| Mydriatic Agents | N/A | N/A | Prepared from 1% tropicamide and 2.5% phenylephrine hydrochloride |
References
- Alzheimer's Disease International. The prevalence of dementia worldwide. Alzheimer's Dis. Int. (December), 1-2 (2008).
- Wimo, A., Winblad, B., &Jönsson, L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimer's Dement. 6 (2), 98-103 (2010).
- Comas-Herrera, A., Northey, S., Wittenberg, R., Knapp, M., Bhattacharyya, S., Burns, A. Future costs of dementia-related long-term care: exploring future scenarios. Int. Psychogeriatr. 23 (1), 20-30 (2011).
- Alzheimer's Association. Alzheimer's disease facts and figures. Alzheimer's Dement. 10 (2), e47-e92 (2014).
- Prince, M., Bryce, R., Albanese, E., Wimo, A., Ribeiro, W., Ferri, C. P. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers. Dement. 9 (1), 63-75 (2013).
- Alzheimer's Association. 2016 Alzheimer's disease facts and figures. Alzheimer's Dement. 12 (4), 459-509 (2016).
- Asih, P. R., Chatterjee, P., Verdile, G., Gupta, V. B., Trengove, R. D., Martins, R. N. Clearing the amyloid in Alzheimer's: progress towards earlier diagnosis and effective treatments - an update for clinicians. Neurodegener. Dis. Manag. 4 (5), 363-378 (2014).
- Cheung, C. Y., Ikram, M. K., Chen, C., Wong, T. Y. Imaging retina to study dementia and stroke. Prog. Retin. Eye Res. , (2017).
- Patton, N., Aslam, T., Macgillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: a rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nat. Rev. Neurol. 9 (1), 44-53 (2013).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Levkovitch-Verbin, H., Quigley, H. A., Kerrigan-Baumrind, L. A., D'Anna, S. A., Kerrigan, D., Pease, M. E. Optic nerve transection in monkeys may result in secondary degeneration of retinal ganglion cells. Investig. Ophthalmol. Vis. Sci. 42 (5), 975-982 (2001).
- Levkovitch-Verbin, H., Quigley, H. A., Martin, K. R., Zack, D. J., Pease, M. E., Valenta, D. F. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Sadun, A. A., Borchert, M., DeVita, E., Hinton, D. R., Bassi, C. J. Assessment of Visual Impairment in Patients With Alzheimer's Disease. Am. J. Ophthalmol. 104 (2), 113-120 (1987).
- Schlotterer, G., Moscovitch, M., Crapper-Mclachlan, D. Visual processing deficits as assessed by spatial frequency contrast sensitivity and backward masking in normal ageing and alzheimer's. Brain. 107 (1), 309-324 (1984).
- Cheung, C. Y. L., et al. A new method to measure peripheral retinal vascular caliber over an extended area. Microcirculation. 17 (7), 495-503 (2010).
- Knudtson, M. D., Lee, K. E., Hubbard, L. D., Wong, T. Y., Klein, R., Klein, B. E. K. Revised formulas for summarizing retinal vessel diameters. Curr. Eye Res. 27 (3), 143-149 (2003).
- Hubbard, L. D., et al. Methods for evaluation of retinal microvascular abnormalities associated with hypertension/sclerosis in the Atherosclerosis Risk in Communities Study. Ophthalmology. 106 (12), 2269-2280 (1999).
- Patton, N., et al. The association between retinal vascular network geometry and cognitive ability in an elderly population. Investig. Ophthalmol. Vis. Sci. 48 (5), 1995-2000 (2007).
- VanHecke, M. V., et al. Are retinal microvascular abnormalities associated with large artery endothelial dysfunction and intima-media thickness? The Hoorn Study. Clin. Sci. London Engl. 110 (5), 597-604 (2006).
- Tien, Y. W., et al. Retinal vascular caliber, cardiovascular risk factors, and inflammation: The Multi-Ethnic Study of Atherosclerosis (MESA). Investig. Ophthalmol. Vis. Sci. 47 (6), 2341-2350 (2006).
- Leung, H., et al. Relationships between age, blood pressure, and retinal vessel diameters in an older population. Investig. Ophthalmol. Vis. Sci. 44 (7), 2900-2904 (2003).
- Wong, T. Y., et al. The prevalence and risk factors of retinal microvascular abnormalities in older persons: The cardiovascular health study. Ophthalmology. 110 (4), 658-666 (2003).
- Ikram, M. K., et al. Retinal vessel diameters and risk of stroke: The Rotterdam Study. Neurology. 66 (9), 1339-1343 (2006).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: Methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Sasongko, M. B., et al. Alterations in retinal microvascular geometry in young type 1 diabetes. Diabetes Care. 33 (6), 1331-1336 (2010).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Mainster, M. a The fractal properties of retinal vessels: embryological and clinical implications. Eye. 4 ( Pt 1) (1), 235-241 (1990).
- Liew, G., et al. The Retinal Vasculature as a Fractal: Methodology, Reliability, and Relationship to Blood Pressure. Ophthalmology. 115 (11), (2008).
- Stosic, T., Stosic, B. D. Multifractal analysis of human retinal vessels. IEEE Trans. Med. Imaging. 25 (8), 1101-1107 (2006).
- Zamir, M., Medeiros, J. A., Cunningham, T. K. &. a. m. p. ;. M., Zamir, J. A., Medeiros, T. K. C. Arterial bifurcations in the human retina. J. Gen. Physiol. 74 (4), 537-548 (1979).
- Mwanza, J. C., Oakley, J. D., Budenz, D. L., Chang, R. T., Knight, O. J., Feuer, W. J. Macular ganglion cell-inner plexiform layer: Automated detection and thickness reproducibility with spectral domain-optical coherence tomography in glaucoma. Investig. Ophthalmol. Vis. Sci. 52 (11), 8323-8329 (2011).
- Bendschneider, D., et al. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J. Glaucoma. 19 (7), 475-482 (2010).
- Cheung, C. Y., Ong, Y. T., Ikram, M. K., Chen, C., Wong, T. Y. Retinal Microvasculature in Alzheimer's Disease. J. Alzheimer's Dis. 42 (s4), S339-S352 (2014).
- Murray, C. D. THE PHYSIOLOGICAL PRINCIPLE OF MINIMUM WORK APPLIED TO THE ANGLE OF BRANCHING OF ARTERIES. J. Gen. Physiol. (4), 835-841 (1926).
- Ding, J., et al. Early retinal arteriolar changes and peripheral neuropathy in diabetes. Diabetes Care. 35 (5), 1098-1104 (2012).
- Yim, C., et al. Retinal Ganglion Cell Analysis Using High-Definition Optical Coherence Tomography in Patients with Mild Cognitive Impairment and Alzheimer's Disease. J. Alzheimer's Dis. Retin. Ganglion Cell Anal. MCI AD. 45 (1), 45-56 (2015).
- Stein, D. M., Wollstein, G., Ishikawa, H., Hertzmark, E., Noecker, R. J., Schuman, J. S. Effect of Corneal Drying on Optical Coherence Tomography. Ophthalmology. 113 (6), 985-991 (2006).
- Mwanza, J. C., et al. Effect of Cataract and its Removal on Signal Strength and Peripapillary Retinal Nerve Fiber Layer Optical Coherence Tomography Measurements. J. Glaucoma. 20 (1), 37-43 (2011).
- Garcia-Martin, E., et al. Influence of cataract surgery on optical coherence tomography and neurophysiology measurements in patients with retinitis pigmentosa. Am. J. Ophthalmol. 156 (2), (2013).
- Kok, P. H. B., et al. The relationship between the optical density of cataract and its influence on retinal nerve fibre layer thickness measured with spectral domain optical coherence tomography. Acta Ophthalmol. , (2012).
- Kim, N. R., et al. Influence of cataract on time domain and spectral domain optical coherence tomography retinal nerve fiber layer measurements. J. Glaucoma. 21 (2), 116-122 (2012).
- Hwang, Y. H., Kim, Y. Y. Effect of Peripapillary Vitreous Opacity on Retinal Nerve Fiber Layer Thickness Measurement Using Optical Coherence Tomography. Arch. Ophthalmol. 130 (6), 789-792 (2012).
- Schwartz, S. G., Flynn, H. W., Fisher, Y. L. "Floater scotoma" demonstrated on spectral-domain optical coherence tomography and caused by vitreous opacification. Ophthalmic Surg. Lasers Imaging Retina. 44 (4), 415-418 (2013).
- Frost, S., et al. Retinal vascular biomarkers for early detection and monitoring of Alzheimer's disease. Transl. Psychiatry. 3 (2), e233 (2013).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- DeJong, F. J., et al. Retinal vascular caliber and risk of dementia: The Rotterdam Study. Neurology. 76 (9), 816-821 (2011).
- Cheung, C. Y., et al. Quantitative and qualitative retinal microvascular characteristics and blood pressure. J. Hypertens. 29 (7), 1380-1391 (2011).
- Cheung, C. Y., et al. Retinal vascular fractal dimension and its relationship with cardiovascular and ocular risk factors. Am. J. Ophthalmol. 154 (4), 663-674 (2012).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Grinton, M. E., et al. The association between retinal vessel morphology and retinal nerve fiber layer thickness in an elderly population. Ophthalmic Surg. Lasers Imaging. 43 (6 Suppl), S61-S66 (2012).
- Hughes, A. D., et al. Quantification of topological changes in retinal vascular architecture in essential and malignant hypertension. J. Hypertens. 24 (5), 889-894 (2006).
- Hughes, A. D., et al. Determinants of retinal microvascular architecture in normal subjects. Microcirculation. 16 (2), 159-166 (2009).
- Lau, Q. P., Lee, M. L., Hsu, W., Wong, T. Y. The Singapore Eye Vessel Assessment System. Image Anal. Model. Ophthalmol. , 143-160 (2014).
- Thomas, G. N., et al. Measurement of Macular Fractal Dimension Using a Computer-Assisted Program. Investig. Opthalmology Vis. Sci. 55 (4), 2237 (2014).
- Murray, C. D. The physiological principle of minimal work. I. The vascular system and the cost of blood volume. Proc. Natl. Acad. Sci. 12, 207-214 (1926).
- Cheung, C., Chen, C., Wong, T. Ocular Fundus Photography as a Tool to Study Stroke and Dementia. Semin. Neurol. 35 (5), 481-490 (2015).
- Williams, M. A., et al. Retinal microvascular network attenuation in Alzheimer's disease. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 1 (2), 229-235 (2015).
- Cheung, C. Y., et al. Retinal Vascular Fractal Dimension Is Associated with Cognitive Dysfunction. J. Stroke Cerebrovasc. Dis. 23 (1), 43-50 (2014).
- Hammes, H. P., et al. Diabetic retinopathy: targeting vasoregression. Diabetes. 60 (1), 9-16 (2011).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- Frame, M. D., Sarelius, I. H. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc Res. 46 (2), 190-205 (1993).
- Djonov, V., Baum, O., Burri, P. H. Vascular remodeling by intussusceptive angiogenesis. Cell Tissue Res. 314 (1), 107-117 (2003).
- Griffith, T. M., Edwards, D. H. Basal EDRF activity helps to keep the geometrical configuration of arterial bifurcations close to the Murray optimum. J. Theor. Biol. 146 (4), 545-573 (1990).
- Griffith, T. M., Edwards, D. H., Randall, M. D. Blood flow and optimal vascular topography: role of the endothelium. Basic Res. Cardiol. 86 Suppl 2, 89-96 (1991).
- Chapman, N., Haimes, G., Stanton, A. V., Thom, S. A. M., Hughes, A. D. Acute effects of oxygen and carbon dioxide on retinal vascular network geometry in hypertensive and normotensive subjects. Clin. Sci. 99 (6), 483-488 (2000).
- Heringa, S. M., Bouvy, W. H., van denBerg, E., Moll, A. C., Jaap Kappelle, L., Jan Biessels, G. Associations between retinal microvascular changes and dementia, cognitive functioning, and brain imaging abnormalities: a systematic review. J. Cereb. blood flow Metab. 33 (7), 983-995 (2013).
- Ding, J., et al. Diabetic retinopathy and cognitive decline in older people with type 2 diabetes: The Edinburgh type 2 diabetes study. Diabetes. 59 (11), 2883-2889 (2010).
- Parisi, V., Restuccia, R., Fattapposta, F., Mina, C., Bucci, M. G., Pierelli, F. Morphological and functional retinal impairment in Alzheimer's disease patients. Clin. Neurophysiol. 112 (10), 1860-1867 (2001).
- Paquet, C., Boissonnot, M., Roger, F., Dighiero, P., Gil, R., Hugon, J. Abnormal retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Neurosci. Lett. 420 (2), 97-99 (2007).
- Moschos, M. M., et al. Structural and functional impairment of the retina and optic nerve in Alzheimer's disease. Curr. Alzheimer Res. 9 (7), 782-788 (2012).
- Lu, Y., et al. Retinal nerve fiber layer structure abnormalities in early Alzheimer's disease: Evidence in optical coherence tomography. Neurosci. Lett. 480 (1), 69-72 (2010).
- Kesler, A., Vakhapova, V., Korczyn, A. D., Naftaliev, E., Neudorfer, M. Retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Clin. Neurol. Neurosurg. 113 (7), 523-526 (2011).
- Ascaso, F. J., et al. Retinal alterations in mild cognitive impairment and Alzheimer's disease: An optical coherence tomography study. J. Neurol. 261 (8), 1522-1530 (2014).
- Berisha, F., Feke, G. T., Trempe, C. L., McMeel, J. W., Schepens, C. L. Retinal abnormalities in early Alzheimer's disease. Investig. Ophthalmol. Vis. Sci. 48 (5), 2285-2289 (2007).
- Iseri, P. K., Altinaş, O., Tokay, T., Yüksel, N. Relationship between Cognitive Impairment and Retinal Morphological and Visual Functional Abnormalities in Alzheimer Disease. J. Neuro-Ophthalmology. 26 (1), 18-24 (2006).
- Garcia-Martin, E. S., et al. Macular thickness as a potential biomarker of mild Alzheimer's disease. Ophthalmology. 121 (5), 1149-1151 (2014).
- Ko, F., et al. Retinal Nerve Fiber Layer Thinning Associated With Poor Cognitive Function Among A Large Cohort, The Uk Biobank. Alzheimer's Dement. 12 (7), P317-P318 (2016).
- Moreno-Ramos, T., Benito-Leon, J., Villarejo, A., Bermejo-Pareja, F. Retinal nerve fiber layer thinning in dementia associated with Parkinson's disease, dementia with Lewy bodies, and Alzheimer's disease. J. Alzheimers. Dis. 34 (3), 659-664 (2013).
- Moschos, M. M., et al. Morphologic changes and functional retinal impairment in patients with Parkinson disease without visual loss. Eur. J. Ophthalmol. 21 (1), 24-29 (2011).
- Garcia-Martin, E., et al. Ability and reproducibility of Fourier-domain optical coherence tomography to detect retinal nerve fiber layer atrophy in Parkinson's disease. Ophthalmology. 119 (10), 2161-2167 (2012).
- Yip, W., et al. Comparison of Common Retinal Vessel Caliber Measurement Software and a Conversion Algorithm. Transl. Vis. Sci. Technol. 5 (5), 11 (2016).
- Gorelick, P. B., et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association. Stroke. 42 (9), 2672-2713 (2011).
- Brown, W. R., Thore, C. R. Review: Cerebral microvascular pathology in ageing and neurodegeneration. Neuropathol. Appl. Neurobiol. 37 (1), 56-74 (2011).
- DeSilva, T. M., Faraci, F. M. Microvascular Dysfunction and Cognitive Impairment. Cell. Mol. Neurobiol. 36 (2), 241-258 (2016).
- Kalaria, R. N., Akinyemi, R., Ihara, M. Does vascular pathology contribute to Alzheimer changes?. J. Neurol. Sci. 322 (1-2), 141-147 (2012).
- Kling, M. A., Trojanowski, J. Q., Wolk, D. A., Lee, V. M. Y., Arnold, S. E. Vascular disease and dementias: paradigm shifts to drive research in new directions. Alzheimers. Dement. 9 (1), 76-92 (2013).
- O'Brien, J. T., et al. Vascular cognitive impairment. Lancet Neurol. 2 (2), 89-98 (2003).
- Chen, C., et al. Alzheimer's disease with cerebrovascular disease: current status in the Asia-Pacific region. J. Intern. Med. 280 (4), 359-374 (2016).
- Pérez, M. A., Bruce, B. B., Newman, N. J., Biousse, V. The use of retinal photography in nonophthalmic settings and its potential for neurology. Neurologist. 18 (6), 350-355 (2012).
- Boppart, S. A. Optical coherence tomography: Technology and applications for neuroimaging. Psychophysiology. 40 (4), 529-541 (2003).
- Hee, M. R., et al. Optical coherence tomography of the human retina. Arch. Ophthalmol. 113 (3), 325-332 (1995).
- Huang, D., et al. Optical coherence tomography. Science (80-.). 254 (5035), 1178-1181 (1991).
- vanVelthoven, M. E. J., Verbraak, F. D., Yannuzzi, L., Rosen, R. B., Podoleanu, A. G. H., deSmet, M. D. Imaging the retina by en face optical coherence tomography. Retina. 26 (2), 129-136 (2006).
- Costa, R. A., et al. Retinal assessment using optical coherence tomography. Prog. Retin. Eye Res. 25 (3), 325-353 (2006).
- DeBuc, D. C., Somfai, G. M., Ranganathan, S., Tátrai, E., Ferencz, M., Puliafito, C. A. Reliability and reproducibility of macular segmentation using a custom-built optical coherence tomography retinal image analysis software. J. Biomed. Opt. 14 (6), 64023 (2009).
- Budenz, D. L., et al. Determinants of Normal Retinal Nerve Fiber Layer Thickness Measured by Stratus OCT. Ophthalmology. 114 (6), 1046-1052 (2007).
- Leung, C. K. S., et al. Retinal Nerve Fiber Layer Imaging with Spectral-Domain Optical Coherence Tomography: A Prospective Analysis of Age-Related Loss. Ophthalmology. 119 (4), 731-737 (2012).
- Cettomai, D., et al. Reproducibility of optical coherence tomography in multiple sclerosis. Arch. Neurol. 65 (9), 1218-1222 (2008).
- Garcia-Martin, E., Pinilla, I., Idoipe, M., Fuertes, I., Pueyo, V. Intra and interoperator reproducibility of retinal nerve fibre and macular thickness measurements using Cirrus Fourier-domain OCT. Acta Ophthalmol. 89 (1), (2011).
- Garcia-Martin, E., Pueyo, V., Pinilla, I., Ara, J. R., Martin, J., Fernandez, J. Fourier-domain OCT in multiple sclerosis patients: reproducibility and ability to detect retinal nerve fiber layer atrophy. Invest. Ophthalmol. Vis. Sci. 52 (7), 4124-4131 (2011).
- Menke, M. N., Knecht, P., Sturm, V., Dabov, S., Funk, J. Reproducibility of nerve fiber layer thickness measurements using 3D fourier-domain OCT. Invest. Ophthalmol. Vis. Sci. 49 (12), 5386-5391 (2008).
- Mwanza, J. C., et al. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Investig. Ophthalmol. Vis. Sci. 51 (11), 5724-5730 (2010).
- Syc, S. B., et al. Reproducibility of high-resolution optical coherence tomography in multiple sclerosis. Mult Scler. 16 (7), 829-839 (2010).
- Ikram, M. K., Cheung, C. Y., Wong, T. Y., Chen, C. P. L. H. Retinal pathology as biomarker for cognitive impairment and Alzheimer's disease. J. Neurol. Neurosurg. Psychiatry. 83 (9), 917-922 (2012).
- MacGillivray, T. J., Trucco, E., Cameron, J. R., Dhillon, B., Houston, J. G., vanBeek, E. J. R. Retinal imaging as a source of biomarkers for diagnosis, characterization and prognosis of chronic illness or long-term conditions. Br. J. Radiol. 87 (1040), 20130832 (2014).
- Patton, N., et al. Retinal image analysis: Concepts, applications and potential. Prog. Retin. Eye Res. 25 (1), 99-127 (2006).
- McGrory, S., et al. The application of retinal fundus camera imaging in dementia: A systematic review. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 6, 91-107 (2017).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Hardin, J. S., Taibbi, G., Nelson, S. C., Chao, D., Vizzeri, G. Factors Affecting Cirrus-HD OCT Optic Disc Scan Quality: A Review with Case Examples. J. Ophthalmol. 2015, 1-16 (2015).
- Kim, N. R., et al. Influence of Cataract on Time Domain and Spectral Domain Optical Coherence Tomography Retinal Nerve Fiber Layer Measurements. J. Glaucoma. 1, (2010).
- Li, H., et al. Lens opacity and refractive influences on the measurement of retinal vascular fractal dimension. Acta Ophthalmol. 88 (6), e234-e240 (2010).
- Maberley, D., Morris, A., Hay, D., Chang, A., Hall, L., Mandava, N. A comparison of digital retinal image quality among photographers with different levels of training using a non-mydriatic fundus camera. Ophthalmic Epidemiol. 11 (3), 191-197 (2004).
- Rochtchina, E., Wang, J. J., Taylor, B., Wong, T. Y., Mitchell, P. Ethnic variability in retinal vessel caliber: A potential source of measurement error from ocular pigmentation?-The Sydney childhood eye study. Investig. Ophthalmol. Vis. Sci. 49 (4), 1362-1366 (2008).
- Wainwright, A., et al. Effect of image quality, color, and format on the measurement of retinal vascular fractal dimension. Investig. Ophthalmol. Vis. Sci. 51 (11), 5525-5529 (2010).
- Nguyen, T. T., Wong, T. Y. Retinal vascular manifestations of metabolic disorders. Trends Endocrinol. Metab. 17 (7), 262-268 (2006).
- Ding, J., et al. Retinal vascular caliber and the development of hypertension: a meta-analysis of individual participant data. J. Hypertens. 32 (2), 207-215 (2014).
- Nguyen, T. T., Wong, T. Y. Retinal vascular changes and diabetic retinopathy. Curr. Diab. Rep. 9 (4), 277-283 (2009).
- Leung, C. K. S., Ye, C., Weinreb, R. N., Yu, M., Lai, G., Lam, D. S. Impact of Age-related Change of Retinal Nerve Fiber Layer and Macular Thicknesses on Evaluation of Glaucoma Progression. Ophthalmology. 120 (12), 2485-2492 (2013).
- Sherry, L. M., et al. Reliability of computer-assisted retinal vessel measurement in a population. Clin. Experiment. Ophthalmol. 30 (3), 179-182 (2002).
- Wardlaw, J. M., et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 12 (8), 822-838 (2013).
- Patton, N., Aslam, T., MacGillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: A rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- Ferri, C. P., et al. Global prevalence of dementia: A Delphi consensus study. Lancet. 366 (9503), 2112-2117 (2005).
- Sahadevan, S., et al. Ethnic differences in Singapore's dementia prevalence: The stroke, Parkinson's disease, epilepsy, and dementia in Singapore study. J. Am. Geriatr. Soc. 56 (11), 2061-2068 (2008).
- Kernt, M., et al. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy (Optomap) compared with ETDRS 7-field stereo photography. Diabetes Care. 35 (12), 2459-2463 (2012).
- Manivannan, A., Plskova, J., Farrow, A., Mckay, S., Sharp, P. F., Forrester, J. V. Ultra-wide-field fluorescein angiography of the ocular fundus. Am. J. Ophthalmol. 140 (3), 525-527 (2005).
- Pellegrini, E., et al. Blood vessel segmentation and width estimation in ultra-wide field scanning laser ophthalmoscopy. Biomed. Opt. Express. 5 (12), 4329 (2014).
- Estrada, R., Tomasi, C., Schmidler, S. C., Farsiu, S. Tree topology estimation. IEEE Trans. Pattern Anal. Mach. Intell. 37 (8), 1688-1701 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved