Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Retinale Bildgebung bei der Demenz zu studieren
In diesem Artikel
Zusammenfassung
Die Netzhaut teilt prominente Ähnlichkeiten mit dem Gehirn und stellt damit ein einzigartiges Fenster zum Gefäßsystem und neuronale Struktur im Gehirn nicht-invasiv zu untersuchen. Dieses Protokoll beschreibt eine Methode, um Demenz mit bildgebenden Verfahren in der Netzhaut zu studieren. Diese Methode kann potenziell in Diagnostik und Risikoabschätzung von Demenz helfen.
Zusammenfassung
Die Netzhaut bietet ein einzigartiges "Fenster" um die pathophysiologischen Prozesse der Demenz im Gehirn, zu studieren, wie es eine Erweiterung des zentralen Nervensystems (ZNS ist) und teilt sich prominente Ähnlichkeiten mit dem Gehirn in Bezug auf die embryologischen Herkunft, anatomische Merkmale und physiologische Eigenschaften. Nun kann die Gefäß- und neuronale Struktur in der Netzhaut leicht visualisiert und nicht-invasiv mittels Retinal bildgebende Verfahren, einschließlich der Fundus-Fotografie und Optische Kohärenztomografie (OCT) und quantifiziert halbautomatisch mit EDV-gestützte Analyse-Programme. Studiert die Zuordnungen zwischen neuronalen und vaskulären Veränderungen in der Netzhaut und Demenz könnte zu einem besseren Verständnis der Demenz und gegebenenfalls Hilfe bei der Diagnose und Risikobewertung. Dieses Protokoll zielt darauf ab, eine Methode zur Quantifizierung und Analyse der retinalen Gefäßsystem und neuronale Struktur, die potenziell mit Demenz zusammenhängen zu beschreiben. Dieses Protokoll auch Beispiele von Netzhautveränderungen bei Patienten mit Demenz und beschreibt technische Fragen und aktuellen Einschränkungen der retinale Bildgebung.
Einleitung
Aufgrund steigender Lebenserwartung Demenz ist geworden ein großen medizinischen Problem, einen Beitrag zu erheblichen sozialen und wirtschaftlichen Gesundheit belasten weltweit1,2,3,4,5. Heute, entwickelt eine Person in den Vereinigten Staaten Alzheimer-Krankheit (AD), die häufigste Form der Demenz, alle 66 s6. Es wurde geschätzt, dass bis zum Jahr 2050 AD7115 Millionen Menschen betroffen sind.
Die Netzhaut bietet eine "einmalige" Demenz aufgrund seiner ähnlichen anatomischen und physiologischen Eigenschaften mit dem Gehirn zu studieren. In Bezug auf das Gefäßsystem, der retinalen Arteriolen und Venolen, Messung von 100 bis 300 µm im Durchmesser teilen Sie ähnliche Funktionen mit kleinen Hirngefäße, wie Ende Arteriolen ohne Anastomosen, Barrierefunktion und Selbstregulierung8, 9. in Bezug auf die neuronale Struktur ganglionic Netzhautzellen (Routinggruppenconnectors) typische Eigenschaften mit Neuronen im zentralen Nervensystem (ZNS) 10 Teilen. Die Routinggruppenconnectors sind prominent mit dem Gehirn verbunden, wie sie der Sehnerv und Projekt visuelle Signale von der Netzhaut, die seitlichen gekniet Kerne und die superior Colliculus bilden. Der Sehnerv, ähnlich wie bei vielen neuronalen Fasern im ZNS, ist von Oligodendrozyten Markhaltige und Ensheathed in meningealen Schichten. Insbesondere kann eine Beleidigung des Sehnervs führen in ähnliche Reaktionen in anderen CNS Axone beobachtet, wie z. B. retrograde und Anterograde Degeneration der Axon, Narbenbildung, Myelin Zerstörung, sekundäre Degeneration, und eine abnorme neurotrophen Faktoren und Neurotransmitter11,12,13,14. Das Aussehen der visuelle Symptome bei Alzheimer-Patienten kann auch durch die robuste Zuordnungen zwischen der Netzhaut und Gehirn15,16erklärt werden. Infolgedessen wurde vermutet, dass die Netzhaut die pathologischen Prozesse der Demenz im Gehirn spiegeln und Netzhaut Bildgebung verwendet werden, kann um Demenz zu studieren.
Die Netzhaut Gefäßsystem und neuronale Struktur können jetzt nicht-invasiv mit retinalen bildgebende Verfahren visualisiert werden. Zum Beispiel retinalen Fundus Fotos mit Fundus Kameras erfasst werden können, und Merkmale der retinalen Gefäße (z. B. Schiff Kaliber, Schlängelung und Fraktale Dimension) können dann mit Hilfe der computergestützten Analyse quantifiziert werden Programme. Darüber hinaus Parameter der Netzhaut neuronale Struktur (z. B. die Dicke des Ganglion Zelle-inneren plexiformen Schicht [GC-IPL] und retinalen Nervenfaserschicht [RNFL]) können sich auch mit optischen Kohärenztomografie (OCT) gemessen und quantifiziert, Verwendung der integrierten Analysealgorithmen.
Dieses Protokoll soll angesichts der Bedeutung der retinale Bildgebung zu studieren Demenz eine Methode von imaging und Analyse der retinalen Gefäße und neuronale Struktur in Vivo mit bildgebenden Verfahren in der Netzhaut zu beschreiben. Dieses Protokoll auch Beispiele von Netzhautveränderungen bei Patienten mit Demenz und beschreibt technische Fragen und aktuellen Einschränkungen der retinale Bildgebung.
Protokoll
alle hier beschriebene Methoden wurden durch eine lokale klinische Forschung-Ethik-Kommission in Hongkong genehmigt.
Hinweis: der Einfachheit halber in die Tabelle der Materialien aufgeführten Geräte wird verwendet, um die Verfahren der retinale Bildgebung und anschließende Analyse zu veranschaulichen. Messung der retinalen Gefäße Parameter ist anhand der Singapur I Schiff Assessment Program (SIVA) 17 (Version 4.0, National University of Singapore, Singapore). Allerdings ist anzumerken, dass eine andere Gruppe von Geräten angenommen werden kann, da die zugrunde liegenden Prinzipien ähnliche bleiben.
1. vorbereiten, dass die Themen Retinal Imaging
- erweitern die Themen ’ Schülerinnen und Schüler mit einem mydriatic Mittel. Warten Sie mindestens 15 min, ausreichende Erweiterung der Pupille zu etablieren.
2. Messen der Netzhaut vaskulären Parameter Fundus Fotografien verwenden eine EDV-gestützte Analyse-Programm
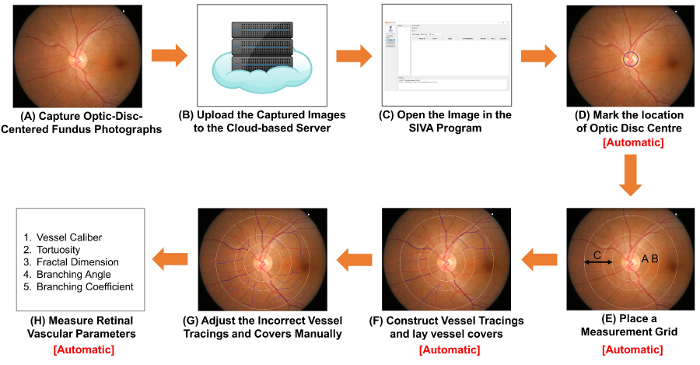
Abbildung 1: Schematische Darstellung zeigt die Verfahren der retinalen Gefäße Parameter messen. (A) erhalten optische Scheibe zentriert Fundus Fotografien mit einer Funduskamera. Abbildung 1A und 2A Abbildung sind zwei Fotos des Augenhintergrundes mit optimaler Qualität. (B) des Augenhintergrundes Fotografien auf den Cloud-basierten Server hochladen und einschlägige Studie Details, einschließlich der Bild-Umrechnungsfaktor (ICF). Andere computergestützte Analyseprogramme können Cloud-basierte Methoden zum Verwalten und Speichern der Bilder. (C) öffnen die Fundus-Fotografie in das EDV-gestützte Analyseprogramm. (D) Mark Papille Mittelpunkten und (E) aufgefordert, die Software automatisch erkennen den Rand der Papille und legen ein Messraster. (F) Konstrukt Schiff Umzeichnungen basierend auf den Pfaden des Schiffes, und lag Schiff erstreckt sich um den Durchmesser der Gefäße zu schätzen. (G) anpassen des falschen Schiff Umzeichnungen Schiff erfasst und manuell. (H) Maßnahme ein Spektrum von retinalen vaskulären Parameter, einschließlich Schiff Kaliber, Schlängelung, Fraktale Dimension und Bifurkation. (D) Schritt für Schritt (F), und (H) erfolgt automatisch durch einige computergestützte Analyseprogramme. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Fundus Fotografien mit einer Funduskamera erfassen.
- Wendung auf die Funduskamera und Einführung der Bildaufnahme-Programm auf dem Computer. Ruhen Sie das Kinn des Themas richtig auf den Kinnhalter mit der Stirn gegen das Kopfband. Verschieben den Steuerhebel den Lichtstrahl richtig zum Thema ausrichten ’ s Schüler.
- Richten die Beleuchtung Punkte, bis beide kleinste auf beiden Seiten im Sucher angezeigt. Bewegen Sie das Fixateur externe Ziel, das Thema zu führen ’ s Augen bis die Papille in der Mitte des Suchers ist und die Regionen von Interesse (ROI) gut innerhalb der Grenzen sind. Anpassen der Fokussierknopf der Netzhaut fokussieren.
- Haben den Betreff fest der Fixateur externe Ziel betrachten und gewährleisten das Thema ’ sind nicht s Augen füllten sich mit Tränen.
- Drücken Sie den Auslöser zum Erfassen eines Abbilds ( Abbildung 1A).
- Prüfen Sie die Qualität des Augenhintergrundes Fotos mithilfe von Abbildung 2A als Standard erfasst. Entsorgen Sie das Bild und Bild Akquisitionsprozess (d. h. Schritt 2.1.1 bis 2.1.4) zu wiederholen, wenn die Schüler schlecht ist geweitet ( Abb. 2 b), die Papille ist nicht in der Mitte des Bildes ( Abbildung 2), oder die Bild ist unscharf ( Abb. 2D).
- Speichern Sie das Bild im TIFF-Format mit Aktionen Auflösung (d.h. ca. 3000 Pixel X 2,000 Pixel, mit mehr als 150 dpi).
Hinweis: Das Protokoll kann hier angehalten. - Wiederholen Sie die Schritte 2.1.1 bis 2.1.6 Fundus Fotos für andere Themen zu erwerben.
- 10 % Auswahl an Bildern nach dem Zufallsprinzip auswählen und Messen Sie die Höhe der optischen Discs in diesen Bildern ( Abbildung 3). Die Bild-Umrechnungsfaktor (ICF) mit Hilfe der Formel zu berechnen:
ICF = 1.800 µm / (durchschnittliche Pixelhöhe von optischen Discs der Bilder abgetastet). - Erfassten Fundus Fotografien auf den Cloud-basierten Server hochladen und einschlägige Studie Details angeben, einschließlich der Bild-Umrechnungsfaktor (ICF) ( Abbildung 1 b).
Hinweis: Das Protokoll kann hier angehalten werden. Andere computergestützte Analyseprogramme können andere Cloud-basierte Methoden verwenden, um die Bilder zu organisieren und Aufzeichnen der ICF.
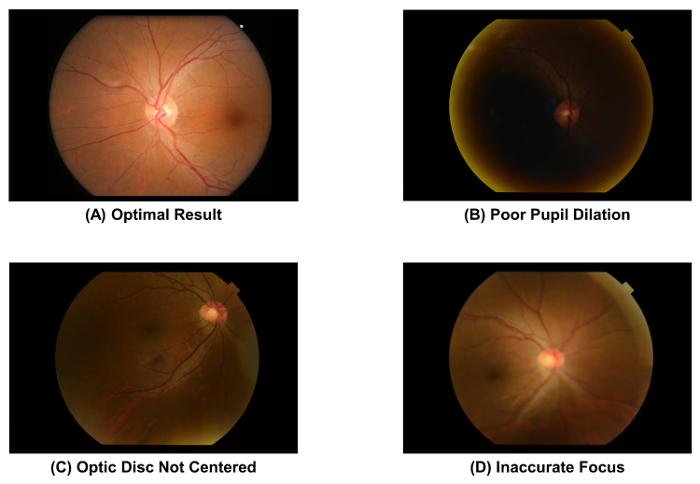
Abbildung 2: Fundus Fotos mit optimalen und suboptimale Qualität. Die Bildqualität eines Fotos des Augenhintergrundes muss sofort nach der Bildaufnahme, überprüft werden, da die Bildqualität direkt die Folgebewertung der retinalen Gefäße Parameter beeinflusst. Das Bild sollte verworfen werden, wenn eines dieser Artefakte beobachtet wird. Diese Bilder wurden mit einem 50° Funduskamera erfasst. Bitte klicken Sie hier für eine größere Version dieser Figur.
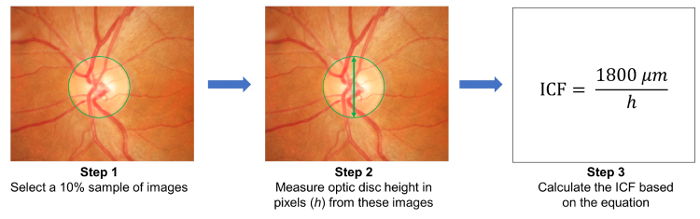
Abbildung 3: Berechnung des Umrechnungsfaktors Bild (ICF). Um die ICF zu berechnen, nach dem Zufallsprinzip eine Stichprobe 10 % von Bildern aus der Studie (Schritt 1). Dann probierte Maß der Höhe für optische Disks (in Pixel) aus den Bildern (Schritt2). Die ICF mit Hilfe der Formel zu berechnen: ICF = 1800 µm / (durchschnittliche Pixelhöhe von optischen Discs der aufgenommenen Bilder), wo 1800 µm ist etwa auf der Höhe der eine normale Papille (Schritt 3). Vergrößerung-Effekt und der Bildauflösung unterscheiden sich von Kamera zu Kamera, ist es notwendig, eine genaue ICF für jede Kamera verwendet zu berechnen. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Fundus-Fotografie in eine EDV-gestützte Analyse-Programm öffnen. Schiff Umzeichnungen zu konstruieren und Schiff Abdeckungen für die Netzhaut Gefäßsystem lag.
Hinweis: In diesem Abschnitt wird das SIVA-Programm verwendet, um das Verfahren zu veranschaulichen. Jedoch kann das SIVA-Programm von anderen verfügbaren EDV-gestützte Analyseprogrammen ersetzt werden. Darüber hinaus Schritte 2.2.2, 2.2.3 erfolgen automatisch durch eine computergestützte Analyse Programme, wenn eine Fotografie des Augenhintergrundes ist geöffnet werden (d.h. Schritt 2.2.1).- Öffnen die Fundus-Fotografie mit dem EDV-gestützte Analyseprogramm ( Abbildung 1).
- Markieren die Lage der Papille ( Abbildung 1).
- Klicken Sie auf die “ OD Center ”-Taste auf der linken Befehlsfeld; der Mauscursor wird durch einen grünen Kreis ersetzt werden.
- Schieben Sie den grünen Kreis in der Mitte der Papille (OD), und mit der linken Maustaste um den Kreis zu beheben.
- Fordert die Software automatisch ein Messraster aufgeben, konstruieren Schiff Kurven und lay-Schiff deckt ( Abb. 1E und 1F).
Hinweis: Behälter Abdeckungen sind Messlinien, die die ungefähre Breite der internen Lumen der Gefäße zu schätzen.- Klicken Sie auf die “ finden OD ” Taste aufgefordert, die Software zur Erkennung der OD-Felge und Platz vier konzentrische Kreisen als ein Messraster, basierend auf der Position des Centers OD.
- Klicken Sie auf den “ Prozess ”-Taste, um die automatische Schiff Verfolgung einzuleiten.
- Adjust falsche Schiff Umzeichnungen manuell. Beginnen die Inspektion von 12 o ’ Uhr-Position im Uhrzeigersinn um sicherzustellen, dass alle Schiff Umzeichnungen überprüft werden.
- Prüfen, ob die Papille genau erfasst und dem Messraster ist korrekt platziert. Die Messraster manuell folgende Schritte 2.2.2, 2.2.3, anpassen, wenn der innerste Kreis die Papille Felge ( Abb. 4A) nicht genau umreißen ist.
- Linksklick Schiff Tracing(s) mit falschen Schiffstyp (Arteriolen und Venolen) beschriftet und klicken das “ Schiff (T) YP ” Taste, um den Schiffstyp.
Hinweis: Arteriolen sind rot gekennzeichnet und Venolen sind blau gekennzeichnet. Arteriolen können von Venolen basierend auf ihre physiologische Differenzen unterschieden werden. Venolen sind beispielsweise in der Regel in der Farbe dunkler und breiter als Arteriolen. Schiffe mit gleichen Schiffstyp in der Regel nicht einander kreuzen. - Verlängern unvollständig Schiff Umzeichnungen folgende Schritte 2.3.3.1 zu 2.3.3.2 ( Abbildung 4 b).
- Verwendung der Cursor am distalen Ende der unvollständigen Schiff Ablaufverfolgung klicken. Klicken Sie links an den Punkten entlang des Pfads Schiff, Schiff-Ablaufverfolgung zu verlängern.
- Stoppen der Raytracing-Vorgang, wenn das distale Ende des Schiffes erreicht ist. Die Ablaufverfolgung auf die äußerste weiße Kreis zu stoppen, wenn der distale Teil des Schiffes dem Messraster fällt (siehe Abbildung 4 b).
- Schiffes Kurven anpassen, wenn die Schiff-Pfade nicht korrekt an die Crossover-Standort ( Abbildung 4) verfolgt werden.
- Klicken Sie auf die “ wählen Sie ”-Taste und klicken Sie dann am falschen Punkt des Schiffes-Tracing. Klicken Sie auf die “ Brea(k) Seg ”-Taste, um das Schiff Verfolgung bei dem ausgewählten Punkt trennen. Wählen Sie das getrennte Segment und klicken Sie auf die “ (Del) Seg ” Taste it. löschen
- Neu konstruieren ein neues Schiff-Tracing mit Schritten 2.3.3.1 und 2.3.3.2.
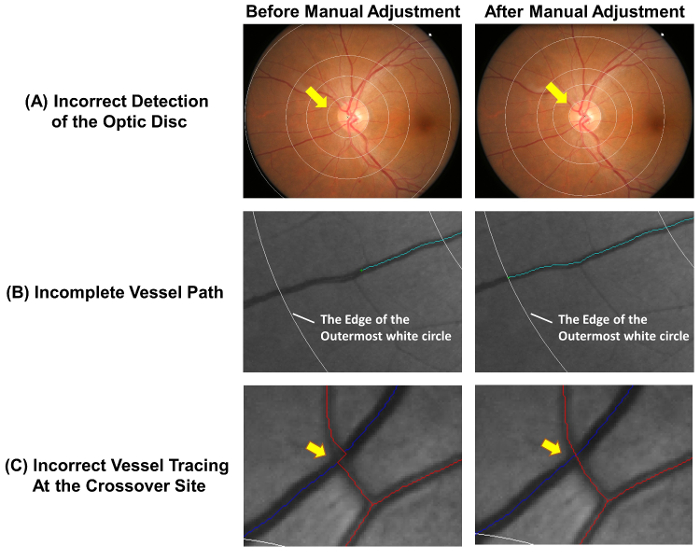
Abbildung 4: häufige Fehler von der Auto-Tracing. Die automatische Schiff die Ablaufverfolgung ist nicht völlig korrekt und manuelle Anpassungen sind erforderlich, um die Genauigkeit der Messung zu gewährleisten. Diese Abbildung zeigt häufige Fehler die Auto-Verfolgung und optimale Ergebnisse nach manuellen Einstellungen. (A) der Papille Mitte falsch markiert und dies führte zu einer Abweichung von dem Messraster, die die nachfolgenden Messungen beeinträchtigen können. Im Idealfall sollte der innerste Kreis des Rasters Messung die Papille Felge dargelegt werden. (B) unvollständige Schiff Ablaufverfolgung könnte die falsche Messung der Fraktale Dimension, Schlängelung, etc., die der Schiff Weg bis zum Ende des Schiffes verfolgt werden sollte. Fällt der distale Teil des Schiffes außerhalb dem Messraster, kann die Verfolgung in die äußerste weiße Kreis gestoppt werden. (C) Schiff Kurven an den Crossover-Standorten unterliegen einer höheren Tendenz der Fehler und erfordern daher besondere Aufmerksamkeit. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Schiffes Abdeckungen über alle Segmente des Schiffes zu legen und die falsche Cover manuell deaktivieren.
- Klicken Sie auf die “ finden deckt ”-Taste, um das Schiff Abdeckungen automatisch über alle Segmente des Schiffes lag.
- Überprüfen, ob alle Behälter Deckel richtig platziert sind. Mit der linken Maustaste und ziehen Sie der Cursor, um Schiff deaktivieren deckt, wenn die Bezüge nicht sind senkrecht auf die Gefäßwände ( Abb. 5A) gelegt, Schiff Weg ist verdeckt durch ein anderes Schiff ( Abb. 5 b), oder die Abdeckungen zu überschätzen oder unterschätzen die Breite des Schiffes Lumen ( Abbildung 5).
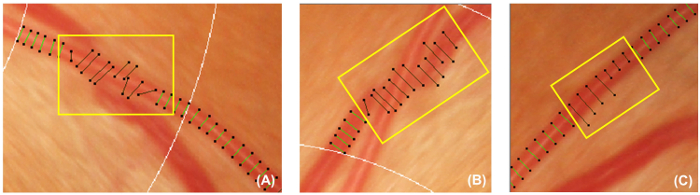
Abbildung 5: falsche Schiff deckt. Diese Abbildung zeigt Beispiele für falsche Schiff Abdeckungen, die deaktiviert werden sollten und von der Folgebewertung ausgeschlossen. Schiff Abdeckungen sollte deaktiviert werden, wenn sie nicht senkrecht zu den Gefässen (A) sind. Darüber hinaus Schiff Abdeckungen sollten auch deaktiviert werden, wenn das Schiff verfolgt unter ein anderes Schiff (B) verdeckt ist, oder die Schiff Abdeckungen können nicht die ungefähre Breite des Schiffes (C) darstellen. Bitte klicken Sie hier für eine größere Version dieser Figur.
- messen retinalen vaskulären Parameter aus der Umzeichnungen Schiff und das Schiff Abdeckungen
Hinweis: Schritt 2.5 erfolgt automatisch durch eine computergestützte Analyse-Programm.- Label Bereich 0,5-1,0-Scheibe Durchmesser von der Papille Marge als Zone B und der Bereich 0,5-2,0 Scheibe Durchmesser von der Papille Marge als Zone C 18 ( Abb. 6A), nach der geänderte Protokoll des Atherosklerose-Risikos in Gemeinschaften (ARIC) studieren 19.
- Maßnahme retinalen Gefäße Kaliber aus Zone B und Zone C, mit einer weithin angenommen-Methode, die aus der ARIC geändert wird studieren 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 ( Abb. 6 b).
- Messen Sie die Länge der Schiff Abdeckungen in den sechs größten Arteriolen und die sechs größten Venolen, retinale Schiff Kaliber zu schätzen.
- Zusammenfassen der retinalen Arteriolen und venular Kaliber als zentralen Netzhautarterie Äquivalent (CRAE) und zentrale Netzhaut Ader Äquivalent (CRVE) bzw. 17, mit der überarbeiteten Knudtson – Parr-Hubbard-Formel 18 , 19.
- identifizieren alle Schiffe in der Zone C mit einem Breite > 40 µm. Berechnen der retinalen Arteriolen und venular Schlängelung von Integral der gesamten quadrierten Krümmung entlang der Schiff Umzeichnungen und normalisieren den Wert mit der gesamten Bogenlänge, beugen und Beugungspunkte 27 , 28.
- Berechnen Sie die Summe, die Arteriolen, und venular Fraktale Dimensionen aus Zone C, mit den etablierten “ Box-counting Methode ” 29 , 30 , 31.
- Unterteilen Sie das Bild in eine Reihe von gleich große Quadrate.
- Die Anzahl der Boxen, enthält einen Abschnitt der Schiff Umzeichnungen.
- Wiederholen Sie den Vorgang mit einer Reihe von gleichgroßen Quadraten mit verschiedenen Größen.
- Plotten den Logarithmus der Anzahl der Kisten mit der Schiff Umzeichnungen gegen den Logarithmus der Größe der Boxen und berechnen Sie die Steigung der die resultierende Linie; Dies ist die fraktale Dimension.
- Schiffe mit ersten Gabelung in der Zone C identifizieren und berechnen Sie den Winkel (θ) zwischen den ersten beiden Tochter Schiffe 32 ( Abbildung 6) vorhanden. Berechnen Sie den Mittelwert um den durchschnittlichen Verzweigung Winkel zu erhalten.
- Der verzweigten Koeffizient von Zone C mit Hilfe der Formel zu berechnen:
(d 1 2 + d 2 2) / d 0 2, wo d 0 ist der mittlere Stamm Kaliber und d 1 und d 2 die mittlere Zweig Kaliber ( Abbildung 6 sind).
- Das grading Fenster zu schließen. Klicken Sie “ senden ” im Popup-Fenster automatisch gemessenen retinalen vaskulären Parameter zu den abgestuften Bildgalerie an den Cloud-basierten Server.
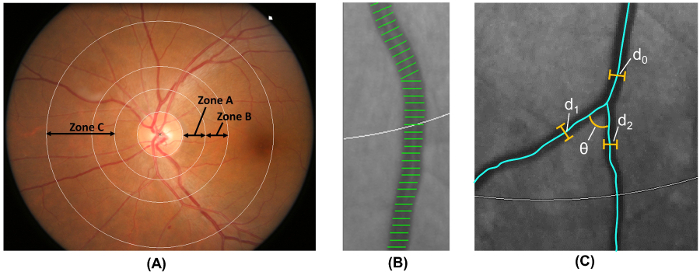
Abbildung 6: Quantifizierung der retinalen Gefäße. (A) Zone B (definiert als 0.5-1.0 disc Durchmesser entfernt am Rand der Scheibe) wird verwendet, um Schiff Kaliber der Zone B nach dem Arteriosklerose-Risiko in Gemeinschaften Studie zu messen. Zone C (definiert als 0,5-2,0 Durchmessern entfernt am Rand der Scheibe Scheibe) dient zur Messung von Schiff Kaliber der Zone C und ein Spektrum der retinalen Gefäße Netzwerkparameter (z. B. Schlängelung, Fraktale Dimension und Bifurkation). (B) Schiff Abdeckungen sind Messlinien verwendet, um die Netzhaut Schiff Kaliber (oder Durchmesser) zu schätzen. Falsche Schiff Abdeckungen sollten manuell von der Messung ausgeschlossen werden. (C) misst für alle Schiffe, die ihre ersten Gabelung in C, das Programm automatisch Zone die verzweigten Winkel (θ) an der ersten Gabelung. Darüber hinaus die verzweigten Koeffizient ist auch mit der Formel berechnet: verzweigte Koeffizient = (d 1 2 + d 2 2) / d 0 2, wo d 0 der Stamm Kaliber, und d 1 und d ist 2 sind die Zweig-Kaliber. Bitte klicken Sie hier für eine größere Version dieser Figur.
3. Beurteilung die Dicke der GC-IPL und RNFL
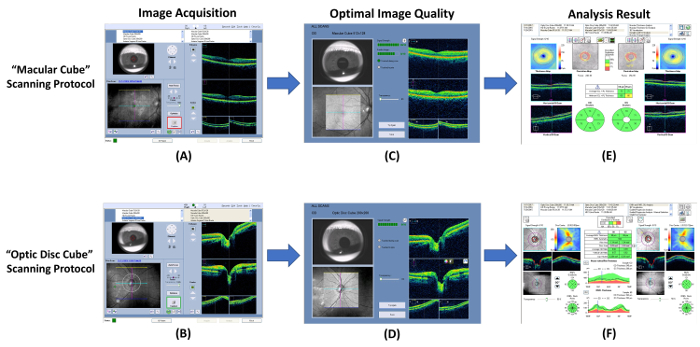
Abbildung 7: Schematische Darstellung zeigt die Verfahren zur Messung der RNFL und GC-IPL Dicke. Optische Kohärenztomografie (OCT) kann verwendet werden, um dicken von Ganglion Zelle-inneren plexiformen Schicht (GC-IPL) und der retinalen Nervenfaserschicht (RNFL) zu messen. (A, B) Messen von der GC-IPL und RNFL stärken, die Verwendung der integrierten “ Makula Cube ” und “ Papille Cube ” Protokolle bzw. Scannen. (C, D) Überprüfen Sie die Bildqualität sofort nach der Bildaufnahme. Verwerfen Sie das Bild und wiederholen Sie den Scan, wenn die Signalstärke kleiner als 6 ist oder Bewegung Artefakte werden erkannt. (E, F) Fordert Sie dann, die integrierte Analyse-Programm, um automatisch das Scan-Ergebnis zu analysieren und erstellen Sie einen Bericht für die Interpretation. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Durchführen Bildaufnahme mit optischer Kohärenztomografie (OCT).
- Das OCT-Programm öffnen und wählen Sie die “ Macular Cube ” Scan-Protokoll starten eine neue Makula-Scan ( Abb. 7A).
- Suchen Sie die Schüler in das Ansichtsfenster "Iris" durch Anpassen der Kinnhalter. Die Beleuchtung zu senken, wenn die Pupillengröße zu klein ist.
- Klicken Sie auf die “ Autofokus ” Taste und dann die “ optimieren ” Taste, um die Bildqualität zu verbessern.
- Anweisen, das Thema ein paar Mal blinken unmittelbar vor dem Starten des Scanvorgangs.
- Klicken Sie auf die “ Capture ” Taste, um den Scan zu starten, wird der Rahmen um die Taste Grün. Anweisen, das Thema zu konzentrieren, die visuelle Fixierung Ziel während der Bildaufnahme, Bewegungsartefakte zu vermeiden.
- Überprüfen Sie die Scan-Qualität mit Abbildung 7 als Standard. Das Scan-Ergebnis verwerfen und wiederholen Sie den Scan, wenn die Signalstärke kleiner als 6 ( Abb. 8A ist) oder Bewegung Artefakte erkannt werden (gekennzeichnet durch Diskontinuität der Blutgefäße) ( Abb. 8 b).
- Speichern das Scanergebnis.
- Wiederholen Sie die Schritte 3.1.1 bis 3.1.7 für ein anderes Auge.
- Führen einen Sehnerv Kopf Scan mit der “ optischen Disc Cube ” Scan-Protokoll folgende Schritte 3.1.2 zu 3.1.9 ( Zahlen 7 b und 7D).

Abbildung 8: Sub-optimale Ergebnisse der optischen Kohärenztomographie. Suboptimale Ergebnisse der optischen Kohärenztomographie (OCT) umfassen (A) schlechte Signalstärke (Stärke-Wert < 6), und (B) Bewegung Artefakte. Die Scan-Qualität sofort nach der Bildaufnahme überprüft werden sollte, und des Scans sollte wiederholt werden, wenn diese Artefakte auftreten. Bitte klicken Sie hier für eine größere Version dieser Figur.
- erzeugen eine Analyse Ausdruck der Makula GC-IPL Dicke.
- Wählen Sie die “ Macular Cube ” Datensätze beider Augen in der Analyse-Schnittstelle zu scannen.
- Klicken Sie auf das “ Ganglion Zellanalyse OU ”, die automatische Analyse-Algorithmus zur Bewertung der GC-IPL-Dicke des Scans ( Abbildung 7E) zu initiieren.
Hinweis: Schritt 3.2.2 erfolgt automatisch durch die Analyse-Algorithmus.- Erzeugen ein 14,13 mm 2 Fovea-zentrierten elliptische Ringraum, der horizontalen innere und äußere Radien von 0,6 mm und 2,4 mm, bzw. hat und vertikale inneren und äußeren Radien von 0,5 bis 2,0 mm bzw..
Hinweis: Die Größe und Form von den elliptischen Ring eng an die Makula Anatomie entsprechen und somit das Gebiet, wo die Routinggruppenconnectors dicksten in normale Augen 33 , 34 entsprechen. Bereich innerhalb des inneren Rings den Ringraum wird nicht gemessen, da die GC-IPL in diesem Bereich sehr dünn ist. - Segment der äußeren Grenze der RNFL und die äußere Begrenzung der inneren plexiformen Schicht (IPL), die GC-IPL ( Abbildung 9) zu finden.
- Messen den Mittelwert, Minimum und sechs sektoriellen (superior, Superotemporal, Superonasal, Inferonasal, minderwertig, inferotemporalen) dicken der Makula GC-IPL in der Fovea-Cenregistrierten elliptische Ringraum.
- Vergleichen Sie die gemessenen GC-IPL-dicken an das Gerät ’ s internen normativen Alter abgestimmt-Datenbank und erzeugen eine Abweichung und Bedeutung
- Melden die Messergebnisse auf einem Ausdruck Analyse.
- Erzeugen ein 14,13 mm 2 Fovea-zentrierten elliptische Ringraum, der horizontalen innere und äußere Radien von 0,6 mm und 2,4 mm, bzw. hat und vertikale inneren und äußeren Radien von 0,5 bis 2,0 mm bzw..
- Analyse Ausdruck im PDF-Format zu speichern.
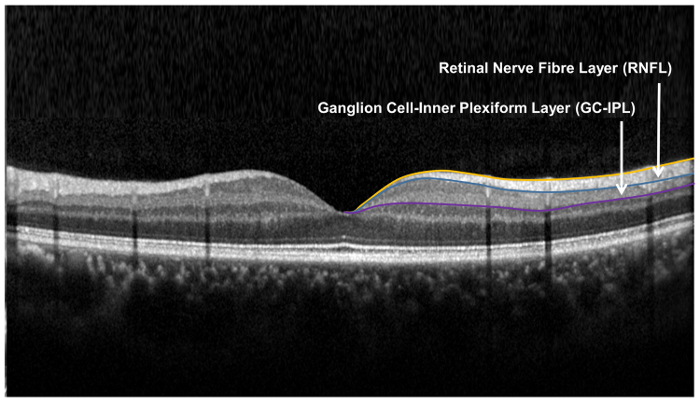
Abbildung 9: Netzhaut Schichten verwendet für die Beurteilung der Netzhaut neuronale Struktur. Die Netzhaut Nerven-Faser-Schicht (RNFL) wird anhand des Sehnerv Kopf (ONH) Algorithmus, während die Ganglion Zelle-inneren plexiformen Schicht gemessen wird mit dem Ganglion Zelle Analyse (GCA) Algorithmus. Der Algorithmus ONH Segmente die innere und äußere Begrenzung der RNFL zur Messung der Dicke der RNFL. Die GCA-Algorithmus erkennt der äußere Grenze der retinalen Nervenfaserschicht (RNFL) und der inneren plexiformen Schicht (IPL), um die kombinierte Stärke des Ganglion-Zellschicht (GCL) zu erzielen und die IPL. Die dicken der GCL und der IPL werden zusammen, gemessen, da die Grenze zwischen GCL und IPL anatomisch undeutlich ist. Die kombinierte Stärke der GCL und IPL (d.h. GC-IPL) ist jedoch immer noch bezeichnend für die Gesundheit der Routinggruppenconnectors. Bitte klicken Sie hier für eine größere Version davon Abbildung.
- generieren die Analyse Ausdruck der RNFL Dicke ( Abbildung 7F).
- Wählen Sie die “ optische Disc Cube ” Datensätze beider Augen in der Analyse-Schnittstelle zu scannen.
- Klicken Sie auf die “ ONH und RNFL OU Analyse ”, die automatische Analyse-Algorithmus zur Bewertung der RNFL Dicke des Scans zu initiieren.
Hinweis: Schritte 3.3.2.1, 3.3.2.6 können durch die Analyse-Algorithmus automatisch durchgeführt werden.- Messen Sie die Dicke der RNFL an jedem Messpunkt und erzeugen eine RNFL Dicke Karte.
- Identifizieren der Papille durch Erkennung einen dunklen Fleck in der Mitte des Scans, die Größe und Form, die konsistent mit dem Angebot an einer optischen Disc hat
- Ein Messraster von 3,46 mm im Durchmesser rund um die Papille auf der RNFL Dicke Karte positionieren.
- Messen und berechnen die globalen, vier-Quadranten (zeitliche, überlegene, nasale und minderwertig) und zwölf-Uhr-Stunden Parapapillary RNFL dicken von dem Messraster.
- Vergleichen Sie die gemessenen RNFL dicken an das Gerät ’ s internen normativen Alter abgestimmten Datenbank und erzeugen eine Abweichung-Karte und eine Karte von Bedeutung.
- Melden die Messergebnisse auf einem Ausdruck Analyse.
- Analyse Ausdruck im PDF-Format zu speichern.
Ergebnisse
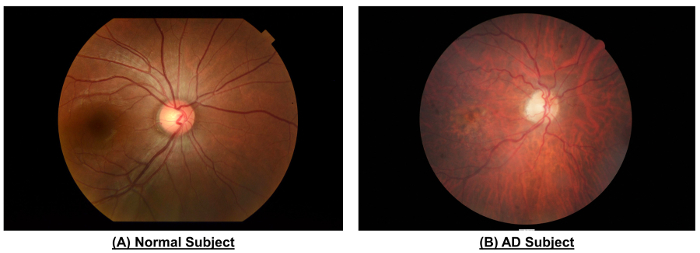
Abbildung 10: Ein Beispiel für die Unterschiede in der Netzhaut Gefäßsystem zwischen einem normalen Subjekt und ein AD Thema. Im Vergleich zu den normalen Subjekt zeigte Fundus Fotographie des Subjekts AD schmaler Schiff Kaliber (CRAE der Zone B, 116,4 µm vs. 156.4 µm; CRVE der Zone B, 186.9 µm vs. 207,5 µm; CRAE Zone C, 138.5 µm <...
Diskussion
Dieses Protokoll beschreibt die Verfahren zur Quantifizierung der neuronaler und vaskulärer Veränderungen in der Netzhaut in Vivo. Die Netzhaut ähnliche embryologischen Ursprung, anatomische Merkmale und physiologische Eigenschaften mit dem Gehirn teilt, können diese Netzhautveränderungen ähnliche Veränderungen des Gefäßsystems und neuronale Struktur im Gehirn widerspiegelt.
Wie in Abbildung 10 und Tabelle 1dargestellt, zeigte da...
Offenlegungen
Wir möchten unsere Anerkennung der School of Computing, National University of Singapore für technische Unterstützung aussprechen.
Danksagungen
Über mögliche finanzielle Bindungen ist der Autor Tien Y. Wong Miterfinder des Programms Singapur I Schiff Bewertung (SIVA) in diesem Artikel verwendet.
Materialien
| Name | Company | Catalog Number | Comments |
| Non-mydriatic Retinal Camera | Topcon, Inc, Tokyo, Japan | TRC 50DX | N/A |
| Singapore I Vessel Assessment Program | National University of Singapore | Version 4.0 | N/A |
| CIRRUS HD-OCT | Carl Zeiss Meditec, Inc, Dublin, CA | Model 4000 | N/A |
| Mydriatic Agents | N/A | N/A | Prepared from 1% tropicamide and 2.5% phenylephrine hydrochloride |
Referenzen
- Alzheimer's Disease International. The prevalence of dementia worldwide. Alzheimer's Dis. Int. (December), 1-2 (2008).
- Wimo, A., Winblad, B., &Jönsson, L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimer's Dement. 6 (2), 98-103 (2010).
- Comas-Herrera, A., Northey, S., Wittenberg, R., Knapp, M., Bhattacharyya, S., Burns, A. Future costs of dementia-related long-term care: exploring future scenarios. Int. Psychogeriatr. 23 (1), 20-30 (2011).
- Alzheimer's Association. Alzheimer's disease facts and figures. Alzheimer's Dement. 10 (2), e47-e92 (2014).
- Prince, M., Bryce, R., Albanese, E., Wimo, A., Ribeiro, W., Ferri, C. P. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers. Dement. 9 (1), 63-75 (2013).
- Alzheimer's Association. 2016 Alzheimer's disease facts and figures. Alzheimer's Dement. 12 (4), 459-509 (2016).
- Asih, P. R., Chatterjee, P., Verdile, G., Gupta, V. B., Trengove, R. D., Martins, R. N. Clearing the amyloid in Alzheimer's: progress towards earlier diagnosis and effective treatments - an update for clinicians. Neurodegener. Dis. Manag. 4 (5), 363-378 (2014).
- Cheung, C. Y., Ikram, M. K., Chen, C., Wong, T. Y. Imaging retina to study dementia and stroke. Prog. Retin. Eye Res. , (2017).
- Patton, N., Aslam, T., Macgillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: a rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nat. Rev. Neurol. 9 (1), 44-53 (2013).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Levkovitch-Verbin, H., Quigley, H. A., Kerrigan-Baumrind, L. A., D'Anna, S. A., Kerrigan, D., Pease, M. E. Optic nerve transection in monkeys may result in secondary degeneration of retinal ganglion cells. Investig. Ophthalmol. Vis. Sci. 42 (5), 975-982 (2001).
- Levkovitch-Verbin, H., Quigley, H. A., Martin, K. R., Zack, D. J., Pease, M. E., Valenta, D. F. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Sadun, A. A., Borchert, M., DeVita, E., Hinton, D. R., Bassi, C. J. Assessment of Visual Impairment in Patients With Alzheimer's Disease. Am. J. Ophthalmol. 104 (2), 113-120 (1987).
- Schlotterer, G., Moscovitch, M., Crapper-Mclachlan, D. Visual processing deficits as assessed by spatial frequency contrast sensitivity and backward masking in normal ageing and alzheimer's. Brain. 107 (1), 309-324 (1984).
- Cheung, C. Y. L., et al. A new method to measure peripheral retinal vascular caliber over an extended area. Microcirculation. 17 (7), 495-503 (2010).
- Knudtson, M. D., Lee, K. E., Hubbard, L. D., Wong, T. Y., Klein, R., Klein, B. E. K. Revised formulas for summarizing retinal vessel diameters. Curr. Eye Res. 27 (3), 143-149 (2003).
- Hubbard, L. D., et al. Methods for evaluation of retinal microvascular abnormalities associated with hypertension/sclerosis in the Atherosclerosis Risk in Communities Study. Ophthalmology. 106 (12), 2269-2280 (1999).
- Patton, N., et al. The association between retinal vascular network geometry and cognitive ability in an elderly population. Investig. Ophthalmol. Vis. Sci. 48 (5), 1995-2000 (2007).
- VanHecke, M. V., et al. Are retinal microvascular abnormalities associated with large artery endothelial dysfunction and intima-media thickness? The Hoorn Study. Clin. Sci. London Engl. 110 (5), 597-604 (2006).
- Tien, Y. W., et al. Retinal vascular caliber, cardiovascular risk factors, and inflammation: The Multi-Ethnic Study of Atherosclerosis (MESA). Investig. Ophthalmol. Vis. Sci. 47 (6), 2341-2350 (2006).
- Leung, H., et al. Relationships between age, blood pressure, and retinal vessel diameters in an older population. Investig. Ophthalmol. Vis. Sci. 44 (7), 2900-2904 (2003).
- Wong, T. Y., et al. The prevalence and risk factors of retinal microvascular abnormalities in older persons: The cardiovascular health study. Ophthalmology. 110 (4), 658-666 (2003).
- Ikram, M. K., et al. Retinal vessel diameters and risk of stroke: The Rotterdam Study. Neurology. 66 (9), 1339-1343 (2006).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: Methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Sasongko, M. B., et al. Alterations in retinal microvascular geometry in young type 1 diabetes. Diabetes Care. 33 (6), 1331-1336 (2010).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Mainster, M. a The fractal properties of retinal vessels: embryological and clinical implications. Eye. 4 ( Pt 1) (1), 235-241 (1990).
- Liew, G., et al. The Retinal Vasculature as a Fractal: Methodology, Reliability, and Relationship to Blood Pressure. Ophthalmology. 115 (11), (2008).
- Stosic, T., Stosic, B. D. Multifractal analysis of human retinal vessels. IEEE Trans. Med. Imaging. 25 (8), 1101-1107 (2006).
- Zamir, M., Medeiros, J. A., Cunningham, T. K. &. a. m. p. ;. M., Zamir, J. A., Medeiros, T. K. C. Arterial bifurcations in the human retina. J. Gen. Physiol. 74 (4), 537-548 (1979).
- Mwanza, J. C., Oakley, J. D., Budenz, D. L., Chang, R. T., Knight, O. J., Feuer, W. J. Macular ganglion cell-inner plexiform layer: Automated detection and thickness reproducibility with spectral domain-optical coherence tomography in glaucoma. Investig. Ophthalmol. Vis. Sci. 52 (11), 8323-8329 (2011).
- Bendschneider, D., et al. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J. Glaucoma. 19 (7), 475-482 (2010).
- Cheung, C. Y., Ong, Y. T., Ikram, M. K., Chen, C., Wong, T. Y. Retinal Microvasculature in Alzheimer's Disease. J. Alzheimer's Dis. 42 (s4), S339-S352 (2014).
- Murray, C. D. THE PHYSIOLOGICAL PRINCIPLE OF MINIMUM WORK APPLIED TO THE ANGLE OF BRANCHING OF ARTERIES. J. Gen. Physiol. (4), 835-841 (1926).
- Ding, J., et al. Early retinal arteriolar changes and peripheral neuropathy in diabetes. Diabetes Care. 35 (5), 1098-1104 (2012).
- Yim, C., et al. Retinal Ganglion Cell Analysis Using High-Definition Optical Coherence Tomography in Patients with Mild Cognitive Impairment and Alzheimer's Disease. J. Alzheimer's Dis. Retin. Ganglion Cell Anal. MCI AD. 45 (1), 45-56 (2015).
- Stein, D. M., Wollstein, G., Ishikawa, H., Hertzmark, E., Noecker, R. J., Schuman, J. S. Effect of Corneal Drying on Optical Coherence Tomography. Ophthalmology. 113 (6), 985-991 (2006).
- Mwanza, J. C., et al. Effect of Cataract and its Removal on Signal Strength and Peripapillary Retinal Nerve Fiber Layer Optical Coherence Tomography Measurements. J. Glaucoma. 20 (1), 37-43 (2011).
- Garcia-Martin, E., et al. Influence of cataract surgery on optical coherence tomography and neurophysiology measurements in patients with retinitis pigmentosa. Am. J. Ophthalmol. 156 (2), (2013).
- Kok, P. H. B., et al. The relationship between the optical density of cataract and its influence on retinal nerve fibre layer thickness measured with spectral domain optical coherence tomography. Acta Ophthalmol. , (2012).
- Kim, N. R., et al. Influence of cataract on time domain and spectral domain optical coherence tomography retinal nerve fiber layer measurements. J. Glaucoma. 21 (2), 116-122 (2012).
- Hwang, Y. H., Kim, Y. Y. Effect of Peripapillary Vitreous Opacity on Retinal Nerve Fiber Layer Thickness Measurement Using Optical Coherence Tomography. Arch. Ophthalmol. 130 (6), 789-792 (2012).
- Schwartz, S. G., Flynn, H. W., Fisher, Y. L. "Floater scotoma" demonstrated on spectral-domain optical coherence tomography and caused by vitreous opacification. Ophthalmic Surg. Lasers Imaging Retina. 44 (4), 415-418 (2013).
- Frost, S., et al. Retinal vascular biomarkers for early detection and monitoring of Alzheimer's disease. Transl. Psychiatry. 3 (2), e233 (2013).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- DeJong, F. J., et al. Retinal vascular caliber and risk of dementia: The Rotterdam Study. Neurology. 76 (9), 816-821 (2011).
- Cheung, C. Y., et al. Quantitative and qualitative retinal microvascular characteristics and blood pressure. J. Hypertens. 29 (7), 1380-1391 (2011).
- Cheung, C. Y., et al. Retinal vascular fractal dimension and its relationship with cardiovascular and ocular risk factors. Am. J. Ophthalmol. 154 (4), 663-674 (2012).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Grinton, M. E., et al. The association between retinal vessel morphology and retinal nerve fiber layer thickness in an elderly population. Ophthalmic Surg. Lasers Imaging. 43 (6 Suppl), S61-S66 (2012).
- Hughes, A. D., et al. Quantification of topological changes in retinal vascular architecture in essential and malignant hypertension. J. Hypertens. 24 (5), 889-894 (2006).
- Hughes, A. D., et al. Determinants of retinal microvascular architecture in normal subjects. Microcirculation. 16 (2), 159-166 (2009).
- Lau, Q. P., Lee, M. L., Hsu, W., Wong, T. Y. The Singapore Eye Vessel Assessment System. Image Anal. Model. Ophthalmol. , 143-160 (2014).
- Thomas, G. N., et al. Measurement of Macular Fractal Dimension Using a Computer-Assisted Program. Investig. Opthalmology Vis. Sci. 55 (4), 2237 (2014).
- Murray, C. D. The physiological principle of minimal work. I. The vascular system and the cost of blood volume. Proc. Natl. Acad. Sci. 12, 207-214 (1926).
- Cheung, C., Chen, C., Wong, T. Ocular Fundus Photography as a Tool to Study Stroke and Dementia. Semin. Neurol. 35 (5), 481-490 (2015).
- Williams, M. A., et al. Retinal microvascular network attenuation in Alzheimer's disease. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 1 (2), 229-235 (2015).
- Cheung, C. Y., et al. Retinal Vascular Fractal Dimension Is Associated with Cognitive Dysfunction. J. Stroke Cerebrovasc. Dis. 23 (1), 43-50 (2014).
- Hammes, H. P., et al. Diabetic retinopathy: targeting vasoregression. Diabetes. 60 (1), 9-16 (2011).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- Frame, M. D., Sarelius, I. H. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc Res. 46 (2), 190-205 (1993).
- Djonov, V., Baum, O., Burri, P. H. Vascular remodeling by intussusceptive angiogenesis. Cell Tissue Res. 314 (1), 107-117 (2003).
- Griffith, T. M., Edwards, D. H. Basal EDRF activity helps to keep the geometrical configuration of arterial bifurcations close to the Murray optimum. J. Theor. Biol. 146 (4), 545-573 (1990).
- Griffith, T. M., Edwards, D. H., Randall, M. D. Blood flow and optimal vascular topography: role of the endothelium. Basic Res. Cardiol. 86 Suppl 2, 89-96 (1991).
- Chapman, N., Haimes, G., Stanton, A. V., Thom, S. A. M., Hughes, A. D. Acute effects of oxygen and carbon dioxide on retinal vascular network geometry in hypertensive and normotensive subjects. Clin. Sci. 99 (6), 483-488 (2000).
- Heringa, S. M., Bouvy, W. H., van denBerg, E., Moll, A. C., Jaap Kappelle, L., Jan Biessels, G. Associations between retinal microvascular changes and dementia, cognitive functioning, and brain imaging abnormalities: a systematic review. J. Cereb. blood flow Metab. 33 (7), 983-995 (2013).
- Ding, J., et al. Diabetic retinopathy and cognitive decline in older people with type 2 diabetes: The Edinburgh type 2 diabetes study. Diabetes. 59 (11), 2883-2889 (2010).
- Parisi, V., Restuccia, R., Fattapposta, F., Mina, C., Bucci, M. G., Pierelli, F. Morphological and functional retinal impairment in Alzheimer's disease patients. Clin. Neurophysiol. 112 (10), 1860-1867 (2001).
- Paquet, C., Boissonnot, M., Roger, F., Dighiero, P., Gil, R., Hugon, J. Abnormal retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Neurosci. Lett. 420 (2), 97-99 (2007).
- Moschos, M. M., et al. Structural and functional impairment of the retina and optic nerve in Alzheimer's disease. Curr. Alzheimer Res. 9 (7), 782-788 (2012).
- Lu, Y., et al. Retinal nerve fiber layer structure abnormalities in early Alzheimer's disease: Evidence in optical coherence tomography. Neurosci. Lett. 480 (1), 69-72 (2010).
- Kesler, A., Vakhapova, V., Korczyn, A. D., Naftaliev, E., Neudorfer, M. Retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Clin. Neurol. Neurosurg. 113 (7), 523-526 (2011).
- Ascaso, F. J., et al. Retinal alterations in mild cognitive impairment and Alzheimer's disease: An optical coherence tomography study. J. Neurol. 261 (8), 1522-1530 (2014).
- Berisha, F., Feke, G. T., Trempe, C. L., McMeel, J. W., Schepens, C. L. Retinal abnormalities in early Alzheimer's disease. Investig. Ophthalmol. Vis. Sci. 48 (5), 2285-2289 (2007).
- Iseri, P. K., Altinaş, O., Tokay, T., Yüksel, N. Relationship between Cognitive Impairment and Retinal Morphological and Visual Functional Abnormalities in Alzheimer Disease. J. Neuro-Ophthalmology. 26 (1), 18-24 (2006).
- Garcia-Martin, E. S., et al. Macular thickness as a potential biomarker of mild Alzheimer's disease. Ophthalmology. 121 (5), 1149-1151 (2014).
- Ko, F., et al. Retinal Nerve Fiber Layer Thinning Associated With Poor Cognitive Function Among A Large Cohort, The Uk Biobank. Alzheimer's Dement. 12 (7), P317-P318 (2016).
- Moreno-Ramos, T., Benito-Leon, J., Villarejo, A., Bermejo-Pareja, F. Retinal nerve fiber layer thinning in dementia associated with Parkinson's disease, dementia with Lewy bodies, and Alzheimer's disease. J. Alzheimers. Dis. 34 (3), 659-664 (2013).
- Moschos, M. M., et al. Morphologic changes and functional retinal impairment in patients with Parkinson disease without visual loss. Eur. J. Ophthalmol. 21 (1), 24-29 (2011).
- Garcia-Martin, E., et al. Ability and reproducibility of Fourier-domain optical coherence tomography to detect retinal nerve fiber layer atrophy in Parkinson's disease. Ophthalmology. 119 (10), 2161-2167 (2012).
- Yip, W., et al. Comparison of Common Retinal Vessel Caliber Measurement Software and a Conversion Algorithm. Transl. Vis. Sci. Technol. 5 (5), 11 (2016).
- Gorelick, P. B., et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association. Stroke. 42 (9), 2672-2713 (2011).
- Brown, W. R., Thore, C. R. Review: Cerebral microvascular pathology in ageing and neurodegeneration. Neuropathol. Appl. Neurobiol. 37 (1), 56-74 (2011).
- DeSilva, T. M., Faraci, F. M. Microvascular Dysfunction and Cognitive Impairment. Cell. Mol. Neurobiol. 36 (2), 241-258 (2016).
- Kalaria, R. N., Akinyemi, R., Ihara, M. Does vascular pathology contribute to Alzheimer changes?. J. Neurol. Sci. 322 (1-2), 141-147 (2012).
- Kling, M. A., Trojanowski, J. Q., Wolk, D. A., Lee, V. M. Y., Arnold, S. E. Vascular disease and dementias: paradigm shifts to drive research in new directions. Alzheimers. Dement. 9 (1), 76-92 (2013).
- O'Brien, J. T., et al. Vascular cognitive impairment. Lancet Neurol. 2 (2), 89-98 (2003).
- Chen, C., et al. Alzheimer's disease with cerebrovascular disease: current status in the Asia-Pacific region. J. Intern. Med. 280 (4), 359-374 (2016).
- Pérez, M. A., Bruce, B. B., Newman, N. J., Biousse, V. The use of retinal photography in nonophthalmic settings and its potential for neurology. Neurologist. 18 (6), 350-355 (2012).
- Boppart, S. A. Optical coherence tomography: Technology and applications for neuroimaging. Psychophysiology. 40 (4), 529-541 (2003).
- Hee, M. R., et al. Optical coherence tomography of the human retina. Arch. Ophthalmol. 113 (3), 325-332 (1995).
- Huang, D., et al. Optical coherence tomography. Science (80-.). 254 (5035), 1178-1181 (1991).
- vanVelthoven, M. E. J., Verbraak, F. D., Yannuzzi, L., Rosen, R. B., Podoleanu, A. G. H., deSmet, M. D. Imaging the retina by en face optical coherence tomography. Retina. 26 (2), 129-136 (2006).
- Costa, R. A., et al. Retinal assessment using optical coherence tomography. Prog. Retin. Eye Res. 25 (3), 325-353 (2006).
- DeBuc, D. C., Somfai, G. M., Ranganathan, S., Tátrai, E., Ferencz, M., Puliafito, C. A. Reliability and reproducibility of macular segmentation using a custom-built optical coherence tomography retinal image analysis software. J. Biomed. Opt. 14 (6), 64023 (2009).
- Budenz, D. L., et al. Determinants of Normal Retinal Nerve Fiber Layer Thickness Measured by Stratus OCT. Ophthalmology. 114 (6), 1046-1052 (2007).
- Leung, C. K. S., et al. Retinal Nerve Fiber Layer Imaging with Spectral-Domain Optical Coherence Tomography: A Prospective Analysis of Age-Related Loss. Ophthalmology. 119 (4), 731-737 (2012).
- Cettomai, D., et al. Reproducibility of optical coherence tomography in multiple sclerosis. Arch. Neurol. 65 (9), 1218-1222 (2008).
- Garcia-Martin, E., Pinilla, I., Idoipe, M., Fuertes, I., Pueyo, V. Intra and interoperator reproducibility of retinal nerve fibre and macular thickness measurements using Cirrus Fourier-domain OCT. Acta Ophthalmol. 89 (1), (2011).
- Garcia-Martin, E., Pueyo, V., Pinilla, I., Ara, J. R., Martin, J., Fernandez, J. Fourier-domain OCT in multiple sclerosis patients: reproducibility and ability to detect retinal nerve fiber layer atrophy. Invest. Ophthalmol. Vis. Sci. 52 (7), 4124-4131 (2011).
- Menke, M. N., Knecht, P., Sturm, V., Dabov, S., Funk, J. Reproducibility of nerve fiber layer thickness measurements using 3D fourier-domain OCT. Invest. Ophthalmol. Vis. Sci. 49 (12), 5386-5391 (2008).
- Mwanza, J. C., et al. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Investig. Ophthalmol. Vis. Sci. 51 (11), 5724-5730 (2010).
- Syc, S. B., et al. Reproducibility of high-resolution optical coherence tomography in multiple sclerosis. Mult Scler. 16 (7), 829-839 (2010).
- Ikram, M. K., Cheung, C. Y., Wong, T. Y., Chen, C. P. L. H. Retinal pathology as biomarker for cognitive impairment and Alzheimer's disease. J. Neurol. Neurosurg. Psychiatry. 83 (9), 917-922 (2012).
- MacGillivray, T. J., Trucco, E., Cameron, J. R., Dhillon, B., Houston, J. G., vanBeek, E. J. R. Retinal imaging as a source of biomarkers for diagnosis, characterization and prognosis of chronic illness or long-term conditions. Br. J. Radiol. 87 (1040), 20130832 (2014).
- Patton, N., et al. Retinal image analysis: Concepts, applications and potential. Prog. Retin. Eye Res. 25 (1), 99-127 (2006).
- McGrory, S., et al. The application of retinal fundus camera imaging in dementia: A systematic review. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 6, 91-107 (2017).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Hardin, J. S., Taibbi, G., Nelson, S. C., Chao, D., Vizzeri, G. Factors Affecting Cirrus-HD OCT Optic Disc Scan Quality: A Review with Case Examples. J. Ophthalmol. 2015, 1-16 (2015).
- Kim, N. R., et al. Influence of Cataract on Time Domain and Spectral Domain Optical Coherence Tomography Retinal Nerve Fiber Layer Measurements. J. Glaucoma. 1, (2010).
- Li, H., et al. Lens opacity and refractive influences on the measurement of retinal vascular fractal dimension. Acta Ophthalmol. 88 (6), e234-e240 (2010).
- Maberley, D., Morris, A., Hay, D., Chang, A., Hall, L., Mandava, N. A comparison of digital retinal image quality among photographers with different levels of training using a non-mydriatic fundus camera. Ophthalmic Epidemiol. 11 (3), 191-197 (2004).
- Rochtchina, E., Wang, J. J., Taylor, B., Wong, T. Y., Mitchell, P. Ethnic variability in retinal vessel caliber: A potential source of measurement error from ocular pigmentation?-The Sydney childhood eye study. Investig. Ophthalmol. Vis. Sci. 49 (4), 1362-1366 (2008).
- Wainwright, A., et al. Effect of image quality, color, and format on the measurement of retinal vascular fractal dimension. Investig. Ophthalmol. Vis. Sci. 51 (11), 5525-5529 (2010).
- Nguyen, T. T., Wong, T. Y. Retinal vascular manifestations of metabolic disorders. Trends Endocrinol. Metab. 17 (7), 262-268 (2006).
- Ding, J., et al. Retinal vascular caliber and the development of hypertension: a meta-analysis of individual participant data. J. Hypertens. 32 (2), 207-215 (2014).
- Nguyen, T. T., Wong, T. Y. Retinal vascular changes and diabetic retinopathy. Curr. Diab. Rep. 9 (4), 277-283 (2009).
- Leung, C. K. S., Ye, C., Weinreb, R. N., Yu, M., Lai, G., Lam, D. S. Impact of Age-related Change of Retinal Nerve Fiber Layer and Macular Thicknesses on Evaluation of Glaucoma Progression. Ophthalmology. 120 (12), 2485-2492 (2013).
- Sherry, L. M., et al. Reliability of computer-assisted retinal vessel measurement in a population. Clin. Experiment. Ophthalmol. 30 (3), 179-182 (2002).
- Wardlaw, J. M., et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 12 (8), 822-838 (2013).
- Patton, N., Aslam, T., MacGillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: A rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- Ferri, C. P., et al. Global prevalence of dementia: A Delphi consensus study. Lancet. 366 (9503), 2112-2117 (2005).
- Sahadevan, S., et al. Ethnic differences in Singapore's dementia prevalence: The stroke, Parkinson's disease, epilepsy, and dementia in Singapore study. J. Am. Geriatr. Soc. 56 (11), 2061-2068 (2008).
- Kernt, M., et al. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy (Optomap) compared with ETDRS 7-field stereo photography. Diabetes Care. 35 (12), 2459-2463 (2012).
- Manivannan, A., Plskova, J., Farrow, A., Mckay, S., Sharp, P. F., Forrester, J. V. Ultra-wide-field fluorescein angiography of the ocular fundus. Am. J. Ophthalmol. 140 (3), 525-527 (2005).
- Pellegrini, E., et al. Blood vessel segmentation and width estimation in ultra-wide field scanning laser ophthalmoscopy. Biomed. Opt. Express. 5 (12), 4329 (2014).
- Estrada, R., Tomasi, C., Schmidler, S. C., Farsiu, S. Tree topology estimation. IEEE Trans. Pattern Anal. Mach. Intell. 37 (8), 1688-1701 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten