É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Utilizando imagens da retina para estudar a demência
Neste Artigo
Resumo
A retina partes proeminentes semelhanças com o cérebro e, portanto, representa uma janela única para estudar vasculatura e estrutura neuronal no cérebro de forma não-invasiva. Este protocolo descreve um método para estudar a demência usando técnicas de imagem da retina. Esse método potencialmente pode ajudar no diagnóstico e avaliação de riscos de demência.
Resumo
A retina oferece uma única "janela" para estudar processos fisiopatológicos da demência no cérebro, pois é uma extensão do sistema nervoso central (SNC) e partes proeminentes semelhanças com o cérebro em termos de origem embriológica, características anatômicas e Propriedades fisiológicas. Estrutura vascular e neuronal na retina pode agora ser retina visualizada facilmente e de forma não-invasiva usando técnicas de imagem, incluindo a fotografia de fundo e tomografia de coerência óptica (OCT) e quantificado usando semi-automática programas de análise assistida por computador. Estudando as associações entre alterações vasculares e neuronais na retina e demência poderia melhorar a nossa compreensão da demência e, potencialmente, ajudar no diagnóstico e avaliação de riscos. Este protocolo visa descrever um método de quantificar e analisar a vasculatura da retina e estrutura neuronal, que são potencialmente associados com demência. Este protocolo também fornece exemplos de alterações da retina em indivíduos com demência e discute questões técnicas e limitações atuais da imagem na retina.
Introdução
Devido ao aumento da expectativa de vida, demência tornou-se um problema médico principal, contribuindo para o social significativo e saúde econômica globalmente sobrecarregar-1,2,3,4,5. Hoje, uma pessoa nos Estados Unidos desenvolve a doença de Alzheimer (AD), a forma mais comum de demência, cada 66 s6. Estima-se que até ao ano 2050, 115 milhões de pessoas serão afetadas pelo AD7.
A retina oferece uma exclusiva "janela" para estudar a demência devido a suas propriedades anatômicas e fisiológicas semelhantes com o cérebro. Em termos de vascularização, a retina arteríolas e vênulas, medindo 100 a 300 µm de diâmetro, compartilham características semelhantes, com pequenos vasos cerebrais, tais como arteríolas fim sem anastomoses, função de barreira e autoregulação8, 9. em termos de estrutura neuronal, células da retina ganglionar (RGCs) compartilham Propriedades típicas com neurônios no sistema nervoso central (SNC) 10. As RGCs proeminente são conectadas com o cérebro como eles formam os nervo óptico e projeto sinais visuais da retina para os núcleos geniculados laterais e o colículo superior. O nervo óptico, semelhante a muitas fibras neuronais no SNC, é mielinizado por oligodendrócitos e é ensheathed em camadas na meninge. Nomeadamente, um insulto para o nervo óptico pode resultar em respostas semelhantes observadas em outros axônios do CNS, tais como retrógrada e anterógrada degeneração do axônio, formação de cicatriz, destruição de mielina, degeneração secundária e um nível anormal de neurotrophic fatores e neurotransmissores11,12,13,14. O aparecimento de sintomas visuais em alguns pacientes AD também pode ser explicado pelas associações robustas entre a retina e o cérebro de15,16. Como resultado, tem sido sugerido que a retina pode refletir os processos patológicos da demência no cérebro e imagem retinal pode ser usada para estudar a demência.
A vasculatura da retina e estrutura neuronal agora podem ser visualizadas não invasiva, usando técnicas de imagem da retina. Por exemplo, fotografias da retina do fundo podem ser capturadas usando câmeras do fundo e características da vasculatura da retina (por exemplo, navio calibre, tortuosidade e fractal dimensão) podem então ser quantificadas usando análise assistida por computador programas. Além disso, os parâmetros da estrutura da retina neuronal (tais como a espessura da camada plexiforme de gânglio célula-interna [GC-IPL] e camada retinal da fibra do nervo [RNFL]) também podem ser medidos usando a tomografia de coerência óptica (OCT) e quantificados usando o built-in algoritmos de análise.
Tendo em conta a importância da imagem na retina para estudar a demência, o presente protocolo visa descrever um método de imagem e analisando a vasculatura da retina e estrutura neuronal na vivo usando técnicas de imagem da retina. Este protocolo também fornece exemplos de alterações da retina em indivíduos com demência e discute questões técnicas e limitações atuais da imagem na retina.
Protocolo
todos os métodos descritos aqui foram aprovados por um Comitê de ética de pesquisa clínica local em Hong Kong.
Nota: para manter a simplicidade, o equipamento listado na Tabela de materiais é usado para ilustrar os procedimentos de imagem da retina e posterior análise. Medição de parâmetros vasculares da retina é ilustrada usando a Singapura I navio avaliação programa (Shiva) 17 (versão 4.0, Nacional Universidade de Singapura, Singapura). No entanto, deve notar-se que um conjunto diferente de equipamentos pode ser adoptado como os princípios subjacentes permanecem similares.
1. preparar os sujeitos para Retinal Imaging
- dilatar os assuntos ’ alunos usando um agente midriático. Aguarde pelo menos 15 minutos para estabelecer a dilatação suficiente.
2. Medir parâmetros vasculares de retina do Fundus fotografias usando um programa de análise assistida por computador
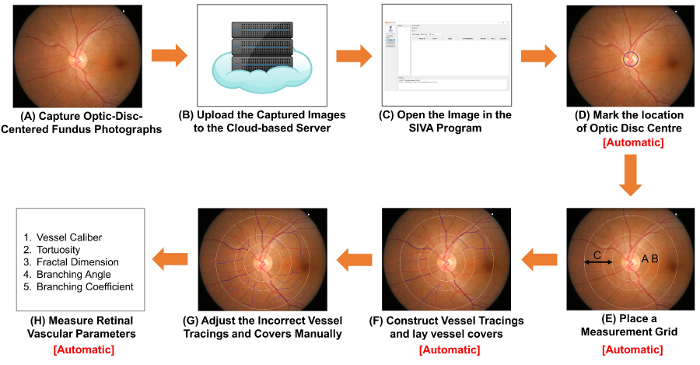
Figura 1: Diagrama esquemático mostrando os procedimentos de medição de parâmetros vasculares da retina. (A) obter fotografias de óptica-disco-centrada do fundo usando uma câmera de fundus. figura 1A e 2A figura são duas fotografias do fundo com ótima qualidade. (B) enviar as fotografias do fundo para o servidor baseado em nuvem e digite as informações relevantes do estudo, incluindo o fator de conversão de imagem (ICF). Outros programas de análise assistida por computador podem usar métodos não baseados em nuvem para organizar e armazenar as imagens. (C) abrir a foto de fundo no programa de análise assistida por computador. Mark (D) a localização do centro do disco óptico e (E) solicitar o software automaticamente detectar a borda do disco óptico e coloque uma grade de medição. (F) construção traçados de navio baseiam os caminhos de navio e colocar o vaso cobre para estimar o diâmetro dos vasos. (G) ajustar os traçados incorreta do navio e embarcação abrange manualmente. (H) medida um espectro de parâmetros vasculares da retina, incluindo calibres de navio, tortuosidade, dimensão fractal e bifurcação. (D) de passo a passo (F) e passo (H) pode ser executado automaticamente por alguns programas de análise assistida por computador. clique aqui para ver uma versão maior desta figura.
- Capturar fotografias de fundo usando uma câmera de fundus.
Programa de
- vez na câmera de fundus e lançamento da captura de imagem no computador. Descanse o queixo do assunto corretamente sobre o chinrest com a testa contra a cinta de cabeça. Mova a alavanca de controle para alinhar o feixe de luz corretamente ao assunto ’ aluno de s.
- Alinhar os pontos de iluminação, até que ambos aparecem menores em ambos os lados no visor. Mova o alvo de fixação externa para guiar o assunto ’ s olhos até o disco óptico está no centro do visor e as regiões de interesse (ROI) são bem dentro dos limites. Ajuste o botão de focalização para focar na retina.
- Com o assunto firmemente, olhar para o alvo de fixação externa e garantir o assunto ’ s olhos não estão cheios de lágrimas.
- Aperte o botão de disparo do obturador para capturar uma imagem ( figura 1A).
- Verificar a qualidade da fotografia do fundo capturada, usando a Figura 2A como um padrão. Descartar a imagem e repita o processo de aquisição de imagem (ou seja, passo 2.1.1 a 2.1.4) se o aluno está mal dilatada ( Figura 2B), o disco óptico não é no centro da imagem ( Figura 2), ou o imagem está fora de foco ( Figura 2D).
- Salvar a imagem em formato TIFF com resolução graduáveis (ou seja, aproximadamente pixels de 3.000 pixels de x 2,000, em mais de 150 dpi).
Nota: O protocolo pode ser pausado aqui. - Passos repetidos 2.1.1 a 2.1.6 para adquirir fotografias do fundo para outras disciplinas.
- Selecione uma amostra de 10% de imagens aleatoriamente e medir a altura dos discos ópticos nestas imagens ( Figura 3). Calcular o fator de conversão de imagem (ICF) usando a fórmula:
ICF = 1.800 µm / (média altura de pixel de discos ópticos das imagens incluídas na amostra). - Carregar as fotografias capturadas do fundo para o servidor baseado em nuvem e digite as informações relevantes do estudo, incluindo o fator de conversão de imagem (ICF) ( figura 1B).
Nota: O protocolo pode ser pausado aqui. Outros programas de análise computadorizada podem utilizar outros métodos não baseados em nuvem para organizar as imagens e gravar o ICF.
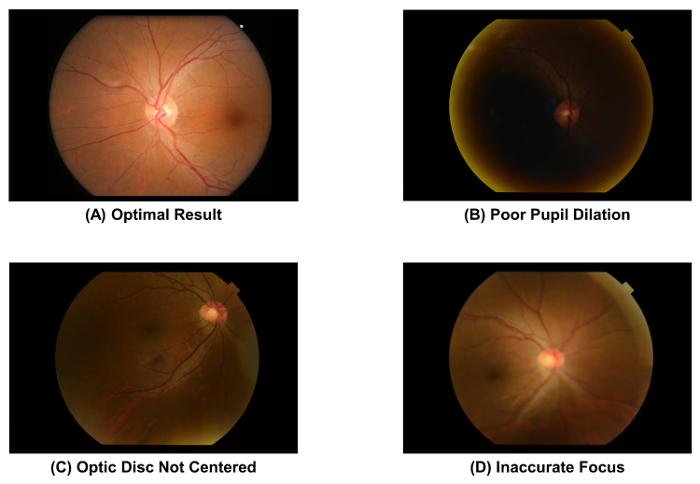
Figura 2: fotografias de fundo com qualidade óptima e suboptimal. A qualidade da imagem de uma fotografia do fundo deve ser verificada imediatamente após a aquisição de imagens, como a qualidade de imagem afeta diretamente a subsequente medição de parâmetros vasculares da retina. A imagem deve ser descartada se um desses artefatos é observado. Estas imagens foram capturadas usando uma câmera de fundus de 50°. clique aqui para ver uma versão maior desta figura.
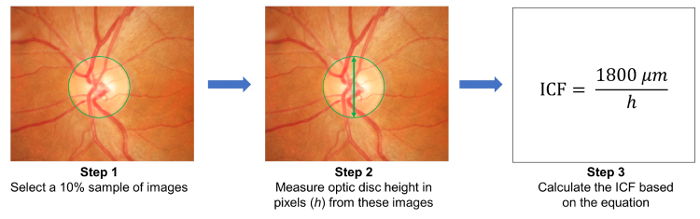
Figura 3: cálculo do factor de conversão de imagem (ICF). Para calcular o ICF, selecione aleatoriamente uma amostra de 10% das imagens do estudo (etapa 1). Em seguida, meça a altura de discos ópticos (em pixels) das imagens incluídas na amostra (etapa 2). Calcular o ICF usando a fórmula: ICF = 1800 µm / (média altura de pixel de discos ópticos das imagens incluídas na amostra), onde 1800 µm é aproximadamente a altura de um disco óptico normal (etapa 3). Como resolução de imagem e efeito de ampliação diferentes de câmera para câmera, é preciso calcular um ICF preciso para cada câmera usada. clique aqui para ver uma versão maior desta figura.
- abre a fotografia do fundo em um programa de análise assistida por computador. Construir traçados de vaso e colocar as tampas de navio para a vasculatura da retina.
Nota: Nesta seção, o programa de Shiva é usado para ilustrar os procedimentos. No entanto, o programa de Shiva pode ser substituído por outros programas de análise assistida por computador disponível. Além disso, passos 2.2.2 para 2.2.3 são executados automaticamente por alguma análise assistida por computador programas quando uma fotografia do fundo é aberto (ou seja, passo 2.2.1).- Abrir a fotografia do fundo com o programa de análise computadorizada ( Figura 1).
- Marca o local do centro do disco óptico ( Figura 1).
- Clique o “ OD centro ” botão no painel esquerdo função; o cursor do mouse será substituído por um círculo verde.
- Mover o círculo verde para o centro do disco óptico (OD) e clique esquerdo para corrigir o círculo.
- Solicitar o software automaticamente colocar uma grade de medição, construir la e traçados de navioy vaso de cobre ( Figura 1E e 1F).
Nota: Tampas de vaso são linhas de medição que estimam a largura aproximada dos lúmens internas dos vasos.- Clique o “ encontrar OD ” botão para solicitar o software para detectar a borda do OD e coloque quatro círculos concêntricos como uma grade de medição, com base na posição do centro de OD.
- Clique a “ processo de ” o botão para iniciar o processo de rastreamento automático navio.
- Traçados de navio incorreta de ajustar manualmente. Começar a inspeção de 12 o ’ relógio posição de forma no sentido horário para garantir que todos os traçados de navio são verificados.
- Verifique se o disco óptico é detectado com precisão e a grade de medição está correctamente colocada. Ajuste da grade de medição manualmente seguindo passos 2.2.2 para 2.2.3, se o círculo mais interno com precisão não prevê a borda do disco óptico ( Figura 4A).
- à esquerda, clique para selecionar tracing(s) navio rotulados com o tipo de embarcação incorreto (arteríolas e vênulas) e clicar a “ tipo de embarcação (T) ” botão para alterar o tipo de embarcação.
Nota: Arteríolas são marcadas em vermelho e vênulas são marcadas em azul. Arteríolas podem ser distinguidas vênulas com base em suas diferenças fisiológicas. Por exemplo, vênulas são geralmente de cor mais escura e mais larga que as arteríolas. Navios com o mesmo tipo de embarcação normalmente não se cruzam. - Traçados de navio incompleta estender as seguintes etapas 2.3.3.1 para 2.3.3.2 ( Figura 4B).
- Use o cursor para clicar na extremidade distal do que o rastreamento de navio incompleta. Clique com o botão esquerdo em pontos ao longo do trajeto de navio para estender o rastreamento de embarcação.
- Parar o processo de rastreamento quando a extremidade distal do navio é atingida. Parar o rastreamento no círculo branco ultraperiférica se a parte distal do vaso cair fora da grade de medição (ver Figura 4B).
- Ajustar traçados do navio se os caminhos do navio não são rastreados corretamente no local do cruzamento ( Figura 4).
- Clique o “ selecione ” botão e, em seguida, clique no ponto incorreto do que o rastreamento de navio. Clique no “ Brea(k) Seg ” botão para desconectar o rastreamento de navio no ponto selecionado. Selecione o segmento desconectado e clique o “ (Del) Seg ” botão para apagá-la
- Re-construir um novo rastreamento de navio usando etapas 2.3.3.1 e 2.3.3.2.
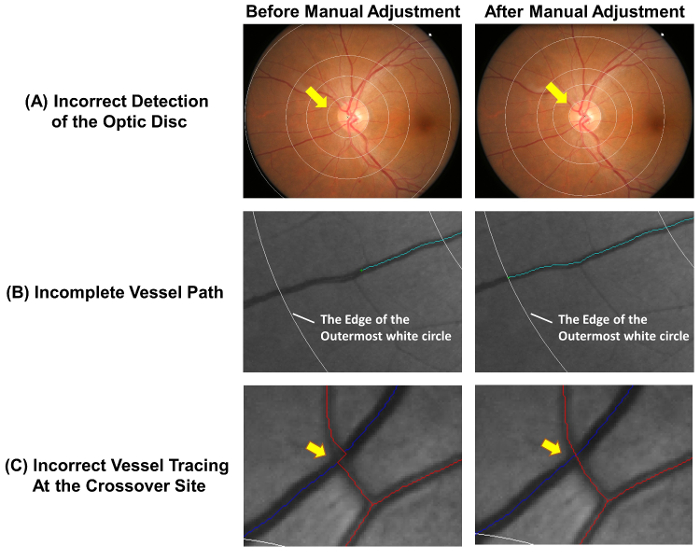
Figura 4: erros comuns do que o autorastreamento. O rastreamento automático de navio não é completamente preciso e ajustes manuais são necessários para assegurar a precisão da medição. Esta figura mostra erros comuns do que o autorastreamento e demonstra resultados óptimos após ajustes manuais. (A), o centro do disco óptico é marcado incorretamente e estes levam a desvio da grade de medição, que pode afetar as medições posteriores. Idealmente, o círculo mais interno da grade de medição deve delinear a borda do disco óptico. Rastreamento de navio incompleta (B) poderia levar à medição incorreta de dimensão fractal, tortuosidade, etc, que o caminho do navio deve ser rastreado até o final do navio. Se a parte distal do vaso cair fora da grade de medição, o rastreamento pode ser interrompido no círculo mais externo branco. (C) vaso traçados dos locais de cruzamento estão sujeitos a uma maior tendência de erro e, portanto, requerem uma atenção especial. clique aqui para ver uma versão maior desta figura.
- colocar tampas de navio em todos os segmentos de navio e desactivar as tampas incorretas manualmente.
- Clique o “ encontrar cobre ” botão pôr capas de navio em todos os segmentos de navio automaticamente.
- Verificar se todas as coberturas do navio estão colocadas correctamente. Botão esquerdo do mouse e arraste o cursor para desactivar o navio cobre se as tampas não são colocadas perpendicular às paredes do vaso ( Figura 5A), o caminho do navio é obscurecido por um outro navio ( Figura 5B), ou o tampas de superestimar ou subestimar a largura do lúmen do vaso ( Figura 5).
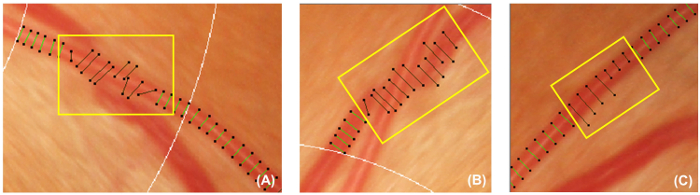
Figura 5: navio incorreto cobre. Esta figura mostra exemplos de capas de vaso incorreta que devem ser desativados e excluídos da medição subsequente. Tampas de vaso devem ser desactivadas, se não forem perpendiculares a navios (A). Além disso, as tampas de vaso também devem ser desativadas se o navio sendo rastreado é obscurecido sob outro navio (B), ou as tampas do vaso não podem representar a largura aproximada do navio (C). clique aqui para ver uma versão maior desta figura.
- medir parâmetros vasculares da retina de traçados o vaso e as tampas de vaso
Nota: etapa 2.5 é realizado automaticamente por um programa de análise assistida por computador. Diâmetros de- rótulo do disco área 0.5-1.0 longe da margem do disco óptico como zona B, a área de 0.5-2.0 disco diâmetros e longe da margem do disco óptico como zona C 18 ( figura 6A), de acordo com o protocolo modificado de risco de aterosclerose em comunidades (ARIC) estudar 19.
- Calibre vascular da retina de medida da zona B e zona C, usando um método amplamente adotada que é modificado a partir da ARIC estuda 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 ( Figura 6B).
- Medir os comprimentos das tampas de vaso em seis maiores arteríolas e as vênulas maiores seis para estimar calibres de vasos da retina.
- Resumir o retinal arteriolar e venular calibres como artéria da retina central equivalente (CRAE) e retina central veia equivalente (CRVE) respectivamente 17, usando a revista Knudtson – fórmula Parr-Hubbard 18 , 19.
- identificar todos os navios na zona C, com uma largura > 40 µm. calcular a tortuosidade arteriolar e venular da retina de integral da curvatura total ao quadrado ao longo de traçados navio e normalizar o valor com o comprimento de arco total, curvando-se e pontos de inflexão 27 , 28.
- Calcular o total, arteriolar, e venular fractal dimensões da zona C, usando o estabelecido “ método de contagem de caixa ” 29 , 30 , 31.
- Dividir a imagem em uma série de quadrados de igual tamanhos.
- Contar o número de caixas que contém uma seção de traçados navio.
- Repetir o processo usando uma série de quadrados de igual tamanhos com diferentes tamanhos.
- Sinopse o logaritmo do número de caixas contendo os traçados do navio contra o logaritmo do tamanho das caixas e calcular o declive da linha resultante; esta é a dimensão fractal.
- Identificar vasos com primeira bifurcação na zona C e calcular os ângulos (θ) abertura entre a primeira filha de dois navios 32 ( Figura 6). Calcular o valor médio para obter o ângulo de ramificação médio.
- Calcular o coeficiente de ramificação da zona C, usando a fórmula:
(d 1 2 + d 2 2) /d 0 2, onde d 0 é o calibre do tronco médio, e d 1 e d 2 são os calibres de ramificação média ( Figura 6).
- Fechar a janela de classificação. Clique “ enviar ” na caixa de diálogo pop-up para carregar a imagem classificada para o servidor baseado em nuvem e registrar os parâmetros vasculares da retina automaticamente medidos.
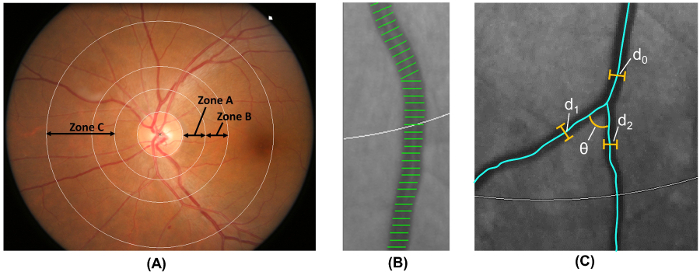
Figura 6: quantificação da vasculatura retiniana. (A) zona B (definido como 0.5-1.0 disc diâmetros longe da margem do disco) é usado para medir calibres de navio da zona B, de acordo com o risco de aterosclerose em comunidades de estudo. Zona C (definido como 0.5-2.0 disco diâmetros longe da margem do disco) é usado para medir a embarcação calibres da zona C e um espectro de parâmetros de rede vascular da retina (como tortuosidade, dimensão fractal e bifurcação). (B) as tampas do vaso são linhas de medição utilizadas para estimar os calibres de vasos da retina (ou diâmetros). Tampas de vaso incorreta devem ser manualmente excluídas da medição. (C) para todos os navios que têm a sua primeira bifurcação dentro zona C, o programa automaticamente mede os ângulos de ramificação (θ) da primeira bifurcação. Além disso, o coeficiente de ramificação também é calculado usando a fórmula: coeficiente de ramificação = (d 1 2 + d 2 2) /d 0 2, onde d 0 é o calibre do tronco e d 1 e d 2 são os calibres de ramo. clique aqui para ver uma versão maior desta figura.
3. avaliar a espessura do GC-IPL e RNFL
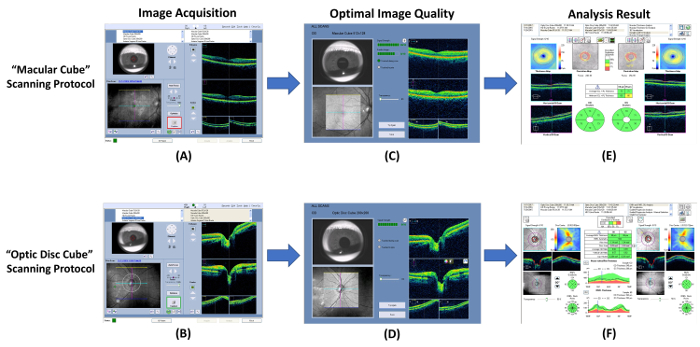
Figura 7: diagrama esquemático mostrando os procedimentos de medição de espessura RNFL e GC-IPL. Tomografia de coerência óptica (OCT) pode ser usada para medir a espessura da camada plexiforme de gânglio célula-interior (GC-IPL) e camada de fibras de nervo da retina (RNFL). (A, B) Medir as espessuras GC-IPL e RNFL usando o built-in “ macular cubo ” e “ cubo disco óptico ” digitalização protocolos respectivamente. (C, D) Verifica a qualidade da imagem imediatamente após a aquisição da imagem. Descartar a imagem e repita o exame se a força do sinal é menor que 6, ou artefatos de movimento são detectados. (E, F) Em seguida, solicitar o programa de análise de built-in automaticamente analisar o resultado do exame e gerar um relatório para interpretação. clique aqui para ver uma versão maior desta figura.
- Realizar a aquisição de imagens usando a tomografia de coerência óptica (OCT).
- Abrir o programa da OCT e selecione o “ Macular cubo ” digitalização protocolo para iniciar um novo scan macular ( Figura 7A).
- Localizar o aluno na viewport íris ajustando o chinrest. Diminuir a iluminação, se o tamanho da pupila é muito pequeno.
- Clique o “ Auto foco ” botão e depois o “ otimizar ” botão para melhorar a qualidade de imagem.
- Instruir o sujeito a piscar algumas vezes imediatamente antes de iniciar a varredura.
- Clique o “ captura ” botão para iniciar a verificação, quando a borda ao redor do botão torna-se verde. Instruir o assunto para focar o alvo de fixação visual durante a aquisição de imagem para evitar artefatos de movimento.
- Rever a qualidade da digitalização usando 7 figura como um padrão. Descartar o resultado do exame e repita a verificação se a força do sinal é menor que 6 ( Figura 8A) ou artefatos de movimento são detectados (indicado pela descontinuidade dos vasos sanguíneos) ( Figura 8B).
- Salvar o resultado do exame.
- Repita etapas 3.1.1 a 3.1.7 para o outro olho.
- Executar uma verificação de cabeça do nervo óptico com o “ cubo de disco óptica ” varredura seguinte protocolo passos 3.1.2 a 3.1.9 ( figuras 7B e 7D).

Figura 8: sub-ótimo resultados da tomografia de coerência óptica. Resultados abaixo do ideal comuns da tomografia de coerência óptica (OCT) incluem (A) sinal fraco (valor de força < 6) e (B) artefatos de movimento. A qualidade da digitalização deve ser revista imediatamente após a aquisição da imagem, e o exame deve ser repetido se esses artefatos são encontrados. clique aqui para ver uma versão maior desta figura.
- gerar uma impressão de análise da espessura macular GC-IPL.
- Selecione a “ Macular cubo ” digitalizar registros de ambos os olhos na interface de análise.
- Clique a “ análise de UO de células ganglionares ” para iniciar o algoritmo de análise automática para avaliar a espessura de GC-IPL da verificação ( Figura 7E).
Nota: Passo 3.2.2 automaticamente é completado pelo algoritmo de análise.- Gerar um 14,13 mm 2 centrada na fóvea elíptico anel que tem raios horizontais de interiores e exteriores de 0,6 mm e 2,4 mm, respectivamente e verticais raios internos e externas de 0.5 mm e 2,0 mm, respectivamente.
Nota: O tamanho e forma do annulus elíptico conformam-se estreitamente a anatomia macular e, portanto, correspondem à área onde os RGCs são mais espessos em olhos normais 33 , 34. A área dentro do anel interno do annulus não é medida, como o GC-IPL nesta área é muito fino. - Segmentar o limite externo do RNFL e o limite externo da camada plexiforme interna (IPL) para localizar o GC-IPL ( Figura 9).
- Medir a média, mínimo e seis setoriais (superior, superotemporal, superonasal, inferonasal, inferior, inferotemporal) espessuras de GC-IPL macular dentro o fóvea-cenanel elíptico tered.
- Comparar as espessuras de GC-IPL medidas para o dispositivo ’ s interno normativo idade correspondente do banco de dados e gerar um mapa de desvio e um mapa de significado
- Relatar os resultados de medição em uma impressão de análise.
- Gerar um 14,13 mm 2 centrada na fóvea elíptico anel que tem raios horizontais de interiores e exteriores de 0,6 mm e 2,4 mm, respectivamente e verticais raios internos e externas de 0.5 mm e 2,0 mm, respectivamente.
- Salvar a impressão de análise no formato. pdf.
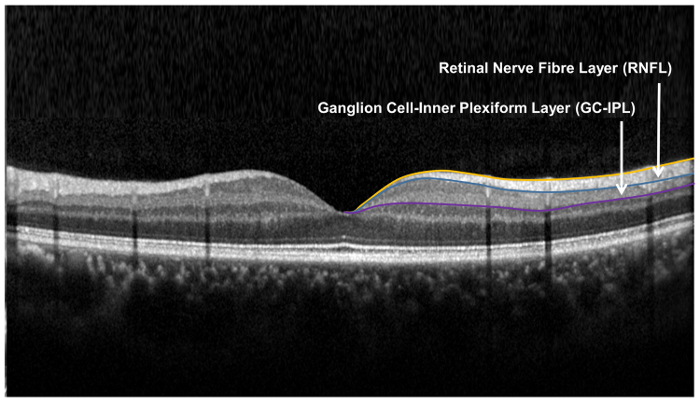
Figura 9: camadas da retina, utilizadas para o avaliação da estrutura da retina neuronal. A camada de fibras nervosas da retina (RNFL) é medida usando o algoritmo de nervo ótico (HNO) cabeça, enquanto a camada plexiforme de célula-interior do gânglio é medida usando o algoritmo de análise (GCA) de células ganglionares. O algoritmo de HNO segmentos fronteira interna e externa da RNFL para medir a espessura de RNFL. O algoritmo de GCA detecta o limite externo da camada retinal da fibra do nervo (RNFL) e a camada plexiforme interna (IPL) para produzir a espessura combinada da camada de células ganglionares (GCL) e o IPL. As espessuras de GCL e o IPL são medidas juntos, como a fronteira entre GCL e IPL é anatomicamente indistinta. No entanto, a espessura combinada do GCL e IPL (ou seja, GC-IPL) é ainda indicativa da saúde de RGCs. por favor clique aqui para ver uma versão maior deste Figura.
- gerar a impressão de análise da espessura RNFL ( Figura 7F).
- Selecione a “ cubo de disco óptica ” digitalizar registros de ambos os olhos na interface de análise.
- Clique o “ HNO e análise de UO RNFL ” para iniciar o algoritmo de análise automática para avaliar a espessura RNFL da varredura.
Nota: Etapas 3.3.2.1 para 3.3.2.6 podem ser concluídas automaticamente pelo algoritmo de análise.- Medir a espessura RNFL em cada ponto de verificação e gerar um mapa de espessura RNFL.
- Identifique o disco óptico, detectando uma mancha escura perto do centro da varredura que tem um tamanho e forma consistente com a escala de uma óptica desc...
- Posicionar uma grade de medição de 3,46 mm de diâmetro ao redor do disco óptico no mapa da espessura RNFL.
- Medida e calcular os globais, quatro-quadrantes (temporais, superiores, nasais e inferiores) e doze horas-relógio parapapillary RNFL espessuras da grade de medição.
- Comparar as espessuras RNFL medidas para o dispositivo ’ s interno normativo idade correspondente do banco de dados e gerar um mapa de desvio e um mapa de significância.
- Relatar os resultados de medição em uma impressão de análise.
- Salvar a impressão de análise no formato. pdf.
Resultados
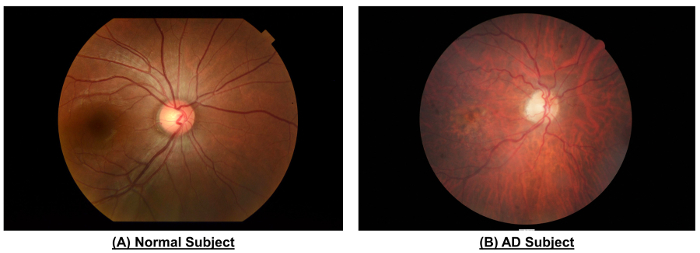
Figura 10: Um exemplo para mostrar as diferenças na vasculatura da retina entre um sujeito normal e um assunto AD. Quando comparado com o assunto normal, fotografia do fundo do sujeito AD mostrou mais estreitos calibres de navio (CRAE da zona B, 116.4 µm vs 156.4 µm; CRVE da zona B, 186.9 µm vs 207,5 µm; CRAE da zona C, 138.5 µm ...
Discussão
Este protocolo descreve os procedimentos de quantificar as alterações neuronais e vasculares no retina na vivo. Como a retina compartilha semelhante origem embriológica, características anatômicas e fisiológicas Propriedades com o cérebro, essas alterações na retina podem refletir alterações similares da vasculatura e estrutura neuronal no cérebro.
Como mostrado na Figura 10 e tabela 1, o assunto AD mostrou diminuição da emb...
Divulgações
Gostaríamos de expressar nossa gratidão para a escola de computação, Universidade Nacional de Cingapura para suporte técnico.
Agradecimentos
Sobre laços financeiros potenciais, o autor Tien Y. Wong é um co-inventor do programa Cingapura I navio avaliação (Shiva) usado neste artigo.
Materiais
| Name | Company | Catalog Number | Comments |
| Non-mydriatic Retinal Camera | Topcon, Inc, Tokyo, Japan | TRC 50DX | N/A |
| Singapore I Vessel Assessment Program | National University of Singapore | Version 4.0 | N/A |
| CIRRUS HD-OCT | Carl Zeiss Meditec, Inc, Dublin, CA | Model 4000 | N/A |
| Mydriatic Agents | N/A | N/A | Prepared from 1% tropicamide and 2.5% phenylephrine hydrochloride |
Referências
- Alzheimer's Disease International. The prevalence of dementia worldwide. Alzheimer's Dis. Int. (December), 1-2 (2008).
- Wimo, A., Winblad, B., &Jönsson, L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimer's Dement. 6 (2), 98-103 (2010).
- Comas-Herrera, A., Northey, S., Wittenberg, R., Knapp, M., Bhattacharyya, S., Burns, A. Future costs of dementia-related long-term care: exploring future scenarios. Int. Psychogeriatr. 23 (1), 20-30 (2011).
- Alzheimer's Association. Alzheimer's disease facts and figures. Alzheimer's Dement. 10 (2), e47-e92 (2014).
- Prince, M., Bryce, R., Albanese, E., Wimo, A., Ribeiro, W., Ferri, C. P. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers. Dement. 9 (1), 63-75 (2013).
- Alzheimer's Association. 2016 Alzheimer's disease facts and figures. Alzheimer's Dement. 12 (4), 459-509 (2016).
- Asih, P. R., Chatterjee, P., Verdile, G., Gupta, V. B., Trengove, R. D., Martins, R. N. Clearing the amyloid in Alzheimer's: progress towards earlier diagnosis and effective treatments - an update for clinicians. Neurodegener. Dis. Manag. 4 (5), 363-378 (2014).
- Cheung, C. Y., Ikram, M. K., Chen, C., Wong, T. Y. Imaging retina to study dementia and stroke. Prog. Retin. Eye Res. , (2017).
- Patton, N., Aslam, T., Macgillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: a rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nat. Rev. Neurol. 9 (1), 44-53 (2013).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Levkovitch-Verbin, H., Quigley, H. A., Kerrigan-Baumrind, L. A., D'Anna, S. A., Kerrigan, D., Pease, M. E. Optic nerve transection in monkeys may result in secondary degeneration of retinal ganglion cells. Investig. Ophthalmol. Vis. Sci. 42 (5), 975-982 (2001).
- Levkovitch-Verbin, H., Quigley, H. A., Martin, K. R., Zack, D. J., Pease, M. E., Valenta, D. F. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Sadun, A. A., Borchert, M., DeVita, E., Hinton, D. R., Bassi, C. J. Assessment of Visual Impairment in Patients With Alzheimer's Disease. Am. J. Ophthalmol. 104 (2), 113-120 (1987).
- Schlotterer, G., Moscovitch, M., Crapper-Mclachlan, D. Visual processing deficits as assessed by spatial frequency contrast sensitivity and backward masking in normal ageing and alzheimer's. Brain. 107 (1), 309-324 (1984).
- Cheung, C. Y. L., et al. A new method to measure peripheral retinal vascular caliber over an extended area. Microcirculation. 17 (7), 495-503 (2010).
- Knudtson, M. D., Lee, K. E., Hubbard, L. D., Wong, T. Y., Klein, R., Klein, B. E. K. Revised formulas for summarizing retinal vessel diameters. Curr. Eye Res. 27 (3), 143-149 (2003).
- Hubbard, L. D., et al. Methods for evaluation of retinal microvascular abnormalities associated with hypertension/sclerosis in the Atherosclerosis Risk in Communities Study. Ophthalmology. 106 (12), 2269-2280 (1999).
- Patton, N., et al. The association between retinal vascular network geometry and cognitive ability in an elderly population. Investig. Ophthalmol. Vis. Sci. 48 (5), 1995-2000 (2007).
- VanHecke, M. V., et al. Are retinal microvascular abnormalities associated with large artery endothelial dysfunction and intima-media thickness? The Hoorn Study. Clin. Sci. London Engl. 110 (5), 597-604 (2006).
- Tien, Y. W., et al. Retinal vascular caliber, cardiovascular risk factors, and inflammation: The Multi-Ethnic Study of Atherosclerosis (MESA). Investig. Ophthalmol. Vis. Sci. 47 (6), 2341-2350 (2006).
- Leung, H., et al. Relationships between age, blood pressure, and retinal vessel diameters in an older population. Investig. Ophthalmol. Vis. Sci. 44 (7), 2900-2904 (2003).
- Wong, T. Y., et al. The prevalence and risk factors of retinal microvascular abnormalities in older persons: The cardiovascular health study. Ophthalmology. 110 (4), 658-666 (2003).
- Ikram, M. K., et al. Retinal vessel diameters and risk of stroke: The Rotterdam Study. Neurology. 66 (9), 1339-1343 (2006).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: Methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Sasongko, M. B., et al. Alterations in retinal microvascular geometry in young type 1 diabetes. Diabetes Care. 33 (6), 1331-1336 (2010).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Mainster, M. a The fractal properties of retinal vessels: embryological and clinical implications. Eye. 4 ( Pt 1) (1), 235-241 (1990).
- Liew, G., et al. The Retinal Vasculature as a Fractal: Methodology, Reliability, and Relationship to Blood Pressure. Ophthalmology. 115 (11), (2008).
- Stosic, T., Stosic, B. D. Multifractal analysis of human retinal vessels. IEEE Trans. Med. Imaging. 25 (8), 1101-1107 (2006).
- Zamir, M., Medeiros, J. A., Cunningham, T. K. &. a. m. p. ;. M., Zamir, J. A., Medeiros, T. K. C. Arterial bifurcations in the human retina. J. Gen. Physiol. 74 (4), 537-548 (1979).
- Mwanza, J. C., Oakley, J. D., Budenz, D. L., Chang, R. T., Knight, O. J., Feuer, W. J. Macular ganglion cell-inner plexiform layer: Automated detection and thickness reproducibility with spectral domain-optical coherence tomography in glaucoma. Investig. Ophthalmol. Vis. Sci. 52 (11), 8323-8329 (2011).
- Bendschneider, D., et al. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J. Glaucoma. 19 (7), 475-482 (2010).
- Cheung, C. Y., Ong, Y. T., Ikram, M. K., Chen, C., Wong, T. Y. Retinal Microvasculature in Alzheimer's Disease. J. Alzheimer's Dis. 42 (s4), S339-S352 (2014).
- Murray, C. D. THE PHYSIOLOGICAL PRINCIPLE OF MINIMUM WORK APPLIED TO THE ANGLE OF BRANCHING OF ARTERIES. J. Gen. Physiol. (4), 835-841 (1926).
- Ding, J., et al. Early retinal arteriolar changes and peripheral neuropathy in diabetes. Diabetes Care. 35 (5), 1098-1104 (2012).
- Yim, C., et al. Retinal Ganglion Cell Analysis Using High-Definition Optical Coherence Tomography in Patients with Mild Cognitive Impairment and Alzheimer's Disease. J. Alzheimer's Dis. Retin. Ganglion Cell Anal. MCI AD. 45 (1), 45-56 (2015).
- Stein, D. M., Wollstein, G., Ishikawa, H., Hertzmark, E., Noecker, R. J., Schuman, J. S. Effect of Corneal Drying on Optical Coherence Tomography. Ophthalmology. 113 (6), 985-991 (2006).
- Mwanza, J. C., et al. Effect of Cataract and its Removal on Signal Strength and Peripapillary Retinal Nerve Fiber Layer Optical Coherence Tomography Measurements. J. Glaucoma. 20 (1), 37-43 (2011).
- Garcia-Martin, E., et al. Influence of cataract surgery on optical coherence tomography and neurophysiology measurements in patients with retinitis pigmentosa. Am. J. Ophthalmol. 156 (2), (2013).
- Kok, P. H. B., et al. The relationship between the optical density of cataract and its influence on retinal nerve fibre layer thickness measured with spectral domain optical coherence tomography. Acta Ophthalmol. , (2012).
- Kim, N. R., et al. Influence of cataract on time domain and spectral domain optical coherence tomography retinal nerve fiber layer measurements. J. Glaucoma. 21 (2), 116-122 (2012).
- Hwang, Y. H., Kim, Y. Y. Effect of Peripapillary Vitreous Opacity on Retinal Nerve Fiber Layer Thickness Measurement Using Optical Coherence Tomography. Arch. Ophthalmol. 130 (6), 789-792 (2012).
- Schwartz, S. G., Flynn, H. W., Fisher, Y. L. "Floater scotoma" demonstrated on spectral-domain optical coherence tomography and caused by vitreous opacification. Ophthalmic Surg. Lasers Imaging Retina. 44 (4), 415-418 (2013).
- Frost, S., et al. Retinal vascular biomarkers for early detection and monitoring of Alzheimer's disease. Transl. Psychiatry. 3 (2), e233 (2013).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- DeJong, F. J., et al. Retinal vascular caliber and risk of dementia: The Rotterdam Study. Neurology. 76 (9), 816-821 (2011).
- Cheung, C. Y., et al. Quantitative and qualitative retinal microvascular characteristics and blood pressure. J. Hypertens. 29 (7), 1380-1391 (2011).
- Cheung, C. Y., et al. Retinal vascular fractal dimension and its relationship with cardiovascular and ocular risk factors. Am. J. Ophthalmol. 154 (4), 663-674 (2012).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Grinton, M. E., et al. The association between retinal vessel morphology and retinal nerve fiber layer thickness in an elderly population. Ophthalmic Surg. Lasers Imaging. 43 (6 Suppl), S61-S66 (2012).
- Hughes, A. D., et al. Quantification of topological changes in retinal vascular architecture in essential and malignant hypertension. J. Hypertens. 24 (5), 889-894 (2006).
- Hughes, A. D., et al. Determinants of retinal microvascular architecture in normal subjects. Microcirculation. 16 (2), 159-166 (2009).
- Lau, Q. P., Lee, M. L., Hsu, W., Wong, T. Y. The Singapore Eye Vessel Assessment System. Image Anal. Model. Ophthalmol. , 143-160 (2014).
- Thomas, G. N., et al. Measurement of Macular Fractal Dimension Using a Computer-Assisted Program. Investig. Opthalmology Vis. Sci. 55 (4), 2237 (2014).
- Murray, C. D. The physiological principle of minimal work. I. The vascular system and the cost of blood volume. Proc. Natl. Acad. Sci. 12, 207-214 (1926).
- Cheung, C., Chen, C., Wong, T. Ocular Fundus Photography as a Tool to Study Stroke and Dementia. Semin. Neurol. 35 (5), 481-490 (2015).
- Williams, M. A., et al. Retinal microvascular network attenuation in Alzheimer's disease. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 1 (2), 229-235 (2015).
- Cheung, C. Y., et al. Retinal Vascular Fractal Dimension Is Associated with Cognitive Dysfunction. J. Stroke Cerebrovasc. Dis. 23 (1), 43-50 (2014).
- Hammes, H. P., et al. Diabetic retinopathy: targeting vasoregression. Diabetes. 60 (1), 9-16 (2011).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- Frame, M. D., Sarelius, I. H. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc Res. 46 (2), 190-205 (1993).
- Djonov, V., Baum, O., Burri, P. H. Vascular remodeling by intussusceptive angiogenesis. Cell Tissue Res. 314 (1), 107-117 (2003).
- Griffith, T. M., Edwards, D. H. Basal EDRF activity helps to keep the geometrical configuration of arterial bifurcations close to the Murray optimum. J. Theor. Biol. 146 (4), 545-573 (1990).
- Griffith, T. M., Edwards, D. H., Randall, M. D. Blood flow and optimal vascular topography: role of the endothelium. Basic Res. Cardiol. 86 Suppl 2, 89-96 (1991).
- Chapman, N., Haimes, G., Stanton, A. V., Thom, S. A. M., Hughes, A. D. Acute effects of oxygen and carbon dioxide on retinal vascular network geometry in hypertensive and normotensive subjects. Clin. Sci. 99 (6), 483-488 (2000).
- Heringa, S. M., Bouvy, W. H., van denBerg, E., Moll, A. C., Jaap Kappelle, L., Jan Biessels, G. Associations between retinal microvascular changes and dementia, cognitive functioning, and brain imaging abnormalities: a systematic review. J. Cereb. blood flow Metab. 33 (7), 983-995 (2013).
- Ding, J., et al. Diabetic retinopathy and cognitive decline in older people with type 2 diabetes: The Edinburgh type 2 diabetes study. Diabetes. 59 (11), 2883-2889 (2010).
- Parisi, V., Restuccia, R., Fattapposta, F., Mina, C., Bucci, M. G., Pierelli, F. Morphological and functional retinal impairment in Alzheimer's disease patients. Clin. Neurophysiol. 112 (10), 1860-1867 (2001).
- Paquet, C., Boissonnot, M., Roger, F., Dighiero, P., Gil, R., Hugon, J. Abnormal retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Neurosci. Lett. 420 (2), 97-99 (2007).
- Moschos, M. M., et al. Structural and functional impairment of the retina and optic nerve in Alzheimer's disease. Curr. Alzheimer Res. 9 (7), 782-788 (2012).
- Lu, Y., et al. Retinal nerve fiber layer structure abnormalities in early Alzheimer's disease: Evidence in optical coherence tomography. Neurosci. Lett. 480 (1), 69-72 (2010).
- Kesler, A., Vakhapova, V., Korczyn, A. D., Naftaliev, E., Neudorfer, M. Retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Clin. Neurol. Neurosurg. 113 (7), 523-526 (2011).
- Ascaso, F. J., et al. Retinal alterations in mild cognitive impairment and Alzheimer's disease: An optical coherence tomography study. J. Neurol. 261 (8), 1522-1530 (2014).
- Berisha, F., Feke, G. T., Trempe, C. L., McMeel, J. W., Schepens, C. L. Retinal abnormalities in early Alzheimer's disease. Investig. Ophthalmol. Vis. Sci. 48 (5), 2285-2289 (2007).
- Iseri, P. K., Altinaş, O., Tokay, T., Yüksel, N. Relationship between Cognitive Impairment and Retinal Morphological and Visual Functional Abnormalities in Alzheimer Disease. J. Neuro-Ophthalmology. 26 (1), 18-24 (2006).
- Garcia-Martin, E. S., et al. Macular thickness as a potential biomarker of mild Alzheimer's disease. Ophthalmology. 121 (5), 1149-1151 (2014).
- Ko, F., et al. Retinal Nerve Fiber Layer Thinning Associated With Poor Cognitive Function Among A Large Cohort, The Uk Biobank. Alzheimer's Dement. 12 (7), P317-P318 (2016).
- Moreno-Ramos, T., Benito-Leon, J., Villarejo, A., Bermejo-Pareja, F. Retinal nerve fiber layer thinning in dementia associated with Parkinson's disease, dementia with Lewy bodies, and Alzheimer's disease. J. Alzheimers. Dis. 34 (3), 659-664 (2013).
- Moschos, M. M., et al. Morphologic changes and functional retinal impairment in patients with Parkinson disease without visual loss. Eur. J. Ophthalmol. 21 (1), 24-29 (2011).
- Garcia-Martin, E., et al. Ability and reproducibility of Fourier-domain optical coherence tomography to detect retinal nerve fiber layer atrophy in Parkinson's disease. Ophthalmology. 119 (10), 2161-2167 (2012).
- Yip, W., et al. Comparison of Common Retinal Vessel Caliber Measurement Software and a Conversion Algorithm. Transl. Vis. Sci. Technol. 5 (5), 11 (2016).
- Gorelick, P. B., et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association. Stroke. 42 (9), 2672-2713 (2011).
- Brown, W. R., Thore, C. R. Review: Cerebral microvascular pathology in ageing and neurodegeneration. Neuropathol. Appl. Neurobiol. 37 (1), 56-74 (2011).
- DeSilva, T. M., Faraci, F. M. Microvascular Dysfunction and Cognitive Impairment. Cell. Mol. Neurobiol. 36 (2), 241-258 (2016).
- Kalaria, R. N., Akinyemi, R., Ihara, M. Does vascular pathology contribute to Alzheimer changes?. J. Neurol. Sci. 322 (1-2), 141-147 (2012).
- Kling, M. A., Trojanowski, J. Q., Wolk, D. A., Lee, V. M. Y., Arnold, S. E. Vascular disease and dementias: paradigm shifts to drive research in new directions. Alzheimers. Dement. 9 (1), 76-92 (2013).
- O'Brien, J. T., et al. Vascular cognitive impairment. Lancet Neurol. 2 (2), 89-98 (2003).
- Chen, C., et al. Alzheimer's disease with cerebrovascular disease: current status in the Asia-Pacific region. J. Intern. Med. 280 (4), 359-374 (2016).
- Pérez, M. A., Bruce, B. B., Newman, N. J., Biousse, V. The use of retinal photography in nonophthalmic settings and its potential for neurology. Neurologist. 18 (6), 350-355 (2012).
- Boppart, S. A. Optical coherence tomography: Technology and applications for neuroimaging. Psychophysiology. 40 (4), 529-541 (2003).
- Hee, M. R., et al. Optical coherence tomography of the human retina. Arch. Ophthalmol. 113 (3), 325-332 (1995).
- Huang, D., et al. Optical coherence tomography. Science (80-.). 254 (5035), 1178-1181 (1991).
- vanVelthoven, M. E. J., Verbraak, F. D., Yannuzzi, L., Rosen, R. B., Podoleanu, A. G. H., deSmet, M. D. Imaging the retina by en face optical coherence tomography. Retina. 26 (2), 129-136 (2006).
- Costa, R. A., et al. Retinal assessment using optical coherence tomography. Prog. Retin. Eye Res. 25 (3), 325-353 (2006).
- DeBuc, D. C., Somfai, G. M., Ranganathan, S., Tátrai, E., Ferencz, M., Puliafito, C. A. Reliability and reproducibility of macular segmentation using a custom-built optical coherence tomography retinal image analysis software. J. Biomed. Opt. 14 (6), 64023 (2009).
- Budenz, D. L., et al. Determinants of Normal Retinal Nerve Fiber Layer Thickness Measured by Stratus OCT. Ophthalmology. 114 (6), 1046-1052 (2007).
- Leung, C. K. S., et al. Retinal Nerve Fiber Layer Imaging with Spectral-Domain Optical Coherence Tomography: A Prospective Analysis of Age-Related Loss. Ophthalmology. 119 (4), 731-737 (2012).
- Cettomai, D., et al. Reproducibility of optical coherence tomography in multiple sclerosis. Arch. Neurol. 65 (9), 1218-1222 (2008).
- Garcia-Martin, E., Pinilla, I., Idoipe, M., Fuertes, I., Pueyo, V. Intra and interoperator reproducibility of retinal nerve fibre and macular thickness measurements using Cirrus Fourier-domain OCT. Acta Ophthalmol. 89 (1), (2011).
- Garcia-Martin, E., Pueyo, V., Pinilla, I., Ara, J. R., Martin, J., Fernandez, J. Fourier-domain OCT in multiple sclerosis patients: reproducibility and ability to detect retinal nerve fiber layer atrophy. Invest. Ophthalmol. Vis. Sci. 52 (7), 4124-4131 (2011).
- Menke, M. N., Knecht, P., Sturm, V., Dabov, S., Funk, J. Reproducibility of nerve fiber layer thickness measurements using 3D fourier-domain OCT. Invest. Ophthalmol. Vis. Sci. 49 (12), 5386-5391 (2008).
- Mwanza, J. C., et al. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Investig. Ophthalmol. Vis. Sci. 51 (11), 5724-5730 (2010).
- Syc, S. B., et al. Reproducibility of high-resolution optical coherence tomography in multiple sclerosis. Mult Scler. 16 (7), 829-839 (2010).
- Ikram, M. K., Cheung, C. Y., Wong, T. Y., Chen, C. P. L. H. Retinal pathology as biomarker for cognitive impairment and Alzheimer's disease. J. Neurol. Neurosurg. Psychiatry. 83 (9), 917-922 (2012).
- MacGillivray, T. J., Trucco, E., Cameron, J. R., Dhillon, B., Houston, J. G., vanBeek, E. J. R. Retinal imaging as a source of biomarkers for diagnosis, characterization and prognosis of chronic illness or long-term conditions. Br. J. Radiol. 87 (1040), 20130832 (2014).
- Patton, N., et al. Retinal image analysis: Concepts, applications and potential. Prog. Retin. Eye Res. 25 (1), 99-127 (2006).
- McGrory, S., et al. The application of retinal fundus camera imaging in dementia: A systematic review. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 6, 91-107 (2017).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Hardin, J. S., Taibbi, G., Nelson, S. C., Chao, D., Vizzeri, G. Factors Affecting Cirrus-HD OCT Optic Disc Scan Quality: A Review with Case Examples. J. Ophthalmol. 2015, 1-16 (2015).
- Kim, N. R., et al. Influence of Cataract on Time Domain and Spectral Domain Optical Coherence Tomography Retinal Nerve Fiber Layer Measurements. J. Glaucoma. 1, (2010).
- Li, H., et al. Lens opacity and refractive influences on the measurement of retinal vascular fractal dimension. Acta Ophthalmol. 88 (6), e234-e240 (2010).
- Maberley, D., Morris, A., Hay, D., Chang, A., Hall, L., Mandava, N. A comparison of digital retinal image quality among photographers with different levels of training using a non-mydriatic fundus camera. Ophthalmic Epidemiol. 11 (3), 191-197 (2004).
- Rochtchina, E., Wang, J. J., Taylor, B., Wong, T. Y., Mitchell, P. Ethnic variability in retinal vessel caliber: A potential source of measurement error from ocular pigmentation?-The Sydney childhood eye study. Investig. Ophthalmol. Vis. Sci. 49 (4), 1362-1366 (2008).
- Wainwright, A., et al. Effect of image quality, color, and format on the measurement of retinal vascular fractal dimension. Investig. Ophthalmol. Vis. Sci. 51 (11), 5525-5529 (2010).
- Nguyen, T. T., Wong, T. Y. Retinal vascular manifestations of metabolic disorders. Trends Endocrinol. Metab. 17 (7), 262-268 (2006).
- Ding, J., et al. Retinal vascular caliber and the development of hypertension: a meta-analysis of individual participant data. J. Hypertens. 32 (2), 207-215 (2014).
- Nguyen, T. T., Wong, T. Y. Retinal vascular changes and diabetic retinopathy. Curr. Diab. Rep. 9 (4), 277-283 (2009).
- Leung, C. K. S., Ye, C., Weinreb, R. N., Yu, M., Lai, G., Lam, D. S. Impact of Age-related Change of Retinal Nerve Fiber Layer and Macular Thicknesses on Evaluation of Glaucoma Progression. Ophthalmology. 120 (12), 2485-2492 (2013).
- Sherry, L. M., et al. Reliability of computer-assisted retinal vessel measurement in a population. Clin. Experiment. Ophthalmol. 30 (3), 179-182 (2002).
- Wardlaw, J. M., et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 12 (8), 822-838 (2013).
- Patton, N., Aslam, T., MacGillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: A rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- Ferri, C. P., et al. Global prevalence of dementia: A Delphi consensus study. Lancet. 366 (9503), 2112-2117 (2005).
- Sahadevan, S., et al. Ethnic differences in Singapore's dementia prevalence: The stroke, Parkinson's disease, epilepsy, and dementia in Singapore study. J. Am. Geriatr. Soc. 56 (11), 2061-2068 (2008).
- Kernt, M., et al. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy (Optomap) compared with ETDRS 7-field stereo photography. Diabetes Care. 35 (12), 2459-2463 (2012).
- Manivannan, A., Plskova, J., Farrow, A., Mckay, S., Sharp, P. F., Forrester, J. V. Ultra-wide-field fluorescein angiography of the ocular fundus. Am. J. Ophthalmol. 140 (3), 525-527 (2005).
- Pellegrini, E., et al. Blood vessel segmentation and width estimation in ultra-wide field scanning laser ophthalmoscopy. Biomed. Opt. Express. 5 (12), 4329 (2014).
- Estrada, R., Tomasi, C., Schmidler, S. C., Farsiu, S. Tree topology estimation. IEEE Trans. Pattern Anal. Mach. Intell. 37 (8), 1688-1701 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados