需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
利用视网膜成像研究痴呆
摘要
视网膜与大脑有着显著的相似性, 因此它是研究脑性中血管和神经元结构的独特窗口。本协议描述了一种利用视网膜成像技术研究痴呆症的方法。这种方法对痴呆的诊断和风险评估有潜在的帮助。
摘要
视网膜提供了一个独特的 "窗口" 来研究大脑中的老年痴呆的病理生理过程, 因为它是中枢神经系统 (CNS) 的延伸, 与大脑在胚胎起源、解剖特征和生理特性。 视网膜的血管和神经元结构现在可以很容易地被形象化和性使用视网膜成像技术, 包括眼底摄影和光学相干断层扫描 (OCT), 和量化半自动使用计算机辅助分析程序。研究视网膜和痴呆的血管和神经元变化之间的联系可以提高我们对痴呆症的认识, 并可能有助于诊断和风险评估。 本议定书的目的是描述一种量化和分析视网膜血管和神经元结构的方法, 这可能与痴呆有关。该协议还提供了一些例子, 视网膜变化的主题与痴呆, 并讨论技术问题和目前的局限性, 视网膜成像。
引言
由于预期寿命的增加, 痴呆已成为一个重大的医疗问题, 导致重大的社会和经济健康负担全球1,2,3,4,5。今天, 一个人在美国发展老年痴呆症 (AD), 最常见的形式的痴呆, 每六十六年代6。据估计, 到公元 2050, 1亿1500万人将受到 AD7的影响。
视网膜提供了一个独特的 "窗口", 以研究痴呆, 由于其类似的解剖和生理特性与大脑。在血管方面, 视网膜动脉和静脉, 测量直径100至300µm, 与脑小血管有相似的特征, 如无吻合的端动脉, 屏障功能, 和调节8,9. 在神经元结构方面, 视网膜节细胞 (视网膜) 与中枢神经系统 (CNS) 10 的神经元有着典型的特性。视网膜是突出的连接与大脑, 因为他们形成的视神经和项目的视觉信号从视网膜到外侧膝状核和优越的丘。视神经, 类似于中枢神经系统中的许多神经纤维, 由突髓, ensheathed 于脑膜层。值得注意的是, 对视神经的污辱会导致其他中枢神经系统轴突的类似反应, 如轴突逆行和顺变性、瘢痕形成、髓鞘破坏、继发变性和神经营养异常水平因素和神经递质11,12,13,14。一些 AD 患者的视觉症状的出现也可以通过视网膜和大脑之间的强关联来解释15,16。因此, 有人建议, 视网膜可能反映痴呆的病理过程中的大脑和视网膜成像可以用来研究痴呆症。
视网膜血管和神经元结构现在可以可视化性利用视网膜成像技术。例如, 视网膜眼底照片可以使用眼底照相机捕捉, 而视网膜血管的特征 (例如,血管口径、曲折和分形维数) 可以通过计算机辅助分析进行量化程序.此外, 还可以使用光学相干断层扫描 (OCT) 测量视网膜神经元结构 (如神经节细胞-内状层的厚度 [GC-光子) 和视网膜神经纤维层 [纤维]) 的参数, 并使用内置分析算法。
鉴于视网膜成像对研究痴呆的重要性, 本议定书的目的是描述一种成像和分析视网膜血管和神经元结构在体内使用视网膜成像技术的方法。该协议还提供了一些例子, 视网膜变化的主题与痴呆, 并讨论技术问题和目前的局限性, 视网膜成像。
研究方案
此处描述的所有方法均已得到香港当地临床研究伦理委员会的批准.
注意: 为了简单起见, 在 材料表中列出的设备 用于说明视网膜成像的过程和随后的分析。利用新加坡 I 船评估计划 (湿婆) 17 (新加坡国立大学, 新加坡), 对视网膜血管参数的测量进行了说明。然而, 应该指出的是, 可以采用一套不同的设备, 因为基本原则仍然是相似的.
1. 准备视网膜成像的对象
- 放大主题和 #8217; 学生使用散的代理。等待至少15分钟, 以建立足够的瞳孔扩张.
2。使用计算机辅助分析程序测量眼底照片中的视网膜血管参数
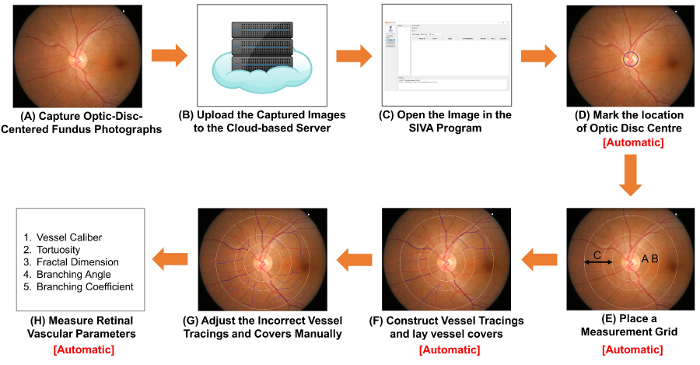
图 1:示意图显示了测量视网膜血管参数的过程。 ( ) 使用眼底照相机获取以光盘为中心的眼底照片。 图 1A 和 图 2A 是两张具有最佳质量的眼底照片。( B ) 将眼底照片上载到基于云的服务器, 并输入相关的研究细节, 包括图像转换因子 (ICF)。其他计算机辅助分析程序可以使用 non-cloud-based 的方法来组织和存储图像。( C ) 在计算机辅助分析程序中打开眼底照片。( D ) 标记光盘中心的位置, ( E ) 提示软件自动检测光盘边缘并放置测量网格。( F ) 根据船只的路径建造船只脉象, 并放置容器盖以估计船只的直径。( G ) 手动调整不正确的容器脉象和容器盖。( H ) 测量视网膜血管参数的频谱, 包括血管口径、曲折、分形维数和分岔。步骤 ( D ) 到步骤 ( F ), 步骤 ( H ) 可以由某些计算机辅助的分析程序自动执行。 请单击此处查看此图的较大版本.
- 使用眼底照相机捕获眼底照片.
- 打开眼底摄像机并在计算机上启动图像捕获程序。将主体的下巴适当地放在 chinrest 上, 前额放在头带上。移动控制杆, 使光束正确对准主语和 #8217 的瞳孔.
- 对齐光照点, 直到取景器两侧都显示为最小。移动外固定靶以引导主体和 #8217 的眼睛, 直到视盘位于取景器的中心, 而感兴趣的区域 (ROI) 也在边界内。调整对焦旋钮聚焦于视网膜.
- 主体要坚定地观察外部固定目标, 确保主体和 #8217; 眼睛里没有泪水.
- 按住快门按钮以捕获图像 ( 图 1A ).
- 检查捕获的眼底照片的质量, 使用 图 2A 作为标准。丢弃图像并重复图像获取过程 (即, 步骤2.1.1 到 2.1.4) 如果瞳孔放大 ( 图 2B ), 则视盘不在图像的中心 ( 图 2C ), 或图像不集中 ( 图 2D ).
- 以 TIFF 格式保存图像, 以层级分辨率 ( 即 , 大约3000像素 x 2000 像素, 在 150 dpi 以上).
注意: 可以在此暂停协议. - 重复步骤2.1.1 到2.1.6 以获取其他主题的眼底照片.
- 随机选择10% 图像样本, 并测量这些图像中的光盘高度 ( 图 3 )。使用公式计算图像转换因子 (icf):
icf = 1800 和 #181; m/(采样的图像的视盘的平均像素高度) - 将捕获的眼底照片上载到基于云的服务器, 并输入相关的研究详细信息, 包括图像转换因子 (ICF) ( 图 1B ).
注意: 协议可以在此处暂停。其他计算机辅助分析程序可能使用其他 non-cloud-based 方法来组织图像并记录 ICF.
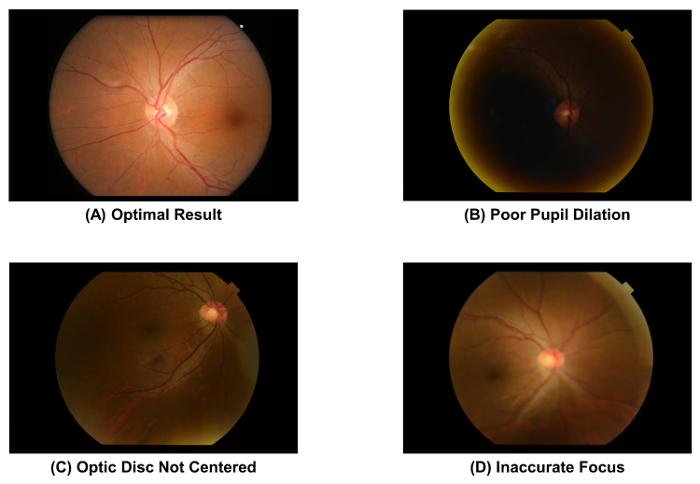
图 2: 眼底照片的最佳和次优质量. 图像采集后必须立即检查眼底照片的图像质量, 因为图像质量直接影响后续的视网膜血管参数测量。如果观察到这些文物中的一个, 则应丢弃该图像。这些图像是使用50和 #176; 眼底摄像头拍摄的。 请单击此处查看此图的较大版本.
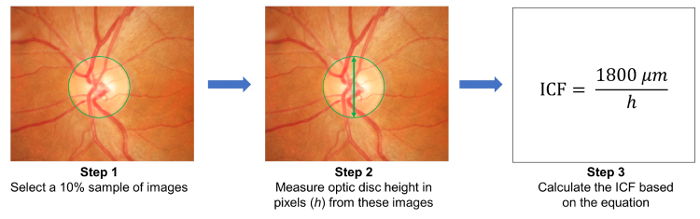
图 3: 图像转换因子 (ICF) 的计算。为了计算 ICF, 从研究中随机选择10% 样本 (步骤 1)。然后, 从采样的图像 (步骤 2) 中测量视盘的高度 (以像素为单位)。使用公式计算 icf: icf = 1800 和 #181; m/(采样图像的光盘的平均像素高度), 其中1800和 #181; m 近似于普通光盘的高度 (步骤 3)。由于放大效果和图像分辨率不同于相机, 所以有必要为每个使用的相机计算一个精确的 ICF。 请单击此处查看此图的较大版本.
- 在计算机辅助分析程序中打开眼底照片。为视网膜血管构筑血管脉象和导管盖.
注: 在本节中, 湿婆程序用于说明程序。然而, 湿婆计划可以被其他可用的计算机辅助分析程序替代。此外, 在打开眼底照片 ( 即 步骤 2.2.1) 时, 某些计算机辅助分析程序会自动执行2.2.2 到2.2.3 的步骤。- 使用计算机辅助分析程序打开眼底照片 ( 图 1C )。
- 标记光盘中心的位置 ( 图 1D )。
- 单击 "#8220; OD 中心和 #8221; 左侧功能面板上的按钮; 鼠标光标将被绿色圆圈替换.
- 将绿色圆圈移至光盘中心 (OD), 并 left-click 以修复圆.
- 提示软件自动放置测量网格, 构造容器脉象和 lay 容器盖 ( 图 1E 和 1F )。
注: 容器盖是测量船只内部流明的近似宽度的度量线。
- 单击并 #8220; 查找 od 和 #8221; 按钮以提示软件检测 od 边缘并将四同心圆作为测量网格, 基于 od 中心的位置.
- 单击 #8220;P 工艺和 #8221; 按钮启动自动跟踪过程.
- 手动调整不正确的容器脉象。开始检查从 12 o 和 #8217; 时钟位置顺时针的方式, 以确保所有船只脉象的验证.
- 检查是否准确地检测到了光盘, 并正确放置了测量网格。如果最里层的圆圈没有准确地勾勒出光盘边缘 ( 图 4A ), 请手动调整测量网格, 然后按照步骤2.2.2 到 2.2.3.
- 左键单击以选择带有不正确容器类型 (微动脉与静脉) 的容器跟踪, 然后单击 #8220; 容器 (T) 型和 #8221; 按钮更改容器类型.
注: 动脉以红色标记, 静脉标记为蓝色。根据静脉的生理差异, 可以区分出微动脉。例如, 静脉的颜色通常较深, 比微动脉宽。具有相同容器类型的容器通常不会相互交叉. - 将不完整的容器脉象以下步骤2.3.3.1 到 2.3.3.2 ( 图 4B )。
- 使用光标单击不完整容器跟踪的远端。左键单击沿船只路径的点, 以延长船只追踪.
- 当到达容器的远端时停止跟踪过程。如果容器的远端位于测量网格之外 (请参见 图 4B ), 则停止在最外层的白色圆圈进行跟踪. 如果在交叉站点 ( 图 4C ) 上未正确跟踪容器路径, 则
- 调整容器脉象。
- 单击 "#8220"; 选择并 #8221; 按钮, 然后单击不正确的船只跟踪点。单击 "#8220;" (k) 赛格和 #8221; 按钮在选定的点上断开船只跟踪。选择断开连接的段, 然后单击 #8220;(D el) 赛格和 #8221; 按钮将其删除.
- 使用步骤2.3.3.1 和2.3.3.2 重新构造新的容器跟踪.
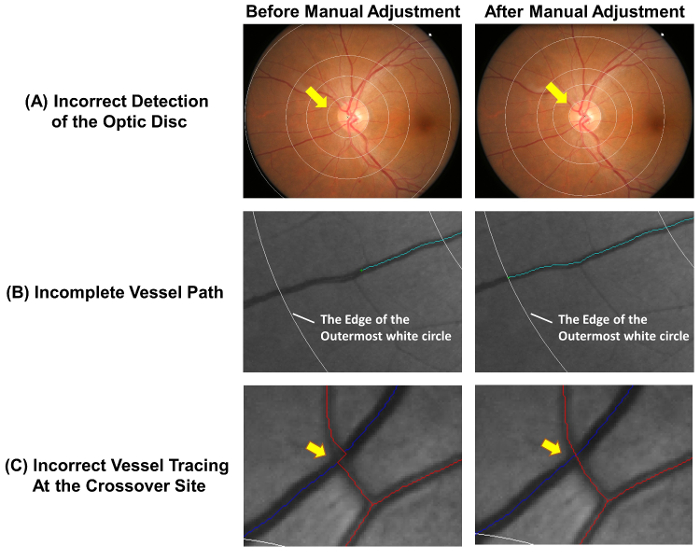
图 4: 自动的常见错误. 船舶自动跟踪不完全准确, 需要进行手动调整, 以确保测量的准确性。此图显示了自动的常见错误, 并演示了手动调整后的最佳结果。( A ) 光盘中心被错误地标记, 这会导致测量网格的偏差, 这可能会影响随后的测量。理想情况下, 测量网格的最内圈应该勾勒出视盘边缘。( B ) 不完整的船只追踪可能导致不正确地测量分形维数、曲折、 等 船只的路径应追查到船只的末端。如果容器的远端落在测量网格之外, 则可以在最外层的白色圆圈处停止跟踪。( C ) 在交叉点的船只脉象有较高的错误倾向, 因此需要特别注意。 请单击此处查看此图的较大版本.
- 在所有容器段上放置容器盖, 并手动停用不正确的盖子.
- 单击 "#8220"; 查找封面和 #8221; 按钮可自动在所有容器段上放置容器盖.
- 检查是否正确放置了所有容器盖。左键单击并拖动光标以停用容器盖如果盖不垂直于容器壁 ( 图 5A ), 则容器路径被另一容器 ( 图 5B ) 遮蔽, 或包括高估或低估容器腔的宽度 ( 图 5C ).
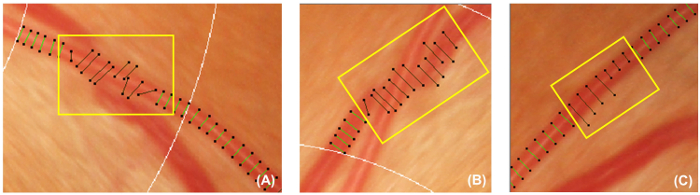
图 5: 不正确的容器盖. 此图显示了不正确的容器盖的示例, 应将其停用并排除在随后的测量中。如果不垂直于容器 ( A ), 则应停用容器盖。此外, 如果被追查的船只在另一船只 ( B ) 下被遮蔽, 或船只盖不能代表船只的大致宽度 ( C ), 也应停用船只盖。 请单击此处查看此图的较大版本.
- 测量来自容器脉象和容器盖的视网膜血管参数
注意: 步骤2.5 由计算机辅助分析程序自动执行。- 将区域 0.5-1.0 盘直径从光盘边缘标记为区域 B, 并将区域 0.5-2.0 盘直径从光盘边距显示为区域 C 18 ( 图 6A ), 根据社区动脉粥样硬化风险修正协议 (ARIC) 研究 19 .
- 使用从 ARIC 研究中修改的广泛采用的方法 19 、 20 、 21 , 从 B 区和区域 C 测量视网膜血管口径, 22 , 23 , 24 , 25 , 26 ( 图 6B )。
- 测量六最大的动脉和六最大静脉的血管覆盖长度, 以估计视网膜血管口径.
- 将视网膜动脉和静脉口径分别概括为视网膜中央动脉等效物 (CRAE) 和视网膜中央静脉等效物 (CRVE) 17 , 使用修订后的 Knudtson 和 #8211;P-哈伯德公式 18 , 19 .
- 将 C 区中的所有容器标识为宽度和 #62; 40 和 #181; m. 计算视网膜动脉和静脉曲折从总的平方曲率积分沿容器脉象和正常化的价值与总弧长, 鞠躬, 和点的拐点 27 , 28 .
- 使用已建立的 #8220 计算区域 C 中的总、动脉和静脉分形维数; 框计数方法和 #8221; 29 , 30 , 31 。
- 将图像分成一系列大小相等的正方形.
- 计算包含容器脉象部分的框数.
- 使用不同大小的一系列同等大小的正方形重复该过程.
- 将包含该容器的箱数的对数与脉象框大小的对数进行绘制, 并计算结果线的斜率; 这是分形维数.
- 在区域 C 中识别具有第一分岔的容器, 并计算角度 (和 #952 在前两个子容器之间;), 32 ( 图 6C )。计算平均值以获得平均分支角.
- 使用公式计算区域 C 中的分支系数:
(d 1 2 + d 2 2 )/d 0 2 , 其中 d 0 是平均主干口径, d 1 和 d 2 是平均分支口径 ( 图 6C ).
- 关闭分级窗口。单击并 #8220; 发送和 #8221; 在弹出式对话框中, 将分级图像上载到基于云的服务器, 并记录自动测量的视网膜血管参数.
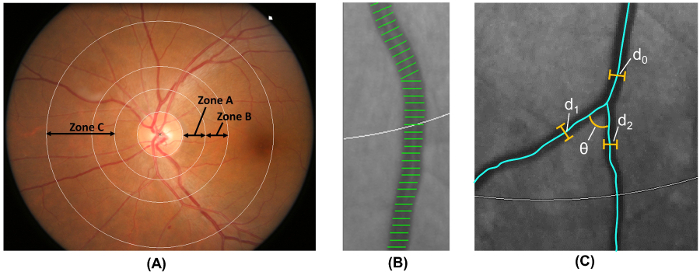
图 6: 视网膜血管的量化。( A ) 区域 b (定义为距离光盘边缘 0.5-1.0 圆盘直径) 用于根据社区研究中的动脉粥样硬化风险测量 b 区的血管口径。区域 c (定义为 0.5-2.0 圆盘直径远离光盘边缘) 用于测量 c 区的容器口径和视网膜血管网络参数 (如曲折、分形维数和分岔) 的频谱。( B ) 容器盖是用于估计视网膜血管口径 (或直径) 的测量线。不正确的容器盖应手动排除在测量之外。( c ) 对于在 C 区内有第一个分支的所有容器, 程序自动测量分支角 (和 #952 第一个分支的;)。此外, 还使用公式计算分支系数: 分支系数 = (d 1 2 + d 2 2 )/d 0 2 , 其中 d 0 是主干口径, d 1 和 d 2 是分支口径。 请单击此处查看此图的较大版本.
3. 评估 GC 和纤维的厚度
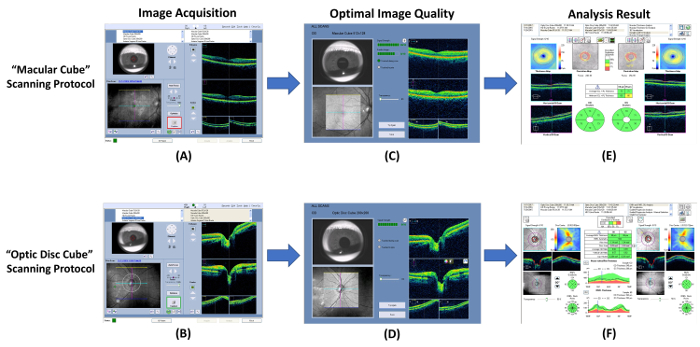
图 7: 显示测量纤维和气相色谱厚度的过程的原理图. 光学相干断层扫描 (OCT) 可用于测量神经节细胞-内状层 (GC) 和视网膜神经纤维层 (纤维) 的厚度。( A, B )使用内置和 #8220 测量色谱和纤维厚度; 黄斑立方体和 #8221; 和 #8220; 光盘立方体和 #8221; 分别扫描协议。( C, D )图像采集后立即检查图像质量。如果信号强度小于 6, 或检测到运动伪影, 则丢弃图像并重复扫描。( E, F )然后, 提示内置的分析程序自动分析扫描结果, 并生成一份解释报告。 请单击此处查看此图的较大版本.
- 使用光学相干层析 (OCT) 执行图像采集.
- 打开 OCT 程序并选择和 #8220; 黄斑立方体和 #8221; 扫描协议以启动新的黄斑扫描 ( 图 7A ).
- 通过调整 chinrest 在虹膜视区中定位瞳孔。如果瞳孔大小太小, 请降低光照.
- 单击 #8220; 自动对焦和 #8221; 按钮, 然后 #8220; 优化和 #8221; 按钮以提高图像质量.
- 指示主题在开始扫描前会立即闪烁几次.
- 单击 #8220; 捕获和 #8221; 按钮在按钮周围的边框变为绿色时开始扫描。在图像采集过程中, 指导主体关注视觉固定目标, 以避免运动伪影.
- 查看扫描质量使用 图 7C 作为标准。如果信号强度小于 6 ( 图 8A ), 或检测到运动伪制品 (由血管的不连续性指示) ( 图 8B ), 则放弃扫描结果并重复扫描.
- 保存扫描结果.
- 重复步骤3.1.1 到3.1.7 另一只眼睛.
- 执行与 #8220 的光学神经头扫描; 光盘立方体和 #8221; 扫描协议以下步骤3.1.2 到 3.1.9 ( 图 7B 和 7D ).

图 8: 光学相干层析成像的次优结果. 光学相干层析成像 (OCT) 的常见次优结果包括 ( A ) 信号强度差 (强度值和 #60; 6), 以及 ( B ) 运动制品。扫描质量应立即审查后, 图像采集, 并应重复扫描, 如果这些文物遇到。 请单击此处查看此图的较大版本.
- 生成黄斑色谱-光子厚度的分析打印输出.
- 选择 #8220; 黄斑立方体和 #8221; 在分析界面中扫描两个眼睛的记录.
- 单击 #8220; 神经节细胞 OU 分析和 #8221; 启动自动分析算法以评估扫描的 GC-彩光厚度 ( 图 7E ).
注意: 步骤3.2.2 由分析算法自动完成。- 生成一个 14.13 mm 2 中心椭圆环, 分别具有 0.6 mm 和 2.4 mm 的水平内和外半径, 分别为 0.5 mm 和 2.0 mm 的垂直内部和外部半径.
注意: 椭圆环的大小和形状与黄斑解剖学紧密吻合, 因而与正常眼中视网膜最厚的区域对应 33 , 34 。环形环内环的面积是不被测量的, 因为这个区域的气相色谱是非常薄的. - 将纤维的外边界和内部状层 (光子) 的外边界分段, 以找到 GC 光子 ( 图 9 ).
- 在凹环中测量黄斑色谱的平均、最小和六扇形 (superotemporal、高级、superonasal、inferonasal、下位、inferotemporal) 厚度tered 椭圆环.
- 将测量的 GC-光子厚度与设备和 #8217 的内部规范年龄匹配数据库进行比较, 并生成偏差图和意义图
- 在分析打印输出上报告测量结果.
- 生成一个 14.13 mm 2 中心椭圆环, 分别具有 0.6 mm 和 2.4 mm 的水平内和外半径, 分别为 0.5 mm 和 2.0 mm 的垂直内部和外部半径.
- 以. pdf 格式保存分析打印输出.
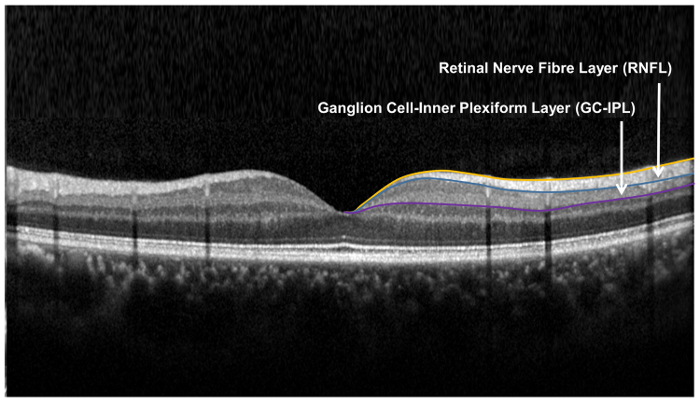
图 9: 用于视网膜神经元结构的评估. 用视神经头 (ONH) 算法测量视网膜神经纤维层 (纤维), 用神经节细胞分析 (配合力) 算法测量神经节细胞内状层。ONH 算法对纤维的内边界和外界进行了分段, 以测量纤维的厚度。该算法检测视网膜神经纤维层 (纤维) 和内状层 (光子) 的外边界, 以产生神经节细胞层 (协合) 和彩光的复合厚度。协鑫和彩光的厚度是一起测量的, 因为协鑫和光子的边界在解剖学上是模糊的。然而, 协鑫和彩光的组合厚度 ( 即 GC) 仍然是视网膜的健康. 请点击这里查看更大版本的图
- 生成纤维厚度 ( 图 7F ) 的分析打印输出.
- 选择 #8220; 光盘多维数据集和 #8221; 在分析界面中扫描两个眼睛的记录.
- 单击 #8220; ONH 和纤维 OU 分析和 #8221; 启动自动分析算法以评估扫描的纤维厚度.
注意: 3.3.2.1 到3.3.2.6 的步骤可以通过分析算法自动完成。- 测量每个扫描点的纤维厚度并生成纤维厚度映射.
- 通过检测扫描中心附近的一个暗点来识别光盘, 该黑点的大小和形状与光盘的范围一致.
- 在纤维厚度图上, 将直径3.46 毫米的测量网格放置在光盘周围.
- 测量和计算全球, 四象限 (时间, 高级, 鼻和下位), 和十二时钟小时 parapapillary 纤维厚度的度量网格.
- 将测量的纤维厚度与设备和 #8217 的内部规范年龄匹配数据库进行比较, 并生成一个偏差映射和一个重要映射.
- 在分析打印输出上报告测量结果.
- 以. pdf 格式保存分析打印输出.
结果
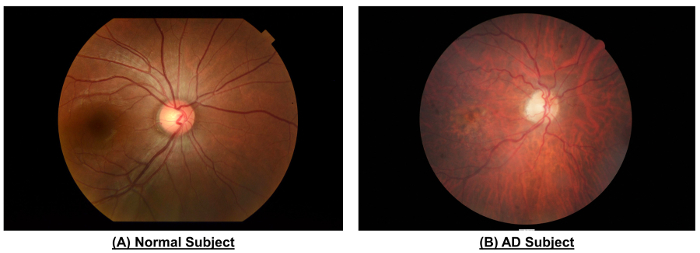
图 10:一个例子, 以显示在正常的主题和一个广告主题之间的视网膜血管的差异.与正常人相比, AD 的眼底照片显示狭窄的血管口径 (CRAE 区 B、116.4 µm vs. 156.4 µm;CRVE 区 B, 186.9 µm vs. 207.5 µm;CRAE 区 C, 138.5 µm vs. 165.8 µm;CRVE 区 C, 206.6 µm vs. 232.2 µm), 更小...
讨论
本协议描述了在视网膜体内量化神经元和血管变化的过程。由于视网膜与大脑有着相似的胚胎来源、解剖特征和生理特性, 这些视网膜的变化可能反映了大脑中血管和神经元结构的类似变化。
如图 10和表 1所示, 与健康主题相比, AD 主题显示的容器口径减少。据报道, 减少 CRVE 和 CRAE 是与阿尔茨海默氏病相关的46,
披露声明
我们对新加坡国立大学计算机学院的技术支持表示感谢。
致谢
关于潜在的金融关系, 作者发明是新加坡 I 船评估 (湿婆) 项目中使用的一份文件。
材料
| Name | Company | Catalog Number | Comments |
| Non-mydriatic Retinal Camera | Topcon, Inc, Tokyo, Japan | TRC 50DX | N/A |
| Singapore I Vessel Assessment Program | National University of Singapore | Version 4.0 | N/A |
| CIRRUS HD-OCT | Carl Zeiss Meditec, Inc, Dublin, CA | Model 4000 | N/A |
| Mydriatic Agents | N/A | N/A | Prepared from 1% tropicamide and 2.5% phenylephrine hydrochloride |
参考文献
- Alzheimer's Disease International. The prevalence of dementia worldwide. Alzheimer's Dis. Int. (December), 1-2 (2008).
- Wimo, A., Winblad, B., &Jönsson, L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimer's Dement. 6 (2), 98-103 (2010).
- Comas-Herrera, A., Northey, S., Wittenberg, R., Knapp, M., Bhattacharyya, S., Burns, A. Future costs of dementia-related long-term care: exploring future scenarios. Int. Psychogeriatr. 23 (1), 20-30 (2011).
- Alzheimer's Association. Alzheimer's disease facts and figures. Alzheimer's Dement. 10 (2), e47-e92 (2014).
- Prince, M., Bryce, R., Albanese, E., Wimo, A., Ribeiro, W., Ferri, C. P. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers. Dement. 9 (1), 63-75 (2013).
- Alzheimer's Association. 2016 Alzheimer's disease facts and figures. Alzheimer's Dement. 12 (4), 459-509 (2016).
- Asih, P. R., Chatterjee, P., Verdile, G., Gupta, V. B., Trengove, R. D., Martins, R. N. Clearing the amyloid in Alzheimer's: progress towards earlier diagnosis and effective treatments - an update for clinicians. Neurodegener. Dis. Manag. 4 (5), 363-378 (2014).
- Cheung, C. Y., Ikram, M. K., Chen, C., Wong, T. Y. Imaging retina to study dementia and stroke. Prog. Retin. Eye Res. , (2017).
- Patton, N., Aslam, T., Macgillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: a rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nat. Rev. Neurol. 9 (1), 44-53 (2013).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Levkovitch-Verbin, H., Quigley, H. A., Kerrigan-Baumrind, L. A., D'Anna, S. A., Kerrigan, D., Pease, M. E. Optic nerve transection in monkeys may result in secondary degeneration of retinal ganglion cells. Investig. Ophthalmol. Vis. Sci. 42 (5), 975-982 (2001).
- Levkovitch-Verbin, H., Quigley, H. A., Martin, K. R., Zack, D. J., Pease, M. E., Valenta, D. F. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Sadun, A. A., Borchert, M., DeVita, E., Hinton, D. R., Bassi, C. J. Assessment of Visual Impairment in Patients With Alzheimer's Disease. Am. J. Ophthalmol. 104 (2), 113-120 (1987).
- Schlotterer, G., Moscovitch, M., Crapper-Mclachlan, D. Visual processing deficits as assessed by spatial frequency contrast sensitivity and backward masking in normal ageing and alzheimer's. Brain. 107 (1), 309-324 (1984).
- Cheung, C. Y. L., et al. A new method to measure peripheral retinal vascular caliber over an extended area. Microcirculation. 17 (7), 495-503 (2010).
- Knudtson, M. D., Lee, K. E., Hubbard, L. D., Wong, T. Y., Klein, R., Klein, B. E. K. Revised formulas for summarizing retinal vessel diameters. Curr. Eye Res. 27 (3), 143-149 (2003).
- Hubbard, L. D., et al. Methods for evaluation of retinal microvascular abnormalities associated with hypertension/sclerosis in the Atherosclerosis Risk in Communities Study. Ophthalmology. 106 (12), 2269-2280 (1999).
- Patton, N., et al. The association between retinal vascular network geometry and cognitive ability in an elderly population. Investig. Ophthalmol. Vis. Sci. 48 (5), 1995-2000 (2007).
- VanHecke, M. V., et al. Are retinal microvascular abnormalities associated with large artery endothelial dysfunction and intima-media thickness? The Hoorn Study. Clin. Sci. London Engl. 110 (5), 597-604 (2006).
- Tien, Y. W., et al. Retinal vascular caliber, cardiovascular risk factors, and inflammation: The Multi-Ethnic Study of Atherosclerosis (MESA). Investig. Ophthalmol. Vis. Sci. 47 (6), 2341-2350 (2006).
- Leung, H., et al. Relationships between age, blood pressure, and retinal vessel diameters in an older population. Investig. Ophthalmol. Vis. Sci. 44 (7), 2900-2904 (2003).
- Wong, T. Y., et al. The prevalence and risk factors of retinal microvascular abnormalities in older persons: The cardiovascular health study. Ophthalmology. 110 (4), 658-666 (2003).
- Ikram, M. K., et al. Retinal vessel diameters and risk of stroke: The Rotterdam Study. Neurology. 66 (9), 1339-1343 (2006).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: Methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Sasongko, M. B., et al. Alterations in retinal microvascular geometry in young type 1 diabetes. Diabetes Care. 33 (6), 1331-1336 (2010).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Mainster, M. a The fractal properties of retinal vessels: embryological and clinical implications. Eye. 4 ( Pt 1) (1), 235-241 (1990).
- Liew, G., et al. The Retinal Vasculature as a Fractal: Methodology, Reliability, and Relationship to Blood Pressure. Ophthalmology. 115 (11), (2008).
- Stosic, T., Stosic, B. D. Multifractal analysis of human retinal vessels. IEEE Trans. Med. Imaging. 25 (8), 1101-1107 (2006).
- Zamir, M., Medeiros, J. A., Cunningham, T. K. &. a. m. p. ;. M., Zamir, J. A., Medeiros, T. K. C. Arterial bifurcations in the human retina. J. Gen. Physiol. 74 (4), 537-548 (1979).
- Mwanza, J. C., Oakley, J. D., Budenz, D. L., Chang, R. T., Knight, O. J., Feuer, W. J. Macular ganglion cell-inner plexiform layer: Automated detection and thickness reproducibility with spectral domain-optical coherence tomography in glaucoma. Investig. Ophthalmol. Vis. Sci. 52 (11), 8323-8329 (2011).
- Bendschneider, D., et al. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J. Glaucoma. 19 (7), 475-482 (2010).
- Cheung, C. Y., Ong, Y. T., Ikram, M. K., Chen, C., Wong, T. Y. Retinal Microvasculature in Alzheimer's Disease. J. Alzheimer's Dis. 42 (s4), S339-S352 (2014).
- Murray, C. D. THE PHYSIOLOGICAL PRINCIPLE OF MINIMUM WORK APPLIED TO THE ANGLE OF BRANCHING OF ARTERIES. J. Gen. Physiol. (4), 835-841 (1926).
- Ding, J., et al. Early retinal arteriolar changes and peripheral neuropathy in diabetes. Diabetes Care. 35 (5), 1098-1104 (2012).
- Yim, C., et al. Retinal Ganglion Cell Analysis Using High-Definition Optical Coherence Tomography in Patients with Mild Cognitive Impairment and Alzheimer's Disease. J. Alzheimer's Dis. Retin. Ganglion Cell Anal. MCI AD. 45 (1), 45-56 (2015).
- Stein, D. M., Wollstein, G., Ishikawa, H., Hertzmark, E., Noecker, R. J., Schuman, J. S. Effect of Corneal Drying on Optical Coherence Tomography. Ophthalmology. 113 (6), 985-991 (2006).
- Mwanza, J. C., et al. Effect of Cataract and its Removal on Signal Strength and Peripapillary Retinal Nerve Fiber Layer Optical Coherence Tomography Measurements. J. Glaucoma. 20 (1), 37-43 (2011).
- Garcia-Martin, E., et al. Influence of cataract surgery on optical coherence tomography and neurophysiology measurements in patients with retinitis pigmentosa. Am. J. Ophthalmol. 156 (2), (2013).
- Kok, P. H. B., et al. The relationship between the optical density of cataract and its influence on retinal nerve fibre layer thickness measured with spectral domain optical coherence tomography. Acta Ophthalmol. , (2012).
- Kim, N. R., et al. Influence of cataract on time domain and spectral domain optical coherence tomography retinal nerve fiber layer measurements. J. Glaucoma. 21 (2), 116-122 (2012).
- Hwang, Y. H., Kim, Y. Y. Effect of Peripapillary Vitreous Opacity on Retinal Nerve Fiber Layer Thickness Measurement Using Optical Coherence Tomography. Arch. Ophthalmol. 130 (6), 789-792 (2012).
- Schwartz, S. G., Flynn, H. W., Fisher, Y. L. "Floater scotoma" demonstrated on spectral-domain optical coherence tomography and caused by vitreous opacification. Ophthalmic Surg. Lasers Imaging Retina. 44 (4), 415-418 (2013).
- Frost, S., et al. Retinal vascular biomarkers for early detection and monitoring of Alzheimer's disease. Transl. Psychiatry. 3 (2), e233 (2013).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- DeJong, F. J., et al. Retinal vascular caliber and risk of dementia: The Rotterdam Study. Neurology. 76 (9), 816-821 (2011).
- Cheung, C. Y., et al. Quantitative and qualitative retinal microvascular characteristics and blood pressure. J. Hypertens. 29 (7), 1380-1391 (2011).
- Cheung, C. Y., et al. Retinal vascular fractal dimension and its relationship with cardiovascular and ocular risk factors. Am. J. Ophthalmol. 154 (4), 663-674 (2012).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Grinton, M. E., et al. The association between retinal vessel morphology and retinal nerve fiber layer thickness in an elderly population. Ophthalmic Surg. Lasers Imaging. 43 (6 Suppl), S61-S66 (2012).
- Hughes, A. D., et al. Quantification of topological changes in retinal vascular architecture in essential and malignant hypertension. J. Hypertens. 24 (5), 889-894 (2006).
- Hughes, A. D., et al. Determinants of retinal microvascular architecture in normal subjects. Microcirculation. 16 (2), 159-166 (2009).
- Lau, Q. P., Lee, M. L., Hsu, W., Wong, T. Y. The Singapore Eye Vessel Assessment System. Image Anal. Model. Ophthalmol. , 143-160 (2014).
- Thomas, G. N., et al. Measurement of Macular Fractal Dimension Using a Computer-Assisted Program. Investig. Opthalmology Vis. Sci. 55 (4), 2237 (2014).
- Murray, C. D. The physiological principle of minimal work. I. The vascular system and the cost of blood volume. Proc. Natl. Acad. Sci. 12, 207-214 (1926).
- Cheung, C., Chen, C., Wong, T. Ocular Fundus Photography as a Tool to Study Stroke and Dementia. Semin. Neurol. 35 (5), 481-490 (2015).
- Williams, M. A., et al. Retinal microvascular network attenuation in Alzheimer's disease. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 1 (2), 229-235 (2015).
- Cheung, C. Y., et al. Retinal Vascular Fractal Dimension Is Associated with Cognitive Dysfunction. J. Stroke Cerebrovasc. Dis. 23 (1), 43-50 (2014).
- Hammes, H. P., et al. Diabetic retinopathy: targeting vasoregression. Diabetes. 60 (1), 9-16 (2011).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- Frame, M. D., Sarelius, I. H. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc Res. 46 (2), 190-205 (1993).
- Djonov, V., Baum, O., Burri, P. H. Vascular remodeling by intussusceptive angiogenesis. Cell Tissue Res. 314 (1), 107-117 (2003).
- Griffith, T. M., Edwards, D. H. Basal EDRF activity helps to keep the geometrical configuration of arterial bifurcations close to the Murray optimum. J. Theor. Biol. 146 (4), 545-573 (1990).
- Griffith, T. M., Edwards, D. H., Randall, M. D. Blood flow and optimal vascular topography: role of the endothelium. Basic Res. Cardiol. 86 Suppl 2, 89-96 (1991).
- Chapman, N., Haimes, G., Stanton, A. V., Thom, S. A. M., Hughes, A. D. Acute effects of oxygen and carbon dioxide on retinal vascular network geometry in hypertensive and normotensive subjects. Clin. Sci. 99 (6), 483-488 (2000).
- Heringa, S. M., Bouvy, W. H., van denBerg, E., Moll, A. C., Jaap Kappelle, L., Jan Biessels, G. Associations between retinal microvascular changes and dementia, cognitive functioning, and brain imaging abnormalities: a systematic review. J. Cereb. blood flow Metab. 33 (7), 983-995 (2013).
- Ding, J., et al. Diabetic retinopathy and cognitive decline in older people with type 2 diabetes: The Edinburgh type 2 diabetes study. Diabetes. 59 (11), 2883-2889 (2010).
- Parisi, V., Restuccia, R., Fattapposta, F., Mina, C., Bucci, M. G., Pierelli, F. Morphological and functional retinal impairment in Alzheimer's disease patients. Clin. Neurophysiol. 112 (10), 1860-1867 (2001).
- Paquet, C., Boissonnot, M., Roger, F., Dighiero, P., Gil, R., Hugon, J. Abnormal retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Neurosci. Lett. 420 (2), 97-99 (2007).
- Moschos, M. M., et al. Structural and functional impairment of the retina and optic nerve in Alzheimer's disease. Curr. Alzheimer Res. 9 (7), 782-788 (2012).
- Lu, Y., et al. Retinal nerve fiber layer structure abnormalities in early Alzheimer's disease: Evidence in optical coherence tomography. Neurosci. Lett. 480 (1), 69-72 (2010).
- Kesler, A., Vakhapova, V., Korczyn, A. D., Naftaliev, E., Neudorfer, M. Retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Clin. Neurol. Neurosurg. 113 (7), 523-526 (2011).
- Ascaso, F. J., et al. Retinal alterations in mild cognitive impairment and Alzheimer's disease: An optical coherence tomography study. J. Neurol. 261 (8), 1522-1530 (2014).
- Berisha, F., Feke, G. T., Trempe, C. L., McMeel, J. W., Schepens, C. L. Retinal abnormalities in early Alzheimer's disease. Investig. Ophthalmol. Vis. Sci. 48 (5), 2285-2289 (2007).
- Iseri, P. K., Altinaş, O., Tokay, T., Yüksel, N. Relationship between Cognitive Impairment and Retinal Morphological and Visual Functional Abnormalities in Alzheimer Disease. J. Neuro-Ophthalmology. 26 (1), 18-24 (2006).
- Garcia-Martin, E. S., et al. Macular thickness as a potential biomarker of mild Alzheimer's disease. Ophthalmology. 121 (5), 1149-1151 (2014).
- Ko, F., et al. Retinal Nerve Fiber Layer Thinning Associated With Poor Cognitive Function Among A Large Cohort, The Uk Biobank. Alzheimer's Dement. 12 (7), P317-P318 (2016).
- Moreno-Ramos, T., Benito-Leon, J., Villarejo, A., Bermejo-Pareja, F. Retinal nerve fiber layer thinning in dementia associated with Parkinson's disease, dementia with Lewy bodies, and Alzheimer's disease. J. Alzheimers. Dis. 34 (3), 659-664 (2013).
- Moschos, M. M., et al. Morphologic changes and functional retinal impairment in patients with Parkinson disease without visual loss. Eur. J. Ophthalmol. 21 (1), 24-29 (2011).
- Garcia-Martin, E., et al. Ability and reproducibility of Fourier-domain optical coherence tomography to detect retinal nerve fiber layer atrophy in Parkinson's disease. Ophthalmology. 119 (10), 2161-2167 (2012).
- Yip, W., et al. Comparison of Common Retinal Vessel Caliber Measurement Software and a Conversion Algorithm. Transl. Vis. Sci. Technol. 5 (5), 11 (2016).
- Gorelick, P. B., et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association. Stroke. 42 (9), 2672-2713 (2011).
- Brown, W. R., Thore, C. R. Review: Cerebral microvascular pathology in ageing and neurodegeneration. Neuropathol. Appl. Neurobiol. 37 (1), 56-74 (2011).
- DeSilva, T. M., Faraci, F. M. Microvascular Dysfunction and Cognitive Impairment. Cell. Mol. Neurobiol. 36 (2), 241-258 (2016).
- Kalaria, R. N., Akinyemi, R., Ihara, M. Does vascular pathology contribute to Alzheimer changes?. J. Neurol. Sci. 322 (1-2), 141-147 (2012).
- Kling, M. A., Trojanowski, J. Q., Wolk, D. A., Lee, V. M. Y., Arnold, S. E. Vascular disease and dementias: paradigm shifts to drive research in new directions. Alzheimers. Dement. 9 (1), 76-92 (2013).
- O'Brien, J. T., et al. Vascular cognitive impairment. Lancet Neurol. 2 (2), 89-98 (2003).
- Chen, C., et al. Alzheimer's disease with cerebrovascular disease: current status in the Asia-Pacific region. J. Intern. Med. 280 (4), 359-374 (2016).
- Pérez, M. A., Bruce, B. B., Newman, N. J., Biousse, V. The use of retinal photography in nonophthalmic settings and its potential for neurology. Neurologist. 18 (6), 350-355 (2012).
- Boppart, S. A. Optical coherence tomography: Technology and applications for neuroimaging. Psychophysiology. 40 (4), 529-541 (2003).
- Hee, M. R., et al. Optical coherence tomography of the human retina. Arch. Ophthalmol. 113 (3), 325-332 (1995).
- Huang, D., et al. Optical coherence tomography. Science (80-.). 254 (5035), 1178-1181 (1991).
- vanVelthoven, M. E. J., Verbraak, F. D., Yannuzzi, L., Rosen, R. B., Podoleanu, A. G. H., deSmet, M. D. Imaging the retina by en face optical coherence tomography. Retina. 26 (2), 129-136 (2006).
- Costa, R. A., et al. Retinal assessment using optical coherence tomography. Prog. Retin. Eye Res. 25 (3), 325-353 (2006).
- DeBuc, D. C., Somfai, G. M., Ranganathan, S., Tátrai, E., Ferencz, M., Puliafito, C. A. Reliability and reproducibility of macular segmentation using a custom-built optical coherence tomography retinal image analysis software. J. Biomed. Opt. 14 (6), 64023 (2009).
- Budenz, D. L., et al. Determinants of Normal Retinal Nerve Fiber Layer Thickness Measured by Stratus OCT. Ophthalmology. 114 (6), 1046-1052 (2007).
- Leung, C. K. S., et al. Retinal Nerve Fiber Layer Imaging with Spectral-Domain Optical Coherence Tomography: A Prospective Analysis of Age-Related Loss. Ophthalmology. 119 (4), 731-737 (2012).
- Cettomai, D., et al. Reproducibility of optical coherence tomography in multiple sclerosis. Arch. Neurol. 65 (9), 1218-1222 (2008).
- Garcia-Martin, E., Pinilla, I., Idoipe, M., Fuertes, I., Pueyo, V. Intra and interoperator reproducibility of retinal nerve fibre and macular thickness measurements using Cirrus Fourier-domain OCT. Acta Ophthalmol. 89 (1), (2011).
- Garcia-Martin, E., Pueyo, V., Pinilla, I., Ara, J. R., Martin, J., Fernandez, J. Fourier-domain OCT in multiple sclerosis patients: reproducibility and ability to detect retinal nerve fiber layer atrophy. Invest. Ophthalmol. Vis. Sci. 52 (7), 4124-4131 (2011).
- Menke, M. N., Knecht, P., Sturm, V., Dabov, S., Funk, J. Reproducibility of nerve fiber layer thickness measurements using 3D fourier-domain OCT. Invest. Ophthalmol. Vis. Sci. 49 (12), 5386-5391 (2008).
- Mwanza, J. C., et al. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Investig. Ophthalmol. Vis. Sci. 51 (11), 5724-5730 (2010).
- Syc, S. B., et al. Reproducibility of high-resolution optical coherence tomography in multiple sclerosis. Mult Scler. 16 (7), 829-839 (2010).
- Ikram, M. K., Cheung, C. Y., Wong, T. Y., Chen, C. P. L. H. Retinal pathology as biomarker for cognitive impairment and Alzheimer's disease. J. Neurol. Neurosurg. Psychiatry. 83 (9), 917-922 (2012).
- MacGillivray, T. J., Trucco, E., Cameron, J. R., Dhillon, B., Houston, J. G., vanBeek, E. J. R. Retinal imaging as a source of biomarkers for diagnosis, characterization and prognosis of chronic illness or long-term conditions. Br. J. Radiol. 87 (1040), 20130832 (2014).
- Patton, N., et al. Retinal image analysis: Concepts, applications and potential. Prog. Retin. Eye Res. 25 (1), 99-127 (2006).
- McGrory, S., et al. The application of retinal fundus camera imaging in dementia: A systematic review. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 6, 91-107 (2017).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Hardin, J. S., Taibbi, G., Nelson, S. C., Chao, D., Vizzeri, G. Factors Affecting Cirrus-HD OCT Optic Disc Scan Quality: A Review with Case Examples. J. Ophthalmol. 2015, 1-16 (2015).
- Kim, N. R., et al. Influence of Cataract on Time Domain and Spectral Domain Optical Coherence Tomography Retinal Nerve Fiber Layer Measurements. J. Glaucoma. 1, (2010).
- Li, H., et al. Lens opacity and refractive influences on the measurement of retinal vascular fractal dimension. Acta Ophthalmol. 88 (6), e234-e240 (2010).
- Maberley, D., Morris, A., Hay, D., Chang, A., Hall, L., Mandava, N. A comparison of digital retinal image quality among photographers with different levels of training using a non-mydriatic fundus camera. Ophthalmic Epidemiol. 11 (3), 191-197 (2004).
- Rochtchina, E., Wang, J. J., Taylor, B., Wong, T. Y., Mitchell, P. Ethnic variability in retinal vessel caliber: A potential source of measurement error from ocular pigmentation?-The Sydney childhood eye study. Investig. Ophthalmol. Vis. Sci. 49 (4), 1362-1366 (2008).
- Wainwright, A., et al. Effect of image quality, color, and format on the measurement of retinal vascular fractal dimension. Investig. Ophthalmol. Vis. Sci. 51 (11), 5525-5529 (2010).
- Nguyen, T. T., Wong, T. Y. Retinal vascular manifestations of metabolic disorders. Trends Endocrinol. Metab. 17 (7), 262-268 (2006).
- Ding, J., et al. Retinal vascular caliber and the development of hypertension: a meta-analysis of individual participant data. J. Hypertens. 32 (2), 207-215 (2014).
- Nguyen, T. T., Wong, T. Y. Retinal vascular changes and diabetic retinopathy. Curr. Diab. Rep. 9 (4), 277-283 (2009).
- Leung, C. K. S., Ye, C., Weinreb, R. N., Yu, M., Lai, G., Lam, D. S. Impact of Age-related Change of Retinal Nerve Fiber Layer and Macular Thicknesses on Evaluation of Glaucoma Progression. Ophthalmology. 120 (12), 2485-2492 (2013).
- Sherry, L. M., et al. Reliability of computer-assisted retinal vessel measurement in a population. Clin. Experiment. Ophthalmol. 30 (3), 179-182 (2002).
- Wardlaw, J. M., et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 12 (8), 822-838 (2013).
- Patton, N., Aslam, T., MacGillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: A rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- Ferri, C. P., et al. Global prevalence of dementia: A Delphi consensus study. Lancet. 366 (9503), 2112-2117 (2005).
- Sahadevan, S., et al. Ethnic differences in Singapore's dementia prevalence: The stroke, Parkinson's disease, epilepsy, and dementia in Singapore study. J. Am. Geriatr. Soc. 56 (11), 2061-2068 (2008).
- Kernt, M., et al. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy (Optomap) compared with ETDRS 7-field stereo photography. Diabetes Care. 35 (12), 2459-2463 (2012).
- Manivannan, A., Plskova, J., Farrow, A., Mckay, S., Sharp, P. F., Forrester, J. V. Ultra-wide-field fluorescein angiography of the ocular fundus. Am. J. Ophthalmol. 140 (3), 525-527 (2005).
- Pellegrini, E., et al. Blood vessel segmentation and width estimation in ultra-wide field scanning laser ophthalmoscopy. Biomed. Opt. Express. 5 (12), 4329 (2014).
- Estrada, R., Tomasi, C., Schmidler, S. C., Farsiu, S. Tree topology estimation. IEEE Trans. Pattern Anal. Mach. Intell. 37 (8), 1688-1701 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。