Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование сетчатки изображений для изучения деменция
В этой статье
Резюме
Сетчатка разделяет видно сходство с мозгом и таким образом представляет собой уникальный окно неинвазивно учиться сосудистую и структуру нейронов в головном мозге. Этот протокол описывает метод для изучения слабоумие, используя сетчатки методы визуализации. Этот метод может потенциально помочь в диагностике и оценке рисков слабоумия.
Аннотация
Сетчатки предлагает уникальный «окна» для изучения патофизиологических процессов деменции в головном мозге, как она является продолжением центральной нервной системы (ЦНС) и разделяет видно сходство с мозгом с точки зрения эмбрионального происхождения, анатомические особенности и физиологические свойства. Сосудистой и нейрональных структура в сетчатке теперь может быть легко визуализировать и неинвазивным используя сетчатки методы визуализации, включая Фундус фотография и оптическая когерентная томография (Окт) и количественно полу-автоматически с помощью компьютерный анализ программ. Изучение ассоциации между сосудистой и нейрональных изменения в сетчатке и слабоумие может улучшить наше понимание деменции и, потенциально, помощь в диагностике и оценке риска. Этот протокол направлен на описать метод количественной оценки и анализа сетчатки сосудистую и нейронные структуры, которые потенциально связаны с деменцией. Этот протокол также предоставляет примеры сетчатки изменений по предметам с деменцией и обсуждаются технические вопросы и текущих ограничений сетчатки изображений.
Введение
Ввиду увеличения продолжительности жизни деменция стал серьезной медицинской проблемой, способствуют значительные социальные и экономического здоровья бремени глобально1,-2,-3,-4,-5. Сегодня человек в Соединенных Штатах развивается болезнь Альцгеймера (AD), наиболее распространенной формой слабоумия, каждый 66 s6. Было подсчитано, что к 2050 году, 115 миллионов человек будут затронуты AD7.
Сетчатки предлагает уникальный «окна» для изучения деменцией вследствие его же анатомические и физиологические свойства с мозгом. С точки зрения сосудистую сетчатки артериол и венул, измерения 100 до 300 мкм в диаметре, разделяют сходные черты с малых сосудов головного мозга, таких как конец артериол без анастомозов, барьерные функции и авто регулирование8, 9. с точки зрения структуры нейронов, ганглиозных клеток сетчатки (РГК) доля типичные свойства с нейронов в центральной нервной системе (ЦНС) 10. РГК видное место связаны с мозга, как они формируют зрительного нерва и проект визуальные сигналы от сетчатки боковых ядер коленчатые и четверохолмия. Зрительного нерва, похож на много волокон нейронов в ЦНС, Миелинизированные, олигодендроциты и периваскулярными менингеальные слоями. В частности, оскорбление для зрительного нерва может привести в аналогичные ответы, наблюдается в других аксоны ЦНС, такие как Ретроградная и антероградная дегенерация аксона, рубцов, разрушение миелиновой, вторичной дегенерации и ненормальным уровня нейротрофических факторы и нейромедиаторов11,12,,1314. Внешний вид визуальных симптомы у некоторых больных ад может быть объяснено надежной связи между сетчатки и мозга15,16. В результате было предложено, что сетчатки может отражать патологических процессов слабоумия в головном мозге и сетчатки изображений может использоваться для изучения слабоумия.
Сетчатки сосудистую и нейронные структуры теперь могут быть визуализированы неинвазивно используя сетчатки методы визуализации. К примеру фотографии сетчатки глазного дна может быть захвачен с помощью фундус-камеры, и характеристики сетчатки сосудистую (например, судно калибр, извилистость и фрактальной аспект) затем могут быть количественно с помощью компьютерного анализа программы. Кроме того параметры сетчатки нейронные структуры (например, толщина ганглия клеток внутренний сплетениевидный слой [GC-IPL] и слой сетчатки нервных волокон [RNFL]) также может быть измерена с помощью оптическая когерентная томография (Окт) и количественно с помощью встроенной алгоритмы анализа.
С учетом важности сетчатки изображений для изучения слабоумие этот протокол стремится описать метод обработки изображений и анализа сетчатки сосудистую и нейронные структуры в естественных условиях с использованием сетчатки методы визуализации. Этот протокол также предоставляет примеры сетчатки изменений по предметам с деменцией и обсуждаются технические вопросы и текущих ограничений сетчатки изображений.
протокол
все методы, описанные здесь были одобрены Комитет по этике местных клинических исследований в Гонконге.
Примечание: для простоты, оборудование, перечисленное в Таблице материалов используется для иллюстрации процедуры сетчатки изображений и последующего анализа. Измерение параметров сетчатки сосудистого иллюстрируется с помощью Сингапур I судно оценки программы (SIVA) 17 (версии 4.0, Национальный университет Сингапура, Сингапур). Однако, следует отметить, что другой набор оборудования может быть принят как основополагающие принципы остаются аналогичными.
1. подготовить вопросы для сетчатки Imaging
- расширяются субъектов ’ учащихся, с помощью Мидриатическая агента. Подождите, по крайней мере 15 минут установить достаточно дилатация зрачка.
2. Измерить сетчатки сосудистого параметров от глазного дна фотографии с помощью программы компьютерного анализа
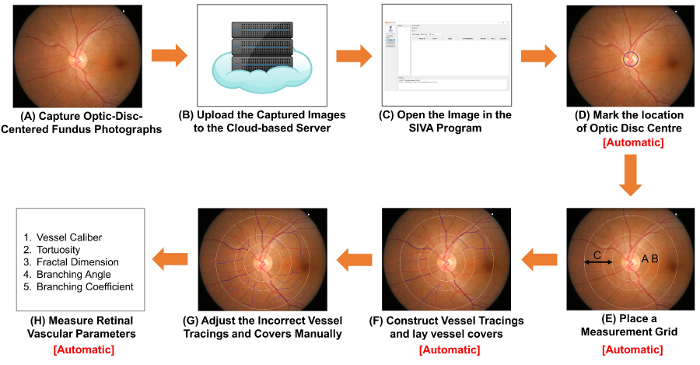
на рисунке 1: Схематическая диаграмма, показывающая процедур измерения сетчатки сосудистого параметров. (A) получать фотографии оптический диск ориентированного глазного дна с помощью фундус-камера. Рисунок 1A и 2A рисунок являются две фотографии глазного дна с оптимальным качеством. (B) загрузить фотографии глазного дна на облаке сервер и введите детали соответствующих исследований, включая фактор преобразования изображения (ICF). Другие программы компьютерного анализа могут использовать методы на основе облака для Организации и хранения изображений. (C) открыть Фундус фотография в программе автоматизированного анализа. Марк расположение центр диска зрительного нерва (D) и (E) запрашивать программное обеспечение для автоматического обнаружения обода диска зрительного нерва и место измерения сетку. (F) конструкции судна Прориси основанный на пути судна и заложить судна покрывает оценить диаметры судов. (G) отрегулируйте Прориси неправильный судно и судно охватывает вручную. (H) мера в спектре сетчатки сосудистого параметров, включая судно калибров, извилистость, фрактальная размерность и бифуркации. (D) шаг к шагу (F) и шаг (H) может выполняться автоматически некоторыми программами компьютерного анализа. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Захватить фотографии глазного дна с помощью фундус камеру.
- Поворот на фундус камеру и запуска образов программы на компьютере. Отдых подбородок предмета правильно на chinrest с лоб от головы ремень. Переместите рычаг управления для выравнивания луч света должным образом к теме ’ учеником ф.
- Выравнивание точки освещения до тех пор, пока оба появляются маленькие с обеих сторон в видоискателе. Переместить целевой внешней фиксации для руководства субъекта ’ s глаза до тех пор, пока диск зрительного нерва находится в центре видоискателя и регионы интереса (ROI) являются хорошо в пределах границ. Отрегулируйте ручку фокусировки сосредоточиться на сетчатке.
- С темой твердо взглянуть на цели внешней фиксации и обеспечить предметом ’ s глаза не наполнились слезами.
- Отожмите кнопку затвора, чтобы захватить изображение ( рис. 1A).
- Проверить качество Фундус фотография захватили, используя рисунок 2A в качестве стандарта. Удалить изображение и повторите процесс приобретения изображения (т.е., шаг 2.1.1 для 2.1.4) если ученик плохо расширены ( рис. 2B), диск зрительного нерва находится не в центре изображения ( рис. 2 c), или изображение находится не в фокусе ( Рисунок 2D).
- Сохранить изображение в формате TIFF с градуированное резолюции (то есть, примерно 3000 x 2,000 пикселей, в более чем 150 dpi).
Примечание: Протокол может быть приостановлена здесь. - Повторите шаги 2.1.1 для 2.1.6 приобрести фотографии глазного дна для других субъектов.
- Случайным образом выбрать 10% выборки изображений и измерить высоту оптических дисков на этих изображениях ( рис. 3). Вычислить коэффициент преобразования изображения (ICF), используя формулу:
МКФ = 1800 мкм / (средняя высота пикселей оптических дисков изображений пробы). - Загрузить фотографии захватили глазного дна на облаке сервер и введите детали соответствующих исследований, включая фактор преобразования изображения (ICF) ( рис. 1B).
Примечание: Протокол может быть приостановлена здесь. Другие программы компьютерного анализа может использовать другие методы на основе облака для Организации изображения и записывать ICF.
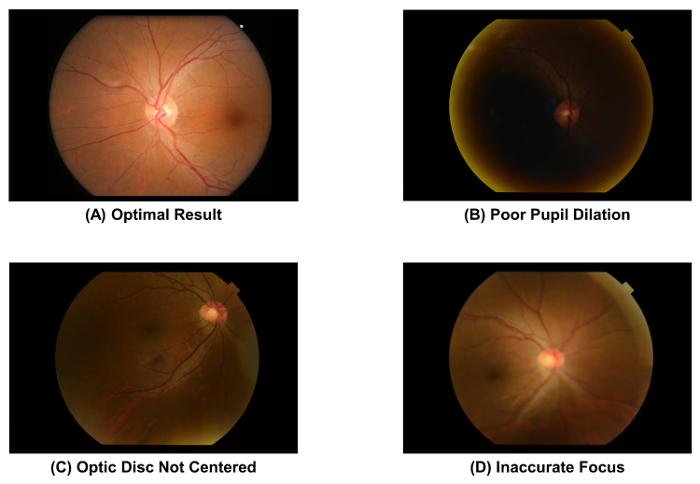
Рисунок 2: фотографии глазного дна с оптимальным и оптимальным качеством. Качество изображения Фундус фотография должна проверяться сразу же после захвата изображений, как качество изображения непосредственно влияет на последующее измерение сетчатки сосудистого параметров. Изображение должно быть отброшено, если один из этих артефактов наблюдается. Эти изображения были получены с помощью фундус-Камера 50°. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
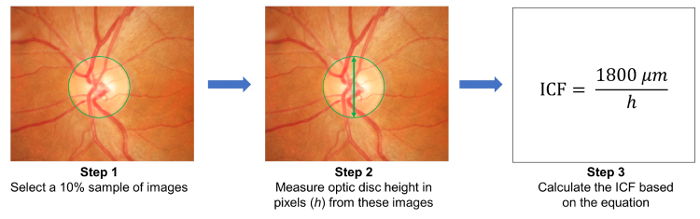
Рисунок 3: расчет коэффициента преобразования изображения (ICF). Чтобы вычислить ICF, случайным образом выберите 10% выборки изображений из исследования (шаг 1). Затем Измерьте высоту оптических дисков из изображения (в пикселах) пробы (шаг 2). Рассчитать ICF, используя формулу: ICF = 1800 мкм / (средняя высота пикселей оптических дисков выборку изображений), где 1800 мкм — приблизительно высоту нормального диска зрительного нерва (шаг 3). Как увеличение эффекта и изображения резолюции отличается от модели камеры, необходимо рассчитать точную ICF для каждой камеры используется. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Открыть Фундус фотография в компьютерный анализ программы. Построить судно Прориси и заложить судно обложки для сетчатки сосудистую.
Примечание: В этом разделе, Сива программа используется для иллюстрации процедуры. Однако программа Шива могут быть заменены другими программами компьютерного анализа. Кроме того, автоматически выполняются шаги 2.2.2 для 2.2.3 путем анализа некоторых компьютерных программ когда Фундус фотография открыт (т.е. шаг 2.2.1).- Открыть Фундус фотография с программой автоматизированного анализа ( рис. 1 c).
- Марк местоположение центра диска зрительного нерва ( рис. 1 d).
- Нажмите “ од центра ” кнопку на панели функции left; курсор мыши будет заменен на зеленый круг.
- Перейти зеленый кружок в центре диска зрительного нерва (OD) и нажмите левую кнопку исправить круг.
- Запрашивать программное обеспечение автоматически место измерения сетки, построить судно Прориси и Лаy судна покрывает ( Рисунок 1E и 1F).
Примечание: Судно крышки являются измерительные линии, которые оценивают приблизительную ширину внутреннего люмен судов.- Нажмите “ найти ОД ” кнопку запрашивать программное обеспечение для обнаружения ОД ОПРАВЫ и место четыре концентрические круги как grid измерения, основанные на положении од центра.
- Нажмите “ процесс ” кнопку, чтобы инициировать процесс трассировки автоматического корабля.
- Коррекция неправильного судно Прориси вручную. Начать осмотр с 12 o ’ часы позиции по часовой стрелке образом, убедитесь, что проверены все судно Прориси.
- Убедитесь, что диск зрительного нерва точно обнаружен и правильно размещен grid измерения. Настроить сетку измерения вручную следующие шаги 2.2.2 для 2.2.3, если внутренний круг не точно изложить обода диска зрительного нерва ( рис. 4A).
- Щелкните левой кнопкой мыши, чтобы выбрать судно tracing(s) помечены неправильно судно типа (артериол и венул) и нажмите “ тип судна (T) ” кнопку, чтобы изменить тип судна.
Примечание: Артериол, помечены красным и синим цветом помечены венулы. Артериолы можно отличить от венулы, основанный на их физиологические различия. К примеру венулы, как правило, темне в цвете и шире, чем артериол. Судов с одного судна типа обычно не пересекаются друг с другом.
Прориси неполной судна продлить - следующие шаги 2.3.3.1 для 2.3.3.2 ( Рисунок 4B).
- Использование курсора нажать на дистальном конце трассировки неполной судна. Щелкните левой кнопкой мыши, в точках вдоль пути судна продлить судна трассировки.
- Остановить процесс трассировки при достижении конца судна. Остановить трассировку на outermost белый круг, если дистальной частью судна выходит за пределы измерения сетки (см. рис. 4B).
- Настроить Прориси судна, если пути судна не прослеживаются правильно на сайте кроссовер ( рис. 4 c).
- Выберите “ выберите ” кнопку и нажмите на неправильные точки трассировки судна. Нажмите кнопку “ Brea(k) Seg ” кнопка для отключения трассировки судна в момент выбран. Выберите сегмент, отключен и нажмите кнопку “ (Del) Seg ” кнопку, чтобы удалить его
- Повторно построить новое судно трассировки с помощью шаги 2.3.3.1 и 2.3.3.2.
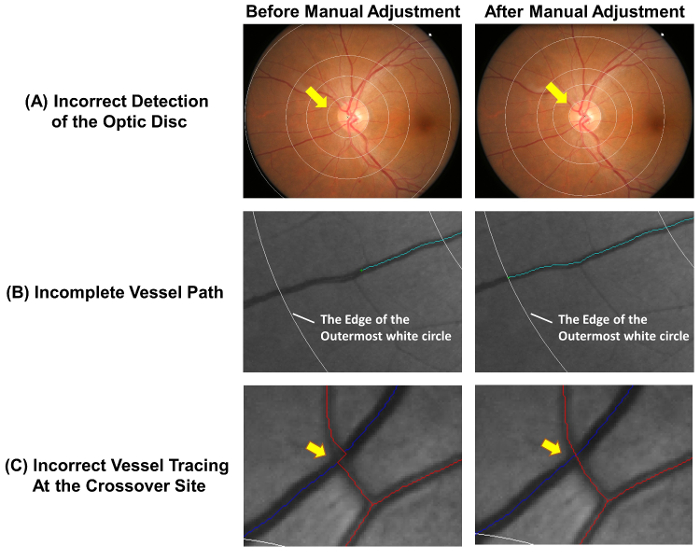
Рисунок 4: распространенные ошибки auto-трассировки. Автоматическое судно трассировки не вполне точны и ручной корректировки необходимы для обеспечения точности измерений. Эта цифра показывает общие ошибки auto-трассировки и демонстрирует оптимальные результаты после ручной корректировки. (A) центр диска зрительного нерва неправильно помечен и это приведет к отклонению измерения сетки, которые могут повлиять на последующие измерения. В идеале внутренний круг сетки измерения следует изложить обода диска зрительного нерва. (B) неполной судно трассировки может привести к неправильной измерения фрактальной размерности, извилистость и т.д., которые путь судно должно быть прослежены до конца судна. Если дистальной частью судна падает вне сетки измерения, отслеживания могут быть остановлены на outermost белый круг. (C) судно Прориси на кроссовер сайты подвергаются более высокой тенденция ошибки и таким образом требуют особого внимания. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- заложить охватывает судна на всех сегментах судна и вручную отключить неправильный охватывает.
- Нажмите “ найти охватывает ” кнопку, чтобы заложить охватывает судна на всех сегментах судна автоматически.
- Проверить, если все судно охватывает правильно установлены. Щелкните левой кнопкой мыши и перетащите курсор, чтобы отключить судна покрывает если обложки не заложен перпендикулярно к стенкам сосуда ( Рисунок 5A), путь корабля заслоняется другого судна ( Рисунок 5B), или охватывает переоценить или недооценивать ширины просвета сосуда ( рис. 5 c).
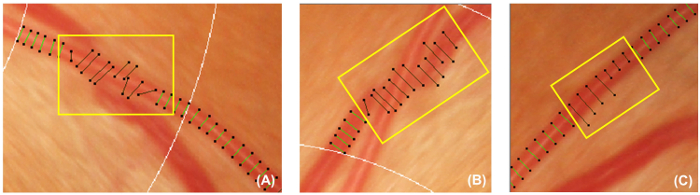
Рисунок 5: неправильный судна покрывает. Эта цифра показывает примеры неправильного судно крышек, которые должны быть отключены и исключены из последующих измерений. Охватывает судна следует отключить, если они не перпендикулярно судов (A). Кроме того судно охватывает также следует отключить, если судно трассируемого скрыта под другого судна (B), или крышки судно не может представлять приблизительную ширину судна (C). пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- измерения сетчатки сосудистого параметров от Прориси судно и судно охватывает
Примечание: шаг 2,5 выполняется автоматически с помощью программы компьютерного анализа. Диаметры- Метка диска площадь 0.5-1.0 от поля диска зрительного нерва как зона B и площадь 0.5-2.0 диск диаметром от поля диска зрительного нерва как зона C 18 ( рис. 6А), согласно измененный Протокол риска атеросклероза в общинах (АРИК) изучение 19.
- Мера сетчатки сосудистого калибр из зоны B и зоны C, используя метод широко принята, который изменяется от АРИК исследования 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 ( Рисунок 6B).
- Измерения длины судна покрывает в шести крупнейших артериол и шести крупнейших венулы оценить сетчатки судно калибров.
- Кратко артериол сетчатки и venular калибра как эквивалент центральной артерии сетчатки (CRAE) и Центральной сетчатки вен эквивалент (CRVE) соответственно 17, используя пересмотренный Knudtson – формула Парр-Хаббард 18 , 19.
- идентифицировать всех судов в зоне C с Ширина > 40 µm. вычислить сетчатки артериол и venular извилистость от integral полная кривизна клетку вдоль судна Прориси и нормализовать значения с длиной всего дуги, кланяясь и точки перегиба 27 , 28.
- Вычисления всего артериол, и venular фрактальной размеры от зоны C, с использованием установленных “ коробки подсчитывая метод ” 29 , 30 , 31.
- Разделить изображение на серии одинаково размера квадратов.
- Количество коробок, содержащих часть судна Прориси.
- Повторить этот процесс, с помощью серии одинаково размера квадратов с разными размерами.
- Участок логарифм числа коробки, содержащие Прориси судна против логарифм размера коробки и вычислить наклон линии результате; это фрактальной размерности.
- Идентификации судов с первого бифуркации в зоне C и вычисления углов (θ) Апертура между первых двух дочь судов 32 ( рис. 6 c). Вычислить среднее значение для получения средний угол ветвления.
- Вычислить коэффициент ветвления от зоны C, используя формулу:
(d 1 2 + d 2 2) / d 0 2, где d 0 представляет средний ствол калибра, и d 1 и d 2 среднее отделение калибров ( рис. 6 c).
- Закрыть окно сортировки. Нажмите кнопку “ отправить ” в всплывающее диалоговое окно Загрузить градуированных изображений на сервер на основе облака и записывать автоматически измеряемые параметры сетчатки сосудистого.
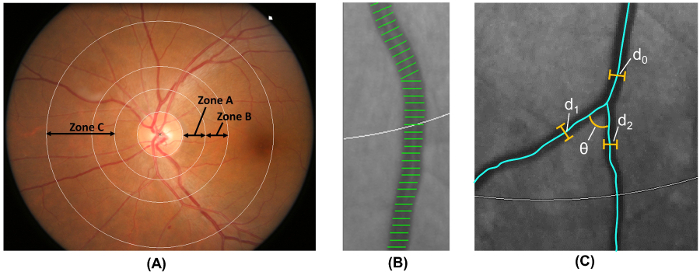
Рисунок 6: количественная оценка сетчатки сосудистую. (A) зона B (определяется как 0.5-1.0 диск диаметром от поля диска) используется для измерения судно калибров зоны B согласно риск атеросклероза в исследовании общин. Зона C (определяется как 0.5-2.0 диск диаметром от поля диска) используется для измерения судно калибров зоны C и спектр сетчатки сосудистого сетевых параметров (например, извилистость, фрактальная размерность и бифуркации). (B) охватывает судна являются измерения линий, используемых для оценки калибров сетчатки судна (или диаметра). Покрывает неправильное судна должны быть вручную исключены из измерения. (C) для всех судов, которые имеют их первый бифуркации в пределах зоны C, программа автоматически измеряет ветвления углов (θ) первого бифуркации. Кроме того, также ветвления коэффициент рассчитывается по формуле: ветвления коэффициент = (d 1 2 + d 2 2) / d 0 2, где d 0 представляет калибр ствола и d 1 и d 2 являются филиал калибров. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
3. оценить толщину GC-IPL и RNFL
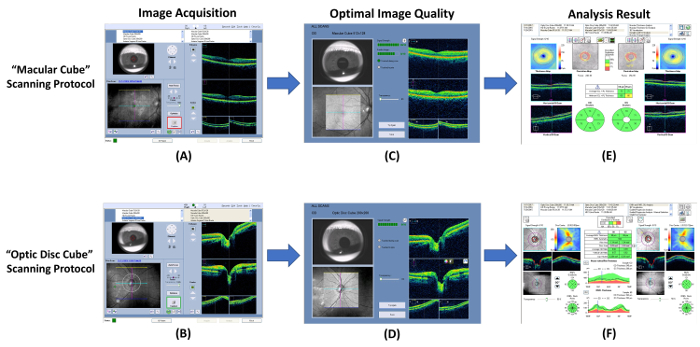
Рисунок 7: Схематическая диаграмма, показывающая процедуры измерения толщины RNFL и GC-IPL. Оптическая когерентная томография (Окт) может использоваться для измерения толщины ганглия клеток внутренний сплетениевидный слой (GC-IPL) и слой сетчатки нервных волокон (RNFL). (A, B) Измерение толщины GC-IPL и RNFL, с помощью встроенной “ макулярной куб ” и “ диска зрительного нерва куб ” сканирование протоколы соответственно. (C, D) Проверите качество изображения сразу после захвата изображений. Удалить изображение и повторите сканирование, если сила сигнала меньше, чем 6, или обнаружены артефакты движения. (E, F) Затем запрашивать встроенную анализ программы автоматически анализировать результат сканирования и создания отчета для интерпретации. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Выполнить получение изображения с помощью оптическая когерентная томография (Окт).
- Откройте OCT программу и выберите “ макулярной куб ” сканирование протокол для начала нового макулярной сканирования ( рис. 7A).
- Найти ученика в видовом экране Ирис, регулируя chinrest. Снижение освещенности, если ученик размер слишком мал.
- Нажмите “ Auto Focus ” кнопку и затем “ оптимизировать ” кнопку для улучшения качества изображения.
- Поручить тему мигает несколько раз непосредственно перед началом сканирования.
- Нажмите “ захват ” кнопку, чтобы начать проверку, когда границы вокруг кнопки становится зеленым. Поручить тему сосредоточиться на целевой визуальный фиксации во время захвата изображений во избежание движение артефакты.
- Обзор качество сканирования, используя Рисунок 7 c как стандарт. Отменить результат сканирования и повторите сканирование, если сила сигнала меньше, чем 6 ( рис. 8A), или обнаружении артефакты движения (обозначается разрыва кровеносных сосудов) ( Рисунок 8B).
- Сохранить результат сканирования.
- Повторите шаги 3.1.1 для 3.1.7 для другой глаз.
- Выполнить проверку головы зрительного нерва с “ оптический диск куб ” сканирование протокол следующие шаги 3.1.2 для 3.1.9 ( цифры 7B и 7 D).

Рисунок 8: югу оптимальные результаты оптическая когерентная томография. Общие югу оптимальные результаты оптическая когерентная томография (Окт) включают в себя (A) бедных сигнала (значение прочности < 6) и артефакты движения (B). Качество сканирования следует пересмотреть сразу же после захвата изображений, и сканирования следует повторить, если встречаются эти артефакты. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- создать распечатку анализа толщины макулярной GC-IPL.
- Выберите “ макулярной куб ” проверять записи обоих глаз в интерфейсе анализа.
- Нажмите “ анализ OU клеток ганглия ” начать алгоритм автоматического анализа для оценки толщины GC-IPL сканирования ( рис. 7е).
Примечание: Шаг 3.2.2 алгоритм анализа автоматически завершается.- Генерировать 14.13 мм 2 фовеа в центре эллиптической кольце, имеющий горизонтальный внутренний и внешний радиусы 0,6 мм и 2,4 мм, соответственно и вертикальный внутренний и внешний радиусы 0,5 мм и 2.0 мм, соответственно.
Примечание: Размер и форма эллиптической кольце тесно соответствовать макулярной анатомии и таким образом соответствуют области, где РГК толстой в нормальный глаз 33 , 34. Область в пределах внутреннего кольца кольце не измеряется, как GC-IPL в этой области является очень тонкой. - Сегмент внешняя граница RNFL и внешняя граница внутренний сплетениевидный слой (IPL), чтобы найти GC-IPL ( рис. 9).
- Измерения среднего, минимального и шесть секторальных (Улучшенный, superotemporal, superonasal, inferonasal, уступает, нижневисочной) толщины макулярной GC-IPL в фовеа ЕКСленным эллиптической кольце.
- Сравнения измеряемой толщины GC-IPL на устройство ’ s внутренней нормативной возраст согласованной базы данных и генерировать отклонение карту и карту значение
- Доклад результаты измерений на распечатку анализа.
- Генерировать 14.13 мм 2 фовеа в центре эллиптической кольце, имеющий горизонтальный внутренний и внешний радиусы 0,6 мм и 2,4 мм, соответственно и вертикальный внутренний и внешний радиусы 0,5 мм и 2.0 мм, соответственно.
- Сохранить распечатку анализа в формате .pdf.
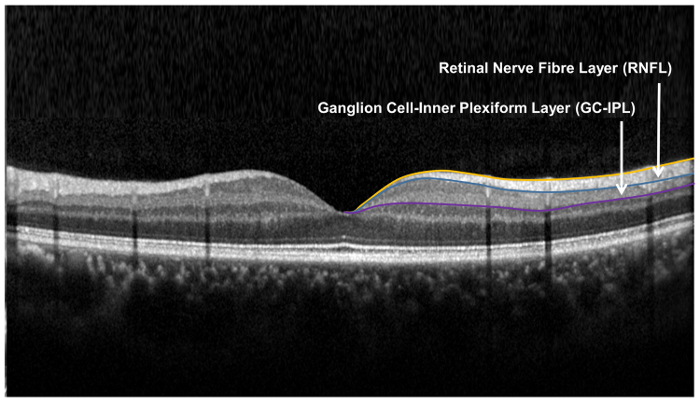
Рисунок 9: слоях сетчатки, используется для Оценка структуры сетчатки нейрональных. Слой сетчатки нервных волокон (RNFL) измеряется с помощью алгоритма зрительного нерва головы (БЕЙКЕ), в то время как ганглия клеток внутренний сплетениевидный слой измеряется с помощью алгоритма анализа (ВКА) клеток ганглия. Алгоритм БЕЙКЕ сегменты внутренней и внешней границы RNFL для измерения толщины RNFL. GCA алгоритм обнаруживает внешние границы слой сетчатки нервных волокон (RNFL) и внутренний сплетениевидный слой (IPL) приносить комбинированных толщина слоя ганглия клеток (GCL) и IPL. Толщины GCL и IPL измеряются вместе, как анатомически нечеткие границы между GCL и IPL. Однако, комбинированные толщина GCL и IPL (т.е. GC-IPL) по-прежнему свидетельствует о здоровье РГК. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этого Рисунок.
- создать распечатку анализа толщины RNFL ( Рисунок 7F).
- Выберите “ оптический диск куб ” проверять записи обоих глаз в интерфейсе анализа.
- Нажмите “ БЕЙКЕ и анализ OU RNFL ” начать алгоритм автоматического анализа для оценки RNFL толщина сканирования.
Примечание: 3.3.2.1 с 3.3.2.6 может быть автоматически шагов алгоритмом анализа.- Измерения толщины RNFL в каждой точке сканирования и создать карту толщина RNFL.
- Идентификация диска зрительного нерва, обнаруживая темное пятно в центре сканирования, который имеет размер и форму, в соответствии с диапазоном оптический диск
- Позиция измерения сетку 3.46 мм в диаметре вокруг диска зрительного нерва на карте толщиной RNFL.
- Мера и рассчитать глобальной, четыре квадранта (временной, Улучшенный, носовой и хуже) и 12 будильник часовой parapapillary RNFL толщины измерения сетки.
- Сравнения измеряемой толщины RNFL на устройство ’ s внутренней нормативной возраст согласованной базы данных и генерировать отклонение карту и карту значение.
- Доклад результаты измерений на распечатку анализа.
- Сохранить распечатку анализа в формате .pdf.
Результаты
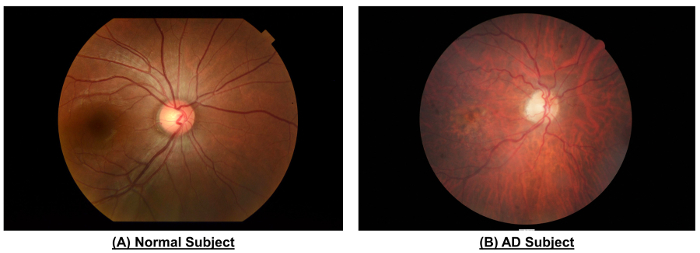
Рисунок 10: Пример, чтобы показать различия в сетчатки сосудистую между нормальным вопросом и предметом AD. По сравнению с нормальным вопросом, Фундус фотография объявление темы показали более узк?...
Обсуждение
Этот протокол описывает процедуры количественного нейронов и сосудистые изменения в сетчатке в естественных условиях. Как сетчатки разделяет аналогичные эмбрионального происхождения, анатомические особенности и физиологические свойства с мозгом, эти изменения сетчатки могут ?...
Раскрытие информации
Мы хотели бы выразить нашу признательность школа Computing, Национальный университет Сингапура для технической поддержки.
Благодарности
Что касается потенциальных финансовых связей автор Тянь ю. Вонг является соизобретателем программы оценки судно Сингапур I (SIVA), используемый в этой статье.
Материалы
| Name | Company | Catalog Number | Comments |
| Non-mydriatic Retinal Camera | Topcon, Inc, Tokyo, Japan | TRC 50DX | N/A |
| Singapore I Vessel Assessment Program | National University of Singapore | Version 4.0 | N/A |
| CIRRUS HD-OCT | Carl Zeiss Meditec, Inc, Dublin, CA | Model 4000 | N/A |
| Mydriatic Agents | N/A | N/A | Prepared from 1% tropicamide and 2.5% phenylephrine hydrochloride |
Ссылки
- Alzheimer's Disease International. The prevalence of dementia worldwide. Alzheimer's Dis. Int. (December), 1-2 (2008).
- Wimo, A., Winblad, B., &Jönsson, L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimer's Dement. 6 (2), 98-103 (2010).
- Comas-Herrera, A., Northey, S., Wittenberg, R., Knapp, M., Bhattacharyya, S., Burns, A. Future costs of dementia-related long-term care: exploring future scenarios. Int. Psychogeriatr. 23 (1), 20-30 (2011).
- Alzheimer's Association. Alzheimer's disease facts and figures. Alzheimer's Dement. 10 (2), e47-e92 (2014).
- Prince, M., Bryce, R., Albanese, E., Wimo, A., Ribeiro, W., Ferri, C. P. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers. Dement. 9 (1), 63-75 (2013).
- Alzheimer's Association. 2016 Alzheimer's disease facts and figures. Alzheimer's Dement. 12 (4), 459-509 (2016).
- Asih, P. R., Chatterjee, P., Verdile, G., Gupta, V. B., Trengove, R. D., Martins, R. N. Clearing the amyloid in Alzheimer's: progress towards earlier diagnosis and effective treatments - an update for clinicians. Neurodegener. Dis. Manag. 4 (5), 363-378 (2014).
- Cheung, C. Y., Ikram, M. K., Chen, C., Wong, T. Y. Imaging retina to study dementia and stroke. Prog. Retin. Eye Res. , (2017).
- Patton, N., Aslam, T., Macgillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: a rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nat. Rev. Neurol. 9 (1), 44-53 (2013).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Levkovitch-Verbin, H., Quigley, H. A., Kerrigan-Baumrind, L. A., D'Anna, S. A., Kerrigan, D., Pease, M. E. Optic nerve transection in monkeys may result in secondary degeneration of retinal ganglion cells. Investig. Ophthalmol. Vis. Sci. 42 (5), 975-982 (2001).
- Levkovitch-Verbin, H., Quigley, H. A., Martin, K. R., Zack, D. J., Pease, M. E., Valenta, D. F. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Sadun, A. A., Borchert, M., DeVita, E., Hinton, D. R., Bassi, C. J. Assessment of Visual Impairment in Patients With Alzheimer's Disease. Am. J. Ophthalmol. 104 (2), 113-120 (1987).
- Schlotterer, G., Moscovitch, M., Crapper-Mclachlan, D. Visual processing deficits as assessed by spatial frequency contrast sensitivity and backward masking in normal ageing and alzheimer's. Brain. 107 (1), 309-324 (1984).
- Cheung, C. Y. L., et al. A new method to measure peripheral retinal vascular caliber over an extended area. Microcirculation. 17 (7), 495-503 (2010).
- Knudtson, M. D., Lee, K. E., Hubbard, L. D., Wong, T. Y., Klein, R., Klein, B. E. K. Revised formulas for summarizing retinal vessel diameters. Curr. Eye Res. 27 (3), 143-149 (2003).
- Hubbard, L. D., et al. Methods for evaluation of retinal microvascular abnormalities associated with hypertension/sclerosis in the Atherosclerosis Risk in Communities Study. Ophthalmology. 106 (12), 2269-2280 (1999).
- Patton, N., et al. The association between retinal vascular network geometry and cognitive ability in an elderly population. Investig. Ophthalmol. Vis. Sci. 48 (5), 1995-2000 (2007).
- VanHecke, M. V., et al. Are retinal microvascular abnormalities associated with large artery endothelial dysfunction and intima-media thickness? The Hoorn Study. Clin. Sci. London Engl. 110 (5), 597-604 (2006).
- Tien, Y. W., et al. Retinal vascular caliber, cardiovascular risk factors, and inflammation: The Multi-Ethnic Study of Atherosclerosis (MESA). Investig. Ophthalmol. Vis. Sci. 47 (6), 2341-2350 (2006).
- Leung, H., et al. Relationships between age, blood pressure, and retinal vessel diameters in an older population. Investig. Ophthalmol. Vis. Sci. 44 (7), 2900-2904 (2003).
- Wong, T. Y., et al. The prevalence and risk factors of retinal microvascular abnormalities in older persons: The cardiovascular health study. Ophthalmology. 110 (4), 658-666 (2003).
- Ikram, M. K., et al. Retinal vessel diameters and risk of stroke: The Rotterdam Study. Neurology. 66 (9), 1339-1343 (2006).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: Methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Sasongko, M. B., et al. Alterations in retinal microvascular geometry in young type 1 diabetes. Diabetes Care. 33 (6), 1331-1336 (2010).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Mainster, M. a The fractal properties of retinal vessels: embryological and clinical implications. Eye. 4 ( Pt 1) (1), 235-241 (1990).
- Liew, G., et al. The Retinal Vasculature as a Fractal: Methodology, Reliability, and Relationship to Blood Pressure. Ophthalmology. 115 (11), (2008).
- Stosic, T., Stosic, B. D. Multifractal analysis of human retinal vessels. IEEE Trans. Med. Imaging. 25 (8), 1101-1107 (2006).
- Zamir, M., Medeiros, J. A., Cunningham, T. K. &. a. m. p. ;. M., Zamir, J. A., Medeiros, T. K. C. Arterial bifurcations in the human retina. J. Gen. Physiol. 74 (4), 537-548 (1979).
- Mwanza, J. C., Oakley, J. D., Budenz, D. L., Chang, R. T., Knight, O. J., Feuer, W. J. Macular ganglion cell-inner plexiform layer: Automated detection and thickness reproducibility with spectral domain-optical coherence tomography in glaucoma. Investig. Ophthalmol. Vis. Sci. 52 (11), 8323-8329 (2011).
- Bendschneider, D., et al. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J. Glaucoma. 19 (7), 475-482 (2010).
- Cheung, C. Y., Ong, Y. T., Ikram, M. K., Chen, C., Wong, T. Y. Retinal Microvasculature in Alzheimer's Disease. J. Alzheimer's Dis. 42 (s4), S339-S352 (2014).
- Murray, C. D. THE PHYSIOLOGICAL PRINCIPLE OF MINIMUM WORK APPLIED TO THE ANGLE OF BRANCHING OF ARTERIES. J. Gen. Physiol. (4), 835-841 (1926).
- Ding, J., et al. Early retinal arteriolar changes and peripheral neuropathy in diabetes. Diabetes Care. 35 (5), 1098-1104 (2012).
- Yim, C., et al. Retinal Ganglion Cell Analysis Using High-Definition Optical Coherence Tomography in Patients with Mild Cognitive Impairment and Alzheimer's Disease. J. Alzheimer's Dis. Retin. Ganglion Cell Anal. MCI AD. 45 (1), 45-56 (2015).
- Stein, D. M., Wollstein, G., Ishikawa, H., Hertzmark, E., Noecker, R. J., Schuman, J. S. Effect of Corneal Drying on Optical Coherence Tomography. Ophthalmology. 113 (6), 985-991 (2006).
- Mwanza, J. C., et al. Effect of Cataract and its Removal on Signal Strength and Peripapillary Retinal Nerve Fiber Layer Optical Coherence Tomography Measurements. J. Glaucoma. 20 (1), 37-43 (2011).
- Garcia-Martin, E., et al. Influence of cataract surgery on optical coherence tomography and neurophysiology measurements in patients with retinitis pigmentosa. Am. J. Ophthalmol. 156 (2), (2013).
- Kok, P. H. B., et al. The relationship between the optical density of cataract and its influence on retinal nerve fibre layer thickness measured with spectral domain optical coherence tomography. Acta Ophthalmol. , (2012).
- Kim, N. R., et al. Influence of cataract on time domain and spectral domain optical coherence tomography retinal nerve fiber layer measurements. J. Glaucoma. 21 (2), 116-122 (2012).
- Hwang, Y. H., Kim, Y. Y. Effect of Peripapillary Vitreous Opacity on Retinal Nerve Fiber Layer Thickness Measurement Using Optical Coherence Tomography. Arch. Ophthalmol. 130 (6), 789-792 (2012).
- Schwartz, S. G., Flynn, H. W., Fisher, Y. L. "Floater scotoma" demonstrated on spectral-domain optical coherence tomography and caused by vitreous opacification. Ophthalmic Surg. Lasers Imaging Retina. 44 (4), 415-418 (2013).
- Frost, S., et al. Retinal vascular biomarkers for early detection and monitoring of Alzheimer's disease. Transl. Psychiatry. 3 (2), e233 (2013).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- DeJong, F. J., et al. Retinal vascular caliber and risk of dementia: The Rotterdam Study. Neurology. 76 (9), 816-821 (2011).
- Cheung, C. Y., et al. Quantitative and qualitative retinal microvascular characteristics and blood pressure. J. Hypertens. 29 (7), 1380-1391 (2011).
- Cheung, C. Y., et al. Retinal vascular fractal dimension and its relationship with cardiovascular and ocular risk factors. Am. J. Ophthalmol. 154 (4), 663-674 (2012).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Grinton, M. E., et al. The association between retinal vessel morphology and retinal nerve fiber layer thickness in an elderly population. Ophthalmic Surg. Lasers Imaging. 43 (6 Suppl), S61-S66 (2012).
- Hughes, A. D., et al. Quantification of topological changes in retinal vascular architecture in essential and malignant hypertension. J. Hypertens. 24 (5), 889-894 (2006).
- Hughes, A. D., et al. Determinants of retinal microvascular architecture in normal subjects. Microcirculation. 16 (2), 159-166 (2009).
- Lau, Q. P., Lee, M. L., Hsu, W., Wong, T. Y. The Singapore Eye Vessel Assessment System. Image Anal. Model. Ophthalmol. , 143-160 (2014).
- Thomas, G. N., et al. Measurement of Macular Fractal Dimension Using a Computer-Assisted Program. Investig. Opthalmology Vis. Sci. 55 (4), 2237 (2014).
- Murray, C. D. The physiological principle of minimal work. I. The vascular system and the cost of blood volume. Proc. Natl. Acad. Sci. 12, 207-214 (1926).
- Cheung, C., Chen, C., Wong, T. Ocular Fundus Photography as a Tool to Study Stroke and Dementia. Semin. Neurol. 35 (5), 481-490 (2015).
- Williams, M. A., et al. Retinal microvascular network attenuation in Alzheimer's disease. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 1 (2), 229-235 (2015).
- Cheung, C. Y., et al. Retinal Vascular Fractal Dimension Is Associated with Cognitive Dysfunction. J. Stroke Cerebrovasc. Dis. 23 (1), 43-50 (2014).
- Hammes, H. P., et al. Diabetic retinopathy: targeting vasoregression. Diabetes. 60 (1), 9-16 (2011).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- Frame, M. D., Sarelius, I. H. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc Res. 46 (2), 190-205 (1993).
- Djonov, V., Baum, O., Burri, P. H. Vascular remodeling by intussusceptive angiogenesis. Cell Tissue Res. 314 (1), 107-117 (2003).
- Griffith, T. M., Edwards, D. H. Basal EDRF activity helps to keep the geometrical configuration of arterial bifurcations close to the Murray optimum. J. Theor. Biol. 146 (4), 545-573 (1990).
- Griffith, T. M., Edwards, D. H., Randall, M. D. Blood flow and optimal vascular topography: role of the endothelium. Basic Res. Cardiol. 86 Suppl 2, 89-96 (1991).
- Chapman, N., Haimes, G., Stanton, A. V., Thom, S. A. M., Hughes, A. D. Acute effects of oxygen and carbon dioxide on retinal vascular network geometry in hypertensive and normotensive subjects. Clin. Sci. 99 (6), 483-488 (2000).
- Heringa, S. M., Bouvy, W. H., van denBerg, E., Moll, A. C., Jaap Kappelle, L., Jan Biessels, G. Associations between retinal microvascular changes and dementia, cognitive functioning, and brain imaging abnormalities: a systematic review. J. Cereb. blood flow Metab. 33 (7), 983-995 (2013).
- Ding, J., et al. Diabetic retinopathy and cognitive decline in older people with type 2 diabetes: The Edinburgh type 2 diabetes study. Diabetes. 59 (11), 2883-2889 (2010).
- Parisi, V., Restuccia, R., Fattapposta, F., Mina, C., Bucci, M. G., Pierelli, F. Morphological and functional retinal impairment in Alzheimer's disease patients. Clin. Neurophysiol. 112 (10), 1860-1867 (2001).
- Paquet, C., Boissonnot, M., Roger, F., Dighiero, P., Gil, R., Hugon, J. Abnormal retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Neurosci. Lett. 420 (2), 97-99 (2007).
- Moschos, M. M., et al. Structural and functional impairment of the retina and optic nerve in Alzheimer's disease. Curr. Alzheimer Res. 9 (7), 782-788 (2012).
- Lu, Y., et al. Retinal nerve fiber layer structure abnormalities in early Alzheimer's disease: Evidence in optical coherence tomography. Neurosci. Lett. 480 (1), 69-72 (2010).
- Kesler, A., Vakhapova, V., Korczyn, A. D., Naftaliev, E., Neudorfer, M. Retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Clin. Neurol. Neurosurg. 113 (7), 523-526 (2011).
- Ascaso, F. J., et al. Retinal alterations in mild cognitive impairment and Alzheimer's disease: An optical coherence tomography study. J. Neurol. 261 (8), 1522-1530 (2014).
- Berisha, F., Feke, G. T., Trempe, C. L., McMeel, J. W., Schepens, C. L. Retinal abnormalities in early Alzheimer's disease. Investig. Ophthalmol. Vis. Sci. 48 (5), 2285-2289 (2007).
- Iseri, P. K., Altinaş, O., Tokay, T., Yüksel, N. Relationship between Cognitive Impairment and Retinal Morphological and Visual Functional Abnormalities in Alzheimer Disease. J. Neuro-Ophthalmology. 26 (1), 18-24 (2006).
- Garcia-Martin, E. S., et al. Macular thickness as a potential biomarker of mild Alzheimer's disease. Ophthalmology. 121 (5), 1149-1151 (2014).
- Ko, F., et al. Retinal Nerve Fiber Layer Thinning Associated With Poor Cognitive Function Among A Large Cohort, The Uk Biobank. Alzheimer's Dement. 12 (7), P317-P318 (2016).
- Moreno-Ramos, T., Benito-Leon, J., Villarejo, A., Bermejo-Pareja, F. Retinal nerve fiber layer thinning in dementia associated with Parkinson's disease, dementia with Lewy bodies, and Alzheimer's disease. J. Alzheimers. Dis. 34 (3), 659-664 (2013).
- Moschos, M. M., et al. Morphologic changes and functional retinal impairment in patients with Parkinson disease without visual loss. Eur. J. Ophthalmol. 21 (1), 24-29 (2011).
- Garcia-Martin, E., et al. Ability and reproducibility of Fourier-domain optical coherence tomography to detect retinal nerve fiber layer atrophy in Parkinson's disease. Ophthalmology. 119 (10), 2161-2167 (2012).
- Yip, W., et al. Comparison of Common Retinal Vessel Caliber Measurement Software and a Conversion Algorithm. Transl. Vis. Sci. Technol. 5 (5), 11 (2016).
- Gorelick, P. B., et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association. Stroke. 42 (9), 2672-2713 (2011).
- Brown, W. R., Thore, C. R. Review: Cerebral microvascular pathology in ageing and neurodegeneration. Neuropathol. Appl. Neurobiol. 37 (1), 56-74 (2011).
- DeSilva, T. M., Faraci, F. M. Microvascular Dysfunction and Cognitive Impairment. Cell. Mol. Neurobiol. 36 (2), 241-258 (2016).
- Kalaria, R. N., Akinyemi, R., Ihara, M. Does vascular pathology contribute to Alzheimer changes?. J. Neurol. Sci. 322 (1-2), 141-147 (2012).
- Kling, M. A., Trojanowski, J. Q., Wolk, D. A., Lee, V. M. Y., Arnold, S. E. Vascular disease and dementias: paradigm shifts to drive research in new directions. Alzheimers. Dement. 9 (1), 76-92 (2013).
- O'Brien, J. T., et al. Vascular cognitive impairment. Lancet Neurol. 2 (2), 89-98 (2003).
- Chen, C., et al. Alzheimer's disease with cerebrovascular disease: current status in the Asia-Pacific region. J. Intern. Med. 280 (4), 359-374 (2016).
- Pérez, M. A., Bruce, B. B., Newman, N. J., Biousse, V. The use of retinal photography in nonophthalmic settings and its potential for neurology. Neurologist. 18 (6), 350-355 (2012).
- Boppart, S. A. Optical coherence tomography: Technology and applications for neuroimaging. Psychophysiology. 40 (4), 529-541 (2003).
- Hee, M. R., et al. Optical coherence tomography of the human retina. Arch. Ophthalmol. 113 (3), 325-332 (1995).
- Huang, D., et al. Optical coherence tomography. Science (80-.). 254 (5035), 1178-1181 (1991).
- vanVelthoven, M. E. J., Verbraak, F. D., Yannuzzi, L., Rosen, R. B., Podoleanu, A. G. H., deSmet, M. D. Imaging the retina by en face optical coherence tomography. Retina. 26 (2), 129-136 (2006).
- Costa, R. A., et al. Retinal assessment using optical coherence tomography. Prog. Retin. Eye Res. 25 (3), 325-353 (2006).
- DeBuc, D. C., Somfai, G. M., Ranganathan, S., Tátrai, E., Ferencz, M., Puliafito, C. A. Reliability and reproducibility of macular segmentation using a custom-built optical coherence tomography retinal image analysis software. J. Biomed. Opt. 14 (6), 64023 (2009).
- Budenz, D. L., et al. Determinants of Normal Retinal Nerve Fiber Layer Thickness Measured by Stratus OCT. Ophthalmology. 114 (6), 1046-1052 (2007).
- Leung, C. K. S., et al. Retinal Nerve Fiber Layer Imaging with Spectral-Domain Optical Coherence Tomography: A Prospective Analysis of Age-Related Loss. Ophthalmology. 119 (4), 731-737 (2012).
- Cettomai, D., et al. Reproducibility of optical coherence tomography in multiple sclerosis. Arch. Neurol. 65 (9), 1218-1222 (2008).
- Garcia-Martin, E., Pinilla, I., Idoipe, M., Fuertes, I., Pueyo, V. Intra and interoperator reproducibility of retinal nerve fibre and macular thickness measurements using Cirrus Fourier-domain OCT. Acta Ophthalmol. 89 (1), (2011).
- Garcia-Martin, E., Pueyo, V., Pinilla, I., Ara, J. R., Martin, J., Fernandez, J. Fourier-domain OCT in multiple sclerosis patients: reproducibility and ability to detect retinal nerve fiber layer atrophy. Invest. Ophthalmol. Vis. Sci. 52 (7), 4124-4131 (2011).
- Menke, M. N., Knecht, P., Sturm, V., Dabov, S., Funk, J. Reproducibility of nerve fiber layer thickness measurements using 3D fourier-domain OCT. Invest. Ophthalmol. Vis. Sci. 49 (12), 5386-5391 (2008).
- Mwanza, J. C., et al. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Investig. Ophthalmol. Vis. Sci. 51 (11), 5724-5730 (2010).
- Syc, S. B., et al. Reproducibility of high-resolution optical coherence tomography in multiple sclerosis. Mult Scler. 16 (7), 829-839 (2010).
- Ikram, M. K., Cheung, C. Y., Wong, T. Y., Chen, C. P. L. H. Retinal pathology as biomarker for cognitive impairment and Alzheimer's disease. J. Neurol. Neurosurg. Psychiatry. 83 (9), 917-922 (2012).
- MacGillivray, T. J., Trucco, E., Cameron, J. R., Dhillon, B., Houston, J. G., vanBeek, E. J. R. Retinal imaging as a source of biomarkers for diagnosis, characterization and prognosis of chronic illness or long-term conditions. Br. J. Radiol. 87 (1040), 20130832 (2014).
- Patton, N., et al. Retinal image analysis: Concepts, applications and potential. Prog. Retin. Eye Res. 25 (1), 99-127 (2006).
- McGrory, S., et al. The application of retinal fundus camera imaging in dementia: A systematic review. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 6, 91-107 (2017).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Hardin, J. S., Taibbi, G., Nelson, S. C., Chao, D., Vizzeri, G. Factors Affecting Cirrus-HD OCT Optic Disc Scan Quality: A Review with Case Examples. J. Ophthalmol. 2015, 1-16 (2015).
- Kim, N. R., et al. Influence of Cataract on Time Domain and Spectral Domain Optical Coherence Tomography Retinal Nerve Fiber Layer Measurements. J. Glaucoma. 1, (2010).
- Li, H., et al. Lens opacity and refractive influences on the measurement of retinal vascular fractal dimension. Acta Ophthalmol. 88 (6), e234-e240 (2010).
- Maberley, D., Morris, A., Hay, D., Chang, A., Hall, L., Mandava, N. A comparison of digital retinal image quality among photographers with different levels of training using a non-mydriatic fundus camera. Ophthalmic Epidemiol. 11 (3), 191-197 (2004).
- Rochtchina, E., Wang, J. J., Taylor, B., Wong, T. Y., Mitchell, P. Ethnic variability in retinal vessel caliber: A potential source of measurement error from ocular pigmentation?-The Sydney childhood eye study. Investig. Ophthalmol. Vis. Sci. 49 (4), 1362-1366 (2008).
- Wainwright, A., et al. Effect of image quality, color, and format on the measurement of retinal vascular fractal dimension. Investig. Ophthalmol. Vis. Sci. 51 (11), 5525-5529 (2010).
- Nguyen, T. T., Wong, T. Y. Retinal vascular manifestations of metabolic disorders. Trends Endocrinol. Metab. 17 (7), 262-268 (2006).
- Ding, J., et al. Retinal vascular caliber and the development of hypertension: a meta-analysis of individual participant data. J. Hypertens. 32 (2), 207-215 (2014).
- Nguyen, T. T., Wong, T. Y. Retinal vascular changes and diabetic retinopathy. Curr. Diab. Rep. 9 (4), 277-283 (2009).
- Leung, C. K. S., Ye, C., Weinreb, R. N., Yu, M., Lai, G., Lam, D. S. Impact of Age-related Change of Retinal Nerve Fiber Layer and Macular Thicknesses on Evaluation of Glaucoma Progression. Ophthalmology. 120 (12), 2485-2492 (2013).
- Sherry, L. M., et al. Reliability of computer-assisted retinal vessel measurement in a population. Clin. Experiment. Ophthalmol. 30 (3), 179-182 (2002).
- Wardlaw, J. M., et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 12 (8), 822-838 (2013).
- Patton, N., Aslam, T., MacGillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: A rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- Ferri, C. P., et al. Global prevalence of dementia: A Delphi consensus study. Lancet. 366 (9503), 2112-2117 (2005).
- Sahadevan, S., et al. Ethnic differences in Singapore's dementia prevalence: The stroke, Parkinson's disease, epilepsy, and dementia in Singapore study. J. Am. Geriatr. Soc. 56 (11), 2061-2068 (2008).
- Kernt, M., et al. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy (Optomap) compared with ETDRS 7-field stereo photography. Diabetes Care. 35 (12), 2459-2463 (2012).
- Manivannan, A., Plskova, J., Farrow, A., Mckay, S., Sharp, P. F., Forrester, J. V. Ultra-wide-field fluorescein angiography of the ocular fundus. Am. J. Ophthalmol. 140 (3), 525-527 (2005).
- Pellegrini, E., et al. Blood vessel segmentation and width estimation in ultra-wide field scanning laser ophthalmoscopy. Biomed. Opt. Express. 5 (12), 4329 (2014).
- Estrada, R., Tomasi, C., Schmidler, S. C., Farsiu, S. Tree topology estimation. IEEE Trans. Pattern Anal. Mach. Intell. 37 (8), 1688-1701 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены