A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس الإنتاجية العالية من غشاء البلازما إعادة ختم الكفاءة في خلايا الثدييات
In This Article
Summary
هنا يصف لنا تحليل القائم على الأسفار الفائق تدابير غشاء البلازما إعادة ختم الكفاءة من خلال تحليلات فلوروميتريك والتصوير في الخلايا الحية. يمكن استخدام هذا الفحص لفحص المخدرات أو الجينات المستهدفة التي تنظم إعادة ختم غشاء البلازما في خلايا الثدييات.
Abstract
في بيئتهم الفسيولوجية، كثيرا ما تتعرض خلايا الثدييات الإجهادات الميكانيكية والكيميائية الحيوية التي تؤدي إلى تلف غشاء البلازما. واستجابة لهذه الأضرار، ختم الأجهزة الجزيئية المعقدة سرعة غشاء البلازما لاستعادة وظيفتها الحاجز والمحافظة على بقاء الخلية. 60 عاماً بحوث في هذا الميدان، وعلى الرغم من أننا لا تزال تفتقر إلى فهم شامل للخلية إعادة ختم الجهاز. أن عنصر التحكم إعادة ختم غشاء البلازما أو الأدوية التي يمكن تحسين إعادة ختم، وقد وضعنا الفائق تحليل القائم على الأسفار أن التدابير غشاء البلازما إعادة ختم الكفاءة في خلايا الثدييات بهدف تحديد المكونات الخلوية مثقف في ميكروبلاتيس. كنظام نموذجي للضرر غشاء البلازما، تتعرض الخلايا إلى ليستيريوليسين السم البكتيري تشكيل المسام س (LLO)، الذي يشكل كبير 30-50 نانومتر القطر البروتينية المسام في المحتوية على نسبة الكولسترول في الدم الأغشية. يسمح استخدام قارئ الميكروسكوبية المتعدد وضع التحكم في درجة الحرارة لقياسات سبيكتروفلوروميتريك السريع والحساسة في تركيبة مع برايتفيلد والأسفار التصوير المجهري للخلايا الحية. التحليل الحركي لشدة الأسفار المنبعثة من فلوروتشرومي الحمض النووي ملزم إيمبيرمينت غشاء يعكس مدى الغشاء مما أدى إلى إصابة وإعادة ختم على مستوى السكان الخلية، مما يتيح لحساب الخلية إعادة ختم الكفاءة . تصوير مجهرية fluorescence يسمح لتعداد الخلايا، تعبر عن حلما فلورسنت من 2B هيستون البروتين النووي، في كل بئر الميكروسكوبية لمراعاة الاختلافات المحتملة في العدد من مؤثرا ويسمح في نهاية المطاف تحديد هوية السكان خلية متميزة. هذا التحليل الفائق هو أداة قوية يتوقع توسيع فهمنا لآليات إصلاح الغشاء عن طريق فحص الجينات المضيف أو مناشئ إضافة المركبات التي تحكم غشاء البلازما إعادة ختم.
Introduction
وتخضع خلايا الثدييات الإجهاد الميكانيكي وناضح والبيوكيميائية، أدى إلى فقدان سلامة غشاء البلازما. دون إعادة ختم سريعة وفعالة، أن تستسلم الخلايا التالفة بسرعة حتى الموت المبرمجة أو نخرية. منذ الستينات، وكان الدافع وراء الجهود الرامية إلى فهم غشاء البلازما إعادة ختم عملية بالعواقب المدمرة المرتبطة الخلل. في الواقع، قد تم ربط إصلاح غشاء البلازما ناقصة بسبب الطفرات في dysferlin ترميز الجينات، وإنتاج متقدمة glycation المنتجات النهائية، والعيوب في أمراض مثل ضمور العضلات أطرافهم-حزام، والسكري، ومتلازمة Higashi شيدياك منظم CHS1، على التوالي1،2،،من34،،من56الليزوزومية من الاتجار بالبشر. ومع ذلك، حتى الآن، أن فهمنا للغشاء إعادة ختم هو ما زالت محدودة7. وقد أثبتت الدراسات الأولية أن إعادة ختم الغشاء يتم تهيئتها بواسطة تدفق خارج الخلية Ca2 + من خلال غشاء البلازما التالفة8،،من910. ومنذ ذلك الحين، عدة غير التبادلية Ca2 +-تعتمد آليات قد اقترحت إعادة ختم الخلايا. وتقترح فرضية التصحيح أن حويصلات داخل الخلايا بالقرب من الجرح، تلتحم مع بعضها البعض وغشاء البلازما التالفة بمثابة تصحيح11،12،،من1314. نموذج ثاني يقترح أن الرقابة تعتمد على الكالسيوم من lysosomes في الجرح إصدارات موقع سفينجوميليناسي حمض الإنزيمات الليزوزومية، الذي يحول سفينجوميلين إلى السيراميد في النشرة الخارجي من غشاء البلازما. يؤدي هذا التغيير المفاجئ في تكوين الدهن يحركها السيراميد الالتقام المنطقة التالفة15،،من1617. وأخيراً، تنطوي الآلية المقترحة ثالث دور اندوسومال الفرز المعقدة اللازمة للنقل (اسكرت) لتشجيع تشكيل حويصلات المواجه للخارج أن برعم قبالة من غشاء البلازما18. حدد فقط مجموعة محدودة من البروتينات في هذه النماذج، ويجب كذلك توضيح آلياتها.
هنا يصف لنا مقايسة الفائق الذي توسط التدابير غشاء البلازما إعادة ختم الكفاءة في خلايا الثدييات ملتصقة تعرض للتلف المؤتلف ليستيريوليسين س (LLO)19. LLO السم تشكيل المسام (بفت) يفرزها الممرض داخل الخلايا اختياري الليستريه المستوحدة20،،من2122 وينتمي إلى مكف/مركز السيطرة على الأمراض (مجمع الهجوم غشاء، بيرفورين، و فوق عائلة سيتوليسين تعتمد على نسبة الكولسترول في الدم). ماكبف تشكيل المسام الثدييات التي تنتجها البروتينات المشاركة في الدفاعات المناعية، بينما المؤلفان السموم البكتيرية أساسا إيجابية العوامل الممرضة التي تضر بالخلايا المضيفة النهوض أنماط الحياة الممرضة23. يتم توليف المؤلفان مونومرات للذوبان في الماء أو dimers التي تربط الكولسترول الموجودة في غشاء البلازما، وأوليجوميريزي إلى مجمع بربري من وحدات فرعية تصل إلى 50. ثم يعيد ترتيب بربري المعقدة لإدراج β-خيوط عبر بلير الدهن، تشكيل مسام بيتا للبرميل الذي يمتد 30-50 نانومتر في قطرها24،25،،من2627. هذه المسام كبيرة تسمح بتدفق الأيونات والمكونات الخلوية الصغيرة داخل وخارج الخلية؛ رغم ذلك، وقد اقترحت بعض الدراسات أن مسام أصغر حجماً هي أيضا شكلت28،،من2930. بين المؤلفان، يعرض LLO خصائص فريدة من نوعها، بما في ذلك التجميع تعتمد درجة الحموضة ودرجة الحرارة لا رجعة فيه، مما يفضي إلى تحليلات الفائق31،32. يمكن إضافة LLO إلى مستنبت الخلية في 4 ˚C، درجة حرارة متساهلة إلى ملزمة لها للخلايا، ولكن ليس إلى تشكيل المسام المعقدة. ثم يمكن أن تكون متزامنة الشروع في تشكيل المسام برفع درجة الحرارة إلى 37 ˚C، مما يسمح لنشر فعالة من الجزيئات السمية في طائرة الغشاء بشكل ليغومرات ويعيد البناء كونفورماشونال المشاركة في توليد المسام. ولذلك، يلي رمز التبديل في درجة الحرارة، والحركية لتلف الخلايا يعتمد على مقدار السمية منضمة إلى غشاء البلازما. الأهم من ذلك، LLO القابلة للذوبان (ليست ملزمة بغشاء البلازما) بسرعة وبلا رجعة المجاميع عند درجة حرارة تصل إلى 37 ˚C، مما يخفف من الحاجة إلى يغسل الجزيئات السمية غير منضم ويحد من مدى الضرر الغشاء على مر الزمن. وأخيراً، لأن LLO تربط بين الكوليسترول وأشكال المسام في الأغشية الغنية بالكولسترول، هذا التحليل قابلة لمجموعة واسعة من خلايا الثدييات. من المهم أن نضع في اعتبارنا أن LLO يؤثر على الخلية المضيفة إشارات أساسا عن طريق تشكيل المسام، مع استثناءات قليلة في خلية مستقلة عن المسامية التي قد تحدث مما يشير إلى33،34،35،36 ،37،،من3839. ولذلك، فإنه لا يمكن استبعاد أن LLO مما يشير إلى أنشطة قد تؤثر على عملية إصلاح غشاء.
ويقيم هذا التحليل مباشرة مدى إصابة الخلية بقياس إدماج خلية إيمبيرمينت fluorochrome (مثلاً، يوديد propidium) الذي يدخل الخلايا الجرحى سلبية ويصبح الفلورية العالية بمجرد أنه يربط مع الأحماض النووية . ومن ثم، يمكن الحفاظ على فلوروتشرومي في مستنبت الخلية طوال هذه التجربة، السماح للتحليلات في الوقت الحقيقي للخلية مما أسفر عن إصابة. كثافة fluorescence صبغ الحمض النووي الملزمة سوف تزيد مع تركيز السمية، لتركيز معين من السمية، سوف تزيد مع مرور الوقت حتى تتشكل جميع المسام، وهي إصلاح الخلايا تماما أو حتى يتم التوصل إلى التشبع. تدفق خارج الخلية Ca2 + من خلال مسام الغشاء حدث شرط أساسي لإعادة ختم. ولذلك، يمكن أن يدل كفاءة ريسيلينج غير مباشر بمقارنة إصابة خلية في المتوسط الثقافة التي تحتوي على Ca2 + (حالة الإصلاح الدلالية) لإصابة في Ca2 +-المتوسطة الحرة (إصلاح الشرط التقييدي). نظراً لكثافة fluorescence صبغ الحمض النووي ملزم طرديا مع تركيز خلية في كل بئر، من المهم أن خلايا البذور في تركيز نفسها في جميع الآبار. من المهم أيضا أن تعداد الخلايا في كل بئر قبل وبعد الفحص لضمان أن الخلية المفرزة لم تحدث، كعائم، الخلايا المجمعة يمكن أن تحجب fluorescence القراءات التي قد تؤدي إلى تعقيد تفسير البيانات. تعداد الخلايا، والخلايا معربا عن هيستون النووية مترجمة 2B-التجارة والنقل (H2B-التجارة والنقل) استخدمت في هذا التحليل. التحكم في درجة الحرارة، وضع متعددة، والقراء الميكروسكوبية الجمع بين القياسات السريعة، الفائق (باستخدام تنسيق لوحة 96 أو 384-جيدا) من شدة الأسفار مع التصوير المجهري للخلايا الحية في 37 درجة مئوية. يمكن استخدام هذا الأخير لعد عدد الخلايا ومراقبة تشكيل خلية متميزة السكان في نهاية المطاف.
في نهاية المطاف، هذا الفحص يوفر للمستخدمين القدرة على توسيع معرفتهم بتعقيد آليات إصلاح الغشاء بالكشف عن الجزيئات المضيف أو إصلاح المركبات مناشئ المضافة التي يمكن التحكم في الغشاء. البروتوكول التالية توضح الخطوات التجريبية لقياس كفاءة الخلايا المعرضة ل LLO ريسيلينج وتقييم آثار المخدرات معين أو العلاج الخلوي في كفاءة إعادة ختم.
Access restricted. Please log in or start a trial to view this content.
Protocol
1-إعداد
- طلاء الخلية
ملاحظة: الإنسان الخلايا الظهارية عنق الرحم، هيلا وهيلا معربا عن هيستون 2B-التجارة والنقل (H2B-التجارة والنقل)، واستخدمت في هذا البروتوكول، ولكن هذا الفحص يمكن تكييفها ل خلايا الثدييات الأخرى19.- فصل الخلايا ملتصقة من 75 سم2 خلية ثقافة قارورة غسل الخلايا مع 2 مل يدتا التربسين 0.25%. استبدال التربسين المستخدمة مع 2 مل من يدتا التربسين الطازجة 0.25%.
- احتضان الخلايا في ˚C 37 لمدة 5 دقائق حتى يكون تقريب الخلايا وبعيدة عن قارورة.
- ريسوسبيند الخلايا في 8 مل من النمو المتوسطة (التي تحتوي على إبطال الحرارة 10% الجنين المصل البقري والبنسلين يو/مليلتر 100 100 ميكروغرام/مل ستربتوميسين دميم).
- تحديد تركيز الخلية باستخدام هيموسيتوميتير و 10 ميليلتر من تعليق خلية.
- تمييع الخلايا في النمو المتوسط لتركيز 2.5 × 105 خلايا/مل.
- من أجل تعليق خلية في حوض ماصة معقمة ومزيج دقيق تعليق استخدام ماصة مصلية من 10 مل.
- استخدام ميكروبيبيتي 12-القنوات المتعددة و 200 ميليلتر نصائح، توزيع خلايا هيلا (2.5 × 104 خلايا/100 ميليلتر/بئر) في ثلاث نسخ (أو البيلوروسية) في لوحة المعالجة بزراعة الأنسجة البوليستيرين أسفل شقة 96، حسنا، واضحة، أسود.
ملاحظة: يرد ترتيب طلاء على سبيل مثال في الشكل 1. - ثقافة الخلايا ح 24 في حاضنة ثقافة خلية هوميديفيد في 37 ˚C و 5% CO2.
- إعداد حل الأسهم
- تحضير 1 لتر مخزون العاشر 10 من المخزن المؤقت م (المستخدمة في إعداد M1 و M2) عن طريق إضافة 95 ز هانكس متوازنة الحل الملح، ز 0.476 مجكل2 (5 ملم)، و 23.83 ز حبيس (100 مم) إلى 900 مل من الماء. ضبط ال pH إلى 7.4 ورفع الحجم إلى 1 تعقيم تصفية ل.
- إعداد 50 مل 50 × (1.25 م) مخزون الجلوكوز عن طريق إضافة 11.26 ز د-(+)-الجلوكوز لما مجموعة 50 مل الماء. فلتر تعقيم الحل.
- إعداد 50 مل 100 × (120 مم) مخزون من الكالسيوم بإضافة ز 0.666 كاكل2 لما مجموعة 50 مل الماء. فلتر تعقيم الحل.
- إعداد 50 مل 10 × الأسهم (50 ملم) من جليكول-bis(2-aminoethylether)-N، N، N '، ن'، حمض tetraacetic (عطا) عن طريق إضافة 0.951 ز لعطا إلى 40 مل من الماء. زيادة درجة الحموضة إلى 8 باستخدام هيدروكسيد الصوديوم إلى حل عطا، ثم رفع الحجم إلى 50 مل. فلتر تعقيم الحل.
- للوحة واحدة 96-جيدا، وإعداد 50 مل من متوسطة 1 (M1، يتضمن Ca2 +)، 50 مل من متوسطة 2 (M2، Ca2 +-الحرة)، و 15 مل من 2 المتوسطة وتستكمل مع عطا، وبناء على ذلك:
- ل M1، إضافة 5 مل 10 س "م المخزن المؤقت" و 0.5 مل من 100 x CaCl21 مل 50 س الجلوكوز إلى 43.5 مل من الماء.
- ل M2، إضافة 5 مل 10 س "م المخزن المؤقت" و 1 مل من الجلوكوز 50 x إلى 44 مل من الماء.
- M2/عطا، إضافة 1.5 مل 10 س "م المخزن المؤقت" و 1.5 مل من 10 x EGTA إلى 12 مل الماء.
ملاحظة: ينبغي أن تعد جميع الحلول التي تتضمن يوديد propidium (PI) مباشرة قبل إضافة إلى الخلايا.
- لوحة إعدادات Cytometer القارئ/التصوير
ملاحظة: استخدم قارئ لوحة وضع المتعدد مزودة بوحدات الكشف عن اثنين: سبيكتروفلوروميتير وسيتوميتير تصوير. الحد من تعرض الأسفار لتجنب فوتوبليتشينج فلوروفوريس.- قبل الحارة للقارئ لوحة إلى 37 درجة مئوية قبل القيام الفحص.
- قم بإعداد المعلمات للمقايسة الحركية تبعاً لذلك ضمن وضع الإعدادات :
- اختر مونوتشروماتورو فلوريدا (الأسفار)و الحركية للتكوين البصري وقراءة وسائط، وقراءة نوع، على التوالي.
- تحت إعدادات الطول الموجي، حدد من 9 إلى 15 نانومتر الإثارة والانبعاثات ممر الموجه، على التوالي. لفحوصات باستخدام يوديد propidium (PI)، تعيين موجات الإثارة والانبعاثات إلى 535 و 617 شمال البحر الأبيض المتوسط، على التوالي.
- ضمن نوع اللوحة، حدد الآبار 96 لشكل اللوحة وتكوين لوحة محددة مسبقاً المقابلة للجدار الأسود واضح أسفل لوحة.
- في إطار مجال القراءة، تسليط الضوء على الآبار التي سيتم تحليلها في جميع أنحاء الحركية.
- تحت PMT والبصريات، مسبقاً ومضات كل قراءة إلى 6 وحدد المربع الاختيار القراءة من أسفل.
- تحت التوقيت، إدراج 00:30:00 في المربع إجمالي وقت تشغيل مقايسة حركية 30 دقيقة، وإدراج 00:05:00 الفاصل الزمني.
ملاحظة: في كل مرة نقطة وطول موجي واحد، وقت قراءة لوحة كاملة 96-جيدا هو 30 ثانية. - تأكيد الإعدادات المحددة في إعدادات المعلومات إلى اليمين، ثم اختر موافق. تشغيل الصحافة القراءة للشروع الحركية.
- قم بإعداد المعلمات التصوير تبعاً لذلك ضمن وضع الإعدادات:
- اختر مينيماكسو التصوير، و نقطة النهاية للتكوين البصري وقراءة وسائط، وقراءة نوع، على التوالي.
- تحت الأطوال الموجية، حدد أحال الضوء، وأما أو كلا المربعين fluorescence المقابلة لموجات الإثارة والانبعاثات من 456/541 نانومتر (بروتينات فلورية خضراء) و 625/713 نانومتر (PI).
- استخدم نفس خيارات نوع اللوحة و مجال القراءة كما هو معرف في الخطوات 1.3.2.3 و 1.3.2.4.
- تحت أيضا مجال الإعداد، حدد العدد من المواقع داخل بئر تصويرها.
ملاحظة: 12 موقعا لتتوافق بصورة كاملة، حسنا. - تحت إعدادات اقتناء الصورة، حدد أوقات التعرض للضوء، أحال 541 (التجارة والنقل)، و 713 (PI). للتجارة والنقل، الصورة كلها جيدا مع وقت تعرض من 20 مللي/الصورة. لأحال الضوء (TL) والأسفار PI، الحصول على صورة واحدة للمركز من كل بئر مع أوقات التعرض لمرض التصلب العصبي المتعدد 8 و 20، على التوالي.
- تأكيد الإعدادات المحدد في معلومات الإعدادات إلى اليمين، ثم اختر موافق. شراء الوقت لتصوير كامل سطح لكل بئر (12 صور في بئر) من لوحة 96-جيدا وطول موجي واحد ~ 15 دقيقة الصحافة القراءة لبدء التصوير.
ملاحظة: يتطلب وقت اكتساب صورة/بئر واحدة من صفيحة 96-جيدا ~2.5 مين/لوحة لطول موجي واحد. تتوافق مع المعلمات المذكورة أعلاه إلى معدات محددة في المختبر. قياسات سبيكتروفلوروميتريك: مصباح زينون فلاش عرض 1.0 شمال البحر الأبيض المتوسط زيادة الإثارة الأطوال الموجية (250-850 nm) مع قابل لتعديل 9 أو 15 نانومتر ممر الموجه، كاشف ضوئي أنبوب مع > 6 تسجيل النطاق الديناميكي وانبعاثات شمال البحر الأبيض المتوسط 15 أو 25 قابل لتعديل ممر الموجه. التصوير سيتوميتير: مصدر إضاءة خفيفة قادرة على الضوء الأبيض، 460 نانومتر، وموجات الإثارة نانومتر 625 مع 20 ممر الموجه nm، عوامل الانبعاثات تركزت في 541 نانومتر (108 من ممر الموجه nm) و 713 نانومتر (ممر الموجه nm 123)، على التوالي، وهدفا 4 X بالإضافة 1.25 12-بت جهاز ميغابيكسل.
2-التحليل
ملاحظة: وقت الفحص، يجب أن تكون الخلايا روافد 70-90%. خلال خطوات الغسيل، وينبغي إزالتها من على المديين المتوسط والمطبقة على الجدار الجانبي للبئر (غير مباشرة فوق الخلايا). الحفاظ على درجة حرارة LLO ˚C < 4 لمنع التجميع بها حتى الخطوة 3.1.5.
- إعداد مخزون من 30 ميكرومتر PI في M1 ومخزون من 30 ميكرومتر PI في M2 استعد مسبقاً في 37 ˚C.
- تغسل بلطف الخلايا الموجودة في لوحة 1 استخدام ميكروبيبيتي 12-القنوات المتعددة و 200 ميليلتر نصائح، على النحو التالي:
- لشروط إصلاح المتساهلة، إزالة المتوسطة النمو وغسل الخلايا مرتين مع 200 ميليلتر/بئر M1 استعد مسبقاً في 37 ˚C. يستعاض في المتوسط 100 ميليلتر/بئر M1 الحارة التي تحتوي على 30 ميكرومتر PI...
- لإصلاح شروط تقييدية، وإزالة المتوسطة النمو وتغسل الخلايا مرة واحدة مع 200 M2 ميليلتر/بئر الحارة التي تحتوي على 5 مم عطا يخلب Ca2 +، تليها غسل واحد مع 200 ميليلتر/بئر M2. استبدال المتوسطة مع 100 M2 ميليلتر/بئر الحارة التي تحتوي على 30 ميكرومتر PI.
- تم غسلها بعد النمو متوسطة واستبدالها مع يوديد propidium تحتوي على المتوسط، الانتقال مباشرة إلى الخطوة 2.1.3.
- صورة لوحة 1 تحت الضوء المنقولة والتجارة والنقل، وبي مفصلة تحت 1.3.3 (الحركية مسبقاً). هذه الخطوة تستغرق 15-20 دقيقة.
- خلال فترة 15 دقيقة في خطوة 2.1.3، إعداد لوحة 2 استخدام ميكروبيبيتي 12-القنوات المتعددة و 200 ميليلتر نصائح على النحو التالي:
- 96-فضلا عن مكان الجولة الميكروسكوبية البوليبروبيلين السفلي على الجليد. تكوين لوحة باستخدام تصميم تجريبي المقابلة للوحة 1 (الشكل 1).
- لشروط إصلاح المتساهلة، إضافة 100 ميليلتر/بئر M1 المثلج التي تحتوي على 60 ميكرومتر PI، تليها إضافة 100 ميليلتر/جيدا M1 المثلج يحتوي على 4 × LLO أو ليس لعنصر التحكم.
- الشروط المقيدة لإصلاح، إضافة 100 ميليلتر/بئر M2 المثلج التي تحتوي على 60 ميكرومتر PI، تليها إضافة 100 ميليلتر/جيدا من المثلج M2 يحتوي على 4 × LLO أو ليس لعنصر التحكم.
- وبعد التصوير لوحة 1 (الخطوة 2.1.3)، ضعه مباشرة في الجليد، واستخدام رقائق الألومنيوم لفصل اللوحة من الاتصال المباشر مع الجليد. تسمح لوحة 1 ليبرد لمدة 5 دقائق.
- باستخدام ميكروبيبيتي 12-متعدد الأقنية و 200 ميليلتر نصائح، نقل 100 ميليلتر من كل بئر في لوحة 2 (الخطوة 2.1.4) إلى الآبار المقابلة في لوحة 1. توزيع السم في وسائط الإعلام في لوحة 1 بشكل صحيح، إدراج النصائح أدناه غضروف ولطف إخراج وحدة التخزين دون إدخال الفقاعات.
ملاحظة: لا "الماصة؛" صعودا وهبوطاً، كما عن غير قصد وهذا قد فصل الخلايا. - اترك لوحة 1 دقيقة إضافية للسماح بالسم ربط الخلايا ونقل مباشرة لوحة 1 للقارئ لوحة للتحليل الحركي باستخدام أسلوب سبيكتروفلوروميتير (الخطوة 1.3.2).
- في نهاية التحليل الحركي، فورا صورة لوحة 1 (الحركية فيما بعد) باستخدام الخطوة 1.3.3.
3-التحليل: خلية التعداد
- تحديد عدد الخلايا استناداً إلى الأسفار النووية باستخدام البرمجيات تعداد خلية ميكروسكوبية.
- ضمن إعدادات، حدد تحليل جديد، ومن ضمن المقطع فئة ضمن إعدادات تحليل الصورة حدد حصيف كائن تحليل استخدام 541 كالطول الموجي للبحث عن الكائنات.
- ضمن الخيار "البحث عن كائنات"، تستخدم في رسم الصور العثور على الأسلوب، حدد الأنوية ضمن علامة التبويب إعدادات، ثم اضغط تطبيق.
- اضغط موافق و القراءة الشروع في الخلية الفرز الخوارزمية.
- بدلاً من ذلك، إذا كان متوفراً لا أداة من هذا القبيل، استخدام برنامج تحليل صورة مثل إيماجيج تعداد الخلايا.
- في إيماجيج، قم بفتح ملف الصورة مكدس.
- تحويل المكدس إلى صور 8-بت اللون الرمادي بواسطة النقر فوق الصورة في شريط القوائم، تحوم فوق نوع، وحدد 8 بت.
- طرح الخلفية: انقر فوق الصورة في شريط القوائم، تحوم فوق ضبط، وحدد السطوع/. قم بضبط قيمة الحد الأدنى إزالة الضوضاء الخلفية وحدد تطبيق.
- عتبة لإنشاء صور ثنائية: انقر فوق الصورة في شريط القوائم، تحوم فوق ضبطوتحديد العتبة. حدد خلفية داكنةوضبط قيم الحد الأدنى والحد الأقصى، وانقر فوق تطبيق.
- في حالة تداخل النوى، يمكن استخدام أداة مستجمعات المياه إلى نوى قطعة. انقر فوق العملية في القائمة، قم بالمرور فوق ثنائي وحدد مستجمعات المياه.
ملاحظة: هذا سوف تلقائياً فصل الأنوية متصلة. - تحليل الصور ملثمين بتطبيق المعايير المحددة من قبل المستخدم (الحجم والتدوير) لتحسين تحديد الأنوية واستبعاد الحطام خلية.
- انقر على تحليل في القائمة ومن ثم تحليل الجزيئات. تعيين الحجم المطلوب (بكسل ^ 2) ونطاقات التدوير (قيمة 1 دائرة كاملة) التي تعتبر كافية لتضمين الخلايا الفردية/نوى.
- في مربع القائمة المنسدلة إظهار، حدد الخيار المطلوب والتحقق من تلخيص، وانقر فوق "موافق" للحصول على عدد خلايا.
4-التحليل: منحنيات الحركية
- نقل البيانات الحركية من برنامج قارئ لوحة لبرنامج بيانات تحليلية.
- لكل حالة تجريبية، ومتوسط كثافة الأسفار من replicates في كل تيميبوينت، جنبا إلى جنب مع الانحراف المعياري المطابقة والخطأ المعياري للوسط لكل حالة تجريبية.
- لكل حالة تجريبية، تتبع المنحنى الحركية المقابلة: كثافة PI (المحور الصادي) مقابل الوقت (س).
- لحساب كفاءة شرط معاملة ريسيلينج، حساب المساحة تحت المنحنى (AUC) من + LLO في M1 (AUC(M1)) و + LLO في M2 (AUC(M2)). استخدام النهج المقترح أدناه لتقييم الكفاءة (ه) إعادة ختم:
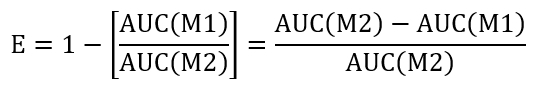
- إجراء مقارنة بين العلاج التحكم والاختبار بتحديد نسبة كفاءة (REff) المشار إليها أدناه:
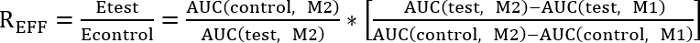
REFF = 1، اختبار العلاج ليس له أي تأثير على إصلاح
REFF < 1، اختبار العلاج يمنع إصلاح
Rالمؤسسة > 1، اختبار العلاج يحسن إصلاح - حساب المساحة تحت المنحنى باستخدام المعادلة التالية:
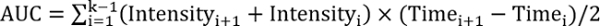 ، حيث ك هو العدد الإجمالي لعمليات المتابعة.
، حيث ك هو العدد الإجمالي لعمليات المتابعة.
Access restricted. Please log in or start a trial to view this content.
النتائج
خلية عد الدقة: خلايا هيلا كثيرا ما تستخدم كخط خلية الثديية نموذجي لاستكشاف آليات إصلاح الغشاء. عند تقييم إصلاح الغشاء على مستوى السكان الخلية، من المهم أن خلايا لوحة في تركيز نفسها في جميع الآبار لتفسير البيانات المناسبة. من المهم أيضا التحقق من وقت الفحص أن أرقام الخلية ...
Access restricted. Please log in or start a trial to view this content.
Discussion
هذا التحليل تدابير كفاءة الغشاء إعادة ختم على مستوى السكان الخلية مع القدرات الإنتاجية العالية. ويمكن استخدامه للكشف عن المكونات الخلوية أو مكتبات المخدرات التي يمكن أن تؤثر على تصليح غشاء. استخدمت مقايسة وصف شكل لوحة 96-جيدا، ولكن فإنه يمكن تكييفها مع لوحات 384-جيدا لأعلى من الناتج. ميزة له...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
نقر الدكتور جيسي كوك (جامعة ولاية أوهايو) يرجى السماح لنا باستخدام برنامجه الكشف عن وضع متعددة لبعض التجارب الأولية. البحث عنها في هذه المقالة أيده بالمعهد الوطني للحساسية والأمراض المعدية من "المعاهد الوطنية للصحة" تحت رقم جائزة RO1AI107250 إلى سيبو ستيفاني. المحتوى هي المسؤولة الوحيدة عن المؤلفين ولا تمثل بالضرورة وجهات النظر الرسمية "المعاهد الوطنية للصحة".
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| SpectraMax i3x Multi-Mode Microplate Reader | Molecular Devices | i3x | |
| MiniMax 300 Imaging cytometer | Molecular Devices | 5024062 | |
| TO-PRO-3 | ThermoFisher Scientific | T3605 | |
| Propidium Iodide | ThermoFisher Scientific | P3566 | |
| HeLa | ATCC | CCL2 | |
| HeLa H2B-GFP | Millipore | SCC117 | |
| Trypsin-EDTA 0.25% | ThermoFisher Scientific | 25200056 | |
| 96-well Corning flat bottom black polystyrene tissue culture treated plate | Corning | 3603 | |
| Hanks' balanced Salts | Sigma-Aldrich | H4891 | |
| EGTA | ISC BioExpress | 0732-100G | |
| HEPES | Fisher Scientific | BP310-500 | |
| D-(+)-Glucose, HybriMax | Sigma-Aldrich | G5146-1KG |
References
- Demonbreun, A. R., McNally, E. M. Plasma Membrane Repair in Health and Disease. Current Topics in Membranes. 77, 67-96 (2016).
- Howard, A. C., McNeil, A. K., McNeil, P. L. Promotion of plasma membrane repair by vitamin E. Nature Communications. 2, 597(2011).
- Howard, A. C., et al. A novel cellular defect in diabetes: membrane repair failure. Diabetes. 60 (11), 3034-3043 (2011).
- Lozano, M. L., et al. Towards the targeted management of Chediak-Higashi syndrome. Orphanet Journal of Rare Diseases. 9, 132(2014).
- Vainzof, M., et al. Dysferlin protein analysis in limb-girdle muscular dystrophies. Journal of Molecular Neuroscience. 17 (1), 71-80 (2001).
- Huynh, C., et al. Defective lysosomal exocytosis and plasma membrane repair in Chediak-Higashi/beige cells. Proceeding of the National Academy of Sciences of the United States of America. 101 (48), 16795-16800 (2004).
- Cooper, S. T., McNeil, P. L. Membrane Repair: Mechanisms and Pathophysiology. Physiological Reviews. 95 (4), 1205-1240 (2015).
- Steinhardt, R. A., Bi, G., Alderton, J. M. J. M. Cell membrane resealing by a vesicular mechanism similar to neurotransmitter release. Science. 263 (5145), 390-393 (1994).
- De Mello, W. C. Membrane sealing in frog skeletal-muscle fibers. Proceedings of the National Academy of Sciences of the United States of America. 70 (4), 982-984 (1973).
- Fishman, H. M., Tewari, K. P., Stein, P. G. Injury-induced vesiculation and membrane redistribution in squid giant axon. Biochimica et Biophysica Acta. 1023 (3), 421-435 (1990).
- Davenport, N. R., Bement, W. M. Cell repair: Revisiting the patch hypothesis. Communicative & Integrative Biology. 9 (6), 1253643(2016).
- McNeil, P. L., et al. Patching plasma membrane disruptions with cytoplasmic membrane. Journal of Cell Science. 113 (11), 1891-1902 (2000).
- Terasaki, M., Miyake, K., McNeil, P. L. Large plasma membrane disruptions are rapidly resealed by Ca2+-dependent vesicle-vesicle fusion events. Journal of Cell Biology. 139 (1), 63-74 (1997).
- Bi, G. Q., Alderton, J. M., Steinhardt, R. A. Calcium-regulated exocytosis is required for cell membrane resealing. Journal of Cell Biology. 131 (6 Pt. 2), 1747-1758 (1995).
- Tam, C., et al. Exocytosis of acid sphingomyelinase by wounded cells promotes endocytosis and plasma membrane repair. Journal of Cell Biology. 189 (6), 1027-1038 (2010).
- Rodriguez, A., et al. Lysosomes behave as Ca2+-regulated exocytic vesicles in fibroblasts and epithelial cells. Journal of Cell Biology. 137 (1), 93-104 (1997).
- Reddy, A., Caler, E. V., Andrews, N. W. Plasma membrane repair is mediated by Ca(2+)-regulated exocytosis of lysosomes. Cell. 106 (2), 157-169 (2001).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136(2014).
- Pathak-Sharma, S., et al. High-Throughput Microplate-Based Assay to Monitor Plasma Membrane Wounding and Repair. Frontiers in Cellular and Infection Microbiology. 7, 305(2017).
- Hamon, M. A., et al. Listeriolysin O: the Swiss army knife of Listeria. Trends in Microbiology. 20 (8), 360-368 (2012).
- Seveau, S. Multifaceted activity of listeriolysin O, the cholesterol-dependent cytolysin of Listeria monocytogenes. Subcellular Biochemistry. 80, 161-195 (2014).
- Osborne, S. E., Brumell, J. H. Listeriolysin O: from bazooka to Swiss army knife. Philosophical Transactions of the Royal Society of London B: Biological Sciences. 372 (1726), (2017).
- Lukoyanova, N., Hoogenboom, B. W., Saibil, H. R. The membrane attack complex, perforin and cholesterol-dependent cytolysin superfamily of pore-forming proteins. Journal of Cell Science. 129 (11), 2125-2133 (2016).
- Tweten, R. K. Cholesterol-dependent cytolysins, a family of versatile pore-forming toxins. Infection and Immunity. 73 (10), 6199-6209 (2005).
- Koster, S., et al. Crystal structure of listeriolysin O reveals molecular details of oligomerization and pore formation. Nature Communications. 5, 3690(2014).
- Duncan, J. L., Schlegel, R. Effect of streptolysin O on erythrocyte membranes, liposomes, and lipid dispersions. A protein-cholesterol interaction. Journal of Cell Biology. 67 (1), 160-174 (1975).
- Morgan, P. J., et al. Subunit organisation and symmetry of pore-forming, oligomeric pneumolysin. FEBS Letters. 371 (1), 77-80 (1995).
- Leung, C., et al. Stepwise visualization of membrane pore formation by suilysin, a bacterial cholesterol-dependent cytolysin. eLife. 3, (2014).
- Marchioretto, M., et al. What planar lipid membranes tell us about the pore-forming activity of cholesterol-dependent cytolysins. Biophysical Chemistry. 182, 64-70 (2013).
- Palmer, M., et al. Assembly mechanism of the oligomeric streptolysin O pore: the early membrane lesion is lined by a free edge of the lipid membrane and is extended gradually during oligomerization. European Molecular Biology Organization Journal. 17 (6), 1598-1605 (1998).
- Bavdek, A., et al. pH dependence of listeriolysin O aggregation and pore-forming ability. Federation of European Biochemical Society Journal. 279 (1), 126-141 (2012).
- Schuerch, D. W., Wilson-Kubalek, E. M., Tweten, R. K. Molecular basis of listeriolysin O pH dependence. Proceeding of the National Academy of Sciences of the United States of America. 102 (35), 12537-12542 (2005).
- Cassidy, S. K., O'Riordan, M. X. More than a pore: the cellular response to cholesterol-dependent cytolysins. Toxins (Basel). 5 (4), 618-636 (2013).
- Lam, J., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes L. monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. , (2017).
- Gekara, N. O., Weiss, S. Lipid rafts clustering and signalling by listeriolysin O. Biochemical Society Transactions. 32 (Pt 5), 712-714 (2004).
- Magassa, N., Chandrasekaran, S., Caparon, M. G. Streptococcus pyogenes cytolysin-mediated translocation does not require pore formation by streptolysin O. European Molecular Biology Organization Reports. 11 (5), 400-405 (2010).
- Baba, H., et al. Induction of gamma interferon and nitric oxide by truncated pneumolysin that lacks pore-forming activity. Infection and Immunity. 70 (1), 107-113 (2002).
- Carrero, J. A., Vivanco-Cid, H., Unanue, E. R. Listeriolysin o is strongly immunogenic independently of its cytotoxic activity. Public Library of Science One. 7 (3), e32310(2012).
- Coconnier, M. H., et al. Listeriolysin O-induced stimulation of mucin exocytosis in polarized intestinal mucin-secreting cells: evidence for toxin recognition of membrane-associated lipids and subsequent toxin internalization through caveolae. Cell Microbiology. 2 (6), 487-504 (2000).
- Suzuki, T., et al. DNA staining for fluorescence and laser confocal microscopy. Journal of Histochemistry and Cytochemistry. 45 (1), 49-53 (1997).
- Bink, K., et al. TO-PRO-3 is an optimal fluorescent dye for nuclear counterstaining in dual-colour FISH on paraffin sections. Histochemistry and Cell Biology. 115 (4), 293-299 (2001).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Birmingham, A., et al. Statistical methods for analysis of high-throughput RNA interference screens. Nature Methods. 6 (8), 569-575 (2009).
- Zhang, X. D. A pair of new statistical parameters for quality control in RNA interference high-throughput screening assays. Genomics. 89 (4), 552-561 (2007).
- Zhang, X. D. A new method with flexible and balanced control of false negatives and false positives for hit selection in RNA interference high-throughput screening assays. Journal of Biomolecular Screening. 12 (5), 645-655 (2007).
- Idone, V., et al. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. Journal of Cell Biology. 180 (5), 905-914 (2008).
- Davenport, N. R., et al. Membrane dynamics during cellular wound repair. Molecular Biology of the Cell. 27 (14), 2272-2285 (2016).
- Defour, A., Sreetama, S. C., Jaiswal, J. K. Imaging cell membrane injury and subcellular processes involved in repair. Journal of Visualized Experiments. (85), (2014).
- Lee, J. J. A., et al. Cell Membrane Repair Assay Using a Two-photon Laser Microscope. Journal of Visualized Experiments. (131), (2018).
- Weisleder, N., et al. Visualization of MG53-mediated cell membrane repair using in vivo and in vitro systems. Journal of Visualized Experiments. (52), (2011).
- Corrotte, M., et al. Toxin pores endocytosed during plasma membrane repair traffic into the lumen of MVBs for degradation. Traffic. 13 (3), 483-494 (2012).
- Kuismanen, E., Saraste, J. Low temperature-induced transport blocks as tools to manipulate membrane traffic. Methods in Cell Biology. 32, 257-274 (1989).
- Togo, T., et al. The mechanism of facilitated cell membrane resealing. Journal of Cell Science. 112, 719-731 (1999).
- Johnson, S. A., et al. Temperature-dependent phase behavior and protein partitioning in giant plasma membrane vesicles. Biochimica et Biophysica Acta. 1798 (7), 1427-1435 (2010).
- Lam, J. G. T., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes Listeria monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. 29 (3), 270-284 (2018).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved