需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
哺乳动物细胞血浆膜检测效率的高通量测量
摘要
在这里, 我们描述了一种高通量荧光检测, 通过在活细胞中的荧光和成像分析测量质膜的重接受效率。该检测方法可用于筛选调节哺乳动物细胞质膜重密封的药物或靶向基因。
摘要
在其生理环境中, 哺乳动物细胞经常受到机械和生化压力, 导致质膜损伤。为了应对这些损伤, 复杂的分子机械迅速重新密封质膜, 以恢复其屏障功能, 并保持细胞存活。尽管在这一领域进行了60年的研究, 但我们仍然缺乏对细胞重闭机械的透彻了解。为了识别控制质膜再密封的细胞成分或可以改善再密封的药物, 我们开发了一种基于荧光的高通量检测方法, 用于测量哺乳动物细胞中的质膜再密封效率在微板中培养。作为细胞膜损伤的模型系统, 细胞暴露在细菌形成毒素李斯特菌素 o (l低铁) 中, 在含胆固醇的膜中形成直径30-50 纳米的大型蛋白质孔。使用温度控制的多模微板读取器, 可以结合明亮场和荧光显微镜成像活细胞进行快速和灵敏的光谱测量。对膜不含核酸结合荧光铬发出的荧光强度进行动力学分析, 反映了细胞膜在细胞群体中的损伤和再密封程度, 从而可以计算细胞的保存效率.荧光显微镜成像允许细胞的计数, 这在宪法上表达了核蛋白组蛋白 2 b 的荧光嵌合体, 在微板的每口井, 以考虑其数量的潜在变化, 并允许最终识别不同的细胞群。这种高通量检测是一个强大的工具, 有望通过筛选宿主基因或控制质膜重新密封的外源添加化合物来扩大我们对膜修复机制的了解。
引言
哺乳动物细胞受到机械、渗透和生化胁迫, 导致细胞膜完整性的丧失。如果没有快速有效的重新密封, 受损的细胞很快就会死于有程序或坏死的死亡。自20世纪60年代以来, 了解质膜重密封过程的努力的动机是其功能障碍带来的破坏性后果。事实上, 像肢体腰带肌肉营养不良症、糖尿病和 chediak-higashi 综合征这样的疾病与由于基因编码异常的突变、先进的糖基化终产物的生产以及缺陷而导致的质膜修复不足有关。溶酶体贩运调节剂 chs1,分别为 1、2、3、4、5、6.然而, 到目前为止, 我们对膜重封的理解仍然有限。初步研究表明, 膜复位是由细胞外 ca2+通过受损的质膜 8,9,10的流入而引发的。自那时以来, 几个非相互排斥的 ca2 +依赖机制已被提出重新体细胞。贴片假说提出, 在接近伤口的细胞内囊泡融合在一起, 并将受损的质膜作为贴片 11,12,13,14。第二个模型提出, 钙依赖性的溶酶体在伤口部位的渗出释放溶酶酸 sphingomyelinase, 它将 sphingomyelin 转化为质膜外单中的神经酰胺。脂质组成的这种突然变化导致受损区域15、16、17的神经酰胺驱动的内吞。最后, 第三个拟议的机制涉及运输所需的子宫内膜分枝复合体 (escrt) 的作用, 以促进从质膜18中脱落的向外的囊泡的形成。在这些模型中只发现了一组有限的蛋白质, 必须进一步阐明它们的机制。
在这里, 我们描述了一种高通量的测定膜重组李斯特菌蛋白 o (l库)19介导的损伤的粘附哺乳动物细胞的膜重组效率。llo 是一种成孔毒素 (pft), 由细胞内的兼发性病原菌单核细胞增生李斯特菌 20、21、22分泌, 属于 macpf按 cdc (膜攻击复合体, 穿孔,胆固醇依赖性细胞分裂素) 超家族。macpf 是参与免疫防御的哺乳动物成孔蛋白, 而 cdc 是细菌毒素, 主要由革兰氏阳性病原体产生, 损害宿主细胞, 促进其致病性生活方式23。cdc 被合成为水溶性单体或二聚体, 结合质膜中的胆固醇, 并将寡聚结合成最多50个亚基的前孢子复合体。然后, 前孔复合物重新排列, 在脂质双层层上插入β链, 形成直径为 24、25、26、27的β桶孔。 这些大毛孔允许离子和小细胞成分进出细胞;不过, 一些研究提出, 较小尺寸的毛孔也会形成 28、2 9、3 0.在 cdc 中, llo 显示出独特的特性, 包括不可逆的 ph 和温度相关的聚合, 这有利于高吞吐量分析31,32。llo 可以在4°c 时添加到细胞培养培养基中, 温度允许其与细胞结合, 但不能添加到孔隙复合体的形成中。然后, 可以通过将温度提高到37°c 来同步孔隙形成的启动, 从而使毒素分子在膜平面上有效扩散, 形成低聚物, 并进行与孔隙生成有关的构象重塑。因此, 随着温度的变化, 细胞损伤的动力学将取决于与质膜结合的毒素量。重要的是, 当温度达到37°c 时, 可溶性 llo (不与质膜结合) 会迅速且不可逆转地聚集在一起, 从而缓解了冲洗未结合毒素分子的需要, 并随着时间的推移限制了膜的损伤程度。最后, 由于 llo 与胆固醇结合, 并在富含胆固醇的膜中形成毛孔, 这种检测方法适用于多种哺乳动物细胞。重要的是要记住, llo 主要通过孔隙形成影响宿主细胞信号, 除了少数例外, 在这些情况下, 与孔隙无关的细胞信号转导可能会发生33、34、35、36 ,37,38,39。因此, 不能排除 llo 信号活动可能会影响膜修复过程。
该检测方法通过测量被动进入损伤细胞并与核酸连接后成为高荧光细胞的小不含氟铬细胞 (例如碘化钠) 的含量, 直接评估细胞损伤的程度.因此, 在整个实验过程中, 荧光铬可以保存在细胞培养介质中, 从而能够实时分析细胞损伤。核酸结合染料的荧光强度会随着毒素的浓度而增加, 对于一定浓度的毒素, 随着时间的推移, 会随着时间的推移而增加, 直到所有毛孔形成, 细胞完全修复或达到饱和度。细胞外 ca2+通过膜孔的涌入是重新密封的必要条件。因此, 通过比较含有 ca2 + (修复允许条件) 的培养基中的细胞损伤与 ca2+ 无损伤 (修复限制性条件) 的损伤, 可以间接地证明细胞损伤的恢复效率。由于核酸结合染料的荧光强度与每口井的细胞浓度成正比, 因此所有油井中相同浓度的种子细胞都很重要。同样重要的是, 在检测前后的每口井中列举细胞, 以确保细胞分离不会发生, 因为漂浮的聚集细胞可能会掩盖荧光读数, 从而使数据解释复杂化。为了列举细胞, 本试验中使用了表达核局部组蛋白 2b-gfp (h2b-gfp) 的细胞。温度控制的多模微板读取器将荧光强度的快速、高吞吐量测量 (使用96或384个孔板格式) 与37°c 下活细胞的显微镜成像相结合。后者可用于列举细胞数量和观察不同细胞群的最终形成。
最终, 这种检测方法通过筛选宿主分子或可能控制膜修复的外源添加化合物, 为用户提供了扩大其对膜修复机制复杂性的了解的能力。下面的协议描述了测量暴露于 llo 的细胞的重密封效率的实验步骤, 并评估特定药物或细胞治疗对重密封效率的影响。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 准备工作
- 电池电镀
注: 本协议中使用了人宫颈上皮细胞、hela 和 hela 表达组蛋白 2b-gfp (h2b-gfp), 但该检测方法可适用于其他哺乳动物细胞19。- 用2毫升的胰蛋白酶-edta 0.25% 清洗细胞, 从75厘米2细胞培养瓶中分离粘附细胞。将使用过的胰蛋白酶替换为2毫升的新鲜胰蛋白酶 edta 0.25%。
- 在37°c 下将细胞加氢 5分钟, 直到细胞圆形并与烧瓶分离。
- 在生长培养基中复制8毫升的细胞 (dmem 含有10% 热灭活的胎儿牛血清、100 u/ml 青霉素和100μgml 链霉素)。
- 使用血细胞计和10μl 细胞悬浮液确定细胞浓度。
- 将生长介质中的细胞稀释至 2.5 x10 5细胞的浓度。
- 将细胞悬浮液倒进无菌的移液器盆中, 并使用10毫升血清学移液器将悬浮液彻底混合。
- 使用12多通道微移液器和200μl 尖端, 将 hela 细胞 (2.5 x10 4 cellsless件) 三分之一 (或四裂) 分布在96井平底、黑色聚苯乙烯组织培养板中。
注意:在图 1中, 电镀布置以示例形式显示。 - 在37°c 和 5% co 2 的加湿细胞培养孵化器中培养细胞 24小时.
- 库存解决方案准备
- 通过添加95克 hanks 平衡盐溶液、0.476 克 mgl 2 (5 mm) 和23.83 克 hepes (100 mm) 至900毫升的水, 制备 10x缓冲液 m (用于制备 mM 和 m2) 的1升。将 ph 值调整到 7.4, 并将体积提高到 1 l. 过滤灭菌。
- 在总共50毫升的水中加入11.26 克 d-(+)-葡萄糖, 制备 50x (1.25 m) 葡萄糖库存的50毫升。滤清器对溶液进行消毒。
- 在总共50毫升的水中加入 0.66 g 的 ccl 2, 制备 100x (120 毫米) 钙库存的50毫升。滤清器对溶液进行消毒。
- 在40毫升的水中加入0.951 克的 egta, 制备出 10倍 (50 mm) 的乙二醇-bis(2 氨基乙叶)-n、n、n、n '、n '、四乙酸 (egta)。使用 naoh 将 ph 值提高到 8, 以溶解 egta, 然后将体积提高到50毫升。滤清器对溶液进行消毒。
- 对于单个96孔板, 请制备 50 ml 的中等 1 (mL, 包含 ca2 +)、50 ml 的中等 2 (m2, ca2 +无) 和 15 ml 的中等 2, 并以 egta 为补充, 因此:
- 对于 mL, 加入5毫升的10倍缓冲液 m, 0.5 ml 的 100x ccl2, 1 毫升的50x 葡萄糖到43.5 毫升的水。
- 对于 m2, 在水中加入5毫升的10倍缓冲 m 和1毫升的50x 葡萄糖。
- 对于 mL/egta, 在12毫升的水中加入 1.5 ml 的10倍缓冲 m 和 1.5 ml 的10倍的 egta。
注: 在添加到细胞中之前, 应直接准备含有碘化物 (pi) 的所有溶液。
- 板读/成像细胞仪设置
注: 使用配备两种检测单元的多模板式读取器: 光谱仪和成像细胞仪。限制荧光暴露, 以避免光漂白的氟。- 在进行测试之前, 将读卡器预热至37°c。
- 在"设置"模式下相应地设置动力学检测的参数:
- 分别为光学配置、读取模式和读取类型选择单色仪、fl (荧光)和动力学。
- 在 "波长设置"下, 分别选择9和15纳米激励和发射带通。对于使用碘化丙酸 (pi) 进行的检测, 将激发和发射波长分别设置为535纳米和617纳米。
- 在"板类型"下, 选择96 井作为板格式和与黑墙透明底板相对应的预置板配置。
- 在"读取区域" 下, 突出显示将在整个动力学过程中分析的井。
- 在pmt 和光学下, 将每次读取的闪光灯预设为6 , 然后选中 "从底部读取" 复选框。
- 在"时间"下, 在"总运行时间" 框中插入00:30:00以进行30分钟的动态分析, 并插入00:05:00进行间隔。
注意: 对于每个时间点和一个波长, 一个完整的96孔板的读取时间为30秒。 - 在右侧的 "设置信息"中确认指定的设置, 然后选择"确定"。按"读取"启动动能运行。
- 在 "设置" 模式下相应地设置映像参数:
- 分别为光学配置、读取模式和读取类型选择 "最小值"、"成像" 和 "终结点"。
- 在波长下, 选择透射光, 并选择与456/541 纳米 (gfp) 和 625/713 nm (pi) 的激发和发射波长相对应的荧光框中的一个或两个。
- 对"板类型" 和"读取区域" 使用与步骤1.3.2.3 和1.3.2.4 中定义的相同选项。
- 在"井区设置" 下, 选择要映像的井内的地点数。
注意: 12个站点对应于完整的图像。 - 在"图像采集设置"下, 选择传输光、541 (gfp) 和 713 (pi) 的曝光时间。对于 gfp, 以 20 ms/图像的曝光时间对整个油井进行成像。对于透射光 (tl) 和 pi 荧光, 获取每个井的中心的单一图像, 曝光时间分别为8毫秒和20毫秒。
- 在右侧的 "设置信息"中确认指定的设置, 然后选择"确定"。对96孔板的每口井 (12 张成像井) 的整个表面进行成像的采集时间为 ~ 15分钟, 按读数启动成像。
注:96 孔板的单个图像/井的采集时间需要一个波长的 ~ 2.5 分钟板。上述参数与我们实验室的特定设备相对应。光谱测量: 显示 1.0 nm 增量激发波长 (250-850 nm) 的氙气闪光灯, 带有可调9或 15 nm 带通, 光电倍增管检测器具有 > 6个测井动态范围和可调节的15或 25 nm 发射通。成像细胞仪: 一种能够提供白光、460纳米和 625 nm 激发波长的照明光源, 具有20纳米带通, 发射滤波器分别以 541 nm (108 nm 带通) 和 713 nm (123 nm 带通) 为中心, 4x 目标耦合到1.2512位电荷耦合设备摄像头。
2. 检测
注意: 在检测时, 细胞必须是70-90% 的融合。在清洗步骤中, 应将介质从井壁中取出并应用于井壁 (而不是直接位于细胞上方)。将 llo 的温度保持在 < 4°c, 以防止其聚合, 直至3.1.5 步骤。
- 在 m1 中准备 30μm pi 的库存, 在37°c 预热的 m2 中制备 30μm pi 的库存。
- 使用12通道微移液器和200μl 吸头轻轻清洗第1版中的细胞, 如下所示:
- 对于可修复的条件, 请取出生长介质, 用 200μl/well m1 在37°c 预热的情况下两次清洗细胞。将含有 30μm pi 的温暖 m1 介质替换为 100μl/井。
- 为在限制性条件下, 取出生长介质, 用含有 5mm egta 的200μl 井温 m2 清洗细胞一次, 将其螯合 ca 2+, 然后用 200μl/well m2 清洗一次。将介质替换为含有 30μm pi 的100μl 井温 m2。
- 在对培养基进行洗涤后, 用含碘化物的培养基代替, 直接移动到步骤2.1.3。
- 图像板1在透射光、gfp 和 pi 下, 在1.3.3 下详细 (前动)。此步骤需要15-20。
- 在2.1.3 步骤的15分钟内, 使用 12-多通道微移液器和200μl 吸头准备2板, 如下所示:
- 将96孔圆形底部聚丙烯微板放在冰上。使用与板材1相对应的实验设计配置板 (图 1)。
- 对于允许的修复条件, 添加含有 60μm pi 的冰凉 m1 的 100μl/well, 然后添加 100μl/well, 其中包含 4倍 llo 或不用于控制。
- 对于限制维修的情况, 添加含有 60μm pi 的冰凉 m2 100μl 井, 然后添加 100μlswell, 其中包含 4倍 llo 或不用于控制。
- 成像板 1 (步骤 2.1.3) 后, 立即将其放置在冰上, 使用铝箔将板与冰直接接触分离。让1号板块冷却5分钟。
- 使用12多通道微移液器和200μl 吸头, 将每口井100μl 转移到2板 (步骤 2.1.4) 中, 转移到板1中的相应井。要在第1片介质中正确分配毒素, 请将小脚尖下方的尖端插入, 然后在不引入气泡的情况下轻轻弹出体积。
注意: 不要上下移液器, 因为这可能会无意中分离单元格。 - 离开板额外 1分钟, 让毒素绑定到细胞, 并立即转移板1到板读取器的动力学分析使用光谱仪荧光模式 (步骤 1.3.2)。
- 在动力学分析结束时, 立即使用步骤1.3.3 成像板 1 (后动力学)。
3. 分析: 细胞枚举
- 使用微板细胞枚举软件确定基于核荧光的细胞计数。
- 在"设置" 中,选择 "重新分析", 然后在"图像分析设置"中的 "类别" 部分下, 使用541选择"离散对象分析" 作为查找对象的波长.
- 在 "查找对象" 选项中, 使用"在图像上绘制"方法, 在 "设置" 选项卡下选择"核酸" , 然后按"应用"。
- 按"确定"和"读取"启动单元计数算法。
- 或者, 如果没有此类工具, 请使用图像分析软件 (如 imagej) 枚举单元格。
- 在 imagej 中, 以堆栈的身份打开图像文件。
- 通过单击菜单栏中的"图像", 将堆栈转换为8位灰度图像, 将鼠标悬停在"类型"上, 然后选择8位。
- 减去背景: 单击菜单栏中的"图像", 将鼠标悬停在"调整"上, 然后选择 "亮度/对比度"。调整最小值以消除背景噪音, 然后选择"应用"。
- 创建二进制图像的阈值: 单击菜单栏中的"图像", 将鼠标悬停在"调整" 上, 然后选择 "阈值"。选择"深色背景", 调整最小值和最大阈值, 然后单击 "应用"。
- 在重叠原子核的情况下, 可以使用流域工具对原子核进行分割。单击菜单中的"处理" , 将鼠标悬停在二进制系统上, 然后选择 "流域"。
注意: 这将自动分离连接的原子核。 - 通过应用用户指定的标准 (大小和循环) 分析蒙版图像, 以细化细胞核的识别和排除细胞碎片。
- 单击菜单中的"分析" , 然后单击 "分析粒子"。设置所需的大小 (pixel^2) 和循环 (值为1是一个完美的圆) 范围, 这足以包括单个细胞/原子核。
- 在 "显示" 下拉框中, 选择所需的选项, 选中"汇总", 然后单击"确定"以获取单元格计数。
4. 分析: 动力学曲线
- 将动力学数据从板式读取器软件传输到分析数据软件。
- 对于每个实验条件, 平均复制的荧光强度在每个时间点, 以及相应的标准偏差和标准误差的平均值为每个实验条件。
- 对于每个实验条件, 跟踪相应的动力学曲线: pi 强度 (y 轴) 与时间 (x 轴)。
- 要计算给定处理条件的重密封效率, 请计算 m2 (AUC(M1) 中 + llo 和 m2 (AUC(M2) 中 + llo) 的曲线 (auc) 下的面积。使用下面建议的方法来评估重新密封的效率 (e):
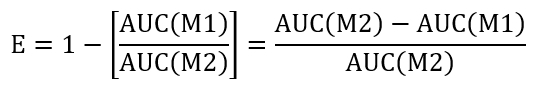
- 通过确定以下所示的效率比 (r抵消), 对控制和测试处理进行比较:
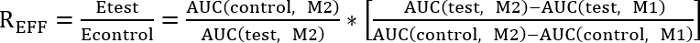
reff = 1, 试验处理对修复没有影响
reff < 1, 试验治疗抑制修复
reff > 1, 测试处理改善修复 - 使用以下公式计算曲线下的面积:
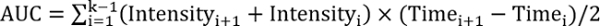 , 其中 k 是后续行动的总数。
, 其中 k 是后续行动的总数。
Access restricted. Please log in or start a trial to view this content.
结果
细胞计数的准确性: hela 细胞经常被用作哺乳动物细胞系的模型, 以探索膜修复机制。在评估细胞群体水平的膜修复时, 重要的是将所有油井中浓度相同的细胞进行平板, 以进行适当的数据解释。在检测时, 验证细胞数量在井间是否相等也很重要。本试验引入了本构表达组蛋白2b 融合到 gfp (h2b-gfp) 的平列细胞, 以便在检测其荧光核的基础上自动列举细胞。为了确定细胞计数的?...
Access restricted. Please log in or start a trial to view this content.
讨论
该方法测量了具有高通量的细胞群体水平上的膜再密封效率。它可用于筛选可能影响膜修复的细胞成分或药物库。所述检测采用了96孔板格式, 但可适用于384孔板, 以获得更高的吞吐量。该方法的优点是能够实时获得粘附活细胞的荧光测量, 而无需进行过多的细胞处理, 如细胞分离、固定或荧光标记固定后。多模板读取器 (如本协议中使用的读取器) 具有足够的灵敏度, 可在96孔板的时间间隔低至30秒?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
我们感谢 jesse kwiek 博士 (俄亥俄州立大学) 善意地允许我们使用他的多模式检测平台进行一些初步实验。本文报告的研究得到了国家卫生研究院国家过敏和传染病研究所的支持, 该研究所的编号为 ro1ai107250, 授予 stephanie seveau。内容完全由作者负责, 不一定代表国家卫生研究院的官方观点。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| SpectraMax i3x Multi-Mode Microplate Reader | Molecular Devices | i3x | |
| MiniMax 300 Imaging cytometer | Molecular Devices | 5024062 | |
| TO-PRO-3 | ThermoFisher Scientific | T3605 | |
| Propidium Iodide | ThermoFisher Scientific | P3566 | |
| HeLa | ATCC | CCL2 | |
| HeLa H2B-GFP | Millipore | SCC117 | |
| Trypsin-EDTA 0.25% | ThermoFisher Scientific | 25200056 | |
| 96-well Corning flat bottom black polystyrene tissue culture treated plate | Corning | 3603 | |
| Hanks' balanced Salts | Sigma-Aldrich | H4891 | |
| EGTA | ISC BioExpress | 0732-100G | |
| HEPES | Fisher Scientific | BP310-500 | |
| D-(+)-Glucose, HybriMax | Sigma-Aldrich | G5146-1KG |
参考文献
- Demonbreun, A. R., McNally, E. M. Plasma Membrane Repair in Health and Disease. Current Topics in Membranes. 77, 67-96 (2016).
- Howard, A. C., McNeil, A. K., McNeil, P. L. Promotion of plasma membrane repair by vitamin E. Nature Communications. 2, 597(2011).
- Howard, A. C., et al. A novel cellular defect in diabetes: membrane repair failure. Diabetes. 60 (11), 3034-3043 (2011).
- Lozano, M. L., et al. Towards the targeted management of Chediak-Higashi syndrome. Orphanet Journal of Rare Diseases. 9, 132(2014).
- Vainzof, M., et al. Dysferlin protein analysis in limb-girdle muscular dystrophies. Journal of Molecular Neuroscience. 17 (1), 71-80 (2001).
- Huynh, C., et al. Defective lysosomal exocytosis and plasma membrane repair in Chediak-Higashi/beige cells. Proceeding of the National Academy of Sciences of the United States of America. 101 (48), 16795-16800 (2004).
- Cooper, S. T., McNeil, P. L. Membrane Repair: Mechanisms and Pathophysiology. Physiological Reviews. 95 (4), 1205-1240 (2015).
- Steinhardt, R. A., Bi, G., Alderton, J. M. J. M. Cell membrane resealing by a vesicular mechanism similar to neurotransmitter release. Science. 263 (5145), 390-393 (1994).
- De Mello, W. C. Membrane sealing in frog skeletal-muscle fibers. Proceedings of the National Academy of Sciences of the United States of America. 70 (4), 982-984 (1973).
- Fishman, H. M., Tewari, K. P., Stein, P. G. Injury-induced vesiculation and membrane redistribution in squid giant axon. Biochimica et Biophysica Acta. 1023 (3), 421-435 (1990).
- Davenport, N. R., Bement, W. M. Cell repair: Revisiting the patch hypothesis. Communicative & Integrative Biology. 9 (6), 1253643(2016).
- McNeil, P. L., et al. Patching plasma membrane disruptions with cytoplasmic membrane. Journal of Cell Science. 113 (11), 1891-1902 (2000).
- Terasaki, M., Miyake, K., McNeil, P. L. Large plasma membrane disruptions are rapidly resealed by Ca2+-dependent vesicle-vesicle fusion events. Journal of Cell Biology. 139 (1), 63-74 (1997).
- Bi, G. Q., Alderton, J. M., Steinhardt, R. A. Calcium-regulated exocytosis is required for cell membrane resealing. Journal of Cell Biology. 131 (6 Pt. 2), 1747-1758 (1995).
- Tam, C., et al. Exocytosis of acid sphingomyelinase by wounded cells promotes endocytosis and plasma membrane repair. Journal of Cell Biology. 189 (6), 1027-1038 (2010).
- Rodriguez, A., et al. Lysosomes behave as Ca2+-regulated exocytic vesicles in fibroblasts and epithelial cells. Journal of Cell Biology. 137 (1), 93-104 (1997).
- Reddy, A., Caler, E. V., Andrews, N. W. Plasma membrane repair is mediated by Ca(2+)-regulated exocytosis of lysosomes. Cell. 106 (2), 157-169 (2001).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136(2014).
- Pathak-Sharma, S., et al. High-Throughput Microplate-Based Assay to Monitor Plasma Membrane Wounding and Repair. Frontiers in Cellular and Infection Microbiology. 7, 305(2017).
- Hamon, M. A., et al. Listeriolysin O: the Swiss army knife of Listeria. Trends in Microbiology. 20 (8), 360-368 (2012).
- Seveau, S. Multifaceted activity of listeriolysin O, the cholesterol-dependent cytolysin of Listeria monocytogenes. Subcellular Biochemistry. 80, 161-195 (2014).
- Osborne, S. E., Brumell, J. H. Listeriolysin O: from bazooka to Swiss army knife. Philosophical Transactions of the Royal Society of London B: Biological Sciences. 372 (1726), (2017).
- Lukoyanova, N., Hoogenboom, B. W., Saibil, H. R. The membrane attack complex, perforin and cholesterol-dependent cytolysin superfamily of pore-forming proteins. Journal of Cell Science. 129 (11), 2125-2133 (2016).
- Tweten, R. K. Cholesterol-dependent cytolysins, a family of versatile pore-forming toxins. Infection and Immunity. 73 (10), 6199-6209 (2005).
- Koster, S., et al. Crystal structure of listeriolysin O reveals molecular details of oligomerization and pore formation. Nature Communications. 5, 3690(2014).
- Duncan, J. L., Schlegel, R. Effect of streptolysin O on erythrocyte membranes, liposomes, and lipid dispersions. A protein-cholesterol interaction. Journal of Cell Biology. 67 (1), 160-174 (1975).
- Morgan, P. J., et al. Subunit organisation and symmetry of pore-forming, oligomeric pneumolysin. FEBS Letters. 371 (1), 77-80 (1995).
- Leung, C., et al. Stepwise visualization of membrane pore formation by suilysin, a bacterial cholesterol-dependent cytolysin. eLife. 3, (2014).
- Marchioretto, M., et al. What planar lipid membranes tell us about the pore-forming activity of cholesterol-dependent cytolysins. Biophysical Chemistry. 182, 64-70 (2013).
- Palmer, M., et al. Assembly mechanism of the oligomeric streptolysin O pore: the early membrane lesion is lined by a free edge of the lipid membrane and is extended gradually during oligomerization. European Molecular Biology Organization Journal. 17 (6), 1598-1605 (1998).
- Bavdek, A., et al. pH dependence of listeriolysin O aggregation and pore-forming ability. Federation of European Biochemical Society Journal. 279 (1), 126-141 (2012).
- Schuerch, D. W., Wilson-Kubalek, E. M., Tweten, R. K. Molecular basis of listeriolysin O pH dependence. Proceeding of the National Academy of Sciences of the United States of America. 102 (35), 12537-12542 (2005).
- Cassidy, S. K., O'Riordan, M. X. More than a pore: the cellular response to cholesterol-dependent cytolysins. Toxins (Basel). 5 (4), 618-636 (2013).
- Lam, J., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes L. monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. , (2017).
- Gekara, N. O., Weiss, S. Lipid rafts clustering and signalling by listeriolysin O. Biochemical Society Transactions. 32 (Pt 5), 712-714 (2004).
- Magassa, N., Chandrasekaran, S., Caparon, M. G. Streptococcus pyogenes cytolysin-mediated translocation does not require pore formation by streptolysin O. European Molecular Biology Organization Reports. 11 (5), 400-405 (2010).
- Baba, H., et al. Induction of gamma interferon and nitric oxide by truncated pneumolysin that lacks pore-forming activity. Infection and Immunity. 70 (1), 107-113 (2002).
- Carrero, J. A., Vivanco-Cid, H., Unanue, E. R. Listeriolysin o is strongly immunogenic independently of its cytotoxic activity. Public Library of Science One. 7 (3), e32310(2012).
- Coconnier, M. H., et al. Listeriolysin O-induced stimulation of mucin exocytosis in polarized intestinal mucin-secreting cells: evidence for toxin recognition of membrane-associated lipids and subsequent toxin internalization through caveolae. Cell Microbiology. 2 (6), 487-504 (2000).
- Suzuki, T., et al. DNA staining for fluorescence and laser confocal microscopy. Journal of Histochemistry and Cytochemistry. 45 (1), 49-53 (1997).
- Bink, K., et al. TO-PRO-3 is an optimal fluorescent dye for nuclear counterstaining in dual-colour FISH on paraffin sections. Histochemistry and Cell Biology. 115 (4), 293-299 (2001).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Birmingham, A., et al. Statistical methods for analysis of high-throughput RNA interference screens. Nature Methods. 6 (8), 569-575 (2009).
- Zhang, X. D. A pair of new statistical parameters for quality control in RNA interference high-throughput screening assays. Genomics. 89 (4), 552-561 (2007).
- Zhang, X. D. A new method with flexible and balanced control of false negatives and false positives for hit selection in RNA interference high-throughput screening assays. Journal of Biomolecular Screening. 12 (5), 645-655 (2007).
- Idone, V., et al. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. Journal of Cell Biology. 180 (5), 905-914 (2008).
- Davenport, N. R., et al. Membrane dynamics during cellular wound repair. Molecular Biology of the Cell. 27 (14), 2272-2285 (2016).
- Defour, A., Sreetama, S. C., Jaiswal, J. K. Imaging cell membrane injury and subcellular processes involved in repair. Journal of Visualized Experiments. (85), (2014).
- Lee, J. J. A., et al. Cell Membrane Repair Assay Using a Two-photon Laser Microscope. Journal of Visualized Experiments. (131), (2018).
- Weisleder, N., et al. Visualization of MG53-mediated cell membrane repair using in vivo and in vitro systems. Journal of Visualized Experiments. (52), (2011).
- Corrotte, M., et al. Toxin pores endocytosed during plasma membrane repair traffic into the lumen of MVBs for degradation. Traffic. 13 (3), 483-494 (2012).
- Kuismanen, E., Saraste, J. Low temperature-induced transport blocks as tools to manipulate membrane traffic. Methods in Cell Biology. 32, 257-274 (1989).
- Togo, T., et al. The mechanism of facilitated cell membrane resealing. Journal of Cell Science. 112, 719-731 (1999).
- Johnson, S. A., et al. Temperature-dependent phase behavior and protein partitioning in giant plasma membrane vesicles. Biochimica et Biophysica Acta. 1798 (7), 1427-1435 (2010).
- Lam, J. G. T., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes Listeria monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. 29 (3), 270-284 (2018).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。