Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Высок объём измерение плазматической мембраны запечатывания эффективность в клетках млекопитающих
В этой статье
Резюме
Здесь мы описываем высокой пропускной способностью на основе флуоресценции assay, который измеряет плазматической мембраны, запечатывания эффективность через анализ флуориметрический и изображений в живых клетках. Этот assay может использоваться для скрининга наркотиков или целевых генов, которые регулируют плазматической мембраны запечатывания в mammalian клетках.
Аннотация
В их физиологической среде часто подвергаются mammalian клеток механических и биохимических напряжений, которые приводят к повреждению плазматической мембраны. В ответ на эти убытки сложных молекулярных механизмов быстро запечатайте плазматической мембраны для восстановления ее барьерные функции и поддержания выживание клетки. Несмотря на 60 лет исследований в этой области мы все еще не имеют глубокое понимание ячейки запечатывания машины. С целью выявления клеточных компонентов этого управления плазматической мембраны запечатывания или препараты, которые могут улучшить запечатывания, мы разработали на основе флуоресценции высок объём assay, который измеряет плазматической мембраны, запечатывания эффективность в клетках млекопитающих культивируемых в планшет. Как модель системы для повреждения плазматической мембраны, клетки подвергаются бактериальной порами формирования токсин листериолизин O (LLO), который образует большие 30-50 Нм диаметр белковых поры в холестерин содержащих мембраны. Использование контролируемой температурой Гонав мульти-режим чтения позволяет для быстрого и чувствительной spectrofluorometric измерений в сочетании с brightfield и флуоресцентной микроскопии изображений живых клеток. Кинетический анализ интенсивности флуоресценции, испускаемых мембраны impermeant нуклеиновые кислоты привязки флюрохром отражает степень мембраны ранения и запечатывания на клеточном уровне населения, позволяя для расчета эффективности запечатывания ячейки . Флуоресцентной микроскопии изображений позволяет для перечисления клеток, которые конститутивно Экспресс флуоресцентные Химера ядерных белков гистонов 2b, в каждой скважине микропланшетов с учетом потенциальных различий в их количество и позволяет для возможного Идентификация отдельных клеточных популяций. Этот assay высок объём является мощным инструментом предполагается расширить наше понимание мембранных механизмов ремонта через скрининга для принимающих генов или экзогенно добавил соединений, что управления запечатывания плазматической мембраны.
Введение
Mammalian клетки подвергаются механические, осмотического и биохимических стресс, что приводит к потере целостности плазматической мембраны. Без быстрого и эффективного запечатывания, поврежденные клетки быстро будет поддаваться запрограммирован или некротической смерти. С 1960 года усилия, чтобы понять плазматической мембраны, запечатывания процесса были вызваны разрушительные последствия, связанные с его дисфункции. Действительно заболеваний, таких как конечности-ремень мышечной дистрофии, сахарный диабет, Синдром Чедиака-Хигаси были связаны с недостатками плазматической мембраны ремонт из-за мутации гена кодирования dysferlin, производство Расширенный гликирования конечных продуктов и дефекты в лизосомальных людьми регулятор CHS1, соответственно1,2,3,4,5,6. Однако на сегодняшний день, наше понимание мембраны запечатывания является еще ограничен7. Первоначальные исследования показали, что мембрана запечатывания инициируется приток внеклеточного Ca2 + через повреждения плазматической мембраны8,9,10. С тех пор нескольких не являющихся взаимоисключающими Ca2 +-зависимых механизмов были предложены для запечатывания ячейки. Гипотеза патч предлагает, что в близости от раны, внутриклеточных везикулы сливаются друг с другом и повреждения плазматической мембраны в качестве патч11,12,,1314. Вторая модель предлагает что экзоцитоз кальций зависимых от лизосомы на рану сайт выпускает лизосомальных ферментов кислоты sphingomyelinase, который преобразует сфингомиелин Церамид в наружный листок плазматической мембраны. Это внезапное изменение в липидного состава приводит к инициативе Церамид эндоцитоза поврежденные региона15,16,17. Наконец третий предложенный механизм включает в себя роли для от англ сортировочный комплекс необходимых для транспорта (ESCRT) для поощрения формирования выходят на внешнюю сторону пузырьки, которые бутон от плазматической мембраны18. Только ограниченный набор белков была определена в этих моделях, и их оборудование должны далее осветил.
Здесь мы описываем пробирного высокой пропускной способности, что меры плазматической мембраны, запечатывания эффективность адэрентных клеток млекопитающих подвергается повреждению при посредничестве рекомбинантных листериолизин O (LLO)19. LLO поры формирование токсин (PFT) выделяется факультативная внутриклеточных патогенов Listeria monocytogenes20,,2122 и принадлежит к MACPF/CDC (комплекс нападения мембраны, Перфорины, и холестерин зависимой cytolysin) надсемейства. MACPF являются млекопитающих формирование пор белков, участвующих в иммунной защиты, тогда как СРНП в основном являются бактериальные токсины, производимые грамположительных возбудителей, которые повреждают клетки хозяина для содействия их патогенного образ жизни23. СРНП синтезируются как водорастворимые мономеров или димеры, привязанные к холестерина в плазматической мембраны и oligomerize в prepore комплекс до 50 подразделений. Комплекс prepore затем переставляет вставлять β-нити через липидный бислой, формируя поры β-ствол, который охватывает 30-50 Нм в диаметр24,25,,2627. Эти большие поры позволяют флюсы ионов и малые клеточных компонентов и выход из клетки; Хотя некоторые исследования предложили, что поры меньших размеров, также сформированного28,29,30. Среди CDCs LLO отображает уникальные свойства, включая необратимым рН и температуры зависит от агрегации, который способствует высокой пропускной способности анализа31,32. LLO могут быть добавлены в среде культуры клеток на 4 ° c, температура разрешительной для его привязки к клеткам, но не в формировании порового комплекса. Начало порообразования затем могут быть синхронизированы с повышения температуры до 37 градусов, позволяя для эффективного распространения молекул токсина в плоскости мембраны к форме олигомеров и конформационные Ремоделирование участвующих в поры поколения. Поэтому следуя переключатель температуры, кинетическая повреждения клеток будет зависеть количество токсина, привязан к плазматической мембраны. Главное растворимых лло (не привязан к плазматической мембраны) быстро и необратимо агрегатов, когда температура достигает 37 градусов, который избавляет от необходимости смывать несвязанных токсин молекул и ограничивает степень повреждения мембраны с течением времени. И наконец потому что LLO связывает холестерин и формирует поры мембраны холестерина-богатые люди, этот assay поддается широкий спектр mammalian клеток. Это важно иметь в виду, что LLO влияет на клетки-хозяина сигнализации главным образом через порообразования, за некоторыми исключениями, в котором поры независимые ячейки сигнализации может произойти33,34,35,36 ,37,,3839. Таким образом, он не может быть исключено что LLO сигнализации деятельность может повлиять на процесс ремонта мембраны.
Этот assay непосредственно оценивает степень клеток ранив путем измерения включение клетки impermeant флюрохром, (например, пропидий йодидом) которая пассивно входит раненых клетки и становится весьма флуоресцентные, когда он ассоциируется с нуклеиновыми кислотами . Таким образом флюрохром может быть сохранен в среде культуры клеток на протяжении эксперимента, что позволяет в реальном времени анализ клеток ранив. Интенсивность флуоресценции нуклеиновых кислот связывание красителя будет возрастать концентрация токсина и для заданной концентрации токсина, будет возрастать с течением времени до тех пор, пока все поры образуются, а клетки полностью отремонтированы или пока не достигнут насыщения. Приток внеклеточного Ca2 + через поры мембраны является событием sine qua non для запечатывания. Таким образом, закрытия эффективности может быть косвенно подтверждается сравнения клеток, ранив в питательной среды, содержащие Ca2 + (ремонт разрешительной условие) до ранения в Ca2 +-бесплатный среднего (ремонт ограничительное условие). Потому что интенсивность флуоресценции нуклеиновых кислот связывание красителя прямо пропорциональна концентрации клеток в каждой скважине, важно для клеток семян на такой же концентрации на всех скважинах. Важно также для перечисления клеток в каждой скважине до и после assay чтобы отряд ячейки не происходит, как плавающие, агрегированные клетки могут скрывать флуоресценции чтений, которые могут затруднить интерпретацию данных. Для перечисления клетки, клетки, выражая-локализованных гистона 2B-GFP (H2B-GFP) были использованы в этом assay. Контролем температуры, мульти-режим, Гонав читателей объединить быстрой и высок объём измерения (используя формат 96 или 384-ну пластины) интенсивностью флюоресценции с микроскопии изображений живых клеток на 37 ° C. Последний может использоваться для перечисления количества клеток и наблюдать возможного формирования различных клеточных популяций.
В конечном счете этот assay предоставляет пользователям возможность расширить свои знания о сложности ремонта мембранных механизмов путем скрининга для принимающих молекул или ремонта экзогенно добавил соединений, которые может контролировать мембраны. Следующий протокол описывает экспериментальные шаги для определения эффективности закрытия клеток подвергается LLO и оценить последствия данного препарата или сотовой лечения по эффективности закрытия.
протокол
1. Подготовка
- Мобильный покрытие
Примечание: Человека шейки матки эпителиальных клеток HeLa и HeLa, выражая гистона 2B-GFP (H2B-GFP), были использованы в настоящем Протоколе, но этот assay может быть адаптирована к другим mammalian клеток19.- Отсоедините адэрентных клеток от 75 см2 клетки культуры колбу путем промывания клетки с 2 мл трипсина-ЭДТА 0,25%. Замените используемые трипсина 2 мл свежего трипсина ЭДТА 0,25%.
- Инкубируйте клетки при 37 ° c за 5 мин до тех пор, пока клетки округлые и отделен от колбы.
- Ресуспензируйте клетки в 8 мл среднего роста (DMEM, содержащие 10% тепло инактивированная плода бычьим сывороточным, 100 ед/мл пенициллина и стрептомицина 100 мкг/мл).
- Определение концентрации клеток с помощью Горяева и 10 мкл суспензии клеток.
- Разбавьте клетки в среднего роста к концентрации 2,5 x 105 клеток/мл.
- Налить суспензию клеток в стерильной пипеткой бассейна и тщательно перемешайте подвеска с помощью Пипетки серологические 10 мл.
- Использование 12-многоканальный микропипеткой и 200 мкл советы, распространять НеЬа клетки (2,5 х 104 клетки/100 мкл/хорошо) в трех экземплярах (или составленном) в 96-луночных плоская, ясно, черный полистирола культуры ткани лечение днище.
Примечание: В качестве примера на рисунке 1представлен механизм покрытия. - Культура клетки для 24 h в инкубатор культуры увлажненные клеток при 37 ° c и 5% CO2.
- Стоковый раствор подготовка
- Подготовка 1 Л 10 x запас буфера М (используется для подготовки М1 и м2), добавив 95 g Хэнкс сбалансированного солевого раствора, 0.476 g MgCl2 (5 мм) и 23,83 g HEPES (100 мм) до 900 мл воды. Отрегулируйте пэ-аш до 7,4 и поднять громкость до 1 л фильтр стерилизовать.
- Подготовка 50 мл 50 x (1,25 М) запасы глюкозы, добавив 11,26 g D-(+)-глюкозы в общей сложности 50 мл воды. Фильтр стерилизовать решение.
- Подготовка 50 мл 100 x (120 мм) запас кальция, добавив 0.666 g CaCl2 в общей сложности 50 мл воды. Фильтр стерилизовать решение.
- Подготовка 50 мл 10 x (50 мм) запас этиленгликоля bis(2-aminoethylether)-N, N, N', N', tetraacetic кислоты (EGTA), добавив 0.951 g EGTA 40 мл воды. Увеличение pH 8 с использованием NaOH распустить EGTA, а затем поднять объем до 50 мл. Фильтр стерилизовать решение.
- Для одной пластине 96-луночных, подготовить 50 мл средний 1 (M1, содержит Ca2 +), 50 мл 2 средних (м2, Ca2 +-бесплатно) и 15 мл 2 средних, дополненные EGTA, соответственно:
- Для M1 добавьте 5 мл 10 x буфер М, 0,5 мл 100 x CaCl2и 1 мл раствора глюкозы 50 x 43.5 мл воды.
- За м2 добавьте 5 мл 10 x буфер M и 1 мл раствора глюкозы 50 x 44 мл воды.
- За м2/EGTA, добавить 1,5 мл 10 x буфер М и 1,5 мл 10 x EGTA до 12 мл воды.
Примечание: Все растворы, содержащие пропидий йодидом (PI) должен быть подготовлен непосредственно перед добавлением к клеткам.
- Пластина читателя/изображений цитометр параметры
Примечание: Используйте читатель многорежимный пластины оснащен двумя блоки детектирования: spectrofluorometer и визуализации цитометр. Ограничьте воздействие флуоресценции, чтобы избежать Фотообесцвечивание флуорофоров.- Предварительно теплой пластины читателя до 37 ° C перед выполнением assay.
- Настройка параметров для кинетического анализа соответственно в режиме параметров :
- Выбрать для оптических конфигурации монохроматора, FL (флуоресценции)и кинетической , читать режимы и читать типа, соответственно.
- В разделе Параметры волнывыберите 9 и 15 Нм возбуждения и выбросов bandpass, соответственно. Для анализов с использованием пропидий йодидом (PI) установите возбуждения и выбросах волн 535 и 617 Нм, соответственно.
- Плиты типавыберите 96 скважин для формат пластины и заранее установленные плиты конфигурации соответствует черно стена четких днище.
- В списке Области чтениявыделите скважин, которые будут проанализированы всей кинетической.
- ПЛТ и оптикапресет вспышки за чтение до 6 и установите флажок для чтения снизу.
- В срокивставить в поле Общее время выполнения для кинетического анализа 30 мин 00:30:00 и вставьте 00:05:00 для интервала.
Примечание: Для каждой точки и одной длины волны, чтение времени полный 96-луночных плиты составляет 30 s. - Подтверждение параметров, указанных в Информации параметров справа и выберите OK. Читать пресс начать кинетическая запуска.
- Установите параметры обработки изображений соответственно в режиме параметров:
- Выберите Minimax, Imagingи конечную точку для оптических конфигурации, читать режимы и читать типа, соответственно.
- В длинах волн, флажки, передаваемая свети один или оба флуоресценции соответствующие волны возбуждения и выбросов 456/541 Нм (ГПУП) и 625/713 Нм (PI).
- Используйте те же параметры для Типа плиты и Области чтения , как они определены в шагах 1.3.2.3 и 1.3.2.4.
- В разделе Также область настройкивыберите количество сайтов в рамках хорошо к записи образа.
Примечание: 12 сайтов соответствует полной изображения. - В разделе Параметры приобретения изображенийвыберите времени экспозиции для передачи света, 541 (КГВ) и 713 (PI). Для GFP изображение все хорошо с Выдержка 20 мс/изображения. Для передачи света (TL) и PI флуоресценции, приобрести единый образ центра каждой скважины с временем экспозиции 8 и 20 мс, соответственно.
- Подтверждение параметров, указанных в информации параметров справа и выберите OK. Приобретение для визуализации на всей поверхности каждой скважины (12 изображений/хорошо) 96-луночных плиты и одной волны время ~ 15 минут чтения пресс начать изображений.
Примечание: Приобретение время одного изображения/хорошо 96-луночных плиты требует ~2.5 мин/пластины для одной длины волны. Описанные выше параметры соответствуют специального оборудования в нашей лаборатории. Spectrofluorometric измерения: ксеноновой лампы отображения волны возбуждения приращения 1.0 Нм (250-850 нм) с регулируемым 9 или 15 Нм полосовой, фотоэлектронный умножитель Трубка детектора с > 6 журнала динамический диапазон и регулируемый 15 или 25 Нм выбросов Bandpass. Imaging цитометр: источник света освещение, способный белого света, 460 Нм и 625 нм волны возбуждения с 20 Нм bandpass, фильтры выбросов, центрированного 541 Нм (108 Нм полосовой) и 713 Нм (123 Нм полосовой), соответственно, и объектив 4 X 1.25 12-битный зарядовой мегапиксела.
2. assay
Примечание: В то время assay клетки должны быть 70-90% притока. Во время мытья шаги следует удалены от средних и применяется к боковой стенке скважины (не непосредственно над клетки). Поддерживать температуру LLO в < 4 ° c для предотвращения агрегации до шага 3.1.5.
- Подготовьте запас 30 мкм PI в M1 и запас 30 мкм PI в м2 до нагревается в 37 градусов.
- Осторожно промойте клетки в плита 1, с помощью 12-многоканальный микропипеткой и 200 мкл советы, следующим образом:
- Для ремонта разрешительной условий удалите среднего роста и мыть, что клетки дважды с 200 мкл/хорошо M1 предварительно разогретую на 37 градусов. Замените носитель 100 мкл/скважина теплой M1 содержащие 30 мкм PI.
- Для ремонта ограничительных условий, удалите среднего роста и вымыть клетки один раз с 200 мкл/хорошо теплой м2, содержащие 5 мм EGTA хелат Ca2 +, следуют один умывальник с 200 мкл/хорошо м2. Замените носитель с 100 мкл/хорошо теплой м2 содержит 30 мкм PI.
- После роста средних промывают и заменить средства, содержащие пропидий йодидом, непосредственно перейти к шагу 2.1.3.
- Изображения пластина 1 под пропускаемого света, GFP и PI подробно под 1.3.3 (предварительно кинетический). Этот шаг занимает 15-20 мин.
- В период 15 мин на шаге 2.1.3 Подготовьте плита 2, с помощью 12-многоканальный микропипеткой и 200 мкл советы следующим образом:
- Место полипропиленовые Гонав 96-луночных круглым дном на льду. Настройка пластину с помощью экспериментальный дизайн, соответствующий пластина 1 (рис. 1).
- Для ремонта разрешительной условий, добавить 100 мкл/Ну ледяной М1 содержащие 60 мкм PI, с последующим добавлением 100 мкл/Ну ледяной М1, содержащих 4 x LLO или не для элемента управления.
- Для ремонта ограничительные условия, добавить 100 мкл/Ну ледяной м2 содержащие 60 мкм PI, с последующим добавлением 100 мкл/Ну ледяной м2, содержащих 4 x LLO или не для элемента управления.
- После визуализации пластина 1 (шаг 2.1.3), сразу же поместить его на льду, с помощью алюминиевой фольги для разделения пластину от прямого контакта со льдом. Разрешить плита 1, чтобы остыть в течение 5 мин.
- Использование 12-многоканальный микропипеткой и 200 мкл советы, передача 100 мкл от каждой скважины в плите 2 (шаг 2.1.4) соответствующие лунки в пластине 1. Должным образом распределить токсин в СМИ пластины 1, вставьте советы ниже мениска и осторожно извлечь тома без введения пузыри.
Примечание: Не Пипетка вверх и вниз, как это случайно может отделить клетки. - Оставьте пластину для дополнительного 1 мин позволить токсин привязать к клеткам и немедленно передавать пластина 1 пластина читателю для кинетической assay, с использованием режима spectrofluorometer (шаг 1.3.2).
- В конце кинетического анализа немедленно изображения пластина 1 (после кинетической) с помощью шаг 1.3.3.
3. Анализ: Клетки перечисление
- Определите количество клеток на основе ядерной флуоресценции, с использованием программного обеспечения ячейки перечисления микроплиты.
- В пределах параметров, выберите Re анализаи Параметры анализа изображений в разделе Категория выберите Сдержанный объект анализа с использованием 541 как волны для поиска объектов.
- В параметр найти объекты, используя опираться на изображения найти метод выберите ядер на вкладке Параметры и нажмите кнопку Применить.
- Нажмите OK и чтения инициировать алгоритм подсчета клеток.
- В качестве альтернативы если нет такой инструмент доступен, используйте программное обеспечение для анализа изображений например ImageJ для перечисления клетки.
- Откройте файл изображения в ImageJ, как стек.
- Преобразовать стек greyscale 8-битных изображений, щелкнув изображение в строке меню наведите тип и выберите пункт 8-битный.
- Вычитание фона: изображение нажмите в строке меню наведите настроитьи выберите Яркость/контраст. Отрегулируйте минимальное значение, чтобы удалить фоновый шум и выберите Применить.
- Порог для создания двоичного изображения: изображение нажмите в строке меню наведите настроитьи выберите порог. Выберите темный фон, корректировать минимальные и максимальные пороговые значения и нажмите кнопку Применить.
- В случае перекрытия ядер, водораздел инструмент может использоваться для сегмента ядер. Выберите процесс в меню, наведите двоичные и выберите водораздел.
Примечание: Это будет автоматически отдельных подключенных ядер. - Анализ изображений масках путем применения критериев, заданных пользователем (размер и округлость) для уточнения определения ядер и исключить ячейки мусор.
- Нажмите на анализ в меню, а затем анализ частиц. Установите желаемый размер (пиксель ^ 2) и округлость (значение 1 является идеальный круг) диапазонов, достаточно включить отдельные клетки/ядер.
- В раскрывающемся списке Показать выберите желаемый вариант(ы), проверьте суммироватьи нажмите кнопку OK для получения клеток.
4. Анализ: Кинетические кривые
- Перенесите кинетические данные из пластины читателя программного обеспечения аналитических данных программного обеспечения.
- Для каждого экспериментальные условия средняя интенсивность флуоресценции реплицирует на каждом timepoint, вместе с соответствующей стандартное отклонение и Среднеквадратичная ошибка среднего для каждой экспериментальной условия.
- Для каждого экспериментальные условия, отслеживать соответствующие кинетической кривой: PI интенсивности (ось y) против времени (ось x).
- Чтобы вычислить закрытия эффективность лечения данного состояния, рассчитать площадь под кривой (AUC) + LLO Н1 (AUC(M1)) и + LLO м2 (AUC(M2)). Использование подхода, предлагаемые ниже для оценки эффективности (E) запечатывания:
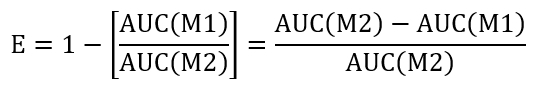
- Выполняют сравнение между контроля и испытаний лечения определяется коэффициент эффективности (REff), указанные ниже:
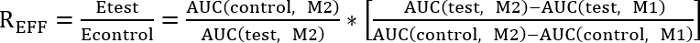
EFF R = 1, тест лечение не влияет на ремонт
REFF < 1, тест лечения препятствует ремонт
EFF R > 1, тест лечение улучшает ремонт - Вычислите площадь под кривой, используя следующее уравнение:
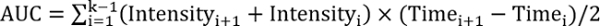 , где k — общее количество последующих мероприятий.
, где k — общее количество последующих мероприятий.
Результаты
Точность подсчета клеток: Клетки HeLa часто используются как линия клеток млекопитающих модель для изучения мембраны ремонт механизмов. При оценке мембраны ремонт на уровне популяции клеток, важно для плиты клетки на такой же концентрации на всех скважинах для правиль?...
Обсуждение
Этот assay измеряет эффективность мембраны запечатывания на уровне популяции клеток с высокой пропускной способностью. Он может использоваться экран для клеточных компонентов или наркотиков библиотек, которые могут повлиять на ремонт мембраны. Описанные assay используется формат 96-луноч...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы признаем доктора Jesse Kwiek (Университет штата Огайо) за любезно предоставленную нам возможность использовать его платформы мульти-режим обнаружения для некоторых предварительных экспериментов. Исследования в этой статье была поддержана национального института аллергии и инфекционных заболеваний национальных институтов здоровья под номером RO1AI107250 награду для Стефани Seveau. Содержание является исключительно ответственности авторов и не обязательно отражают официальную точку зрения национальных институтов здоровья.
Материалы
| Name | Company | Catalog Number | Comments |
| SpectraMax i3x Multi-Mode Microplate Reader | Molecular Devices | i3x | |
| MiniMax 300 Imaging cytometer | Molecular Devices | 5024062 | |
| TO-PRO-3 | ThermoFisher Scientific | T3605 | |
| Propidium Iodide | ThermoFisher Scientific | P3566 | |
| HeLa | ATCC | CCL2 | |
| HeLa H2B-GFP | Millipore | SCC117 | |
| Trypsin-EDTA 0.25% | ThermoFisher Scientific | 25200056 | |
| 96-well Corning flat bottom black polystyrene tissue culture treated plate | Corning | 3603 | |
| Hanks' balanced Salts | Sigma-Aldrich | H4891 | |
| EGTA | ISC BioExpress | 0732-100G | |
| HEPES | Fisher Scientific | BP310-500 | |
| D-(+)-Glucose, HybriMax | Sigma-Aldrich | G5146-1KG |
Ссылки
- Demonbreun, A. R., McNally, E. M. Plasma Membrane Repair in Health and Disease. Current Topics in Membranes. 77, 67-96 (2016).
- Howard, A. C., McNeil, A. K., McNeil, P. L. Promotion of plasma membrane repair by vitamin E. Nature Communications. 2, 597 (2011).
- Howard, A. C., et al. A novel cellular defect in diabetes: membrane repair failure. Diabetes. 60 (11), 3034-3043 (2011).
- Lozano, M. L., et al. Towards the targeted management of Chediak-Higashi syndrome. Orphanet Journal of Rare Diseases. 9, 132 (2014).
- Vainzof, M., et al. Dysferlin protein analysis in limb-girdle muscular dystrophies. Journal of Molecular Neuroscience. 17 (1), 71-80 (2001).
- Huynh, C., et al. Defective lysosomal exocytosis and plasma membrane repair in Chediak-Higashi/beige cells. Proceeding of the National Academy of Sciences of the United States of America. 101 (48), 16795-16800 (2004).
- Cooper, S. T., McNeil, P. L. Membrane Repair: Mechanisms and Pathophysiology. Physiological Reviews. 95 (4), 1205-1240 (2015).
- Steinhardt, R. A., Bi, G., Alderton, J. M. J. M. Cell membrane resealing by a vesicular mechanism similar to neurotransmitter release. Science. 263 (5145), 390-393 (1994).
- De Mello, W. C. Membrane sealing in frog skeletal-muscle fibers. Proceedings of the National Academy of Sciences of the United States of America. 70 (4), 982-984 (1973).
- Fishman, H. M., Tewari, K. P., Stein, P. G. Injury-induced vesiculation and membrane redistribution in squid giant axon. Biochimica et Biophysica Acta. 1023 (3), 421-435 (1990).
- Davenport, N. R., Bement, W. M. Cell repair: Revisiting the patch hypothesis. Communicative & Integrative Biology. 9 (6), 1253643 (2016).
- McNeil, P. L., et al. Patching plasma membrane disruptions with cytoplasmic membrane. Journal of Cell Science. 113 (11), 1891-1902 (2000).
- Terasaki, M., Miyake, K., McNeil, P. L. Large plasma membrane disruptions are rapidly resealed by Ca2+-dependent vesicle-vesicle fusion events. Journal of Cell Biology. 139 (1), 63-74 (1997).
- Bi, G. Q., Alderton, J. M., Steinhardt, R. A. Calcium-regulated exocytosis is required for cell membrane resealing. Journal of Cell Biology. 131 (6 Pt. 2), 1747-1758 (1995).
- Tam, C., et al. Exocytosis of acid sphingomyelinase by wounded cells promotes endocytosis and plasma membrane repair. Journal of Cell Biology. 189 (6), 1027-1038 (2010).
- Rodriguez, A., et al. Lysosomes behave as Ca2+-regulated exocytic vesicles in fibroblasts and epithelial cells. Journal of Cell Biology. 137 (1), 93-104 (1997).
- Reddy, A., Caler, E. V., Andrews, N. W. Plasma membrane repair is mediated by Ca(2+)-regulated exocytosis of lysosomes. Cell. 106 (2), 157-169 (2001).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136 (2014).
- Pathak-Sharma, S., et al. High-Throughput Microplate-Based Assay to Monitor Plasma Membrane Wounding and Repair. Frontiers in Cellular and Infection Microbiology. 7, 305 (2017).
- Hamon, M. A., et al. Listeriolysin O: the Swiss army knife of Listeria. Trends in Microbiology. 20 (8), 360-368 (2012).
- Seveau, S. Multifaceted activity of listeriolysin O, the cholesterol-dependent cytolysin of Listeria monocytogenes. Subcellular Biochemistry. 80, 161-195 (2014).
- Osborne, S. E., Brumell, J. H. Listeriolysin O: from bazooka to Swiss army knife. Philosophical Transactions of the Royal Society of London B: Biological Sciences. 372 (1726), (2017).
- Lukoyanova, N., Hoogenboom, B. W., Saibil, H. R. The membrane attack complex, perforin and cholesterol-dependent cytolysin superfamily of pore-forming proteins. Journal of Cell Science. 129 (11), 2125-2133 (2016).
- Tweten, R. K. Cholesterol-dependent cytolysins, a family of versatile pore-forming toxins. Infection and Immunity. 73 (10), 6199-6209 (2005).
- Koster, S., et al. Crystal structure of listeriolysin O reveals molecular details of oligomerization and pore formation. Nature Communications. 5, 3690 (2014).
- Duncan, J. L., Schlegel, R. Effect of streptolysin O on erythrocyte membranes, liposomes, and lipid dispersions. A protein-cholesterol interaction. Journal of Cell Biology. 67 (1), 160-174 (1975).
- Morgan, P. J., et al. Subunit organisation and symmetry of pore-forming, oligomeric pneumolysin. FEBS Letters. 371 (1), 77-80 (1995).
- Leung, C., et al. Stepwise visualization of membrane pore formation by suilysin, a bacterial cholesterol-dependent cytolysin. eLife. 3, (2014).
- Marchioretto, M., et al. What planar lipid membranes tell us about the pore-forming activity of cholesterol-dependent cytolysins. Biophysical Chemistry. 182, 64-70 (2013).
- Palmer, M., et al. Assembly mechanism of the oligomeric streptolysin O pore: the early membrane lesion is lined by a free edge of the lipid membrane and is extended gradually during oligomerization. European Molecular Biology Organization Journal. 17 (6), 1598-1605 (1998).
- Bavdek, A., et al. pH dependence of listeriolysin O aggregation and pore-forming ability. Federation of European Biochemical Society Journal. 279 (1), 126-141 (2012).
- Schuerch, D. W., Wilson-Kubalek, E. M., Tweten, R. K. Molecular basis of listeriolysin O pH dependence. Proceeding of the National Academy of Sciences of the United States of America. 102 (35), 12537-12542 (2005).
- Cassidy, S. K., O'Riordan, M. X. More than a pore: the cellular response to cholesterol-dependent cytolysins. Toxins (Basel). 5 (4), 618-636 (2013).
- Lam, J., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes L. monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. , (2017).
- Gekara, N. O., Weiss, S. Lipid rafts clustering and signalling by listeriolysin O. Biochemical Society Transactions. 32 (Pt 5), 712-714 (2004).
- Magassa, N., Chandrasekaran, S., Caparon, M. G. Streptococcus pyogenes cytolysin-mediated translocation does not require pore formation by streptolysin O. European Molecular Biology Organization Reports. 11 (5), 400-405 (2010).
- Baba, H., et al. Induction of gamma interferon and nitric oxide by truncated pneumolysin that lacks pore-forming activity. Infection and Immunity. 70 (1), 107-113 (2002).
- Carrero, J. A., Vivanco-Cid, H., Unanue, E. R. Listeriolysin o is strongly immunogenic independently of its cytotoxic activity. Public Library of Science One. 7 (3), e32310 (2012).
- Coconnier, M. H., et al. Listeriolysin O-induced stimulation of mucin exocytosis in polarized intestinal mucin-secreting cells: evidence for toxin recognition of membrane-associated lipids and subsequent toxin internalization through caveolae. Cell Microbiology. 2 (6), 487-504 (2000).
- Suzuki, T., et al. DNA staining for fluorescence and laser confocal microscopy. Journal of Histochemistry and Cytochemistry. 45 (1), 49-53 (1997).
- Bink, K., et al. TO-PRO-3 is an optimal fluorescent dye for nuclear counterstaining in dual-colour FISH on paraffin sections. Histochemistry and Cell Biology. 115 (4), 293-299 (2001).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Birmingham, A., et al. Statistical methods for analysis of high-throughput RNA interference screens. Nature Methods. 6 (8), 569-575 (2009).
- Zhang, X. D. A pair of new statistical parameters for quality control in RNA interference high-throughput screening assays. Genomics. 89 (4), 552-561 (2007).
- Zhang, X. D. A new method with flexible and balanced control of false negatives and false positives for hit selection in RNA interference high-throughput screening assays. Journal of Biomolecular Screening. 12 (5), 645-655 (2007).
- Idone, V., et al. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. Journal of Cell Biology. 180 (5), 905-914 (2008).
- Davenport, N. R., et al. Membrane dynamics during cellular wound repair. Molecular Biology of the Cell. 27 (14), 2272-2285 (2016).
- Defour, A., Sreetama, S. C., Jaiswal, J. K. Imaging cell membrane injury and subcellular processes involved in repair. Journal of Visualized Experiments. (85), (2014).
- Lee, J. J. A., et al. Cell Membrane Repair Assay Using a Two-photon Laser Microscope. Journal of Visualized Experiments. (131), (2018).
- Weisleder, N., et al. Visualization of MG53-mediated cell membrane repair using in vivo and in vitro systems. Journal of Visualized Experiments. (52), (2011).
- Corrotte, M., et al. Toxin pores endocytosed during plasma membrane repair traffic into the lumen of MVBs for degradation. Traffic. 13 (3), 483-494 (2012).
- Kuismanen, E., Saraste, J. Low temperature-induced transport blocks as tools to manipulate membrane traffic. Methods in Cell Biology. 32, 257-274 (1989).
- Togo, T., et al. The mechanism of facilitated cell membrane resealing. Journal of Cell Science. 112, 719-731 (1999).
- Johnson, S. A., et al. Temperature-dependent phase behavior and protein partitioning in giant plasma membrane vesicles. Biochimica et Biophysica Acta. 1798 (7), 1427-1435 (2010).
- Lam, J. G. T., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes Listeria monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. 29 (3), 270-284 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены