このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
哺乳類細胞における効率を再封止膜の高スループット測定
要約
ここで細胞の蛍光イメージング解析による効率を再封止膜を測定する高スループット蛍光を用いた測定について述べる。この試金は、薬や哺乳類細胞における原形質膜を再シールするターゲット遺伝子をスクリーニングするために使用できます。
要約
彼らの生理学的環境で哺乳類細胞はしばしば細胞膜損傷力学的および生化学的ストレスにさらされます。これらの損害に対し、複雑な分子機械は急速にそのバリア機能を回復し、細胞の生存を維持する細胞膜を再シールします。にもかかわらず、この分野の研究の 60 年間、我々 はまだ機械を再シールする細胞の完全に理解を欠いています。細胞成分の同定の目的とその制御膜を再シールまたは、再シールを改善できる薬開発した哺乳類細胞における効率を再封止膜を測定する蛍光ベースの高スループット試金マイクロ プレートで培養しました。細菌の孔形成毒素リステリオリジン O (LLO) は、大規模な 30-50 nm 径のタンパク質はコレステロールを含むの細孔を形成するのにさらされている細胞膜損傷のためのモデル システムとして膜。温度制御マルチモード マイクロ プレート リーダーは、明視野観察と細胞の蛍光顕微鏡との組み合わせで迅速・高感度カルバゾール測定に使用します。膜非透過性核酸結合の螢光によって放射される蛍光強度の速度論的解析および効率を再シールするセルの計算を可能にするセルの人口レベルで再封止膜の範囲を反映します。.蛍光顕微鏡イメージング恒常蛍光核蛋白質ヒストン 2 の b の数の潜在的な変化を考慮するマイクロ プレートの各ウェルに、キメラを表現でき、最終的な細胞の列挙が可能します。異なる細胞集団の同定。この高スループット試金は、宿主遺伝子のスクリーニングを介して膜修復メカニズムの私達の理解を拡大するまたは追加外因の強力なツールは、その制御膜を再シール化合物です。
概要
哺乳類細胞膜の完全性の損失で、その結果機械、浸透、および生化学的ストレス予告があります。迅速かつ効率的な再封止、なし損傷した細胞プログラムまたは壊死死にすぐに屈する。プロセスを再封止膜を理解する努力は、1960 年代以降、その機能障害に関連付けられている壊滅的な結果によってが動機になっています。確かに、ベイジュ症候群、糖尿病、肢帯型筋ジストロフィーなどの病気は、突然変異遺伝子符号化ジスフェリン、高度の glycation の最終製品の生産や欠陥による欠損細胞膜修復にリンクされています。ライソゾーム人身売買レギュレータ CHS1、それぞれ1,2,3,4,5,6。しかし、まで、膜の私達の理解を再シールはまだ限られた7です。初期の研究は、細胞外 Ca2 +膜破損した8,9,10までの流入によって膜を再シールを開始することを示しています。その後、いくつか非相互に排他的な Ca2 +の細胞を再シールするのに依存のメカニズムが提案されています。パッチの仮説は、傷口に近接、細胞内小胞がお互いとパッチ11,12,13,14として破損した細胞膜融合を提案します。2 番目のモデルは、カルシウム依存性の開口放出を提案する傷をリソソームのサイト リリース ライソゾーム酵素酸性スフィンゴミエリナーゼは、スフィンゴミエリンをセラミド細胞膜の外側のリーフレットに変換します。脂質組成の変化は、損傷領域15,16,17のセラミド駆動エンドサイトーシスの結果します。最後に、3 つめの提案されたメカニズムには、エンドソーム並べ替えを複雑なトランスポート (ESCRT) 膜18から発芽する外向きの小胞の形成を促進するために必要な役割が含まれます。蛋白質の限定セットのみがこれらのモデルで識別され、その機械をさらに解明する必要があります。
ここ付着性哺乳類細胞における効率を再封止膜が損傷を受けた措置を介する遺伝子組換えリステリオリジン O (LLO)19高スループット試金を記述します。LLO リステリア菌20,21,22通性細胞内病原体によって分泌される孔形成毒素 (PFT) を MACPF/CDC に属する (膜の攻撃の複合体、パーフォリンとコレステロール依存性 cytolysin) スーパーファミリー。MACPF は、哺乳類の気孔形成グラム陽性の病原体の病原性ライフ スタイル23を促進するために宿主細胞に損傷を与えるプロデュース CDCs 主に細菌毒素に対し免疫防御に関与するタンパク質。CDCs は水溶性モノマーとして合成される化や細胞膜に存在コレステロールに結合する二量体まで 50 サブユニットの孔形成前の複合体に oligomerize複雑な prepore は、直径24,25,,262730-50 nm にわたる β バレル型細孔を形成脂質全体の β ストランドを挿入するのには、再配置します。 これらの大きな毛穴がセルのうちイオンと小型携帯電話部品のフラックスを許可します。しかし、いくつかの研究は、小さいサイズの細孔が形成された28,29,30も提案しています。CDCs、間 LLO ハイスループット解析31,32を助長している不可逆的な pH と温度依存性の集計を含む固有のプロパティが表示されます。LLO は 4 ° C、孔複合体の形成ではなく、細胞への結合に許容温度で細胞培養液に追加できます。ポア形成の開始は、細孔生成に関与するフォーム オリゴマーに膜面での毒素分子の効率的な拡散と構造改造を許可する、37 ° C に温度を上げることによって、同期できます。したがって、細胞の損傷の運動、温度スイッチ、次は、細胞膜にバインド毒素の量に依存します。重要なは、水溶性 LLO (細胞膜にはバインドされていない) 迅速かつ不可逆的集約温度 37 ° C、非連結の毒素分子を離れて洗浄する必要性を軽減し、時間をかけて膜損傷の程度を制限に達したとき。最後に、LLO コレステロール バインド コレステロール豊富な膜で毛穴を形作るため、この試金は哺乳類細胞の広い範囲に従う。おいて LLO ホスト細胞の気孔の形成を介して主にシグナル伝達に影響を与えることが重要です間隙に依存しないセルのいくつかの例外を持つシグナルが発生する33,34,35,36 ,37,38,39。したがって、ことはできませんその LLO 活動は細胞膜修復のプロセスに影響を及ぼす信号を除外します。
この試金は直接セル、セル非透過性螢光色素 (例えば、ヨウ化 propidium) 受動的負傷者の細胞に入ると核酸に関連付けられると、高輝度になります定款を測定することにより負傷の程度を評価します。.したがって、螢光色素は細胞を傷つけるのリアルタイム解析をできるように、実験を通して細胞培養培地で維持できます。核酸結合色素の蛍光強度は毒素の濃度が増えるし、毒素の濃度が増加時間をかけてすべての細孔が形成され、細胞は完全に修復されか、飽和に達するまで。細胞外 Ca2 +膜の気孔を通して流入は、再封止かやりイベントです。したがって、resealing の効率が直接判明しない細胞 Ca2 +で負傷する Ca2 + (修理寛容な条件) を含む培地の負傷を比較して-無料媒体 (修理制限条件)。核酸結合色素の蛍光強度は直接各ウェルの細胞濃度に比例しているので、すべての井戸で同じ濃度でシード セルに重要です。また、細胞の剥離が発生しないこと、フローティングとして集計されるセルは、データの解釈を複雑にするかもしれない蛍光測定値を隠すことができるように試験の前後に、各ウェルの細胞を列挙することが重要です。細胞を列挙するには、ローカライズされた核ヒストン 2B GFP (H2B GFP) を発現する細胞は、この試金で使用されました。温度制御、マルチモード マイクロ プレート リーダー迅速、高スループット計測計測を組み合わせる (96 または 384 ウェル プレート フォーマットを使用して) 蛍光強度の 37 ° c. で生きている細胞の顕微鏡イメージングの後者は細胞数を列挙し、異なる細胞集団の最終的な形成を観察に使用できます。
最終的には、この試金はホスト分子のスクリーニングによって膜修復機構の複雑さの彼らの知識を拡大する機能をユーザーに提供または外追加化合物膜を制御する修理します。次のプロトコル LLO 細胞の resealing の効率を測定する実験の手順を説明し、ある薬剤または再シール効率で細胞治療の効果を評価します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 準備
- 電池めっき
注: ひと子宮頸の上皮細胞、hela 細胞、hela 細胞のヒストン 2B GFP (H2B GFP) を表現するがこのプロトコルで使用されていたが、この試金は他の哺乳類細胞19に合わせることができます。- 0.25% トリプシン-EDTA の 2 mL で細胞を洗浄することにより付着性のセル 75 cm2細胞培養用フラスコからをデタッチします。新鮮なトリプシン-EDTA 0.25 %2 mL に使用されるトリプシンを置き換えます。
- セルが丸みを帯びた、フラスコから切り離されるまでは、5 分の 37 ° C でセルを孵化させなさい。
- 8 mL の培 (10% 熱不活化牛胎児血清、100 U/mL ペニシリンおよび 100 μ g/mL ストレプトマイシンを含む DMEM) に細胞を再懸濁します。
- 診断および細胞懸濁液の 10 μ L を使用してセルの濃度を決定します。
- 2.55セル/mL の 10 倍濃度の培地に細胞を希釈します。
- 滅菌ピペット盆地に細胞懸濁液を注ぐし、10 mL の血清ピペットを使用して懸濁液を徹底的にミックスします。
- 12 マルチ チャンネル ピペットと 200 μ L のヒントを使用すると、96 ウェル フラット、明確な底、黒ポリスチレン培養処理板で 3 通 (または 4 連) の HeLa 細胞 (104セル/100 μ L/ウェル x 2.5) を配布します。
注: めっきの配置は、図 1の例として提示されます。 - 37 ° C、5% CO2で加湿細胞文化のインキュベーターで 24 時間培養します。
- 貯蔵液の準備
- ハンクス平衡塩類溶液, MgCl2 (5 mM) の 0.476 g 95 g を追加することによってバッファー M (M1 と M2 を準備するために使用) の 10 x の在庫の 1 L の準備と水 900 mL に HEPES (100 mM) の 23.83 g。PH 7.4 に調整し、1 l. フィルター滅菌にボリュームを上げます。
- 11.26 g d-(+) を追加することによってグルコース (1.25 M) 在庫 x 50 の 50 mL を準備-血糖値が 50 mL の水の合計。フィルター滅菌ソリューションです。
- 0.666 CaCl2 g を 50 mL の水の合計に追加することによってカルシウムの (120 mM) 在庫 × 100 の 50 mL を準備します。フィルター滅菌ソリューションです。
- エチレング リコール-bis(2-aminoethylether)-N, N, N の在庫を (50 mM) x 10 の 50 mL を準備 '、N'、グリコールエーテルジアミン四酢酸の 0.951 g を水 40 mL に追加することによって四酢酸 (グリコールエーテルジアミン四酢酸)。8、グリコールエーテルジアミン四酢酸を分解する NaOH を使用して pH を増加し、50 mL にボリュームを上げます。フィルター滅菌ソリューションです。
- 単一の 96 ウェル プレート、中 1 の 50 mL を準備 (M1、含んでいる Ca2 +)、中 2 の 50 mL (M2、Ca2 +-無料)、それに応じて、グリコールエーテルジアミン四酢酸を添加した培地 2 の 15 ml:
- M1 の 43.5 mL の水に 5 mL のバッファー M、100 x CaCl2, 0.5 mL と 50 x グルコースの 1 mL x 10 を追加します。
- M2、44 mL の水に 5 mL バッファー M x 10 と 50 倍のブドウ糖の 1 mL を追加します。
- M2/グリコールエーテルジアミン四酢酸、追加 10 バッファー M x と 10 の 1.5 mL の 1.5 mL 12 mL の水を x EGTA。
注: propidium ヨウ化 (PI) を含むすべてのソリューションは、直接のセルを追加する前に準備されるべき。
- プレート リーダー/イメージングの Cytometer 設定
メモ: 検出の 2 台搭載マルチモード プレート リーダーを使用して: 蛍光とイメージングの cytometer。退色、蛍光物質を避けるために蛍光露出を制限します。- 事前分析を実行する前に 37 ° c プレート リーダーを暖かきます。
- したがって運動の試金のためのパラメーターを設定設定モード内。
- 光学構成の単色光分光器、 FL (蛍光)、および運動をします、読み取りモード、およびそれぞれの種類を読みます。
- 波長の設定] の下で、9 と 15 nm 励起と放射バンドパスをそれぞれ選択します。試金による (PI)、535 と 617 nm それぞれ励起と放射の波長を設定します。
- [板タイプ] プレート形式と黒壁明確な底板に対応する事前設定板構成の96 ウェルを選択します。
- 読み取りエリアの下には、運動を通して分析する井戸を強調表示します。
- [光電子増倍管、光学、プリセット6の読み取りあたり点滅し下から読み取りのチェック ボックスをオン。
- 「タイミング、 00:30:00 30 分運動の試金ための実行時間の合計ボックスでし間隔の00:05:00を挿入します。
注: たびに、ポイントし、1 つの波長完全 96 ウェル プレートの読書時間は 30 秒。 - 右側に設定情報で指定した設定を確認し、 [ok]を選択します。運動を開始するプレス読み取りを実行します。
- 撮像パラメーターを適宜設定設定モード内。
- 光学構成のMinimax、イメージング、およびエンドポイントを選択、読み取りモード、およびそれぞれの種類を読みます。
- 波長、下ボックスをオン透過光を、いずれかまたは両方、蛍光 456/541 の励起・発光波長に対応する nm (GFP) と 625/713 nm (PI)。
- 1.3.2.3 と 1.3.2.4 の手順で定義されているプレート型読み取りエリアの同じオプションを使用します。
- 圏域の設定も、[イメージを作成するも内のサイトの数を選択します。
注: 12 のサイトは、完全によく画像に対応します。 - [画像集録設定、透過光、541 (GFP) と 713 (PI) の露光時間を選択します。GFP の 20 ms/画像の露光時間でも全体をイメージします。送信される光 (TL) と PI 蛍光 8 ~ 20 ms の露光時間で各ウェルの中心の単一のイメージをそれぞれ取得します。
- 右側の設定情報で指定した設定を確認し、 [ok]を選択します。96 ウェル プレートの各ウェル (12 画像/井戸) の表面全体を撮像と一つの波長の同期捕捉時間は 〜 15 分押して読み取りイメージングを開始します。
注: 96 ウェル プレートの単一のイメージ/井戸の取得時間は 1 つの波長の ~2.5 分/プレートを必要があります。上記のパラメーターは、当研究室では、特定の機器に対応します。カルバゾール測定: 1.0 nm 増分励起波長 (250 850 nm) 調整可能な 9 や 15 nm のバンドパスを表示するキセノン フラッシュ ランプ、光電子増倍管検出器 > 6 ログ ダイナミック レンジと調節可能な 15 または 25 nm の発光帯域通過。イメージングの cytometer: 白色光、460 のことができる、照明光源 nm と 20 nm のバンドパス、541 を中心とした排ガス浄化で 625 nm 励起波長 nm (108 nm バンドパス) と 713 nm (123 nm バンドパス)、それぞれ、4 X 目的が 1.25 に結合し、メガピクセルカメラ 12 ビット電荷結合素子。
2. アッセイ
注: 試金の時に、細胞は 70-90% の合流をする必要があります。洗浄手順の間に媒体をから削除され、よく (直接ではなく上記のセル) の側壁に適用する必要があります。3.1.5 のステップまでその凝集を予防する < 4 ° C で LLO の温度を維持します。
- 30 μ M PI M1 の在庫を準備し、M2 の 30 μ M PI の在庫で 37 ° C に加温します。
- プレート 12 マルチ チャンネル ピペットと 200 μ L ヒントを次のように使用して 1 のセルは水洗いしています。
- 修理許容条件の 37 ° C に加温 200 μ L/ウェル M1 で 2 回細胞成長培地と洗浄を削除します。培地を 100 μ L/ウェル暖かい M1 の 30 μ M PI を含むに置き換えます。
- 制限条件を修復、成長培地を取り除き、5 mM グリコールエーテルジアミン四酢酸キレート Ca2 +、200 μ L/ウェル M2 と 1 洗浄の順を含む 200 μ L/ウェル暖かい M2 と一度セルを洗浄します。100 μ L/ウェル暖かい M2 30 μ M PI を含む媒体を交換してください。
- 成長媒体の洗浄および propidium ヨウ化物を含有する培地に置き換え後は、直接 2.1.3 をステップに移動します。
- 画像板 1 透過光、GFP と PI の下 1.3.3 (事前運動) の下のとおりです。この手順は、15-20 分かかります。
- 2.1.3 の手順で 15 分間プレート 12 マルチ チャンネル ピペットと 200 μ L ヒントを次のように使用して 2 の準備します。
- 氷の上の 96 ウェル丸底ポリプロピレン マイクロ プレートを配置します。1 (図 1) をプレートに対応する、実験的なデザインを使用してプレートを構成します。
- 修理許容条件追加 100 μ L/ウェル冷たい M1 の 60 μ M 100 の添加に続いて、PI を含む μ L/ウェル冷たい M1 の 4 LLO x かコントロールが含まれています。
- 修理制限条件追加 100 μ L/ウェル冷たい M2 の 60 μ M 100 の添加に続いて、PI を含む冷たい m 2 含む 4 LLO x またはコントロールのための μ L/ウェル。
- イメージング プレート 1 (2.1.3 ステップ)、すぐに後氷との直接接触からプレートを分離するアルミ箔を使って氷の上に配置します。プレート 1 5 分間クールダウンを許可します。
- 12 マルチ チャンネル ピペットと 200 μ L のヒントを使用して、対応する井戸に板 1、2 (ステップ 2.1.4) プレートに各ウェルから 100 μ L を転送します。プレート 1 のメディアで毒素を正しく配布するには、メニスカスの下のヒントを挿入し、軽く気泡を導入することがなく、ボリュームを取り出します。
注: はない上下、ピペットのセルを切断可能性があります誤ってこれとして。 - セルにバインドし、すぐに板 1 を蛍光モード (ステップ 1.3.2) を使用して、測定用のプレート リーダーに転送する毒素を許可するようにさらに 1 分間プレートを残します。
- 運動アッセイの終わりには、1.3.3 をステップすぐにプレート 1 (運動後) を用いた画像。
3. 解析: セル列挙
- 核蛍光マイクロ プレート セル列挙ソフトウェアを使用してに基づく細胞数を決定します。
- 設定内で再分析を選択し、画像分析の設定の [カテゴリ] セクションの下で控えめなオブジェクト解析波長として541を使用してオブジェクトを検索するを選択します。
- 画像上に描画を方法を見つけることを使用してオブジェクトを検索し、オプションで [設定] タブで、核を選択し、適用を押します。
- [Ok] 、読み取りカウント アルゴリズムはセルを起動するを押します。
- また、このようなツールがない場合は、細胞を列挙する ImageJ など画像解析ソフトを使用します。
- ImageJ でスタックとして画像ファイルを開きます。
- メニュー バーでは、種類覆いかぶさるのイメージをクリックしてスタックを 8 ビットのグレースケール画像に変換し、 8 ビットを選択します。
- 背景を減算: メニュー バーのクリック画像調整、ホバーし、明るさ・ コントラストを選択します。バック グラウンド ノイズを削除し、選択適用する最小値を調整します。
- バイナリ画像を作成するしきい値: メニュー バーのクリック画像調整、ホバーし、しきい値を選択します。暗い背景、最小値と最大しきい値を調整し、適用をクリックします。
- 核をオーバラップ セグメント核へ流域のツールを使用できます。メニュー上でバイナリのプロセスをクリックし、流域を選択します。
注: これは自動的に接続された核が分離されます。 - (サイズと真円度) 核の同定を絞り込むし、細胞の残骸を除外するユーザー指定の基準を適用することによってマスクされたイメージを分析します。
- メニューとし、分析粒子分析をクリックします。目的のサイズを設定 (ピクセル ^2)、(1 の値は完全な円) 真円度の範囲を個々 の細胞核を含めるだけで十分です。
- 表示」ドロップ ダウン ボックスで必要なオプションを選択し、集計の方法、 OKセル数を得ることをクリックします。
4. 解析: 運動曲線
- プレート リーダー ソフトウェアから速度論的データを分析データ ソフトウェアに転送します。
- 各条件では, 対応する標準偏差と実験条件ごとに平均の標準誤差、各 timepoint で複製の蛍光強度の平均値します。
- 実験条件ごとに対応する運動曲線をトレース: PI 強度 (y 軸) と時間 (x 軸) です。
- 与えられた治療条件の resealing の効率を計算するには、(AUC) 曲線の下の領域を計算の + M1 の LLO (AUC(M1)) と + M2 の LLO (AUC(M2))。再シールの効率 (E) を評価するために以下に示す方法を使用します。
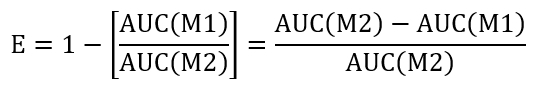
- 以下に示す効率比 (REff) を決定することによりコントロールとテスト治療の比較を実行します。
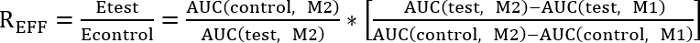
REFF = 1、テスト治療は修復に影響を与えません
REFF < 1、テスト治療の修復を阻害します。
REFF > 1、テスト治療改善修理 - 次の方程式を使用して曲線の下の領域を計算します。
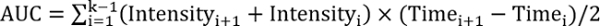 、k はフォロー アップの合計数。
、k はフォロー アップの合計数。
Access restricted. Please log in or start a trial to view this content.
結果
細胞数測定精度: HeLa 細胞は膜修復機構を探索、モデル哺乳類セルラインとして頻繁に。セルの人口レベルの細胞膜修復を評価し、適切なデータ解釈のすべての井戸で同じ濃度で細胞をプレートすることが重要です。また、井戸の間で、細胞数が同等である試金の時に確認することが重要です。恒常ヒストン 2B (H2B GFP) GFP の融合を表現する HeLa 細胞は、自動的にその蛍...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この試金は高スループット容量を持つセルの人口レベルで再封止膜の効率を測定します。使用できる細胞成分や細胞膜修復に影響を与える薬物ライブラリの画面に。説明アッセイは 96-well 版のフォーマットを使用、高いスループット 384 ウェル プレートに合わせることができます。このアッセイの利点は、過剰な細胞など細胞の剥離、固定、または蛍光標識後固定処理を必要とせずリアルタ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者が明らかに何もありません。
謝辞
我々 は、私たちはいくつかの予備的な実験のため彼のマルチモード検出プラットフォームを使用する許可していただいた博士ジェシー Kwiek (オハイオ州立大学) を認めます。この記事で報告された研究は、国立研究所のアレルギーとステファニー Seveau を受賞番号 RO1AI107250 の下で健康の国民の協会の感染症によって支持されました。内容は著者の責任と国立衛生研究所の公式見解を必ずしも表さない。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| SpectraMax i3x Multi-Mode Microplate Reader | Molecular Devices | i3x | |
| MiniMax 300 Imaging cytometer | Molecular Devices | 5024062 | |
| TO-PRO-3 | ThermoFisher Scientific | T3605 | |
| Propidium Iodide | ThermoFisher Scientific | P3566 | |
| HeLa | ATCC | CCL2 | |
| HeLa H2B-GFP | Millipore | SCC117 | |
| Trypsin-EDTA 0.25% | ThermoFisher Scientific | 25200056 | |
| 96-well Corning flat bottom black polystyrene tissue culture treated plate | Corning | 3603 | |
| Hanks' balanced Salts | Sigma-Aldrich | H4891 | |
| EGTA | ISC BioExpress | 0732-100G | |
| HEPES | Fisher Scientific | BP310-500 | |
| D-(+)-Glucose, HybriMax | Sigma-Aldrich | G5146-1KG |
参考文献
- Demonbreun, A. R., McNally, E. M. Plasma Membrane Repair in Health and Disease. Current Topics in Membranes. 77, 67-96 (2016).
- Howard, A. C., McNeil, A. K., McNeil, P. L. Promotion of plasma membrane repair by vitamin E. Nature Communications. 2, 597(2011).
- Howard, A. C., et al. A novel cellular defect in diabetes: membrane repair failure. Diabetes. 60 (11), 3034-3043 (2011).
- Lozano, M. L., et al. Towards the targeted management of Chediak-Higashi syndrome. Orphanet Journal of Rare Diseases. 9, 132(2014).
- Vainzof, M., et al. Dysferlin protein analysis in limb-girdle muscular dystrophies. Journal of Molecular Neuroscience. 17 (1), 71-80 (2001).
- Huynh, C., et al. Defective lysosomal exocytosis and plasma membrane repair in Chediak-Higashi/beige cells. Proceeding of the National Academy of Sciences of the United States of America. 101 (48), 16795-16800 (2004).
- Cooper, S. T., McNeil, P. L. Membrane Repair: Mechanisms and Pathophysiology. Physiological Reviews. 95 (4), 1205-1240 (2015).
- Steinhardt, R. A., Bi, G., Alderton, J. M. J. M. Cell membrane resealing by a vesicular mechanism similar to neurotransmitter release. Science. 263 (5145), 390-393 (1994).
- De Mello, W. C. Membrane sealing in frog skeletal-muscle fibers. Proceedings of the National Academy of Sciences of the United States of America. 70 (4), 982-984 (1973).
- Fishman, H. M., Tewari, K. P., Stein, P. G. Injury-induced vesiculation and membrane redistribution in squid giant axon. Biochimica et Biophysica Acta. 1023 (3), 421-435 (1990).
- Davenport, N. R., Bement, W. M. Cell repair: Revisiting the patch hypothesis. Communicative & Integrative Biology. 9 (6), 1253643(2016).
- McNeil, P. L., et al. Patching plasma membrane disruptions with cytoplasmic membrane. Journal of Cell Science. 113 (11), 1891-1902 (2000).
- Terasaki, M., Miyake, K., McNeil, P. L. Large plasma membrane disruptions are rapidly resealed by Ca2+-dependent vesicle-vesicle fusion events. Journal of Cell Biology. 139 (1), 63-74 (1997).
- Bi, G. Q., Alderton, J. M., Steinhardt, R. A. Calcium-regulated exocytosis is required for cell membrane resealing. Journal of Cell Biology. 131 (6 Pt. 2), 1747-1758 (1995).
- Tam, C., et al. Exocytosis of acid sphingomyelinase by wounded cells promotes endocytosis and plasma membrane repair. Journal of Cell Biology. 189 (6), 1027-1038 (2010).
- Rodriguez, A., et al. Lysosomes behave as Ca2+-regulated exocytic vesicles in fibroblasts and epithelial cells. Journal of Cell Biology. 137 (1), 93-104 (1997).
- Reddy, A., Caler, E. V., Andrews, N. W. Plasma membrane repair is mediated by Ca(2+)-regulated exocytosis of lysosomes. Cell. 106 (2), 157-169 (2001).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136(2014).
- Pathak-Sharma, S., et al. High-Throughput Microplate-Based Assay to Monitor Plasma Membrane Wounding and Repair. Frontiers in Cellular and Infection Microbiology. 7, 305(2017).
- Hamon, M. A., et al. Listeriolysin O: the Swiss army knife of Listeria. Trends in Microbiology. 20 (8), 360-368 (2012).
- Seveau, S. Multifaceted activity of listeriolysin O, the cholesterol-dependent cytolysin of Listeria monocytogenes. Subcellular Biochemistry. 80, 161-195 (2014).
- Osborne, S. E., Brumell, J. H. Listeriolysin O: from bazooka to Swiss army knife. Philosophical Transactions of the Royal Society of London B: Biological Sciences. 372 (1726), (2017).
- Lukoyanova, N., Hoogenboom, B. W., Saibil, H. R. The membrane attack complex, perforin and cholesterol-dependent cytolysin superfamily of pore-forming proteins. Journal of Cell Science. 129 (11), 2125-2133 (2016).
- Tweten, R. K. Cholesterol-dependent cytolysins, a family of versatile pore-forming toxins. Infection and Immunity. 73 (10), 6199-6209 (2005).
- Koster, S., et al. Crystal structure of listeriolysin O reveals molecular details of oligomerization and pore formation. Nature Communications. 5, 3690(2014).
- Duncan, J. L., Schlegel, R. Effect of streptolysin O on erythrocyte membranes, liposomes, and lipid dispersions. A protein-cholesterol interaction. Journal of Cell Biology. 67 (1), 160-174 (1975).
- Morgan, P. J., et al. Subunit organisation and symmetry of pore-forming, oligomeric pneumolysin. FEBS Letters. 371 (1), 77-80 (1995).
- Leung, C., et al. Stepwise visualization of membrane pore formation by suilysin, a bacterial cholesterol-dependent cytolysin. eLife. 3, (2014).
- Marchioretto, M., et al. What planar lipid membranes tell us about the pore-forming activity of cholesterol-dependent cytolysins. Biophysical Chemistry. 182, 64-70 (2013).
- Palmer, M., et al. Assembly mechanism of the oligomeric streptolysin O pore: the early membrane lesion is lined by a free edge of the lipid membrane and is extended gradually during oligomerization. European Molecular Biology Organization Journal. 17 (6), 1598-1605 (1998).
- Bavdek, A., et al. pH dependence of listeriolysin O aggregation and pore-forming ability. Federation of European Biochemical Society Journal. 279 (1), 126-141 (2012).
- Schuerch, D. W., Wilson-Kubalek, E. M., Tweten, R. K. Molecular basis of listeriolysin O pH dependence. Proceeding of the National Academy of Sciences of the United States of America. 102 (35), 12537-12542 (2005).
- Cassidy, S. K., O'Riordan, M. X. More than a pore: the cellular response to cholesterol-dependent cytolysins. Toxins (Basel). 5 (4), 618-636 (2013).
- Lam, J., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes L. monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. , (2017).
- Gekara, N. O., Weiss, S. Lipid rafts clustering and signalling by listeriolysin O. Biochemical Society Transactions. 32 (Pt 5), 712-714 (2004).
- Magassa, N., Chandrasekaran, S., Caparon, M. G. Streptococcus pyogenes cytolysin-mediated translocation does not require pore formation by streptolysin O. European Molecular Biology Organization Reports. 11 (5), 400-405 (2010).
- Baba, H., et al. Induction of gamma interferon and nitric oxide by truncated pneumolysin that lacks pore-forming activity. Infection and Immunity. 70 (1), 107-113 (2002).
- Carrero, J. A., Vivanco-Cid, H., Unanue, E. R. Listeriolysin o is strongly immunogenic independently of its cytotoxic activity. Public Library of Science One. 7 (3), e32310(2012).
- Coconnier, M. H., et al. Listeriolysin O-induced stimulation of mucin exocytosis in polarized intestinal mucin-secreting cells: evidence for toxin recognition of membrane-associated lipids and subsequent toxin internalization through caveolae. Cell Microbiology. 2 (6), 487-504 (2000).
- Suzuki, T., et al. DNA staining for fluorescence and laser confocal microscopy. Journal of Histochemistry and Cytochemistry. 45 (1), 49-53 (1997).
- Bink, K., et al. TO-PRO-3 is an optimal fluorescent dye for nuclear counterstaining in dual-colour FISH on paraffin sections. Histochemistry and Cell Biology. 115 (4), 293-299 (2001).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Birmingham, A., et al. Statistical methods for analysis of high-throughput RNA interference screens. Nature Methods. 6 (8), 569-575 (2009).
- Zhang, X. D. A pair of new statistical parameters for quality control in RNA interference high-throughput screening assays. Genomics. 89 (4), 552-561 (2007).
- Zhang, X. D. A new method with flexible and balanced control of false negatives and false positives for hit selection in RNA interference high-throughput screening assays. Journal of Biomolecular Screening. 12 (5), 645-655 (2007).
- Idone, V., et al. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. Journal of Cell Biology. 180 (5), 905-914 (2008).
- Davenport, N. R., et al. Membrane dynamics during cellular wound repair. Molecular Biology of the Cell. 27 (14), 2272-2285 (2016).
- Defour, A., Sreetama, S. C., Jaiswal, J. K. Imaging cell membrane injury and subcellular processes involved in repair. Journal of Visualized Experiments. (85), (2014).
- Lee, J. J. A., et al. Cell Membrane Repair Assay Using a Two-photon Laser Microscope. Journal of Visualized Experiments. (131), (2018).
- Weisleder, N., et al. Visualization of MG53-mediated cell membrane repair using in vivo and in vitro systems. Journal of Visualized Experiments. (52), (2011).
- Corrotte, M., et al. Toxin pores endocytosed during plasma membrane repair traffic into the lumen of MVBs for degradation. Traffic. 13 (3), 483-494 (2012).
- Kuismanen, E., Saraste, J. Low temperature-induced transport blocks as tools to manipulate membrane traffic. Methods in Cell Biology. 32, 257-274 (1989).
- Togo, T., et al. The mechanism of facilitated cell membrane resealing. Journal of Cell Science. 112, 719-731 (1999).
- Johnson, S. A., et al. Temperature-dependent phase behavior and protein partitioning in giant plasma membrane vesicles. Biochimica et Biophysica Acta. 1798 (7), 1427-1435 (2010).
- Lam, J. G. T., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes Listeria monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. 29 (3), 270-284 (2018).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved