JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
포유류 세포에서 효율 Resealing 원형질 막의 높은 처리량 측정
요약
여기는 살아있는 세포에서 fluorometric 및 이미징 분석 통해 효율 resealing 플라즈마 멤브레인을 측정 하는 높은 처리량 형광 기반 분석 결과 설명 합니다. 이 분석 결과 약 또는 포유류 세포에서 원형질 막 resealing 규제 대상 유전자 검사에 대 한 사용할 수 있습니다.
초록
그들의 생리 적인 환경에서 포유류 세포 원형질 막 손상 기계 및 생 화 확 적인 스트레스를 자주 받게 됩니다. 이러한 손해에 대응, 복잡 한 분자 기계는 빠르게 원형질 막의 장벽 기능 복원 및 세포 생존을 유지 다시 봉인. 이 분야에 있는 연구의 60 년에 불구 하 고 우리는 여전히 기계를 resealing 셀에 대 한 철저 한 이해 부족. 세포질 구성 요소를 식별 하는 목적으로 그 제어 플라즈마 멤브레인 resealing 또는 resealing, 향상 시킬 수 있는 약물 개발 했습니다 플라즈마 멤브레인 resealing 포유류 세포에 있는 효율성을 측정 하는 형광 기반의 높은 처리량 분석 결과 microplates에서 경작. 원형질 막 손상에 대 한 모델 시스템으로 서 세포 세균 기 공 형성 독 소 listeriolysin O (LLO), 큰 30 ~ 50 nm 직경 배치할 포함 하는 콜레스테롤에 숨 구멍을 형성 하에 노출 되는 세포 막. 명시 및 살아있는 세포의 형광 현미경 이미지와 함께 신속 하 고 민감한 spectrofluorometric 측정 온도 제어 멀티 모드 microplate 리더를 사용 하 여 수 있습니다. 부상 및 효율 resealing 셀의 계산을 허용 세포 인구 수준 resealing 막의 정도 반영 하는 막 impermeant 핵 산 바인딩 형광 색소에 의해 방출 되는 형광 강도의 운동 분석 . 형광 현미경 영상 constitutively 핵 단백질 히스톤 2B 잠재적인 변화 그들의 수에 대 한 계정에 미 판의 각 우물에서의 형광 키메라를 표현 하 고 결국 세포의 열거 허용 뚜렷한 세포 인구의 식별입니다. 이 높은 처리량 분석 결과 호스트 유전자에 대 한 심사를 통해 막 복구 메커니즘에 대 한 우리의 이해를 확장 하는 것으로 예상 된다 또는 것 추가 하는 강력한 도구는 제어 플라즈마 멤브레인 resealing 화합물 이다.
서문
포유류 세포 원형질 막 무결성의 손실의 결과로 기계, 삼 투, 및 생 화 확 적인 스트레스를 받습니다. 신속 하 고 효율적인 resealing 없이 손상 된 세포는 신속 하 게 프로그램 또는 회 저 성 죽음에 굴복 하 고. 1960 년대 이후, 노력 과정 resealing 플라즈마 멤브레인을 이해 하는 엄청난 결과 장애와 관련 된 동기가 있다. 실제로, 사지 띠 근 위축 증, 당뇨병, 및 Chediak-히가시 증후군 같은 질병 돌연변이 유전자 인코딩 dysferlin, 고급 glycation 엔드 제품의 생산에서 및 결함 결핍 플라즈마 막 복구에 연결 되었습니다. lysosomal 밀매 레 귤 레이 터 CHS1, 각각1,2,,34,,56. 그러나, 날짜, 막의 우리의 이해를 resealing은 여전히 제한7입니다. 초기 연구는 세포 외 캘리포니아2 + 원형질 막 손상 된8,,910의 유입에 의해 시작 막 resealing 증명 하고있다. 그 이후, 여러 비 배타적이 캘리포니아2 +-종속 메커니즘 셀 봉인에 제안 되었습니다. 패치 가설 상처에 근접, 세포내 소포는 패치11,12,,1314로 손상 된 원형질 막 서로와 퓨즈를 제안 합니다. 두 번째 모델 제안 그 칼슘 의존 exocytosis 상처에서 리소좀의 사이트 해제 하는 lysosomal 효소 산 sphingomyelinase, 원형질 막의 외부 전단에서 세 라마 이드 sphingomyelin 변환. 지질 구성에서이 갑자기 변경 결과 손상 된 지역15,,1617의 세 라마 이드 기반 endocytosis. 마지막으로, 세 번째 제안 된 메커니즘 endosomal 정렬 복잡 한 전송 (ESCRT) 플라즈마 막18에서 떨어져 새싹 외부와 접한 vesicles의 형성을 촉진 하는 데 필요한에 대 한 역할을 포함 한다. 단백질의 제한 된 집합에 대해서만 이러한 모델에서 확인 된 그리고 그들의 기계를 더 해명 합니다.
여기 우리가 대책 resealing 효율 부착 포유류 세포에서 원형질 막 손상 받게 재조합 listeriolysin O (LLO)19에 의해 중재 높은 처리량 분석 결과 설명 합니다. LLO facultative 세포내 병원 체 Listeria monocytogenes20,,2122 분 비는 기 공 형성 독 (PFT) 이며 MACPF/CDC에 속한다 (막 공격 복합물, perforin, 그리고 콜레스테롤-종속 cytolysin) superfamily입니다. MACPF는 포유류 기 공 형성 단백질 반면 CDCs 세균성 독 소 주로 면역 방어에 관련 된 그들의 병원 성 생활23홍보 호스트 세포 손상 그람 양성 병원 균에 의해 생산. CDCs 수용 성 단위체로 합성 됩니다 또는 콜레스테롤을 바인딩할 이합체 플라즈마 멤브레인에 최대 50 subunits의 복잡 한 prepore에 oligomerize. Prepore 복잡 한 지질 bilayer, β 배럴 공 직경24,25,,262730-50 nm에 걸쳐 형성에서 β-가닥을 삽입할 다음 재정렬 합니다. 이러한 큰 모 공 세포;와 이온 및 작은 세포 구성 성분의 용 허용 하지만, 일부 연구는 작은 크기의 숨 구멍 형성된28,,2930도 제안 했다. CDCs, 가운데 LLO 높은 처리량 분석31,32에 도움이 되는 돌이킬 수 없는 pH 및 온도 의존 집계를 포함 한 독특한 속성을 표시 합니다. LLO 4 ˚C, 셀, 있지만 복잡 한 기 공 형성 수 없습니다 그것의 바인딩을 허용 온도에서 세포 배양에 추가 될 수 있습니다. 기 공 형성의 개시 다음 허용 양식 올리고 하 막의 비행기에 있는 독 소 분자의 효율적인 확산에 대 한 구조적 리 모델링에 대 한 기 공 생성에 관여 하는 37 ˚C를 온도 올려서 동기화 수 있습니다. 따라서, 온도, 세포 손상의 운동에 스위치에 따라 원형질 막에 바인딩된 독 소의 양을에 달라 집니다. 중요 한 것은, 녹는 LLO (원형질 막에 바인딩되지 않은) 신속 하 고 irreversibly 집계 온도 37 ˚C, 언바운드 독 소 분자를 멀리 세척 하는 필요를 완화 하 고 시간이 지남에 막 손상의 범위를 제한에 도달 하면. 마지막으로, LLO 콜레스테롤에 바인딩하고 콜레스테롤이 풍부한 세포 막에 있는 숨 구멍을 형성,이 분석 결과 이므로 다양 한 포유류 세포에 순종. LLO 호스트 셀 기 공 형성을 통해 주로 신호에 영향을 주는 다는 것을 명심 하는 것이 중요 하다는 기 공-독립 셀에 몇 가지 예외 신호33,,3435,36 발생할 수 있습니다 ,,3738,39. 따라서, 그것은 수 없습니다 그 LLO 활동 막 복구의 과정에 영향을 미칠 수 있습니다 신호를 제외.
이 분석 결과 직접 셀 한 셀 impermeant 형광 색소 (예를 들어, propidium 요오드 화물) 수 동적으로 상처 입은 세포를 입력 하 고 높은 형광 일단 핵 산으로 연결 되는의 설립을 측정 하 여 상처의 정도 평가 . 따라서, 허용 셀 부상의 실시간 분석 실험에 걸쳐 세포 배양에는 형광 색소를 유지할 수 있습니다. 핵 산 바인딩 염료의 형광 강도 독 소의 농도 증가 하 고, 독 소의 특정된 농도 대 한 것입니다 시간이 지남에 모든 숨 구멍 형성 되 고 세포는 완전히 수리 될 때까지 또는 증가 채도 도달할 때까지. 세포 외 캘리포니아2 + 막 숨 구멍을 통해 유입 resealing에 대 한 사인 qua 비 이벤트입니다. 따라서, resealing 효율 명시 될 수 있다 직접 하지 셀 부상 포함 된 캘리포니아2 + (수리 허용 조건)는 캘리포니아2 +에서 부상 하는 문화 매체에 비교 하 여-자유로운 매체 (수리 제한적인 조건). 핵 산 바인딩 염료의 형광 강도 각 음에 셀 농도에 직접 비례 하기 때문에 모든 우물에 같은 농도에서 종자 세포에 중요 하다. 그것은 또한 전후에 셀 분리 발생 하지 않습니다, 부동,으로 집계 셀 데이터 해석 복잡 하 게 만들 수 있습니다 하는 형광 읽기 애매 한 수 있도록 분석 결과 셀에 각 잘 열거 하는 것이 중요. 셀, 열거할 지역화 핵 히스톤 2B-GFP (H2B-GFP)를 표현 하는 세포는이 분석 결과에서 사용 되었다. 온도 제어, 멀티 모드 microplate 리더 결합 형광 강렬의 급속 한, 높은 처리량 측정 (를 사용 하 여 96 또는 384-잘 플레이트 형식) 37 ° c.에 살아있는 세포의 현미경 이미징 후자는 휴대폰 번호를 열거 하 고 뚜렷한 세포 인구의 최종 형성 관찰을 사용할 수 있습니다.
궁극적으로,이 분석 결과 사용자 호스트 분자에 대 한 심사에 의해 막 복구 메커니즘의 복잡성의 그들의 지식을 확장 하는 기능을 제공 한다 또는 수리 하는 것 추가 화합물 멤브레인을 제어할 수 있습니다. 다음 프로토콜 LLO에 노출 하는 셀의 resealing 효율성을 측정 하는 실험 단계를 설명 하 고 특정된 약물 또는 resealing 효율성에 세포 치료의 효과 평가.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1입니다. 준비
- 셀 도금
참고: 인간 자 궁 경부 상피 세포, 헬러와 히스톤 2B-GFP (H2B-GFP), 표현 헬러가이 프로토콜에서 사용 되었다 그러나이 분석 결과 다른 포유류 세포19에 적용할 수 있습니다.- 0.25% Trypsin EDTA의 2 mL와 함께 셀을 세척 하 여 75 cm는2 셀은 문화 플라스 크에서 부착 세포를 분리 합니다. 사용 된 트립 신을 2 mL 신선한 트립 신-EDTA 0.25%의 바꿉니다.
- 세포는 둥글게 하 고 플라스 크에서 분리 될 때까지 5 분 동안 37 ˚C에서 세포를 품 어.
- 성장 매체 (DMEM 10% 열 비활성화 태아 둔감 한 혈 청, 100 U/mL 페니실린 그리고 100 µ g/mL 스)의 8 ml 셀 resuspend
- hemocytometer 세포 현 탁 액의 10 µ L을 사용 하 여 셀 농도 결정 합니다.
- 2.5 x 105 셀/mL의 농도에 성장 매체에 셀을 희석.
- 피 펫 멸 균 분 지에 세포 현 탁 액을 부 어 하 고 철저 하 게 현 탁 액 10 mL 혈 청 학적인 피 펫을 사용 하 여 혼합.
- 12-멀티 채널 micropipette 및 200 µ L 팁 using, 96-잘 평면, 분명 바닥, 블랙 폴리스 티 렌 조직 문화 취급 접시에 3 중 (또는 quadruplicate) HeLa 세포 (2.5 x 104 셀/100 µ L/잘) 배포 합니다.
참고: 도금 배열 그림 1예제로 제공 됩니다. - 37 ˚C와 5% CO2습도 셀 문화 인큐베이터에서 24 h에 대 한 셀을 문화.
- 재고 솔루션 준비
- 행 크 스 균형 소금 솔루션, MgCl2 (5 m m)의 0.476 g의 95 g를 추가 하 여 버퍼 M (m 1과 m 2를 준비 하는 데 사용)의 10 배 재고의 1 리터를 준비와 HEPES (100 mM)의 23.83 g을 물 900 mL를. PH 7.4에 조정 하며 볼륨 1 L. 필터 소독을 합니다.
- 11.26 g D-(+)를 추가 하 여 포도 당 (1.25 M) 재고 x 50의 50 mL를 준비-물 50 mL의 총 포도 당. 필터 솔루션 소독.
- CaCl2 0.666 g 물 50 mL의 총에 추가 하 여 칼슘의 (120mm) 재고 x 100의 50 mL를 준비 합니다. 필터 솔루션 소독.
- (50mm) 주식 에틸렌 글리콜-bis(2-aminoethylether)-N, N, n x 10의 50 mL를 준비 ', N', tetraacetic 산 (EGTA) EGTA 0.951 g 물 40 mL에 추가 하 여. 8 해산 EGTA, NaOH를 사용 하 여 pH를 증가 다음 볼륨 50 mL을 인상. 필터 솔루션 소독.
- 단일 96 잘 접시 준비 중간 1의 50 mL (M1, 포함 캘리포니아2 +), 보통 2의 50 mL (M2, 캘리포니아2 +-무료), 그리고 보통 2 EGTA, 그에 따라 보충의 15 mL:
- M 1, 물의 43.5 ml 버퍼 M, 100 x CaCl2, 0.5 mL 및 50 x 포도의 1 mL x 10의 5 mL를 추가 합니다.
- M 2에 대 한 물 44 mL를 버퍼 M x 10의 5 mL 및 50 x 포도의 1 mL를 추가 합니다.
- M2/EGTA, 추가 10 버퍼 M x 10의 1.5 mL 1.5 mL 물 12 mL를 x EGTA.
참고: 모든 솔루션 propidium 요오드 화물 (PI)를 포함 하는 셀에 추가 하기 전에 직접 준비 한다.
- 플레이트 리더/이미징 Cytometer 설정
참고: 두 명의 감지 장치를 갖춘 멀티 모드 플레이트 리더 사용:는 spectrofluorometer 및 이미징 cytometer. Photobleaching는 fluorophores 피하기 위해 형광 노출을 제한 합니다.- 사전 분석 결과 수행 하기 전에 37 ° C로 플레이트 리더를 따뜻한.
- 운동 분석 결과 대 한 매개 변수를 적절 하 게 설정 설정 모드에서:
- 단색, FL (형광), 그리고 운동 광학 구성에 대 한, 읽기 모드, 선택한 유형, 각각 읽기.
- 파장 설정에서 9와 15 nm 여기 및 방출 대역를 각각 선택 합니다. 분석 실험에 대 한 propidium 요오드 화물 (PI)를 사용 하 여 설정 여기 및 방출 파장 535와 617 nm, 각각.
- 판형, 96 웰 플레이트 형식 및 블랙 벽 분명 하단 플레이트에 해당 사전 설정된 판 구성에 대 한 선택 합니다.
- 읽기 영역에서 웰 스는 운동에 걸쳐 분석을 강조 표시 합니다.
- PMT와 광학에서 미리 읽기 6 깜박 하 고 아래에서읽기 확인란을 선택 합니다.
- 타이밍에서 운동 분석 결과 30 분의 총 실행 시간 상자에서 00시 30분: 00 을 삽입 하 고 간격에 대 한 00시 05분: 00 을 삽입 합니다.
참고: 각 시간에 대 한 포인트 이며 한 파장, 전체 96 잘 접시의 독서 시간 30 s. - 오른쪽에 설정 정보 에 지정 된 설정을 확인 하 고 확인을 선택 합니다. 보도 자료 읽기 는 운동 시작을 실행 합니다.
- 이미지 매개 변수를 적절 하 게 설정 설정 모드에서:
- 광학 구성 Minimax, 이미징, 및 끝점 을 선택 하 고 읽기 모드, 유형, 각각 읽기.
- 파장, 선택 빛 전송, 그리고 하나 또는 둘 모두 456/541의 여기 및 방출 파장에 해당 하는 형광 상자 (GFP) 및 625/713 nm (PI).
- 1.3.2.3 및 1.3.2.4 단계에서 정의 된 판형 및 읽기 영역 에 대 한 동일한 옵션을 사용 합니다.
- 잘 지역 설정에서 이미지 수를 잘 내 사이트의 수를 선택 합니다.
참고: 12 사이트 전체 잘 이미지에 해당합니다. - 이미지 수집 설정에서 541 (GFP), 및 713 (PI) 빛, 전송에 대 한 노출 시간을 선택 합니다. GFP, 잘 20 ms/이미지의 노출 시간으로 전체 이미지. 빛 (TL)과 PI 형광, 전송에 대 한 8 및 20 ms의 노출 시간으로의 각 센터의 단일 이미지를 각각 획득.
- 오른쪽에 설정 정보에 지정 된 설정을 확인 하 고 확인을 선택 합니다. 96 잘 접시의 각 음 (12 이미지/잘)의 표면 전체를 이미징 및 1 개의 파장에 대 한 수집 시간 ~ 15 분 언론 읽기 시작 영상 이다.
참고: 단일 이미지/96 잘 접시의 우물의 획득 시간 한 파장 ~2.5 분/접시 필요합니다. 위에서 설명한 매개 변수는 우리의 실험실에서 특정 장비에 해당 합니다. Spectrofluorometric 측정: 크 세 논 플래시 램프 1.0 nm 증가 여기 파장 (250-850 nm)는 조정 가능한 9 또는 15 nm 대역으로 표시, 광 전 증폭 관 관 탐지기 > 6 로그 동적 범위와 가변 15 또는 25 nm 방출 대역 통과입니다. Cytometer 이미징:는 조명 광원 수 하얀 빛, 460 nm와 20 nm 대역, 방출 필터 가운데 541에 625 nm 여기 파장 (108 nm 대역) 및 713 nm (123 nm 대역), 각각, 그리고 4 X 목표는 1.25 메가 픽셀 12 비트 전 하 결합 소자 사진기.
2입니다. 분석 결과
참고: 분석 결과의 때에 세포는 70-90% 합칠 수 있어야 합니다. 세척 단계 동안 매체에서 제거 되며 (직접 셀) 이상 잘의 측 벽에 적용 되어야 한다. < 4 단계 3.1.5까지 그것의 집계를 방지 하기 위해 ˚C에서 LLO의 온도 유지 합니다.
- M 1에서 30 µ M PI의 재고를 준비 하 고 m 2에서 30 µ M PI의 주식 37 ˚C에서 미리 예 열.
- 부드럽게 세척 접시 1 12-멀티 채널 micropipette 및 200 µ L 팁, 다음과 같이 사용 하 여 셀:
- 복구 허가 조건에 대 한 성장 매체 및 세척 셀 200 µ L/잘 m 1 두 번 37 ˚C에서 미리 예 열을 제거 합니다. 100 µ L/잘 따뜻한 M1의 30 µ M PI를 포함 하는 매체를 바꿉니다.
- 에 대 한 제한적인 조건 수리, 성장 매체를 제거 하 고 세척 셀 한번 200 µ L/잘 따뜻한 M2 5mm 킬레이트 캘리포니아2 +, 200 µ L/m 2 잘 세척 한 뒤에 EGTA를 포함 하. 30 µ M PI를 포함 100 µ L/잘 따뜻한 M2와 매체를 교체 합니다.
- 성장 매체 세척 되 고 propidium 요오드 화물을 포함 하는 매체 대체 후 2.1.3 단계로 직접 이동 합니다.
- 이미지 플레이트 1 전송된 빛, GFP, 및 PI 1.3.3 (운동 전)에서 설명한 대로. 이 단계는 15-20 분 걸립니다.
- 2.1.3 단계에서 15 분 동안 준비 접시 2 사용 하 여 12-멀티 채널 micropipette 200 µ L 팁 다음과 같습니다.
- 얼음에 96-잘 둥근 바닥 폴 리 프로필 렌 microplate를 놓습니다. 접시 접시 1 (그림 1)에 해당 하는 실험 설계를 사용 하 여 구성 합니다.
- 복구 허가 조건, 추가 100 µ L/우물의 차가운 M1 60 마이크론 PI, 100의 추가 의해 다음을 포함 포함 4 LLO x 또는 하지 컨트롤에 대 한 차가운 m1 µ L/잘.
- 수리 제한 조건 추가 100 µ L/우물의 얼음 M2 60 마이크론 PI, 뒤에 100의 추가 포함 4 LLO x 또는 하지 컨트롤에 대 한 포함 된 차가운 M2의 µ L/잘.
- 플레이트 1 (2.1.3 단계)를 즉시 이미징 후 자리에 얼음, 얼음와 직접적인 접촉에서 접시를 분리를 알루미늄 호 일을 사용 하 여. 플레이트 1 5 분 동안 진정을 허용 합니다.
- 12-멀티 채널 micropipette 및 200 µ L 팁 using, 1 접시에 해당 우물을 판 2 (단계 2.1.4)에 각 우물에서 100 µ L 전송. 격판덮개 1의 미디어에서 독 소를 제대로 배포 하는 초승달 아래 팁 넣고 부드럽게 거품 소개 없이 볼륨을 추출 합니다.
참고:이 실수로 셀 분리 수 있습니다으로 업 / 다운, 플라스틱 하지 않습니다. - 셀에 바인딩할 즉시 접시 1 접시 리더 spectrofluorometer 모드 (1.3.2 단계)를 사용 하 여 운동 분석 결과 대 한 전송을 독 소를 허용 하는 추가 1 분 동안 접시를 남겨 주세요.
- 운동 분석 결과의 끝에, 즉시 접시 1 (포스트 운동) 사용 하 여 이미지 1.3.3 단계.
3. 분석: 셀 열거형
- 미 판 셀 열거형 소프트웨어를 사용 하 여 핵 형광에 따라 셀 수를 결정 합니다.
- 설정 내에서 재 분석, 선택 하 고 이미지 분석 설정 내에서 범주 섹션에서 신중 개체 분석 파장으로 541 을 사용 하 여 개체를 찾는 대 한 선택.
- 찾을 개체 옵션을 사용 하는 이미지에 그리기 메서드를 찾는 내 설정 탭에서 핵 을 선택 하 고 적용을 누릅니다.
- 확인 및 읽기 시작 알고리즘을 계산 하는 셀을 누릅니다.
- 또는 이러한 도구를 사용할 수 있는 경우 셀을 열거할 ImageJ 같은 이미지 분석 소프트웨어를 사용 합니다.
- ImageJ, 스택으로 이미지 파일을 엽니다.
- 메뉴 표시줄, 유형, 해당 이미지 를 클릭 하 여 8 비트 그레이 스케일 이미지 스택 변환 하 고 8 비트선택 합니다.
- 배경 빼기: 메뉴 모음에서 이미지 를 클릭 조정, 위로 마우스를 이동 하 고 밝기/대비를 선택 합니다. 배경 잡음을 제거 하 고 적용을 선택 하 고 최소 값을 조정 합니다.
- 이진 이미지를 생성 하는 임계값: 메뉴 모음에서 이미지 를 클릭 조정, 위로 마우스를 이동 하 고 임계값을 선택 합니다. 어두운 배경선택, 최소 및 최대 임계값 값을 조정 하 고 적용을 클릭 합니다.
- 핵, 겹치는 경우 분수령 도구 세그먼트 핵을 사용할 수 있습니다. 이진 해당 메뉴에서 프로세스 를 클릭 하 고 분수령을 선택 합니다.
참고:이 자동으로 연결 된 핵 분리 됩니다. - 사용자가 지정한 기준 (크기와 순환)를 핵의 id를 수정 하 고 세포 파편을 제외을 적용 하 여 마스크 이미지를 분석 합니다.
- 메뉴 그리고 분석 입자에서 분석 을 클릭 합니다. 원하는 크기를 설정 (픽셀 ^2) 및 순환 (값 1은 완벽 한 동그라미) 범위는 개별 셀/핵을 포함 하는 충분 한.
- 표시 드롭다운 상자에서 원하는 옵션을 선택 하 고 확인 요약, 셀 카운트를 확인 을 클릭 합니다.
4. 분석: 키네틱 곡선
- 플레이트 리더 소프트웨어에서 분석 데이터 소프트웨어 운동 데이터를 전송.
- 각 실험 조건에 대 한 해당 표준 편차와 표준 오차 각 실험 조건에 대 한 의미의 각 timepoint에 복제의 형광 강도 평균.
- 각 실험 조건에 대 한 추적 해당 운동 곡선: PI 강도 (y 축) 시간 (x 축)에 대.
- 주어진된 처리 조건의 resealing 효율을 계산 하려면의 (AUC) 곡선 아래 면적을 계산는 + m 1에서 LLO (AUC(M1)) 및 + M2에서 LLO (AUC(M2)). 아래 resealing의 효율 (E)를 평가 하기 위해 제안 하는 방법을 사용 하 여:
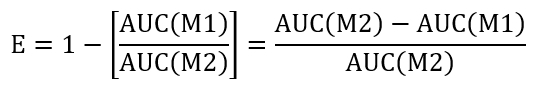
- 아래 표시 된 효율 비율 (REff)를 결정 하 여 제어 및 테스트 처리 사이 비교를 수행.
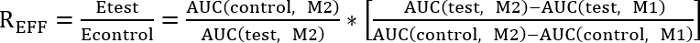
EFF R = 1, 테스트 처리는 복구에는 영향을 주지 않습니다
REFF < 1, 테스트 처리 억제 수리
EFF R > 1, 테스트 처리 개선 복구 - 다음 수식을 사용 하 여 곡선 아래 면적을 계산:
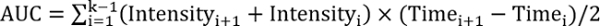 여기서 k는 후속의 총 수.
여기서 k는 후속의 총 수.
Access restricted. Please log in or start a trial to view this content.
결과
셀 계산 정확도: 헬러 세포 막 복구 메커니즘을 탐구 모델 포유류 세포 선으로 자주 사용 됩니다. 세포 인구 수준에서 막 복구를 평가할 때는 적절 한 데이터 해석에 대 한 모든 우물에 같은 농도에서 판 세포에 중요 하다. 그것은 또한 웰 스에서 핸드폰 번호는 해당 시험의 시간에 확인 해야 합니다. 헬러 세포 constitutively 히스톤 2B GFP (H2B-GFP) 융합을 표현 하는이 분석 결과?...
Access restricted. Please log in or start a trial to view this content.
토론
이 분석 결과 막 셀 인구 수준 높은 처리량 용량 resealing의 효율성을 측정 합니다. 그것은 사용 될 수 있다 세포 구성 요소 또는 막 복구에 영향을 미칠 수 있는 약물 라이브러리에 대 한 화면으로. 기술된 분석 결과 96 잘 접시 형식을 사용 하지만 높은 처리량에 대 한 384-잘 접시를 적응 시킬 수 있다. 이 분석 결과의 장점은 과도 한 셀 셀 분리, 고정, 또는 형광 라벨 후 고정 등 처리에 대 한 필요 없?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 없다.
감사의 말
우리는 친절 하 게 우리 일부 예비 실험에 대 한 그의 멀티 모드 검색 플랫폼을 사용 하 수 있도록 박사 제시 Kwiek (오하이오 주립 대학)를 인정 합니다. 이 문서에서 보고 하는 연구는 알레르기 국립 연구소와 전염병의 스테파니 Seveau에 보너스 번호 RO1AI107250에서 건강의 국가 학회에 의해 지원 되었다. 내용은 전적으로 저자의 책임 이며 반드시 국립 보건원의 공식 의견을 대표 하지 않는다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| SpectraMax i3x Multi-Mode Microplate Reader | Molecular Devices | i3x | |
| MiniMax 300 Imaging cytometer | Molecular Devices | 5024062 | |
| TO-PRO-3 | ThermoFisher Scientific | T3605 | |
| Propidium Iodide | ThermoFisher Scientific | P3566 | |
| HeLa | ATCC | CCL2 | |
| HeLa H2B-GFP | Millipore | SCC117 | |
| Trypsin-EDTA 0.25% | ThermoFisher Scientific | 25200056 | |
| 96-well Corning flat bottom black polystyrene tissue culture treated plate | Corning | 3603 | |
| Hanks' balanced Salts | Sigma-Aldrich | H4891 | |
| EGTA | ISC BioExpress | 0732-100G | |
| HEPES | Fisher Scientific | BP310-500 | |
| D-(+)-Glucose, HybriMax | Sigma-Aldrich | G5146-1KG |
참고문헌
- Demonbreun, A. R., McNally, E. M. Plasma Membrane Repair in Health and Disease. Current Topics in Membranes. 77, 67-96 (2016).
- Howard, A. C., McNeil, A. K., McNeil, P. L. Promotion of plasma membrane repair by vitamin E. Nature Communications. 2, 597(2011).
- Howard, A. C., et al. A novel cellular defect in diabetes: membrane repair failure. Diabetes. 60 (11), 3034-3043 (2011).
- Lozano, M. L., et al. Towards the targeted management of Chediak-Higashi syndrome. Orphanet Journal of Rare Diseases. 9, 132(2014).
- Vainzof, M., et al. Dysferlin protein analysis in limb-girdle muscular dystrophies. Journal of Molecular Neuroscience. 17 (1), 71-80 (2001).
- Huynh, C., et al. Defective lysosomal exocytosis and plasma membrane repair in Chediak-Higashi/beige cells. Proceeding of the National Academy of Sciences of the United States of America. 101 (48), 16795-16800 (2004).
- Cooper, S. T., McNeil, P. L. Membrane Repair: Mechanisms and Pathophysiology. Physiological Reviews. 95 (4), 1205-1240 (2015).
- Steinhardt, R. A., Bi, G., Alderton, J. M. J. M. Cell membrane resealing by a vesicular mechanism similar to neurotransmitter release. Science. 263 (5145), 390-393 (1994).
- De Mello, W. C. Membrane sealing in frog skeletal-muscle fibers. Proceedings of the National Academy of Sciences of the United States of America. 70 (4), 982-984 (1973).
- Fishman, H. M., Tewari, K. P., Stein, P. G. Injury-induced vesiculation and membrane redistribution in squid giant axon. Biochimica et Biophysica Acta. 1023 (3), 421-435 (1990).
- Davenport, N. R., Bement, W. M. Cell repair: Revisiting the patch hypothesis. Communicative & Integrative Biology. 9 (6), 1253643(2016).
- McNeil, P. L., et al. Patching plasma membrane disruptions with cytoplasmic membrane. Journal of Cell Science. 113 (11), 1891-1902 (2000).
- Terasaki, M., Miyake, K., McNeil, P. L. Large plasma membrane disruptions are rapidly resealed by Ca2+-dependent vesicle-vesicle fusion events. Journal of Cell Biology. 139 (1), 63-74 (1997).
- Bi, G. Q., Alderton, J. M., Steinhardt, R. A. Calcium-regulated exocytosis is required for cell membrane resealing. Journal of Cell Biology. 131 (6 Pt. 2), 1747-1758 (1995).
- Tam, C., et al. Exocytosis of acid sphingomyelinase by wounded cells promotes endocytosis and plasma membrane repair. Journal of Cell Biology. 189 (6), 1027-1038 (2010).
- Rodriguez, A., et al. Lysosomes behave as Ca2+-regulated exocytic vesicles in fibroblasts and epithelial cells. Journal of Cell Biology. 137 (1), 93-104 (1997).
- Reddy, A., Caler, E. V., Andrews, N. W. Plasma membrane repair is mediated by Ca(2+)-regulated exocytosis of lysosomes. Cell. 106 (2), 157-169 (2001).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136(2014).
- Pathak-Sharma, S., et al. High-Throughput Microplate-Based Assay to Monitor Plasma Membrane Wounding and Repair. Frontiers in Cellular and Infection Microbiology. 7, 305(2017).
- Hamon, M. A., et al. Listeriolysin O: the Swiss army knife of Listeria. Trends in Microbiology. 20 (8), 360-368 (2012).
- Seveau, S. Multifaceted activity of listeriolysin O, the cholesterol-dependent cytolysin of Listeria monocytogenes. Subcellular Biochemistry. 80, 161-195 (2014).
- Osborne, S. E., Brumell, J. H. Listeriolysin O: from bazooka to Swiss army knife. Philosophical Transactions of the Royal Society of London B: Biological Sciences. 372 (1726), (2017).
- Lukoyanova, N., Hoogenboom, B. W., Saibil, H. R. The membrane attack complex, perforin and cholesterol-dependent cytolysin superfamily of pore-forming proteins. Journal of Cell Science. 129 (11), 2125-2133 (2016).
- Tweten, R. K. Cholesterol-dependent cytolysins, a family of versatile pore-forming toxins. Infection and Immunity. 73 (10), 6199-6209 (2005).
- Koster, S., et al. Crystal structure of listeriolysin O reveals molecular details of oligomerization and pore formation. Nature Communications. 5, 3690(2014).
- Duncan, J. L., Schlegel, R. Effect of streptolysin O on erythrocyte membranes, liposomes, and lipid dispersions. A protein-cholesterol interaction. Journal of Cell Biology. 67 (1), 160-174 (1975).
- Morgan, P. J., et al. Subunit organisation and symmetry of pore-forming, oligomeric pneumolysin. FEBS Letters. 371 (1), 77-80 (1995).
- Leung, C., et al. Stepwise visualization of membrane pore formation by suilysin, a bacterial cholesterol-dependent cytolysin. eLife. 3, (2014).
- Marchioretto, M., et al. What planar lipid membranes tell us about the pore-forming activity of cholesterol-dependent cytolysins. Biophysical Chemistry. 182, 64-70 (2013).
- Palmer, M., et al. Assembly mechanism of the oligomeric streptolysin O pore: the early membrane lesion is lined by a free edge of the lipid membrane and is extended gradually during oligomerization. European Molecular Biology Organization Journal. 17 (6), 1598-1605 (1998).
- Bavdek, A., et al. pH dependence of listeriolysin O aggregation and pore-forming ability. Federation of European Biochemical Society Journal. 279 (1), 126-141 (2012).
- Schuerch, D. W., Wilson-Kubalek, E. M., Tweten, R. K. Molecular basis of listeriolysin O pH dependence. Proceeding of the National Academy of Sciences of the United States of America. 102 (35), 12537-12542 (2005).
- Cassidy, S. K., O'Riordan, M. X. More than a pore: the cellular response to cholesterol-dependent cytolysins. Toxins (Basel). 5 (4), 618-636 (2013).
- Lam, J., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes L. monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. , (2017).
- Gekara, N. O., Weiss, S. Lipid rafts clustering and signalling by listeriolysin O. Biochemical Society Transactions. 32 (Pt 5), 712-714 (2004).
- Magassa, N., Chandrasekaran, S., Caparon, M. G. Streptococcus pyogenes cytolysin-mediated translocation does not require pore formation by streptolysin O. European Molecular Biology Organization Reports. 11 (5), 400-405 (2010).
- Baba, H., et al. Induction of gamma interferon and nitric oxide by truncated pneumolysin that lacks pore-forming activity. Infection and Immunity. 70 (1), 107-113 (2002).
- Carrero, J. A., Vivanco-Cid, H., Unanue, E. R. Listeriolysin o is strongly immunogenic independently of its cytotoxic activity. Public Library of Science One. 7 (3), e32310(2012).
- Coconnier, M. H., et al. Listeriolysin O-induced stimulation of mucin exocytosis in polarized intestinal mucin-secreting cells: evidence for toxin recognition of membrane-associated lipids and subsequent toxin internalization through caveolae. Cell Microbiology. 2 (6), 487-504 (2000).
- Suzuki, T., et al. DNA staining for fluorescence and laser confocal microscopy. Journal of Histochemistry and Cytochemistry. 45 (1), 49-53 (1997).
- Bink, K., et al. TO-PRO-3 is an optimal fluorescent dye for nuclear counterstaining in dual-colour FISH on paraffin sections. Histochemistry and Cell Biology. 115 (4), 293-299 (2001).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Birmingham, A., et al. Statistical methods for analysis of high-throughput RNA interference screens. Nature Methods. 6 (8), 569-575 (2009).
- Zhang, X. D. A pair of new statistical parameters for quality control in RNA interference high-throughput screening assays. Genomics. 89 (4), 552-561 (2007).
- Zhang, X. D. A new method with flexible and balanced control of false negatives and false positives for hit selection in RNA interference high-throughput screening assays. Journal of Biomolecular Screening. 12 (5), 645-655 (2007).
- Idone, V., et al. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. Journal of Cell Biology. 180 (5), 905-914 (2008).
- Davenport, N. R., et al. Membrane dynamics during cellular wound repair. Molecular Biology of the Cell. 27 (14), 2272-2285 (2016).
- Defour, A., Sreetama, S. C., Jaiswal, J. K. Imaging cell membrane injury and subcellular processes involved in repair. Journal of Visualized Experiments. (85), (2014).
- Lee, J. J. A., et al. Cell Membrane Repair Assay Using a Two-photon Laser Microscope. Journal of Visualized Experiments. (131), (2018).
- Weisleder, N., et al. Visualization of MG53-mediated cell membrane repair using in vivo and in vitro systems. Journal of Visualized Experiments. (52), (2011).
- Corrotte, M., et al. Toxin pores endocytosed during plasma membrane repair traffic into the lumen of MVBs for degradation. Traffic. 13 (3), 483-494 (2012).
- Kuismanen, E., Saraste, J. Low temperature-induced transport blocks as tools to manipulate membrane traffic. Methods in Cell Biology. 32, 257-274 (1989).
- Togo, T., et al. The mechanism of facilitated cell membrane resealing. Journal of Cell Science. 112, 719-731 (1999).
- Johnson, S. A., et al. Temperature-dependent phase behavior and protein partitioning in giant plasma membrane vesicles. Biochimica et Biophysica Acta. 1798 (7), 1427-1435 (2010).
- Lam, J. G. T., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes Listeria monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. 29 (3), 270-284 (2018).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유