A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بروتوكول السريرية لإنتاج كسر الأوعية الدموية Stromal المستمدة من الأنسجة الدهنية لتجديد الغضاريف المحتملة
In This Article
Summary
نقدم هنا، بروتوكولا لإنتاج جزء الأوعية الدموية stromal المستمدة من الأنسجة الدهنية وتطبيقه على تحسين وظائف الركبة بتجديد الأنسجة مثل الغضاريف في مرضى هشاشة العظام البشرية.
Abstract
هشاشة العظام (الزراعة العضوية) واحدة من الأكثر شيوعاً اضطرابات المنهكة. في الآونة الأخيرة، بذلت محاولات عديدة لتحسين وظائف الركبتين باستخدام أشكال مختلفة من الخلايا الجذعية الوسيطة (MSCs). في كوريا ومركزات نخاع العظام والحبل السري عليها الخلايا الجذعية المشتقة من الدم "الأغذية الكورية" وإدارة المخدرات (مستخلصات) لتجديد الغضاريف. وباﻹضافة إلى ذلك، سمح مستخلصات المستمدة من الأنسجة الدهنية stromal الأوعية الدموية جزء (SVF) لحقن مشتركة في المرضى البشرية. ذاتي المستمدة من الأنسجة الدهنية لصندوق التبرعات الخاص يحتوي على مصفوفة خارج الخلية (ECM) بالإضافة إلى الخلايا الجذعية الوسيطة. إدارة المحتوى في المؤسسة يتغوط السيتوكينات المختلفة، جنبا إلى جنب مع حمض الهيالورونيك (هكتار) والبلازما الغنية بالصفائح الدموية (PRP) تنشيط بواسطة كلوريد الكالسيوم، ويمكن أن تساعد MSCs تجديد الغضاريف، وتحسين وظائف الركبة. في هذه المقالة، قدمنا بروتوكول لتحسين وظائف الركبة بتجديد الأنسجة مثل الغضاريف في المرضى البشرية مع الزراعة العضوية. أولاً ذكرت 2011 متبوعاً بعدد قليل من المنشورات إضافية نتيجة للبروتوكول. ويشمل البروتوكول شفط الدهون للحصول على ليبواسبيراتيس ذاتي مختلطة مع كولاجيناز. ثم يتم قص هذا الخليط ليبواسبيراتيس-كولاجيناز وتجانس لإزالة النسيج الليفي الكبيرة التي قد تسد الإبرة أثناء الحقن. وبعد ذلك، هو المحتضنة الخليط للحصول على التبرعات المستمدة من الأنسجة الدهنية. التبرعات المستمدة من الأنسجة الدهنية الناتجة عن ذلك، تتضمن كل المستمدة من الأنسجة الدهنية MSCs وبقايا من إدارة المحتوى في المؤسسة، يتم حقن في الركبتين للمرضى، جنبا إلى جنب مع ها وكلوريد الكالسيوم المنشط الحزب الثوري. وتشتمل على ثلاث حالات من المرضى الذين عولجوا مع بروتوكول لدينا مما أدى إلى تحسن الأم في الركبة وتورم ونطاق الحركة جنبا إلى جنب مع الأدلة التصوير بالرنين المغناطيسي للأنسجة مثل الغضاريف هيلين.
Introduction
الخلايا الجذعية الوسيطة (MSCs) من المعروف أن لديها القدرة على تجديد غضروف1،2،3،4،،من56. يمكن الحصول عليها بسهولة من مصادر مختلفة: دم الحبل السري، نخاع العظام والأنسجة الدهنية بين العديد من الآخرين. من بين هذه المصادر، هو الأنسجة الدهنية المصدر الوحيد حيث يمكن الحصول على عدد كاف من MSCs دون أي توسع الثقافة تجديد غضروف في إعدادات السريرية7،8. نخاع العظم ذاتي كسر الأوعية الدموية stromal (SVF) يمكن بسهولة الحصول عليها كذلك. عدد الخلايا الجذعية الواردة في نخاع الموسعة غير الثقافة غير منخفضة جداً7،8. قد يحتوي دم الحبل السري على عدد كاف من MSCs. ومع ذلك، دم الحبل السري ليس مصدرا متاحة بسهولة من صندوق التبرعات الخاص الذاتي.
تتوفر أساليب عديدة لمعالجة الأنسجة الدهنية للحصول على التبرعات للتطبيقات السريرية. ومن بين هذه الطريقة الحصول على MSCs من الأنسجة الدهنية باستخدام كولاجيناز، وضعت وأكده زاك et al. 5 , 6، يتم قبول جيد جداً. لقد تم تعديل هذا الأسلوب لاستخدام كولاجيناز للتطبيقات السريرية في قسم جراحة العظام. لتطبيق إعدادات السريرية، يجب أن يكون النظام نظام مغلق الاحتفاظ العقم مع الحفاظ على الراحة. تعديل معين واحد المعروضة في هذا المقال ينطوي على تجانس ليبواسبيراتيس. يتم هضمها ليبواسبيراتيس صغيرة الحجم نسبيا أسرع من الأكبر حجماً التي تسفر عن انهيار متفاوتاً من الأنسجة الدهنية. وعلاوة على ذلك، قد تنتج هذه ليبواسبيراتيس الحجم الأكبر الأنسجة الليفية التي يمكن أن تسد المحاقن والإبر أثناء إجراء حقن مشتركة9،10. بغية منع هذه القضايا، قد تجانس في ليبواسبيراتيس بالقطع وتنميق ليبواسبيراتيس قبل الحضانة مع كولاجيناز. التبرعات المستمدة من الأنسجة الدهنية الناتجة عن ذلك قد تتضمن المصفوفة خارج الخلية أكثر توحيدا (ECM) بالمقارنة مع ليبواسبيراتيس غير المتجانس11. قد يعمل ECM المعطلة الواردة في صندوق التبرعات الخاص ك سقالة12.
في عام 2009، سمح ذاتي من صندوق التبرعات الخاص المستمدة من الأنسجة الدهنية "الأغذية الكورية" وإدارة المخدرات (مستخلصات) عند معالجتها داخل مرفق طبي مع الحد الأدنى من المعالجة بواسطة طبيب13. وبعد ذلك، وقد استخدمت ذاتي المستمدة من الأنسجة الدهنية لصندوق التبرعات الخاص كعامل محتمل لتحسين وظائف الركبة في مرضى هشاشة العظام (الزراعة العضوية) التي يحتمل أن تجديد الأنسجة مثل الغضاريف10،،من1415 , 16 , 17 , 18 .
في عام 2011، أظهرت باك لأول مرة أن الخلايا الجذعية المشتقة من الأنسجة الدهنية (الخزفية) الواردة في صندوق التبرعات الخاص المستمدة من الأنسجة الدهنية يمكن تحسين وظائف الركبة احتمال تجديد الأنسجة مثل الغضاريف في مرضى الزراعة العضوية البشرية عندما حقنت مع الصفيحات الغنية البلازما (PRP) 14. وباﻹضافة إلى ذلك، سجلت باك et al. سلامة البيانات في عام 2013 التي تشمل 91 مريضا. وكان معدل كفاءة يعني ذكرت في سلامة هذه البيانات 67%15. وفي وقت لاحق، أظهرت دراسات إضافية قبل باك et al. الركبة تحسين وظائف يحتمل أن تكون بسبب تجديد الأنسجة مثل الغضاريف في المرضى الذين يعانون غضروف المسيل للدموع وتلين الغضروف10،16،17 ،18. استناداً إلى المواد التي ذكرت، فمن المعروف أن عدد الخلايا الجذعية الموجودة في 100 غرام أنسجة الدهنية لمعالجتها بواسطة البروتوكول الواردة في هذه المادة قد تتراوح من 40000000 1,000,000 تبعاً لخصائص المرضى8، 19 , 20 , 21 , 22 , 23.
نقدم هنا، على بروتوكول سريرية للركبة البشرية الزراعة العضوية باستخدام التبرعات ذاتي المستمدة من الأنسجة الدهنية مع ها والحزب الثوري المنشط مع كلوريد الكالسيوم. النسخة الأولى من هذا البروتوكول السريرية، التي تشمل نظام مغلق، ودليل للحفاظ على العقم، أفيد في 201114. البروتوكول متطابقة الأمثل، الحفاظ على العقم، وأفادت التقارير في عام 2013 و 201610،15. ويرد هنا، البروتوكول الأمثل. ويرد في الشكل 1التخطيطي نظرة عامة على البروتوكول.
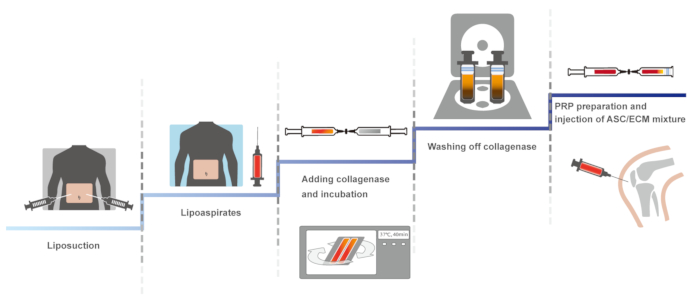
رقم 1: نظرة عامة التخطيطي للبروتوكول. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Protocol
تم التنازل عن الموافقة والموافقة على تقرير عقب تقارير عن حالة اللجنة "المجلس الاستعراض المؤسسي جامعة ميونججي" (مجويرب). علاوة على ذلك، كان هذا البروتوكول السريرية امتثالا للمبادئ التوجيهية "إعلان هلسنكي" والتنظيم لمستخلصات. للإجراءات، تم الحصول على الموافقات المستنيرة من المرضى.
1. شفط الدهون
ملاحظة: إجراء مع تقنية العقيمة.
- استخدام إدراج المعايير التالية: (1) دليل التصوير بالرنين المغناطيسي للمرحلة 3 الزراعة العضوية؛ (2) أما الذكور أو الإناث؛ (3) ما يزيد على 18 سنة عمر؛ (4) الأنسجة الدهنية (100-110 غ) كافية لشفط الدهون؛ (5) عدم رغبة في المضي قدما في التدخل الجراحي؛ (6) عدم قيام إدارة المحافظ؛ والألم تعطيل الجارية (7).
- استخدام معايير الاستبعاد التالية: (1) مرض التهاب أو النسيج الضام النشط ويعتقد أن تأثير حالة الأم (أي، الذئبة، والتهاب المفاصل، فيبروميالغيا)؛ (2) اضطراب الغدد الصماء النشطة التي قد تؤثر في حالة الألم (أي الغدة الدرقية، والسكري)؛ (3) النشطة من الاضطرابات العصبية التي قد تؤثر في حالة الألم (أي اعتلال الأعصاب المحيطية، والتصلب المتعدد)؛ (4) مرض الرئة النشطة التي تتطلب استخدام الدواء؛ (5) لا تاريخ لحقن الستيرويد المشتركة خلال 3 أشهر.
- إحضار المريض إلى غرفة العمليات مع غطاء A فئة الإخطار البيولوجية ووضع له (أو لها) في موقف ضعيف.
- تنظيف منطقة البطن للمريض مع 5% تدين (بوفيدون) وثني المريض باستخدام تقنية تعقيم، تعريض منطقة تنظيفها من البطن لشفط الدهون.
- تخدير حوالي 5 سم إينفيرو أفقياً من السرة، موقعين (واحد على الجانب الأيمن والآخر على الجانب الأيمن من السرة) من شق-يكون-باستخدام 2 مل ليدوكائين 2% دون أدرينالين بإبرة (قياس 25، 1 بوصة) في حقنه 5 مل عن طريق حقن كل موقع على مستوى البشرة.
- تخدير موقع شق إلى-يكون-باستخدام 5 مل من محلول المخدر (500 مل من الطبيعي المالحة، 40 مل من يدوكائين 2%، 20 مل من 0.5% bupivacaine، 0.5 مل أدرينالين 1: 1000) في حقنه 10 مل بإبرة (قياس 25، 1 بوصة).
- جعل شقوق 2 0.5 سم تقريبا 5 سم أسفل السرة جانبياً معسر الجلد لزيادة عمق مستوى تحت الجلد.
- استخدام شفرة رقم 11، كزة الجلد التي أثيرت لاختراق عن طريق لمستوى تحت الجلد ولكن ليس إلى اختراق من خلال جدار البطن.
- باستخدام قنية 16-قياس 20 سم، تخدير مستوى تحت الجلد في منطقة البطن السفلي كله، والتي يكون-ليبوسوكتيونيد، مع 700 إلى 800 مل الحل المخدر.
- بعد الانتهاء من تسلل كامل أسفل البطن مع الحل متورم، إعداد جهاز شفط الدهون عن طريق توصيل قنية 3.0 ملم متصل بالمحاقن من 60 مل (أو 30 مل) لشفط يدوي أو قنية مصممة خصيصا 3.0 ملم متصل عدة أجهزة الطرد المركزي، وحقنه نظام مغلق غرض إبقاء العقم، متصلاً بجهاز الشفط لشفط الدهون بمساعدة الفراغ.
- إجراء شفط الدهون للحصول على 100-110 غ أنسجة الدهنية لاستبعاد الحل متورم. عند القيام بشفط الدهون، سيتم الحصول على الأنسجة الدهنية جنبا إلى جنب مع الحل المخدر، التي ينبغي أن تفصل وإزالتها.
- لفصل الحل متورم، أولاً عن طريق الجاذبية، نقل الأنسجة الدهنية في عدة أجهزة الطرد المركزي لحقنه 60 مل والمحاقن لأسفل (أي، جزء المحاقن في الجزء السفلي). بانتظار دقيقة 5-6، سيتم فصل الأنسجة الدهنية والسائل المخدر. إزالة السائل في الجزء السفلي من المحاقن بالضغط على الجزء العلوي من المكبس المحاقن.
- تنفيذ الخطوات المذكورة أعلاه 1.9-1.11 حتى تراكمت مجموعة من 100-110 غ أنسجة الدهنية (ليبواسبيراتيس) في الركبة.
2-إعداد مزيج ASC/ECM مع نظام مغلق العقيمة
- بعد فصل مكان الحل متورم بالجاذبية وتراكم ز 50-55 من ليبواسبيراتيس لكل مجموعة أجهزة الطرد المركزي 60 مل، نظام مغلق عقيمة، مجموعات 2 أجهزة الطرد المركزي في أجهزة الطرد المركزي حاوية دلو وتدور الساعة 1600 x ز لمدة 5 دقائق، التكثيف ليبواسبيراتيس وفصل السوائل من الأنسجة الدهنية. وفي هذا يتكثف عملية أخرى، وليبواسبيراتيس قد تنتج النفط الدهنية في بعض الحالات.
- ويجري حذراً لا اهتزاز، وإزالة غطاء السلامة وسد العجز في الجزء السفلي من عدة أجهزة الطرد المركزي.
- إزالة السائل السفلي عن طريق الضغط ببطء إلى أسفل على رأس المكبس عدة أجهزة الطرد المركزي.
- في محقن منفصل 60 مل، حل 10 ملغ كولاجيناز (5 ملغ كولاجيناز محددة للنسيج الضام24 ) و 5 ملغ من كولاجيناز محددة للأنسجة الدهنية25مع 50 مل من المحلول الملحي العادي.
- مزيج من حوالي 25-30 مل ليبواسبيراتي مكثف مع كولاجيناز المذاب (5 ملغ كولاجيناز محددة للنسيج الضام) و 5 ملغ من كولاجيناز محددة للأنسجة الدهنية بنسبة 1:1 (الخامس: الخامس) عن طريق توصيل المحاقن 60 مل مجموعة أجهزة الطرد مركزي باستخدام موصل متخصصة.
- دقة مزيج ليبواسبيراتي مكثف وكولاجيناز عن طريق دفع المحتوى بين 60 مل المحاقن ومعدات الطرد المركزي باستخدام قضيب أو دافع.
- نقل الخليط في ليبواسبيراتي وفي كولاجيناز مرة أخرى إلى 60 مل المحاقن.
- قم بتوصيل كل 60 مل حقنه تحتوي على الخليط مع الخالطون أنسجة التي تحتوي على شفرات.
- الاتصال حقنه فارغة 60 مل في الطرف الآخر من الخالطون.
- دفع الخليط إلى المحاقن 60 مل أخرى من خلال الخالطون 4-6 مرات، مما أدى إلى قطع وتنميق ليبواسبيراتي.
- نقل ليبواسبيراتي المتجانس وخليط كولاجيناز مرة أخرى إلى مجموعات أجهزة الطرد المركزي 60 مل من خلال رابط المتخصصة
- وضع معدات الطرد المركزي في حاوية لتوضع في حاضنة الذي تم مسبقاً ساخنة في 37 درجة مئوية.
- احتضان مجموعات اثنين من أجهزة الطرد المركزي مع الخليط المتجانس في 37 درجة مئوية لمدة 40 دقيقة بينما تناوب 45 لفة في الدقيقة.
- وبعد 40 دقيقة الحضانة، إزالة الحاوية من الحاضنة بطريقة عقيمة. ثم إزالة معدات الطرد المركزي ووضعها في جهاز الطرد مركزي.
- الطرد المركزي الخلائط في 800 x ز لمدة 5 دقائق لفصل صندوق التبرعات الخاص المستمدة من الأنسجة الدهنية.
- بعد الطرد المركزي، إزالة المادة طافية (التي تشمل كولاجيناز وهضم الأنسجة الدهنية) من كل مجموعات أجهزة الطرد المركزي بإزالة الغطاء حقنه على رأس المكبس ووضع حقنه 30 مل على المكبس فتح قفل عن طريق حقنه اتصال.
- اضغط لأسفل الجزء البرميل من المحاقن 30 مل للمادة طافية لملء في محقن 30 مل ببطء.
- اضغط لأسفل فوهة المحقن 30 مل كل الطريق وصولاً إلى مل 3-4 آخر الجزء السفلي من عدة أجهزة الطرد المركزي، تاركاً فقط الماضي 3-4 مل من صندوق التبرعات الخاص المستمدة من الأنسجة الدهنية. يتم تجاهل المادة طافية.
- إزالة المحاقن 30 مل من الجزء العلوي من المكبس وملء المحاقن مع الدكستروز 5% في الحل في المسابقة لاكتاتيد (D5LR).
- عن طريق ربط المحاقن 30 مل مليئة D5LR على رأس المكبس فتح، ملء مجموعات أجهزة الطرد المركزي، الذي يحتوي على 3-4 مل من صندوق التبرعات الخاص المستمدة من الأنسجة الدهنية، مع D5LR تصل إلى 55 مل.
- إزالة المحاقن 30 مل وكاب المكبس والطرد المركزي في مجموعات أجهزة الطرد المركزي مرة أخرى في 300 x غ لمدة 4 دقائق.
- كرر الخطوات من 2.17 2.21 لمجموعة الغسالات 4. كولاجيناز المستخدمة إكسينوجينيك. ولذلك، تتم إزالة كولاجيناز معظم من الغسالات 4. بيد لموافقة إدارة الأغذية والعقاقير، صقل للبروتوكول قد تكون ضرورية لإزالة بقايا كولاجيناز تماما في الحجم النهائي، على الرغم من أن المبلغ الحالي من بقايا كولاجيناز قد تكون لا تذكر للمرضى التي ليس لديها أي السريرية الآثار الجانبية.
- بعد استخدام الطرد المركزيال 4، بغية الحصول على صندوق التبرعات الخاص النهائي للحقن، إزالة غطاء السلامة وسد العجز في افتتاح أسفل مجموعة أجهزة الطرد المركزي، دون هز أو تشغيل عدة أجهزة الطرد المركزي.
- إرفاق حقنه 20 مل إلى أسفل مجموعة أجهزة الطرد المركزي فتح باستخدام موصل مصممة خصيصا.
- سحب المكبس للمحاقن عدة مرات ذهابا وإيابا يهز الخلايا التي استقرت في الجزء السفلي من عدة أجهزة الطرد المركزي.
- إزالة الحجم الإجمالي المطلوب لصندوق التبرعات الخاص الذي يتضمن الخزفية وإدارة المحتوى في المؤسسة جنبا إلى جنب مع الخلايا والأنسجة الأخرى (عادة حوالي 3-4 مل من كل مجموعة أجهزة الطرد المركزي لحقن الركبة المشتركة).
3-PRP التحضير مع تقنية تعقيم
- أثناء إعداد الخزفية وإدارة المحتوى في المؤسسة، رسم 30 مل دم الذاتي مع 2.5 مل من محلول سكر العنب سترات التخثر.
- نقل الدم مرسومة لمعدات الطرد المركزي 60 مل.
- الطرد المركزي الدم مرسومة في 730 x ز لمدة 5 دقائق وإزالة المادة طافية في مجموعة جديدة من أجهزة الطرد مركزي 60 مل. الطرد المركزي المادة طافية في 1300 س ز لمدة دقيقة 4، أسفر عن 3-4 مل من الحزب الثوري الشعبي.
- حق قبل الحقن، إضافة كلوريد الكالسيوم 3% (w/v) بنسبة 10:2 (PRP: كلوريد الكالسيوم، والخامس: الخامس) إلى الحزب الثوري لتنشيطه.
- إضافة 0.5% (w/v) هكتار، سقالة، إلى الحزب الثوري المنشط مع كلوريد الكالسيوم. تنشيط هذه الخزفية مع إدارة المحتوى في المؤسسة، جنبا إلى جنب مع الحزب الثوري، بواسطة كلوريد الكالسيوم، وها الخليط ASC/إدارة المحتوى في المؤسسة.
4-الرابطة/إدارة المحتوى المؤسسي القائم على خليط العلاج
- تنظيف الركبة للمريض مع تدين 5% وثني ذلك بطريقة عقيمة.
- جس الأمامي للركبة لمساحة مشتركة بين عظام الفخذ والدانية.
- تخدير موقع الحقن سطحي مع يدوكائين المخفف (1 مل يدوكائين 1% المخفف مع 4 مل من المحلول الملحي العادي) من الجلد للتو خارج الكبسولة المشتركة.
- تخدير داخل الكبسولة المشتركة مع روبيفاكيني المخفف (0.75% 1 مل روبيفاكيني المخفف مع 3 مل من المحلول الملحي العادي).
- ميكس 2 مل من ها لمل 6-8 من صندوق التبرعات الخاص الواردة في حقنه 20 مل من خلال الرابط حقنه بحقنه.
- باستخدام موصل حقنه بحقنه، أضف 0.4 مل كلوريد الكالسيوم لمل 3-4 من الحزب الثوري الشعبي الذي تم إعداده مسبقاً ذاتي ويجري الاستعداد في حقنه 5 مل.
- الجمع بين 3.5-4.5 مل كلوريد الكالسيوم PRP/في حقنه 5 مل مع 8-10 مل مخلوط هكتار/صندوق التبرعات الخاص في محقنة 20 مل عبر موصل حقنه بحقنه.
- فورا بحقن الخليط (حوالي 12-15 مل) ببطء المشترك تيبيو الفخذ الأمامي من الركبتين مع أو بدون توجيه الموجات فوق الصوتية باستخدام إبرة قياس 18 38 ملم.
- بعد الحقن، ضمادة الحقن مع الضغط بطي الشاش القطن 4 x 4 4 مرات ووضع الأشرطة فوق شاش 4 × 4 مطوية.
- إرشاد المريض للبقاء لا يزال 60 دقيقة للسماح لمرفق خلية.
- إرشاد المريض للحد من أنشطة للحد الأدنى من 1 أسبوع بعد خروجه من المستشفى.
- عودة إلى العيادة لحقن إضافية ثلاثة من الحزب الثوري الشعبي تنشيطه بواسطة كلوريد الكالسيوم أكثر من 3 أسابيع.
5-المعالجة اللاحقة متابعة
- تقييم المريض في الأسبوع الممتد من 2 و 4 و 16 (18 أو 22) لتحسين الألم من حيث الحجم التناظرية البصري (VAS) وتحسين وظيفة من حيث المعلمات العلاج الطبيعي. تحديد الفهرس تصنيف وظيفي (الجمعة) وخدمات القيمة المضافة، ونطاق الحركة (ROM) كما هو موضح سابقا26،27.
- متابعة المريض بعد العلاج بالرنين المغناطيسي 3 أشهر بعد العلاج.
النتائج
ثلاثة مرضى (إحدى الإناث 87 عاماً مع المرحلة 3 من الزراعة العضوية، وذكر عمره 68 سنة واحد مع المرحلة 3 من الزراعة العضوية، وامرأة عمرها 60 عاماً مع مرحلة الزراعة العضوية 3) دون أي الماضي هامة التاريخ الطبي المقدمة إلى العيادة مع الأم في الركبة المستمرة والمطلوب لإمكانات ذاتي ال?...
Discussion
وفي عام 2001، زاك وآخرون. عزل الخلايا الجذعية من الأنسجة الدهنية عن طريق تحطيم المصفوفة الكولاجين كولاجيناز6. بعد ذلك، أظهر الفريق أنه يمكن تحويل هذه الخلايا الجذعية المعزولة من الأنسجة الدهنية إلى الغضاريف والأنسجة الأخرى من ميسوديرم في الأصل، تثبت أن هذه الخلايا الجذعي?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ويسلم مقدم البلاغ الدعم من موظفي "العيادة الطبية ميبرو" وتصميم الشكل بجبيل/ديفيد "لي". هذا العمل كان يدعمها المنح البحثية من الحيوية وبرنامج تطوير التكنولوجيا الطبية من جبهة الخلاص الوطني تموله مست (رقم 2017M3A9E4078014-جبهة الخلاص الوطني)؛ والوطنية بحوث مؤسسة من كوريا (جبهة الخلاص الوطني) الممولة من وزارة العلوم وتكنولوجيا المعلومات والاتصالات (أرقام 2017R1A2B4002315 جبهة الخلاص الوطني وجبهة الخلاص الوطني-2016R1C1B2010308).
Materials
| Name | Company | Catalog Number | Comments |
| Material | |||
| 5% Betadine (povidone-iodine) | Firson Co., Ltd. | 657400260 | |
| 2% Lidocaine | Daehan Pharmaceutical Co. | 670603480 | |
| Tumescent solution | Myungmoon Pharm. Co. Ltd. | N01BB01 | The solution was composed of 500 mL normal saline, 40 mL 2% lidocaine, 20 mL 0.5% marcaine, and 0.5 mL epinephrine 1:1000. |
| Liberase TL and TM research grade | Roche Applied Science | 5401020001 | |
| D5LR | Dahan Pharm. Co., Ltd. | 645101072 | Dextrose 5% in lactated Ringer's solution |
| Anticoagulant citrate dextrose solution | Fenwal, Inc. | NDC:0942-0641 | The solution was composed of 0.8% citric acid, 0.22% sodium citrate, and 0.223% dextrose. |
| 3% (w/v) Calcium chloride | Choongwae Pharmaceutical Co. | 644902101 | |
| 0.5% (w/v) HA (Hyaluronic acid ) | Dongkwang pharm. Co., Ltd. | 645902030 | |
| 0.25% Ropivacaine | Huons Co., Ltd. | 670600150 | |
| Equipment | |||
| 3.0 mm Cannula | WOOJU Medical Instruments Co. | ML30200 | |
| 60-mL Luer-Lock syringe | BD (Becton Dickinson) | 309653 | |
| Centrifuge Barrel Kit | CPL Co., Ltd. | 30-0827044 | |
| Tissue homogenizer that contains blades | CPL Co., Ltd. | 30-0827045 | |
| Rotating incubator mixer | Medikan Co., Ltd | MS02060092 | |
| Centrifuge | Hanil Scientific Inc. | CE1133 | |
| Magnetic Resonance Imaging | Philips Medical Systems Inc. | 18068 | |
| Ultrasound Imaging System | Samsung Medison co., Ltd | CT-LK-V10-ICM-09.05.2007 |
References
- Arnoczky, S. P. Building a meniscus. Biologic considerations. Clinical Orthopaedics and Related Research. (367 Suppl), S244-S253 (1999).
- Barry, F. P. Mesenchymal stem cell therapy in joint disease. Novartis Foundation Symposium. 249, 86-241 (2003).
- Usuelli, F. G., et al. Adipose-derived stem cells in orthopaedic pathologies. British Medical Bulletin. 124 (1), 31-54 (2017).
- Zhang, H. N., Li, L., Leng, P., Wang, Y. Z., Lv, C. Y. Uninduced adipose-derived stem cells repair the defect of full-thickness hyaline cartilage. Chinese Journal of Traumatology. 12 (2), 92-97 (2009).
- Zuk, P. A., et al. Human adipose tissue is a source of multipotent stem cells. Molecular Biology of the Cell. 13 (12), 4279-4295 (2002).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Engineering. 7 (2), 211-228 (2001).
- Baer, P. C., Geiger, H. Adipose-derived mesenchymal stromal/stem cells: tissue localization, characterization, and heterogeneity. Stem Cells International. 2012, 812693 (2012).
- Zhu, Y., et al. Adipose-derived stem cell: a better stem cell than BMSC. Cell Biochemistry and Function. 26 (6), 664-675 (2008).
- Bellei, B., Migliano, E., Tedesco, M., Caputo, S., Picardo, M. Maximizing non-enzymatic methods for harvesting adipose-derived stem from lipoaspirate: technical considerations and clinical implications for regenerative surgery. Scientific Reports. 7 (1), 10015 (2017).
- Pak, J., Lee, J. H., Park, K. S., Jeong, B. C., Lee, S. H. Regeneration of Cartilage in Human Knee Osteoarthritis with Autologous Adipose Tissue-Derived Stem Cells and Autologous Extracellular Matrix. BioResearch Open Access. 5 (1), 192-200 (2016).
- Alexander, R. W. Understanding Adipose-derived Stromal Vascular Fraction (AD-SVF) Cell Biology and Use on the Basis of Cellular, Chemical, Structural and Paracrine Components: A Concise Review. Journal of Prolotherapy. 4, e855-e869 (2012).
- Benders, K. E., et al. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends in Biotechnology. 31 (3), 169-176 (2013).
- Korean Food and Drug Administration (KFDA). Cell therapy: Rules and Regulations. KFDA. , (2009).
- Pak, J. Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue-derived stem cells: a case series. Journal of Medical Case Reports. 5, 296 (2011).
- Pak, J., Chang, J. J., Lee, J. H., Lee, S. H. Safety reporting on implantation of autologous adipose tissue-derived stem cells with platelet-rich plasma into human articular joints. BMC Musculoskeletal Disorders. 14, 337 (2013).
- Pak, J., Lee, J. H., Kartolo, W. A., Lee, S. H. Cartilage Regeneration in Human with Adipose Tissue-Derived Stem Cells: Current Status in Clinical Implications. BioMed Research International. 2016, 4702674 (2016).
- Pak, J., Lee, J. H., Lee, S. H. A novel biological approach to treat chondromalacia patellae. PLoS One. 8 (5), e64569 (2013).
- Pak, J., Lee, J. H., Lee, S. H. Regenerative repair of damaged meniscus with autologous adipose tissue-derived stem cells. BioMed Research International. 2014, 436029 (2014).
- Aust, L., et al. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy. 6 (1), 7-14 (2004).
- De Ugarte, D. A., et al. Comparison of multi-lineage cells from human adipose tissue and bone marrow. Cells Tissues Organs. 174 (3), 101-109 (2003).
- Guilak, F., et al. Clonal analysis of the differentiation potential of human adipose-derived adult stem cells. Journal of Cellular Physiology. 206 (1), 229-237 (2006).
- Mitchell, J. B., et al. Immunophenotype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24 (2), 376-385 (2006).
- Oedayrajsingh-Varma, M. J., et al. Adipose tissue-derived mesenchymal stem cell yield and growth characteristics are affected by the tissue-harvesting procedure. Cytotherapy. 8 (2), 166-177 (2006).
- . Liberase TL information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/05401020001?lang=en®ion=US (2018)
- . Liberase TM information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/Libtmro?lang=en®ion=US (2018)
- Childs, J. D., Piva, S. R. Psychometric properties of the functional rating index in patients with low back pain. European Spine Journal. 14 (10), 1008-1012 (2005).
- Price, D. D., McGrath, P. A., Rafii, A., Buckingham, B. The validation of visual analogue scales as ratio scale measures for chronic and experimental pain. Pain. 17 (1), 45-56 (1983).
- Pilgaard, L., Lund, P., Rasmussen, J. G., Fink, T., Zachar, V. Comparative analysis of highly defined proteases for the isolation of adipose tissue-derived stem cells. Regenerative Medicine. 3 (5), 705-715 (2008).
- D'Ambrosi, R., Indino, C., Maccario, C., Manzi, L., Usuelli, F. G. Autologous Microfractured and Purified Adipose Tissue for Arthroscopic Management of Osteochondral Lesions of the Talus. Journal of Visualized Experiments. (131), e56395 (2018).
- Packer, J. D., Chang, W. T., Dragoo, J. L. The use of vibrational energy to isolate adipose-derived stem cells. Plastic Reconstructive Surgery-Global Open. 6 (1), e1620 (2018).
- Hanke, C. W., Bernstein, G., Bullock, S. Safety of tumescent liposuction in 15,336 patients. National survey results. Dermatologic Surgery. 21 (5), 459-462 (1995).
- Illouz, Y. G. Complications of liposuction. Clinics in Plastic Surgery. 33 (1), 129-163 (2006).
- Dixit, V. V., Wagh, M. S. Unfavourable outcomes of liposuction and their management. Indian Journal of Plastic Surgery. 46 (2), 377-392 (2013).
- Lehnhardt, M., et al. Major and lethal complications of liposuction: a review of 72 cases in Germany between 1998 and 2002. Plastic and Reconstructive Surgery. 121 (6), 396e-403e (2008).
- Iyer, S. S., Rojas, M. Anti-inflammatory effects of mesenchymal stem cells: novel concept for future therapies. Expert Opinion on Biological Therapy. 8 (5), 569-581 (2008).
- Zhang, J., Middleton, K. K., Fu, F. H., Im, H. J., Wang, J. H. HGF mediates the anti-inflammatory effects of PRP on injured tendons. PLoS One. 8 (6), e67303 (2013).
- Li, N. Y., Yuan, R. T., Chen, T., Chen, L. Q., Jin, X. M. Effect of platelet-rich plasma and latissimus dorsi muscle flap on osteogenesis and vascularization of tissue-engineered bone in dogs. Journal of Oral and Maxillofacial Surgery. 67 (9), 1850-1858 (2009).
- Parsons, P., et al. The biological effect of platelet rich-plasma on the fracture healing process. The Journal of bone and joint surgery. British volume. 91-B, 293 (2009).
- Wu, W., Chen, F., Liu, Y., Ma, Q., Mao, T. Autologous injectable tissue-engineered cartilage by using platelet-rich plasma: experimental study in a rabbit model. Journal of Oral and Maxillofacial Surgery. 65 (10), 1951-1957 (2007).
- Cooper, T. W., Eisen, A. Z., Stricklin, G. P., Welgus, H. G. Platelet-derived collagenase inhibitor: characterization and subcellular localization. Proceedings of the National Academy of Sciences of the United States of America. 82 (9), 2779-2783 (1985).
- Uzuki, M., Sawai, T. A. A comparison of the affinity of sodium hyaluronate of various molecular weights for degenerated cartilage: a histochemical study using hyaluronic acid binding protein. International Congress Series. 1223, 279-284 (2001).
- Pagano, C., et al. Molecular and morphometric description of adipose tissue during weight changes: a quantitative tool for assessment of tissue texture. International Journal of Molecular Medicine. 14 (5), 897-902 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved